Участие памяти чрезвычайно важно для идентификации и оценки запахов [116]. Ранее полагали, что гиппокамп (ГИПП) предпочтительно участвует не в запоминании отдельных запахов, а в кодировании отношений между ними и запоминании нейронных отображений запахов в новых ситуациях [28, 73]. Однако современные исследования эффектов, вызванных повреждениями мозга человека, показали, что специализированные отображения запахов в ГИПП поддерживают как их восприятие, так и память на сцены и последовательности их поступления [70]. Имеются данные о том, что идентификация запахов человеком коррелирует с пространственной памятью и что эти процессы взаимозависимы благодаря связям ГИПП с орбитофронтальной корой (ОфК), т.е. с областью коры, играющей важную роль в памяти, необходимой для распознавания запахов [23]. Во время кодирования информации в присутствии запаха височная, теменная и лобная области коры, особенно ОфК, активируются сильнее, чем в его отсутствие [32]. Однако в обоих состояниях активируется общая сеть эпизодической памяти, включающая ГИПП [32]. У пациентов с нарушением памяти, вызванным повреждением ГИПП, распознавание запахов значительно ухудшалось уже через час после их предъявления [58]. Кроме того, у испытуемых с повреждением ГИПП и амнезией было нарушено обучение ассоциации “запах–место”, хотя распознавание запахов не нарушалось [36]. Дискриминацию запахов и пространственное обучение поддерживают взаимодействия между ГИПП и обонятельной корой [109].
В предшествующей работе [4] нами был предложен возможный механизм обработки запахов в ЦНС, который реализуется в обонятельной нейронной сети, включающей обонятельную луковицу (ОЛ), переднее обонятельное ядро (ПОЯ), пириформную кору (ПК), обонятельный бугорок (ОБ), являющийся частью вентрального стриатума (прилежащего ядра, ПЯ) – входной структуры базальных ганглиев (БГ) и вентральный паллидум (ВП) – выходную структуру БГ. Было учтено то обстоятельство, что в обработке запахов участвуют также медиодорзальное ядро таламуса (МДЯ) и ОфК, которая реципрокно связана с ПК и является частью префронтальной коры (ПфК) [4]. Поскольку на активность шипиковых нейронов в ПЯ влияют также входы к ним из ПфК, ГИПП при участии таламического ядра реуниенс (РЕ), реципрокно связанное с ним и с ПфК, может влиять на активность обонятельной цепи как через БГ, так и через ПфК. В свою очередь, обонятельная сеть может влиять на активность ГИПП, благодаря проекциям из ОЛ в энторинальную кору (ЭК) [4]. Кроме того, ОЛ может влиять на активность нейронов поля СА2 гиппокампа через различные ядра гипоталамуса. Как указано нами ранее, это влияние должно способствовать формированию отображений ассоциаций “запах–объект–место” на нейронах всех частей ГИПП [3]. На влияние обоняния указывают данные о том, что повреждение ОЛ у крыс приводило и серьезному нарушению памяти [121].
Целью настоящей работы являлся анализ возможных механизмов совместного функционирования обонятельной и гиппокампальной нейронных сетей, а также связанных с ними фронтальных областей новой коры. Благодаря взаимозависимому функционированию этих сетей осуществляется обработка и запоминание информации о запахах, а также связанные с запахами обучение и пространственная навигация.
СВЯЗИ МЕЖДУ НЕЙРОНАМИ ОБОНЯТЕЛЬНЫХ СТРУКТУР И ГИППОКАМПАЛЬНОЙ ФОРМАЦИИ, ЛЕЖАЩИЕ В ОСНОВЕ ИХ ВЗАИМОЗАВИСИМОГО ФУНКЦИОНИРОВАНИЯ
У грызунов ГИПП может функционировать совместно с первичными сенсорными областями коры [125]. Однако в ходе эволюции неокортекс приматов расширился, сместив функциональные сети ГИПП от первичных сенсорных областей коры к ассоциативным областям. Исследования зрительной, слуховой и соматосенсорной систем человека в состоянии покоя указывают на преимущественные связи ГИПП с высшими ассоциативными областями коры. В отличие от других сенсорных систем, обоняние является уникальной сенсорной системой и характеризуется структурной консервативностью на протяжении всей эволюции млекопитающих. Так, у человека в состоянии покоя первичная обонятельная область, включающая ПОЯ, ОБ и ПК, имеет более сильную функциональную связь с ГИПП, чем другие сенсорные системы [124].
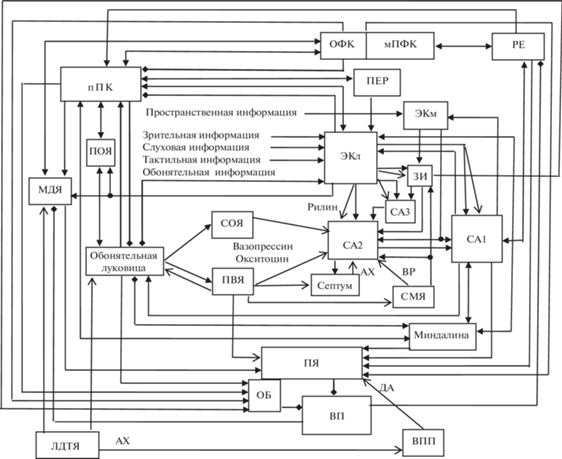
Взаимосвязи обонятельной нейронной сети, состоящей из ОЛ, ПОЯ, ПК, ОБ, ВП, медиодорзального ядра таламуса (МДЯ) и ОфК с гиппокампальной формацией представлены на рис. 1. С вентральной частью медиальной префронтальной коры (мПФК) связана медиальная орбитальная кора, нейроны которой иннервируют, в частности, медиальный стриатум, ОБ, ПЯ, таламические ядра РЕ и МДЯ, а также нейроны дофаминергических структур вентральное поле покрышки и черное вещество. Ядро РЕ, которое реципрокно связано и с ГИПП, и с мПфК, опосредует передачу информации между этими структурами [60]. Ядро РЕ проецируется в слои I, III и IV медиальной и вентролатеральной частей ОфК, а также в слои лакунозум и молекулярный поля СА1 гиппокампа [124].
Рис. 1.
Схема организации межнейронных связей в нейронной сети, включающей гиппокампальную формацию, обонятельные и подкорковые структуры. ВП – вентральный паллидум; ВПП – вентральное поле покрышки; ЗИ – зубчатая извилина; МДЯ – медиодорзальное ядро таламуса; мПфК – медиальная префронтальная кора; ОБ – обонятельный бугорок; ОЛ – обонятельная луковица; ОфК – орбитофронтальная кора; ПВЯ – паравентрикулярное ядро гипоталамуса; пПК – передняя пириформная кора; ПОЯ – переднее обонятельное ядро; ПЯ – прилежащее ядро (вентральный стриатум); РЕ – таламическое ядро реуниенс; СА3, СА2, СА1 – поля гиппокампа; СМЯ – супрамамиллярное ядро гипоталамуса; СОЯ – супраоптическое ядро гипоталамуса; ЭКл и ЭКм – латеральная и медиальная части энторинальной коры. Линии, заканчивающиеся стрелками и ромбами – возбудительные и тормозные входы соответственно; линии с двумя стрелками на концах – реципрокные возбудительные связи.
Обонятельный вход в ГИПП реализуется через полисинаптический путь, опосредованный латеральной и ростральной частями энторинальной коры (ЭК). Латеральная ЭК (ЭКл) получает возбуждение непосредственно от митральных клеток ОЛ и пирамидных клеток ПК. Стимуляция обонятельного тракта вызывала ответы с латентными периодами в ПК – 16 мс, в ростральной части ЭКл – 33.2 мс, в ЭКм – 52–63 мс [35]. Следует отметить, что вызванная запахом активность отдельных нейронов ПК была больше, чем активность нейронов ЭКл, которые отвечали на более ограниченное количество запахов [120]. Эти данные позволили предположить, что ЭКл играет модулирующую роль в кодировании специфичных запахов с учетом опыта и функционального состояния. В свою очередь, ЭКл посылает проекции обратно в ПК и ОЛ [21] (рис. 1). В отличие от грызунов, только у приматов проекция из ОЛ является единственной прямой сенсорной проекцией, по которой обонятельная информация достигает ЭК [43]. У грызунов обонятельная проекция занимает всю протяженность ЭК, тогда как у макак она занимает примерно 15% ЭК, а у человека обонятельная область ЭК меньше, чем у макак [43]. Обнаружена когерентность в тета-диапазоне частот (6–12 Гц) между активностью в ГИПП и в ОЛ, т.е. в начальном звене обработки информации о запахах в ЦНС [38]. Эта корреляция была двунаправленной и относительно слабой. Однако в диапазоне бета-частот (15–35 Гц) выявлена сильная однонаправленная связь от OЛ к дорзальной и вентральной частям ГИПП [38]. Судя по этим данным, во время обработки информации о запахе бета-колебания в ГИПП управляются сигналами из ОЛ.
Реакции нейронов ОЛ и ГИПП на разные запахи характеризовались изменениями частоты их разрядов. Статистически значимые ответы наблюдали у 60% нейронов ОЛ, 48% нейронов поля СА1 и 12% нейронов поля СА3 [27]. Ни один из реагирующих на запах нейронов как в ОЛ, так и в ГИПП не реагировал на все 5 предъявляемых запахов [27], что указывает на их избирательность по отношению к разным запахам. Нейроны ОЛ относительно не избирательны к интервалам между предъявляемыми запахами, тогда как в ГИПП они были избирательны. При этом нейроны полей СА1 и СА3 реагировали только на 1–3 разных интервала в анализируемом диапазоне [27]. Авторы указанной работы предположили, что такие свойства гиппокампальных нейронов могут использоваться в навигации по запаху.
При обнюхивании крысой различных предметов в зубчатой извилине (ЗИ) наблюдали всплеск гамма активности с частотой 30–80 Гц, которая коррелировала с усилением популяционного спайка, вызванного стимуляцией перфорантного пути, т.е. входа из ЭК [111]. Примечательно, что зрительные, слуховые или тактильные воздействия таких всплесков не вызывали [111]. Стимуляция латерального обонятельного тракта приводила к вызванным ответам в ипсилатеральной ЗИ с латентными периодами 12–20 мс [61]. Эти ответы могли быть вызваны дисинаптическим афферентным входом в ЗИ из латеральной части ОЛ через нейроны молекулярного слоя ЭКл [96]. В экспериментах на мадагаскарском тенеке показано, что нейроны ЗИ проецируются в молекулярный слой ростромедиальной части ОБ, тогда как пирамидные клетки полей СА3 и СА1 иннервируют ПЯ [52]. Авторы указанной работы полагают, что такая организация входов может быть характерна также для кошек и обезьян. Их этих данных следует, что входы из ЗИ конвергируют на нейронах ОБ с входами из ОЛ и ПК (рис. 1) и благодаря этому могут влиять на обработку запахов.
Обонятельная информация поступает в ЭКл также через периринальную кору [61]. На эту область коры, участвующую в обонятельном поведении, сильное возбуждающее воздействие оказывает ПОЯ [90] (с целью упрощения на рис. 2 показан вход в ЭКл из ПК, в которую проецируется ПОЯ). Возбудительные входы из ПОЯ в периринальную кору слабо зависят от дисинаптического торможения, поэтому они сильные и позволяют открыть НМДА каналы на постсинаптических нейронах [90]. Благодаря возбуждению периринальной коры, обработка запахов может происходить с учетом информации о контексте. Проведенный в работе [106] анализ показал, что вследствие высокоструктурированной анатомии энторинальных выходных проекций, клетки-мишени ЭК, расположенные в ЗИ, полях СА3 и СА1, а также в передней части ПК (пПК) и ОЛ, получают информацию, обработанную различным образом. Поскольку показано на крысах, что обратимые повреждения ипсилатеральной ЭКл увеличивают спонтанную активность отдельных нейронов пПК [21], можно полагать, что вход из ЭКл оказывает тормозное действие на активность нейронов пПК. То, что ЭК оказывает в основном ингибирующий эффект на ОЛ, а также на пПК, но в меньшей степени, показано и в работе [69]. Не исключено, что этот эффект вызван афферентным торможением. Примечательно, что обратимые билатеральные повреждения ЭКл нарушали способность к распознаванию хорошо выученного сложного запаха, но не влияли на хорошо выученное распознавание простого запаха. Однако двустороннее обратимое повреждение пПК нарушало выполнение задачи на дискриминацию даже простого запаха. Учитывая известную роль ЭКл в рабочей памяти и мультисенсорной интеграции, эти результаты позволили предположить, что ЭКл является нисходящим модулятором функционирования обонятельной коры и таким образом участвует в восприятия запахов [21, 120]. При стимуляции обонятельного тракта латентные периоды ответов в ЭКм были значительно больше, чем в ЭКл [35]. После повторяющейся стимуляции латерального обонятельного тракта с частотой 2–8 Гц реакции нейронов в ЭКм наблюдали примерно через 60 мс [109]. Этот ответ был вызван предшествующей активацией ЗИ, а также полей CA3 и CA1 в септальной и височной частях ГИПП [109]. Повторная стимуляция контралатерального латерального обонятельного тракта вызывала ответ в ЭК, который достигал максимума на 76 мс. Анализ показал, что этот ответ в контралатеральной части ЭК в основном осуществляется за счет внутригиппокампальных комиссуральных путей CA3–CA3 [109]. Из этих данных следует, что стимуляция обонятельного входа, имитирующая обнюхивание во время распознавания запаха, вызывает диффузную активацию как в ипси-, так и в контралатеральной частях ГИПП и ЭК. Интенсивность стимуляции для появления ответа в ЭКм должна была в 3–5 раз превышать интенсивность, необходимую для получения максимального моносинаптического ответа в ПК [14].
Рис. 2.
Схема формирования усложняющихся ассоциаций “запах–объект–место”. ПЕР – периринальная кора; ПОР – постринальная кора. Остальные обозначения как на рис. 1.
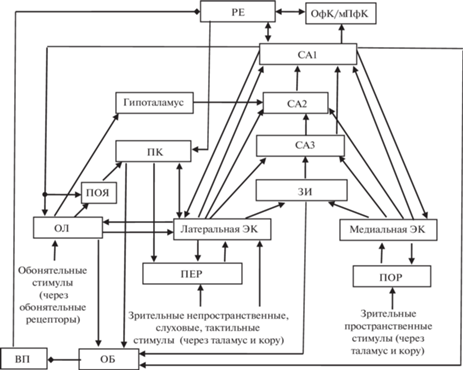
Латеральная и медиальная части ЭК передают соответственно непространственную информацию “что” и пространственную “где” в поле СА1 гиппокампа как через прямой путь из слоя 3 ЭК в поле СА1, так и через непрямой путь из слоя 2 ЭК в ЗИ, затем через поле СА3 в поле СА1 [59] (рис. 2). Примечательно, что ЭКл предпочтительно возбуждает поверхностные пирамидные нейроны в дистальной части поля CA1 (в направлении субикулюма), тогда как ЭКм предпочтительно активирует пирамидные нейроны глубоких слоев в проксимальной части поля CA1 (в направлении поля CA2) [67]. Обратные входы из поля СА1 в ЭКл и ЭКм также формируются разными группами нейронов поля СА1, поскольку ЭК и CA1 связаны реципрокно и топографически [105]. Вследствие реципрокности, сеть ГИПП-ЭК состоит из множества параллельно организованных специфических замкнутых возвратных цепей [71]. Кроме того, обнаружены проекции из височной трети поля СА1 в ПОЯ и в ОЛ [112] (рис. 2). Вентральные две трети поля СА1 посылают аксонные коллатерали не только к обонятельной, но и к другим сенсорным областям коры, а также к орбитальной области коры [19].
У человека ЭКл теснее связана с дистальной частью поля CA1, проксимальным субикулюмом и ОфК, а ЭКм теснее связана с пресубикулюмом и ретросплениальной корой [103] (на рисунках эти связи не приведены). Показано, что проекционные нейроны ЭКл избирательно формируют прямые возбуждающие синапсы на субпопуляции экспрессирующих кальбиндин пирамидных нейронах в дорзальной части поля СА1, в то время как нейроны ЭКм единообразно иннервируют все пирамидные нейроны дорзальной части поля СА1 [59]. Оптогенетическая инактивация экспрессирующих кальбиндин пирамидных нейронов в поле CA1 замедляла обонятельное ассоциативное обучение [59]. Из этих данных следует, что прямая связь ЭКл с дорзальной частью поля CA1 необходима для обонятельного ассоциативного обучения.
Хотя существуют входы в ГИПП из вентромедиальной ПфК, ОфК и периринальной коры, выдвинуто предположение, что ГИПП эффективно связан со структурами, в которых осуществляются более ранние стадии обработки информации, чем в ЭК и пресубикулюме [87]. У человека кроме поступающих в ГИПП потоков информации “что” и “где” соответственно через ЭКл и ЭКм имеются обширные прямые корковые связи, которые в обход ЭК соединяют ГИПП с периринальной и парагиппокампальной областями коры, с ретросплениальной корой и даже с ранними сенсорными областями коры [42, 64] (на рисунках эти входы не приведены). Корковые связи менее иерархичны и разделены, чем это принято в схеме для двух потоков через ЭКл и ЭКм. Одним из следствий такой организации связей является то, что парагиппокампальные области, а также периринальная кора, могут выполнять специализированную обработку информации, используя данные от потоков “что” и “где” [42].
В ЭК и ГИПП активность специфически увеличивалась в ответ на идентифицированные запахи и уменьшалась в ответ на не идентифицированные запахи [50]. На бодрствующих мышах показано, что для быстрой дискриминации типа и интенсивности запаха существенно важна активация нейронов слоя II ЭКл [16]. В этом слое ЭКл имеются две субпопуляции функционально различных возбудительных нейронов, которые вовлечены в прямые и обратные взаимодействия во время обработки запаха [56]. Нейроны, содержащие рилин, переносят обонятельную информацию из ЭКл в ГИПП, тогда как нейроны, экспрессирующие кальбиндин, проецируются в обонятельные структуры – ПК и ОЛ [56]. Нейроны, содержащие рилин, отвечают на специфические запахи с большей избирательностью, чем нейроны, содержащие кальбиндин и ГАМКергические клетки, у которых самая низкая избирательность к запахам [56]. Популяционный анализ активности ансамблей нейронов слоя II ЭКл показал, что тип запаха кодируется частотой, но она мало чувствительна к интенсивности запаха, которая кодируется временными изменениями спайковой активности [16]. В отличие от ЭКл, в поле СА1 интенсивность запаха слабо кодируется временными параметрами разрядов [16]. Правильная идентификация запаха вызывала усиление активности нейронов в задних парагиппокампальных извилинах, правой части ГИПП, а также в левой части ЭК [50]. Ассоциативные связи в периринальной, парагиппокампальной и энторинальной областях коры, которые реципрокно связаны с областями коры в лобных и височных долях, обеспечивают значительную степень интеграции унимодальных и полимодальных входных сигналов, так что в остальную часть гиппокампальной формации поступает только высоко интегрированная информация [53]. Таким образом, периринальная, парагиппокампальная и энторинальная области коры представляют собой нечто большее, чем интерфейсы для связи между неокортексом и гиппокампальной формацией, и они активно участвуют в процессах памяти [53].
ВОЗМОЖНЫЕ МЕХАНИЗМЫ СОВМЕСТНОГО ФУНКЦИОНИРОВАНИЯ ОБОНЯТЕЛЬНЫХ СТРУКТУР И ГИППОКАМПАЛЬНОЙ ФОРМАЦИИ ПРИ ЗАПОМИНАНИИ ЗАПАХОВ И СВЯЗАННОМ С НИМИ ОБУЧЕНИИ
В нашей предшествующей работе был предложен возможный механизм обработки информации в обонятельной нейронной сети, базирующийся на дофамин-зависимых пластических перестройках эффективности синаптической передачи в ОБ и последующей реорганизации эффективности связей между различными элементами этой сети [4]. Согласно этому механизму, дофамин, выделяющийся нейронами среднего мозга в ответ на запах и на подкрепление, разнонаправленно модулирует эффективность возбудительных синаптических входов к проецирующимся в ВП стрионигральным и стриопаллидарным шипиковым клеткам ОБ. В результате этих перестроек происходит растормаживание нейронов ОЛ со стороны ВП. Это способствует формированию на нейронах ОЛ, а также на их клетках-мишенях в ПОЯ и в ПК контрастных отображений запахов. Одновременно происходит растормаживание нейронов МДЯ и увеличение активности их клеток-мишеней в ОфК, что приводит к возрастанию возбуждения нейронов ПК не только снизу–вверх со стороны ОЛ, но и сверху–вниз со стороны ОфК. Суммация возбуждения способствует индукции длительной потенциации (ДП) эффективности синаптического входа из ОЛ в ПК и формированию контрастных отображений запахов на нейронах этой структуры [4]. Такой механизм обработки запахов принципиально сходен с предложенными нами ранее механизмами обработки зрительных и звуковых стимулов [2, 97].
Гиппокампальная формация вовлечена в механизм функционирования обонятельной цепи за счет своих связей с разными ее звеньями. Как уже указывалось, поскольку нейроны ЗИ, получающие обонятельную информацию из ЭКл, проецируются в ОБ [52] и потому могут влиять на прохождение сигналов через ОБ. Поскольку поле СА1 проецируется в ПЯ, в которое поступают также входы из ОфК и мПфК, эта выходная структура ГИПП также влияет на изменения функционирования всей нейронной сети и может лежать в основе участия гиппокампальной формации в обучении, связанном с запахами. Полагают, что долговременные декларативные воспоминания сохраняются за счет взаимодействий ГИПП с ассоциативными областями новой коры, одной из которых является ОфК, сильно и реципрокно связанная с ГИПП [81]. Пары нейронов из поля СА1 и из ОФК возбуждались вместе в пределах одного тета-цикла, причем пики активности нейронов ОФК были привязаны по фазе к тета-колебаниям в активности ГИПП [83]. Во время переобучения крыс в крестообразном лабиринте ответы нейронов в поле СА1 позволяли предсказать изменения в активности нейронов ОФК, но не наоборот [83]. По-видимому, передача сигналов из поля СА1 в ОфК происходит по полисинаптическому пути, так как активация поля СА1 вызывала разряды нейронов в ОФК с латентным периодом примерно 30 мс [83]. Нейроны ОфК значительно лучше реагировали на идентифицированные запахи, чем на не идентифицированные [50], возможно, благодаря влиянию на их активность со стороны ГИПП. Об участии мПФК в запоминании запахов свидетельствуют данные о том, что временная инактивация мПфК перед запоминанием ухудшала память на их распознавание [85].
Ядро РЕ участвует в консолидации памяти за счет реципрокных связей с ГИПП и мПфК [30]. Примечательно, что это ядро играет решающую роль в мнемонических задачах, требующих взаимодействия ГИПП с мПфК, но не в задачах, для которых требуется участие только ГИПП. Повреждении ядра РЕ нарушало обратное обучение, в котором условным сигналом был запах [60]. Кроме того, ядро РЕ вовлечено в обработку обонятельной информации благодаря тому, что его дорзальная часть проецируется в переднюю и заднюю части ПК [25]. Ядро РЕ может влиять на обработку информации и через БГ, поскольку оно проецируется в переднюю медиальную часть ПЯ, где имеются также входы из поля СА1, ЭК, ПфК и ВПП [77]. Хотя ранее было принято считать, что ГИПП и ПфК связаны друг с другом только через ядро РЕ, сравнительно недавно было показано, что оптогенетическая стимуляция аксонов нейронов вентральной части поля СА1 приводит к моносинаптическим ответам в мПфК [49]. Поскольку в вентральную часть поля СА1 из ЭКм поступает пространственная информация, она после обработки в этом поле поступает и в мПфК.
Вентральная часть ЗИ, к гранулярным клеткам которой информация о запахах поступает из ЭКл [118], играет важную роль в тех видах обучения, для которых необходимо разделение и запоминание запахов [114]. В этом она отличается от дорзальной части ЗИ, участвующей в процессах разделения паттернов пространственной информации. У крыс с поражениями вентральной части ЗИ распознавание запахов нарушалось. Наихудшие результаты наблюдали при необходимости разделении близких запахов [114]. Примечательно, что при ассоциативном обучении у гранулярных клеток ЗИ в большей степени, чем у нейронов ЭКл, изменялись ответы на запах и увеличивалось различие нейронных отображений разных запахов. При этом точность отображений запахов в активности гранулярных клеток ЗИ коррелировала с будущей поведенческой дискриминацией [118]. При регистрации моносинаптических ответов нейронов в гранулярном слое ЗИ на стимуляцию латерального перфорантного пути (т.е. входа из ЭКл) до и после обучения задаче, в которой требовалось различить подкрепляемый запах, в ряде случаев наблюдали увеличение ВПСП, длящееся, по крайней мере, в течение 2 часов [107]. Эти данные указывают на индукцию ДП на входе из ЭКл в ЗИ. При псевдо-обусловливании увеличений ответов не наблюдалось [107]. При стимуляции обонятельного тракта во время ассоциативного обучения в ипсилатеральной части ЗИ возникал полисинаптический ответ с ЛП 30–40 мс, который потенциировался, тогда как при псевдообусловливании ДП отсутствовала [20]. Наличие ДП в полисинаптическом пути в ЗИ предполагает существование реактивированной гиппокампальной петли во время обработки обонятельной информации [20]. Полисинаптический ответ в ЗИ на запах может возникать вследствие возбуждения ЭКл со стороны ПК. На крысах в свободном поведении показано, что стимуляция передней части ПК приводила к индукции в ЗИ ДП, которая зависела от частоты стимуляции и длилась более 24 ч, причем она отличалась от пластичности в ЗИ, вызванной стимуляцией перфорантного пути [101]. Когда крысы в совершенстве обучались ассоциациям, в ПК также возникала ДП [108]. В экспериментах, в которых крыс обучали выполнению задания на ассоциативную обонятельную дискриминацию, а естественные запахи заменяли стимуляцией обонятельного пути, также наблюдали модификацию эффективности синаптической передачи, которая влияла на поведенческую активность [88]. На пирамидных нейронах ПК крыс ДП наблюдали только при наличии устойчивых ассоциаций [88]. При обучении с участием запаха НМДА-зависимая ДП развивается на синаптических входах к нейронам не только ЗИ, но также полей CA3, CA1 и лобной коры [89]. Через трое суток после окончания обучения средняя плотность шипиков на апикальных дендритах пирамидных нейронов поля СА1 обученных крыс была достоверно на 20.5% выше, чем у наивных животных или чем при псевдообучении, что свидетельствует об усилении синаптической передачи в ГИПП у обученных животных [51]. Полагают, что пластические перестройки способствуют долговременному хранению обонятельной информации [107]. При запоминании запахов у крыс наблюдали активацию нейронов в поле СА1 [65]. Обычно недавние воспоминания более зависимы от активности в дорзальной части поля CA1 гиппокампа, тогда как отдаленные воспоминания более зависимы от активности прелимбической коры. Однако при наличии запахов отдаленные воспоминания зависят от активности дорзальной части поля CA1 [39]. Авторы указанной работы предположили, что запах сдвигает организацию процессов памяти в сторону ГИПП.
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ ОТОБРАЖЕНИЙ АССОЦИАЦИЙ “ЗАПАХ–ОБЪЕКТ–МЕСТО” НА НЕЙРОНАХ ГИППОКАМПА И УЧАСТИЯ ЗАПАХОВ В НАВИГАЦИИ
Имеются различные свидетельства того, что у грызунов, у которых относительно плохая острота зрения, но очень развита обонятельная система, запахи способствуют формированию в активности нейронов ГИПП пространственных отображений окружающей среды и играют важную роль в пространственной навигации [5]. Обычно в формировании “полей места” ключевыми элементами являются зрительно-пространственные ассоциации. Однако и в отсутствие визуальной информации как люди, так и другие позвоночные, способны генерировать очень эффективные пространственные представления. Воздействие запахов усиливает активность нейронов ГИПП, связанных с обработкой пространственной информации. При выполнении задания, требующего участия обонятельной рабочей памяти, в поле CA1 гиппокампа мыши активировались “клетки запаха”, причем их рецептивные поля оставались стабильными в течение суток [104]. У голубей, подвергавшихся воздействию запахов, в дорсолатеральной части ГИПП активировалось значительно больше нейронов, чем у голубей, подвергавшихся воздействию фильтрованного воздуха без запахов [46].
Не исключено, что в основе участия запахов в формировании “полей места” в ГИПП и в пространственной навигации лежит предложенный нами ранее механизм формирования нейронных отображений ассоциаций “запах–объект–место” на нейронах разных полей ГИПП [3]. Согласно этому механизму, нейронный паттерн, отображающий ассоциацию “запах–объект–место” вначале формируется в ЗИ, где конвергируют поступающие в ГИПП из ЭКл и ЭКм два потока информация о свойствах объекта (включая запах) и о месте его расположения. По мере продвижения информации из ЗИ в другие поля ГИПП разделение потоков сохраняется [71] (рис. 2). Поэтому, при переносе сигналов от нейронного паттерна, сформированного в ЗИ к нейронам поля СА3 в активности последних также активируется паттерн, на который накладывается информация, поступающая в это поле непосредственно из ЭКл и ЭКм. Вследствие этого, в поле СА3 формируется более сложный нейронный паттерн, отображающий ассоциацию “запах–объект–место”.
Пирамидные нейроны поля СА2, расположенные между полями СА3 и СА1, получают возбуждение не только из поля СА3 и из ЗИ, в дополнение к прямому входу от нейронов слоя II ЭК (рис. 2). На пирамидных нейронах поля СА2 имеется в три раза больше входов из ЭКл, чем на нейронах поля СА1 [99], а ВПСП в соме нейронов поля СА2 в 5–6 раз больше, чем в поле СА1. Этого возбуждения из ЭКл достаточно для генерации спайков нейронами поля СА2, но не поля СА1 [99]. Возбуждение, поступающее на проксимальные дендриты нейронов поля СА2 из поля СА3 является слабым [22], по-видимому, вследствие наличия сильного афферентного торможения. Поскольку возбуждение из ЭК, поступающее на дистальные дендриты нейронов поля СА2, затем преобразуется в сильное возбуждение этих нейронов, поле СА2 должно играть важную роль в продвижении сигналов из ЗИ в поле СА1 [22].
На функционирование нейронов в поле СА2 и передачу возбуждения в поле СА1 существенное влияние оказывают нейроны различных ядер гипоталамуса, непосредственно иннервирующие нейроны поля СА2. На этих нейронах располагаются рецепторы, чувствительные к поступающим из гипоталамуса нейромодуляторам [12]. Благодаря входам из гипоталамуса, поле СА2 служит модуляторным звеном, в котором обрабатывается информация, поступающая из ЭК и из поля СА3, прежде чем она передается в поле СА1 [12]. В частности, на прохождение сигналов через поле СА2 в поле СА1 влияет супрамамиллярное ядро гипоталамуса [84]. Выделяемое нейронами этого ядра вещество Р способствует индукции НМДА-зависимой ДП на входе от коллатералей Шаффера (аксонов пирамидных нейронов поля СА3) к пирамидным нейронам поля СА2. На входе из ЭК в поле СА2 вещество Р способствует превращению кратковременной потенциации в ДП [24]. Эта модификация облегчает ассоциативное взаимодействие входов из ЭК и поля СА3 к нейронам поля СА2 [24]. С учетом данных о том, что информация о запахе поступает из ЭКл в разные поля ГИПП, а также о том, что нейромодуляторы, поступающие в поле СА2 из гипоталамуса, способствуют индукции ДП эффективности синаптической передачи в пути СА2–СА1 и суммации возбуждения, поступающего из полей СА3 и СА2 в поле СА1, поле СА2 должно играть существенную роль в формировании ассоциаций “запах–объект–место” на нейронах ГИПП [3]. На то, что благодаря уникальности связей, отличающих поле СА2 от полей СА1 и СА3, а также от ЗИ, это поле может вносить существенный вклад в кодирование и запоминание информации о контексте, было указано и в работах [12, 41]. Имеются различные свидетельства того, что нейроны поля СА2 участвуют в обработке различных видов информации и в формировании гиппокамп-зависимой памяти [55]. В частности, отмечено, что поле СА2 играет важную роль в запоминании и извлечении из памяти информации, связанной с обонянием [68, 100]. Показано, что в поле CA2, как и в поле СА1, имеются “клетки места” [7]. Эти “клетки места” реагировали на новые положения в пространстве, что выражалось в увеличении средней частоты их разрядов, хотя в поле СА2 оценка положения в пространстве была хуже, чем в поле СА1 [13]. У крыс в свободном поведении пространственные паттерны возбуждения отдельных пирамидных нейронов поля СА2, отображающие “поля места”, существенно отличались по характеристикам от поля СА1 [66].
Из предлагаемого механизма формирования ассоциаций “запах–объект–место” следует, что наличие запаха может усилить активность “клеток места” в поле СА1 за счет дополнительной активации нейронов в этом поле. Действительно, во время обучения задаче, в которой ориентирами являлись запахи, они улучшали отображение пространства “клетками места” в поле CA1 и значительно облегчали навигацию [31]. Предъявление одного и того же запаха в разных местах порождало разные отображения этих локусов “клетками места”. Сигнальный запах увеличивал плотность “клеток места”, а также приводил к образованию “клеток места” за пределами локализации сигнала [31]. Это способствовало распознаванию второго, более отдаленного сигнального запаха в качестве отдельного ориентира [31]. У “клеток места” поля CA1, вовлеченных в управляемую запахом устойчивую виртуальную навигацию, проявлялись свойства, аналогичные тем, которые характерны для навигации в условиях визуального наблюдения за средой [80]. Из этого следует, что при навигации, основанной на сигналах различных сенсорных модальностей, используются сходные когнитивные карты. Хотя “поля места” следуют за вращением только зрительных сигналов, обонятельные сигналы все же влияют на отображение пространства в ГИПП. Так, удаление знакомых запахов серьезно нарушало как долговременную стабильность, так и поворот к зрительным стимулам в новой среде [5]. По мнению авторов указанной работы, запахи со временем становятся неотъемлемой частью контекста и оказывают сильное влияние на стабильность его отображения в ГИПП. На роль запахов в навигации даже на ранней стадии их восприятия указывают данные о том, что повреждение ОЛ у крыс приводило к сильному нарушению прохождения лабиринта Морриса [113].
В свою очередь, информация о пространственном расположении запаха может влиять на его восприятие, поскольку она поступает не только в ГИПП, но и в ПОЯ [8]. Рабочую память о запахе поддерживает вентральная часть ГИПП (вГИПП) [48]. Полагают, что за счет проекций из вГИПП в ПОЯ опосредуется ассоциация запаха с его контекстом [57]. Не исключено, что в ПОЯ хранятся контекстуально значимые энграммы запахов, и что эта активность необходима и достаточна для поведенческого выражения памяти о запахе [8]. Пространственная память на запах нарушалась после ингибирования топографически организованных путей из ГИПП в ПОЯ [9]. Обратимое повреждение либо ПОЯ, либо ГИПП после обучения ассоциировать запах с различным зрительно-пространственным контекстом нарушало выполнение задачи. При этом дискриминация запахов, не связанных с контекстом, не нарушалась [57]. Эти данные указывают на то, что ПОЯ, являющееся одним из звеньев ранней стадии обработки обонятельной информации, функционирует как интегрирующая структура [57].
Современный анализ показал, что ЭКл может являться центром интеграции мультисенсорной информации. Она играет важную роль в формировании эпизодической памяти до ГИПП и в долговременной ассоциативной памяти “запах-контекст” [76]. Крысы с поражением ЭКл нормально распознавали объекты и места их расположения, но независимо друг от друга [117]. Из предлагаемого механизма следует, что и другие сенсорные стимулы, такие как звуковые или тактильные, также могут участвовать в пространственном картировании, поскольку информация о них, как и о запахах, поступает во все поля ГИПП через ЭКл. (По-видимому, это обстоятельство позволяет слепым использовать звуки для навигации.) Имеются данные о том, что у мышей, преследующих цель различной сенсорной модальности, имеются модально-инвариантные нейроны, отображающие поведенчески релевантную координату независимо от ее физической модальности [80]. Таким образом, ГИПП отображает пространство не как одну физическую переменную, а как комбинацию сенсорных и абстрактных систем отсчета, определяемых поведенческой целью [80].
Следует отметить, что кроме “клеток места” и “клеток запаха” (в активности которых, как предполагают, кодируется информация о запахах [104], в ГИПП имеются клетки, отвечающие на сложные зрительные стимулы или их отдельные свойства. Например, некоторые нейроны ГИПП, как и нейроны зрительных областей новой коры, отвечали на стимулы определенной формы и размера, а также на стимулы, движущиеся в определенном направлении [47]. Нами было выдвинуто предположение, что при вспоминании целого эпизода активируется не только его отображение на группах нейронов в разных полях ГИПП, но и отображения деталей этого эпизода, сохраненные в активности нейронов тех областей коры, в которых информация об этих деталях обрабатывалась при их восприятии [1]. В согласии с таким предположением показано, что при вспоминании или воображении цветного объекта активируется зрительная область коры V4, в которой обрабатывается не только цвет, поступившего извне зрительного стимула, но и цвет самогенерируемого образа цветного объекта [10]. Благодаря тому, что эти процессы происходят в одной и той же области коры, память о цвете, связанном с объектом, влияет на реакции нейронов поля V4 [110]. Из предлагаемого в настоящей работе механизма отображения ассоциации “запах–объект–место” следует, что в случае вспоминания свойств запахов одновременно с нейронами ГИПП должны активироваться нейроны ПК. Действительно, при вспоминании объекта, предъявленного вместе с запахом, активировались и ГИПП, и ПК [37]. Этот эффект наблюдали в экспериментах, в которых после предъявления запаха вместе с объектом тот же объект предъявляли без запаха. На крысах, выполняющих задачу пространственного выбора по запаху, показано, что на нейронах задней ПК формируется надежное пространственное отображение окружающей среды, имеющее свойство когнитивной карты. Это отображение стабильно и не зависит от доступности вознаграждения [78]. Точность отображения пространственной информации отдельными нейронами ПК определялась силой их функциональной связи с ГИПП в тета-ритме [78]. То, что связь ГИПП и ПК может лежать в основе уникальной роли запахов в кодировании информации и извлечении гиппокамп-зависимых ассоциативных воспоминаний, связанных с запахами, было предположено и в работе [102]. На нейронных ансамблях ПК одновременно отображались идентифицированный запах и пространственное расположение животного, формируя карту “запах–место” [78]. Эти данные указывают на роль ПК в управлении пространственной навигацией с помощью обонятельных сигналов.
При исследовании определенного набора запахов в среде с подавленными визуальными и слуховыми сигналами наблюдали стабильные “поля места”, которые вращались при вращении набора запахов и переназначались, когда запахи смещались [123]. По мнению авторов указанной работы, их данные свидетельствуют о том, что для создания пространственных представлений ГИПП может использовать не только визуальные пространственные ресурсы, но и пространственную обонятельную информацию. Однако критический анализ методик, использованных в работе [123], привел к заключению, что запахи скорее дополняют пространственные карты [54]. Предлагаемый нами механизм указывает на то, что запахи неизбежно участвуют в пространственном картировании, поскольку их обработка и обработка информации о пространственном расположении объектов осуществляется одновременно и взаимозависимо.
РОЛЬ НЕЙРОГЕНЕЗА В ГИППОКАМПЕ И ОБОНЯТЕЛЬНОЙ ЛУКОВИЦЕ В ВОСПРИЯТИИ И ЗАПОМИНАНИИ ИНФОРМАЦИИ
Нейрогенез является формой структурной пластичности, которая способствует обучению и памяти. Показано, что нейрогенез является высокодинамичным процессом. Добавление новых нейронов в существующую нейронную сеть зависит от сенсорных стимулов, связанных с обучением [63]. Нейроны ОЛ, рожденные во взрослом возрасте, обладают пластичностью, на которую влияют сенсорный опыт и обонятельное обучение [40]. Существующие экспериментальные данные позволили предположить, что гранулярные клетки в ОЛ и в ЗИ, появляющиеся в процессе нейрогенеза, могут функционировать как модуляторы активности имеющихся нейронов и влиять на разделение паттернов [6, 92]. Полагают, что благодаря разделению паттернов активности, нейрогенез в гиппокампе у взрослых особей способствует различению похожих стимулов во время решения поведенческих задач [62].
Имеются различные экспериментальные свидетельства того, что нейрогенез модулирует обучение и память у грызунов [75]. Непрерывный постнатальный нейрогенез в ОЛ играет ключевую роль в гибком обонятельно-ассоциативном обучении и памяти [94]. У мышей усиление нейрогенеза (генетически или с помощью лекарств) перед обучением улучшало ГИПП-зависимую память [75]. Показано, что вновь образованные 21-дневные нейроны в ОЛ и ЗИ устанавливают синаптические контакты с проекционными нейронами в ПОЯ, ОБ, ПК, а также ЭКл и ЭКм [26]. Несмотря на то, что зрелые гранулярные клетки взрослых крыс по численности значительно превосходят новорожденные гранулярные клетки, последние, благодаря их повышенной возбудимости и пластичности, играют уникальную роль в функционировании ГИПП [33, 95]. У взрослых мышей, содержащихся в обогащенных запахом клетках, наблюдали заметное увеличение количества новых нейронов в ОЛ и улучшение обонятельной памяти без изменений в способности пространственного обучения [86]. При уменьшении количества пролиферирующих клеток в ЗИ, а также при задержке дифференцировки вновь рожденных клеток в содержащие кальбиндин зрелые нейроны, наблюдали нарушение поведения пассивного избегания и условного рефлекса страха [44].
НАРУШЕНИЯ ОБОНЯНИЯ И ПАМЯТИ НА ЗАПАХИ ПРИ СТАРЕНИИ, НЕЙРОДЕГЕНЕРАТИВНЫХ И ВИРУСНЫХ ЗАБОЛЕВАНИЯХ
Из предлагаемого механизма следует, что повреждение или ухудшение функционирования различных элементов нейронной сети, связывающей обонятельные структуры, гиппокампальную формацию и фронтальные области коры, должно приводить к нарушению не только восприятия и запоминания запахов, но и пространственной памяти. Действительно, показано, что при уменьшении объемов обоих частей ГИПП, ОЛ и левой медиальной части ОфК, т.е. областей критически вовлечены в различение запахов и память на запахи, наблюдается паросмия (искаженное восприятие запахов) [15]. По объему правой части ГИПП и левой медиальной ОфК можно было предсказать правильность идентификации запахов и выраженность пространственной памяти [23]. После удаления правой височной области или правой части ОфК память на запахи также ухудшалась [45]. Патология ЭКл может вносить вклад в ранний обонятельный дефицит, наблюдаемый при болезни Паркинсона (БП) [21]. У пациентов с БП была значимо хуже, чем у контрольных субъектов, память на распознавание запахов [17]. Посмертные исследования головного мозга пациентов с БП выявили накопление патологии α-синуклеина в поле СА2, а также атрофию полей СА2 и СА3, большую чем в других частях ГИПП [74]. Накапливаются данные, свидетельствующие о том, что поле СА2 может быть идеальным локусом для дифференциации различных нейродегенеративных стадий БП [74].
Посмертные исследования выявили корреляцию между ухудшением идентификации запаха при болезни Альцгеймера (БА) и числом тау-клубков в ЭК и поле CA1/субикулюм, но не числом тау-клубков в других участках коры [115]. Авторы указанной работы полагают, что трудности с определением знакомых запахов в пожилом возрасте отчасти связаны с накоплением нейрофибриллярной патологии в центральных обонятельных областях. Дефицит связанной с запахом памяти без грубых изменений общей обонятельной способности наблюдали на модели БА у мышей, когда иммунореактивность к Aβ амилоиду и тау-белкам имела место в ПК, ЭК, ОфК и ГИПП [18]. В работе [121] также отмечено, что при БА значительные гистопатологические изменения происходят в тесно связанных с обонянием структурах головного мозга, в которые проецируется ОЛ. Судя по данным работы [119], полученным на модели БА, дефицит идентификации запаха может отражать нарушения в областях коры выше, чем ПК. Уже на ранних стадиях БА в ростральных обонятельных структурах наблюдали снижение числа интернейронов [93].
Отмечено, что, хотя воспроизведение запахов, а также способность к обучению ухудшаются при нормальном старении, однако это проявляется далеко не так сильно, как при БА [72]. У пожилых испытуемых по сравнению с молодыми людьми наблюдали нарушение ассоциативной памяти “запах–место”, но память “объект–место” не нарушалась [34]. У старых крыс избирательно ухудшалась память на относительно малознакомые запахи, а дефицит памяти на запахи коррелировал с нарушениями пространственной памяти [29]. Эти результаты дополняют электрофизиологические данные, указывающие на то, что с возрастом ухудшается способность нейронов ГИПП дифференцировать контекстуальную информацию. Не исключают, что такое нарушение обработки информации лежит в основе общего возрастного снижения обонятельной и пространственной памяти [29]. Хотя старение не влияло на пороги обнаружения запахов, у пожилых крыс было непропорционально нарушено по сравнению с молодыми выполнение задач, требующих различения сходных обонятельных стимулов [122]. У старых крыс дефицит различения был тесно связан с дефицитом пространственного обучения [122]. Примечательно, что этот дефицит не был связан с общим нарушением обучения у старых крыс, поскольку они выполняли задачи на другие типы сложных различений наравне с молодыми крысами [122]. Следует отметить, что обонятельную дисфункцию наблюдают и при различных вирусных инфекциях, которые характеризуются нарушением нейрогенеза в ОЛ [82]. Опосредованное нейровоспалением ухудшение нейрогенеза в ГИПП может приводить к возникновению и прогрессированию деменции после заболевания COVID-19 [79].
ЗАКЛЮЧЕНИЕ
Благодаря тому, что у человека обонятельная система сильнее функционально связана с гиппокампом, чем другие сенсорные системы, обоняние может способствовать пониманию того, как восприятие и память зависят от взаимодействий других сенсорных систем с гиппокампом. Предлагаемый механизм взаимозависимого функционирования обонятельной и гиппокампальной нейронных сетей позволяет объяснить, почему гиппокамп участвует как в восприятии запахов, так и памяти на события (сцены), в которых присутствуют запахи. В функционировании этих сетей существенную роль играют длительные изменения эффективности связей между нейронами гиппокампальной формации, обонятельных структур, вентральной части базальных ганглиев, фронтальных областей коры, таламических ядер реуниенс и медиодорзального. Предлагаемый механизм позволяет объяснить влияние запахов на сдвиг процессов запоминания в сторону гиппокампа, а также важную роль поля СА2 гиппокампа в запоминании и извлечении из памяти информации, связанной с запахами.
Предложен механизм формирования отображений ассоциаций “запах–объект–место” на нейронах из разных частей гиппокампа, на которых конвергируют входы из латеральной и медиальной областей энторинальной коры. Благодаря одновременной и взаимозависимой обработке информации о запахе и о пространственном расположении объектов, запахи могут участвовать в формировании “полей места”. С другой стороны, благодаря гиппокампальным проекциям в обонятельные структуры, на нейронах пириформной коры формируется пространственное отображение окружающей среды. Благодаря этому, запахи участвуют в картировании пространства и навигации. Высказано предположение, что обоняние развилось для облегчения навигации, а внутренняя связь между обонянием и пространственной памятью является следствием параллельной эволюции обонятельной и гиппокампальной систем [23].
Поскольку при нейрогенезе вновь образованные нейроны в обонятельной луковице и зубчатой извилине обладают повышенной возбудимостью и пластичностью, и поскольку они устанавливают синаптические контакты с проекционными нейронами из обонятельной цепи и гиппокампальной формации, нейрогенез у взрослых может способствовать формированию ассоциаций “запах–объект–место” и оптимальному кодированию обонятельной и контекстуальной информации.
Согласно предлагаемому механизму, повреждения различных звеньев анализируемых нейронных сетей, а также нарушения нейрогенеза, могут приводить к ухудшению различения запахов и памяти на них. Это заключение согласуется с обонятельным дефицитом, характерным для старения, а также для таких нейродегенеративных заболеваний как болезнь Паркинсона и болезнь Альцгеймера. При COVID-19 у пациентов ухудшаются обучение и память, причиной которых является нарушение нейрогенеза в зубчатой извилине, вызванное нейровоспалением [98]. При COVID-19 кроме снижения нейрогенеза в гиппокампе наблюдали усиление апоптоза, морфологические изменения пирамидных клеток, а также изменение пространственного распределения гиппокампальных нейронов в разных слоях [11]. Авторы указанной работы полагают, что эти изменения в гиппокампе могут лежать в основе ухудшение памяти и других долгосрочных неврологических осложнений при COVID-19. Следует отметить, что обогащение среды запахом способствует нейрогенезу в обонятельной луковице, а также значительно увеличивает количество нейронов в гиппокампе [91]. Усиление нейрогенеза в гиппокампе под воздействием запахов свидетельствует в пользу предположения, что обогащенная среда может отсрочить начало или замедлить прогрессирование нейродегенеративных заболеваний [91].