ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
ГЕНЕТИЧЕСКИЕ ТЕХНОЛОГИИ И
СИСТЕМЫ ЖИЗНЕОБЕСПЕЧЕНИЯ
УДК 57.085
ЛИНИЯ ИММОРТАЛИЗОВАННЫХ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ
МЫШИ - НОВАЯ МОДЕЛЬ ДЛЯ ИССЛЕДОВАНИЙ КОЖИ
© 2021 г. Ю.А. Чикиткина1, Е.В. Сытина1, A.A. Aлексеев2, A.A. Пантелеев1,*
1 Национальный исследовательский центр «Курчатовский институт», Москва, Россия
2 ФГБУ «НМИЦ хирургии имени А.В. Вишневского» Минздрава России, Москва, Россия
* E-mail: Panteleev_AA@nrcki.ru
Фибробласты являются основными резидентными клетками соединительной ткани. Многие патологические
процессы в коже сопровождаются нарушениями работы этих клеток. Например, плохо поддающиеся лечению
грубые рубцы образуются из-за чрезмерной сократительной активности фибробластов при заживлении ран и
ожогов. Традиционно в качестве экспериментальной модели in vitro используются либо первичные дермаль-
ные фибробласты, либо иммортализованные эмбриональные фибробласты мыши 3T3/NIH. Однако исполь-
зование первичных клеток ограничено из-за низкой способности к пассированию, а фенотип клеток 3T3/NIH
имеет мало общего со специфическим фенотипом дермальных фибробластов. Работа посвящена созданию
стабильной линии постнатальных дермальных фибробластов, эффективно сочетающей основные свойства
как первичных, так и иммортализованных клеток. Спонтанная иммортализация дермальных постнатальных
(P5) фибробластов мышей C57BL/6 в соответствии с протоколом 3T3 была использована для получения новой
линии dp3T3. Проведено сравнение dp3T3 с первичными фибробластами мыши и клетками 3T3/NIH с ис-
пользованием методов экспрессионного анализа (РТ-ПЦР, вестерн-блоттинг, иммуноцитохимия), кариотипи-
рования и оценки сократительной активности. По морфологии клеток, количеству хромосом, сократительной
способности, содержанию гладкомышечного актина, паттерну экспрессии ColI и уровням профибротических
цитокинов Lox и CTGF новая линия dp3T3 значительно ближе к первичным фибробластам, чем клетки линии
3T3/NIH, что делает их перспективной экспериментальной моделью для биоинженерии кожи человека и для
исследования раневой контракции.
ВВЕДЕНИЕ
остаются одной из самых сложных, актуальных и
Способность восстанавливать ткани после по-
обсуждаемых проблем в биомедицине [1].
вреждения является жизненно важной для любого
Фибробласты - основные резидентные клетки
организма. Особую значимость эта способность
соединительной ткани. Синтез и поддержание ма-
имеет для кожных покровов, защищающих орга-
трикса и, следовательно, формообразование, меха-
низм от воздействия агрессивных факторов внеш-
ника ткани, заживление - все эти жизненно важ-
ней среды. При этом главной проблемой является
ные функции находятся в их компетенции. Именно
максимально быстрое восстановление целостно-
с нарушениями деятельности фибробластов как
сти барьеров. Нормальный процесс заживления
основного эффекторного звена в конечном итоге
кожных ран включает в себя целый ряд последова-
связано формирование патологических рубцов и
тельно сменяющих друг друга событий, слаженное
контрактур при заживлении обширных кожных ран
взаимодействие сложных молекулярных каскадов
и ожогов. Известно, что формирование патологи-
и сигнальных путей, благодаря которым осущест-
ческих рубцов связано, в первую очередь, с транс-
вляется миграция клеток, синтез внеклеточного
формацией фибробластов в миофибробласты и их
матрикса и его ремоделирование. При отклонени-
чрезмерной активностью [2]. Миофибробласты об-
ях от нормального процесса заживления наблюда-
разуются в конце фазы пролиферации и отвечают
ется формирование грубых рубцов и контрактур.
за стягивание краев раны и синтез внеклеточного
Несмотря на успехи современной медицины и раз-
матрикса [3]. Основным маркером миофибробла-
витие новых технологий, рубцовые осложнения
стов является гладкомышечный актин - а (aSMA).
32
ЛИНИЯ ИММОРТАЛИЗОВАННЫХ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ МЫШИ...
33
Экспрессия aSMA регулируется различными сиг-
Таким образом, встает вопрос о получении более
нальными молекулами (TGF-b, CTGF) [4] и меха-
специализированной модели, позволяющей изу-
ническими свойствами микроокружения [5].
чать молекулярные механизмы заживления, харак-
В 1961 году Леонард Хейфлик показал, что при
терные именно для кожи.
длительном субкультивировании фетальных фи-
В ходе данной работы впервые была получена
бробластов человека в среде, богатой всеми не-
иммортализованная линия дермальных фибро-
обходимыми веществами, к 40-60 пассажам про-
бластов мыши с использованием 3T3-протокола
исходит постепенное старение клеточной линии,
из постнатальных дермальных фибробластов для
характеризующееся увеличением времени удвое-
изучения молекулярных и клеточных процессов,
ния популяции и накоплением клеточного дебриса.
происходящих в дерме кожи, а также для создания
Этот предел жизни клеточной популяции, называ-
тканеинженерных конструкций и для исследова-
емый лимитом Хейфлика, связан с постепенным
ния раневой контракции. Было проведено сравне-
укорочением теломерных участков хромосом в
ние полученной линии дермальных постнатальных
процессе митотического деления [6].
3T3 фибробластов (dp3T3) с линией первичных
Однако, было показано, что при длительном
дермальных фибробластов мыши (MDF) и линией
пассировании эмбриональные фибробласты мыши
3T3/NIH, и было отмечено, что по большинству па-
способны к спонтанной иммортализации. Впервые
раметров (кариотип, морфология, экспрессия мар-
линия иммортализованных фибробластов была по-
керов миофибробластов) новая линия более близка
лучена в 1963 году при культивировании эмбрио-
к MDF, чем линия 3T3/NIH.
нальных фибробластов мыши согласно 3T3-про-
токолу (3-day transfer, inoculum 3•105 cells) [7].
МАТЕРИАЛЫ И МЕТОДЫ
Спонтанная иммортализация эмбриональных фи-
Выделение, культивирование и иммортализация
бробластов мыши сопровождается мутациями в
мышиных дермальных фибробластов
генах ARF и p53, участвующих в регуляции кле-
Все эксперименты с животными проводили в
точного цикла [8, 9]. Иммортализованные фиброб-
строгом соответствии с требованиями Local Ethics
ласты никогда не имеют нормального диплоидного
Committee on Biomedical Research (NRC «Kurchatov
кариотипа, у них присутствует контактное ингиби-
Institute»; Protocol #5, April 5, 2017).
рование, они не формируют колонии в мягком ага-
Фибробласты выделяли из дермы пятидневных
ре и не формируют опухоли при инъекции имму-
мышат C57BL/6 (P5) как описано ранее [19] и куль-
нодефицитным мышам [10]. 3T3-протокол также
тивировали в соответствии с 3T3-протоколом [47].
использовался для иммортализации фибробластов
Клетки прошедшие через кризис культуры, выжив-
других видов животных: свиньи [11] и эмбриона
шие после пассажей p28-30 и сохранившие высо-
цыпленка [12].
кий пролиферативный потенциал были обозначены
Традиционно в экспериментальных исследо-
как фибробласты dp3T3.
ваниях физиологии кожи используется линия им-
Первичные мышиные эмбриональные фиброб-
мортализованных эмбриональных фибробластов
ласты получали как описано ранее [20] и использо-
мыши 3T3/NIH или культура первичных фибробла-
вали в качестве контрольных при сравнении.
стов [13, 14, 15]. К сожалению, обе модели обла-
Клетки культивировали в среде DMEM/F12 с
дают существенными недостатками. Использова-
50 мкг\л гентамицина, GlutaMAX™ Supplement
ние линии 3T3/NIH не позволяет учесть тканевую
(Gibco, MA, USA) и 10% FBS (Gibco). Для фиброб-
специфику. Также известно, что до определенного
ластов dp3T3 после пассажа p60 концентрация сы-
этапа эмбрионального развития у плода рубцов не
воротки была снижена до 5%.
образуется, следовательно, эмбриональные фибро-
бласты должны значительно отличаться от постна-
Сравнение контрактирующей
тальных [16, 17, 18]. При использовании в качестве
способности в коллагеновом геле
объекта исследования первичных культур клеток
3•105 клеток dp3T3 (p47 и p76), 3T3/NIH или
взрослого организма, в том числе фибробластов,
MDF (p1) высевали в 2.25 мл коллагенового геля
недостатком является небольшая продолжитель-
(0.1 мг/мл) в лунку стандартного 6-тилуночного
ность жизни культуры, что требует большого ко-
планшета как описано ранее [21] и культивировали
личества материала, а также затрудняет стандарти-
в течении 7 дней. Ежедневно проводили измерения
зацию и проведение долгосрочных экспериментов.
и вычисляли площадь геля.
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
34
Ю.А. ЧИКИТКИНА и др.
MTT-тест
Таблица 2. List of antibodies used
MTT-тест в соответствии с инструкцией произ-
Вторичные антитела
Вторичные
водителя (Sigma, Darmstadt, Germany). Для иссле-
Первичные антитела
(иммуноцитохимия)
(вестерн-блот)
дования 3T3/NIH, MDF и dp3T3 клетки высевали
goat anti-mouse
goat anti-mouse HRP
αSMA (ab7817)
в лунки 48-луночного планшета в количестве 1•104
(ab150113)
(G-21040)
клеток на лунку. Для оценки динамики пролифе-
collagen I type
donkey anti-rabbit
goat anti-rabbit HRP
рации dp3T3 фибробласты разных пассажей (p27,
(ab34710)
(ab150076)
(G-21234)
p33 и p45), также как фибробласты MDF и 3T3/NIH
goat anti-mouse
goat anti-mouse HRP
fibronectin (ab6328)
(ab150113)
(G-21040)
культивировали в одинаковых условиях, ежеднев-
lysyl oxidase
donkey anti-rabbit
goat anti-rabbit HRP
но проводя МТТ-тест. Полученные данные были
(ab31238)
(ab150076)
(G-21234)
представлены в виде графиков (рис. 1б).
donkey anti-rabbit
goat anti-rabbit HRP
CTGF (ab6992)
(ab150076)
(G-21234)
ПЦР в реальном времени
Клетки высевали в лунку стандартного 6-тилу-
goat anti-mouse HRP
β-actin (sc-58673)
(G-21040)
ночного планшета и лизировали по достижении
конфлюэнтности. Тотальную РНК выделяли, ис-
ICC and immunofluorescence (IF) protocols). Ядра
пользуя реагент ExtractRNA (Евроген, Москва).
докрашивали DAPI. После окрашивания препа-
cDNA синтезировали с использованием набора
раты заключали в Immu-Mount medium (Thermo
«MMLV RT kit» (Евроген) в соответствии с про-
Scientific, PA, USA) и просматривали на микроско-
токолом производителя. ПЦР в реальном времени
пе AxioImager-2 Research Microscope (Zeiss). Спи-
проводили с использованием qPCRmix-HS SYBR
сок использованных антител представлен в табл. 2.
(Евроген) на амплификаторе CFX96TM Real-Time
System C1000 Thermal Cycler (Bio-Rad). Список ис-
Кариотипирование
пользованных праймеров представлен в табл. 1.
Образцы метафазных хромосом приготовляли
как описано [22] с незначительными изменениями.
Иммуноцитохимия и
Подсчет хромосом проводили для 30 метафазных
окрашивание фаллоидином
пластинок при помощи микроскопа Axio Imager 2
Фибробласты
(5‧104 клеток) культивировали
Research Microscope (Zeiss) и программного обе-
на покровных стеклах в течение 2 дней и фикси-
ровали 4% раствором параформальдегида в ФСБ
10 минут. Иммуноцитохимическое окрашивание
Вестерн-блот
и окрашивание с помощью Phalloidin-iFluor 488
Конфлюэнтные культуры клеток MDF, 3T3/NIH
Reagent (ab176753, Abcam, MA, USA) проводили в
и dp3T3 лизировали в 400 мкл буфера RIPA, со-
соответствии с протоколом производителя (Abcam
держащего 200 мM PMSF (Sigma). Концентрацию
Таблица 1. Перечень основных характеристик передатчиков S-диапазона
Ген
Номер
Прямой праймер
Обратный праймер
Ссылка
Wei B., Cai L., Sun D. et al. //
Acta2
NM_007392.3
GAAGGAATAGCCACGCTCAG
TGCTGTCCCTCTATGCCTCT
Molecules. 2014. №19 (4).
С. 4967-4985.
Kim S.W., Hur W., Li T.Z. et
Col1a1
NM_007742.4
CTGCTGGTGAGAGAGGTGAAC
ACCAAGGTCTCCAGGAACAC
al. //,. Exp Mol Med. 2014, 46,
e92.
Velden J.L., Alcorn J.F.,
Guala A.S. et al. // Am J Respir
Fn1
NM_010233.2
GTGTAGCACAACTTCCAATTACGAA
GGAATTTCCGCCTCGAGTCT
Cell Mol Biol. 2011. №44 (4).
С. 571-581.
Varelas X., Samavarchi-
Tehrani P., Narimatsu M. et
Ctgf
NM_010217.2
GGGCCTCTTCTGCGATTTC
ATCCAGGCAAGTGCATTGGTA
al. // Dev Cell. 2010. №19 (6).
С. 831-844.
PrimerBank: 6671509a1
Actb
NM_007393.5
GGCTGTATTCCCCTCCATCG
CCAGTTGGTAACAATGCCATGT
primerbank/
Lox
NM_010728.3
CCAAGGGACATCGGACTTCTTAC
TGAATTCGTCCATGCTGTGGTA
Designed in house
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
ЛИНИЯ ИММОРТАЛИЗОВАННЫХ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ МЫШИ...
35
белка в лизатах определяли методом Бредфорда.
сажа, то есть уменьшалось время удвоения популя-
Образцы наносили в количестве 50-100 мкг белка
ции. Мы предполагаем, что эти изменения связаны
на дорожку 6-7% полиакриламидного геля. После
с процессом иммортализации.
фореза проводили перенос на PVDF-мембрану.
Для подтверждения перехода фибробластов от
Перед окрашиванием мембраны антителами
нормального к иммортализованному состоянию,
проводили блокировку в 5% растворе обезжирен-
при помощи MTT-теста оценивали уровень сум-
ного молока в PBST (PBS - 0.1% Tween) в течение
марной метаболической активности клеток. Коли-
12 часов при 4°C. Список использованных антител
чество клеточных делений в культуре ограничено
представлен в табл. 2.
(лимит Хейфлика). Суммарная метаболическая
активность первичной культуры постепенно сни-
Статистический анализ
жается в соответствии с уменьшающимся количе-
Результаты представлены как среднее±стан-
ством клеток. При иммортализации культуры это-
дартное отклонение. Статистический анализ про-
го не происходит, поскольку клетки продолжают
водили, используя непараметрический критерий
активно делиться. Для анализа уровня клеточного
Манна-Уитни (OriginPro 8.0; MA, USA). Величина
метаболизма были выбраны пассажи 27, 33, 45 по-
p<0.05 рассматривалась как соответствующая ста-
лученной нами линии dp3T3 и классическая линия
тистически значимой разнице.
3T3/NIH. (рис. 1). Для каждой временной точки
было использовано 6 биологических повторностей,
РЕЗУЛЬТАТЫ
на графике показано среднее значение по шести
1. Получение линии dp3T3 фибробластов
точкам и стандартное отклонение.
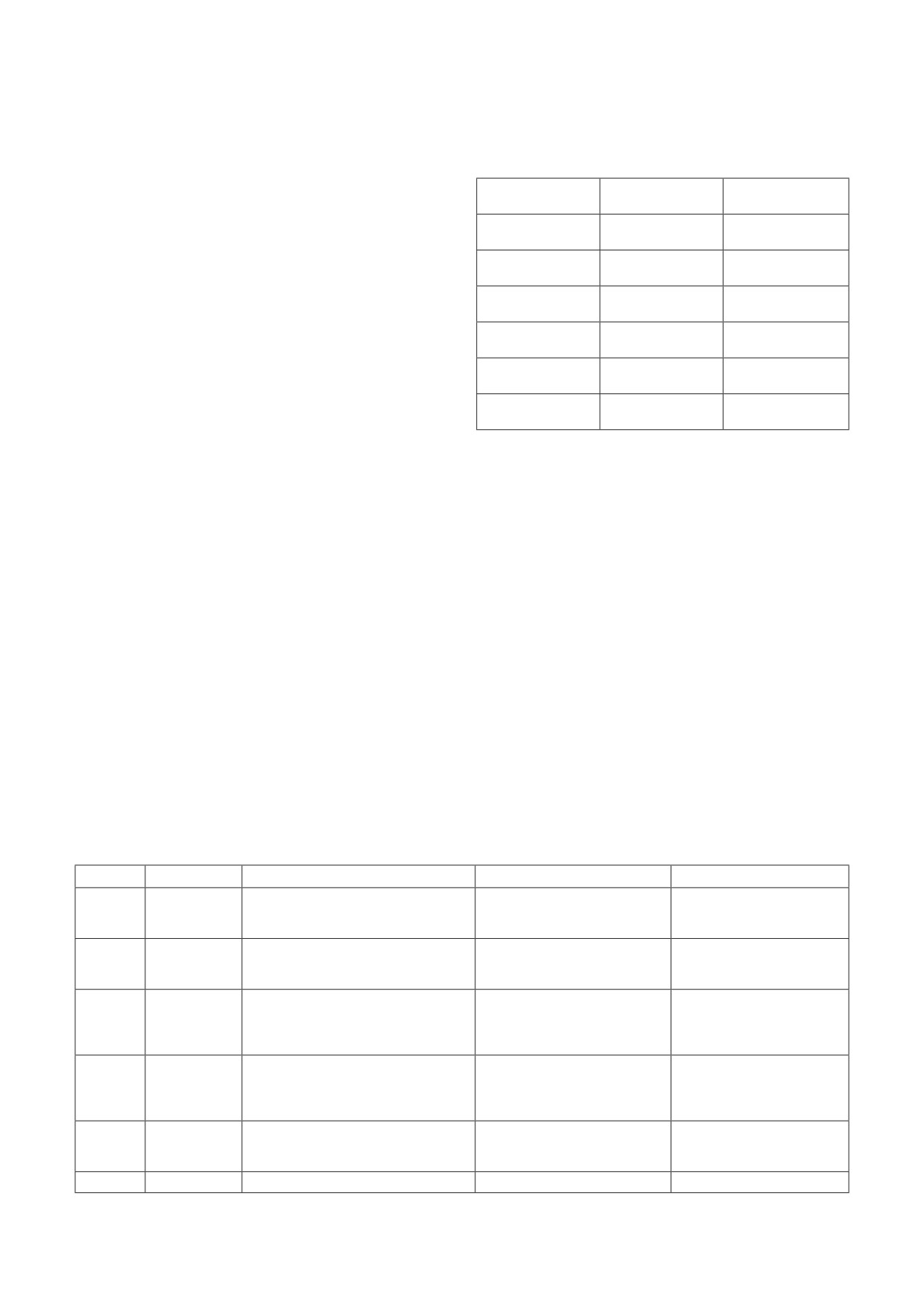
Фибробласты выделили из дермы новорожден-
Видно, что дермальные постнатальные фиброб-
ной мыши (P5) и вели согласно 3T3-протоколу
ласты dp3T3 на 27 пассаже ещё не прошли транс-
(3-day transfer, inoculum 3•105 cells) [7]. Согласно
формацию, и суммарная метаболическая актив-
протоколу, фибробласты, выжившие и сохранив-
ность образца заметно снижена по сравнению 33
шие proliferative capacity после 25-30 пассажей,
и 45 пассажами. Динамика изменения суммарной
можно считать иммортализованными [7]. В нашем
метаболической активности образца dp3T3 фибро-
опыте было отмечено, что на 27 пассаже происхо-
бластов на 33 и 45 пассажах сходна, что говорит о
дил «кризис культуры»: появлялось большое коли-
стабилизации полученной линии (рис. 1б). Пока-
чество клеточного дебриса, резко замедлялся рост
затели MTT-теста для дермальных иммортализо-
клеток, ускорялся процесс закисления среды. По-
ванных фибробластов значительно выше, чем для
сле пересева (p28-p30) в культуре пропадали при-
фибробластов 3T3/NIH.
знаки «кризиса», и время достижения монослоя
Параллельно был проведен анализ времени
уменьшилось по сравнению с культурой до 27 пас-
удвоения: скорость пролиферации dp3T3 фиброб-
Рис. 1. Получение и характеристика линии dp3T3 фибробластов. а) Сравнение морфологии dp3T3 фибробластов, MDF и 3T3/NIH
фибробластов после двух дней культивирования. ФК - фазовый контраст, 10x, 20x, 40x - увеличение объектива. Масштабный
отрезок - 100 мкм. б) Результаты MTT-теста для дермальных фибробластов на разных пассажах и линии 3T3/NIH, показано
среднее значение и стандартное отклонение
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
36
Ю.А. ЧИКИТКИНА и др.
ластов (p50) выше (время удвоения 18,6 ± 1,6 часа),
сократительной способности фибробластов dp3T3
чем скорость пролиферации 3T3/NIH (время удвое-
с 3T3/NIH и MDF анализировали уровень РНК и
ния 24,8 ± 1,2 часа) и скорость пролиферации MDF
белка αSMA.
(время удвоения 28 ± 4,75 часов).
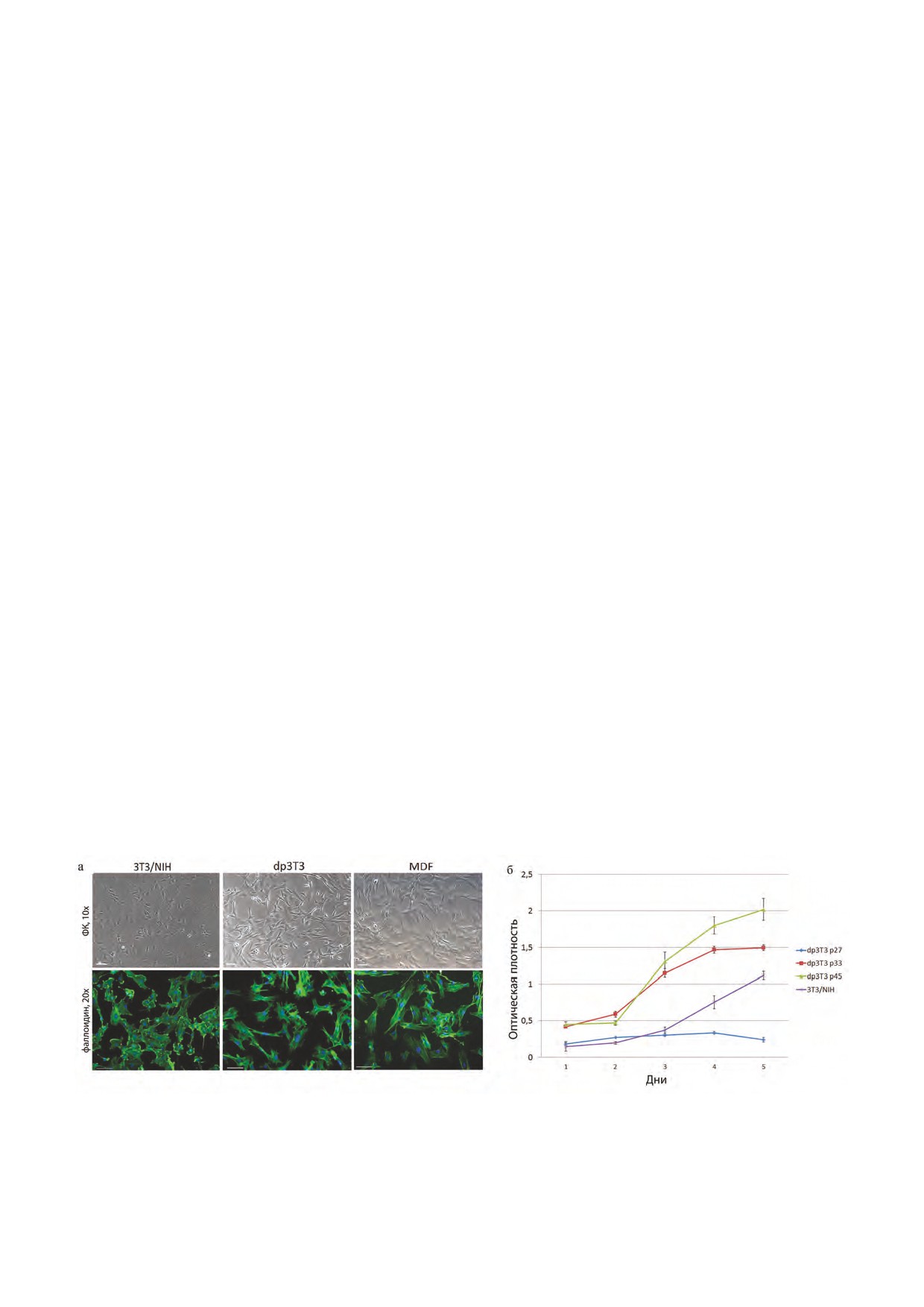
Результаты ПЦР в реальном времени выявили
значительную разницу в экспрессии αSMA: в 3T3/
2. Характеристика линии dp3T3 фибробластов
NIH фибробластах экспрессия αSMA ниже, чем в
a. Кариотипирование линии dp3T3 фибробластов.
dp3T3 фибробластах и в MDF (рис. 2г). Результа-
При кариотипировании линии dp3T3 было про-
ты Вестерн-блота подтверждают данные ПЦР в ре-
анализировано 30 метафазных пластинок. Обнару-
альном времени: количество белка αSMA в dp3T3
жено, что число хромосом варьирует от 39 до 59,
фибробластах и в MDF выше, чем в 3T3/NIH фи-
среднее количество хромосом 50, медиана 52 хро-
бробластах (рис. 2в). Кроме того, было проведено
мосомы. Согласно литературным данным, карио-
окрашивание антителами к αSMA. Данные им-
тип линии иммортализованных эмбриональных
муноцитохимии подтвердили данные ПЦР и Ве-
фибробластов 3T3/NIH состоит из 52-82 хромосом
стерн-блота, и было отмечено, что в культуре не
(среднее число 75) [23]. Таким образом, кариотип
все клетки положительны по αSMA. В фибробла-
полученной линии dp3T3 ближе к нормальному ка-
стах 3T3/NIH белок αSMA расположен диффузно
риотипу мыши, чем кариотип линии 3T3/NIH .
в цитоплазме клеток, а в dp3T3 и в MDF он нахо-
b. Сравнение морфологии фибробластов линий
дится в составе стресс-фибрилл (рис. 2а) - струк-
dp3T3, 3T3/NIH и MDF.
тур, являющихся характерной чертой миофиброб-
Морфология dp3T3 фибробластов и эмбри-
ластов, обладающих выраженной сократительной
ональных фибробластов 3T3/NIH различна. По
способностью. Таким образом, сравнительный
морфологии 3T3/NIH фибробласты ближе к пер-
анализ показал, что по экспрессии αSMA получен-
вичным мышиным эмбриональным фибробластам
ная линия ближе к первичным дермальным фибро-
стадии E18, а dp3T3 - к первичным дермальным
бластам мыши, чем линия 3T3/NIH.
фибробластам мыши (MDF). Как MDF, так и dp3T3
Основным методом оценки способности фибро-
фибробласты имеют веретенообразную форму, в
бластов к контракции является сокращение колла-
то время как фибробласты 3T3/NIH сильнее рас-
геновых гелей in vitro.
пластываются по субстрату, а формы клеток более
Для сравнения сократительной способности ис-
округлые (рис. 1а). Окрашивание с использовани-
следуемых линий, фибробласты сеяли в коллагено-
ем фаллоидина после двух дней культивирования
вые гели и культивировали в течение 7 дней. Для
показало, что в 3T3/NIH фибробластах фибрил-
посева были выбраны MDF p1, 3T3/NIH, а также
лярный актин сосредоточен, главным образом,
dp3T3 p47 и p76 (рис. 2б).
на ведущем краю ламеллоподий и диффузно рас-
По графикам зависимости площади коллаге-
пределен в цитоплазме, тогда как у MDF и dp3T3
нового геля от времени культивирования видно,
филлоподии преобладают над ламеллоподиями, и в
что фибробласты, полученные из постнатальной
цитоплазме выявляются характерные сократитель-
дермы (MDF), обладают большей сократительной
ные стресс-фибриллы гладкомышечного актина (то
способностью, чем линия эмбриональных фибро-
есть, наблюдается большее сходство с «сократи-
бластов 3T3/NIH. Линия dp3T3 по своей сократи-
тельным» фенотипом) (рис. 1а).
тельной способности сходна с MDF. Также сокра-
Таким образом, полученная нами линия dp3T3
тительная способность dp3T3 фибробластов двух
фибробластов по морфологическим характеристи-
разных пассажей (p47 и p76) сходна, что говорит о
кам ближе к линии MDF, чем классическая линия
стабильности полученной линии.
3T3/NIH.
b) Коллаген I типа
3. Сравнительный анализ уровня
Результаты ПЦР в реальном времени не выяви-
экспрессии некоторых ключевых генов, играющих
ли статистически значимой разницы в экспрессии
важную роль при заживлении ран, в трех линиях
коллагена I между фибробластами dp3T3, MDF и
фибробластов (dp3T3, 3T3/NIH и MDF).
3T3/NIH (рис. 2д). Данные окрашивания культу-
ры антителами к коллагену I подтвердили данные
a) Гладкомышечный актин-α и контрактирующая
ПЦР в реальном времени. Интересно, что в отли-
способность фибробластов
чие от распределения коллагена I в фибробластах
Белок гладкомышечный актин-α (αSMA) - ос-
3T3/NIH, где он детектируется в одинаковом ко-
новной маркёр миофибробластов. Для сравнения
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
ЛИНИЯ ИММОРТАЛИЗОВАННЫХ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ МЫШИ...
37
Рис. 2. Анализ уровня экспрессии αSMA и коллагена I в фибробластах dp3T3, MDF и 3T3/NIH. а) Фибробласты после двух дней
культивирования, иммуноцитохимическое окрашивание антителами к αSMA, 20x, 40x - увеличения объектива. Масштабный
отрезок - 100 мкм. б) Сравнение контрактирующей способности фибробластов dp3T3, MDF и 3T3/NIH, на графике указано
среднее значение площади коллагенового геля и стандартное отклонение. в) Результаты Вестерн-блота по количеству белка
aSMA, стандартизация по b-актину. г) Результаты ПЦР в реальном времени по aSMA, стандартизация по β-актину, разница
статистически значима при p<0.05. д) Результаты ПЦР в реальном времени по коллагену I, стандартизация по β-актину, не
обнаружено статистически значимой разницы при p<0.05. е) Иммуноцитохимическое окрашивание антителами к коллагену I,
20x, 40x - увеличения объектива. Масштабный отрезок - 100 мкм
личестве во всех фибробластах, в культуре dp3T3
d) Лизилоксидаза
фибробластов отмечалась гетерогенность: на тех
Иммуноцитохимическое окрашивание антите-
участках, где плотность культивирования выше,
лами к lysyl oxidase (Lox) после двух дней куль-
сила сигнала значительно ниже, чем на участках с
тивирования выявило значительную разницу в ко-
меньшей плотностью культивирования (рис. 2е).
личестве белка в трех линиях клеток: наибольшее
количество белка выявляется в полученной нами
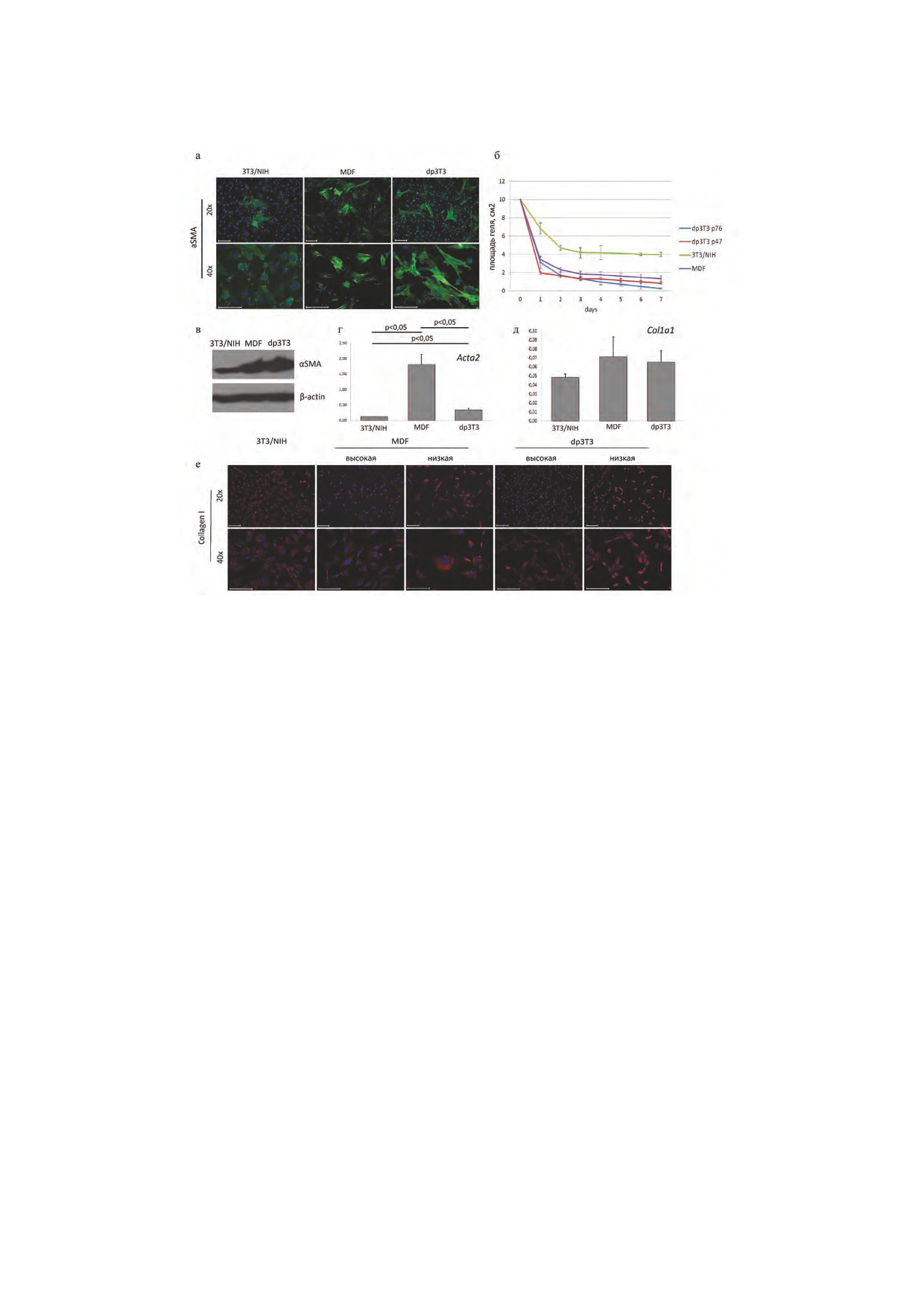
c) Фибронектин
линии dp3T3 фибробластов, наименьшее - в ли-
По данным ПЦР в реальном времени экспрес-
нии фибробластов 3T3/NIH (рис. 3а). Данные Ве-
сия фибронектина в эмбриональных фибробла-
стерн-блота подтверждают результаты окрашива-
стах 3T3/NIH значительно выше, чем в MDF и
ния (рис. 3в). Результаты ПЦР в реальном времени
dp3T3 фибробластах. Данные иммуноцитохимии
несколько отличаются от данных Вестерн-блота
и данные Вестерн-блота совпадают, но несколь-
и иммуноцитохимии: наиболее высокий уровень
ко отличаются от данных реал-тайм-ПЦР для фи-
РНК Lox наблюдается в MDF, а самый низкий - в
бронектина (рис. 3б, в): большее количество белка
полученной нами линии dp3T3 (рис. 3б). Это согла-
детектируется в MDF, чуть меньше в 3T3/NIH и
суется с полученными ранее данными о том, что
минимальное количество - в dp3T3 фибробластах.
постнатальные фибробробласты более склонны к
В dp3T3 фибробластах фибронектин диффузно
приобретению фенотипа миофибробластов, чем
распределен в цитоплазме клеток, а в культуре эм-
эмбриональные клетки (рис. 2а).
бриональных фибробластов 3T3/NIH и в культуре
Во всяком случае, по количеству белка Lox
MDF фибронектин находится в основном вне кле-
dp3T3 ближе к MDF, чем к эмбриональным клет-
ток, и в меньшем количестве в клетках (рис. 3а).
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
38
Ю.А. ЧИКИТКИНА и др.
кам, что возможно является следствием сохране-
ОБСУЖДЕНИЕ
ния ими тканеспецифических характеристик.
3T3-протокол использовали для получения им-
мортализованных линий эмбриональных фибро-
i) CTGF
бластов мыши, цыпленка [12] и постнатальных
По полученным нами данным иммуноцитохи-
фибробластов свиньи [11]. В данной работе мы
мического окрашивания и Вестерн-блота видно,
представили результаты получения иммортали-
что количество белка CTGF в MDF и фибробластах
зованных дермальных фибробластов мыши, как
dp3T3 примерно одинаково, и намного выше, чем
наиболее распространенного модельного объек-
в фибробластах 3T3/NIH (рис. 3а, в), что находит-
та. В процессе работы над получением линии по
ся в соответствии с данными, полученными ранее
3T3-протоколу на p27 мы наблюдали наступление
(Colwell et al., 2006). По данным ПЦР в реальном
кризиса в культуре фибробластов, а после него -
времени уровень экспрессии CTGF самый высокий
увеличение пролиферативного потенциала. Таким
в MDF, средний - в dp3T3 и наименьший в линии
образом, учитывая характер поведения культуры
эмбриональных фибробластов 3T3/NIH (рис. 3б).
в момент, являющийся согласно протоколу мо-
ментом перехода клеток к иммортализованному
состоянию, а так же то, что на момент заверше-
ния работы наша линия проходила 100 пассаж, и
в культуре не наблюдалось признаков старения,
полученную нами линию клеток можно считать
иммортализованной.
Согласно литературным данным, спонтанная
иммортализация эмбриональных фибробластов
сопровождается возникновением мутаций в гене
p53, что приводит к снятию ареста клеточного
цикла [8, 9]. В нашем случае Вестерн-блот не вы-
явил достоверной разницы по количеству белка
р53 между линиями, таким образом, для оценки
имеющихся нарушений требуются дальнейшие
исследования.
Кариотип является одной из основных ха-
рактеристик и наиболее точным критерием для
идентификации линий клеток. Полученные нами
клетки, как и другие иммортализованные фибро-
бласты [10] не имеют нормального диплоидного
кариотипа и не формируют колонии в мягком ага-
ре. Анализ кариотипа dp3T3 показал, что среднее
число хромосом 52 (медиана 50), что даже ближе
к норме (40 хромосом), чем у классической линии
3T3/NIH (52-82 хромосомы). Кроме того, анализ
морфологии трех линий клеток (3T3/NIH, MDF,
dp3T3) показал, что и по морфологическим харак-
теристикам фибробласты линии dp3T3 ближе к
MDF, чем 3T3/NIH фибробласты.
Рис. 3. Сравнительный анализ уровня экспрессии FN, Lox,
Уровень и паттерн экспрессии αSMA в фибро-
CTGF, играющих важную роль при заживлении ран, в трех ли-
бластах напрямую связан с их способностью при-
ниях фибробластов (dp3T3, 3T3/NIH и MDF). а) Результаты
обретать характерный для миофибробластов со-
иммуноцитохимического окрашивания фибробластов dp3T3,
кратительный фенотип, главной морфологической
3T3/NIH и MDF антителами к FN, Lox, CTGF в 3T3/NIH,
чертой которого является наличие стресс-фибрилл
dp3T3 и MDF, 2 дня культивирования. Увеличение объектива -
40х, масштабный отрезок 100 мкм. б) Данные ПЦР в реальном
гладкомышечного актина-α. Следует отметить,
времени, стандартизация по b-актину, различия статистиче-
что традиционное культивирование на жестком
ски значимые при p<0.05. в) Данные Вестерн-блота, стандар-
субстрате (пластик) способствует формированию
тизация по b-актину
сократительного фенотипа, причем для фиброб-
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
ЛИНИЯ ИММОРТАЛИЗОВАННЫХ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ МЫШИ...
39
ластов его выраженность зависит от плотности
клеток и во внеклеточном матриксе. Фибронектин
культивирования: чем плотность ниже, тем больше
экспрессируется в большом количестве разных ти-
доля αSMA-положительных клеток. Иммуноцито-
пов клеток и играет важную роль в клеточной ад-
химия подтвердила эти наблюдения для всех трех
гезии и миграции. Фибронектин участвует в про-
исследованных линий. Причем по количеству и ло-
цессах морфогенеза, процессах заживления ран
кализации этого белка dp3T3 также ближе к MDF
и свертывания крови. Содержание фибронектина
(рис. 2).
значительно выше в дерме плода, а в дерме взрос-
Для функциональной оценки контрактирующей
лого организма фибронектин выявляется в неболь-
способности использовали метод культивирования
шом количестве в зоне дермально-эпидермальных
в коллагеновых гелях, подробно описанный Бел-
контактов [16].
лом в 1979 году [21]. По графикам зависимости
Известно, что в процессе образования патоло-
площади коллагенового геля от времени культиви-
гических рубцов происходит чрезмерный синтез
рования видно, что фибробласты, полученные из
молекул внеклеточного матрикса, в том числе и
постнатальной дермы (MDF), обладают большей
фибронектина [28]. Последний служит связующим
сократительной способностью, чем линия эмбри-
звеном/мостом между клеткой/сократительным
ональных фибробластов 3T3/NIH (рис. 2). Данные
фибриллярным аппаратом клетки и окружающим
полностью согласуются с полученными ранее: на
матриксом (через интегрины). В полученной нами
культуре фибробластов кролика было показано, что
линии уровень экспрессии фибронектина (РНК и
контрактирующая способность эмбриональных
белка) намного ниже, чем в 3T3/NIH и MDF. Дан-
фибробластов ниже, чем контрактирующая способ-
ные ПЦР в реальном времени, полученные нами,
ность дермальных фибробластов [24].
согласуются с данными Coolen et al. [16]: экспрес-
Коллаген является основным компонентом вне-
сия фибронектина в эмбриональных дерме значи-
клеточного матрикса дермы, составляя от 70% до
тельно выше, чем в постнатальной. Отмечаются
80% от сухой массы кожи. Существует несколько
различия и в его распределении в клетке: в dp3T3
типов коллагена, кодируемых разными генами, но
фибробластах фибронектин диффузно распределен
преобладающими в соединительной ткани явля-
в цитоплазме, а в культуре эмбриональных фибро-
ются коллагены I, II и III типа. Коллагены играют
бластов 3T3/NIH и в культуре MDF фибронектин
важную роль в процессе заживления ран и кон-
находится в основном вне клеток, и в меньшем
тролируют форму клеток, их дифференцировку,
количестве в клетках, что говорит о его активном
миграцию и синтез ряда белков [25]. На началь-
синтезе и немедленной секреции в межклеточное
ных этапах заживления раны миофибробласты
пространство (рис. 3). Как эта разница в нашем
синтезируют коллаген III, который впоследствии
случае связана со способностью клеток к мигра-
замещается на коллаген I. Было показано, что в
ции, формированию внеклеточного матрикса - этот
составе фиброзной ткани преобладает коллаген I
вопрос требует дальнейших исследований.
и в небольшом количестве присутствует коллаген
Лизилоксидазы семейства Lox обеспечивают
VI [26]. Согласно литературным данным стати-
возникновение сшивок между коллагеновыми и
стически значимой разницы в уровне экспрессии
эластиновыми фибриллами межклеточного ма-
коллагена I в фетальных и постнатальных фибро-
трикса. В литературе встречаются противоречивые
бластах человека не обнаруживается [27]. Так как
данные о том, какую роль играет повышение экс-
коллаген I типа является таким же маркером мио-
прессии Lox в клетках. В некоторых работах отме-
фибробластов, как и αSMA, весьма вероятно, что
чается, что повышение экспрессии Lox характерно
количество белка коллагена I типа также зависит от
для раковых клеток и способствуют метастазиро-
плотности культивирования: чем плотность выше,
ванию [29]. Другие исследователи считают, что
тем белка меньше. Действительно, оказалось, что
наоборот, повышение экспрессии Lox приводит к
линии фибробластов 3T3/NIH, MDF и dp3T3 близ-
подавлению роста опухолей [30]. Ингибирование
ки по уровню экспрессии коллагена I типа, но зави-
лизилоксидаз Lox и LoxL приводит к снижению
симость количества белка коллагена от плотности
жесткости субстрата и уменьшению количества
культивирования наблюдается только в нашей ли-
миофибробластов [31]. По количеству белка Lox
нии dp3T3 фибробластов и MDF (рис. 2).
клетки dp3T3 вновь оказались ближе к нормаль-
Фибронектин
- гликопротеин, представлен-
ным фибробластам дермы, чем к эмбриональным
ный в растворимой димерной форме в плазме и в
3T3/NIH (рис. 3). Этот результат кажется вполне
димерной или полимерной форме на поверхности
оправданным, с учетом того, что в эмбриогенезе
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
40
Ю.А. ЧИКИТКИНА и др.
созревание фибриллярных белков межклеточно-
нейшего развития: планируется продолжить анализ
го матрикса дермы протекает на поздних стадиях
полученной клеточной линии, в том числе необхо-
развития [32].
димо оценить ее опухолевый потенциал, миграци-
Белок CTGF, также известный как CCN2, при-
онные свойства клеток, а также найти адекватный
надлежит к семейству белков CCN1-CCN6, игра-
критерий оценки степени иммортализации линии,
ющих важную роль в контроле экспрессии моле-
так как в литературе достаточных данных по этому
кул внеклеточного матрикса. Белок CTGF активно
вопросу нет.
экспрессируется в процессе развития организма и
Работа поддержана внутренним финансирова-
участвует в контроле клеточной адгезии, проли-
нием НИЦ Курчатовский институт (приказ 1058), а
ферации, выживания, миграции и продукции вне-
также грантом РФФИ № 19-015-00306.
клеточного матрикса многими типами клеток [33],
играет важную роль в заживлении ран. Экспрессия
СПИСОК ЛИТЕРАТУРЫ
CTGF индуцируется через TGF-β - сигнальный
1. Strong A.L., Neumeister M.W., Levi B. // Clin Plast Surg.
путь. Было показано, что ингибирование CTGF с
2017, №44(3), p. 635-650.
использованием антисмысловых олигонуклеоти-
2. Darby I.A, Zakuan N., Billet F., Desmouliere A. // Cell
дов способствует нормальному процессу зажив-
Mol Life Sci. 2016, №73(6), p. 1145-1157.
ления через подавление чрезмерной активности
3. Gurtner G.C., Werner S., Barrandon Y. et al. // Nature.
миофибробластов, уменьшение экспрессии ткане-
2008, №453(7193), p. 314-321.
вого ингибитора протеиназ TIPM-1 и коллагенов
4. Hinz B. // J Invest Dermatol. 2007, №127(3), p. 526-537.
I и III, но не препятствует затягиванию раны [34].
5. Yeung T., Georges P.C., Flanagan L.A. et al. // Cell Motil
Интересно, что мыши, дефицитные по CTGF, раз-
Cytoskeleton. 2005, №60(1), p. 24-34.
виваются нормально, и отсутствие CTGF не влия-
6. Hayflick L., Moorhead P.S. // Exp Cell Res. 1961, №25(3),
ет на заживление раны, что предполагает присут-
p. 585-621.
ствие какого-то компенсаторного механизма [35].
7. Todaro G.J., Green H. // J Cell Biol. 1963, №1,
Ранее было проведено сравнение эмбриональных
p. 299-313.
фибробластов мыши на разных стадиях развития
8. Harvey D.M., Levine A.J. // Genes Dev. 1991, №5(12B),
и фибробластов, выделенных из дермы взрослой
p. 2375-2385.
мыши, и показано, что уровень экспрессии CTGF
9. Zindy F., Eischen C.M., Randle D.H. et al. // Genes Dev.
в эмбриональных фибробластах мыши на стадиях
1998, №12(15), p. 2424-2433.
E17 и E19, ниже, чем в фибробластах, выделенных
10. Stepanenko A.A., Kavsan V.M. // Tsitol Genet. 2012,
из постнатальной дермы [36]. По нашим данным,
№46(2), p. 36-75.
действительно, зрелой формы белка CTGF намно-
го меньше в эмбриональных 3T3/NIH, чем в dp3T3
11. Oh H.Y., Jin X., Kim J.G. et al. // BMC Cell Biol. 2007,
№8, p. 20.
или MDF (рис. 3). Таким образом, уровень экспрес-
сии CTGF, одного из профибротических цитоки-
12. Christman S.A., Kong B.W., Landry M.M. et al. // BMC
нов, согласуется с полученными нами данными от-
Cell Biol. 2006, №7, p. 27.
носительно способности исследуемых клеточных
13. Immonen J.A., Zagon I.S., McLaughlin P.J. // Exp Biol
линий дифференцироваться в миофибробласты.
Med. 2014, №239(10), p. 1300-1309.
Обобщая полученные данные, следует отме-
14. Sakar M.S., Eyckmans J., Pieters R. et al. // Nat
тить, что по всем пунктам dp3T3 имеют боль-
Commun. 2016, №7, p. 11036.
шее сходство с MDF, чем с 3T3/NIH, что говорит
15. Thangavel P., Ramachandran B., Kannan R. et al. //
в пользу сохранения ими тканеспецифических
J Biomed Mater Res B Appl Biomater. 2016, №105B,
характеристик.
p. 1401-1408.
Работа по созданию новой клеточной линии
16. Coolen N.A., Schouten K.C.W.M., Middelkoop E. et al. //
является сложной и многокомпонентной задачей,
Arch Dermatol Res. 2010, №02(1), p. 47-55.
требующей проведения большого количества те-
17. Ellis I., Banyard J., Schor S.L. // Development. 1997,
стов. Нами был успешно осуществлён первый этап
№124(8), p. 1593-1600.
этой важной и актуальной для дальнейшего разви-
18. Moulin V., Tam B.Y., Castilloux G. et al. // J Cell Physiol.
тия исследований кожи работы - получение линии
2001, №188(2), p. 211-222.
иммортализованных дермальных постнатальных
19. Takashima A. Establishment of fibroblast cultures. Curr
фибробластов. Вместе с тем, работа требует даль-
Protoc Cell Biol. 2001, №2(2.1).
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021
ЛИНИЯ ИММОРТАЛИЗОВАННЫХ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ МЫШИ...
41
20. Xu, J. Preparation, culture, and immortalization of
29. Wang T.-H., Hsia S.-M., Shieh T.-M. // Int J Mol Sci.
mouse embryonic fibroblasts. Curr. Protoc Mol Biol. 2005,
2017, №18(1), p. 62.
Chapter 28, Unit 28.1.
30. Kaneda A., Wakazono K., Tsukamoto T. et al. // Cancer
21. Bell E., Ivarsson B., Merrill C. // Proc Nat Acad Sci
Res. 2004, №64, p. 6410-6415.
U.S.A. 1979, №76, p. 1274-1278.
31. Van der Slot A.J., Zuurmond A.M., van den Bogaerdt A.J.
22. Bates S.E. // Methods Mol Biol. 2011, №767, p. 177-190.
et al. //. Matrix Biol. 2004, №23(4), p. 251-257.
23. Leibiger C., Kosyakova N. Mkrtchyan H. et al. // J
32. Yamazaki Y., Mikami Y., Yuguchi M. et al. // Anat. Histol.
Histochem Cytochem. 2013, №61(4), p. 306-312.
Embryol. 2012, №41, p. 68-74.
24. Satish L., Johnson S., Wang J.H.-C. et al. // PLoS One.
33. Faith H.-G., Karen M.L. // Cell Mol Life Sci. 2011,
2010, №5(4), e10063.
№68(19), p. 3209-3217.
25. Brett D. // Wounds. 2008, №20(12), p. 347-356.
34. Sisco M., Kryger Z.B., O'Shaughnessy K.D. et al. //
Wound Repair Regen. 2008, №16(5), p. 661-673.
26. Sabatelli P., Gualandi F., Gara S.K. et al. // Matrix Biol.
2012, №31, p. 187-196.
35. Liu S., Thompson K., Leask A. // Wound Rep Reg. 2014,
№22, p. 119-124.
27. Rolfe K.J., Irvine L.M., Grobbelaar A.O., Linge C. //
Wound Rep Reg. 2007, №15, p. 897-906.
36. Colwell A.S., Krummel A.S., Longaker T.M. et al. //
28. To W.S., Midwood K.S. // Fibrogenesis Tissue Repair.
Plastic & Reconstructive Surgery. 2006.
2011, №4, p. 21.
ВЕСТНИК ВИТ «ЭРА», том 2, номер 2, 2021