Известия РАН. Серия биологическая, 2021, № 1, стр. 65-72
Особенности функционирования сукцинатдегидрогеназы и малатдегидрогеназы в листьях шпината Chenopodium foliosum L. и амаранта Amaranthus caudatus L. при солевом стрессе
А. Т. Епринцев 1, *, Д. Н. Федорин 1, О. С. Федорина 1
1 Воронежский государственный университет
394018 г. Воронеж, Университетская пл., 1, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 08.04.2019
После доработки 22.06.2019
Принята к публикации 22.06.2019
Аннотация
Показано, что воздействие хлорида натрия вызывает изменение активности и изоферментного состава митохондриальной малатдегидрогеназы (МДГ), что проявляется в индукции дополнительной изоформы в листьях амаранта (С4-тип). Отмечено, что в растениях шпината (С3-тип) засоление не вызывает значительных изменений активности исследуемых ферментов и изоферментного состава, активность сукцинатдегидрогеназы (СДГ) в листьях амаранта при засолении увеличивается в несколько раз, изоферментный состав СДГ в листьях растений остается без изменений. Обнаружено, что уровни транскриптов генов четко коррелируют с изменением активности МДГ и СДГ в листьях амаранта и шпината, а солевой стресс усиливает экспрессию генов mdh-mtx (митохондриальной формы) и mdh-cyt (цитоплазматической) в листьях амаранта на протяжении всего эксперимента. Для гена sdha установлено снижение содержания транскриптов, что четко коррелирует с уменьшением активности СДГ.
Исследования биохимических аспектов адаптивной реакции клеточного метаболизма у растений в условиях солевого стресса проводятся, как правило, на энзиматическом уровне (Hasegawa et al., 2000; Bajji et al., 2002). Известно, что универсальная особенность адаптации растительного метаболизма к солевому стрессу ‒ недопуск Na+ в особо чувствительные к засолению ткани, такие как апикальные меристемы, листовые пластинки и генеративные органы. Кроме того, поддержка значений градиентов водного потенциала в системе целого растения должна обеспечивать непрерывный ток воды в восходящем направлении даже в отсутствие транспирации (Балнокин и др., 2005).
Для регулирования осмотического баланса, складывающегося между цитоплазмой и вакуолью, необходимы дополнительный биосинтез осмолитов и накопление ионов калия. Для этого требуются повышение уровня энергетических эквивалентов и перестройка углеводного и азотного обмена (Igamberdiev, Eprintsev, 2016). Считается, что наибольший адаптационный потенциал имеет С4-тип растений, обладающих более сложной морфофизиологической структурой (Kranz ‒ анатомия листа). Особый интерес представляют метаболические пути, с помощью которых осуществляется интеграция мезофилла и обкладки в стрессовых условиях. Типичный представитель этих растений ‒ амарант (аспартатный тип С4-метаболизма) ‒ характеризуется высокой продуктивностью и повышенным уровнем засухо- и солеустойчивости. В то же время растения, относящиеся к С3-группе (шпинат), солечувствительны и не выдерживают последствий солевого стресса (Chow et al., 1991; Shannon, Grieve, 1999).
Известно, что адаптивную реакцию осуществляют ферментные системы цикла Кребса и других метаболических путей. Ранее нами была показана для кукурузы (С4-растение) адаптивная реакция на уровне малатдегидрогеназной (МДГ) системы, обусловленная изменением активности и изоферментного состава (Епринцев, Федорина, 2007). В связи с этим большой интерес вызывает сравнительный анализ изменения активности ферментов цикла Кребса у С4- и С3-растений. Следует отметить, что биохимический механизм регуляции ферментативной активности у растений в стрессовых условиях недостаточно изучен, причем особенно это касается представлений о молекулярных аспектах адаптивной реакции. В перспективе в нашей лаборатории будут проведены исследования экспрессионной регуляции и выявление тонких молекулярных способов управления работой генов при солевом стрессе. Важнейший момент ‒ исследование регуляции транскрипции и трансляции ферментных систем с помощью геноспецифических промоторов, транскрипционных факторов и трансдукторов белковой природы (Schulze et al., 2002; Zeng et al., 2015).
Цель работы ‒ изучение изменения активности ключевых ферментов цикла трикарбоновых кислот (ЦТК) малатдегидрогеназы (МДГ, КФ 1.1.1.37) и сукцинатдегидрогеназы (СДГ, КФ 1.3.99.1), их изоферментного состава и экспрессии кодирующих их генов в листьях шпината и амаранта, характеризующихся различной устойчивостью к засолению.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили 14-суточные проростки амаранта Amaranthus caudatus L. сорта “Рыжик” и шпината земляничного Chenopodium foliosum L. Растения были выращены гидропонным способом в воде при 16-часовом световом дне с интенсивностью света 25 Вт/м2 при 25°С. Солевой стресс моделировали инкубацией проростков в растворе 150 мМ NaCl. В качестве контроля использовали образцы, экспонированные в воде. Первую пробу брали до начала инкубации, а затем после 1, 3 и 6 ч экспозиции.
Содержание пролина в разделенных тканях амаранта определяли методом Бейтса (Bates et al., 1973). Экстракцию пролина из растительного материала (5 г) осуществляли толуолом. Количественное определение осуществляли спектрофотометрически при длине волны 520 нм, поглощаемой комплексом, образующимся при реакции пролина с нингидрином.
Разделение клеток мезофилла и обкладки амаранта проводили на холоду, механически (Farineau, 1975). Листья амаранта (5 г) растирали в среде выделения: 0.1 М Tris-HCI-буфер, рН 8.0; 10 мМ MgCl2 · 6Н2О; 4 мМ ЭДТА; 4 мМ дитиотреитола (ДТТ). Гомогенат фильтровали через 4 слоя марли. Фильтрат центрифугировали 5 мин при 3000 g. Полученный супернатант представлял собой мезофилл. Чтобы выделить обкладку, неразрушенные ткани растирали со стеклом в той же среде. Гомогенат центрифугировали 10 мин при 5000 g. Надосадок представлял собой разрушенные клетки обкладки. Чистоту разделенных тканей определяли по активности маркерных ферментов – фосфоенолпируваткарбоксилазы и НАДФ-зависимой глицероальдегидфосфатдегидрогеназы. В данной работе из листьев амаранта удалось получить мезофилльную и обкладочную фракции со степенью перекрестного загрязнения не более 7.8 и 16.1% соответственно (Юзбеков, 1990). Для разрушения листьев шпината (3 г) применяли такую же среду выделения, как и для амаранта, и после центрифугирования (3000 g) получали клеточный экстракт.
Активность МДГ определяли спектрофотометрически на СФ-2000 при длине волны 340 нм (поглощение восстановленного НАДН) в среде спектрофотометрирования следующего состава: 100 мМ трис-HCl, рН 8.0; 1 мМ оксалоацетат, 0.2 мМ НАДН, 10 мМ MgCl2 и 400 мкг белка (Епринцев, Федорина, 2007).
Активность СДГ определяли на спектрофотометре при длине волны 600 нм. Среда фотометрирования представляла собой 30 мМ фосфатный буфер (рН 7.8), содержащий 1 мМ феназинметасульфата (ФМС), 0.08 мМ дихлорфенолиндофенола, 2 мМ азида натрия, 20 мМ сукцината натрия и 400 мкг белка (Попов и др., 2007). За единицу ферментативной активности принимали такое количество фермента, которое катализировало превращение 1 мкМ субстрата за 1 мин при 25°С и оптимальных значениях рН.
Для выделения митохондрий из листьев исследуемых растений проводили гомогенизацию 5 г растительного материала в фарфоровой ступке в соотношении 1 : 10 в растворе (100 мМ трис-HCl-буфер, pH 7.6, содержащий 0.3 М сахарозы, 1 мМ ЭДТА, 5 мМ ДТТ). Затем гомогенат отфильтровывали через 4 слоя марли. После центрифугирования при 1300 g в течение 5 мин осадок отбрасывали, а супернатант центрифугировали снова при 14 000 g в течение 20 мин. Осадок, содержащий митохондрии, разрушали осмотическим шоком в 1 мл 100 мМ трис-HCl-буфера, pH 7.6, содержащего 5 мМ MgCl2, 1 мМ ЭДТА и 5 мМ ДТТ (15 мин). Надосадочная жидкость представляла цитозольную фракцию. В полученных экстрактах измеряли активность ферментов и их изоферментный состав, который исследовали с помощью электрофореза в полиакриламидном геле методом Девиса (Davis, 1994). Концентрация верхнего геля составляла 2%, а разделяющего ‒ 8%. Специфическое проявление гелей осуществляли тетразолиевым методом в среде следующего состава: 0.05 М трис-HCl-буфер, рН 8.0, 0.05 М малат, 0.02 М НАД+, 0.01 М ФМС и 0.01 М нитросинего тетразолия (Fieldes, 1992).
Суммарную клеточную РНК из листьев исследуемых растений выделяли методом фенолхлороформной экстракции с использованием в качестве осадителя LiCl (Chomczynski, Sacchi, 1987). Нуклеиновые кислоты разделяли в 1%-ном геле агарозы (Helicon, Россия). Обратную транскрипцию РНК осуществляли с использованием обратной транскриптазы M-MuLV RT (Fermentas, Литва) для синтеза первой цепи кДНК согласно рекомендациям производителя.
Праймеры подбирали на основе сравнения нуклеотидных последовательностей искомых генов с помощью программы Primer3. Праймеры к гену mdh-mtx: прямой – 5'-ggtatgacccgwgayggatctc-3', обратный – 5'-traanayctcwgcwgcaaty-3'. Праймеры к гену mdh-cyt: прямой – 5'-ttatgcttggtgcagaccag-3', обратный – 5'-gtgcattataatatgggtgg-3'. Праймеры к гену sdha: прямой – 5'-caaacgggtcacttccaact-3', обратный – 5'-ccaaaactgtcccacgtctt-3′.
Для выяснения изменения уровня экспрессии генов проводили ПЦР в реальном времени на приборе Bio-Rad DNA Engine Thermal Cycler Chromo 4 (Bio-Rad, США) с использованием в качестве красителя SYBR Green I. Количество матрицы контролировали с помощью параллельной амплификации фактора элонгации ef-1α с геноспецифичными праймерами (Nicot et al., 2005). Определение относительного уровня экспрессии исследуемых генов проводили с применением 2–ΔΔCt-метода (Livak, Schmittgen, 2001) с использованием программного обеспечения Opticon MonitorTM Software (Bio-Rad).
Опыты проводили в трехкратной повторности, аналитические определения для каждой пробы осуществляли в трех повторностях. На рисунках приводятся данные типичных опытов, причем каждое значение ‒ среднее трех измерений. Для установления достоверности результатов определений применяли метод вариационной статистики. Полученные данные обрабатывали с использованием статистических критериев (Лакин, 1990). Обсуждаются статистически достоверные различия при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведенные с растениями амаранта и шпината исследования показали, что в тканях листьев (мезофилл и обкладка) исследуемых объектов в условиях солевого стресса наблюдается повышение содержания пролина. Концентрация данной аминокислоты была на 40‒43% выше в условиях опыта по сравнению с контрольными значениями в клетках мезофилла в течение первых 3 ч. После 6-часовой экспозиции наблюдали увеличение содержания пролина на 13% выше контрольного во всех исследуемых тканях (данные не представлены). Аналогичные результаты были получены для листьев шпината, при этом содержание пролина в опытном варианте повышалось до 26% в течение 3-часовой экспозиции. Ранее аналогичные результаты были получены для кукурузы, экспонируемой в солевом растворе (Chow et al., 1991; Popov et al., 2003).
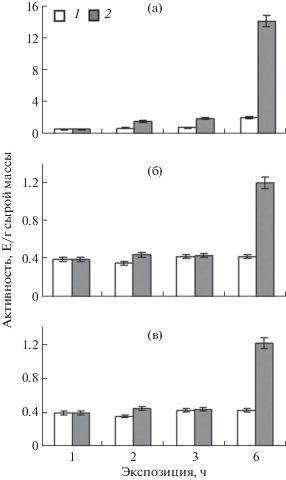
Влияние солевого стресса на функционирование НАД-зависимой МДГ из тканей представителей С3- и С4-растений – шпината C. foliosum L. и амаранта A. caudatus L. ‒ характеризовалось изменением активности данного фермента в листьях изучаемых растений (рис. 1). Показано, что под действием хлорида натрия как в мезофилле, так и в обкладке амаранта происходила значительная активация НАД-зависимой МДГ после 6 ч экспозиции (рис. 1а и б). В клетках мезофилла активность НАД-МДГ выросла в 9.3, а в обкладке – в 2.8 раза по сравнению с контрольными значениями. В листьях шпината подобную активацию фермента не наблюдали, напротив, после 6 ч действия засоления активность НАД-МДГ уменьшилась почти в 2 раза (рис. 1в).
Рис. 1.
Динамика активности НАД+-МДГ в клетках мезофилла (а) и обкладки амаранта (б) и листьях шпината (в) в норме (1) и при засолении (2).
Исследование динамики активности митохондриальной и цитозольной форм МДГ в листьях амаранта показало, что в первые 3 ч уменьшалась активность митохондриальной формы исследуемого фермента и немного увеличивалась активность цитозольной формы (рис. 2а). К шестому часу эксперимента митохондриальная форма МДГ активировалась более чем в 4.5 раза в клетках мезофилла амаранта и в 3 раза в клетках обкладки. Цитоплазматическая форма МДГ активировалась в листьях амаранта в клетках мезофилла, а в клетках обкладки оставалась на начальном уровне.
Рис. 2.
Динамика активности митохондриальной (1) и цитоплазматической (2) форм НАД+-МДГ в клетках мезофилла (а) и обкладки (б) амаранта и листьях шпината (в) в норме и при засолении. 3 ‒ контрольные растения, экспонированные в воде.
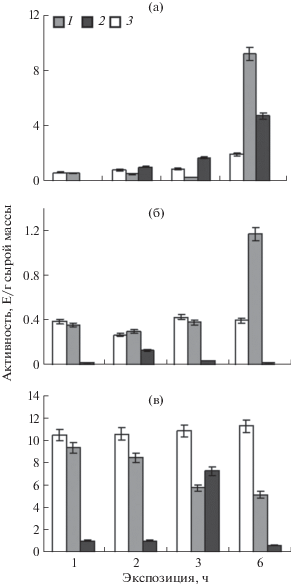
В листьях шпината динамика активности разных клеточных изоформ МДГ свидетельствовала о снижении данного показателя для митохондриальной МДГ на протяжении всего эксперимента. При этом для цитозольной формы характерно 4‑кратное увеличение активности при 3-часовой экспозиции растений в солевом растворе, что соотносится с увеличением общей активности МДГ в листьях шпината (рис. 2в). Видимо, увеличение общей активности МДГ в листьях шпината на 3 ч солевого стресса связано с активацией цитозольной формы МДГ.
Были исследованы изоферментные спектры НАД-МДГ в зеленых листьях шпината и дифференцированных тканях амаранта. В листьях шпината удалось обнаружить присутствие трех изоформ этого фермента как в норме, так и при стрессе (рис. 3а). В тканях амаранта в контроле присутствовали две изоформы фермента, одна из которых (Rf = 0.6) была обнаружена как в мезофилле, так и в обкладке, а вторая (Rf = 0.55) оказалась специфична для клеток мезофилла. Солевой стресс индуцировал появление еще одной дополнительной молекулярной формы НАД-МДГ с Rf = 0.66 в клетках мезофилла, тогда как в обкладке стрессиндуцированных изменений изоферментного спектра у амаранта не было обнаружено. Установлено, что индуцибельная форма НАД-МДГ имеет митохондриальную локализацию (рис. 3б).
Рис. 3.
Изоферментный состав НАД+-МДГ в дифференцированных тканях амаранта и в листьях шпината (а) и митохондриальной НАД+-МДГ в клетках мезофилла амаранта и в листьях шпината (б) в нормальных и стрессовых условиях. К – контрольные растения; 1, 3, 6 – время экспозиции растений в солевом растворе; для рис. 3, 5, 6.
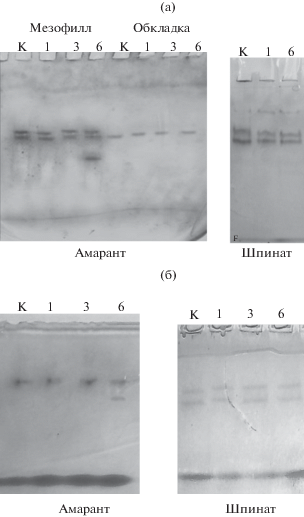
Ранее было показано, что засоление вызывало изменение функционирования ферментов МДГ-системы в дифференцированных тканях листьев кукурузы, при этом наблюдался аналогичный характер динамики трансформации активности МДГ не только в клетках мезофилла, но и в обкладке кукурузы (Епринцев, Федорина, 2007).
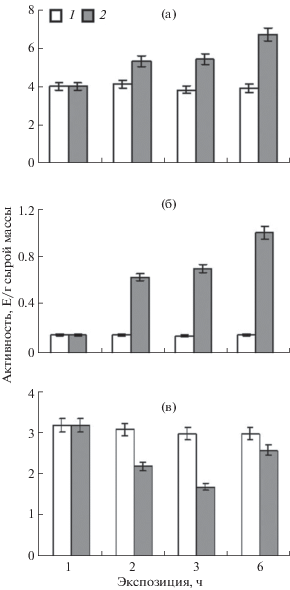
Для амаранта показано стрессиндуцированное увеличение активности маркерного фермента ЦТК – сукцинатдегидрогеназы как в мезофилле, так и в обкладке амаранта (рис. 4а и б), причем в клетках мезофилла активация фермента в первые 3 ч была менее выражена по сравнению с таковой в обкладке. В обеих тканях активность достигала максимальных значений к 6-му часу экспозиции. Активность СДГ при засолении в тканях шпината заметно снижалась по сравнению с контролем (рис. 4в).
Рис. 4.
Динамика активности СДГ в клетках мезофилла и обкладки амаранта (а) и листьях шпината (б) в норме (1) и при засолении (2).
Анализ изоферментного состава СДГ в клетках мезофилла и обкладки амаранта, а также в клетках листьев шпината показал, что в норме и в условиях солевого стресса не наблюдалось изменение числа изоферментов СДГ (рис. 5). Во всех исследуемых образцах как у амаранта, так и у шпината были обнаружены две формы СДГ.В тканях амаранта в отличие от тканей шпината под действием соли происходила активация двух важнейших ферментов – МДГ и СДГ, причем в мезофилле амаранта была обнаружена индуцибельная форма МДГ, тогда как изоферментный состав МДГ в обкладке, как и в клетках шпината, не изменялся при засолении.
Рис. 5.
Изоферментный состав СДГ в дифференцированных тканях амаранта и в листьях шпината в нормальных и стрессовых условиях.

Для изучения экспрессионной регуляции солезависимой индукции активности изоферментов МДГ и СДГ была выделена суммарная клеточная РНК из амаранта и шпината. Праймеры для изучения экспрессии генов МДГ и СДГ были разработаны на основе нуклеотидных последовательностей из GeneBank. Для этого проводили выравнивание последовательностей с помощью программы AliBee − Multiple alignment Release 2.0 ‒ в целях выявления наиболее консервативных участков. Специфичность разработанных праймеров проверяли путем сравнения их сходства с известными последовательностями мРНК и генов в базе данных GeneBank: для шпината ‒ ген митохондриальной МДГ mdh-mtx (LOC110788228), ген цитоплазматической МДГ mdh-cyt (LOC110787385), ген СДГ sdha (LOC110803652). Поскольку для амаранта не было обнаружено аннотированных генов исследуемых ферментов, праймеры были разработаны методом сравнительного анализа генов ферментов растений на основе высококонсервативных участков: для гена митохондриальной формы МДГ ‒ арабидопсиса (NM_104202.3), кукурузы (NM_001138756.1), риса (XM_015783979.2), крысы (NM_031151.2), кишечной палочки (NP_417703.1); для гена цитоплазматической формы МДГ ‒ арабидопсиса (NM_123699.4), кукурузы (NM_001153688.1), риса (NC_029265.1), крысы (NM_001316877.1), кишечной палочки (NP_417703.1), для гена сукцинатдегидрогеназы – арабидопсиса (NM_127401.3), кукурузы (NC_024465.2), риса (NC_029263.1), крысы (NC_005100.4), кишечной палочки (NC_025167.1). Полученные праймеры были апробированы ранее (Хаба и др., 2013).
В опытах по влиянию засоления на уровень экспрессии генов митохондриального и цитоплазматического изоферментов МДГ в клетках амаранта было показано, что воздействие стрессового фактора индуцирует изменения в работе генетического аппарата, приводящие к увеличению количества мРНК обоих генов (рис. 6а) Так, наибольший уровень экспрессии генов mdh-mtx и mdh-cyt наблюдали после 6-часового воздействия стрессора, что совпадает с пиком активности НАД-МДГ. Анализ данных по изменению функционирования гена sdha в исследуемых растениях на протяжении всего опыта воздействия на них хлорида натрия показал, что увеличивается концентрация матричной РНК гена. Для амаранта было установлено увеличение содержания матричной РНК этого гена, которая зависела прямо пропорционально от времени экспозиции растения в растворе 150 мМ NaCl.
Рис. 6.
Динамика экспрессии генов sdha (1), mdh-mtx (2) и mdh-cyt (3) в листьях амаранта (а) и шпината (б) в норме и при солевом стрессе.
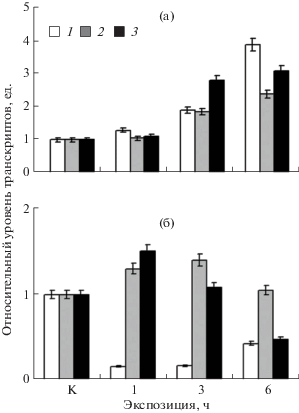
Реакция генетического аппарата шпината в норме и при солевом стрессе оказалась противоположной по отношению к СДГ, т.е. при экспозиции шпината в солевых условиях наблюдалось резкое снижение содержания транскриптов гена sdha (рис. 6б). Динамика содержания транскриптов генов митохондриальной и цитоплазматической форм МДГ имела сходный характер. В первые 3 ч действия солевого стресса наблюдалось небольшое увеличение содержания мРНК исследуемых генов. Однако к 6-му часу экспозиции уровень транскриптов данных генов снижался в 1.5‒2 раза.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты позволяют сделать заключение о важной роли ключевых ферментов цикла Кребса и глиоксилатного пути в механизме адаптивной реакции у С3- и С4-растений. Анализ данных изменения активности и изоферментного состава МДГ- и СДГ-ферментных систем в тканях листьев амаранта и шпината показал, что у С4-растений (амарант) наблюдалось увеличение активности этих ферментов при действии засоления. Следует отметить, что в мезофилле зеленых листьев амаранта обнаруживалось появление дополнительной изоформы после 6-часовой экспозиции. Выявленные изменения в динамике активности и изоферментном составе НАД-МДГ и СДГ свидетельствовали о том, что наблюдаемая активация ферментов в мезофилле зеленых листьев амаранта при засолении происходила при 6‑часовой экспозиции. В обкладке зеленых листьев амаранта активация НАД-МДГ в ответ на засоление была менее выражена, что в определенной степени подтверждается индикаторными показателями развития стрессовых реакций. Более высокие значения концентраций пролина были обнаружены в клетках мезофилльной ткани по сравнению с клетками обкладки. В листьях шпината (С3-тип) стрессиндуцибельных изоформ МДГ не было обнаружено. Неспособность этих растений при засолении усилить функционирование МДГ и СДГ свидетельствует о низком уровне их адаптации. Более того, экстремальные условия подавляют в листьях шпината активность изучаемых ферментов.
Для определения роли отдельных изоформ МДГ в интеграции адаптивной реакции к засолению важное значение имеют результаты по изменению активности цитоплазматической и митохондриальной форм. Известно, что НАД-МДГ в мезофилле амаранта при засолении может существенно влиять на скорость окисления малата в клетках растений, что позволяет максимально приспособить их энергетическую систему к меняющимся условиям среды и перейти на новый стационарный уровень функционирования (Епринцев, Попов, 1999; Eprintsev et al., 2016). Известно, что малат в растительной клетке способен не только накапливаться в больших количествах, но и выполнять функцию транспортного эквивалента органического вещества, что может играть важную роль в адаптивной реакции клеточного метаболизма (Igamberdiev, Eprintsev, 2016). По-видимому, хлорид натрия интенсифицирует работу цикла Кребса, о чем свидетельствует в первую очередь сильное увеличение активности его маркерного фермента (СДГ) и митохондриальной изофомы НАД-МДГ, активируемых при солевом стрессе. Этот эффект обусловлен известным в физиологии растений явлением – “солевым дыханием” (Полевой, 1989).
Ранее было показано, что НАД+-зависимая МДГ растительных клеток представлена широким спектром множественных молекулярных форм (Faleiro et al., 2003). Индукция дополнительного синтеза изоформ данного фермента при стрессе позволяет клеткам компенсировать энергетические затраты и поставлять промежуточные метаболиты (углеродные скелеты) из яблочной кислоты, запасенной в вакуолях. Оксалоацетат, образуемый этим ферментом, ‒ известный осмолит, способный фиксировать аминогруппы для нейтрализации повышенных концентраций солей или связывания свободной воды, защищая, таким образом, организм от нарушения его важнейших метаболических функций (Пинейру де Карвалью и др., 1991; Faleiro et al., 2003).
В значительной степени эти предположения были подтверждены полученными данными о количественных характеристиках экспрессии генов, кодирующих изучаемые ферментные системы. Отметим, что проведение данного исследования стало возможно благодаря разработанным нами специфическим праймерам для генов sdha, mdh-cyt и mdh-mtx. Выявлено, что интенсификация работы обоих энзимов коррелирует с увеличением уровня транскрипции соответствующих генов в клетках амаранта. При этом солевой стресс усиливает экспрессию генов (концентрацию транскриптов) как митохондриальной, так и цитоплазматической изоформ МДГ в листьях амаранта. Четкая зависимость значений этих показателей от активации исследуемых энзимов свидетельствует, по-видимому, о многократном увеличении активности исследуемых ферментов путем синтеза de novo. Так, например, многократное увеличение активности цитоплазматической формы МДГ обусловлено резким возрастанием числа транскриптов гена mdh-cyt. Это в определенной степени свидетельствует об участии цитоплазматической формы МДГ в метаболических реакциях, обеспечивающих поддержание осмотического баланса клетки путем регуляции метаболизма вакуолярного малата (Igamberdiev, Eprintsev, 2016).
ЗАКЛЮЧЕНИЕ
Установлено, что в условиях кратковременного хлоридного засоления в растительных клетках значительно менялось функционирование ферментов, участвующих в регуляции окислительных процессов и метаболизма запасного малата. При этом в клетках шпината, относящегося к С3-типу растений, солевое воздействие не вызывало изменений в изоферментном составе МДГ и в итоге приводило к угнетению ее активности, а также к ингибированию маркерного фермента ЦТК – СДГ. Для амаранта (С4-растение) показана стрессиндуцированная активация изученных ферментов, сопровождающаяся появлением дополнительной формы МДГ в клетках мезофилла. Очевидно, в тканях амаранта солезависимая интенсификация митохондриальной и цитоплазматической форм МДГ, а также СДГ регулируется на уровне транскрипции соответствующих генов, кодирующих исследуемые энзимы, так как увеличение концентрации транскриптов генов sdhа, mdh-cyt и mdh-mtx четко коррелирует с интенсификацией их функционирования в условиях солевого стресса. Адаптивная реакция клеточного метаболизма амаранта к засолению обусловлена интенсификацией работы генетического аппарата, что обеспечивает, по-видимому, усиление окислительного метаболизма и синтеза осмолитов, что в свою очередь позволяет скомпенсировать негативное стрессовое воздействие и вносит вклад в адаптивную реакцию, повышающую общую солеустойчивость организма. В то же время ферментные системы окислительного метаболизма шпината недостаточно вариабельны и не способны обеспечить достаточную адаптационную защиту клеток при засолении, вследствие чего проростки шпината чувствительны к хлориду натрия и испытывают угнетение.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ в рамках государственного задания вузам в сфере научной деятельности на 2020‒2022 годы, проект № FZGU-2020-0044.
Список литературы
Балнокин Ю.В., Котов А.А., Мясоедов Н.А., Хайлова Г.Ф., Куркова Е.Б., Луньков Р.В., Котова Л.М. Участие дальнего транспорта Na+ в поддержании градиента водного потенциала в системе среда‒корень‒лист у галофита Suaeda altissima // Физиология растений. 2005. Т. 52. С. 549‒557.
Епринцев А.Т., Попов В.Н. Ферментативная регуляция метаболизма ди- и трикарбоновых кислот в растениях. Воронеж: Изд-во ВГУ, 1999. С. 134–135.
Епринцев А.Т., Федорина О.С. Функционирование малатдегидрогеназной системы в мезофилле и обкладке листьев кукурузы в условиях солевого стресса // Физиология растений. 2007. Т. 54. С. 820‒827.
Лакин Г.Ф. Биометрия. М.: Высш. шк., 1990. 351 с.
Пинейру де Карвалью М.А.А., Землянухин А.А., Епринцев А.Т. Малатдегидрогеназа высших растений. Воронеж: Изд-во ВГУ, 1991. 216 с.
Полевой В.В. Физиология растений. М.: Высш. шк., 1989. 464 с.
Попов В.Н., Епринцев А.Т., Федорин Д.Н. Световая регуляция экспрессии сукцинатдегидрогеназы в листьях Arabidopsis thaliana // Физиология растений. 2007. Т. 54. С. 409‒415.
Хаба А.М., Федорина О.С., Сальников А.В., Зайчикова М.В., Епринцев А.Т. Экспрессионная регуляция генов малатдегидрогеназы в амаранте сорта “Харьковский” при засолении // Вестн. ВГУ, Серия: Химия. Биология. Фармация. 2013. № 2. С. 88‒90.
Юзбеков А.К. Спектрофотометрические способы определения активности ключевых ферментов фотосинтетического метаболизма у С3- и С4-растений. Препринт. Киев: 1990. 32 с
Bajji M., Kinet J.-M., Lutts S. Osmotic and ionic effects of NaCl on germination, early seedling growth, and ion content of Atriplex halimus (Chenopodiaceae) // Can. J. Bot. 2002. № 3. V. 80. P. 297‒304.
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water-stress studies // Plant Soil. 1973. V. 39. P. 205‒207.
Chomczynski P., Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction // Anal. Biochem. 1987. V. 162. P. 156‒159.
Chow W.S., Ball M.C., Anderson J.M. Growth and photosynthetic responses of spinach to salinity: Implications of K+ nutrition for salt tolerance // Austral. Plant Physiol. 1991. V. 17. P. 563–578.
Davis B.J. Disc electrophoresis II. Method and aplication to human serum protein // Ann. N.Y.: Acad. Sci., 1994. V. 121. P. 404‒427.
Eprintsev A.T., Gataullina M.O., Lyashchenko M.S. Physicochemical and catalytic properties of NAD+-dependent malate dehydrogenase isoforms from maize mesophyll // Prikl. Biokhim. Mikrobiol. 2016. V. 52. P. 365‒369.
Faleiro A.C., Gazoli R.A., Pires da Silva M., Machado M. Malate dehydrogenase isozyme patterns in cladophylls of a Opuntia ficus-indica Mill. (Cactaceae) clonal population // Acta Sci. Biol. Sci. 2003. V. 25. P. 207‒211.
Farineau J. Photoassimilation of CO2 by isolated bundle-sheath strands of Zea mays. L. Stimulation of CO2 assimilation by adding of various intermediates of the photosynthetic cycle; Evidence for a deficient photosystem II activity // Physiol. Plant. 1975. V. 33. P. 300‒309.
Fieldes M.A. An explanation of the achromatic bands produced by peroxidase isozymes inpolyacrylamide electrophoresis gels stained for malatedehydrogenase // Electrophoresis. 1992. V. 13. P. 82‒86.
Hasegawa P.M., Bressan R.A., Zhu J.-K., Bohnert H.J. Plant cellular and molecular responses to high salinity // Annu. Rev. Plant Physiol. Plant Mol. Biol. 2000. V. 51. P. 463‒499.
Igamberdiev A.U., Eprintsev A.T. Organic acids: the pools of fixed carbon involved in redox regulation and energy balance in higher plants // Front Plant Sci. 2016. V. 7: 1042.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2‒ΔΔCt method // Methods. 2001. V. 25. P. 402‒408.
Nicot N., Hausman J.F., Hoffmann L., Evers D. Housekeeping gene selection for real-time RT-PCR normalization in potato during biotic and abiotic stress // J. Exp. Bot. 2005. V. 56. P. 2907–2914.
Popov V.N., Dmitrieva E.A., Eprintsev A.T., Igamberdiev A.U. Glycolate oxidase isoforms are distributed between the bundle sheath and mesophyll tissues of maize leaves // J. Plant Physiol. 2003. V. 160. P. 851‒857.
Schulze J., Tesfaye M., Litjens R.H.M.G., Bucciarelli B., Trepp G., Miller S., Samac D., Allan D., Vance C.P. Malate plays a central role in plant nutrition // Plant Soil. 2002. V. 247. P. 133‒139.
Shannon M.C., Grieve C.M. Tolerance of vegetable crops to salinity // Sci. Hort. 1999. V. 78. P. 5–38.
Zeng H., Xu L., Singh A., Wang H., Du L., Poovaiah B.W. Involvement of calmodulin and calmodulin-like proteins in plant responses to abiotic stresses // Front Plant Sci. 2015. V. 6.: 600.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


