Известия РАН. Серия биологическая, 2023, № 3, стр. 278-286
Влияние светодиодного освещения разного спектра на развитие салата листового (Lactuca sativa)
О. В. Наконечная 1, *, А. С. Холин 2, Е. П. Субботин 2, Е. В. Бурковская 1, Ю. А. Хроленко 1, И. В. Гафицкая 1, И. Ю. Орловская 1, М. Л. Бурдуковский 1, А. В. Михеева 1, Ю. Н. Кульчин 2
1 Федеральный научный центр биоразнообразия наземной биоты Восточной Азии ДВО РАН
690022 Владивосток, просп. 100-летия Владивостока, 159, Россия
2 Институт автоматики и процессов управления Дальневосточного отделения
Российской академии наук
Владивосток, Россия
* E-mail: markelova@biosoil.ru
Поступила в редакцию 12.05.2022
После доработки 13.07.2022
Принята к публикации 07.11.2022
- EDN: MIAMYV
- DOI: 10.31857/S1026347022600406
Аннотация
Исследовано влияние 5 спектров светодиодных (СД) светильников на растения L. sativa сорта “Афицион”, выращиваемых в условиях закрытого почвогрунта. Для контроля использовали теплый белый свет WW (соотношение долей синего, зеленого и красного света – 14% : 48% : 38%). Максимальные значения размеров листьев и сырой массы надземной части выявлены у группы RGB (сине-зеленый-красный – 32% : 19% : 49%), по значениям сухой массы и золы – у группы FS (сине-зеленый-красный 27% : 11% : 62%). Плотность распределения устьиц и их размер на нижней стороне листа была максимальной у растений SB (сине-зеленый-красный 33% : 41% : 38%). Это наиболее эффективное сочетание параметров в плане архитектоники листа. Увеличение доли красного света в спектре при снижении доли зеленого света положительно влияет на развитие растений L. sativa, в то же время увеличение доли зеленого света в спектре положительно отражается на формировании устьичного аппарата.
Интенсивность и спектральный состав света являются факторами, регулирующими как ростовые, так и фотосинтетические реакции в системе целого растения (Протасова, 1987; Frąszczak, Kula–Maximenko, 2021). Понимание процессов передачи сигналов и формирование адаптационного ответа позволит выработать механизмы управления потенциалом развития растений. Интерес к тематике возрастает при выращивании сельскохозяйственных культур. Одной из них является салат (Lactuca sativa L.). В растении присутствуют полиненасыщенные жирные кислоты, которые важны для здоровья человека (Kaur et al., 2014). Основными жирными кислотами в салате являются α-линоленовая кислота и линолевая кислота, составляющие 60 и 20% от общего количества жирных кислот, соответственно (Le Guedard et al., 2008). Кроме того, в листьях содержатся такие элементы как Na, K, Ca, Mg, Zn, Fe (Kawashima, Soares, 2003; Mou, 2005; Koudela and Petríková, 2008; Baslam et al., 2013), витамин С, Е, B9 (Kim et al., 2016), каротиноиды (Mou, 2005) и др. Наличие клетчатки в растениях салата при употреблении в пищу способствует снижению риска сердечно-сосудистых заболеваний, диабета, развития рака толстой кишки (Kim et al., 2016; Shimokawa et al., 2014).
Исследования влияния спектров света и интенсивности на разные сорта салата начались в конце прошлого столетия. К настоящему времени механизмы воздействия света изучены более чем на 40 сортах. Было определено, что в зависимости от сорта реакция растений на разный спектр не всегда была одинаковой – изменялся синтез веществ или параметры роста (Hunter, Burritt, 2004; Caldwell, Britz , 2006; Stutte et al., 2009; Shimokawa et al., 2014; Bantis et al., 2016).
При изучении влияния красного света (R, 660 нм) на развитие проростков салата выявлено сильное вытягивание растений. Добавление синих фотонов (B, 435–470 нм) к красному спектру привело к минимальному удлинению гипокотилей и черешков листьев (Hoenecke et al., 1992). Ингибирующее действие на рост побегов салата при использовании синего света и стимулирующее процессы развития у красного света подтверждено позднее (Hunter, Burritt, 2004). При постоянном воздействии увеличение доли синего света способствует изменению фотосинтетических характеристик и росту из-за стимулирования морфологических и физиологических реакций (Wang et al., 2016). Синие светодиоды (440 нм) регулируют метаболические пути, ведущие к увеличению концентрации антиоксидантов в тканях листьев салата (Stutte et al., 2009).
Определенное влияние на развитие растений оказывает ультрафиолет. Показано, что дополнительное УФ-облучение увеличивало концентрацию каротиноидов и хлорофилла в зеленом листовом салате, одновременно снижая уровни этих соединений в красном листовом салате (Caldwell, Britz, 2006). Добавление 1% ультрафиолета привело к увеличению показателей общей массы, соотношению корень/побег и общему содержанию фенола (Han et al., 2017).
Исследовано сочетание спектров света разных длин волн. Так, чередование красного и синего света значительно ускоряло рост растений салата и увеличивало накопление сырой массы в 1.6 раза, чем при одновременном облучении, и почти в два раза − при флуоресцентном освещении (Shimokawa et al., 2014). Аналогичные результаты были получены при использовании четырех режимов освещения с различными интервалами свечения красного (R) и синего (B) света (Chen et al., 2017). Было показано, что спектры R/B (8 ч) и R/B (1 ч) привели к более высокой урожайности, в то время как R/B (4 ч) и R/B (2 ч) дали более высокую питательную ценность по сравнению с растениями, выращенными под постоянным RB светом (Chen et al., 2017).
Изучение влияния зеленого света на рост растений салата рассмотрено в нескольких работах (Kim et al., 2004a, 2004b, 2004c, 2005, 2006; Johkan et al., 2012; Мишанов и др., 2015). Авторы использовали зеленые светодиоды с разной длиной волны (G510, G520, G530) и интенсивности (плотность потока фотонов в видимом спектре (ППФ) – 100 и 300). Развитие растений, культивированных под G510 при ППФ 300, было самым интенсивным (Johkan et al., 2012). Изменение доли зеленого света в спектре может влиять на морфометрические показатели в растениях салата (Kim et al., 2004a, 2004b, 2004c; Мишанов и др., 2015).
Несмотря на разнообразные исследования по влиянию спектров на развитие салата, формирование адаптационных реакций у растений остается в полной мере не изучено. Кроме того оптимизация режимов освещения для получения максимальных морфометрических показателей растений при сохранении качества продукции актуальна. Цель данной работы − выявление морфофизиологического отклика растений салата (Lactuca sativa) сорта “Афицион” при их развитии в условиях применения светодиодных источников полихромных спектров.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали салат (Lactuca sativa) сорта “Афицион”. Семена для эксперимента предоставлены ФГУП “Дальневосточное” Суражевским тепличным комбинатом. Для культивирования растений использовали пластиковые контейнеры объемом 10 см3 и почвогрунт “Универсальный” с содержанием элементов: азот – 160–240 мг/л, фосфор – 145–215 мг/л, калий – 180–290 мг/л, магний – 135 мг/л, гуминовые вещества – 35 мг/л, pH водного раствора – 5.5–7 (ООО “Терра мастер”, Новосибирск).
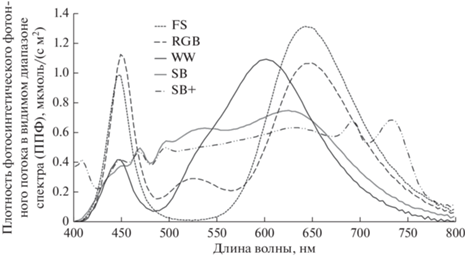
Через 3 дня после посева пластиковые контейнеры (КВ9М 0.5 л, ООО “Джетта”, Россия) с проросшими семенами поместили в боксы экспериментальной установки, расположенной в Лазерном центре Института автоматики и процессов управления Дальневосточного отделения Российской академии наук (ЛЦ ИАПУ ДВО РАН). Установка представляла собой 5 боксов, обтянутых внутри светоотражающим материалом, в верхней части которых располагали светодиодные (СД) светильники с разными спектрами освещения (рис. 1, табл. 1). Специализированные источники света были сконструированы и изготовлены в ИАПУ ДВО РАН. В источниках света применялись матрицы с набором светодиодов фирмы Chanzon (China) мощностью 3 Вт и силой тока 700 мА каждый. Светильник со спектром теплого белого света с цветовой температурой 3500К (WW) использовали как контроль. ППФ составляла 150 мкмоль/с м2. Для создания одинакового уровня освещенности подбирали мощность излучения каждого светильника с помощью световых драйверов (EUM-150S105DG, Китай). Уровень освещенности контролировали спектрофотометром “ТКА-Спектр” (НТП “ТКА”, Россия). В боксах поддерживали температуру 21°C днем и 18°C ночью, влажность воздуха 75%, световой режим 16/8. Продолжительность экспериментов составила 35 сут. Эксперимент проводили в трех повторностях.
Таблица 1.
Спектральные характеристики источников света
| Параметр | Единица измерения |
Тип светильника | ||||
|---|---|---|---|---|---|---|
| WW | SB | RGB | FS | SB+ | ||
| Максимальная облученность в диапазоне длин волн | Eemax (мВт/м2) | 219 | 145 | 301 | 264 | 123 |
| Общая ФАР облученность (400–700 нм) |
Eе (PAR) (Вт/м2) | 31 | 33 | 32 | 32 | 33 |
| PPFD (мкмоль/с м2) | 150 | 155 | 153 | 154 | 152 | |
| % | 100 | 100 | 100 | 100 | 100 | |
| Спектральная облученность / PPFD | ||||||
| Синий (400–500 нм) |
Eе (PAR) (Вт/м2) | 5 | 8 | 10 | 9 | 10 |
| PPFD (мкмоль/с м2) | 17 | 33 | 39 | 32 | 38 | |
| % | 14 | 25 | 32 | 27 | 31 | |
| Зеленый (500–600 нм) |
Eе (PAR) (Вт/м2) | 15 | 14 | 6 | 3 | 11 |
| PPFD (мкмоль/с м2) | 70 | 63 | 29 | 16 | 53 | |
| % | 48 | 41 | 19 | 11 | 35 | |
| Красный (600–700 нм) |
Eе (PAR) (Вт/м2) | 12 | 11 | 16 | 20 | 11 |
| PPFD (мкмоль/с м2) | 63 | 59 | 86 | 107 | 61 | |
| % | 38 | 33 | 49 | 62 | 34 | |
По завершению эксперимента у 20 растений из каждого бокса измерены: число листьев, длина и ширина первых трех листьев в розетке, сырая и сухая массы надземной части растения и корней. Для определения процента золы (зольности) использовали общую навеску из всех исследованных растений в каждом эксперименте. После сушки в электрошкафу (СНОЛ–3,5.5.3,5/3,5–И5, Россия) образцы измельчали в лабораторной зерновой мельнице (ЛЗМ–1, Россия) и озоляли в муфельной печи (ЭКПС–10, Россия) при 450°C в течение 8 ч.
Изучение устьиц листьев проводились на препаратах, приготовленных согласно общепринятым методикам с некоторыми модификациями применительно к данному объекту (Khrolenko et al., 2012). Слепки эпидермы просматривали и фотографировали под микроскопом Axioskop-40 с помощью встроенной видеокамеры AxioCam HRc (Zeiss, Germany). Длину замыкающих клеток устьиц и их число на условную единицу площади (1 см2) на обеих сторонах листовой пластинки определяли в 50-кратной повторности для каждого экземпляра, выращенного при различных световых режимах. Подсчет проводили на микрофотографиях, полученных с препаратов слепков эпидермы листа, при помощи программы Axio Vision версии 4.8.3. (для регистрации, обработки и анализа изображений). Область подсчета числа устьиц ограничивали площадью круга S = πr2 с радиусом r = 178.46 µm. При заданных условиях значения равнялись n × × 103/cм2.
Все полученные результаты обработаны статистически с использованием пакета “Statistica” версии 13.3. Диаграммы построены на основе средних арифметических значений измеренных параметров со стандартной ошибкой. Сравнение средних данных для растений разных вариантов с контролем проводили попарно, используя t-критерий Стьюдента. Критический уровень значимости принимали равным 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
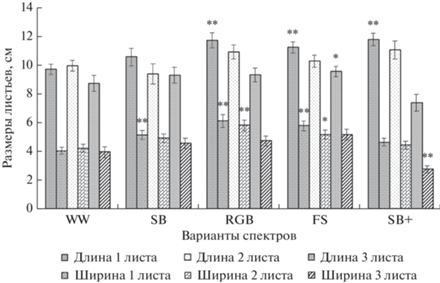
Внешний вид растений и значения морфометрических параметров растений приведены в табл. 2 и на рис. 2 и 3. При анализе полученных результатов выявлена тенденция к увеличению размеров и числа листьев в розетках у растений группы RGB. Наименьшее значение числа листьев отмечено в группе SB+. Первый лист был достоверно длиннее у растений групп RGB, FS и SB+, по длине и шире – у групп SB, RGB и FS (рис. 3). По длине второго и третьего листа достоверных отличий нет. По ширине второго листа значимые различия выявлены у растений RGB и FS групп по сравнению с контролем (рис. 3). Достоверно меньше была ширина третьего листа у растений группы SB+ (рис. 3).
Таблица 2.
Морфометрические параметры растений Lactuca sativa, выращенного при разных условиях светодиодного освещения
| WW | SB | RGB | FS | SB+ | |
|---|---|---|---|---|---|
| Число листьев, шт | 6.24 ± 0.20 | 6.41 ± 0.33 | 6.61 ± 0.30 | 6.29 ± 0.34 | 5.5 ± 0.15** |
| Сырая масса надземной части, г | 1.98 ± 0.24 | 2.54 ± 0.33 | 3.73 ± 0.59* | 3.47 ± 0.45** | 1.88 ± 0.21 |
| Сырая масса корней, г | 0.49 ± 0.36 | 0.36 ± 0.07 | 0.36 ± 0.07 | 0.41 ± 0.08 | 0.13 ± 0.02 |
| Соотношение корней к общей массе растения, % | 8.18 ± 0.48 | 16.12 ± 1.27 | 9.51 ± 0.57 | 11.44 ± 1.07 | 7.54 ± 0.49 |
| Сухая масса надземной части, г | 0.08 ± 0.01 | 0.12 ± 0.02* | 0.15 ± 0.02** | 0.19 ± 0.03** | 0.07 ± 0.01 |
| Сухая масса корней, г | 0.01 ± 0.001 | 0.02 ± 0.004** | 0.02 ± 0.003** | 0.02 ± 0.004** | 0.01 ± 0.001 |
| Зола, % | 82.713 | 84.530 | 82.739 | 89.583 | 82.217 |
| Примечание. * – достоверность P < 0.05 по отношению к контролю; ** – достоверность P < 0.01 по отношению к контролю. | |||||
Рис. 3.
Размеры листьев растений Lactuca sativa, выращенного при разных условиях светодиодного освещения.* – достоверность P < 0.05 по отношению к контролю; ** – достоверность P < 0.01 по отношению к контролю.
Максимальные значения показателей сырой массы надземной части отмечены у растений группы RGB (табл. 2), минимальные – у растений SB+ и контрольной (WW) групп. В то же время сырая масса корней больше у растений контроля, однако, значимых отличий от растений других групп не выявлено. Растения группы FS характеризовались близкими к максимальным значениями сырой массы надземной части, и максимальными значениями сухой массы надземной части и корней, золы. Минимальные значения параметров отмечены у растений групп SB+ и WW (контроль).
Установлено, что листья L. sativa дорзовентральные, амфистоматные, тип устьиц аномоцитный. Крупноклеточная нижняя эпидерма однослойная, с извилистыми антиклинальными стенками (рис. 4). Количественные показатели устьичного аппарата листа растений салата, выращенных при разных режимах полихроматического светодиодного освещения, представлены на рис. 5.
Рис. 4.
Строение нижнего эпидермиса Lactuca sativa, выращенного при разных условиях светодиодного освещения. Масштабная линейка 50 мкм.
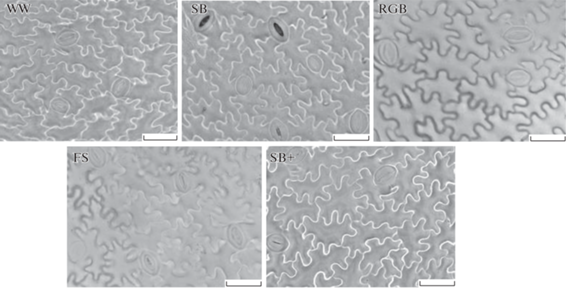
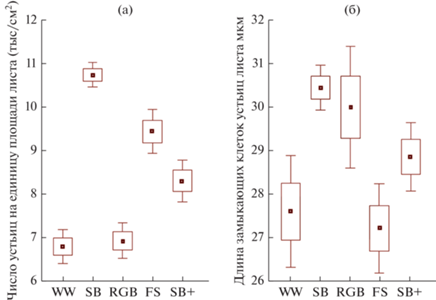
Рис. 5.
Изменение количественных параметров устьиц нижнего эпидермиса Lactuca sativa, выращенного при разных условиях светодиодного освещения: а − число устьиц на единицу площади листа (тыс./см2); б − длина замыкающих клеток устьиц листа, мкм; ◻ – среднее значение; ◻ – среднее значение ± SE; I – среднее значение ± 1.96 SE. Варианты освещения: WW – теплый белый; SB – солнечный спектр; RGB – красный-зеленый-синий; FS – красно-синий, SB+ – измененный солнечный спектр.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Спектры света, при которых у растений наблюдали наибольшие значения исследованных морфометрических показателей (число, длина и ширина листьев, сырая и сухая массы надземной части и корней), содержат наибольшую долю красного света (49% у RGB спектра, 62% – у FS) и наименьшую долю зеленого света (19% у RGB спектра, 11% у FS). Минимальные значения морфометрических параметров отмечены у растений групп SB+ и WW (контроль). Форма спектра светильника SB+ способствовала вытягиванию листьев растений, что в свою очередь повлияло на минимальное накопление массы у растений L. sativa и меньший процент золы, полученный с данной экспериментальной пробы. У спектров SB+ и WW доли красного света меньше, чем у RGB и FS, и составляют (34% у SB+, 38% у WW), а доли зеленого света выше – 35 и 48% соответственно. Так, для выращивания растений салата сорта “Афицион” доля зеленого в спектре, вероятно, должна быть до 20%, а доля красного в два раза больше.
Аналогичные результаты были получены ранее (Kim et al., 2004a, 2004b, 2004c; Мишанов и др., 2015). Так при изучении влияния двух спектров выявлено, что изменение соотношения зеленого и красного света в спектре излучателя в сторону уменьшения зеленого ведет к увеличению накопления сухого и органического веществ в растениях L. sativa (Мишанов и др., 2015). Американскими учеными (Kim et al., 2004a, 2004b, 2004c) при выращивании растений L. sativa “Waldmann’s Green” под светодиодами с красным, синим и зеленым светом было выявлено, что 24% зеленого света в спектре способствовали получению более высоких показателей сырой и сухой массы и большей площади листьев, чем у растений, выращенных под люминесцентными лампами со спектром холодного белого (CWF, 51% зеленого) или флуоресцентного синего (0% зеленого) света. Избыток (86%) зеленого света в спектре привел к получению наименьшей массы растений. Позднее те же авторы показали, что источники света, имеющие в спектре более 50% зеленого, вызывают снижение скорости роста растений, тогда как комбинации, включающие до 24% зеленого, ускоряют рост (Kim et al., 2005, 2006).
Наиболее узкие листья отмечены в группе контроля (WW). В этом спектре доля синего света минимальна и составляет 14%, в то время как во всех других спектрах его доля выше – 26–32% (табл. 1). Ранее при изучении влияния синего в сравнении с красным светом высокой интенсивности (500 и 1000 ммоль/с м2) выявлено, что изменение доли синего света (от 0 до 6%) способствовало увеличению площади листьев. Данный факт авторы объясняли увеличением размеров клеток в 3.1 раза и частоты деления клеток в 1.6 раза (Dougher, Bugbee, 2004).
Спектральный состав света влияет на фотосинтез и проводимость устьиц. Так было показано, что скорость фотосинтеза листьев и проводимость устьиц были выше у растений, выращенных под белыми флуоресцентными лампами (CWF), чем у растений, выращенных под красными светодиодами с дополнительным синим светом или без него (Yorio et al., 2001).
В нашем эксперименте при исследовании устьичного аппарата листьев выявлено, что суммарная поверхностная плотность распределения устьиц на единицу площади листа находилась в пределах от 12 тыс/см2 (SB+) до 19 тыс/см2 (SB). Эти значения попадают в диапазон, характерный для сциофитных растений – типичных представителей подлеска. Это также встречается у мезофитных и хозяйственно-ценных видов растений, как нами было показано ранее (Наконечная и др., 2022).
В данной работе выявлено статистически достоверное (p < 0.01) увеличение поверхностной плотности распределения устьиц на нижней стороне листа у SB, SB+ и FS вариантов (рис. 5а). У растений RGB группы изменение по этому показателю статистически не достоверно по сравнению с контролем. Подобные результаты были получены китайскими авторами. При культивировании микрорастений картофеля под светом FL (Fluorescent white light) наблюдали увеличение плотности распределения устьиц на нижней стороне листа (Ma et al., 2015). У листьев растений салата (Lactuca sativa L.), выращенных при соотношении красного и синего спектра (R/B = 1) значительно увеличилась поверхностная плотность распределения устьиц при небольшом уменьшении размеров самих устьиц и, как следствие, эти растения имели самую высокую скорость фотосинтеза (Wang et al., 2016).
Размеры замыкающих клеток устьиц у групп SB+ и FS соответствовали контролю (различия не достоверны) или немного были выше такового. Интересен тот факт, что самые крупные устьица в опыте наблюдали у образцов SB варианта (различия с контролем достоверны p < 0.01) (рис. 5б) при наибольшей плотности распределения устьиц на листе. Это, вопреки ожидаемому, не подтверждает известную для растений закономерность – наличие отрицательной корреляции между длиной замыкающих клеток устьиц и их числом (Jones et al., 1987). Однако сочетание параметров устьичного аппарата, как выявлено у группы растений SB, является наиболее эффективным с точки зрения архитектоники фотосинтезирующего листа.
Сопротивление диффузии газа в лист складывается из устьичного и мезофильного сопротивлений. Устьичное сопротивление определяется такими факторами как степень открытия устьиц, число устьиц на единицу площади листа и др. Увеличение поверхностной плотности распределения устьиц должно позволить растениям в условиях достаточного увлажнения усилить проводимость газообмена листа и, таким образом, избегать ограничения фотосинтеза (Мокроносов, Гавриленко, 1992). В литературе нет четких доказательств корреляции между определенными спектрами и параметрами устьиц растений. Так японские авторы установили, что под влиянием синего спектра увеличивается поверхностная плотность распределения устьиц микрорастений разных сортов винограда, а изменение размеров замыкающих клеток устьиц под этим спектром выявило сортовую специфичность (Poudel et al., 2008). В то же время китайские авторы показали, что самая высокая плотность распределения устьиц на листе и самые крупные устьица у микрорастений хлопка были при обработке красным и синим спектром (Li et al., 2010).
ЗАКЛЮЧЕНИЕ
При исследовании влияния 5 спектров светодиодных светильников на морфологию растений L. sativa сорта “Афицион”, выращиваемых в условиях закрытого почвогрунта, выявлено, что доля света определенной длины волны, а также соотношение долей длин волн в спектре светильников, могут влиять на развитие растений. Для получения развитых растений L. sativa в спектре освещения доля зеленого света не должна быть выше 20%, доля красного – 50–60%, доля синего около – 30%. Увеличение доли зеленого и снижение доли синего света в спектре вызывает вытягивание растений. В результате проведенного исследования было выявлено, что влияние спектрального состава света SB+, SB и FS стимулировало образование устьиц. Закономерное уменьшение длины замыкающих клеток устьиц выявлено в тех же вариантах, за исключением SB, у которого наблюдали самые крупные устьица с максимальной плотностью распределения их на листе. Таким образом, полученные данные позволяют предположить, что растения вариантов SB+, SB и FS обладают наименьшей устьичной проводимостью, и, соответственно, потенциально более высоким уровнем фотосинтеза.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № 121031000144-5), поддержана грантом Российской академии наук № 20-16-00016.
Список литературы
Мишанов А.П., Маркова А.Е., Ракутько С.А., Бровцин В.Н., Ракутько Е.Н. Влияние соотношения долей зеленого и красного излучения на биометрические показатели салата // Сб. науч. трудов. ИАЭП. 2015. Вып. 87. С. 264–271.
Мокроносов А.Т., Гавриленко В.Ф. Фотосинтез. Физиолого-экологические и биохимические аспекты. М.: МГУ, 1992. 319 с.
Наконечная О.В., Холин А.С., Субботин Е.П., Грищенко О.В., Бурковская Е.В., Хроленко Ю.А., Бурдуковский М.Л., Кульчин Ю.Н., Журавлев Ю.Н. Развитие растений томатов под светом различного спектрального состава // Физиол. раст. 2022. Т. 69. № 5. С. 472–479.
Протасова Н.Н. Светокультура как способ выявления потенциальной продуктивности растений // Физиол. раст. 1987. Т. 34. № 4. С. 812–822.
Bantis F., Ouzounis T., Radoglou K. Artificial LED lighting enhances growth characteristics and total phenolic content of Ocimum basilicum, but variably affects transplant success // Sci. Hortic. 2016. V. 198. P. 277–283.
Baslam M., Morales F., Garmendia I., Goicoechea N. Nutritional quality of outer and inner leaves of green and red pigmented lettuces (Lactuca sativa L.) consumed as salads // Sci. Hort. 2013. V. 151. P. 103–111.
Caldwell C.R., Britz S.J. Effect of supplemental ultraviolet radiation on the carotenoid and chlorophyll composition of green house-grown leaf lettuce (Lactuca sativa L.) cultivars // J. Food Compos. Anal. 2006. V. 19. № 6–7. P. 637–644.
Chen X.L., Yang Q.C., Song W.P., Wang L.C., Guo W.Z., Xue X.Z. Growth and nutritional properties of lettuce affected by different alternating intervals of red and blue LED irradiation // Sci. Hortic. 2017. V. 223. P. 44–52.
Dougher T.A., Bugbee B. Long-term blue light effects on the histology of lettuce and soybean leaves and stems // J. Am. Soc. Hortic. Sci. 2004. V. 129. № 4. P. 467–472.
Frąszczak B., Kula-Maximenko M. The preferences of different cultivars of lettuce seedlings (Lactuca sativa L.) for the spectral composition of light // Agronomy. 2021. V. 11. № 6. P. 1211.
Han T., Vaganov V., Cao S., Li Q., Ling L., Cheng, X., Peng L., Zhang C., Yakovlev A.N., Zhong Y., Tu M. Improving “color rendering” of LED lighting for the growth of lettuce // Sci. Rep. 2017. V. 7. P. 45944.
Hoenecke M.E., Bula R.J., Tibbitts T.W. Importance of 'blue' photon levels for lettuce seedlings grown under red-light-emitting diodes // HortScience. 1992. V. 27. № 5. P. 427–430.
Hunter D.C., Burritt D.J. Light quality influences adventitious shoot production from cotyledon explants of lettuce (Lactuca sativa L.) // In Vitro Cellular and Developmental Biology-Plant. 2004. V. 40. № 2. P. 215–220.
Johkan M., Shoji K., Goto F., Hahida S.N., Yoshihara T. Effect of green light wavelength and intensity on photomorphogenesis and photosynthesis in Lactuca sativa // Environ. Exp. Bot. 2012. V. 75. P. 128–133.
Jones H.G., Farquar G.D., Cowan I.R. Breeding for stomatal characters // Stomatal function. Eds. Zeiger E., Farquhar G.D. Cowan I.R. Stanford (CA): Stanford University Press. 1987. P. 431–443.
Kaur N., Chugh V., Gupta A.K. Essential fatty acids as functional components of foods – a review // J. Food Sci. Technol. 2014. V. 51. № 10. P. 2289–2303.
Kawashima L.M., Soares L.M.V. Mineral profile of raw and cooked leafy vegetables consumed in Southern Brazil // J. Food Compos. Anal. 2003. V. 16. № 5. P. 605–611.
Kim H.H., Goins G.D., Wheeler R.M., Sager J.C. A comparison of growth and photosynthetic characteristics of lettuce grown under red and blue light-emitting diodes (LEDs) with and without supplemental green LEDs // Acta Hort. 2004a. V. 659. P. 467–475.
Kim H.H., Goins G.D., Wheeler R.M., Sager J.C. Green-light supplementation for enhanced lettuce growth under red- and bluelight-emitting diodes // HortScience. 2004b. V. 39. P. 1617–1622.
Kim H.H., Goins G.D., Wheeler R.M., Sager J.C. Stomatal conductance of lettuce grown under or exposed to different light qualities // Ann. Bot. (Lond.) 2004c. V. 94. P. 691–697.
Kim H.H., Wheeler R.M., Sager J.C., Gains G.D., Naikane J.H. Evaluation of lettuce growth using supplemental green light with red and blue light-emitting diodes in a controlled environment-a review of research at Kennedy Space Center // In V International Symposium on Artificial Lighting in Horticulture. 2005. V. 711. P. 111–120.
Kim H.H., Wheeler R.M., Sager J.C., Goins G.D., Norikane J.H. Evaluation of lettuce growth using supplemental green light with red and blue light-emitting diodes in a controlled environment – A review of research at Kennedy Space Center // Acta Hort. 2006. V. 711. P. 111–119.
Kim M.J., Moon Y., Tou J.C., Mou B., Waterland N.L. Nutritional value, bioactive compounds and health benefits of lettuce (Lactuca sativa L.) // J. Food Compos. Anal. 2016. V. 49. P. 19–34.
Khrolenko Yu.A., Burundukova O.L., Burkovskaya E.V., Zhuravlev Yu.N. Mesophyll structure and chloroplast density in Panax ginseng leaves from the Sikhote-Alin Mts // Acta Biol. Cracov., Ser. Bot. 2012. V. 54. № 2. P. 54–60.
Koudela M., Petríková K. Nutrients content and yield in selected cultivars of leaf lettuce (Lactuca sativa L. var. crispa) // Hortic.Sci. 2008. V. 35. № 3. P. 99–106.
Le Guedard M., Schraauwers B., Larrieu I., Bessoule J.-J. Development of a biomarker for metal bioavailability: the lettuce fatty acid composition // Environ. Toxicol. Chem. 2008. V. 27. № 5. P. 1147–1151.
Li H., Xu Z., Tang C. Effect of light-emitting diodes on growth and morphogenesis of upland cotton (Gossypium hirsutum L.) plantlets in vitro // PCTOC. 2010. V. 103. № 2. P. 155–163
Ma X., Wang Y., Liu M., Xu J., Xu Z. Effects of green and red lights on the growth and morphogenesis of potato (Solanum tuberosum L.) plantlets in vitro // Sci. Hortic. 2015. V. 190. P. 104–109.
Mou B. Genetic variation of beta-carotene and lutein contents in lettuce // J. Am. Soc. Hortic. Sci. 2005. V. 130. № 6. P. 870–876.
Poudel P.R., Kataoka I., Mochioka R. Effect of red-and blue-light-emitting diodes on growth and morphogenesis of grapes // Plant cell, tissue and organ culture. 2008. V. 92. № 2. P. 147–153.
Shimokawa A., Tonooka Y., Matsumoto M., Ara H., Suzuki H., Yamauchi N., Shigyo M. Effect of alternating red and blue light irradiation generated by light emitting diodes on the growth of leaf lettuce // bioRxiv. 2014. P. 003103.
Stutte G.W., Edney S., Skerritt T. Photoregulation of bioprotectant content of red leaf lettuce with light-emitting diodes // HortScience. 2009. V. 44. № 1. P. 79–82.
Wang J., Lu W., Tong Y., Yang Q. Leaf morphology, photosynthetic performance, chlorophyll fluorescence, stomatal development of lettuce (Lactuca sativa L.) exposed to different ratios of red light to blue light // Frontiers in Plant Science. 2016. V. 7. P. 64–73.
Yorio N.C., Goins G.D., Kagie H.R., Wheeler R.M., Sager J.C. Improving spinach, radish, and lettuce growth under red light-emitting diodes (LEDs) with blue light supplementation // HortScience. 2001. V. 36. № 2. P. 380–383.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая