Известия РАН. Серия биологическая, 2023, № 3, стр. 297-307
Размеры тела и пищеварительного тракта у мелких млекопитающих-фитофагов: влияние экологических и физиологических факторов
Е. И. Наумова 1, *, Т. Ю. Чистова 1, Г. К. Жарова 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: einaumova@gmail.com
Поступила в редакцию 25.10.2022
После доработки 14.11.2022
Принята к публикации 19.12.2022
- EDN: MJZEFJ
- DOI: 10.31857/S1026347022600832
Аннотация
Рассмотрен вопрос о размерном соотношении тела и пищеварительного тракта (ПТ) у мелких млекопитающих-фитофагов на примере песчанок (Gerbillidae) – группе грызунов, исключительно удобной для изучения подобных зависимостей в связи с существенными различиями в массе тела и морфологической однородности ПТ. Мы проанализировали весовые соотношения размеров тела и ПТ, сырой массы содержимого и тканей ПТ у 6 видов песчанок с 10-кратным диапазоном массы тела (в среднем от 18 до 175 г), сосуществующих в пустыне Негев – Psammomys obesus, Meriones crassus, Gerbillus pyramidum, Gerbillus allenbyi, Gerbillus dasyurus Gerbillus henleyi. В ряду исследованных видов мелких млекопитающих с массой тела менее 0.5 кг не обнаружено линейной зависимости между размерами тела и ПТ. Аллометрия рассмотренных показателей обусловлена главным образом экологическими и физиологическими факторами.
Структура и размеры пищеварительного тракта (ПТ) млекопитающих-фитофагов неизбежно сопряжены с размерами тела животных. В исследованиях размерных эффектов взаимодействия массы тела и ПТ основное внимание исследователей привлекали крупные фитофаги (Janis, 1976; Demment, 1982; Demment, Van Soest, 1985; Hofmann, 1989). Этот интерес обусловлен традиционным представлением о лучшей адаптации крупных млекопитающих к потреблению волокнистых кормов по сравнению с мелкими (Bell, 1971; Jarman, 1974). Его суть заключается в том, что высокое содержание в растительных кормах структурных углеводов требует увеличения объема пищеварительного тракта для осуществления длительной микробной ферментации. Это, в свою очередь, влечет за собой увеличение размеров тела, что приносит дополнительную выгоду – уменьшение удельных энергетических потребностей в соответствии с правилом Клайбера (Kleiber, 1961). В соответствии с этими взглядами малые размеры тела и ферментативных камер ПТ не позволяют млекопитающим, в том числе грызунам, быть успешными потребителями бедных кормов, требующих длительной микробной ферментации (Parra, 1978; Demment, 1982; Demment, van Soest, 1985; Foley, Cork, 1992; Hume, 2002; Langer, 2002). Тем не менее, среди мелких млекопитающих известны виды, высоко специализированные к питанию вегетативными частями растений (Hammond, Wunder, 1991; Justice, Smith, 1992; Castle, Wunder, 1995). В разных группах млекопитающих формирование связи размеров тела и пищеварительного тракта реализуется по-разному в зависимости от таксономической принадлежности, экологических, физиологических и морфологических факторов (McArtur, 2014; Наумова и др., 2021). Маскирующее влияние этих факторов на размерные взаимодействия в наибольшей мере проявляется у мелких травоядов, способность которых питаться целлюлозосодержащими кормами не безусловна, но в ряде случаев реализуема.
На основании статистического анализа взаимодействий размеров тела, размеров и функций пищеварительного тракта у почти 100 видов фитофагов с большим диапазоном массы тела, сгруппированных по морфофизиологическим признакам, была установлена изометрическая связь размерных показателей тела и ПТ (Clauss et al., 2007). Ранее изометрическое соотношение размеров тела и ПТ было обнаружено на межвидовом уровне у отдельных групп млекопитающих (Demment, Van Soest, 1985; Illius, Gordon, 1992; Clauss, Нammel, 2005). Однако включение в исследование физиологических показателей, таких как потребление корма, уровень метаболизма, переваримость и длительность ферментации выявили их аллометрическую зависимость от размеров тела (Clauss et al., 2007, 2013; Muller et al., 2013; McArtur, 2014; Steuer et al., 2014). Полученные результаты привели исследователей к выводу, что увеличение размеров тела не дает фитофагам заметных преимуществ в усвоении бедных кормов.
Изометрическая зависимость между массой тела и объемом ПТ была зафиксирована и у ряда мелких млекопитающих-фитофагов, хотя неоднократно были отмечены внутривидовые вариации массы ПТ как ответ на качество диеты (Gross et al., 1985, Stevens, 1988; Hammond, Wunder, 1991; Foley, Cork, 1992; Pei et al., 2001a, 2001b). Все же эмпирических данных по структуре и размерам тела и органов пищеварения у мелких фитофагов, необходимых для детального количественного и функционального анализа, немного. Кроме того, данные разных авторов часто оказываются несопоставимыми ввиду использования разных приемов получения весовых характеристик (только содержимое в сухом, или сыром весе, сухая масса тканей ПТ, сырая масса ПТ в целом) у грызунов в условиях клеточного содержания на разных экспериментальных кормовых рационах. На данный момент условия подобных опытов и детали обработки материала не стандартизированы, тогда как однозначная интерпретация особенностей размерных взаимодействий у мелких млекопитающих может быть выполнена только на основании сопоставления родственных видов с разной массой тела, а не разрозненных данных по отдельным видам.
Мы предположили, что масса ПТ, освобожденного от содержимого, в большей степени скоординирована с массой тела, чем масса наполненного кормом пищеварительного тракта. В этом случае взвешивание интактных органов ПТ отразит характер взаимодействия уровня наполнения ПТ и массы тела.
Рассмотренное в работе сообщество песчанок, населяющих пустыню Негев – морфологически и экологически компактная группа мелких млекопитающих-фитофагов, удобная для рассмотрения взаимосвязи размеров тела и функций пищеварения и питания. Исследованные виды, обитающие в сходных условиях (Kam et al., 1997; Degen et al., 1998; Khokhlova et al., 2005), характеризуются разной пищевой специализацией, 10-кратным диапазоном размеров тела и однородной морфологией ПТ (Naumova et al., 2019). Последнее обстоятельство позволяет исключить из функционального анализа влияние структурных особенностей ПТ на соотношение размеров тела и ПТ у песчанок.
МАТЕРИАЛЫ И МЕТОДЫ
Получены весовые показатели пищеварительного тракта у следующих видов песчанок, населяющих пустыню Негев (Израиль): Psammomys obesus, Meriones crassus, Gerbillus pyramidum, Gerbillus allenbyi, Gerbillus dasyurus, Gerbillus henleyi. Материалом для работы послужили грызуны, содержавшиеся в лабораторных условиях на разных травах (по 24 взрослых особи P. obesus и M. crassus, и по 6 особей G. pyramidum и G. dasyurus), а также отловленные в природе (по 4–5 особей P. obesus, G. allenbyi, G. dasyurus, G. henleyi). P. obesus питается исключительно зелеными частями растений, и характеризуется высокой переваримостью волокнистых элементов растений (Degen et al., 2000). Остальные виды преимущественно семеноядных песчанок в природе также периодически употребляют в пищу травянистые корма. Кормовые рационы P. obesus (4 экспериментальных группы по 6 особей в каждой) состояли из зеленых частей следующих кормовых растений: Atriplex halimus, Sueda monoica, Anabasis articulata, Salsola tetrandra. Четыре группы M. crassus кормили теми же растениями, за исключением A. articulata, которая была заменена S. tetrandra в стадии раннего плодоношения (S. tetrandra 2). По шесть особей G. pyramidum и G. dasyurus содержали только на плодоносящей S. tetrandra.
Декапитацию большей части песчанок осуществляли в вечерние часы (19–20 ч). Это позволило оценить наполнение ПТ за время дневной активности грызунов. Для выяснения уровня наполнения ПТ в ночное время 6 особей M. сrassus анатомированы в 8 ч утра. Кроме того, были обследованы песчанки, отловленные в природе в утренние часы. Взвешивание производили с точностью до 0.01 г после вскрытия по завершении экспериментальной части работы (Naumova et al., 2019, 2021; Наумова и др., 2021). Массу сырого содержимого ПТ и отдельных органов определяли как разницу между массой наполненного и освобожденного от содержимого ПТ. У двух видов G. henleyi и G. allenbyi взвешивали только наполненный ПТ. Количественный анализ всех показателей выполняли относительно массы тела. Полученные данные были обработаны методами непараметрической статистики (Statistica 12).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
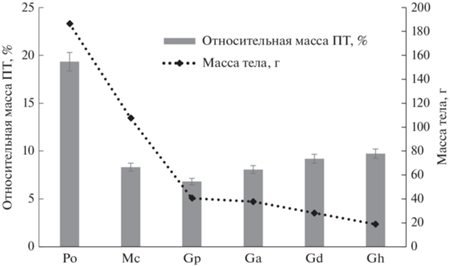
Масса тела и всего пищеварительного тракта. P. obesus – самый крупный вид из населяющих пустыню Негев грызунов и единственный зеленоядный представитель этого сообщества. Масса тела экспериментальных и отловленных животных в среднем составила 175 г. У самого мелкого вида – G. henleyi – средняя масса тела составила 18.8 г. Среди рассматриваемых видов наибольшая относительная масса всего желудочно-кишечного тракта (22%) была зафиксирована для P. оbesus, значительно меньшие показатели (6–9%) были получены для представителей родов Meriones и Gerbillus (рис. 1). У разных видов Gerbillus просматривается обратная зависимость между массами тела и всего пищеварительного тракта. Минимальные значения доли пищеварительного тракта в массе тела – 6% были отмечены для G. рyramidum, тогда как у самого мелкого вида G. henleyi это значение достигает почти 10%.
Рис. 1.
Относительная масса ПТ у песчанок. Po – P. obesus, Mc – M. crassus, Gp – G. pyramidum, Ga – G. allenbyi, Gd – G. dasyurus, Gh – G. henleyi.
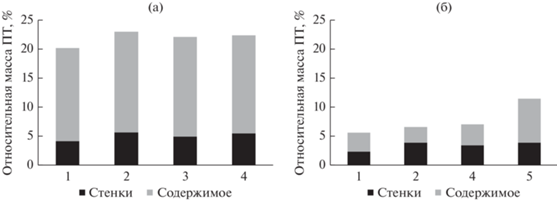
Содержание на разных кормовых объектах не отразилось существенно на массе пищеварительного тракта P. оbesus, но сказалось на весовых показателях у M. сrassus (рис. 2.) У P. obesus наблюдались незначительные колебания массы ПТ в пределах 20–23% при содержании на разных травах, причем заметна тенденция к увеличению массы всего ПТ при кормлении песчанок S. monoica. У M. сrassus эти колебания более существенны: при содержании животных на рационе, состоящем из S. tetrandra c незрелыми семенами, относительная масса ПТ увеличилась примерно вдвое по сравнению с особями, потреблявшими A. halimus (от 5.5 до 11.5%).
Рис. 2.
Относительная масса тканей и содержимого ПТ у P. obesus (а) и M. crassus (б) при содержании на разных кормах.
Относительная масса разных отделов ПТ. У мелких фитофагов основную функциональную нагрузку, связанную со спецификой питания, несут локусы ферментации – преджелудок, слепая кишка и ободочная спираль. Поэтому именно эти отделы, отвечающие за усвоение структурных углеводов с помощью микробных ферментов, можно считать наиболее показательными при рассмотрении взаимосвязи размеров тела и органов пищеварения.
Самая большая доля преджелудка в массе тела вполне ожидаемо оказалась у P. оbesus, как у исключительно зеленоядного вида (до 3.3%). У всех исследованных видов наблюдались значительные колебания этого признака, (табл. 1). Относительная масса всего желудка у P. obesus колебалась от 4.5 до 5.8%. У M. crassus масса всего желудка и отдельно преджелудка была существенно меньше, чем у P. оbesus и составила в среднем 2.3 и 1.4% соответственно. У песчанок рода Gerbillus масса желудка колебалась в районе 2%, причем максимальным (2.6%) это значение было отмечено для самого мелкого вида – G. henleyi, минимальным – для G. pyramidum (1.9%). В соответствии с этими показателями была и масса преджелудка.
Таблица 1.
Относительная масса отделов ПТ у песчанок при содержании на разных кормах
| Вид | Корм | Желудок | Преджелудок | Железистый желудок |
Тонкий кишечник | Слепая кишка |
Ободочная кишка |
|---|---|---|---|---|---|---|---|
| P. obesus | A. halimus | 5.6 ± 2.221 | 3.41 ± 1.809 | 2.19 ± 0.446 | 3.83 ± 1.096 | 6.4 ± 0.647 | 4.16 ± 0.344 |
| S. monoica | 5.7 ± 1.471 | 2.7 ± 1.55 | 3.01 ± 0.237 | 4.7 ± 0.72 | 8.25 ± 0.336 | 3.61 ± 0.572 | |
| A. articulata | 5.76 ± 1.133 | 3.03 ± 1.038 | 2.73 ± 0.336 | 4.66 ± 0.817 | 6.97 ± 1.371 | 4.42 ± 0.512 | |
| S. tetrandra | 5.37 ± 2.102 | 2.87 ± 1.838 | 2.5 ± 0.601 | 4.81 ± 0.98 | 7.32 ± 1.857 | 4.58 ± 0.867 | |
| P. obesus* | 4.5 ± 0.615 | 2.58 ± 0.37 | 1.91 ± 0.29 | 2.75 ± 0.237 | 6.02 ± 1.053 | 3.09 ± 0.232 | |
| M. crassus | A. halimus | 1.19 ± 0.2445 | 0.53 ± 0.156 | 0.66 ± 0.112 | 1.90 ± 0.366 | 1.32 ± 0.504 | 1.09 ± 0.38 |
| S. monoica | 1.3 ± 0.373 | 0.63 ± 0.248 | 0.67 ± 0.129 | 2.03 ± 0.401 | 1.85 ± 0.531 | 1.22 ± 0.131 | |
| S. tetrandra 1 | 1.39 ± 0.273 | 0.72 ± 0.177 | 0.67 ± 0.101 | 2.61 ± 0.463 | 1.48 ± 0.117 | 1.09 ± 0.239 | |
| S. tetrandra 2 | 2.52 ± 0.888 | 1.35 ± 0.534 | 1.16 ± 0.438 | 3.52 ± 0.772 | 3.64 ± 1.121 | 1.62 ± 0.313 | |
| M. crassus* | 3.04 ± 0.99 | 1.97 ± 0.822 | 1.07 ± 0.181 | 3.35 ± 0.476 | 1.51 ± 0.399 | 1.31 ± 0.313 | |
| G. dasyurus | S. tetrandra 2 | 1.6 ± 0.559 | 0.78 ± 0.305 | 0.81 ± 0.274 | 2.36 ± 0.686 | 1.96 ± 0.734 | 0.78 ± 0.203 |
| G. dasyurus* | 3.25 ± 1.157 | 2.22 ± 1.083 | 1.03 ± 0.089 | 3.88 ± 1.156 | 1.52 ± 0.599 | 1.01 ± 0.146 | |
| G. pyramidum | S. tetrandra 2 | 1.9 ± 0.442 | 0.97 ± 0.397 | 0.93 ± 0.144 | 2.58 ± 0.431 | 1.39 ± 0.272 | 0.65 ± 0.142 |
| G. allenbyi* | 2.16 ± 0.043 | 1.25 ± 0.049 | 0.91 ± 0.092 | 2.7 ± 0.164 | 1.47 ± 0.058 | 0.74 ± 0.16 | |
| G. henleyi* | 2.69 ± 0.834 | 3.05 ± 0.389 | 1.52 ± 0.249 | 0.89 ± 0.054 |
Масса тонкого кишечника также оказалась вариабельной. У P. оbesus она оказалась самой большой и колебалась при содержании на разных кормах от 3.8 до 4.8%; у M. crassus масса тонкого кишечника в среднем составила 2.9%. У песчанок рода Gerbillus максимальная масса тонкого кишечника была у G. dasyurus (3.1%). Наименьшая относительная масса тонкого кишечника была отмечена для G. pyramidum (2.6%).
Различия между видами по весовым показателям слепой кишки, являющейся у грызунов основным ферментативным органом, оказались более существенными. Самая большая по относительной массе слепая кишка (в среднем 6.6%) характерна для P. obesus, что соответствует статусу строго зеленоядного вида. Однако колебания массы слепой кишки в зависимости от кормового рациона очень значительны и создают разницу почти в 2% (от 6 у отловленных в природе до 8.2% потреблявших S. monoica). Очень большой диапазон колебаний относительной массы слепой кишки наблюдался у M. crassus. Максимальная масса этого органа оказалась почти втрое выше при содержании на S. tetrandra 2 (3.6%), чем при кормлении грызунов A. halimus (1.3%) и особей, отловленных в природе (1.5%). У песчанок рода Gerbillus масса слепой кишки колебалась от 1.4 до 2.0%.
У всех исследованных видов песчанок наблюдалась очень высокая вариабельность относительной массы ободочной кишки, главным образом за счет ее проксимальной части. По убыванию массы ободочной кишки исследованные виды располагаются в следующем порядке: P. obesus, M. сrassus, G. dasyurus, G. henlyi, G. allenbyi, G. pyramidum.
Относительная масса тканей ПТ. Вклад массы собственно тканей ПТ в массу наполненных кормом органов у разных видов песчанок неодинаков (табл. 2). У P. obesus масса стенок ПТ составляет около 5% массы тела. Значимой зависимости этого показателя от кормового рациона не наблюдается. Масса стенок отдельных органов также относительно постоянна при содержании на разных травах. Только при кормлении S. monoica отмечено увеличение массы тонкого кишечника и слепой кишки.
Таблица 2.
Относительная масса стенок отделов ПТ при содержании песчанок на разных кормах
| Вид | Корм | Желудок | Тонкий кишечник | Слепая кишка | Ободочная кишка |
|---|---|---|---|---|---|
| P. obesus | A. halimus | 0.71 ± 0.155 | 0.72 ± 0.216 | 0.92 ± 0.227 | 1.08 ± 0.173 |
| S. monoica | 0.84 ± 0.115 | 1.50 ± 0.199 | 1.33 ± 0.202 | 1.14 ± 0.093 | |
| A. articulata | 0.79 ± 0.05 | 0.80 ± 0.115 | 0.92 ± 0.164 | 1.16 ± 0.119 | |
| S. tetrandra 1 | 0.81 ± 0.181 | 1.07 ± 0.383 | 0.99 ± 0.341 | 1.35 ± 0.229 | |
| M. crassus | A. halimus | 0.54 ± 0.092 | 0.60 ± 0.179 | 0.28 ± 0.089 | 0.34 ± 0.094 |
| S. monoica | 0.70 ± 0.072 | 1.47 ± 0.323 | 0.45 ± 0.092 | 0.56 ± 0.093 | |
| S. tetrandra 1 | 0.59 ± 0.021 | 1.20 ± 0.344 | 0.44 ± 0.081 | 0.58 ± 0.159 | |
| S. tetrandra 2 | 0.81 ± 0.242 | 1.21 ± 0.251 | 0.49 ± 0.10 | 0.55 ± 0.114 | |
| G. dasyurus | S. tetrandra 2 | 0.66 ± 0.113 | 1.28 ± 0.381 | 0.51 ± 0.138 | 0.44 ± 0.108 |
| G. pyramidum | S. tetrandra 2 | 0.90 ± 0.310 | 1.29 ± 0.267 | 0.42 ± 0.043 | 0.46 ± 0.084 |
У M. сrassus относительная масса стенок всего ПТ заметно меньше (в среднем 3.4%), чем у P. оbesus, но вариабельность по этому показателю в зависимости от кормления несколько больше – от 2.2% массы тела при содержании на А. halimus, до 3.8% при содержании на S. monoica и S. tetrandra 2 (рис. 2). Эти различия возникают в основном за счет изменения массы тканей тонкого кишечника – от 0.7% при потреблении грызунами А. halimus почти до 1.7% при поедании S. monoica.
У G. pyramidum – наиболее крупного представителя рода Gerbillus (средняя масса тела 40 г), доля тканей ПТ достигает 4%, что составляет более половины всей массы заполненных кормом органов. При этом тонкий кишечник по массе стенок превышает как желудок, так и толстый отдел кишечника (слепую и ободочную кишки). Несколько меньший по размерам G. dasyurus имеет сходную с G. pyramidum относительную массу тканей отдельных органов ПТ.
Наполнение кормом ПТ. P. оbesus выделяется среди прочих песчанок высоким уровнем наполнения ПТ кормом, которое у этого вида достигает 15–16% (табл. 3). В самом вместительном органе ПТ – слепой кишке у P. оbesus содержится до одной трети всего содержимого, достигающей 7% массы тела (рис. 3). У остальных песчанок масса всего содержимого не достигает 5% массы тела, а органом, сопоставимым по вместительности со слепой кишкой, в некоторых случаях оказывается тонкий кишечник. Максимальное значение массы содержимого у M. сrassus составляет 7.6%, а у G. dasiurus 5.7%, G. pyramidum – около 3% массы тела. Наполнение ПТ у P. оbesus при питании разными травами оказалось сходным, а у M. сrassus различалось более чем вдвое при потреблении S. monoica и S. tetrandra 2. Неодинаковым было наполнение также у клеточных и свободно живущих зверьков.
Таблица 3.
Относительная масса содержимого ПТ песчанок при содержании на разных кормах
| Корм | P. obesus | M. crassus | G. dasyurus | G. pyramidum | |
|---|---|---|---|---|---|
| Экспериментальные корма | A.halimus | 16.03 ± 1.117 (12.69–20.86) |
3.32 ± 0.383 (2.42–4.70) |
||
| S. monoica | 17.35 ± 0.916 (16.2–21.0) |
2.67 ± 0.225 (1.99–3.32) |
|||
| A. articulata | 17.16 ± 0.892 (14.73–20.82) |
||||
| S. tetrandra 1 | 16.91 ± 1.611 (12.28–21.74) |
3.62 ± 0.308 (2.23–4.43) |
|||
| S. tetrandra 2 | 7.60 ± 0.993 (3.85–11.0) |
3.34 ± 0.660 (1.73–6.23) |
2.84 ± 0.347 (1.72–3.92) |
||
| Естественный корм | 11.80 ± 0.59 (10.43–13.47) |
5.62 ± 0.648 (3.85–8.19) |
5.65 ± 0.756 (3.79–7.13) |
||
| Среднее | 15.94 ± 0.601 (10.43–21.74) |
4.56 ± 0.410 (1.99–11.0) |
4.27 ± 0.60 (1.73–7.13) |
2.84 ± 0.347 (1.72–3.92) |
|
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При анализе органной композиции млекопитающих в зависимости от размеров тела оказалось, что в пределах класса не наблюдается пропорционального увеличения масс ПТ и тела: у животного массой 7 г доля желудка и кишечника составляет 10%, а у 6.6-тонного зверя она достигает лишь 4% (Calder, 1984). Эти данные были получены для ряда млекопитающих, масса тела которых различалась более чем в 900000 раз. Однако в пределах таксонов млекопитающих более низкого ранга было выявлено изометрическое изменение размеров ПТ относительно массы тела (Parra, 1978; Demment, 1982; Clauss et al., 2005).
Более детальное исследование показало, что у мелких фитофагов, таких как грызуны, наблюдаются иные зависимости во взаимосвязи размеров тела и органов ПТ. Так, в исследованном ряду 11 видов Muroidea, относящихся к 7 родам, не было обнаружено однозначной прямой связи между размерами тела и органов ПТ (Варшавский и др., 2017). Аллометрия наиболее четко проявилась при сравнении представителей более крупных таксонов – Murinae и Arvicolinae. Решающим фактором в этих случаях оказалась пищевая специализация и соответствующая ей структура ПТ. У зеленоядных полевок относительная масса ПТ достигала 30%, причем с преимуществом массы хорошо развитого и сложно организованного толстого отдела кишечника, тогда как у семеноядных мышей масса всего ПТ составила в среднем 17% с преобладанием массы желудка и тонкого отдела кишечника. При сравнении травоядных полевок, имеющих разные размеры тела, но сходные пищевую специализацию и стратегию пищеварения, просматривается изометрия масс слепой кишки и тела. Так, водяная и серые полевки близки по относительной массе слепой кишки (11.5 и 9%); при сравнении норвежского и лесного леммингов также проявляется изометрия размеров слепой кишки (2.2 и 2.3%) (Варшавский и др., 2017). Песчанки отличаются от полевок по размерным соотношениям тела и ПТ.
В ряду исследованных нами видов песчанок масса тела различается в 10 раз, а в ряду преимущественно семеноядных Meriones и Gerbillus – в 6 раз. В рассматриваемом ряду близких по питанию песчанок, масса тела которых находилась в диапазоне от 18 до 111 г, не выявлено линейной зависимости между массами тела, ПТ и его отдельными органами.
P. obesus выделяется из всех песчанок большой массой желудочно-кишечного тракта, достигающей около 20% массы тела, при этом масса желудка колеблется в диапазоне 4.5–6%, а масса слепой кишки достигает 8%. У исследованных видов родов Meriones и Gerbillus относительная масса пищеварительного тракта составляет около 10%; при этом относительная масса слепой кишки во всех случаях едва достигает 2%. У самого мелкого вида G. henleyi относительная масса ПТ оказалась выше, чем у M. crassus. То есть, в этой группе семеноядных видов изометрического изменения массы ПТ и тела не наблюдается: у M. crassus, потребляющих кроме семян и зеленые корма, ПТ имеет относительно меньшую массу, чем у мелких семеноядных G. henleyi, у которых с уменьшением массы тела заметна тенденция к увеличению относительной массы желудочно-кишечного тракта.
Если сравнить зеленоядные виды полевок и песчанок с близкими размерами тела, то очевидно, что доля ПТ в массе тела существенно больше у полевок – 30% против 20% у песчанок. У семеноядных песчанок относительная масса ПТ также меньше, чем у других грызунов с аналогичной пищевой специализацией (Варшавский и др., 2017). Среди песчанок рода Gerbillus наблюдается тенденция к отрицательной корреляции масс тела и ПТ.
Как влияет доля тканей в массе ПТ на оценку соотношения масс интактного ПТ и тела. Масса всего ПТ и его отдельных органов складывается из масс собственно стенок ПТ и содержимого. Чтобы правильно оценить уровень наполнения ПТ кормом важно проанализировать следующие показатели: массу тканей относительно массы заполненных кормом органов и тела. У песчанок при недостаточном заполнении ПТ кормом масса стенок достигает половины всей массы органов, в условиях насыщения кормом около четверти ее массы. То есть масса сырого содержимого существенно ниже значений, полученных взвешиванием всего ПТ, или его отдельных органов. Часто используемые данные, полученные путем расчета объема кишечника как трубы могут исказить реальные значения, особенно это касается мелких млекопитающих.
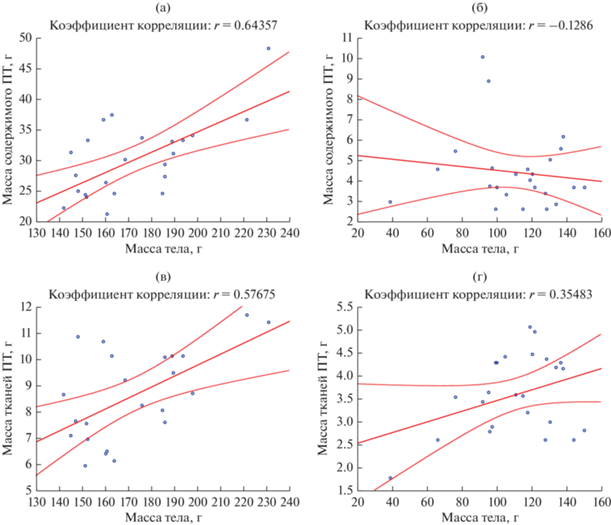
Соотношение масс содержимого и стенок ПТ неодинаково у исследованных песчанок (рис. 3). У более крупных песчанок P. оbesus и M. crassus наблюдается положительная корреляция массы тканей ПТ с размерами тела, в отличие от массы содержимого. Относительная масса тканей ПТ менее изменчива, чем наполненного пищеварительного тракта. Вариативность может быть обусловлена методической погрешностью – тщательностью освобождения полостей ПТ от содержимого. У трех видов семеноядных песчанок – M. crassus, G. pyramidum и G. dasiurus с разной массой тела (в среднем 108, 40 и 30 г соответственно) доля тканей ПТ находится в диапазоне 3.5–4% массы тела, то есть наблюдается изометрия между этими показателями. У P. оbesus относительная масса стенок пищеварительного тракта несколько больше и составляет около 5% массы тела. При условии незначительной изменчивости массы тканей ПТ показатели массы интактного ПТ отражают уровень наполнении отдельных органов и всего ПТ у разных видов.
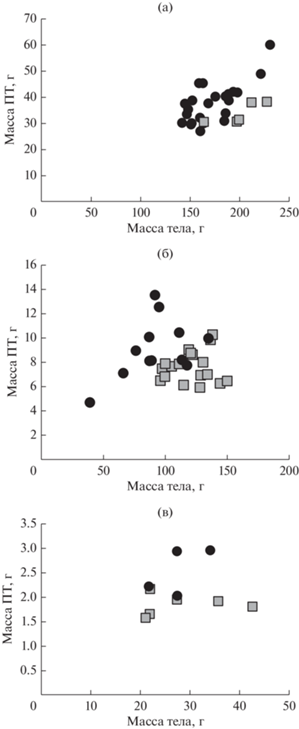
Влияние экологических и физиологических факторов. Масса тканей отдельных органов коррелирует со степенью развития слизистой оболочки. В желудке у всех видов преобладает масса правой железистой части, стенка которой заметно толще, чем в безжелезистом преджелудке. У крупных зеленоядных песчанок преобладающим по массе органом является слепая кишка. Масса тканей и содержимого этого органа у P. оbesus положительно коррелирует с размерами тела, тогда как у семеноядных песчанок (M. crassus) такой связи нет (рис. 4). У песчанок, относящихся к родам Meriones и Gerbillus, тонкий кишечник превосходит по массе остальные органы ПТ. Эти особенности в целом соответствуют пищевой специализации этих видов (Degen et al. 1997; Kam et al., 1997). Масса тканей ободочной спирали достигает значимых величин только у P. obesus, что обеспечено ее значительной длиной (она образует W-образную форму) и высокими косыми складками слизистой, заполняющими просвет кишки (Naumova et al., 2019). Эта часть ободочной кишки у всех исследованных песчанок редко была заполнена химусом в силу ее функциональных особенностей.
Рис. 4.
Корреляция: между массой содержимого слепой кишки и тела у P. obesus (а) и M. crassus (б); между массой тканей слепой кишки и тела in P. obesus (в) and M. crassus (г).
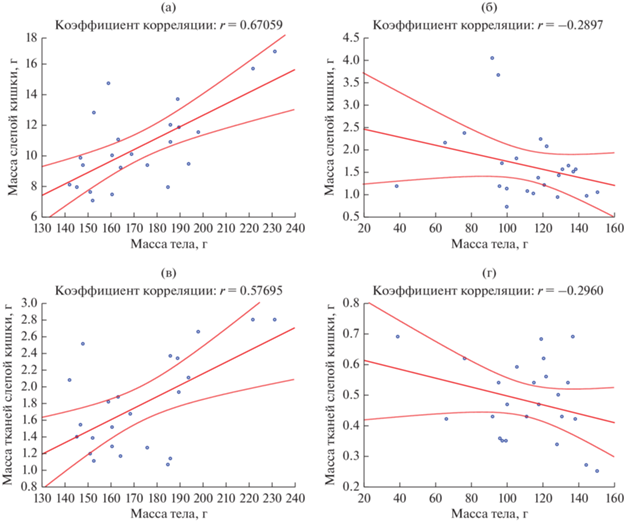
Потребление разных кормовых объектов у P. оbesus не отразилось существенно на относительной массе ПТ и слепой кишки. У этого вида наблюдались незначительные колебания массы пищеварительного тракта в пределах 20–23% при содержании на разных травах. С наибольшей охотой P. obesus поедали S. monoica и A. articulata, что отразилось, прежде всего на наполнении слепой кишки. Одновременно наблюдалась и выраженная в увеличении массы некоторая гипертрофия стенок кишечника, что возможно было связано с биохимической спецификой этих растений.
У M. crassus зарегистрирована четкая зависимость относительной массы желудочно-кишечного тракта от кормового рациона. Из предложенных трав M. crassus предпочитали S. tetrandra с завязями семян, что и отразилось на наполнении слепой кишки. Относительная масса слепой кишки у этого вида в среднем составила 3.6%, преджелудка – 1.4% массы тела. При потреблении песчанками вегетативных частей S. tetrandra с незрелыми семенами масса всего ПТ увеличилась вдвое, и почти в три раза возросла относительная масса слепой кишки. В проведенных нами экспериментах различия в наполнении ПТ в зависимости от состава кормового рациона у P. obesus составили около 2%, а у M. crassus 4% массы тела.
В действительности трудно ожидать четких зависимостей между размерами тела и ПТ у животных, у которых относительная масса ПТ может увеличиваться в два раза, как мы наблюдали у M. crassus в наших опытах и как это было показано ранее на примере полевок (Hammond, Wunder, 1991; Lee, Houston, 1993) и Meriones unguiculates (Pei et al., 2001a). Эти различия обусловлены в основном разным уровнем потребления предлагаемых растений, что отразилось на наполнении ПТ.
Различия в массе содержимого между экспериментальными и добытыми в природе зверьками мы рассматриваем как следствие различий в потреблении и качестве экспериментального рациона и естественных кормов, а также условий клеточного содержания и условий обитания в природе. При этом уровень наполнения ПТ у грызунов, анатомированных до начала или после кормовой активности, может отличаться более чем вдвое. Именно в лабильности вместительности ПТ у мелких грызунов заключается важнейшая адаптивная способность к изменению кормового рациона в связи с сезонной, или годовой сменой качества кормовой базы.
Анализ размерных соотношений ПТ и тела в группе грызунов со сходной морфологией ПТ позволил выявить влияние на эту взаимосвязь некоторых экологических и физиологических факторов. Существенные сезонные изменения массы тела, сопряженные со снижением уровня метаболизма у песчанок были показаны в ряде исследований в лабораторных и полевых условиях (Degen et al., 1998). Очевидно, масса ПТ у пустынных песчанок может закономерно изменяться и в природе от сезона к сезону в связи со сменой кормовой базы, а также уровнем метаболизма и его колебаниями. Самые заметные колебания размеров ПТ нами были отмечены для M. crassus: значительное увеличение массы ПТ, и особенно слепой кишки при содержании на S. tetrandra 2 по сравнению с животными, потреблявшими A. halimus. Причиной такого сильного увеличения массы ПТ послужило не только качество кормового рациона, но и кормовая активность. M. crassus – ночные грызуны, поэтому данные по наполнению, полученные в утреннее время в конце периода кормовой активности, заведомо должны быть выше, чем данные, полученные после периода покоя. По-видимому, результаты по мелким песчанкам, ведущим ночной образ жизни, полученные в вечернее время до начала кормовой активности, не отражают возможностей максимального наполнения кормом ПТ этих грызунов. Напротив, у ведущей дневной образ жизни P. obesus относительная масса ПТ, добытых в утренние часы меньше, чем у экспериментальных животных (рис. 5). У других ночных песчанок, добытых утром после насыщения кормом во время ночной активности, масса ПТ была больше, чем у экспериментальных грызунов.
Рис. 5.
Корреляция между массой наполненного кормом ПТ и тела в зависимости от кормовой активности. а – P. obesus; б – M. crassus; в – G. dasyurus. Светлые значки – до кормовой активности, темные значки – после кормовой активности.
Способность мелких грызунов к существенным вариациям объема ПТ неизбежно влечет за собой оптимизацию физиологии пищеварения, что неоднократно было продемонстрировано на разных грызунах. Прежде всего, это уровень потребления корма, скорость его прохождения по ПТ и переваримость, а также особенности бактериальной ферментации в преджелудке и слепой кишке (Lee, Houston, 1993; Penry, Jumars, 1986; Pei et al., 2001a, 2001b; Hume et al., 2002; Наумова и др., 1921).
ЗАКЛЮЧЕНИЕ
Для исследованных видов песчанок получены неоднозначные результаты по взаимодействию масс тела, ПТ и его наполнения кормом. При значительном, 10-кратном различии в массе тела исследованных 6 видов песчанок крайние значения относительной массы их ПТ различались примерно втрое. Линейная зависимость этих показателей была нарушена следующими факторами.
Первый из этих факторов вполне очевидный – пищевая специализация, которая в общих чертах соответствует весовым показателям органов ПТ и тела. Зеленоядный вид – P. obesus имеет самую большую массу ПТ, составляющую 20% массы тела. Семеноядные виды могут замещать семенные корма зелеными, увеличивая при этом массу ПТ за счет потребления объемного корма. Масса их ПТ не достигает значений, характерных для зеленоядных видов, но все же может увеличиваться значительно. И еще один фактор, который следует учитывать – это естественные суточные колебания наполнения ПТ, обусловленные кормовой активностью. Ночные грызуны, такие как M. crassus и Gerbillus, за время кормовой активности могут вдвое повысить относительную массу ПТ, что проблематично для крупных фитофагов с длительным периодом ферментации. У M. crassus по нашим наблюдениям, масса ПТ может колебаться от 4.3 до 14.7%, а масса слепой кишки от 0.9 до 4.8%. У других видов, в том числе и у P. obesus также заметны существенные колебания массы ПТ в зависимости от кормовой активности. По-видимому, эта особенность характерна для всех мелких фитофагов. Например, рыжая полевка (Myodes glareolus), по неопубликованным данным Т.Ю. Чистовой, только за одну фазу кормовой активности может поглотить около 2 г сырой массы зеленых частей растений, что заметно увеличивает массу ПТ.
И, наконец, масса собственно тканей ПТ, вариативность которой определяется не только методической погрешностью, но и физиологическим состоянием ПТ в момент добычи животного, может достигать половины всей массы ПТ. Все перечисленные факты иллюстрируют отсутствие прямой связи между размерами тела и ПТ у мелких растительноядных грызунов. В отличие от крупных млекопитающих-фитофагов, у которых изометрия между размерами ПТ и тела сохраняется в условиях диверсификации физиологических процессов, у грызунов размерные взаимодействия между этими показателями как правило, сопряжены, и отражают возможность смены кормового режима у отдельных видов. Эти взаимодействия затрагивают, прежде всего, вариабельность наполнения ПТ в зависимости от качества кормов, что определяет скорость прохождения корма и его переваримость, а также цикличность кормовой активности.
Авторы приносят глубокую благодарность израильским коллегам А. Дегену, М. Каму, И.С. Хохловой и Б.Р. Краснову за предоставленный материал и организацию работы.
Список литературы
Варшавский Ал.А., Наумова Е.И., Жарова Г.К., Чистова Т.Ю., Варшавский Ан.А. Взаимосвязь размеров тела и органов пищеварительного тракта у некоторых Myomorpha: изометрия, или аллометрия? // Изв. РАН. Сер. биол. 2017. № 4. С. 534–540.
Наумова Е.И., Чистoва Т.Ю., Варшавский А.А., Жарова Г.К. Функциональная диверсификация морфологически сходных органов пищеварительного тракта у представителей Muroidea // Изв. РАН. Сер биол. 2021. № 3. С. 270–279.
Bell R.H.V. A grazing ecosystem in the Serengeti // Sci. Amer. 1971. V. 225. № 1. P. 86–93.
Calder W.A. Size, Function, and Life History. Harvard University Press. Cambridge. MA. 1984. 431 p.
Castle K.T., Wunder B.A. Limits to food intake and fiber utilization in the prairie vole, Microtus ochrogaster: effects of food quality and energy need // J. Comparative Physiology B. 1995. V. 164. № 8. P. 609–617.
Clauss M., Hummel J. The digestive performance of mammalian herbivores: why big may not be that much better // Mammal Rev. 2005. V. 35. № 2. P. 174–187.
Clauss M., Schwarm A., Ortmann S., Streich W.J., Hummel J. A case of non-scaling in mammalian physiology? Body size, digestive capacity, food intake, and ingesta passage in mammalian herbivores // Comp. Biochem. Physiol. A. 2007. V. 148. № 2. P. 249–265.
Clauss M., Steuer P., Müller D.W.H, Codron D., Hummel J. Herbivory and body size: Allometries of diet quality and gastrointestinal physiology, and implications for herbivore ecology and dinosaur gigantism // PLoS ONE. 2013. V. 8(10): e68714.
Degen A.A., Khokhlova I.S., Kam M., Nagy K.A. Body size, granivory and seasonal dietary shifts in desert gerbilline rodents. Funct. Ecology. 1997. V. 11. P. 53–59.
Degen A.A., Kam M., Khokhlova I.S., Krasnov B.R., Barraclough T.G. Average daily metabolic rate of rodents: habitat and dietary comparisons // Funct. Ecol. 1998.V. 12. P. 63–73.
Degen A.A., Kam M., Khokhlova I.S. Fiber digestion and energy utilization of fat sand rats (Psammomys obesus) consuming the chenopod Anabasis articulate // Physiol. Biochem. Zool. 2000. V. 73. № 5. P. 574–580.
Demment M.W. The scaling of ruminoreticulum size with body weight in East African ungulates // Afr. J. Ecol. 1982. V. 20. № 1. P. 43–47.
Demment M.W., Van Soest P.J. A nutritional explanation for body-size patterns of ruminant and nonruminant herbivores // Amer. Natur. 1985. V. 125. № 5. P. 641–672.
Foley W.J., Cork S.G. Use of fibrous diets by small herbivores: how far the rule be “bent”? // Trends Ecol. Evol. 1992. V. 7. № 5. P. 159–162.
Gross J.E., Wang Z., Wunder B.A. Effect of food quality and energy needs: changes in gut morphology and capacity of Microtus ochrogaster // J. Mammal. 1985. V. 66. P. 661–667.
Hammond K.A., Wunder B.A. The role of diet quality and energy need in the nutritional ecology of a small herbivore, Microtus ochrogaster // Physiol. Zool. 1991. V. 64. P. 541–567.
Hume I.D. Digestive strategies of mammals // Acta Zoologica Sinica. 2002. V. 48. № 1. P. 1–19.
Hofmann R.R. Evolutionary steps ecophysiological adaptation and diversification of ruminants: a comparative view of their digestive system // Oecologia. 1989. V. 78. P. 443–457.
Janis C. The evolutionary strategy of the Equidae and the origins of rumen and caecal digestion. // Evolution. 1976. V. 30. № 4. P. 757–774.
Jarman P.J. The social organisation of antelope in relation to their ecology // Behaviour. 1974. V. 48. № 1. P. 215–267.
Justice K.E., Smith F.A. A model a dietary fiber utilization by small mam malian herbivores, with empirical results for Neotoma // The Amer. Naturalist. 1992. V. 139. № 2. P. 398–416.
Kam M., Khokhlova I.S., Degen A. Granivory and plant selection by desert gerbils of different body size // Ecology. 1997. V. 78. № 7. P. 22–29.
Khokhlova I.S., Krasnov B.R., Kuznetsov V., Sartor C.E., Zan M., Salek L., Ghazaryan L., Kam M., Degen A.A. Dietary intake and time budget in two desert rodents: a diurnal herbivore, Psammomys obesus, and a nocturnal granivore, Meriones crassus // Mammalia. 2005. V. 69. № 1. P. 1–11.
Kleiber M. The Fire of Life: An Introduction to Animal Energetics. N.Y. Wiley. 1961. 454 p.
Langer P. The digestive tract and life history of small mammals // Mammal Rev. 2002. V. 32. № 2 P. 107–131.
Lee W.B., Houston D.C. The effect of diet quality on gut anatomy in British voles (Microtinae) // J. Comp. Physiol. B. 1993. V. 163. P. 337–339.
McArthur C. Do we ditch digestive physiology in explaining the classic relationship between herbivore body size diet and diet quality? // Funct. Ecol. 2014. V. 28. № 5. P. 1059–1060.
Muller D.W., Codron D., Meloro C., Munn A., Schwarm A., Hummel J., Clauss M. Assessing the Jarman–Bell principle: scaling of intake, digestibility, retention time and gut fill with body mass in mammalian Herbivores // Comp. Biochem. Physiol. A. 2013. V. 164. № 1. P. 129–140.
Naumova E.I., Chistova T.Yu., Zharova G.K., Kam M., Khokhlova I.S., Krasnov B.R., Degen A.A. Energy requirements, length of digestive tract compartments and body mass in six gerbilline rodents of the Negev Desert // Zoology. 2019. V. 137. P. 1–8.
Naumova E.I., Chistova T.Yu., Zharova G.K., Kam M., Khokhlova I.S., Krasnov B.R., Clauss M., Degen A.A. Particle size reduction along the digestive tract of fat sand rats (Psammomys obesus) fed four chenopods // J. Comp. Physiol. B. 2021. V. 191. P. 831–841.
Parra R. Comparison of foregut and hindgut fermentation in herbivores. In: Montgomery, G.G (Ed.). The ecology of Aboreal Folivores. Smithsonian Institution Press. Washington DC. 1978. P. 205–229.
Pei Y.-X., Wang D.-H., Hume I. Effect of Dietary Fibre on Digesta Passage, Nutrient Digestibility and Gastrointestinal Morphology in the Granivorous Mongolian Gerbil (Meriones unguiculates) // Physiol. Biochem Zoology. 2001a. V. 74. № 5. P. 742–749.
Pei Y.-X., Wang D.-H., Hume I. Selective digesta retention and coprophagy in Brandt’s vole (Microtus brandti) // J. Comp. Physiol. B. 2001b. V. 171. P. 457–464.
Penry D.L., Jumars D.A. Chemical reactor analysis and optimal digestion // Bioscience. 1986. V. 36. P. 310–315.
Stevens C.E. Comparative physiology of the vertebrate digestive system. Cambridge: Cambr. Univ. Press. 1988. 300 p.
Steuer P., Sudekum K.-H., Tutken T., Muller D.W.H., Kaandorp J., Bucher M., Clauss M., Hummel J. Does body mass convey a digestive advantage for large herbivores? // Funct. Ecol. 2014. V. 28. № 5. P. 1127–1134.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая