Известия РАН. Серия биологическая, 2023, № 3, стр. 332-336
Кутикула куколок черной львинки Hermetia illucens как биосорбент для пробиотиков
Н. А. Ушакова 1, *, С. В. Свергузова 2, И. Г. Шайхиев 2, Ж. А. Сапронова 2, А. И. Бастраков 1, Е. А. Левенко 1, Р. М. Хацаева 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр., 33, Россия
2 Белгородский технологический университет им. В.Г. Шухова
308012 г. Белгород, ул. Костюкова, 46, Россия
* E-mail: naushakova@gmail.com
Поступила в редакцию 11.11.2022
После доработки 15.12.2022
Принята к публикации 19.12.2022
- EDN: MOPXXE
- DOI: 10.31857/S1026347022601072
Аннотация
С помощью метода сканирующей электронной микроскопии проведено сравнительное исследование морфологии поверхности частиц и элементного состава кутикулы куколки Hermetia illucens до и после нанесения культуральной жидкости (КЖ) пробиотического штамма Lactobacillus acidophilus В 2707. Показано, что после щадящего высушивания сорбированные клетки лактобацилл сохраняются под пленкой на носителе. При этом под воздействием КЖ наблюдается деструкция относительно крупных частиц порошка хитин-белкового комплекса кутикулы (средний диаметр частиц D 845.3 ± ± 109.1 мкм) и образование мелких фрагментов (средний D 63.4 ± 13.9 мкм), в том числе, наночастиц (средний D 54 ± 18 нм). Получена обогащенная кальцием, магнием и фосфором биопленка лактобактерий на сорбенте, состоящем из микрочастиц кутикулы куколок насекомого, и включающем наночастицы, что обеспечило пробиотическому препарату высокую биологическую эффективность.
Хитин мухи черная львинка Hermetia illucens привлекает внимание исследователей в связи с возможностью промышленного разведения насекомого и получения возобновляемого сырья, обладающего биологической активностью. Жизненный цикл мухи включает стадию куколки, из которой вылупляется имаго. После вылета взрослой мухи остаются пустые пупарии, представляющие собой хитин-содержащий экзувий. Хитин является основой экзоскелета членистоногих, обеспечивает жесткость и структурную целостность; выделенный в чистом виде хитин характеризуется также иммуномодулирующими, противомикробными, противогрибковыми и сорбционными свойствами (Скрябин и др., 2002; Lenardon et al., 2010; Варламов и др., 2020).
В организме насекомых хитин присутствует в комплексе с белками (Henriques et al., 2020) и его содержание варьирует от 0.27% у пчелиного расплода, до 5% у мучных червей (Finke, 2013). По литературным данным личинки черной львинки 5-го возраста содержат от 4.5% (Caruso et al., 2014) до 8.7% хитина (Diener et al., 2009). После вылета мухи кутикула, содержащая хитин, может быть использована как биосорбент, в том числе и как сорбент для получения препаратов пробиотических бактерий, усиливающий их выживаемость в кишечном тракте и пробиотическую эффективность.
Цель исследования – изучение поверхности кутикулы куколки H. illucens до и после нанесения суспензии молочнокислых пробиотиков, щадящего высушивания и измельчения.
МАТЕРИАЛЫ И МЕТОДЫ
Препарат биомассы кутикул куколок после вылета мух H. illucens получен при содержании личинок насекомого на комбикорме ПК-3 Раменского комбината хлебопродуктов, Россия. Кутикулу измельчали растиранием в фарфоровой ступке и стерилизовали термически в сухожарном шкафу при 160°С 2 ч.
Согласно приведенному в паспорте ВКПМ описанию, штамм пробиотических бактерий Lactobacillus acidophilus В 2707 выращивали сутки на стерильном обезжиренном молоке, затем смешивали со стерильным порошком кутикулы в соотношении 1 : 2, вес/объем. Высушивали при 45°С в течение 12 ч и измельчали растиранием в фарфоровой ступке.
Сканирующую электронную микроскопию осуществляли на микроскопе TESCAN MIRA 3 LMH (TESCAN, Czech Republic). Препараты в виде порошка наносили на поверхность двустороннего проводящего скотча для микроскопии Supplies (США), наклеенного на предметный столик. Напыление осуществляли золотом на установке Q150R ES Plus (Quorum Technologies Ltd, Соединенное Королевство). Оценку элементного состава и размеры частиц определяли с использованием системы энергодисперсионного анализа Oxford AZtecOne X-act (Oxford Instruments, UK) – программного обеспечения к микроскопу TESCAN MIRA 3 LMH (TESCAN, Czech Republic) при ускоряющем напряжении 10 квт и количестве накопленных импульсов 5 млн. Количественные расчеты осуществлялись автоматически программой AZtecOne Quant. Статистические различия оценивали с помощью однофакторного дисперсионного анализа в программе Statistica 10 (Anova). Для первичной обработки данных и построения диаграмм использовали Microsoft Excel 2019.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ.
Возможность получения сорбированного на носителе пробиотика во многом определяется структурной организацией сорбента. Электронные фотографии частиц интактной кутикулы куколок H. illucens демонстрировали упорядоченную структуру повторяющихся шестиугольных единиц (рис. 1а, 1б), поверхность и пространство между которыми в процессе получения пробиотика на носителе заполнены культуральной жидкостью, что видно на рис. 1 в по изменению рельефа поверхности сорбента. При высушивании частиц кутикулы с иммобилизованным пробиотиком, образовалась пленка, покрывающая клетки микроорганизмов, которая, по-видимому, выполняет функцию защиты лактобактерий, так как они сохранили свою бациллярную морфологию, не сморщены и не сплющены (рис. 1г).
Рис. 1.
Поверхность шестиугольных единиц кутикулы куколок H. illucens: а – увеличение 1480×; б – 3840×; в – частицы кутикулы с нанесенной культуральной жидкостью лактобациллы, 1310×; г – лактобациллы (отмечено стрелками) под пленкой на поверхности носителя, 24600×.

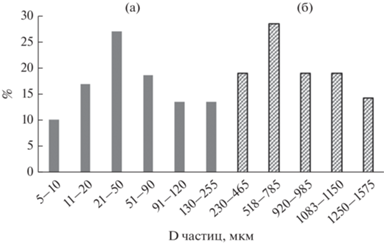
Значительные изменения в структуре частиц интактной измельченной кутикулы наблюдались при медленном 12-часовом режиме высушивания порошка сорбента с иммобилизованным пробиотиком без применения высоких температур (45°С). За этот период, вероятно, относительно крупные частицы кутикулы (рис. 2а) подверглись ферментативному гидролизу культуральной жидкостью с лактобациллой, что привело к деструкции склеротинизированного хитин-белкового комплекса и проявилось в образовании мелких частиц (рис. 2б), включая образование наночастиц (рис. 2в). Средний диаметр частиц порошка измельченной кутикулы куколок составил D 845.3 ± 109.1 мкм, в то время как средние размеры частиц кутикулы с пробиотиком были достоверно меньше, D 63.4 ± ± 13.9 мкм (F = 276.1; P ≤ 0.001), и не превышали D 255 мкм. Распределение размерных фракций частиц в % (без учета наночастиц) приведено на рис. 3. Средний размер наночастиц составил D 54 ± ± 18 нм.
Рис. 2.
Фото частиц измельченной кутикулы куколок H. illucens: а – частицы интактной кутикулы, увеличение 53×; б – высушенные частицы с пробиотиком, 311×; в – наночастицы кутикулы, 109 000×. Отрезками на фото 2 б и 2 в отмечены максимальные диаметры (D) частиц, которые учитывали при анализе размерных фракций.

Рис. 3.
Распределение размерных фракций частиц, %: а – препарат пробиотик на частицах кутикулы; б – измельченная интактная кутикула.
Процентный состав основных элементов кутикулы куколок H. illucens представлен в табл. 1.
Таблица 1.
Элементный состав порошка кутикулы куколок H. illucens и комплекса кутикулы с культуральной жидкостью L. acidophilus В 2707
| Кутикула | Кутикула с пробиотиком | |||||
|---|---|---|---|---|---|---|
| Элемент | % | σ | С/N | % | σ | С/N |
| C | 61.53 | 0.16 | 8.7 | 68.24 | 0.29 | 52.5 |
| N | 7.08 | 0.23 | 1.30 | 0.40 | ||
| O | 28.02 | 0.09 | 26.74 | 0.15 | ||
| Na | 0.09 | 0.01 | 0.41 | 0.01 | ||
| Mg | 0.38 | 0.01 | 0.24 | 0.01 | ||
| P | 0.71 | 0.01 | 0.51 | 0.03 | ||
| K | 0.66 | 0.01 | 0.66 | 0.02 | ||
| Ca | 1.53 | 0.02 | 1.90 | 0.03 | ||
| Всего | 100.00 | 100.00 | ||||
Элементный состав комплекса кутикулы куколок H. illucens с внесенной культуральной жидкостью с L. acidophilus В 2707 показал отличия от исходной кутикулы не в качественном отношении, а в количественном соотношении элементов. В 6 раз увеличилась величина С/N за счет снижения доли азота, что коррелирует с предположением о расщеплении хитин-белкового комплекса кутикулы и выявленном уменьшении размеров частиц сорбента. Повысилась доля натрия и несколько повысилось содержание кальция, а магния и фосфора уменьшилось, по-видимому, за счет химического состава нанесенной на кутикулу органики и перераспределения удельного содержания компонентов.
Пробиотик, иммобилизованный на сорбенте из микрочастиц кутикулы куколок H. illucens, был протестирован в рационе цыплят. Исследования проводились в условиях СГЦ “Загорское ЭПХ” на бройлерах кросса “Росс 309” в клеточных батареях типа Р-15, по 35 голов в каждой группе, с суточного до 35 – суточного возраста выращивания. Нормы посадки, световой, температурный, влажностный режимы, фронт кормления и поения соответствовали рекомендациям ФНЦ ВНИТИП РАН (Фисинин, Егоров, 2018) и для всех групп были одинаковыми. Включение препарата в дозе 0.5 г/т комбикорма повысило прирост живой массы цыплят в конце опыта на 5.7% по сравнению с бройлерами контрольной группы, и обеспечило высокую сохранность птицы. При этом затраты корма на 1 кг прироста живой массы в опытной группе за период выращивания снизились на 3.5% за счет повышения переваримости и использования питательных веществ корма, что может быть связано с активностью пробиотика.
Таким образом, получена обогащенная кальцием, магнием и фосфором биопленка лактобактерий L. acidophilus В 2707 на сорбенте, состоящем из микро частиц кутикулы куколок черной львинки H. illucens, включая наночастицы, что позволило получить пробиотический препарат с высокой биологической эффективностью.
Работа выполнена в рамках реализации федеральной программы поддержки университетов “Приоритет 2030”.
Список литературы
Варламов В.П., Ильина А.В., Шагдарова Б.Ц., Луньков А.П., Мысякина И.С. Хитин/хитозан и его производные: фундаментальные и прикладные аспекты // Успехи биол. Хим. 2020. Т. 60. С. 317–368.
Скрябин К.Г., Вихорева Г.А., Варламов В.П. Хитин и хитозан: Получение, свойства и применение. М.: Наука, 2002. 368 с.
Фисинин В.И., Егоров И.А. Руководство по кормлению сельскохозяйственной птицы. Сергиев Посад: ООО “Лика”, 2018. 226 с
Caruso D., Devic E., Subamia IW., Talamond P., Baras E. Technical handbook of domestication and production of diptera Black Soldier Fly (BSF) Hermetia illucens, Stratiomyidae / IRD Editions IPB Press 2014. 141 p. ISBN: 978–979-493-610-8.
Diener S., Zurbrügg C., Tockner K. Conversion of organic material by black soldier fly larvae: establishing optimal feeding rates // Waste Management & Research. 2009. T. 27. № 6. C. 603–610.
Finke M.D. Complete nutrient content of four species of feeder insects // Zoo Biol. 2013. V. 32. № 1. P. 27–36. https://doi.org/10.1002/zoo.21012
Henriques B.S., Garcia E.S., Azambuja P., Ariel F.G. Determination of Chitin Content in Insects: An Alternate Method Based on Calcofluor Staining //Methods article Front. Physiol., Sec. Invertebrate Physiology, 2020. https://doi.org/10.3389/fphys.2020.00117
Lenardon M.D., Munro C.A., Gow N.A. Chitin synthesis and fungal pathogenesis //Current Opinion in Microbiology. 2010. V. 13. P. 416–423.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


