Известия РАН. Серия биологическая, 2023, № 3, стр. 246-257
Множественный хромосомный полиморфизм у мышовок группы subtilis (Rodentia, Dipodoidea, Sicista sp.) из Саратовского Правобережья
М. И. Баскевич 1, *, М. Л. Опарин 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: mbaskevich@mail.ru
Поступила в редакцию 16.04.2022
После доработки 16.09.2022
Принята к публикации 16.09.2022
- EDN: GZXQLR
- DOI: 10.31857/S1026347022700020
Аннотация
На основе цитогенетического анализа (рутинная, G-, C-и AgNOR окраски хромосом) приведены новые данные по хромосомному полиморфизму в выборке (n = 13) из популяции Sicista sp. 1, вида-двойника мышовок группы subtilis из Саратовского Правобережья. Показано, что в исследованной полиморфной популяции из северной части ареала вида (Воскресенский р-н Саратовской обл.) число хромосом в кариотипах варьирует от 2n = 22 до 2n = 24, число плеч аутосом от NFa = 39 до NFa = 44; всего обнаружено 6 вариантов кариотипа: с 2n = 24, NFa = 44; 2n = 24, NFa = 43; 2n = 23, NFa = 40; 2n = 23, NFa = 41; 2n = 22, NFa = 39; 2n = 22, NFa = 40. С помощью G-окраски хромосом показано, что обнаруженный внутрипопуляционный хромосомный полиморфизм у Sicista sp. 1 обусловлен наличием двух типов перестроек: тандемная транслокация, вовлекающая двуплечие аутосомы №№ 4 и 10 и перицентрическая инверсия в паре аутосом № 6. Выявлено устойчивое преимущество гетерозигот по обеим структурным хромосомным мутациям, а обнаруженный хромосомный полиморфизм характеризуется как сбалансированный или гетерозиготный. Обсуждается потенциальная роль выявленного хромосомного полиморфизма в хромосомной эволюции и адаптивной стратегии вида.
Принято считать, что у млекопитающих кариотип является видовым признаком (Воронцов, 1958; Matthey, 1970; Орлов, 1974). Однако по мере накопления данных по кариологии этого класса позвоночных животных, стало очевидным, что это утверждение небесспорно. Так, к середине 1980-х гг., было известно о 4% кариологически полиморфных видов среди 1500 изученных (Тимофеев-Ресовский и др., 1977), а позднее к концу 1990-х гг. уже у 150 видов среди более чем 2100 кариологически исследованных видов млекопитающих был выявлен хромосомный полиморфизм, что составило величину порядка 7% (Раджабли, Графодатский, 1977; Орлов, Булатова, 1983; Иваницкая, 1990). В дальнейшем, главным образом, за счет представителей отряда Rodentia, число известных кариологически полиморфных видов млекопитающих возросло, а представления о степени хромосомной изменчивости у ранее изученных видов дополнены новыми сведениями (Ахвердян и др., 1999; Анискин и др., 2003; Huang et al., 2006; Kartavtseva et al., 2008; Баскевич и др., 2008; Romanenko et al., 2019; Galindo et al., 2021; Картавцева и др., 2021; и др.). При этом у большинства кариологически полиморфных видов был выявлен и продолжает активно изучаться определенный тип хромосомных перестроек. Например, для обыкновенной бурозубки Sorex araneus характерен распространенный по всему ареалу вида Робертсоновский (Rb) полиморфизм (Щипанов, Павлова, 2016 и др.), у слепушонки Ellobius tancrei хромосомная изменчивость также связана с Rb полиморфизмом (Ляпунова и др., 1990; Baklushinskaya, Lyapunova, 1995; и др.). А например, хромосомный полиморфизм у африканской многососковой крысы Mastomys erythroleucus (Dobigny et al., 2010) или же в ряде популяций с Кавказа (Ахвердян и др., 1999) и Русской равнины (Баскевич и др., 2008) алтайской полевки Microtus obscurus, или в некоторых популяциях степной мышовки Sicista subtilis s. str. (Kovalskaya et al., 2011) связан с перицентрическими инверсиями. Полиморфизм по редким тандемным транслокациям, как правило, не в гетерозиготном состоянии, отмечен в природных популяциях млекопитающих рр. Ctenomys, Taterillus, Sicista, Uroderma, Muntiacus, Mazama (см. Dobigny et al., 2017; Galindo et al., 2021). В целом, имеющаяся по внутрипопуляционному хромосомному полиморфизму информация пока немногочисленна и противоречива (Орлов, Булатова. 1983; Иваницкая, 1990; Гилева, 1990; Zima, 2000; Dobigny et al., 2017), и некоторые вопросы в изучении этого явления, поставленные в ряде аналитических обзоров (Иваницкая, 1990; Гилева, 1990; Баклушинская, 2016; Dobigny et al., 2017; Martinez et al., 2017; Damas et al., 2021), по-прежнему ждут решения.Так, до сих пор остается открытым вопрос, почему в группах близкородственных видов млекопитающих одни виды имеют полиморфные кариотипы, тогда как у других – хромосомные наборы характеризуются мономорфизмом; не ясно, связаны ли системы внутривидовой хромосомной изменчивости с видообразованием или же с адаптивной стратегией видов, а главное, каковы причины возникновения и поддержания внутрипопуляционного хромосомного полиморфизма в популяциях млекопитающих. В отношении ответа на последний вопрос существует несколько гипотез. Так, предполагается, что хромосомный полиморфизм в каждом конкретном случае обусловлен разными причинами и имеет свою историю. Высказывалась точка зрения о хромосомном полиморфизме как возможном пути симпатрического видообразования (Matthey, 1970). Предложенные позднее гипотезы: историческая (=филогенетическая), расселения (=преадаптивная), как правило, основывались на аллопатрическом формообразовании, и скорее, имели отношение к межпопуляционной хромосомной изменчивости, чем к внутрипопуляционному хромосомному полиморфизму (Загороднюк, 1991). Предполагалось также адаптивное значение для тех хромосомных перестроек (например, изменчивость по числу добавочных хромосом), которые не играют существенной роли в становлении изолирующих механизмов, поддерживая генетическое разнообразие в популяциях (Волобуев, 1981; Борисов, 2008; и др.). Адаптивное значение хромосомного полиморфизма по перестройкам, затрагивающим изменение положения генов: в частности, перицентрические инверсии (ПИ)), доказанное, в частности, для двукрылых насекомых (Dobzhansky, 1948; Ayala et al., 2017), постулируется и для млекопитающих (Орлов, 1974). Сложнее обстоит дело с хромосомными перестройками, затрагивающими изменение числа хромосом: Rb (Робертсоновские), ТТ (тандемные транслокации), а также по количественным изменениям в хромосомах (делеции – дупликации) (Орлов, 1974). Следует упомянуть, что адаптивность хромосомного полиморфизма рассматривается в рамках популяционно-генетической гипотезы и не противоречит таковой мутационной (Загороднюк, 1991). Что касается попыток получить уточняющие ответы на два других, выше упомянутых вопроса: о связи систем внутрипопуляционного хромосомного полиморфизма с хромосомной эволюцией и предполагаемых причинах существования полиморфных и мономорфных видов в группах близко родственных видов, очевидно, что особый интерес в этой связи представляет анализ внутрипопуляционного хромосомного полиморфизма в достаточно хорошо изученных в плане хромосомной дифференциации и филогении группах млекопитающих. Примером такой группы могут служить обитатели степных и пустынных ландшафтов Северной Палеарктики Sicista группы subtilis (= Sicista subtilis s. l.).
В ходе цитогенетического изучения политипического вида Sicista subtilis s. l. (= мышовки группы subtilis), представленной, как было принято считать в общепринятых таксономических сводках (Павлинов, 2003; Holden, Musser, 2005) двумя кариологически дискретными видами: S. subtilis s. str. и S. severtzovi, было обнаружено, что вариабельность кариотипа только по числу и морфологии хромосом у мышовок группы subtilis в значительной степени превосходит таковую у других представителей рода: число хромосом в группе колеблется от 2n = 16 до 2n = 26, а число плеч хромосом от NF = 28 до NF = 48 (Баскевич, 2016). Использование методов дифференциальной окраски хромосом для представителей группы до последнего времени носило фрагментарный характер, позволяя уточнять лишь механизм хромосомных перестроек в кариотипах некоторых форм (Анискин и др., 2003; Баскевич и др., 2010; 2011). Однако последние хромосомные исследования мышовок группы sibtilis на территории юго-восточной части Русской равнины в бассейне Среднего Дона с привлечением сравнительной G-окраски хромосом и филогенетического анализа матрицы хромосомных данных привели к обнаружению пяти в значительной степени дивергировавших хромосомных форм мышовок группы subtilis: S. subtilis s. str. (2n = 24, NF = 40–46), S. severtzovi (2n = 26, NF = = 48), Sicista sp. 1 (2n = 22–26, NF = 41–46), Sicista sp. 2 (2n = 16–22, NF = 28–31), S. nordmanni (2n = 26, NF = 48) (Kovalskaya et al., 2011). Все обнаруженные на Среднем Дону хромосомные формы мышовок группы subtilis аллопатричны, за исключением S. subtilis s. str. и Sicista sp. 1, чьи ареалы перекрываются в Правобережье Волгоградской обл. при отсутствии гибридизации в зоне контакта (Kovalskaya et al., 2011). Этими же исследователями было показано, что кариотипы (G-banding) обнаруженных на Среднем Дону, видов мышовок группы subtilis (в т. ч. предполагаемых) отличаются друг от друга 10-29 структурными перестройками: робертсоновскими транслокациями (Rb), перицентрическими инверсиями (ПИ) и в меньшей степени тандемными транслокациями (ТТ). Таксономическая ревизия, основанная, преимущественно, на сравнительной кариологии пока не завершена, и найдены ее некоторые противоречия с молекулярными реконструкциями группы (Русин и др., 2015; Lebedev et al., 2019). В любом случае, полученные авторами этой интересной цитогенетической работы данные по межвидовой хромосомной дифференциации у степных мышовок могут быть использованы в ходе анализа внутрипопуляционного хромосомного полиморфизма у представителей группы.
В задачу настоящего исследования входил анализ внутрипопуляционного хромосомного полиморфизма у представителя Sicista группы subtilis из Саратовского Правобережья, относящегося в соответствии с современными взглядами к Sicista sp. 1.
МАТЕРИАЛЫ И МЕТОДЫ
В работе проанализировано 13 особей мышовок группы subtilis (= Sicista sp. 1) из Правобережья Саратовской области, (7 км к северу от с. Славянка Воскресенского р-на), отловленных в 2006 (n = 2), 2008 (n = 6), 2009 (n = 1) и 2011 (n = 4) годах.
Препараты метафазных хромосом получали из клеток костного мозга по общепринятой методике воздушно-высушенных препаратов с предварительным колхицинированием живых зверьков (Ford, Hamerton, 1956). Для получения G-исчерченных хромосом использовали метод Сибрайт (Seabright, 1971). Структурный гетерохроматин выявляли c помощью метода С-окраски хромосом (Sumner, 1972), а ядрышкообразующие районы – с использованием одной из последних методик серебрения (Howell, Black, 1980).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Цитогенетический анализ выборки Sicista sp. 1 показал наличие 6 вариантов кариотипа: с 2n = 24, NFa = 44; 2n = 24, NFa = 43; 2n = 22, NFa = 39; 2n = = 22, NFa = 40; 2n = 23, NFa = 40; 2n = 23, NFa = 41, различающиеся как числом хромосом, так и морфологией некоторых пар аутосом (табл. 1). При этом половые хромосомы во всех кариотипических вариантах были одинаковы: Х-хромосома – мелкий акроцентрик, Y-хромосома – мельчайший акроцентрический элемент набора (рис. 1, рис. 2, табл. 1). В первом варианте (2n = 24, NFa = 44) все аутосомы (11 пар), за исключением половых хромосом, представлены убывающими по величине двуплечими (субмета-, метацентрическими) элементами (все пары аутосом пронумерованы; рис. 1а). Такой хромосомный набор обнаружен у одного самца (табл. 1). Второй вариант (2n = 24, NFa = 43) отличается от первого только гетероморфизмом аутосомной пары № 6: один гомолог которой представлен мета-, а второй акроцентрическим элементом (рис. 1б). Он был выявлен у одной самки (табл. 1). В третьем, отмеченном у одной самки, варианте (2n = 22, NFa = 39) (табл. 1), с гетероморфной 6-й парой аутосом, в кариотипе появляется крупнейшая в наборе мета-субметацентрическая пара (ей дано буквенное обозначение: ТТ), предположительно, гомеологичная субментацентрикам пары № 4 и метацентрикам пары № 10 после их тандемного слияния, которые, естественно, отсутствуют на рутинно окрашенной кариограмме (рис. 1в). Отличие четвертого варианта (2n = 22, NFa = 40) от третьего связано с вариабельностью морфологии 6-й пары аутосом, представленной у последнего двумя метацентрическими элементами (рис. 1г). Такой кариотип обнаружен у трех 22-хромосомных самок (табл. 1). В пятом 23-хромосомном варианте (2n = 23, NFa = 40), среди аутосом выделяются три непарных элемента: самая крупная, превосходящая по своим размерам другие элементы набора, мета-субметацентрическая хромосома (буквенное обозначение: Т), средней величины субметацентрик (№ 4) и несколько меньшей величины среднеразмерный мета-субметацентрик (№ 10). Остальные аутосомы представлены серией из девяти, плавно убывающих по величине пар хромосом, среди которых лишь одна акроцентрическая пара (№ 6) (рис. 2a, 2б). Такой вариант кариотипа найден у одного самца и одной самки (табл. 1). Шестой вариант кариотипа (2n = 23, NFa = 41), сходен с предшествующим, за одним исключением: он обладает гетероморфной парой № 6, представленной акроцентриком и метацентриком. Этот хромосомный набор обнаружен у четырех самок и одного самца (табл. 1).
Таблица 1.
Структура кариологически изученной выборки Sicista sp. 1 из полиморфной популяции в Саратовском Правобережье
| № п/п | Полевой номер зверька |
Пол | 2n | NFa | Изменчивость морфологии пары № 6 (ПИ) |
Тандемная транслокация пар №№ 4–10 |
|---|---|---|---|---|---|---|
| 1 | 06-59 | Самец | 23 | 40 | А-А | Гетерозигота |
| 2 | 06-65 | Самка | 23 | 41 | А-М | Гетерозигота |
| 3 | 07-22 | Самка | 23 | 41 | А-М | Гетерозигота |
| 4 | 07-23 | Самец | 23 | 41 | А-М | Гетерозигота |
| 5 | 07-24 | Самка | 22 | 39 | А-М | Гомозигота |
| 6 | 07-25 | Самка | 24 | 43 | А-М | – |
| 7 | 07-28 | Самка | 23 | 41 | А-М | Гетерозигота |
| 8 | 07-54 | Самка | 22 | 40 | М-М | Гомозигота |
| 9 | 09-1 | Самец | 24 | 44 | М-М | – |
| 10 | 11-1 | Самка | 22 | 40 | М-М | Гомозигота |
| 11 | 11-2 | Самка | 23 | 41 | А-М | Гетерозигота |
| 12 | 11-3 | Самка | 23 | 40 | А-А | Гетерозигота |
| 13 | 11-5 | Самка | 22 | 40 | М-М | Гомозигота |
Рис. 1.
Варианты рутинно окрашенных 24- и 22-хромосомных кариотипов в популяции Sicista sp. 1 из Саратовского Правобережья (окрестности пос. Славянка Воскресенского р-на): (а) – с 2n = 24, NFa = 44, самец; (б) – с 2n = 24, NFa = 43, самка;(в) – с 2n = 22, NFa = 39, самка; (г) – с 2n = 22, NFa = 40, самка.
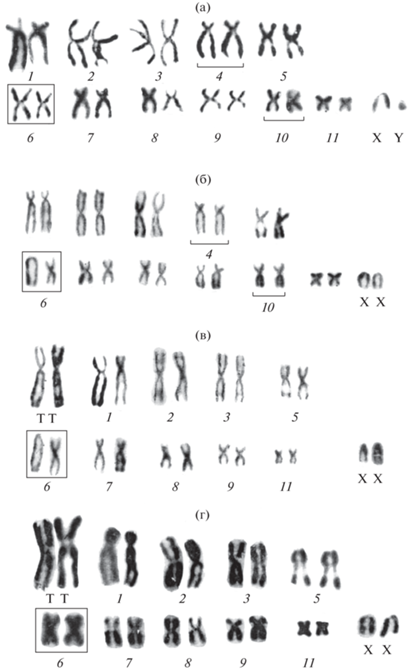
Рис. 2.
Варианты 23-хромосомных кариотипов в популяции Sicista sp. 1 из Саратовского Правобережья (окрестности пос. Славянка Воскресенского р-на): (a) – с NFa = 40, самец, рутинная окраска хромосом; (б) – то же, С- banding; (в) – NFa = 41, самка, AgNOR-окраска хромосом; (г) – то же, G-banding. (Пронумерованы пары аутосом и две непарные аутосомы, крупнейшему в наборе субметацентрику дано буквенное обозначение).

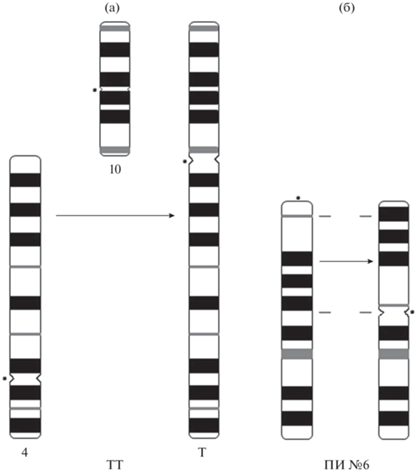
Дифференциальная окраска хромосом была выполнена только для 23-хромосомных особей Sicista sp. 1. Так, гетерохроматин был отмечен исключительно в не вовлеченных в перестройки хромосомах: в прицентромерных районах пары № 7 и Х-хромосомы, а также в полностью гетерохроматичной Y-хромосоме (рис. 2б). Аналогичная картина прослеживается при AgNOR-окрашивании, в частности, в кариотипе 23-хромосомной самки (2n = 23, NFa = 40) ядрышковый организатор (ЯОР) локализован в интеркалярных районах мета-субметацентрической пары № 5, также не вовлеченной в формирование обнаруженного нами внутрипопуляционного хромосомного полиморфизма (рис. 2в). G-окраска хромосом, как и следовало ожидать, позволила выявить гомеологию крупнейшего непарного субметацентрического элемента (Т) непарным аутосомам №№ 4 и 10, что подтверждает роль тандемной транслокации в его возникновении. Также показано, что гетероморфизм пары № 6 (акроцентрик – двуплечий элемент), зафиксированный в хромосомном наборе 23-хромосомной самки, обусловлен перицентрической инверсией (рис. 2г, 3).
Рис. 3.
Схема хромосомных перестроек в популяции Sicista sp 1 из Саратовского Правобережья: (а) – тандемное слияние хромосом №№ 4 и 10; (б) – перицентрическая инверсия в хромосоме № 6. Точками отмечено положение центромер.
Исследованная нами выборка уточняет северную границу распространения Sicista sp. 1, расширяя ареал этого кариологически полиморфного узко ареального вида от бассейна Среднего Дона до Саратовского Правобережья, представляющего собой периферическую часть области распространения вида (рис. 4, табл. 2).
Рис. 4.
Область распространения Sicista sp. 1, очерченная по результатам хромосомного типирования: 1 – пункт собственных сборов; 2–7–места находок, известные по литературным данным (Ковальская и др., 2000; Анискин и др., 2003; Kovalskaya et al., 2011). Номера находок соответствуют нумерации в табл. 2.
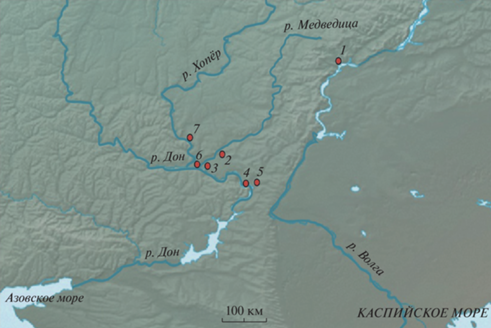
Таблица 2.
Распространение и географическая изменчивость кариотипа у Sicista sp. 1
| № п/п |
Место отлова | Географические координаты | Число экз. | 2n | NFa | Источник |
|---|---|---|---|---|---|---|
| 1 | Саратовская обл. Правобережье р. Волга, (Воскресенский р-н), Славянка |
51.84 N/46.25 E | 13 | 22–24 | 39–44 | Наши данные |
| 2 | Волгоградская обл. Левобережье р. Медведица |
49.93N./43.20 E | 1 | 22 | 39 | Kovalskaya et al., 2011 |
| 3 | Арчединско-Донские пески. Север |
49/65 N/42.72 E | 1 | 23 | 42 | » |
| 4 | Арчединско-Донские пески, Юг |
49. 20 N/43.77 E | 2 | 24 | 44 | » |
| 5 | Окрестности с. Иловля. 10 км на Ю-В |
49.25 N/44.12 E | 1 | 24 | 44 | » |
| 6 | Правобережье р. Медведица | 49.65 N/42 62 E | 3 1 |
26 25 |
44 42 |
» Анискин и др., 2003 Ковальская и др., 2000 |
| 7 | Алексеевские Пески | 50.20 N/42.30 E | 1 | 26 | 44 | Kovalskaya et al., 2011 |
Примечание. 2n – диплоидное число хромосом, NFa – число плеч аутосом. Нумерация в таблице соответствует номерам находок вида на рис. 4.
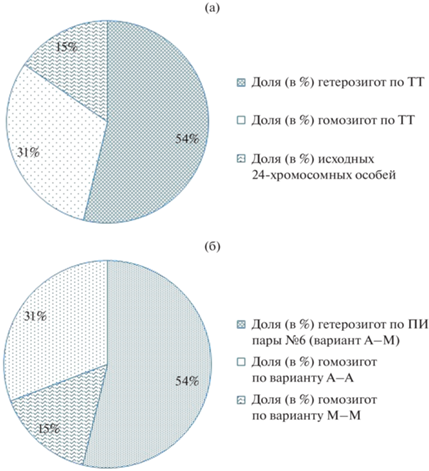
Количественный анализ кариологически исследованной выборки Sicista sp. 1 показал, что среди 13 изученных экз. 7 особей гетерозиготны (2n = 23), четыре – гомозиготны (2n = 22) по тандемной транслокации (№№ 4–10), и две обладают исходным 24-хромосомным кариотипом. Распределение связанных с ПИ пары №6 в исследованной нами выборке Sicista sp. 1 выглядит следующим образом: семь гетерозигот по вариантуА-М, две гомозиготы по варианту А-А и четыре гомозиготы по варианту М-М (табл. 1, рис. 5, на котором соотношение разных хромосомных вариантов показано в процентном отношении). В совокупной выборке отмечено преимущество гетерозигот по обеим структурным хромосомным мутациям (рис. 5).
Рис. 5.
Соотношение (в %) в совокупной выборке (n=13) кариологически изученной популяции Sicista sp. 1 из Саратовского Правобережья: (а) – гетерозиготных (54%), гомозиготных (31%) по тандемной транслокации (ТТ) особей и обладающих исходным 24-хромосомным кариотипом (15%); (б) – вариантов кариотипа, связанных с вариабельностью морфологии пары № 6 (ПИ): гетерозигот по варианту А-М (54%), гомозигот по варианту А-А (15%), гомозигот по варианту (М-М) (31%).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Внутрипопуляционный хромосомный полиморфизм в исследованной выборке Sicista sp. 1 из Саратовского Правобережья обусловлен наличием двух типов хромосомных перестроек: тандемная транслокация (ТТ) и перицентрическая инверсия (ПИ). С помощью G-окраски было показано, что перестройки затрагивают три, не маркируемые при C- и AgNOR окрасках, пары аутосом: это вовлекаемые в ТТ пары №№ 4 и 10 и изменяющая в результате ПИ свою морфологию пара № 6 (рис. 2, 3) (Баскевич и др., 2010; наши данные).
Ранее у Sicista sp. 1. была выявлена географическая изменчивость кариотипа с вариабельностью числа хромосом в наборах от 22 до 26 (Kovalskaya et al., 2011). При этом, 26-хромосомные особи были найдены в Алексеевских песках (№ 7 в табл. 2) и на правом берегу р. Медведица (№ 6 в табл. 2; здесь была найдена также одна 25-хромосомная особь), 22-хромосомные – в левобережье Медведицы (№ 2 в табл. 2), 24-хромосомные – в окрестностях Иловли и в южной части Арчединско-Донских песков (соответственно №№ 5 и 4 в табл. 2) , тогда как в их северной части (№ 3 в табл. 2) отмечены находки 23-хромосомных особей этого вида (Ковальская и др., 2000; Анискин и др., 2003; Kovalskaya et al., 2011) (табл. 2, рис. 4). Использование методов дифференциальной окраски хромосом (G-banding) позволило уточнить механизмы географической изменчивости кариотипа у этого вида (Kovalskaya et al., 2011). Было показано, что межпопуляционная изменчивость кариотипа у Sicista sp. 1 определяется тремя типами хромосомных перестроек: тандемное слияние (ТТ), Rb транслокация и перицентрическая инверсия (ПИ) при дефиците гетерозигот по хромосомным перестройкам (ТТ, ПИ) в совокупной выборке (Kovalskaya et al., 2011): только две из восьми особей оказались гетерозиготами по ТТ и ПИ. Исследованная нами полиморфная выборка из северной части ареала вида (Воскресенский р-н Саратовской обл.), включающая 6 выше упомянутых вариантов кариотипа (2n = 24, NFa = 44; 2n = 24, NFa = 43; 2n = 22, NFa = 39; 2n = 22, NFa = 40; 2n = 23, NFa = 40; 2n = = 23, NFa = 41), напротив, характеризуется преимуществом гетерозигот по двум структурным хромосомным перестройкам (ТТ, ПИ), определивших генетическое разнообразие исследованной популяции данного представителя мышовок группы subtilis (рис. 5, табл. 1). Известно, что ПИ проявляют себя в мейозе у гетерозигот путем “запирания кроссинговера”, что может играть важную роль в адаптации популяции к тем или иным условиям среды (Хвостова, Богданов, 1975; Bonvicino et al., 2001). Этот же феномен (подавление кроссинговера) может проявляться и у гетерозигот по достаточно редким для млекопитающих хромосомным перестройкам, ТТ (Раджабли, Графодатский, 1977; Elder, 1980; Elder, Hsu, 1988; Иваницкая, 1990; Huang et al., 2006; Kartavtseva et al., 2008; Картавцева и др., 2021; Galindo et al., 2021). Так, например, было показано, что гетерозиготность по ТТ приводит к нарушению коньюгации хромосом в мейозе и их последующему расхождению с образованием при коньюгации в профазе 1 мейоза не бивалента, а квадривалента. С одной стороны, это может приводить к понижению плодовитости у гетерозигот, а с другой стороны, из-за затруднений с плотной коньюгацией вблизи точек разрывов к подавлению кроссинговера в транслоцированных участках, что на генетическом уровне в дальнейшем может определять адаптивные свойства популяции (Хвостова, Богданов, 1975).
Преимущество гетерозигот является одним из механизмов, поддерживающих разнообразие (Тимофеев-Ресовский и др., 1977; Patton et al., 1980), и внутрипопуляционный полиморфизм в данном случае может быть охарактеризован как сбалансированный. Стабильность такого внутрипопуляционного полиморфизма поддерживается балансированным или гетерозиготным отбором. При этом следует отметить, что существование хромосомного полиморфизма можно объяснить не только действием отбора, но и неселективными факторами: в малых демах это генетический дрейф (Kimura, 1985).
Проведенное нами на основе хромосомного анализа исследование генетической структуры популяции Sicista sp. 1 из северной части ареала вида, указывает на ее своеобразие, заключающееся в наличии множественного хромосомного полиморфизма (ТТ, ПИ), тогда как все другие популяции вида (при фрагментарности выборок) характеризуются мономорфизмом (Kovalskaya et al., 2011), или же наличием только одной хромосомной перестройки: Rb-транслокации, обнаруженной в популяции из правобережья р. Медведица (Анискин и др., 2003; Kovalskaya et al., 2011). При этом следует отметить, что межпопуляционная хромосомная изменчивость у Sicista sp. 1 определяется тем же спектром хромосомных мутаций (Rb, ПИ, ТТ), которые выявляются на внутрипопуляционном уровне. Обнаруженная нами значительная внутрипопуляционная хромосомная изменчивость и отмеченная ранее на внутри- и межпопуляционном уровнях вариабельность кариотипа у этого представителя Sicista группы subtilis (Анискин и др., 2003; Kovalskaya et al., 2011), по-видимому, имеют исторические причины, связанные с пульсацией ландшафта и климата в регионе исследования. Так, по молекулярным данным отделение от общего ствола предка мышовок группы subtilis датируется рубежом плиоцена и плейстоцена, а диверсификация аллопатрических форм группы происходила во второй половине среднего плейстоцена (примерно 400–250 тыс. лет назад) (Lebedev et al., 2019). Что касается истории исследуемого узко ареального вида, населяющего участки степи и пустыни в междуречье среднего Дона, Медведицы, Арчеды и Волги, то, по крайней мере, для Арчединско-Донских и Алексеевских песков, откуда известны находки вида, установлена связь с отложениями древнего Дона и его притоков и движением ледников в ледниковые периоды Днепровского и Московского оледенения (Богучарсков, Князев, 2012), а для Нижнего Поволжья по данным споро-пыльцевого анализа показана неоднократная смена растительных поясов в плейстоцене в результате трансгрессий Каспия (Москвитин, 1962). Очевидно, что эти и другие события плейстоцена, связанные с чередованием процессов изоляции и расселения, а также возможной гибридизации предковых форм, повлияли на формирование значительной внутривидовой хромосомной изменчивости этого вида, отмеченной как на меж-, так и на внутрипопуляционном уровнях.
Высокий уровень внутривидовой хромосомной изменчивости у исследованного нами узко ареального представителя Sicista группы subtilis коррелирует с биогеографической гипотезой (Geographic Range Hypothesis) (Bonvicino et al., 2001; Hooper, Price, 2015 – цит. по Martinez et al., 2017), согласно которой у видов с ограниченным распространением отбор и генетический дрейф благоприятствуют более быстрой фиксации хромосомных перестроек и в конечном счете, благоприятствуют фиксации локальных адаптивных характеристик.
Хромосомный полиморфизм был выявлен и у других узко ареальных представителей Sicista группы subtilis из бассейна среднего Дона: у видов-двойников, относящихся по результатам секвенирования двух генов (cytb, COI) мт ДНК к одной с Sicista sp. 1 филогруппе (cimlanica): Sicista sp. 2, S. cimlanica (Lebedev et al., 2019). Этот результат согласуется с “законом гомологических рядов наследственной изменчивости”, в соответствии с которым у филогенетически близких форм проявляется параллелизм изменчивости, уменьшающийся с увеличением степени филогенетической дивергенции (Вавилов, 1920). Напомним, что остальные, входящие в состав Sicista группы subtilis виды: S. nordmanni (населяет южные степи Восточной Европы), S. severtzovi (известен только из типового местообитания), S. trizona (обитатель степных участков юго-западной Европы) характеризуются мономорфными кариотипами. Исключение представляет евроазийский широко ареальный политипический вид Sicista subtilis s. str., у которого был выявлен полиморфизм и географическая изменчивость кариотипа, связанные с вариабельностью морфологии трех пар аутосом (№№ 6, 8, 10), механизмом которых являются ПИ (Соколов и др., 1986; Баскевич и др., 2010; Kovalskaya et al., 2011). Сравнивая исследованный нами случай внутрипопуляционного хромосомного полиморфизма у Sicista sp. 1 с кариологически полиморфными популяциями других представителей группы, следует отметить, что особенностью изученной нами выборки является множественный характер выявленных хромосомных перестроек и преимущество гетерозигот по ним. Такой характер генетической структуры данной популяции вероятно определяет ее адаптивность к конкретным условиям среды. Очевидно, что на данном этапе такая система сбалансированного хромосомного полиморфизма не может служить в качестве материала для хромосомной эволюции (Гилева, 1990), что отличает ее от кариологически полиморфных популяций большинства других видов Sicista группы subtilis (Соколов и др., 1986; Баскевич и др., 2011; Kovalskaya et al., 2011).
Финансирование. Работа выполнена в рамках госзадания ИПЭЭ РАН (проект АААА-А18-118042490058-8).
Благодарности. За содействие в сборе полевого материала авторы выражают глубокую признательность сотруднице Саратовского филиала ИПЭЭ РАН А.А. Цветковой, а за консультативную помощь в подготовке иллюстративного материала благодарят своих коллег: Е.А. Авилову и Д.С. Костина.
Соблюдение этических норм. Все применяемые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Анискин В.М., Богомолов П.Л., Ковальская Ю. М., Лебедев В.С., Суров А.В., Тихонов И.А. Кариологическая дифференциация мышовок группы “subtilis” (Rodentia, Sicista) на юго-востоке Русской равнины – Аверьянов А.О., Абрамсон Н.И. (ред.). Материалы международного совещания: систематика, филогения и палеонтология мелких млекопитающих. Санкт-Петербург: Зоологический институт РАН. 2003. С. 27−29.
Ахвердян М.Р., Ляпунова Е.А., Воронцов Н.Н., Тесленко С.В. Внутрипопуляционный аутосомный полиморфизм обыкновенной полевки Microtus arvalis Закавказья // Генетика. 1999. Т. 35. № 12. С. 1687−1698.
Баклушинская И.Ю. Хромосомные перестройки, реорганизация генома и видообразование // Зоол. журн. 2016. Т. 95. № 4. С. 376−393.
Баскевич М.И., Опарин М.Л., Соколенко О.В., Авилова Е.А. Новые данные по хромосомной изменчивости и распространению видов-двойников Microtus arvalis sensu lato (Rodentia, Arvicolinae) в Нижнем Поволжье // Зоол. журн. 2008. Т. 87. № 11. С. 1382−1390.
Баскевич М.И., Опарин М.Л., Черепанова Е.В., Авилова Е.А. Хромосомная дифференциация степной мышовки, Sicista subtilis (Rodentia, Dipodoidea) в Саратовском Поволжье // Зоол. журн. 2010. Т. 89. № 6. С. 749−757.
Баскевич М.И., Сапельников С.Ф., Власов А.А. Новые данные по хромосомной изменчивости темной мышовки (Sicista severtzovi, Rodentia, Dipodoidea) из Центрального Черноземья // Зоол. журн. 2011. Т. 90. № 1. С. 59−66.
Баскевич М.И. Систематика, эволюция и изменчивость р. Sicista (Rodentia, Dipodoidea): обзор кариологических и молекулярных данных // Аспекты биоразнообразия // Труды Зоол. музея МГУ им. М.В. Ломоносова. Т. 54. Ч. 1. М.: Т-во научн. изданий КМК. 2016. С. 191−228.
Богучарсков В.Т., Князев Ю.П. Историко-географический анализ изучения ландшафтов бассейна Среднего и Нижнего Дона // Вестник ВГУ. Серия географическая. Геоэкология. 2012. № 2. С. 65−69.
Борисов Ю.М. Процесс увеличения числа и вариантов системы B-хромосом мышей Apodemus peninsulae в популяции горного Алтая за 26-летний период // Генетика. 2008. Т. 44. № 9. С. 1227−1237.
Вавилов Н.И. Закон гомологических рядов в наследственной изменчивости. Доклад на III Всероссийском селекционном съезде в г. Саратове 4 июня 1920. 16 с.
Волобуев В.Т. В-хромосомы млекопитающих // Успехи соврем. биологии. 1981. Т. 86. № 3. С. 387–402.
Воронцов Н.Н. Значение изучения хромосомных наборов для систематики млекопитающих // Бюлл. Моск. обз-ва испыт. Природы. Отд. Биол. 1958. Т. 63. № 2. С. 5–36.
Гилева Э.А. Хромосомная изменчивость и эволюция. М.: Наука. 1990. 141 с.
Загороднюк И.В. Кариотипическая изменчивость 46-хромосомных форм полевок группы Microtus arvalis (Rodentia): Таксономическая оценка // Вестн. зоол. 1991. № 1. С. 36−45.
Иваницкая Е.Ю. Существуют ли закономерности хромосомной эволюции млекопитающих // Эволюционные и генетические исследования млекопитающих. Материалы докладов Всесоюзного совещания. Владивосток: ДВО АН СССР. 1990. Ч. 1. С. 1−9.
Картавцева И.В., Шереметьева И.Н., Павленко М.В. Множественный хромосомный полиморфизм хромосомной расы “эворон” эворонской полевки (Rodentia, Arvicolinae) // Генетика. 2021. Т. 57. № 1. С. 82−94.
Ковальская Ю.М., Тихонов И.А., Тихонова Г.Н., Суров А.В., Богомолов П.Л., Новые находки хромосомных форм мышовок группы subtilis и описание Sicista severtzovi cimlanica subsp.n. (Mammalia, Rodentia) из среднего течения Дона // Зоол. журн. 2000. Т. 79. № 8. С. 954−964.
Ляпунова Е.А., Баклушинская И.Ю., Коломиец О.Л., Мазурова Т.Ф. Анализ плодовитости гибридов разнохромосомных форм слепушонок надвида Ellobius tancrei, отличающихся по одной паре робертсоновских метацентриков // ДАН СССР. 1990. Т. 310. № 3. С. 721−723.
Москвитин А.И., Плейстоцен Нижнего Поволжья // Тр. Геологического Ин-та АН СССР. 1962. Вып. 64. 279 с.
Орлов В.Н. Кариосистематика млекопитающих. М.: Наука. 1974. 207 с.
Орлов В.Н., Булатова Н.Ш. Сравнительная цитогенетика и кариосистематика млекопитающих. М.: Наука, 1983. 405 с.
Павлинов И.Я.Систематика современных млекопитающих. Калякин М.В. (ред.) [Труды Зоологического Музея МГУ.Т. XLVI]. М.: Изд-во МГУ. 2003. 297 с.
Раджабли С.И., Графодатский А.С. Эволюция кариотипа млекопитающих (структурные перестройки хромосом и гетерохроматина) // Цитогенетика гибридов, мутаций и эволюция кариотипа. Новосибирск: Наука. 1977. С. 231−248.
Русин М.О., Шрамко Г., Черкес Т. Ревизия степных мышовок (Sicista subtilis s. l.) Европейской части ареала // Структура вида у млекопитающих. Материалы конференции, 21−23 окт. 2015 г., Москва. М.: Т-во научн. изданий КМК. 2015. С. 71.
Cоколов В.Е., Баскевич М.И., Ковальская Ю.М. Изменчивость кариотипа степной мышовки, Sicista subtilis Pallas (1778) и обоснование видовой самостоятельности S. severtzovi Ognev, 1935 (Rodentia, Zapodidae) // Зоол. журн. 1986. Т. 65. № 2. С. 1684–1692.
Тимофеев-Ресовский, Воронцов Н.Н., Яблоков А.В. Краткий очерк теории эволюции. М.: Наука. 1977. 302 с.
Хвостова В.В., Богданов Ю.Ф. Цитология и генетика мейоза М.: Наука, 1975. 432 с.
Щипанов Н.А., Павлова С.В. Многоуровневая подразделенность в группе видов “araneus” рода Sorex. 1. Хромосомная дифференциация // Зоол. журн. 2016. Т. 95. № 2. С. 216–233.
Ayala D., Pelayo Acevedo, Marco Pombi, I. Dia, D. Baccolini, C. Costantini, F. Simard, D. Fontenille. Chromosome inversions and ecological plasticity in the main African malaria mosquitoes // Evolution. 2017. V. 71. P. 686–701.
Baklushinskaya I.Yu., Lyapunova E.A. Robertsonian translocations and origin of new forms in group Ellobius tancrei (Mammalia, Rodentia) // Chromosome Research. 1995. V. 3. P. 69–70.
Bonvicino C., D’Andrea P., Borodin P. Pericentric inversion in natural populations of Oligoryzomys nigripes (Rodentia, Sigmodontinae) // Genome. 2001. V. 4. P. 791–796.
Damas J., Marco Corbo M., Lewin H.A. Vertebrate Chromosome Evolution // Annu. Rev. Anim. Biosci. 2021. V. 9. P. 1−27.
Dobigny G., Catalan J., Gauthier P., O’Brien P.C.M., Brouat C., B€A K., Tatard C., Ferguson–Smith M.A., Duplantier J.M., Granjon L., Britton–Davidian J. Geographic patterns of inversion polymorphisms in a wild African rodent, Mastomys erythroleucus // Heredity. 2010. V. 104. P. 378–386.
Dobigny G., Britton-Davidian J., Robinson T.J., 2015. Chromosomal. polymorphism in mammals: an evolutionary perspective // Biol. Reviews. 2017. V. 92. №1. P. 1−21. https://doi.org/10.1111/brv.12213
Dobzhansky Th. Genetics of natural populations. XZVI. Altitudional and seasonal changes produced by natural selection in certain populations of Drosophila pseudoobscura and Drosophila persimilis // Genetics. 1948. V. 33. P. 158–176.
Elder F.F.B. Tandem fusion, centric fusion, and chromosomal evolution in the cotton rats, genus Sigmodon // Cytogen. Cell Genet. 1980. V. 26. P. 199–210.
Elder F.F.B., Hsu T.C. Tandem fusions in the evolution of mammalian chromosomes // The Cytogenetics of Mammalian Autosomal Rearrangements / Ed. Sandberg A.A. N.Y.: Alan R. Liss. 1988. P. 481–506.
Ford C.E., Hamerton J.L. A colchicine hypotonic citrate, squash sequence for mammalian chromosomes // Stain Technol. 1956. V. 31. P. 247−251.
Galindo D.J., Martins G.S., Vozdova M., Cernohorska H., Kubickova S., Bernegossi A.M., Kadlcikova D., Rubes J., Duarte J.M.B. Chromosomal polymorphism and speciation: the case of the genus Mazama (Cetartiodactyla, Cervidae) // Genes. 2021. V. 12. P. 165. https://doi.org/10.3390/genes12020165
Holden M.E., Musser G.G. Family Dipodidae. – Wilson D.E., Reeder D.M. (eds). Mammal species of the world.A taxonomic and geographic reference. 3d ed. Baltimore: The Johns Hopkins University Press. 2005. P. 21−42.
Howell W.M., Black D.A. Controlled silver-staining of nucleolus organizer regions with a protective colloidal developer: a 1-step method // Experientia. 1980. V.36. P. 1014−1015.
Huang L., Wang J., Nie W., Su W., Yang F. Tandem chromosome fusions in karyotypic evolution of Muntiacus: Evidence from M. feae and M. gongshanensis // Chromosome Res. 2006. V. 14. P. 637−647.
Kartavtseva I.V., Sheremetyeva I.N., Korobitsina K.V., Nemkova G.A., Konovalova E.V., Korablev V.P., Voita L.L. Chromosomal forms of Microtus maximowiczii (Schrenck, 1858) (Rodentia, Cricetidae): Variability in 2n and NF in different geographic regions // Russ. J. Theriology. 2008. V. 7. № 2. P. 89–97.
Kimura M. The Neutral Theory of Molecular Evolution. Cambridge University Press, Cambridge. 1985. 384 p.
Kovalskaya Y.M., Aniskin V.M., Bogomolov P.L., Surov A.V., Tikhonov I.A., Tikhonova G.N., Robinson T.J., Volobuev V.T. Karyotype reorganization in the subtilis group of birch mice (Rodentia, Dipodidae, Sicista): unexpected taxonomic diversity within a limited distribution // Cytogenet. Genome Res. 2011. V. 132. № 4. P. 271−288.
Lebedev V., Poplavskaya N., Bannikova A., Rusin M., Surov A., Kovalskaya Yu. Genetic variation in the Sicista subtilis (Pallas, 1773) species group (Rodentia, Sminthidae), as compared to karyotype differentiation // Mammalia, 2019. https://doi.org/10.1515/mammalia-2018-0216
Martinez P.A., Jacobina U.P., Fernandes R.V., Brito C., Penone C., Amado T.F., Fonseca C.R., Bidau C.J. A comparative study on karyotypic diversification rate in mammals // Heredity. 2017. V. 118. P. 366–373.
Matthey R. Caryotypes de murides et de dendromurides origenaiores de Republique Centrafricaine // Mammalia. 1970. V. 34. № 3. P. 459−466.
Patton J.C., Baker R.J., Genoways H.H. Apparent chromosomal heterosis in a fossorial mammal // Mamm. Papers: Univ. Nebraska State Museum. 1980. P. 193−197.
Romanenko S., Lyapunova E.A., Abdusator S. Saidov, O’Brien P.C.M., Serdykova N.A., Ferguson–Smith M.A., Grafodatsky A.S., Baklushinskaya I. Chromosome translocations as a driver of diversification in mole voles Ellobius (Rodentia, Mammalia) // Int. J. Moll. Sci. 2019. V. 20. P. 4466. https://doi.org/10.3390/ijms20184466
Seabright M. A rapid banding technique for human chromosomes // Lancet. 1971. V. 11. P. 971−972.
Sumner A.T. A simple technique for demonstrating centromeric heterochromatin // Exp. Cell Res. 1972. V. 75. P. 304−306.
Zima J. Chromosomal evolution in small mammals (Insectivora, Chiroptera, Rodentia) // Hystrix, (n.s.). 2000. V. 11. № 2. P. 5−15.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


