Известия РАН. Серия биологическая, 2023, № 2, стр. 186-197
Половые различия возрастных изменений функциональной активности и экспрессии основных регуляторных белков ренин-ангиотензиновой системы в аорте и миокарде крыс
Л. М. Кожевникова 1, *, И. Ф. Суханова 1
1 ФГБНУ “НИИ общей патологии и патофизиологии”
125315 Москва, ул. Балтийская, 8, Россия
* E-mail: lubovmih@yandex.ru
Поступила в редакцию 11.11.2021
После доработки 01.12.2021
Принята к публикации 14.03.2022
- EDN: HAHDOI
- DOI: 10.31857/S1026347022700056
Аннотация
Оценены половые различия возрастных изменений функциональной активности и экспрессии рецепторных и регуляторных белков ренин-ангиотензиовой системы (RAS) в аорте и миокарде крыс. Установлено, что с возрастом у самок повышается чувствительность аорты к вазоконстрикторному действию ангиотензина II, в то время как у старых самцов она остается неизменной. В аорте старых самок выявлено снижение уровня мРНК ACE, MasR и ACE2 в 1.6, 1.8 и 4.4 раза соответственно. Показано, что в процессе старения в левом желудочке самок уровень мРНК MasR и ACE2 снижается, у самцов, напротив, уровень мРНК ACE и MasR повышается. Полученные результаты свидетельствуют о половых особенностях возрастных изменений активности RAS в сосудах и сердце крыс.
Наиболее частой причиной смерти среди пожилых людей являются сердечно-сосудистые и цереброваскулярные заболевания. Борьба с возрастными сосудистыми заболеваниями имеет решающее значение, поскольку с каждым годом увеличивается число людей старше 65 лет. В основе развития возрастной сосудистой патологии лежат нарушения сократительной, барьерной, секреторной, транспортной функций сосудистой системы (Lakatta 2015; Lacolley et al., 2018; Ungvari et al.,2018). Результаты эпидемиологических исследований артериального давления у мужчин и женщин, а также данные, полученные на экспериментальных моделях животных, указывают на существенные половые различия в возникновении артериальной гипертензии и последующих осложнений, включая инфаркт миокарда, инсульт, ретинопатию, хроническую почечную недостаточность, сахарный диабет (Boese et al.,2017; Kavousi, 2020).
У молодых людей артериальное давление определяется в основном резистентностью периферических сосудов, в то время как у пожилых – в большей степени жесткостью магистральных сосудов (Quinn et al., 2012; Thijssen et al., 2016; Saeed et al.,2018). Прогрессирующее увеличение жесткости крупных эластических артерий, прежде всего аорты, является ранним показателем их старения. Важная функция аорты заключается в том, чтобы гасить повышение давления, вызванное выбросом крови из левого желудочка во время систолы. По мере потери эластичности аорты повышается систолическое кровяное давление на единицу крови, выбрасываемой из левого желудочка, что приводит к увеличению систолического давления и к нагрузке на левый желудочек сердца. Все это способствует развитию гипертонии, гипертрофии левого желудочка, субэндокардиальной ишемии и фиброза сердца (Mazzaro et al., 2005; Sheydina et al., 2011).
Большинство исследований по изучению возрастных изменений проводится на артериях с преобладающей резистивной функцией. Физиологические эффекты старения магистральных сосудов, в том числе изменения их чувствительности по отношению к вазоактивным соединениям, и механизмы развития гипертонии в пожилом возрасте у мужчин и женщин изучены недостаточно.
В настоящее время доказано влияние окислительного стресса на процессы старения сосудов. Активные формы кислорода обладают цитотоксическим действием, негативно влияют на функцию митохондрий и увеличивают синтез широкого спектра воспалительных цитокинов и хемокинов, что приводит к активации воспалительных процессов в стареющих сосудах (Wang, Shah, 2015; Ungvari et al., 2018). Снижение синтеза и биодоступности NO является одной из причин возрастного снижения эндотелий зависимой дилатации сосудов, увеличения вазоконстрикции и нарушения перфузии тканей (Taddei et al., 2000; Rodriguez-Manas et al., 2009; Donato et al.,2015).
Решающая роль в возрастной дисфункции сосудов отводится рецепторам плазматической мембраны клеток, связанных с G-белками (GPCR), которые активируют сходные сигнальные пути и регулируют широкий спектр клеточных физиологических и патологических процессов (Wirth et al., 2016). Важную роль в регуляции функциональной активности сосудов играет ренин-ангиотензиновая система (RAS). RAS состоит из двух осей регуляции внутриклеточной сигнализации: 1) классической ACE/ATII/AT1R, активация которой приводит к вазоконстрикции, пролиферации клеток, гипертрофии органов, задержке ионов натрия, высвобождению альдостерона и др. и 2) альтернативной ACE2/AT(1–7)/MasR. Посредством ACE2/ AT(1–7)/MasR-сигнального каскада реализуются вазодилатационный, антипролиферативный, антигипертрофический, кардиозащитный, противоспалительный эффекты RAS. При активации данного каскада подавляется процесс тромбообразования в микрососудах и фиброзирования легочной ткани (Verdecchia et al., 2020).
Связанное с возрастом повышение активности RAS в значительной степени способствует развитию гипертонии и широкого спектра нарушений, включая гипертрофию сердца, фибрилляцию предсердий и сердечную недостаточность (Mehta, Griendling, 2007; Yamamoto et al., 2007; Lakatta, 2015; Wang, Shah, 2015). Мы предположили, что в стареющих сосудах и миокарде происходят значительные изменения на уровне экспрессии генов, кодирующих важнейшие регуляторные белки RAS, что приводит к дисбалансу функциональной активности двух осей регуляции внутриклеточной сигнализации: ACE/ATII/AT1R и ACE2/ ATII/MasR.
В настоящем исследовании мы оценили функциональную активность и экспрессию генов ангиотензиновых рецепторов AT1A-типа, а также экспрессию генов MasR и ангиотензинпревращающих ферментов – ACE и ACE2 в аорте и миокарде молодых и старых крыс обоего пола для понимания вклада RAS в развитие сердечно-сосудистых заболеваний в старости.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты выполнены на беспородных крысах обоего пола.
Крысы, включенные в исследование, были рандомизированы на четыре группы: 1 группа – самки в возрасте 4 мес. (молодые, n = 19); 2 группа – самки в возрасте 24 мес. (старые, n = 19); 3 группа – самцы 4 мес. (молодые, n = 19); 4 группа – самцы в возрасте 24 мес. (старые, n = 19).
Анестезированных крыс (25% раствор уретана, 4 мл/кг) декапитировали, извлекали сердце и грудной отдел аорты для проведения дальнейших физиологических и молекулярно-биологических исследований. Часть изолированной аорты (~1 см) помещали в раствор Кребса–Хенселейта, охлажденный до +4°C, и использовали в физиологических экспериментах. Состав раствора Кребса–Хенселейта в мМ: NaCl – 121; KCl – 4.69; KH2PO4 – 1.1; NaHCO3 – 23.8; MgSO4 – 1.6; CaCl2 – 1.6; ЭДТА – 0.032; D-глюкоза – 8. Остальную часть аорты и фрагмент левого желудочка сердца помещали в охлажденный до +4°C физиологический раствор NaCl и использовали для проведения ПЦР анализа.
Измерение силы сокращения аорты в изометрическом режиме. Сосуды очищали от жировой и соединительной тканей и нарезали на кольца шириной 1.5–2.2 мм, которые крепили на держателях, помещенных в раствор Кребса-Хенселайта, аэрируемый карбогеном (5%-ная CO2 в O2) в проволочном четырехканальном миографе (“DanishMyo Technology”, модель Multi Myograph System – 620M).
После достижения в камерах миографа температуры раствора 37.0 ± 0.5°С фрагменты аорты растягивали радиально до оптимального диаметра просвета, соответствующего 90% пассивного диаметра сосуда при 100 мм Hg (Mulvany, Halpern, 1977). После процедуры растяжения и последующего периода стабилизации в течение 20 мин жизнеспособность сосудов проверяли с помощью 1 мкМ фенилэфрина – агониста α-адренорецепторов (α-AR, “Sigma”, США). Сохранность эндотелия тестировали с помощью агониста мускариновыхрецепторов10 мкМ карбахола–негидролизируемого ацетилхолинэстеразами аналога ацетилхолина (Sigma, США).
После процедуры стандартизации сосудов приступали к измерению силы сокращения колец аорты в ответ на воздействие ATII в концентрации 100 нМ (Sigma, США). Данная концентрация ATII является насыщающей концентрацией для сосудов в условиях наших экспериментов.
Обработка результатов физиологических экспериментов. Результаты обрабатывали в Microsoft Excel с использованием количественных данных силы сокращения сосудов (мН), экспортированных из программного обеспечения миографа (LabChartPro).
Статистический анализ проводили с использованием программного обеспечения Graph Pad Prism 5. Для сравнения средних значений и статистических различий между группами использовали дисперсионный анализ (ANOVA) с последующими апостериорными тестами Тьюки. Расхождения считали достоверными при p < 0.05.
Проведение количественного ПЦР анализа. Экспрессию мРНК рецепторов AT1AR и MasR и ферментов ACE и ACE2 измеряли в тканях аорты и левого желудочка сердца. Возрастные изменения оценивали по разнице в уровне мРНК.
Выделение тотальной РНК. После извлечения фрагментов сердца и аорты кровь отмывали физиологическим раствором хлорида натрия охлажденным до +4°C. Затем ткани помещали в раствор RNAlater (Ambion, США) и хранили до выделения РНК при –20°C.
Кусочки ткани левого желудочка и аорты измельчали в жидком азоте. Экстракцию РНК из тканей проводили с использованием набора GeneJET™ (ThermoFisher Scientific Inc., США) согласно протоколу производителя. Выделенную тотальную РНК обрабатывали ДНКазой I (Thermo Fisher Scientific Inc., США) для предотвращения загрязнения геномной ДНК. Концентрацию тотальной РНК определяли количественно на спектрофотометре NanoDrop ® ND-1000 (Thermo Fisher Scientific Inc., США). Для проведения реакции обратной транскрипции с использованием набора Revert Aid H Minus First Strand cDNA Synthesis Kit (Thermo Fisher Scientific Inc., США) брали 1 мкг РНК. Реакцию обратной трансрипции проводили в соответствии с инструкциями производителя, используя случайны егексамерные праймеры.
Проведение количественной полимеразной цепной реакции. Количественную ПЦР проводили с использованием набора qPCRmix-HS (“Евроген”, Россия) согласно инструкции производителя праймеров. Праймеры для реакции были подобраны, синтезированы и валидированы ООО “ДНК-Синтез” (Россия) (табл. 1)
Таблица 1.
Последовательность праймеров, используемых в работе
| Ген | Прямой праймер | Обратный праймер | Праймер с флуоресцентным зондом |
|---|---|---|---|
| Actb | CTGACAGGATG CAGAAGGAG | GATAGAGCCACCAA TCCAC | FAM-CAAGATCATTGCTCCTCCTGAGC-BHQ1 |
| AT1AR | CACCAGGTCAA GTGGATTTC | CTTTTGATACCATCT TCAGCA | FAM-AGTGTCTGAGACCAACTCAACCCA-BHQ1 |
| MasR | CATCCTGCCAGA GAGAAAATG | GGTATTCATGGCTT TCTCCTCA | FAM-CCAGCACAAGAACTCCTCATGGACC-BHQ1 |
| ACE | CAAAGTACGTG GACTTCTCCA | GCTCCAAGTCGTCG GACTC | FAM-CAAGCTCAACGGCTACTCTGATGC-BHQ1 |
| ACE2 | GGCTGAAAGAG CAGAACAG | CCCAAGAGCTGATT TTAGGCT | FAM-ACTGGAGCCCATATGCCGACC-BHQ1 |
Количественную ПЦР проводили в амплификаторе CFX96 Cycler-RealTime PCR Detection System (BioRad Laboratories, Inc., Hercules, CA, США) в 96-луночном планшете, в объеме 20 мкл, используя 1 мкл кДНК. Все эксперименты включали отрицательный контроль и были повторены дважды.
Реакцию проводили при следующих условиях: начальная денатурация (инициация фермента) – 3 мин при 95°C, далее 40 циклов (денатурация – 15 с при 95°C, отжиг/элонгация – 1 мин при 60°C). Для нормализации уровней экспрессии генов использовали β-актин. Различия в экспрессии целевого гена оценивали по изменению соотношения уровней мРНК гена/мРНК β-актина. Отрицательные контроли были поставлены в соответствии с общепринятыми стандартами для отрицательных контролей при проведении количественной ПЦР. Реакцию проводили без фрагментов кДНК, чтобы исключить контаминацию реагентов, и с образцом тотальной РНК, чтобы исключить контаминацию кДНК геномной ДНК.
Анализ результатов количественной ПЦР. Результаты обрабатывали в Microsoft Excel с использованием алгоритма 2–ΔΔCt.
Статистический анализ проводили с использованием программного обеспечения Graph Pad Prism 5. Для сравнения средних значений и статистических различий между группами использовали дисперсионный анализ (ANOVA) с последующими апостериорными тестами Тьюки. Расхождения считались достоверными при p < 0.05. Данные в тексте представлены в виде средних значений и ошибки среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
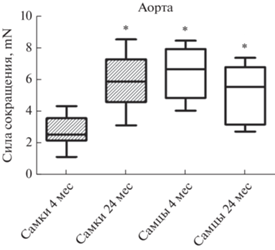
Аорта. У самок в процессе старения аорта становится более чувствительной к вазоконстрикторному действию ангиотензина II (ATII). Так, в ответ на воздействие ATII в концентрации 100 nМ на изолированные кольца аорты старых самок прирост силы их сокращения составлял 5.9 ± 0.5 mN, что значительно превышало величину агонист-индуцированного сокращения сосудов молодых самок (2.6 ± 0.3 mN) (рис. 1). В отличие от самок, у старых крыс самцов реакция аорты на воздействие ATII существенно не отличалась от реакции сосудов молодых животных (рис. 1). Воздействие ATII (100 nМ) на изолированные кольца аорты молодых и старых крыс самцов приводило к одинаковому приросту силы их сокращения (6.5 ± 0.5 mN и 5.5 ± 0.6 mN соответственно), что свидетельствовало об отсутствии возрастных изменений реактивности аорты старых самцов по отношению к действию ATII. Отмечено, что чувствительность аорты молодых крыс самок к вазоконстрикторному действию ATII (100 nМ) достоверно ниже, чем сосудов молодых самцов (соответственно 2.6 ± ± 0.3 mN и 6.5 ± 0.5 mN, p < 0.001) (рис. 1).
Рис. 1.
Влияние возраста на силу сокращения изолированных колец аорты крыс самок и самцов в ответ на воздействие ангиотензина II (ATII, 100nM). * – p < < 0.001 при сравнении с самками в возрасте 4 мес.
Установлено, что в сосудах старых крыс независимо от пола животных уровень мРНК рецепторов AT1A-типа, через которые реализуется вазоконстрикторный эффект ATII, остается неизменным и сопоставим по величине у самок и самцов (рис. 2а).
Рис. 2.
Влияние возраста на уровень экспрессии генов (а) ангиотензиновых рецепторов AT1A-типа и (б) ангиотензинпревращающего фермента (ACE) в аорте крыс самок и самцов. *– p < 0.0001 при сравнении с самками в возрасте 4 мес.; # – p < 0.0001 при сравнении с самками в возрасте 24 мес.
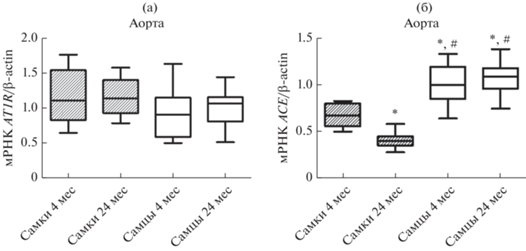
Как показано на рис. 2б, в процессе старения в аорте крыс самок снижается уровень мРНК ACE c 0.7 ± 0.04 до 0.41 ± 0.02 относительных единиц (ОЕ), в то время как в сосудах самцов он остается неизменным. Отмечено, что у самцов в аорте уровень мРНК ACE превышает в 1.5 и в 2.6 раза аналогичные показатели в сосудах молодых и старых самок (соответственно 0.7 ± 0.04 и 1.02 ± 0.05; 0.41 ± ± 0.02 и 1.06 ± 0.05ОЕ).
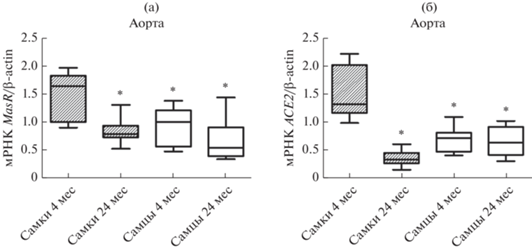
В аорте старых крыс самок более чем в полтора раза снижается уровень мРНК MasR по сравнению с уровнем данных рецепторов в сосудах молодых животных (с 1.46 ± 0.1 до 0.83 ± 0.06 ОЕ) (рис. 3а). В отличие от самок, в аорте крыс самцов не выявлено возрастных изменений уровня мРНК MasR. Однако отмечено, что в сосудах крыс самцов уровень экспрессии MasR значительно ниже, чем в сосудах молодых самок (рис. 3а). Выявлена аналогичная динамика возрастных и половых изменений уровня экспрессии гена ACE2. Так, по сравнению с сосудами молодых крыс уровень мРНК ACE2 в аорте старых самок падает более чем в 4 раза, в то время как в аорте старых самцов он остается неизменным (рис. 3б). В аорте самцов уровень мРНК ACE2 более чем в 2 раза ниже аналогичных показателей в сосудах молодых самок. Следует отметить, что в сосудах старых самцов уровень мРНК ACE2 выше, чем в аорте старых самок (соответственно 0.65 ± 0.07 и 0.35 ± 0.05 ОЕ), что обусловлено исключительно только значительным падение экспрессии гена ACE2 в аорте старых самок (рис. 3б).
Рис. 3.
Влияние возраста на уровень экспрессии генов (а) рецепторов MasR и (б) ангиотензинпревращающего фермента 2 (ACE2) в аорте крыс самок и самцов. *– p < 0.01 при сравнении с самками в возрасте 4 мес.
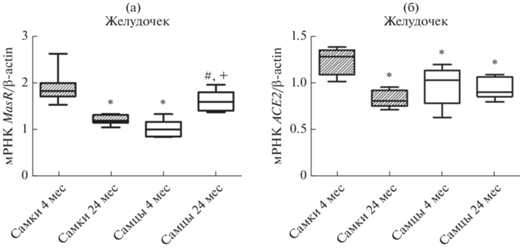
Сердце. Возрастных изменений содержания мРНК рецепторов ангиотензина AT1A-типа в левом желудочке сердца крыс обоего пола не обнаружено. Важно отметить, что независимо от возраста уровень мРНК AT1AR в левом желудочке крыс-самок был достоверно выше, чем у самцов (рис. 4а).
Рис. 4.
Влияние возраста на уровень экспрессии генов (а) AT1AR и (б) и ACE в левом желудочке крыс самок и самцов. *– p < 0.05 при сравнении с самками в возрасте 4 мес.; # – p < 0.05 при сравнении с самками в возрасте 24 мес.; + – p < 0.05 при сравнении с самцами в возрасте 4 мес.
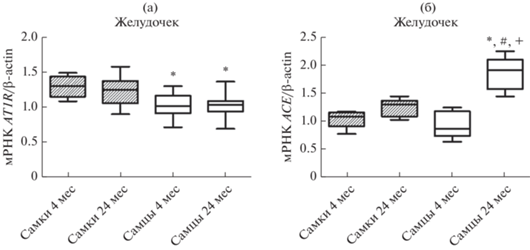
В желудочке молодых крыс обоего пола уровень экспрессии гена ACE (рис. 4б) одинаков. Однако при старении экспрессия гена ACE увеличивается в желудочке старых самцов крыс в 2 раза по сравнению с молодыми самцами.
В желудочке молодых самок крыс уровень экспрессии генов MasR и ACE2 выше, чем у самцов (рис. 5). В миокарде старых самок по сравнению с молодыми самками уровень мРНК MasR снижается с 1.9 ± 0.1 до 1.2 ± 0.03 ОЕ и мРНК ACE2 с 1.24 ± 0.04 до 0.83 ± 0.03 ОЕ. Важно подчеркнуть, что у самок наблюдается сходная динамика возрастных изменений экспрессии исследуемых генов в миокарде и аорте. В отличие от самок крыс, у старых самцов в левом желудочке выявлено достоверное увеличение экспрессии гена MasR, при этом уровень экспрессии гена ACE2 не изменился (рис. 5).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Учитывая нынешний и прогнозируемый рост числа пожилых людей, в ближайшем будущем возрастет частота сердечно-сосудистых заболеваний и увеличится нагрузка на здравоохранение. До сих пор причина возрастного повышения артериального давления плохо изучена. С возрастом возрастает активность вазоактивных медиаторов, в том числе ангиотензина II, которые участвуют в физиологии старения сосудов, способствуя структурно-функциональным изменениям гладкомышечных и эндотелиальных клеток сосудов, уменьшению эластичности и изменению сократительных свойств артерий. Ранее было установлено, что активация RAS напрямую зависит от уровня половых гормонов (Paul et al., 2006). Эстрогены подавляют активность RAS как на системном, так и на тканевом уровнях (Fischer et al., 2002). Показано, что эстрогены снижают уровень мРНК ACE в почках, легких и аорте крыс, подавляют экспрессию рецептора AT1. Несмотря на многочисленные экспериментальные и клинические свидетельства того, что половые гормоны регулируют RAS и тем самым опосредуют воздействие на сердечно-сосудистую систему у мужчин и женщин в пре- и постменопаузе/андропаузе в физиологических условиях, их роль в развитии половых различий при возникновении сердечно-сосудистых заболеваний и смертности полностью не установлена.
Известно, что мужчины предрасположены к развитию сердечно-сосудистых заболеваний, включая атеросклероз и гипертонию, в более раннем возрасте по сравнению с женщинами, что связывают с защитной функцией эстрогенов. В частности, у женщин эндотелиальная дисфункция возникает более чем на десять лет позже, чем у мужчин (LeBlanc et al., 2009,2013; Stanhewicz et al., 2018). В процессе физиологического старения у женщин в большей степени, чем у мужчин, сохраняется целостность структуры миокарда (Olivetti et al., 1995). Что, по-видимому, обусловливает более высокую частоту возникновения фибрилляций предсердий (Atrialfibrillation, AF) у пожилых мужчин, чем у женщин (Tsuneda et al., 2009; Magnani et al., 2012, 2014; Lin et al., 2018; Kavousi, 2020). Полагают, что это связано с более ранним поражением коронарных артерий у мужчин. У женщин AF диагностируется в более пожилом возрасте, но риск развития связанных с AF осложнений у них значительно выше, чем у мужчин того же преклонного возраста. То есть негативные проявления процесса старения сосудов и миокарда раньше проявляются у мужчин, чем у женщин, но по мере увеличения продолжительно жизни эти различия нивелируются, и имеют тенденцию к прогрессированию отдельных проявлений в зависимости от пола.
Нами установлено, что сила сокращения аорты молодых крыс самок в ответ на воздействие ATII почти в 2 раза меньше силы сокращения сосудов молодых самцов (рис. 1). Мы полагаем, что при одинаковом уровне мРНК AT1AR в аорте молодых крыс обоего пола гипочувствительность сосудов молодых самок к действию ATII обусловлена более низким уровнем экспрессии ACE и высоким – ACE2 и MasR, чем в аорте молодых крыс самцов (рис. 2, 3). Полученные результаты согласуются с данными литературы. Показано, что у молодых здоровых самцов мыши по сравнению со здоровыми самками сосудосуживающий ответ на действие ATII и эндотелин-1 более выражен, что связано не только с более высоким синтезом ATII и ET-1, но также с половыми различиями в экспрессии их рецепторов (Stanhewicz et al., 2018). Кроме того, у самок выше концентрация АТ(1–7) в крови и уровень экспрессии MasR в сосудах, что также способствует менее выраженному агонист индуцированному повышению тонуса сосудов у здоровых молодых самок, по сравнению с молодыми самцами. Более низкий сосудосуживающий эффект на воздействие ATII у самок крыс, чем у самцов, также связан с действием эстрогенов (Sampson et al., 2012). На хирургической модели менопаузы (овариэктомированные крысы) показано, что сосудосуживающий ответ на воздействие ATII был значительно выше, а на AT(1–7) – ниже, чем у контрольных животных (Endlich et al., 2017).
Нами установлено, что по мере старения у старых самок чувствительность аорты к вазоконстрикторному действию ATII значительно возрастает, в то время как чувствительность сосудов старых самцов остается неизменной (рис. 1). При этом в аорте крыс обоего пола не выявлено возрастных изменений уровня экспрессии гена AT1AR. Поскольку эстроген оказывает сильное вазодилататорное влияние на сосудистую сеть, полагают, что у особей женского пола в старости снижение циркулирующего эстрогена может привести к усилению GPCR-опосредованных сосудосуживающих ответов артерий (Mouat et al., 2018). Высокую распространенность артериальной гипертензии у женщин в постменопаузе связывают с активацией RAS (Lima et al., 2012). Ранее в экспериментах на молодых (4 мес.) и старых (24 мес.) мышах самцах C57BL6 также было продемонстрировано, что в сонных артериях сокращения, вызванные воздействием ATII, а также экспрессия генов двух изоформ рецептора AT1AR и AT1BR, которые опосредуют вазоконстрикторные эффекты ATII, не изменяются в процессе старения (Meyer et al., 2014). Следует отметить, что только в старости сила сокращения аорты самок в ответ на воздействие ATII сопоставима по величине с реакцией сосудов, как молодых, так и старых крыс самцов (рис 1). Столь значительный рост сократительной реакции аорты старых самок на воздействие ATII вероятно обусловлен падением уровня экспрессии генов ACE2, MasR и ACE в стареющих сосудах (рис. 2, 3). В отличие от крыс самок у старых самцов в сосудах не было выявлено возрастных изменений экспрессии генов основных регуляторных белков как классической ACE/ATII/AT1R, так и альтернативной ACE2/AT(1–7)/MasR осей RAS.
Тканеспецифическая активация RAS, связанная с процессом старения, была продемонстрирована на примере различных органов, включая сердце (Wang et al., 2010; Yoon, Choi, 2014; Yoon et al., 2016). ATII действует как модулятор ремоделирования желудочков после инфаркта миокарда и может вызывать гипертрофию и фиброз сердца за счет прямого воздействия на сердце независимо от артериального давления (De Smet et al., 2003; Dasgupta, Zhang, 2011). Клеточные процессы, которые запускает ATII в сердце в основном опосредованы AT1AR. Было обнаружено, что AT1AR индуцирует экспрессию β-трансформирующего фактора (TGFβ1), за счет которого реализуется гипертрофический рост кардиомиоцитов (Campbell, Katwa, 1997; Kupfahl et al., 2002; Schulz et al., 2002). Активация сигнального каскада от рецепторов TGFβ1 также увеличивает ядерную транслокацию белков Smad и транскрипцию генов белков, таких как коллаген, фибронектин и фактор роста соединительной ткани (CTGF) (Lim, Zhu, 2006). Таким образом, индуцированные ATII/TGFβ1 аутокринно-паракринные клеточные ответы в фибробластах, интерстиции миокарда и кардиомиоцитах вызывают гипертрофию сердца. Гипертрофические изменения миокарда, вызванные ATII, также могут опосредоваться активацией MAP-киназы и сигнальных каскадов JAK/STAT (Marrero et al., 1995; Paul et al., 2006; Dasgupta, Zhang, 2011; Karnik et al., 2015). AT1R также является мощным медиатором окислительного стресса, что является одним из вредных последствий активации RAS. Активные формы кислорода играют важную роль в прогрессировании сердечно-сосудистой дисфункции и хронической сердечной недостаточности (Seshiah et al., 2002; Taniyama, Griendling, 2003; Touyz, 2005).
Мы обнаружили, что у крыс обоего пола в процессе старения в левом желудочке не изменяется содержание мРНК AT1AR. Важно отметить, что в левом желудочке как молодых, так и старых крыс самок экспрессия AT1AR была, в среднем, на 20% выше, чем у самцов (рис. 4а). В сердце старых самок экспрессия гена ACE остается неизменной, тогда как в миокарде старых самцов уровень мРНК ACE значительно возрастает по сравнению с аналогичными показателями у молодых самцов и самок независимо от их возраста (рис. 4б). Ранее показано, что у половозрелых мышей в сердце самцов в большей степени, чем у самок экспрессируется ACE (Freshour et al., 2002). Выявленные половые различия в экспрессии гена ACE позволяют предположить, что синтез этого фермента значительно усиливается в сердцах стареющих крыс самцов, что приводит к последующей генерации ATII и чрезмерной хронической активации AT1AR-индуцированных внутриклеточных сигнальных каскадов в кардиомиоцитах.
В левом желудочке молодых самок уровень экспрессии генов MasR и ACE2 достоверно выше, чем у молодых самцов, в 1.5 и 1.3 раза соответственно (рис. 5). Однако, с возрастом у самок наблюдалось значительное снижение уровней мРНК MasR и ACE2. Эти данные позволили предположить, что в левом желудочке старых самок (24 мес.) активность альтернативной RAS оси ACE2/AT(1–7)/MasR снижается, что может способствовать усилению повреждающего влияния ATII на функциональную активность миокарда. Кардиопротекторный эффект эстрогенов продемонстрирован в многочисленных исследованиях. В сердце мышей, подвергшихся овариэктомии, было обнаружено снижение экспрессии генов ACE2, MasR и AT2R и увеличение экспрессии AT1R, что свидетельствует о нарушении баланса между осями RAS: ACE/ATII/AT1R и ACE2/AT(1–7)/MasR (Borges et al., 2017).
В отличие от крыс самок, в левом желудочке старых самцов уровень мРНК MasR не снижался, а, напротив, увеличился на 71% по сравнению со значениями в сердце молодых самцов (рис. 5а). Биологические функции MasR в сердце менее изучены, чем в сосудах. Экспрессия MasR обнаруживается в кардиомиоцитах, сердечных фибробластах и клетках синоатриального узла (Ferreira et al., 2011). MasR– это GPCR, который обладает высокой конститутивной активностью, взаимодействуя с белками Gαi, Gαq, Gαq/11, Gα12/13 (Canals et al., 2006; Zang et al., 2012; Tirupula et al., 2014; Karnik et al., 2015). Сложность изучения функционального значения MasR-индуцированной передачи сигналов обусловлена не только их высокой конститутивной активностью и взаимодействием с различными G-белками, но и способностью образовывать гетеродимеры с рецепторами ангиотензина AT1R и AT2R и брадикинина B2R. Образование гетеродимеров существенно влияет на десенсибилизацию, транспортные свойства и передачу сигналов каждого из рецепторов, входящих в комплекс (Castro et al., 2005; Rukavina Mikusic et al., 2020).
Влияние MasR на функцию сердца в основном оценивалась по эффектам AT(1–7)(Santos et al., 2019). Одним из основных эффектов AT(1–7) является стимуляция сигнального каскада PI3K-Akt, что приводит к увеличению активности eNOS и nNOS и синтеза NO в кардиомиоцитах (Sampaio et al., 2007; Dias-Peixoto et al., 2008; Costa et al., 2010). Показано, что активация NO/cGMP сигнального пути ингибирует ATII-индуцированную транслокацию ядерного фактора активированных Т-клеток (NFAT) и предотвращает патологическое ремоделирование кардиомиоцитов (Gomes et al., 2010, 2012). Однако роль в этих процессах MasR остается не ясной, поскольку AT(1–7) может регулировать сердечно-сосудистую систему независимо от них посредством AT1R и AT2R (Clark et al., 2001; Walters et al., 2005).
Конститутивная активность MasR в сверхэкспрессирующих клетках активирует передачу сигналов от G-белков (Gomes et al., 2012; Tirupula et al., 2014). Сверхэкспрессия MasR в кардиомиоцитах новорожденных крыс приводит к развитию гипертрофии миоцитов. Эти эффекты происходят через активацию сигнального пути Gαq/PLC/ IP3/Ca2+ (Zhang et al., 2012). Агонисты MasR активируют передачу сигналов Gαq и уменьшают коронарный кровоток в изолированных сердцах мышей и крыс. Напротив, обработка изолированных сердец крыс обратным агонистом приводит к улучшению коронарного кровотока, снижению желудочковых аритмий и апоптоза кардиомиоцитов после ишемического реперфузионного повреждения сердца. Ранее показано, что у мышей с нокаутом MasR размер инфаркта был меньше, чем у мышей с физиологической экспрессией MasR (Santos et al., 2006; Zhang et al., 2012). Авторы полагают, что активация MasR во время инфаркта миокарда усугубляет течение процесса, а ингибирование передачи сигнала Gαq/PLC/IP3/Ca2+может обеспечить новую терапевтическую стратегию, направленную на кардиопротекцию.
ЗАКЛЮЧЕНИЕ
Таким образом, у крыс самок в процессе старения повышается чувствительность аорты к вазоконстрикторному действию ATII, что, по-видимому, связано со снижением экспрессии генов ACE2 и MasR и дисбалансом прессорного и депрессорного эффектов RAS в сторону первого. В отличие от самок, у старых самцов реактивность аорты по отношению к действию ATII не изменяется, что может быть обусловлено отсутствием значимых возрастных изменений уровней экспрессии важнейших регуляторных белков RAS. Установлено, что в процессе старения в левом желудочке крыс самок снижается активность ACE2/AT(1–7)/MasR сигналинга, у самцов, напротив, повышается в результате почти двукратного увеличения содержания мРНК MasR при неизменном уровне мРНК ACE2. Многообразие и разнонаправленность эффектов MasR, обусловленных высокой конститутивной активностью и их взаимодействием с различными G-белками, позволяют предположить, что возраст-ассоциированное как снижение (у самок крыс), так и повышение (у самцов) экспрессии гена MasR в левом желудочке старых крыс может негативно влиять на функциональную активность стареющего сердца. Выявленные возрастные изменения функциональной активности и экспрессии генов основных регуляторных белков RAS в сосудах и сердце могут быть факторами риска развития сердечно-сосудистых заболеваний в старости и влиять на динамику их возникновения в зависимости от пола животного.
Соблюдение этики в работе с животными. Исследование проведено в соответствии с рекомендациями этического комитета Института общей патологии и патофизиологии и было одобрено Комитетом по этике (протокол утверждения проекта № 5 от 7 июня 2019 г.; протокол окончательного утверждения № 1а от 2 октября 2020). Благополучие животных соответствовало приказу Министерства здравоохранения РФ № 708н “Об установлении правил лабораторной практики” от 23.08.2010 г. и этическим стандартам, изложенным в Хельсинкской декларации о надлежащей лабораторной практике (GLP). (2000).
Финансирование. Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (0520-2019-0024).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Boese A.C., Kim S.C., Yin Ke-Jie, Lee Jean-Pyo, Hamblin M.H. Sex differences in vascular physiology and pathophysiology: estrogen and androgen signaling in health and disease // Am. J. Physiol. Heart Circ. Physiol. 2017. V. 313(3). P. 524–545. https://doi.org/10.1152/ajpheart.00217.2016
Borges C.C., Penna-de-Carvalho A., Medeiros Junior J.L., Aguila M.B., Mandarim-de-Lacerda C.A. Ovariectomy modify local renin-angiotensin-aldosterone system gene expressions in the heart of ApoE (−/−) mice // Life Sci. 2017. V. 191. P. 1–8. https://doi.org/10.1016/j.lfs.2017.10.002
Campbell S.E., Katwa L.C. Angiotensin II stimulated expression of transforming growth factor-β1 in cardiac fibroblasts and myofibroblasts // J. Mol. Cell. Cardiol. 1997. V. 29. P. 1947–1958. https://doi.org/10.1006/jmcc.1997.0435
Canals M., Jenkins L., Kellett E., Milligan G. Up-regulation of the angiotensin II type 1 receptor by the MAS proto-oncogene is due to constitutive activation of Gq/G11 by MAS // J. Biol. Chem. 2006. V. 281(24). P. 16757–16767. https://doi.org/10.1074/jbc.M601121200
Castro C.H., Santos R.A.S., Ferreira A.J., Bader M., Alenina N., Almeida A.P. Evidence for a functional interaction of the angiotensin-(1-7) receptor Mas with AT1 and AT2 receptors in the mouse heart // Hypertension. 2005. V. 46(4). P. 937–942. https://doi.org/10.1161/01.hyp.0000175813.04375.8a
Clark M.A., Tallant E.A., Diz D.I. Downregulation of the AT1A receptor by pharmacologic concentrations of angiotensin-(1-7) // J. Cardiovasc. Pharmacol. 2001. V. 37(4). P. 437–448. https://doi.org/10.1097/00005344-200104000-00011
Costa M.A., Lopez Verrilli M.A., Gomez K.A., Nakagawa P., Peña C., Arranz C., Gironacci M.M. Angiotensin-(1-7) upregulates cardiac nitric oxide synthase in spontaneously hypertensive rats // Am. J. Physiol. – Hear. Circ. Physiol. 2010. V. 299(4). P. 1205–1211. https://doi.org/10.1152/ajpheart.00850.2009
Dasgupta C., Zhang L. Angiotensin II receptors and drug discovery in cardiovascular disease // Drug Discov. Today. 2011. V. 16(1–2). P. 22–34. https://doi.org/10.1016/j.drudis.2010.11.016
De Smet H.R., Menadue M.F., Oliver J.R., Phillips P.A. Endothelin ETA receptor antagonism does not attenuate angiotensin II-induced cardiac hypertrophy in vivo in rats // Clin. Exp. Pharmacol. Physiol. 2003. V. 30(4). P. 278–283. https://doi.org/10.1046/j.1440-1681.2003.03831.x
Dias-Peixoto M.F., Santos R.A.S., Gomes E.R.M., Alves M.N.M., Almeida P.W.M., Greco L., Rosa M., Fauler B., Bader M., Alenina N. et al. Molecular mechanisms involved in the angiotensin-(1–7)/mas signaling pathway in cardiomyocytes // Hypertension 2008. V. 52(3). P. 542–548. https://doi.org/10.1161/HYPERTENSIONAHA.108.114280
Donato A.J., Morgan R.G., Walker A.E., Lesniewski L.A. Cellular and molecular biology of aging endothelial cells // J. Mol. Cell. Cardiol. 2015. V. 89 (Pt B). P. 122–135. https://doi.org/10.1016/j.yjmcc.2015.01.021
Endlich P.W., Claudio E.R.G., Lima L.C.F., Ribeiro Júnior R.F., Peluso A.A.B., Stefanon I., Bissoli N.S., Lemos V.S., Santos R.A.S., Abreu G.R. Exercise modulates the aortic renin-angiotensin system independently of estrogen therapy in ovariectomized hypertensive rats // Peptides. 2017. V. 87. P. 41–49. https://doi.org/10.1016/j.peptides.2016.11.010
Ferreira A.J., Moraes P.L., Foureaux G., Andrade A.B., Santos R.A.S., Almeida A.P. The angiotensin-(1–7)/mas receptor axis is expressed in sinoatrial node cells of rats // J. Histochem. Cytochem. 2011. V. 59(8). P. 761–768. https://doi.org/10.1369/0022155411411712
Fischer M., Baessler A., Schunkert H. Renin angiotensin system and gender differences in the cardiovascular system // Cardiovasc. Res. 2002. V. 53(3). P. 672–677. https://doi.org/10.1016/s0008-6363(01)00479-5
Freshour J.R., Chase S.E., Vikstrom K.L. Gender differences in cardiac ACE expression are normalized in androgen-deprived male mice // Am. J. Physiol. – Hear. Circ. Physiol. 2002. V. 283(5). P. 1997–2003. https://doi.org/10.1152/ajpheart.01054.2001
Gomes E.R.M., LaraA.A., Almeida P.W.M., Guimarães D., Resende R.R., Campagnole-Santos M.J., Bader M., Santos R.A.S., Guatimosim S. Angiotensin-(1-7) prevents cardiomyocyte pathological remodeling through a nitric oxide/guanosine 3',5'-cyclic monophosphate-dependent pathway // In Proceedings of the Hypertension. 2010. V. 55(1). P. 153–160. https://doi.org/10.1161/HYPERTENSIONAHA.109. 143255
Gomes E.R.M., Santos R.A.S., Guatimosim S. Angiotensin-(1-7)-mediated signaling in cardiomyocytes // Int. J. Hypertens. 2012. V. 2012. P. 493129. https://doi.org/10.1155/2012/493129
Karnik S.S., Unal H., Kemp J.R., Tirupula K.C., Eguchi S., Vanderheyden P.M.L., Thomas W.G. International Union of Basic and Clinical Pharmacology. XCIX. Angiotensin Receptors: Interpreters of Pathophysiological Angiotensinergic Stimuli [corrected] // Pharmacol. Rev. 2015. V. 67. P. 754–819. https://doi.org/10.1124/pr.114.010454
Kavousi M. Differences in Epidemiology and Risk Factors for Atrial Fibrillation Between Women and Men // Front. Cardiovasc. Med. 2020. V. 7. P. 3. https://doi.org/10.3389/fcvm.2020.00003
Kupfahl C., Pink D., Friedrich K., Zurbrügg H.R., Neuss M., Warnecke C., Fielitz J., Schultz J.E.J., Witt S.A., Glascock B.J., Nieman M.L., Reiser P.J., Nix S.L., Kimball T.R., Doetschman T. TGF-β1 mediates the hypertrophic cardiomyocyte growth induced by angiotensin II // J. Clin. Invest. 2002. V. 109(6). P. 787–796. https://doi.org/10.1172/jci200214190
Lacolley P., Regnault V., Avolio A.P. Smooth muscle cell and arterial aging: Basic and clinical aspects // Cardiovasc. Res. 2018. V. 114(4). P. 513–528. https://doi.org/10.1093/cvr/cvy009
Lakatta E.G. So! What’s aging? Is cardiovascular aging a disease? // J. Mol. Cell. Cardiol. 2015. V. 83. P. 1–13. https://doi.org/10.1016/j.yjmcc.2015.04.005
LeBlanc A.J., Reyes R., Kang L.S., Dailey R.A., Stallone J.N., Moningka N.C., Muller-Delp J.M. Estrogen replacement restores flow-induced vasodilation in coronary arterioles of aged and ovariectomized rats // Am. J. Physiol. – Regul. Integr. Comp. Physiol. 2009. V. 297(6). P. 1713–1723. https://doi.org/10.1152/ajpregu.00178.2009
LeBlanc A.J., Chen B., Dougherty P.J., Reyes R.A., Shipley R.D., Korzick D.H., Muller-Delp J.M. Divergent effects of aging and sex on vasoconstriction to endothelin in coronary arterioles // Microcirculation. 2013. V. 20(5). P. 365–376. https://doi.org/10.1111/micc.12028
Lim H., Zhu Y.Z. Role of transforming growth factor-β in the progression of heart failure // Cell. Mol. Life Sci. 2006. V. 63. P. 2584–2596. https://doi.org/10.1007/s00018-006-6085-8
Lima R., Wofford M., Reckelhoff J.F. Hypertension in postmenopausal women // Curr. Hypertens. Rep. 2012. V. 14. P. 254–260. https://doi.org/10.1007/s11906-012-0260-0
Lin Y.K., Chen Y.A., Lee T.I., Chen Y.C., Chen S.A., Chen Y.J. Aging modulates the substrate and triggers remodeling in atrial fibrillation // Circ. J. 2018. V. 82(5). P. 1237–1244. https://doi.org/10.1253/circj.CJ-17-0242
Magnani J.W., Moser C.B., Murabito J.M., Nelson K.P., Fontes J.D., Lubitz S.A., Sullivan L.M., Ellinor P.T., Benjamin E.J. Age of natural menopause and atrial fibrillation: The Framingham Heart Study // Am. Heart J. 2012. V. 163(4). P. 729–734. https://doi.org/10.1016/j.ahj.2012.01.010
Magnani J.W., Moser C.B., Murabito J.M., Sullivan L.M., Wang N., Ellinor P.T., Vasan R.S., Benjamin E.J., Coviello A.D. Association of sex hormones, aging, and atrial fibrillation in men the framingham heart study // Circ. Arrhythmia Electrophysiol. 2014. V. 7(2). P. 307–312. https://doi.org/10.1161/CIRCEP.113.001322
Marrero M.B., Schieffer B., Paxton W.G., Heerdt L., Berk B.C., Delafontaine P., Bernstein K.E. Direct stimulation of Jak/STAT pathway by the angiotensin II AT1 receptor // Nature. 1995. V. 375(6528). P. 247–250. https://doi.org/10.1038/375247a0
Mazzaro L., Almasi S.J., Shandas R., Seals D.R., Gates P.E. Aortic input impedance increases with age in healthy men and women // Hypertension. 2005. V. 45(6). P. 1101–1106. https://doi.org/10.1161/01.HYP.0000164579.73656.c4
Mehta P.K., Griendling K.K. Angiotensin II cell signaling: Physiological and pathological effects in the cardiovascular system // Am. J. Physiol. – Cell Physiol. 2007. V. 292(1). P. 82–97. https://doi.org/10.1152/ajpcell.00287.2006
Meyer M.R., Fredette N.C., Barton M., Prossnitz E.R. Endothelin-1 but not angiotensin II contributes to functional aging in murine carotid arteries // Life Sci. 2014. V. 118(2). P. 213–1218. https://doi.org/10.1016/j.lfs.2014.02.027
Mouat M.A., Coleman J.L.J., Smith N.J. GPCRs in context: sexual dimorphism in the cardiovascular system // Br. J. Pharmacol. 2018. V. 175(21). P. 4047–4059. https://doi.org/10.1111/bph.14160
Mulvany M.J., Halpern W. Contractile properties of small arterial resistance vessels in spontaneously hypertensive and normotensive rats // Circ. Res. 1977. V. 41. P. 19–26. https://doi.org/10.1161/01.RES.41.1.19
Olivetti G., Giordano G., Corradi D., Melissari M., Lagrasta C., Gambert S.R., Anversa P. Gender differences and aging: Effects on the human heart // J. Am. Coll. Cardiol. 1995. V. 26(4). P. 1068–1079. https://doi.org/10.1016/0735-1097(95)00282-8
Paul M., Mehr A.P., Kreutz R. Physiology of local renin-angiotensin systems // Physiol. Rev. 2006. V. 86(3). P. 747–803. https://doi.org/10.1152/physrev.00036.2005
Quinn U., Tomlinson L.A., Cockcroft J.R. Arterial stiffness // JRSM Cardiovasc. Dis. 2012. V. 1(6). P. cvd.2012.012024. https://doi.org/10.1258/cvd.2012.012024
Rodríguez-Mañas L., El-Assar M., Vallejo S., López-Dóriga P., Solís J., Petidier R., Montes M., Nevado J., Castro M., Gómez-Guerrero C., Peiró C., Carlos F Sánchez-Ferrer C.F. Endothelial dysfunction in aged humans is related with oxidative stress and vascular inflammation // Aging Cell. 2009. V. 8(3). P. 226–238. https://doi.org/10.1111/j.1474-9726.2009.00466.x
Rukavina Mikusic N.L., Silva M.G., Pineda A.M., Gironacci M.M. Angiotensin Receptors Heterodimerization and Trafficking: How Much Do They Influence Their Biological Function? // Front. Pharmacol. 2020. V. 11. P. 1–20. https://doi.org/10.3389/fphar.2020.01179
Saeed Y., Temple I.P., Borbas Z., Atkinson A., Yanni J., Maczewski M., Mackiewicz U., Aly M., Logantha S.J.R.J., Garratt C.J., Dobrzynski H. Structural and functional remodeling of the atrioventricular node with aging in rats: The role of hyperpolarization-activated cyclic nucleotide–gated and ryanodine 2 channels // Heart Rhythm. 2018. V. 15(5). P. 752–760. https://doi.org/10.1016/j.hrthm.2017.12.027
Sampaio W.O., Dos Santos R.A.S., Faria-Silva R., Da Mata Machado L.T., Schiffrin E.L., Touyz R.M. Angiotensin-(1-7) through receptor Mas mediates endothelial nitric oxide synthase activation via Akt-dependent pathways // Hypertension. 2007. V. 49(1). P. 185–192. https://doi.org/10.1161/01.HYP.0000251865.35728.2f
Sampson A.K., Hilliard L.M., Moritz K.M., Thomas M.C., Tikellis C., Widdop R.E., Denton K.M. The arterial depressor response to chronic low-dose angiotensin II infusion in female rats is estrogen dependent // Am. J. Physiol. – Regul. Integr. Comp. Physiol. 2012. V. 302(1). P. 159–165. https://doi.org/10.1152/ajpregu.00256.2011
Santos R.A.S., Castro C.H., Gava E., Pinheiro S.V.B., Almeida A.P., De Paula R.D., Cruz J.S., Ramos A.S., Rosa K.T., Irigoyen M.C., Bader M., Alenina N., Kitten G.T., Ferreira A. J. Impairment of in vitro and in vivo heart function in angiotensin-(1-7) receptor mas knockout mice // Hypertension. 2006. V. 47(5). P. 996–1002. https://doi.org/10.1161/01.HYP.0000215289.51180.5c
Santos R.A.S., Oudit G.Y., Verano-Braga T., Canta G., Steckelings U.M., Bader M. The renin-angiotensin system: Going beyond the classical paradigms // Am. J. Physiol. - Hear. Circ. Physiol. 2019. V. 316(5). P. 958–970. https://doi.org/10.1152/ajpheart.00723.2018
Schultz J.E.J., Witt S.A., Glascock B.J., Nieman M.L., Reiser P.J., Nix S.L., Kimball T.R., Doetschman T. TGF-β1 mediates the hypertrophic cardiomyocyte growth induced by angiotensin II // J. Clin. Invest. 2002. V. 109(6). P. 787–796. https://doi.org/10.1172/jci200214190
Seshiah P.N., Weber D.S., Rocic P., Valppu L., Taniyama Y., Griendling K.K. Angiotensin II stimulation of NAD(P)H oxidase activity: Upstream mediators // Circ. Res. 2002. V. 91(5). P. 406–413. https://doi.org/10.1161/01.RES.0000033523.08033.16
Sheydina A., Riordon D.R., Boheler K.R. Molecular mechanisms of cardiomyocyte aging // Clin Sci (Lond). 2011. V. 121(8). P. 315–329. https://doi.org/10.1042/CS20110115
Stanhewicz A.E., Wenner M.M., Stachenfeld N.S. Sex differences in endothelial function important to vascular health and overall cardiovascular disease risk across the lifespan // Am. J. Physiol. – Hear. Circ. Physiol. 2018. V. 315(6). P. 1569–1588. https://doi.org/10.1152/ajpheart.00396.2018
Taddei S., Galetta F., Virdis A., Ghiadoni L., Salvetti G., Franzoni F., Giusti C., Salvetti A. Physical activity prevents age-related impairment in nitric oxide availability in elderly athletes // Circulation. 2000. V. 101(25). P. 2896–2901. https://doi.org/10.1161/01.CIR.101.25.2896
Taniyama Y., Griendling K.K. Reactive Oxygen Species in the Vasculature: Molecular and Cellular Mechanisms // Hypertension. 2003. V. 42(6). P. 1075–1081. https://doi.org/10.1161/01.HYP.0000100443.09293.4F
Thijssen D.H.J., Carter S.E., Green D.J. Arterial structure and function in vascular ageing: Are you as old as your arteries? // J. Physiol. 2016. V. 594(8). P. 2275–2284. https://doi.org/10.1113/JP270597
Tirupula K.C., Desnoyer R., Speth R.C., Karnik S.S. Atypical signaling and functional desensitization response of MAS receptor to peptide ligands // PLoS One. 2014. V. 9(7). P. e103520. https://doi.org/10.1371/journal.pone.0103520
Touyz R.M. Intracellular mechanisms involved in vascular remodelling of resistance arteries in hypertension: Role of angiotensin II // In Proceedings of the Experimental Physiology. 2005. V. 90(4). P. 449–455. https://doi.org/10.1113/expphysiol.2005.030080
Tsuneda T., Yamashita T., Kato T., Sekiguchi A., Sagara K., Sawada H., Aizawa T., Fu L.T., Fujiki A., Inoue H. Deficiency of testosterone associates with the substrate of atrial fibrillation in the rat model // J. Cardiovasc. Electrophysiol. 2009. V. 20(9). P. 1055–1060. https://doi.org/10.1111/j.1540-8167.2009.01474.x
Ungvari Z., Tarantini S., Donato A.J., Galvan V., Csiszar A. Mechanisms of vascular aging // Circ. Res. 2018. V. 123(7). P. 849–867. https://doi.org/10.1161/CIRCRESAHA.118.311378
Verdecchia P., Cavallini C., Spanevello A., Angeli F. The pivotal link between ACE2 deficiency and SARS-CoV-2 infection // Eur. J. Intern. Med. 2020. V. 76. P. 14–20. https://doi.org/10.1016/j.ejim.2020.04.037
Walters P.E., Gaspari T.A., Widdop R.E. Angiotensin-(1-7) acts as a vasodepressor agent via angiotensin II type 2 receptors in conscious rats // Hypertension. 2005. V. 45(5). P. 960–966. https://doi.org/10.1161/01.HYP.0000160325.59323.b8
Wang M., Shah A.M. Age-associated pro-inflammatory remodeling and functional phenotype in the heart and large arteries // J. Mol. Cell. Cardiol. 2015. V. 83. P. 101–111. https://doi.org/10.1016/j.yjmcc.2015.02.004
Wang M., Zhang J., Walker S.J., Dworakowski R., Lakatta E.G., Shah A.M. Involvement of NADPH oxidase in age-associated cardiac remodeling // J. Mol. Cell. Cardiol. 2010. V. 48(4). P. 765–772. https://doi.org/10.1016/j.yjmcc.2010.01.006
Wirth A., Wang S., Takefuji M., Tang C., Althoff T.F., Schweda F., Wettschureck N., Offermanns S. Age-dependent blood pressure elevation is due to increased vascular smooth muscle tone mediated by G-protein signalling // Cardiovasc. Res. 2016. V. 109(1). P. 131–140. https://doi.org/10.1093/cvr/cvv249
Yamamoto R., Akazawa H., Ito K., Toko H., Sano M., Yasuda N., Qin Y., Kudo Y., Sugaya T., Chien K.R., Komuro I. Angiotensin II type 1a receptor signals are involved in the progression of heart failure in MLP-deficient mice // Circ. J. 2007. V. 71(12). P. 1958–1964. https://doi.org/10.1253/circj.71.1958
Yoon H.E., Choi B.S. The renin-angiotensin system and aging in the kidney // Korean J. Intern. Med. 2014. V. 29(3). P. 291–295. https://doi.org/10.3904/kjim.2014.29.3.291
Yoon H.E., Kim E.N., Kim M.Y., Lim J.H., Jang I.A., Ban T.H., Shin S.J., Park C.W., Chang Y.S., Choi B.S. Age-associated changes in the vascular renin-angiotensin system in vice // Oxid. Med. Cell. Longev. 2016. V. 2016. P. 6731093. https://doi.org/10.1155/2016/6731093
Zhang T., Li Z., Dang H., Chen R., Liaw C., Tran T.A., Boatman P.D., Connolly D.T., Adams J.W. Inhibition of Mas G-protein signaling improves coronary blood flow, reduces myocardial infarct size, and provides long-term cardioprotection // Am. J. Physiol. – Hear. Circ. Physiol. 2012. V. 302(1). P. 299–311. https://doi.org/10.1152/ajpheart.00723.2011
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая