Известия РАН. Серия биологическая, 2023, № 3, стр. 308-320
Исходный тип вегетативной регуляции определяет развитие инфаркта у крыс в модели необратимой ишемии миокарда
М. П. Морозова 1, *, А. Д. Куренкова 2, Ю. Л. Волкова 3, А. Б. Бердалин 4, Е. Н. Банзелюк 1, Б. А. Умарова 5, Е. В. Лукошкова 6, С. А. Гаврилова 1
1 Факультет фундаментальной медицины МГУ им. М.В. Ломоносова
119991 Москва, Россия
2 Институт регенеративной медицины, ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет)
119991 Москва, Россия
3 Институт Физиологии, Университет Цюриха
8057 Цюрих, Швейцария
4 ФГБУ “Федеральный центр мозга и нейротехнологий” ФМБА
117513 Москва, Россия
5 Биологический факультет, МГУ им. М.В. Ломоносова
119234 Москва, Россия
6 ФГБУ “НМИЦ кардиологии Министерства здравоохранения РФ”
121552 Москва, Россия
* E-mail: mormasha@gmail.com
Поступила в редакцию 14.03.2022
После доработки 25.05.2022
Принята к публикации 30.05.2022
- EDN: HAPEFA
- DOI: 10.31857/S102634702270007X
Аннотация
Методом анализа вариабельности ритма сердца (ВРС) у крыс оценивали связь исходного уровня общей ВРС и регуляторные изменения в работе сердца до и на 1, 3 и 28 сут после моделирования необратимой ишемии (НИ). По уровню общей ВРС выделили две группы крыс: с исходно “низкимˮ и “высокимˮ уровнем ВРС - группы НВ (SDRR = 5.0 мс) и ВВ (SDRR = 8.2 мс). НВ и ВВ крысы по-разному реагировали на холодовую пробу до и после НИ. Через 3 сут после НИ у НВ крыс была лучшая сохранность вегетативной регуляции сердца, а через 28 сут – меньший размер поражения миокарда и смертность. У ВВ крыс в очаге ишемии было выше число тучных клеток, а в зоне, незатронутой ишемией, – выше доля дегранулированных клеток, чем у НВ крыс. Таким образом, исходное состояние вегетативной нервной системы определяет развитие инфаркта миокарда у крыс.
По анализу вариабельности ритма сердца (ВРС) и соотношению вкладов парасимпатического и симпатического отделов ВНС (пВНС и сВНС) в управление ритмом сердца можно определить тип вегетативной регуляции функций в организме (Giuliano et al., 2018, Морозова и др., 2020). Так, в популяции здоровых людей выделяют лиц ваготоников, характеризующихся преобладанием вклада пВНС в регуляцию хронотропной функции сердца, симпатикотоников – с преобладанием вклада сВНС – и нормотоников – с примерно одинаковым участием пВНС и сВНС в сопровождении работы сердца (Kotenko et al., 2014). В зависимости от типа вегетативной регуляции люди могут иметь различный адаптационный потенциал в условиях стресса: от способности достигать результатов в определенных видах спорта (Aubert et al., 2003, Шлык, Зуфарова, 2013) до эмоциональной чувствительности к изменениям жизненных обстоятельств (Luecken, Appelhans, 2006). Мы предполагаем, что исходные особенности влияния ВНС на работу сердца могут определять адаптационный потенциал организма не только к предъявлению мягких стрессорных воздействий, но и при развитии патологии.
Патогенез инфаркта миокарда сопровождается гибелью части сердечной мышцы, сильным болевым синдромом и падением насосной функции сердца. Это приводит к запуску стресс-реакции, заключающейся в компенсаторной активации гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) и усилению влияния сВНС на работу сердца для поддержания достаточного уровня перфузии тканей организма (Ciarka et al., 2008; Goldberger et al., 2019). В клинической практике на основании анализа многочисленных данных показано, что снижение ВРС (в частности, параметра SDNN ниже 50 мс) после инфаркта миокарда сильно коррелирует с риском повторных сердечно-сосудистых событий и неблагоприятным прогнозом на продолжительность жизни (Kleiger et al., 1987; Carpeggiani et al., 2004; Huikuri, Stein, 2012; Goldberger et al., 2019).
Кроме того, вегетативная нервная система оказывает регуляторное воздействие на реализацию иммунных функций в организме, что привело к появлению понятия “воспалительного рефлексаˮ (Tracey et al., 2002). Высвобождение цитокинов и других медиаторов воспаления макрофагами, дендритными клетками и другими иммунными клетками воспринимается местными афферентными волокнами, которые в составе блуждающего нерва несут информацию в продолговатый мозг, в ГГНС, в передний мозг и на эфферентные преганглинарные нейроны пВНС. Через высвобождение ацетилхолина и его взаимодействие с α7nAChR происходит подавление экспрессии и высвобождения провоспалительных цитокинов TNFα, IL-1β, IL-6 (Borovikova et al., 2000), а также переключение провоспалительного ответа на процессы пролиферации. Тучные клетки являются важными участниками воспалительного ответа, поскольку сопровождают все стадии его развития, от альтерации до пролиферации. Интересно, что тучные клетки экспрессируют на своей поверхности целый спектр рецепторов к ацетилхолину: как инотропные, так и метаботропные изоформы (Radosa et al., 2011; Shi et al., 2017). Мы предполагаем, что связь вегетативного типа регуляции и функциональных последствий развития воспалительного процесса в сердце после инфаркта миокарда в определённой степени опосредована тучными клетками.
В клинических условиях, в ситуации развития фатальных кардиологических событий у пациента проверка данных гипотез невозможна. Лечащий врач не имеет возможности узнать исходный тип вегетативной регуляции пациента, ни сопоставить его с последствиями инфаркта миокарда, эффективностью и безопасностью назначаемых терапевтических мероприятий. Однако в эксперименте на лабораторных животных данные предположения можно проверить.
Целью данного исследования было изучение связи между исходным типом вегетативной регуляции у крыс, функциональной активностью тучных клеток миокарда и динамикой изменения вегетативной регуляции после моделирования необратимой ишемии миокарда.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальные животные. Исследование выполняли на самцах белых беспородных крыс (n = 350 ± 25 г), которых содержали в условиях вивария с регулируемым световым режимом: 12 ч – день, 12 ч – ночь, со свободным доступом к воде и пище – стандартному гранулированному корму для разведения и содержания лабораторных животных. При работе с экспериментальными животными руководствовались приказом Министерства здравоохранения Российской Федерации № 199н от 01.04.2016 г. “Об утверждении Правил надлежащей лабораторной практикиˮ. На проведение опытов получено разрешение комиссии по биоэтике факультета фундаментальной медицины МГУ им. М.В. Ломоносова.
Перед началом эксперимента всех животных приучали к рукам, взвешивали и оценивали параметры вариабельности ритма сердца.
Регистрация ЭКГ и расчёт параметров ВРС. Для оценки типа вегетативной регуляции методом анализа ВРС у бодрствующих крыс регистрировали ЭКГ в 1-м отведении 20 мин в состоянии спокойного бодрствования и 10 мин после холодовой пробы (ХП) до моделирования инфаркта и на 1, 3 и 28 сут после ишемии. Для выполнения ХП животных переносили в стеклянный куб на пакет со снегом (t = +4°С) на 3 мин.
За сутки до регистрации ЭКГ у крыс удаляли шерсть с верхней части спины с помощью машинки для стрижки животных. В день опыта на оголенные части спины крысы накладывали электроды (Skintact F-301, “Leonhard Lang GmbH”, Австрия), фиксировали их ременным жилетом. Затем животных адаптировали к условиям эксперимента в стеклянном кубе с затемненными стенками в течение 1 ч.
Сигнал с накожных электродов регистрировали с частотой оцифровки 2 кГц с помощью многоканальной системы ECGA (“Hugo Sachs Elektronik”, Германия), подсоединенной через аналогово-цифровой преобразователь E14-140 (“L-CARD”, Россия) к персональному компьютеру, и программы PowerGraph (Россия). Для обработки полученных записей использовали адаптированное для крыс программное обеспечение LabVIEW (“National Instruments”, США), которое обеспечивает как определение длительностей RR-интервалов, предоставляя оператору возможность удалять эктопические комплексы и артефакты, так и последующий расчет необходимых статистических (во временной области) параметров.
По 5-минутным фрагментам записи ЭКГ определяли медиану значений мгновенной ЧСС (HR, уд./мин), и медиану длительности RR-интервалов (RR, мс). Из параметров ВРС, определяемых во временной области, рассчитывали показатели, характеризующие: 1) общую ВРС – стандартное отклонение для RR-интервалов (SDRR, мс) и для ЧСС (SDHR, уд./мин); 2) наиболее быстрые изменения ритма сердца, интерпретируемые как вклад пВНС в общую ВРС – квадратный корень из среднего квадрата разностей величин длительности смежных RR-интервалов синусового происхождения (RMSSD, мс), процент RR-интервалов синусового происхождения, отличающихся от предыдущего более чем на 3 мс – pNN3; 3) относительно медленные изменения ритма, интерпретируемые как вклад сВНС в общую ВРС – SDARR и SDAHR, т.е. стандартные отклонения средних значений RR-интервалов и ЧСС, вычисленных по 1 минутным сегментам записи, аналоги принятого для человека показателя SDANN, рассчитываемого по 5-минутным сегментам.
Перед моделированием необратимой ишемии у всех крыс регистрировали ЭКГ и вычисляли параметры ВРС. После этого по значению показателя общей ВРС, SDRR, с помощью кластеризации методом k-средних животные были разделены на подгруппы с исходно высоким (ВВ) и исходно низким (НВ) уровнем общей ВРС.
Моделирование инфаркта. Инфаркт моделировали у крыс через прокол в межреберье без искусственной вентиляции легких и вскрытия грудной клетки под общей анестезией хлоралгидратом (в/б 400 мг/кг). Необратимую ишемию (НИ) миокарда выполняли перевязкой нисходящей ветви левой коронарной артерии (Selye et al., 1960, Гаврилова и др., 2017). Результаты исследования были объединены и оценены в трех сериях экспериментов.
Характеристика поражения сердца. Через 28 сут после моделирования инфаркта миокарда у эвтаназированных крыс извлекали сердце и по фиброзному кольцу удаляли сосуды и предсердия. Для оценки веса частей сердца последовательно по внутренним границам отделяли правый желудочек, межжелудочковую перегородку (не затрагивая внешнюю стенку левого желудочка). Из передне-боковой стенки левого желудочка вырезали рубец (белесая ткань) и взвешивали правый желудочек, межжелудочковую перегородку, рубец и оставшуюся живую ткань левого желудочка без перегородки и рубца.
Морфофункциональная характеристика тучных клеток миокарда. На 1, 3 и 28 сут опыта крысам под общим наркозом через катетер промывали сердце раствором 4%-ного формалина в фосфатно-солевом буфере (рН 7.4). Образцы ткани сердца инкубировали в 10%-ного растворе формалина в фосфатно-солевом буфере в течение 1 сут и промывали проточной водой в течение 7 ч. С помощью прибора Лаборант (Россия) осуществляли стандартную гистологическую проводку препаратов последовательно через следующие растворы: 50%-ный этиловый спирт – 6 ч, 70%-ный этиловый спирт – 6 ч, 96%-ный этиловый спирт – дважды по 6 ч, 100%-ный этиловый спирт – 6 ч, спирт : : хлороформ 1:1 – 6 ч, хлороформ – 6 ч, хлороформ : : парафин 1:1 – 6 ч, парафин – 5 ч.
Парафиновые срезы толщиной 5 мкм получали на микротоме Microm HM 3559 (“Thermo Fisher Scientific”, США). Гидратацию и дегидратацию осуществляли по стандартной методике с использованием толуола и этанола разной концентрации.
Срезы окрашивали 0.1%-ным раствором толуидинового синего по модифицированному протоколу (Puebla-Osorio et al., 2017). Анализ проводили на микроскопе Imager A1 Axio (Zeiss, Германия).
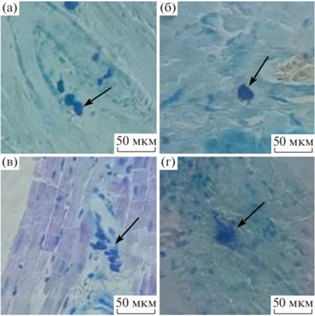
На срезах миокарда определяли количество тучных клеток в пяти полях зрения при увеличении ×400 в трех зонах: передней стенке, межжелудочковой перегородке и задней стенке, не менее чем в четырех кольцевых срезах средней части сердца. Оценивали степень дегрануляции тучных клеток в различных зонах, не менее 8 клеток на зону в разных кольцевых срезах, по баллам: 0 – недегранулированные клетки (рис. 1а); 1 и 2 – слабо и сильно дегранулированные клетки, соответственно (рис. 1б, 1в); 3 – очень сильно дегранулированные клетки, вплоть до потери очертаний (рис. 1 г).
Рис. 1.
Репрезентативные микрофотографии тучных клеток разной степени дегрануляции. Условные обозначения: (а) – недегранулированные клетки; (б, в) – слабо и сильно дегранулированные клетки; (г) – очень сильно дегранулированные клетки.
Статистическую обработку результатов проводили с использованием программного пакета SPSS Statistics версии 23.0 (“IBM”, США). Нулевую гипотезу отвергали при р < 0.05. Для описания количественных переменных применяли медиану и квартили, для качественных – частоту и долю (в процентах).
Соответствие распределения количественных переменных нормальному проверяли методом построения частотных гистограмм и тестом Шапиро–Уилка. Для качественных зависимых переменных сравнения частот между категориями группирующих переменных выполняли посредством критерия χ2 Пирсона или точного критерия Фишера. Для сравнения нескольких связанных групп использовали дисперсионный анализ с повторными измерениями. Последующие попарные сравнения проводили с помощью t-критерия для зависимых выборок с поправкой Бонферрони. При изучении корреляций между количественными переменными использовали метод расчета коэффициента корреляции по Пирсону. C помощью кластерного анализа методом k-средних экспериментальных животных разделяли на высоковариабельных и низковариабельных.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристика крыс в зависимости от их исходного уровня ВРС. Перед моделированием инфаркта миокарда у крыс регистрировали ЭКГ и анализировали параметры ВРС в состоянии покоя. С помощью кластерного анализа методом k-средних популяцию животных разделили на крыс с исходно условно низким уровнем ВРС (НВ; SDRR = 5.0 ± 0.8 мс) и исходно условно высоким уровнем ВРС (ВВ; SDRR = 8.2 ± 0.8 мс). Абсолютные значения медиан показателей ВРС у крыс, полученные в начале эксперимента, представлены в табл. 1.
Таблица 1.
Исходные значения параметров ВРС у крыс с исходно высоким и низким уровнем ВРС
| Параметры ВРС | Крысы с исходно
низким уровнем ВРС (n = 109) |
Крысы с исходно
высоким уровнем ВРС (n = 99) |
|---|---|---|
| RR, мс | 175 (165; 187) | 174 (160; 186) |
| HR, уд./мин | 343 (321; 364) | 345 (324; 376) |
| SDRR, мс | 5.0 (4.2; 5.8) | 8.2 (7.3; 8.9)**** |
| SDHR, уд./мин | 9.5 (7.9; 11.4) | 16.9 (14.5; 20.0)**** |
| RMSSD, мс | 3.1 (2.3; 4.4) | 4.3 (3.0; 5.5)**** |
| pNN3, % | 33 (17; 49) | 40 (25; 55)* |
| SDARR, мс | 2.6 (1.8; 5.2) | 5.3 (2.8; 8.7)**** |
| SDAHR, уд./мин | 5.2 (3.4; 10.2) | 10.6 (5.0; 20.2)**** |
У НВ крыс все показатели ВРС были значимо меньше по сравнению с животными из группы ВВ. При этом ЧСС и длительность RR-интервалов между группами животных не различались.
После выполнения холодовой пробы (ХП) как у НВ, так и у ВВ животных наблюдали увеличение ЧСС на 15% и соответствующее уменьшение на 13% длительности RR-интервалов. Реакция параметров ВРС на предъявление ХП различалась. Так, НВ животные реагировали на ХП увеличением всех показателей общей ВРС: SDRR и SDHR увеличивались на 22 и 84% соответственно. Параметры RMSSD и pNN3, характеризующие вклад парасимпатического отдела ВНС в общую ВРС, уменьшались на 12 и 28% соответственно. А показатели SDARR и SDAHR, характеризующие вклад симпатического отдела ВНС в общую ВРС, напротив, возрастали в 1.8 и 3.3 раза.
Для ВВ крыс после ХП было показано значимое снижение на 13% показателя SDRR и увеличение на 14% – SDHR. Показатели RMSSD и pNN3 уменьшались на 24 и 34%, что по степени реакции значимо не отличалось от группы НВ. Параметры SDARR и SDAHR возрастали на 96 и 109% соответственно, что гораздо менее выражено, чем у НВ крыс.
Таким образом, у ВВ крыс все значения параметров ВРС были значимо выше, чем у НВ животных. В ответ на мягкое стрессорное воздействие показатели вклада парасимпатического отдела изменялись сходным образом, в то время как показатели сВНС у НВ животных реагировали с большей амплитудой.
Влияние инфаркта на ЧСС у крыс с разным исходным уровнем ВРС. Через 1 сут после моделирования необратимой ишемии у крыс развивалась тахикардия: уровень ЧСС увеличивался на 17–26% в популяциях НВ и ВВ крыс. Значимых отличий по степени выраженности тахикардии между группами показано не было. С 3 по 28 сут опыта в обеих группах животных наблюдали восстановление уровня ЧСС к доинфарктным значениям, за исключением того, что у НВ крыс к 28 сут эксперимента появилась тенденция к развитию брадикардии: произошло уменьшение на 5% ЧСС (р = 0.058).
После моделирования НИ выполнение теста с холодовым воздействием показало, что через 1 сут у НВ крыс параметр ЧСС реагирует значимым увеличением на 7%, а через 3 и 28 сут на уровне тенденции возрастает примерно в 2 раза (р = 0.08). У ВВ крыс на всех сроках после моделирования НИ ответ параметров ЧСС сохранялся на доинфарктном уровне.
Динамика параметров ВРС в модели необратимой ишемии миокарда
В состоянии спокойного бодрствования. Через 1 сут после развития инфаркта у НВ крыс наблюдали уменьшение на 25–43% всех показателей общей ВРС. Значения параметров RMSSD и pNN3 уменьшились на 32–74%, а параметров SDARR и SDAHR – на 60-69%. На 3 сут опыта все показатели ВРС у НВ крыс не отличались от исходных значений. Через 28 сут после НИ значения показателей RMSSD значимо возросли в 2 раза по сравнению с исходным уровнем, тогда как показатели общей ВРС и параметры SDARR и SDAHR не отличались от исходной нормы (рис. 2).
Рис. 2.
Параметры ВРС у НВ и ВВ крыс до и на 1, 3, 28 сут после моделирования НИ. Условные обозначения: * – р < 0.05, ** – р < 0.01, *** – р < 0.001, **** – р < 0.0001 – статистически значимые отличия от показателя до моделирования НИ в соответствующей группе.
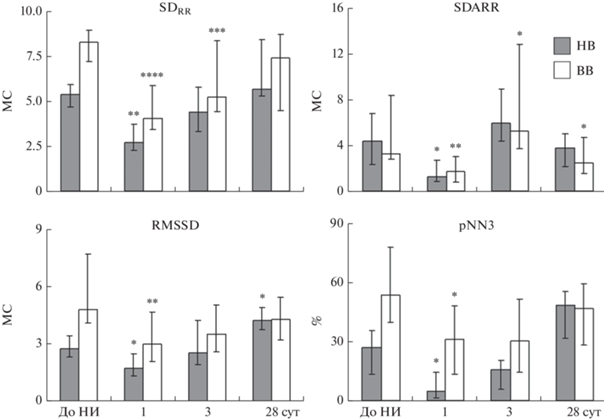
У ВВ крыс через 1 сут после моделирования НИ наблюдали снижение всех показателей ВРС: SDRR, SDHR – на 26–47%, показателей RMSSD и pNN3 – на 55 и 48%, SDARR и SDAHR – на 66 и 56%, соответственно. К 3 сут опыта параметры RMSSD и pNN3 восстанавливались до исходного уровня, тогда как показатели общей ВРС и вклада сВНС в общую ВРС оставались все еще сниженными на уровне 1 сут после операции. К 28 сут эксперимента наблюдали восстановление структуры ВРС, за исключением сниженных на 36 и 53% значений параметров SDARR и SDAHR (рис. 2).
Реакция на ХП. Через 1 сут после НИ предъявление ХП сопровождалось увеличением в 2 и 1.5 раза параметров SDARR и SDAHR у НВ крыс. Остальные параметры ВРС в ответ на ХП не изменялись, что отличалось от реакции параметров ВРС до моделирования инфаркта. Через 3 и 28 сут развития НИ подобная картина ответа показателей ВРС на ХП сохранялась, однако отмечена тенденция к возвращению чувствительности показателей RMSSD и pNN3: они отвечали снижением своего уровня на 13% (p = 0.06) и 37% (p < 0.008) соответственно (рис. 3).
Рис. 3.
Реакция параметров ВРС на предъявление ХП до и на 1, 3, 28 сут после моделирования НИ у НВ и ВВ крыс. Условные обозначения: * – р < 0.05, ** – р < 0.01 – статистически значимые отличия ответа в дельта % от уровня покоя – ось Х; # – р < 0.1 – тенденция к отличию от уровня покоя.
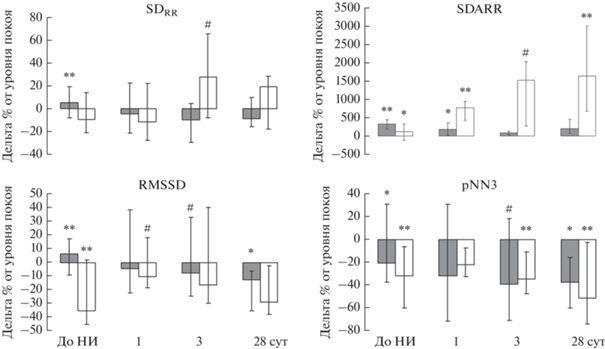
Выполнение ХП через 1 сут после НИ у ВВ крыс не выявило значимого изменения показателей общей ВРС. После теста наблюдали тенденцию к уменьшению на 18% параметра pNN3, что в 2 раза меньше, чем было исходно до инфаркта. Однако SDARR и SDAHR после ХП были увеличены в 6.7 и 8.7 раза соответственно, т. е их чувствительность к функциональному тесту была увеличена трехкратно по сравнению с доинфарктной степенью реакции. Через 3 сут после операции выполнение ХП у ВВ крыс приводило к увеличению показателей общей ВРС SDRR и SDHR на 43 (p = 0.09), и 84% соответственно, что существенно отличается от реакции до операции и реакции параметров через 1 сут после НИ. Детальное рассмотрение ответа на ХП показало, что параметр pNN3 значимо снижался на 27%, тогда как для SDARR и SDAHR наблюдали тенденцию к увеличению в 9.7 (р = 0.07) и 16 раз (р = 0.07) соответственно. Через 28 сут после моделирования НИ у ВВ крыс реакция на ХП не затрагивала показатели общей ВРС, но выявляла снижение на 62% ответа pNN3 и рост в 11.4 и 17.3 раза параметров SDARR и SDAHR (рис. 3).
Таким образом, у НВ животных изменение вегетативной регуляции работы сердца после инфаркта наблюдали преимущественно в острые сроки опыта и оно не затрагивали влияния симпатического отдела ВНС. У ВВ крыс наблюдали более длительный период ремоделирования вегетативной регуляции, которая не завершилась к окончанию срока наблюдения и сопровождалась сильными изменениями в реактивности симпатического отдела ВНС.
Морфофункциональный анализ популяции тучных клеток сердца. Поскольку подсчет числа тучных клеток и оценка их дегрануляции происходили в остром эксперименте, то каждой временной точке соответствует отдельная группа животных, а для оценки функционального состояния тучных клеток во временной точке “до операции” забор гистологического материала производили у интактных животных.
У интактных НВ и ВВ крыс не наблюдали различий в количестве и степени дегрануляции тучных клеток во всех отделах сердца.
Моделирование НИ приводило к увеличению числа тучных клеток в передней стенке миокарда – зоне, непосредственно затронутой ишемией (табл. 2). При этом у ВВ животных количество тучных клеток в передней стенке на 3 и 28 сут опыта было значимо больше по сравнению с НВ крысами. На протяжении всех сроков эксперимента в передней стенке обнаруживались сильно и очень сильно дегранулированные клетки, хотя значимых отличий между НВ и ВВ животными по функциональному статусу тучных клеток не обнаружено (рис. 4).
Таблица 2.
Число тучных клеток в различных зонах сердца
| День опыта | Уровень ВРС | Передняя стенка | Межжелудочковая перегородка | Задняя стенка |
|---|---|---|---|---|
| До | НВ | 4.0 (3.5; 4.0) | 1.0 (1.0; 1.5) | 3.0 (2.5; 3.0) |
| ВВ | 3.0 (3.0; 3.0) | 1.0 (1.0; 1.5) | 3.0 (2.5; 3.0) | |
| 1 сут | НВ | 6.0 (4.5; 8.3)* | 2.0 (1.3; 2.8)* | 4.5 (2.5; 5.75)* |
| ВВ | 7.0 (5.0; 8.0)* | 4.0 (3.0; 5.0)* | 5.0 (5.0; 6.0)* | |
| 3 сут | НВ | 7.0 (5.8; 9.3)* | 3.5 (2.8; 4.5)* | 5.0 (3.75; 6.0)* |
| ВВ | 11.0 (9.5; 12.3)*$ | 6.0 (4.8; 6.5)* | 5.0 (4.75; 5.25)* | |
| 28 сут | НВ | 26.0 (26.0; 26.0)** | 1.5 (1.3; 1.8) | 1.5 (1.25; 1.75) |
| ВВ | 32.5 (27.8; 37.3)**$ | 3.5 (2.3; 4.8) | 2.5 (2.25; 2.75) |
Рис. 4.
Соотношение тучных клеток в разном функциональном состоянии до и на 1, 3 и 28 сут после моделирования необратимой ишемии миокарда. Условные обозначения: 0 – доля недегранулированных тучных клеток; 1 – доля слабодегранулированных тучных клеток; 2 – сильно дегранулированные тучные клетки; 3 – очень сильно дегранулированные тучные клетки. Условные обозначения. * – отличия в структуре популяции тучных клеток между НВ и ВВ крысами на данном сроке опыта.
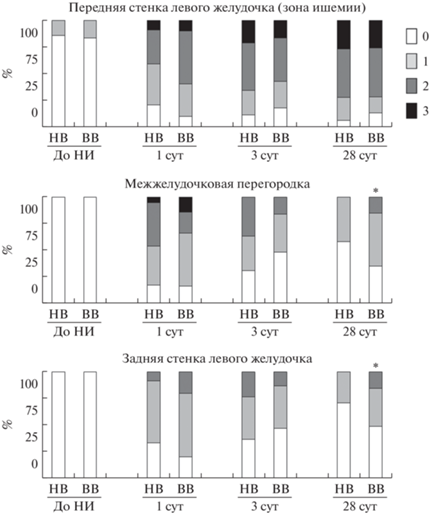
Количество тучных клеток в задней стенке и межжелудочковой перегородке также возрастало в острый период после инфаркта миокарда, но к 28 сут не отличалось от значений у интактных животных (табл. 2). В перегородке через 1 и 3 сут увеличивалось количество очень сильно и сильно дегранулированных тучных клеток. В эти же сроки в задней стенке возрастал процент сильно и слабо дегранулированных клеток. К 28 сут степень дегрануляции в целом уменьшалась, но не достигала соотношения интактного контроля (рис. 4). Разницы между НВ и ВВ крысами в количестве тучных клеток в непосредственно не затронутых ишемией участках сердца не было. Однако, в отличие от НВ, у ВВ животных присутствовали сильно дегранулированные клетки через 28 сут (рис. 4).
В целом, несмотря на схожее распределение по дегрануляции, количество тучных клеток у НВ животных в зоне ишемии было значимо ниже по сравнению с ВВ. Более того, у НВ крыс наблюдали более быстрое восстановление популяции недегранулированных тучных клеток в зонах, непосредственно не затронутых ишемией: задней стенке миокарда и межжелудочковой перегородке.
Оценка размера поражения миокарда после инфаркта и выживаемости крыс. Через 28 сут после моделирования НИ у ВВ животных были значимо больше абсолютные значения массы сформировавшегося рубца, а также массы рубца, нормированные на массу всего левого желудочка и массу всего сердца (табл. 3). При этом масса левого желудочка у НВ крыс на уровне тенденции (р = 0.07) была выше, чем в ВВ группе, а абсолютные значения масс стенки правого желудочка, межжелудочковой перегородки не отличались (табл. 3).
Таблица 3.
Характеристика поражения сердца на 28 сут после инфаркта
| Характеристики сердца | НВ | ВВ |
|---|---|---|
| Рубец, мг | 162 (98;188)* | 200 (192; 268) |
| Правый желудочек, мг | 167 (163; 200) | 198 (179; 227) |
| Межжелудочковая перегородка, мг | 246 (198; 288) | 245 (228; 306) |
| Левый желудочек, мг | 281 (244; 346)# | 172 (124; 224) |
| Сердце, мг | 929 (728; 1035) | 867 (836; 902) |
| Рубец/левый желудочек, % | 35 (25; 39)* | 58 (46; 65) |
| Рубец/сердце, % | 18 (16; 19)* | 24 (22; 30) |
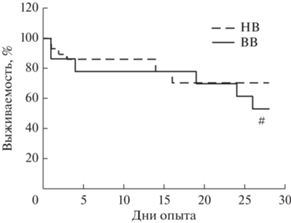
Выживаемость в группе НВ животных к 28 сут составила 70%, а среди ВВ крыс – 53%, т.е. у ВВ животных к 28 сут наблюдали тенденцию (р = 0.067) к большей смертности (рис. 5). Стоит отметить, что основная гибель ВВ крыс наблюдалась в основном в отставленные сроки, после 3 сут эксперимента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исходно популяция крыс неоднородна по уровню ВРС. Результаты исследования показали, что животные изначально неоднородны по уровню абсолютных значений показателей ВРС. По значению параметра SDRR можно различить крыс с разным типом вегетативной регуляции: относительно низким и высоким уровнем общей вариабельности ритма сердца. Было показано, что при равной длительности RR интервала и ЧСС все параметры ВРС значительно ниже у крыс НВ группы, по сравнению с ВВ животными. Реакции в разных группах на мягкое стрессорное воздействие ХП также различаются. НВ животные на тест холодом реагируют увеличением уровня общей ВРС прежде всего за счет более выраженного роста показателей симпатического отдела ВНС, на фоне снижения параметров парасимпатического вклада ВНС в общую ВРС. ВВ крысы в период восстановления после ХП демонстрируют незначительные, противоположно направленные колебания параметров общей ВРС. Отсутствие реакции, по всей видимости, обусловлено компенсированным снижением показателей парасимпатического вклада ВНС и сопоставимым ростом параметров симпатического вклада ВНС в общую ВРС. Различия в уровне ВРС и реакции на ХП указывают на то, что вегетативное сопровождение сердца организовано по-разному у НВ и ВВ крыс, что может влиять на адаптационные возможности животного в стрессорных условиях.
Известно, что популяция здоровых людей может сильно различаться по показателям ВСР, реакциям параметров ВСР на раздражители и соотношению влияний пВНС и сВНС на ритм сердца (Baevsky et al., 2007; Golosheykin et al., 2017; Tegegne et al., 2018; Giuliano et al., 2018; Spangler et al., 2018). Согласно двухконтурной модели регуляции сердечного ритма, предложенной Р.М. Баевским, пейсмейкерная активность синусного узла сердца находится под воздействием системы иерархически организованных влияний ВНС, в которой выделяют автономный и центральный контуры управления (Баевский и др., 2001). Считается, что автономный контур регуляции отвечает за цикличность ритма сердца, связанную с дыхательными движениями, обеспечиваемую на уровне синусного узла, вегетативных ганглиев, расположенных внутри грудной клетки, блуждающего нерва и его ядер в продолговатом мозге. Центральный контур регуляции отвечает за цикличность, связанную с влиянием звеньев подкорковых структур продолговатового мозга, гипоталамо-гипофизарного уровня и коры головного мозга, и обеспечивается симпатоадреналовыми воздействиями (Heart rate variability, 1996; Шлык, Зуфарова, 2013).
По оценке выраженности влияний автономного и центрального контуров регуляции ритма сердца (Baevsky et al., 2007) и их реактивности можно судить о возможности к оптимизации функций в организме человека в покое, возможности их мобилизации и способности к быстрому и полноценному восстановлению после нее (Lima-Borges et al., 2018). Предполагается, что при преобладании центрального типа регуляции ритма сердца организм людей затрачивает больше усилий на контроль его работы, чем у лиц с автономным типом регуляции. Однако при центральном типе регуляции ниже функциональные и адаптационные возможности организма, а при автономном типе – выше уровень саморегуляции, что позволяет достигать оптимума работы системы без перенапряжения системы управления (Шлык, Зуфарова, 2013). В связи с этим можно сделать предположение о различии возможностей регуляторных систем адаптации к внешним воздействиям и путей их реализации у НВ и ВВ лиц (Максимов и др., 2015; Сокрут и др., 2016, Ефремова, Спицин, 2017).
По всей видимости, организация вегетативного контроля может определять патогенез различных заболеваний. Так встречаются единичные сообщения о том, что в зависимости от типа вегетативной регуляции у пациентов могут реализовываться разные патогенезы заболеваний суставов (Сокрут и др., 2016). Обнаружено, что среди пациентов, страдающих ревматоидным артритом, превалируют лица с преобладанием центрального контура регуляции, т.е. НВ субъекты, а среди лиц с хроническим подагрическим артритом и остеоартритом – люди с преобладанием автономного контура регуляции ритма сердца (Сокрут и др., 2016). Авторы исследования, на основании данных ведения 643 больных, указывают, что эффективность реабилитационных мероприятий у пациентов может зависеть от типа их вегетативной регуляции (Сокрут и др., 2016).
В условиях клиники, на людях не проводилось исследований влияния типа вегетативной регуляции на последующее восстановление хронотропной функции сердца после фатальных кардиологических событий. Крысы являются удобным экспериментальным объектом для моделирования отдельных звеньев патогенеза заболеваний человека, в том числе патологий сердечно-сосудистой системы, поэтому целесообразно перенести подходы к измерению ВРС, а также типизации животных на субпопуляции по типу вегетативной регуляции функций. В нашем исследовании крысы с исходно низким уровнем ВРС, соответствуют людям с преобладанием центрального контура регуляции ритма сердца, а животные с высоким уровнем ВРС – людям с преобладанием автономного контура регуляции (Морозова и др., 2020).
Исходный уровень ВРС определяет развитие и исход инфаркта миокарда у крыс. Выполнение необратимой окклюзии левой ветви коронарной артерии приводит к формированию очага некроза в передней стенке левого желудочка сердца крыс. Афферентная информация от болевых рецепторов в сердце, механорецепторов, регистрирующих изменение геометрии и падение силы сокращения сердца, барорецепторов в сосудистом русле по нервным путям достигает ядра солитарного тракта в продолговатом мозге, важного распределительного информационного центра (Goldberger et al., 2019). В результате серии переключений в нейронных сетях информация достигает ГГНС и происходит активация сВНС (Ciarka et al., 2008). Это направлено на компенсаторное увеличение сердечного выброса и поддержание артериального давления на исходном уровне, однако впоследствии может приводить к ухудшению сердечной функции (Triposkiadis et al., 2009). Длительная гиперактивация сВНС снижает порог возникновения фибрилляции и повышает вероятность развития угрожающих жизни аритмий, в то время как воздействие пВНС на сердце повышает этот порог и защищает от аритмии (Schwartz et al., 1992; Ciarka et al., 2008; Qin et al., 2019). Оценка параметров ВСР в эксперименте позволила детально изучить состояние парасимпатических и симпатических регуляторных влияний, участвующих в адаптации работы сердца крыс после развития инфаркта.
У всех животных в острые сроки после НИ в состоянии покоя наблюдали падение всех параметров ВРС, однако у НВ крыс они возвращались на доинфарктный уровень уже к 3 сут наблюдения. У ВВ крыс процесс восстановления регуляторных влияний ВНС на ритм сердца был замедленным: нормализация показателей общей ВРС и параметров вклада пВНС в нее была завершена к концу сроков наблюдения, тогда как значения параметров вклада сВНС не восстановились к 28 дню эксперимента. Выполнение пробы с холодовым воздействием показало, что состояние регуляторных контуров у НВ животных более сохранно: несмотря на изменение чувствительности параметров общей ВРС и вклада пВНС только на ранних сроках после инфаркта, влияния на сердце со стороны сВНС оставались на доинфарктном уровне на всем постоперационном периоде наблюдения. У ВВ животных после моделирования необратимой ишемии миокарда наблюдали более выраженные колебания отдельных параметров ВРС, на фоне развития все возрастающей чувствительности сВНС к холодовому воздействию. Последний факт можно интерпретировать как развитие гиперчувствительности со стороны сВНС (Ciarka et al., 2008), что может приводить к необратимым последствиям для жизни: гиперсенситизация миокарда к влияниям сВНС вместе с попыткой восстановить достаточный уровень кровообращения будет дополнительно изнашивать условно “интактный” миокард инфарктных животных. Эта гипотеза подтверждается увеличением размера рубца и тенденцией к более высокой смертности в группе ВВ-крыс. Увеличение активности сВНС в отставленные сроки после инфаркта может быть связано с разрастанием нервных окончаний в выживших зонах миокарда и его большей чувствительностью к катехоламинам (Jardine et al., 2005; Гаврилова и др., 2017).
Результаты нашего исследования только частично согласуются с данными других исследователей, поскольку ранее никто не делил популяцию животных по исходному типу вегетативной регуляции. Как и в нашем исследовании, в работе Kolettis и соавторов показано развитие тахикардии в покое, увеличение показателей вклада сВНС и снижение показателей вклада пВНС в общую ВРС в течение первых 24 ч после необратимой ишемии миокарда у крыс (Kolettis et al., 2018). Интересно, что исследователи обнаружили, что показатели RMSSD у крыс с повышенной двигательной активностью были выше, чем у менее подвижных животных (Kolettis et al., 2018). Вероятно, это может служить косвенным признаком неоднородности популяции крыс и их способности адаптировать вегетативную регуляцию сердца после инфаркта миокарда. В других исследованиях динамики показателей ВРС у крыс после инфаркта также наблюдалась тахикардия на 1-й, 3-й и 7-й день эксперимента, которая к 28 дням возвращалась к уровню ложнооперированных животных (Aires et al., 2017). Методами спектрального анализа ВРС в исследовании Aires и соавт. у инфарктных крыс показано снижение на 1 и 3 сут опыта параметра HF, отражающего влияние пВНС на сердце, тогда как через 7 и 28 сут наблюдения было зарегистрировано восстановление нормального уровня мощности показателя HF. Общая мощность спектра, ТР, была снижена у крыс, на 1 сутки после необратимой ишемии, что согласуется со снижением абсолютных значений временных параметров SDRR и SDHR в нашем исследовании. Тем не менее, никаких существенных изменений в абсолютных значениях показателя LF, характеризующих вклад сВНС в общую ВРС, после инфаркта не наблюдали. Показатель баланса LF/HF достоверно не изменялся у крыс с инфарктом (Aires et al., 2017).
В клинических исследованиях было показано, что восстановление показателей ВРС у пациентов наблюдается уже через 6 недель после инфаркта миокарда (Lampert et al., 2003). В нашем эксперименте на крысах динамика временных параметров ВСР в общем соответствовала клиническим данным.
Значение тучных клеток в вегетативной регуляции работы сердца. Развитие воспалительной реакции в миокарде крыс после моделирования необратимой ишемии имеет свою хронологию: 1–3 сут наблюдения соответствуют острой стадии воспаления, а 28 день после операции характеризуется завершением процессов ремоделирования миокарда и формированием рубца (Гаврилова и др., 2017). В динамике развития воспалительной реакции отдельное регуляторное значение имеют влияния ВНС (Tracey et al., 2002) и отзывчивость на ее стимулы иммунных клеток-эффекторов (Borovikova et al., 2000, Radosa et al., 2011; Shi et al., 2017). Тучные клетки играют особенную роль в реализации воспалительного ответа, т.к. сопровождают его на всем протяжении от стадии альтерации до пролиферации и могут выделять как провоспалительные, так и противовоспалительные факторы. На ранних сроках воспаления тучные клетки высвобождают провоспалительные цитокины и хемокины, привлекающие другие иммунные клетки в зону ишемии. На поздних сроках воспаления тучные клетки выступают источником ростовых факторов (VEGF, bFGF) и могут участвовать в заживлении и формировании сосудистых коллатералей после ишемии. Таким образом, эффекты тучных клеток зависят от времени, прошедшего с момента инициации воспаления, а также их количества и уровня функциональной активности самих клеток. Вероятно, отдельное влияние на состояние тучных клеток оказывает ВНС, т.к. на их клеточных мембранах обнаружена экспрессия целого спектра рецепторов к ацетилхолину (Radosa et al., 2011; Shi et al., 2017).
Результаты нашего исследования показывают, что после моделирования инфаркта на всех сроках опыта количество тучных клеток отличалось у крыс с разным типом вегетативной регуляции: у ВВ крыс число тучных клеток особенно в зоне ишемии сердца было выше, чем в НВ подгруппе. И если по степени дегрануляции распределение тучных клеток в ишемизированной области было примерно одинаковым у НВ и ВВ животных, то в зонах условно интактного миокарда показана более быстрая нормализация состава тучных клеток у крыс с преобладанием автономного типа вегетативной регуляции.
Гистамин – один из главных медиаторов тучных клеток – участвует не только в организации локального и системного воспалительного ответа, но и способен оказывать свои эффекты на пейсмейкерные клетки синусного узла, клетки проводящей системы сердца, а также афферентные и эфферентные нервные волокна, иннервирующие миокард.
В экспериментах на овцах показано, что гистамин может увеличивать длительность фазы плато потенциала действия кардиомиоцитов (Thome et al., 1992), и, следовательно, повышать риск кальциевой перегрузки клеток и вероятность их гибели. Уменьшение длительности потенциала действия будет приводить к тахикардии, что соотносится с результатами нашего исследования в 1 сут после операции. Развитие тахикардии сопровождается и уменьшением длительности фазы диастолы, а именно в этот период происходит восстановление кислородного и питательного резерва миокарда. Таким образом, развитие тахикардии в инфарктном сердце будет дополнительно потенцировать риск ишемического повреждения условно сохранного миокарда, на который перераспределилась нагрузка по перекачке крови (Thome et al., 1992). Кроме того, через H1-рецепторы гистамин снижает скорость проведения импульса через атриовентрикулярный узел и повышает его пейсмейкерную активность, что, в конечном счете, будет приводить к электрической нестабильности миокарда и возникновению фатальных для жизни аритмий (Wolff, Levi, 1986). Результаты нашего исследования косвенно согласуются с этими данными: ВВ крысы были больше подвержены смертности после НИ, что также может быть связано с негативными эффектами гистамина на хронотропную функцию сердца.
Кроме того, известно, что гистамин может оказывать свои эффекты через Н3-рецепторы, расположенные непосредственно на постганглионарных симпатических нервных волокнах, иннервирующих сердце. Их активация ингибирует высвобождение норадреналина и, следовательно, уменьшает его кардиостимулирующий эффект (Lokhandwala, 1978; Malinowska et al., 1998). Этот факт может объяснять возрастающую чувствительность параметров вклада сВНС в общую ВРС после НИ в холодовом тесте у ВВ крыс. Кроме того, в экспериментах на кошках, обнаружено, что гистаминовые рецепторы экспрессируются и на афферентных окончаниях чувствительных нейронов сердца, а значит, через этот путь возможна передача информации об изменении не только механических свойств сердца, но и химического окружения нервных окончаний, вызванном ишемией (Nishi et al., 1977). Позже было показано, что стимуляция сенсорных С-волокон сердца высвобождает пептид, связанный с геном кальцитонина, который увеличивает частоту сердечных сокращений, сократительную способность и коронарный кровоток, а гистамин через пресинаптические Н3-рецепторы модулирует высвобождение CGRP в сердце (Imamura et al., 1996) и, вероятно, также опосредует развитие тахикардии в острые сроки развития инфаркта.
Таким образом, опираясь на результаты нашего исследования и данные других исследователей, можно заключить, что от активности тучных клеток зависит характер афферентной информации, поступающей в сердечно-сосудистый центр продолговатого мозга, и степень модуляции эфферентных влияний со стороны по крайней мере сВНС на сердце после моделирования необратимой ишемии миокарда у крыс. Количественное содержание и выраженность доли функционально активных тучных клеток определяются исходным типом вегетативной регуляции животного уже после развития необратимой ишемии.
ЗАКЛЮЧЕНИЕ
Индивидуальный подход и концепция “персонифицированной медицины” требуют составления базы данных на каждого пациента и предполагают учет его биологических и психосоциальных особенностей. Мы полагаем, что одной из важных физиологических характеристик индивидуальности пациента может стать тип вегетативной регуляции, оцененный по вариабельности ритма сердца.
Настоящее исследование показало, что деление популяции крыс по уровню общей ВРС, определенному по значению показателя SDRR, позволяет выявить различия в адаптивных возможностях ВНС на предъявление холодовой пробы и моделирование необратимой ишемии миокарда. Также были продемонстрированы различия в количественном и качественном составе тучных клеток, участвующих в координации воспалительного ответа не только в зоне ишемии, но и областях условно интактного миокарда. Таким образом, предположение о возможности использования типа вегетативной регуляции в качестве одной из физиологических характеристик для описания индивидуальных особенностей человека в концепции персонифицированной медицины получило предварительное подтверждение в экспериментах на крысах. Оценка параметров ВРС может стать обязательной процедурой в программе регулярного медицинского осмотра.
Список литературы
Баевский Р.М., Иванов Г.Г., Чирейкин Л.В., Гаврилушкин А.П., Довгалевский П.Я., Кукушкин Ю.А., Мироов Т.Ф., Прилуцкий Д.А., Семенов Ю.Н., Фёдоров В.Ф., Флейшман А.Н., Медведев М.М. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем // Вест. аритмологии. 2001. Т. 24. С. 65–87.
Гаврилова С.А., Марков М.А., Бердалин А.Б., Куренкова А.Д., Кошелев В.Б. Изменение симпатической иннервации сердца крысы при экспериментальном инфаркте миокарда; влияние пептида Семакс // Бюллетень экспериментальной биологии и медицины. 2017. Т. 163. №. 5. С. 570–574.
Ефремова Р.И., Спицин А.П. Особенности устойчивости симпатотонического типа вегетативной регуляции у юных лыжников под действием тренировочных и соревновательных нагрузок // Журн. медико-биологических исследований. 2017. Т. 5. № 4. С. 90–92.
Максимов А.Л., Лоскутова А.Н., Аверьянова И.В. Информативность показателей вариабельности кардиоритма при оценке адаптированности юношей призывного возраста к условиям Северо-Востока России // Журн. медико-биологических исследований. 2015. № 4. С. 66–79.
Морозова М.П., Евсеев А.М., Прохорова А.В., Миронова О.Г., Банзелюк Е.Н., Гаврилова С.А. Связь вегетативного тонуса девушек и юношей с их психологическим профилем личности // Физиология человека. 2020. Т. 46. № 5. С. 15–26.
Сокрут В.Н., Сокрут О.П., Синяченко О.В. “Вегетативный паспорт” и реабилитационный диагноз в артрологической практике // Боль. Суставы. Позвоночник. 2016. № 1(21). С.45–51.
Шлык Н.И., Зуфарова Э.И. Нормативы показателей вариабельности сердечного ритма у исследуемых 16–21 года с разными преобладающими типами вегетативной регуляции // Вестник Удмуртского университета. Сер. “Биология. Науки о Земле”. 2013. № 4. С. 96–105.
Aires R., Pimentel E.B., Forechi L., Dantas E.M., Mill J.G. Time course of changes in heart rate and blood pressure variability in rats with myocardial infarction // Braz J Med Biol Res. 2017. V. 50. № 1. P. e5511.
Aubert A.E., Seps B., Beckers F. Heart rate variability in athletes // Sports Med. 2003. V. 33. № 12. P. 889–919.
Baevsky R.M., Baranov V.M., Funtova I.I., Diedrich A., Pashenko A.V., Chernikova A.G., Drescher J., Jordan J., Tank J. Autonomic cardiovascular and respiratory control during prolonged spaceflights aboard the International Space Station // J. Appl. Physiol. 2007. V. 103. № 1. P. 156–161.
Borovikova L.V., Ivanova S., Zhang M., Yang H., Botchkina G.I., Watkins L.R., Wang H., Abumrad N., Eaton J.W., Tracey K.J. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. // Nature. 2000. V. 405. № 6785. P. 458–462.
Carpeggiani C., Landi P., Michelassi C., Raciti M., Macerata A., Emdin M. Early assessment of heart rate variability is predictive of in-hospital death and major complications after acute myocardial infarction // Int J Cardiol. 2004. V. 96. № 3. P. 361–368.
Ciarka A., van de Borne P., Pathak A. Myocardial infarction, heart failure and sympathetic nervous system activity: new pharmacological approaches that affect neurohumoral activation // Expert Opin Investig Drugs. 2008. V. 17. № 9. P. 1315–1330.
Giuliano R.J., Karns C.M., Bell T.A., Petersen S., Skowron E.A., Neville H.J., Pakulak E. Parasympathetic and sympathetic activity are associated with individual differences in neural indices of selective attention in adults // Psychophysiology. 2018. V. 55. P. e13079.
Goldberger J.J., Arora R., Buckley U., Shivkumar K. Autonomic Nervous System Dysfunction: JACC Focus Seminar // J. Am. Coll Cardiol. 2019. V. 73. N. 10. P. 1189–1206.
Golosheykin S., Grant J.D., Novak O.V., Heath A.C., Anokhin A.P. Genetic influences on heart rate variability // Int. J. Psychophysiol. 2017. V. 115. P. 65–73.
Heart rate variability. Standards of measurement, physiological interpretation, and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology // Eur. Heart J. 1996. V. 17. № 3. P. 354–381.
Huikuri H.V., Stein P.K. Clinical application of heart rate variability after acute myocardial infarction // Front Physiol. 2012. V. 3. P. 41.
Imamura M., Smith N.C., Garbarg M., Levi R. Histamine H3-receptor-mediated inhibition of calcitonin gene-related peptide release from cardiac C fibers. A regulatory negative-feedback loop // Circ Res. 1996. V. 78. № 5. P. 863–869.
Jardine D.L., Charles C.J., Ashton R.K., Bennett S.I., Whitehead M., Frampton C.M., Nicholls M.G. Increased cardiac sympathetic nerve activity following acute myocardial infarction in a sheep model // J. Physiol. 2005. V. 565. Pt. 1. P. 325–333.
Kleiger R.E., Miller J.P., Bigger J.T., Moss A.J. Decreased heart rate variability and its association with increased mortality after acute myocardial infarction // Am. J. Cardiol. 1987. V. 59. № 4. P. 256–262.
Kolettis T.M., Kontonika M., Lekkas P., Vlahos A.P., Baltogiannis G.G., Gatzoulis K.A., Chrousos G.P. Autonomic responses during acute myocardial infarction in the rat model: implications for arrhythmogenesis // J. Basic and Clinical Physiology and Pharmacology. 2018. V. 29. № 4. P. 339–345.
Kotenko M.A., Smelisheva L.N., Kuznetsov A.P., Kiseleva M.M. Stress-induced indicators of hydrolytic function of the stomach and the pancreas in persons with various type of autonomic nervous system // Vopr Pitan. 2014. V. 83. № 6. P. 18–24.
Lampert R., Ickovics J.R., Viscoli C.J., Horwitz R.I., Lee F.A. Effects of propranolol on recovery of heart rate variability following acute myocardial infarction and relation to outcome in the beta-blocker heart attack trial // The American J. Cardiology. 2003. V. 91. № 2. P. 137–142.
Lima-Borges D.S., Martinez P.F., Vanderlei L.C.M., Barbosa F.S.S., Oliveira-Junior S.A. Autonomic modulations of heart rate variability are associated with sports injury incidence in sprint swimmers // Phys Sportsmed. 2018. V. 46. № 3. P. 374–384.
Lokhandwala M.F. Inhibition of sympathetic nervous system by histamine:studies with H1- and H2-receptor antagonists // J. Pharmacol. Exp. Ther. 1978. V. 206. № 1. P. 115–122.
Luecken L.J., Appelhans B.M. Early parental loss and salivary cortisol in young adulthood: the moderating role of family environment // Dev. Psychopathol. 2006. V. 18. № 1. P. 295–308.
Malinowska B., Godlewski G., Schlicker E. Histamine H3 receptors–general characterization and their function in the cardiovascular system // J. Physiol Pharmacol. 1998. V. 49. № 2. P. 191–211.
Nishi K., Sakanashi M., Takenaka F. Activation of afferent cardiac sympathetic nerve fibers of the cat by pain producing substances and by noxious heat // Pflugers Arch. 1977. V. 372. № 1. P. 53–61.
Puebla-Osorio N., Sarchio S.N.E., Ullrich S.E., Byrne S.N. Detection of Infiltrating Mast Cells Using a Modified Toluidine Blue Staining // Methods Mol Biol. 2017. V. 1627. P. 213–222.
Radosa J., Dyck W., Goerdt S., Kurzen H. The cholinergic system in guttate psoriasis with special reference to mast cells // Exp. Dermatol. 2011. V. 20. № 8. P. 677–679.
Qin M., Zeng C., Liu X. The cardiac autonomic nervous system: A target for modulation of atrial fibrillation // Clin Cardiol. 2019. V. 42. № 6. P. 644–652.
Schwartz P.J., La Rovere M.T., Vanoli E. Autonomic nervous system and sudden cardiac death. Experimental basis and clinical observations for post-myocardial infarction risk stratification // Circulation. 1992. V. 85. 1 suppl. P. I77–191.
Selye H., Bajusz E., Grasso S., Mendell P. Simple techniques for the surgical occlusion of coronary vessels in the rat // Angiology. 1960. V. 11. P. 398–407.
Shi L., Xu H., Wu Y., Li X., Zou L., Gao J., Chen H. Alpha7-nicotinic acetylcholine receptors involve the imidacloprid-induced inhibition of IgE-mediated rat and human mast cell activation // RSC Adv. 2017. V. 7. P. 51896–51906.
Spangler D.P., Gamble K.R., McGinley J.J., Thayer J.F., Brooks J.R. Intra-individual variability in vagal control is associated with response inhibition under stress // Front Hum Neurosci. 2018. V. 12. P. 475.
Tegegne B.S., Man T., van Roon A.M., Riese H., Snieder H. Determinants of heart rate variability in the general population: the lifelines cohort study // Heart Rhythm. 2018. V. 15. № 10. P. 1552–1558.
Thome U., Berger F., Borchard U., Hafner D. Electrophysiological characterization of histamine receptor subtypes in sheep cardiac Purkinje fibers // Agents Actions. 1992. V. 37. № 1–2. P. 30–38.
Tracey K.J. The inflammatory reflex // Nature. 2002. T. 420. № 6917. P. 853–859.
Triposkiadis F., Karayannis G., Giamouzis G., Skoularigis J., Louridas G., Butler J. The sympathetic nervous system in heart failure: physiology, pathophysiology, and clinical implications // J. Am. Coll. Cardiol. 2009. V. 54. № 19. P. 1747–1762.
Wolff A.A., Levi R. Histamine and cardiac arrhythmias // Circ. Res. 1986. V. 58. № 1. P. 1–16.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая