Известия РАН. Серия биологическая, 2023, № 2, стр. 122-133
Роль альбумина и альфа-фетопротеина в пренатальном онтогенезе глаза человека
И. Г. Панова 1, *, А. С. Татиколов 2
1 НП Международный научно-практический центр пролиферации тканей
119034 Москва, ул. Пречистенка, 14/19, Россия
2 Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
* E-mail: pinag@mail.ru
Поступила в редакцию 11.12.2021
После доработки 28.01.2022
Принята к публикации 28.01.2022
- EDN: HJSFZC
- DOI: 10.31857/S1026347022700093
Аннотация
В стекловидном теле глаза плодов человека присутствуют сывороточный альбумин (СА) и альфа-фетопротеин (АФП), который в норме характерен для эмбрионов и плодов человека. Во втором триместре оба белка находятся в стекловидном теле в концентрации, сравнимой с концентрацией в сыворотке крови, после чего их содержание резко снижается. В настоящем аналитическом обзоре с учетом биологических свойств СА и АФП обсуждается роль этих белков в процессах роста и дифференцировки структур развивающегося глаза.
Важность стекловидного тела для нормального функционирования глаза явилась поводом для написания данного обзора.
Стекловидное тело, расположенное между хрусталиком и сетчаткой, составляет ~4/5 от объема глаза. Оно представляет собой прозрачную, бесцветную, высокогидратированную (приблизительно 99% воды) гелеобразную структуру. В норме у взрослых стекловидное тело полностью лишено кровеносных сосудов. Единственными клетками стекловидного тела являются гиалоциты (Hogan et al., 1971; Balazs et al., 1980; Bishop, 2000; Bishop et al., 2002; Le Goff, Bishop, 2008).
Стекловидное тело играет важную роль в структурной организации и функциональной активности глаза: обеспечивает сохранение формы и тонуса глазного яблока, амортизирует механические удары, регулирует внутриглазное давление, поддерживает нормальный гомеостаз сетчатки и хрусталика, и обладает антиангиогенными свойствами (Hogan et al., 1971; Jacobson et al., 1985; Lutty et al., 1993).
Основными компонентами стекловидного тела являются коллаген II типа, гиалуроновая кислота, гликозаминогликаны, протеогликаны, растворимые белки, ферменты, аминокислоты, цитокины (Bishop et al., 2002; Le Goff, Bishop, 2008). На протяжении всего онтогенеза стекловидное тело претерпевает изменения состава и структуры, связанные как с нормальным развитием до и после рождения, так и с различными глазными и системными заболеваниями. В связи с этим знание биохимических изменений в стекловидном теле поможет обеспечить лучшее понимание патофизиологических процессов, которые имеют место при витреоретинопатиях, макулярных дегенерациях, катарактах, глаукоме, ретинопатии недоношенных, врожденных аномалиях глаза. Все больше внимания уделяется исследованию протеома стекловидного тела, как в норме, так и при различных заболеваниях и возрастных изменениях глаз, что является важной задачей не только для понимания природы и течения заболеваний глаз, но и для разработки терапевтических подходов для их лечения (Yamane et al., 2003; Wu et al., 2004; Grus et al., 2007 Angi et al., 2012; Murthy et al., 2014; Yee et al., 2015; Mandal et al., 2015.
Несомненный интерес стекловидное тело представляет в раннем пренатальном развитии человека, когда происходят значительные изменения на морфологическом и биохимическом уровнях. Развитие стекловидного тела глаза человека включает ряд последовательных периодов. На протяжении первого периода с конца 3-й–начала 4-й недели и до конца 6-й недели формируется первичное стекловидное тело. Характерным признаком этого периода является формирование в пределах стекловидного тела гиалоидных сосудов, к которым относятся главная гиалоидная артерия (arteria hyaloidea), ее разветвления в полости первичного стекловидного тела (vasa hyaloidea propria), сосуды задней (tunica vasculosa lentis posterior) и передней (tunica vasculosa lentis anterior) сосудистой сумки хрусталика. Эти сосуды необходимы для дыхания, питания и созревания внутренних частей развивающегося глаза (хрусталика, сетчатки, стекловидного тела). Выполнив свое назначение, они постепенно подвергаются обратному развитию. Второй период связан с развитием вторичного (бессосудистого) стекловидного тела между сетчаткой и первичным стекловидным телом и осуществляется в период с конца 6-й недели (это совпадает с закрытием глазной зародышевой щели) и до конца 12-й недели. После 10-й недели начинаются процессы регрессии гиалоидных сосудов, в результате чего к 28-й неделе формируется прозрачная гелеобразная структура стекловидного тела, практически лишенная кровеносных сосудов (Mann, 1949; Sebag, 1989, 2005; Bremer, Rasquin, 1998; Bishop, 2000; Saint-Geniez, Amore, 2004; Sebag, Yee, 2007).
С самых ранних стадий пренатального развития происходит ремоделирование матрикса стекловидного тела. С возрастом эмбрионов и плодов человека показана смена коллагенов: до 8-й недели в стекловидном теле определяется коллаген типа III; начиная с 8-й недели и на всех последующих сроках у плодов и после рождения – коллаген типа II, который является основным на протяжении всей жизни человека (Azuma et al., 1998). Гиалуроновую кислоту авторы анализировали с 5-й недели эмбрионального развития и показали ее присутствие в стекловидном теле (Azuma et al., 1998). Гиалуроновая кислота является основным составляющим компонентом гликозаминогликанов, присутствующих в стекловидном теле на протяжении жизни человека (Azuma et al., 1998; Bremer, Rasquin, 1998). На стадиях с 6-й по 40-ю неделю беременности у человека в стекловидном теле развивающегося глаза транзиторно присутствуют также сульфатированные гликозаминогликаны: с 6-й по 39-ю неделю хондроитин-6-сульфатпротеогликан и с 12-й по 39-ю неделю хондроитин-4-сульфатпротеогликан. Начиная с 40-й недели беременности и после рождения, по крайней мере, до 2-х лет, они более не обнаруживаются (Azuma et al., 1998).
Сравнительный анализ протеомного состава стекловидного тела у плодов человека с 14-й по 20-ю недели гестации проводился с целью выявления изменения состава стекловидного тела в связи с регрессией гиалоидных сосудов и развитием вторичного стекловидного тела. В этот период было идентифицировано 1217 белков, многие из которых играют важную роль в регрессии гиалоидных сосудов и ремоделировании внеклеточного матрикса. Это белки-регуляторы ангиогенеза (PEDF, cofilin-1), белки клеточной адгезии (cadherins, dystroglycan), белки-регуляторы апоптоза (cytochrome C) (Yee et al., 2015). В стекловидном теле у плодов человека также было обнаружено присутствие основных белков сыворотки крови – сывороточного альбумина (СА) и альфа-фетопротеина (АФП) (Панова, Татиколов, 2011; Панова и др., 2010). Несмотря на то, что биологические функции этих белков в организме достаточно хорошо изучены (и продолжают изучаться), мало известно о роли этих белков в пренатальном развитии глаза человека. В настоящем обзоре мы акцентировали внимание на присутствие СА и АФП в стекловидном теле глаза человека в пренатальном развитии, их динамике в сравнении с сывороткой крови, а также на их биологических функциях, важных для развития глаза.
СЫВОРОТОЧНЫЙ АЛЬБУМИН И АФП У ПЛОДОВ ЧЕЛОВЕКА
В то время как СА является главным компонентом сыворотки крови, АФП в значимых количествах присутствует только в эмбриональном и плодном развитии. У взрослого человека АФП в сыворотке крови наблюдается лишь в следовых количествах. Повышение концентрации АФП у взрослого человека свидетельствует об онкологическом заболевании (Abelev, 1971; Tomasi, 1977; Deutsch, 1991). В отличие от АФП, СА является основным белком организма на протяжении всего онтогенеза человека (Adinolfi et al., 1975; Peters, 1996; Christiansen et al., 2000).
АФП синтезируется у эмбрионов и плодов человека клетками висцеральной эндодермы желточного мешка и печени. После атрофии желточного мешка основным источником этого белка является печень. Имеются также сведения о том, что АФП на низком уровне в пренатальном развитии человека синтезируется клетками желудочно-кишечного тракта, поджелудочной железы, мезонефроса (Gitlin et al., 1972; Ruoslahti, Seppala, 1979; Naval et al., 1992; Jones et al., 2001; Elmaouhoub et al., 2007; Trojan, Uriel, 1982). СА у человека также начинает синтезироваться на ранних стадиях беременности в желточном мешке и зачатке печени (Jauniaux et al., 1994). Во втором триместре и далее на протяжении всей жизни человека СА вырабатывается печенью (Naval et al., 1992).
Поступая в кровеносное русло плода, СА и АФП переносятся к развивающимся органам и тканям. Кроме того, АФП проникает через плаценту в циркуляторное русло матери, и уровень АФП в сыворотке крови беременных женщин служит для диагностики некоторых нарушений в развитии плода. Повышенный уровень АФП в материнской крови может свидетельствовать о дефектах развития нервной трубки у плода, в то время как пониженный уровень характерен для синдрома Дауна (Seller, 1990; Szajkowski et al., 2006). АФП обладает иммуномодулирующими и иммунорегуляторными свойствами и защищает развивающийся плод от материнской иммунологической атаки (Adinolfi et al., 1975; Tomasi, 1977). Кроме сыворотки крови, присутствие АФП было показано и в других биологических средах плодов человека: цереброспинальной жидкости (Smith et al., 1971; Jamieson, Shaw, 1975; Christiansen et al., 2000), желчи, меконии (Smith et al., 1971), амниотической жидкости (Wathen et al., 1993; Adinolfi et al., 1975), стекловидном теле (Панова и др., 2010; Панова, Татиколов, 2011). В стекловидном теле в пренатальном развитии человека было также показано присутствие СА (Panova et al., 2007; Панова, Татиколов, 2011; Панова и др., 2016).
ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ СА И АФП В СЫВОРОТКЕ КРОВИ И СТЕКЛОВИДНОМ ТЕЛЕ ГЛАЗА ЧЕЛОВЕКА В РАННЕМ ПРЕНАТАЛЬНОМ РАЗВИТИИ
Динамика концентрации СА и АФП в сыворотке крови плодов человека, адаптированная по данным из разных источников литературы, представлена на рис. 1 (Nayak, Mital, 1977; Yachnn, 1978; Kim, Yang, 1987; Seller, 1990; Christiansen et al., 2000; Coakley et al., 2005). До 19-й недели пренатального развития концентрации СА и АФП (рис. 1, 1, 2) в сыворотке крови плодов человека находятся приблизительно на одинаковом уровне, а затем концентрация АФП начинает снижаться (рис. 1, 2), а СА повышаться (рис. 1, 1). Оба белка в сыворотке крови к рождению достигают уровня концентраций близких к концентрациям взрослого человека.
Рис. 1.
Значения концентраций СА (1) и АФП (2) в сыворотке крови плодов человека, взятые из работ разных авторов (Nayak, Mital, 1977; Yachnin, 1978; Kim, Yang, 1987; Seller, 1990; Christiansen et al., 2000; Coakley et al., 2005).
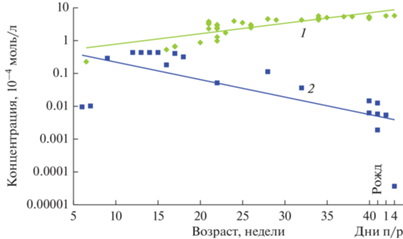
В стекловидном теле концентрации СА (рис. 2, 1) и АФП (рис. 2, 2) уменьшаются с возрастом плода (Панова и др., 2007, 2010, 2016, 2018; Панова, Татиколов, 2011). Сравнение показало, что уровень концентрации СА и АФП в стекловидном теле приблизительно до 23–24-й недели соответствует уровню концентрации этих белков в сыворотке крови (рис. 3а, 3б), и затем концентрация обоих белков снижается. Снижение концентрации СА в стекловидном теле происходит на фоне повышения его концентрации в сыворотке крови, а АФП – на фоне снижения концентрации этого белка в сыворотке крови (рис. 3а, 3б).
Рис. 2.
Концентрации СА (1) и АФП (2) в стекловидном теле глаза плодов человека с 14 по 31 неделю (из: Панова и др., 2007, 2010; Панова, Татиколов, 2011).
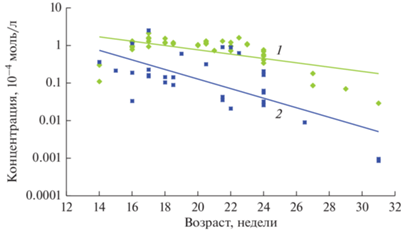
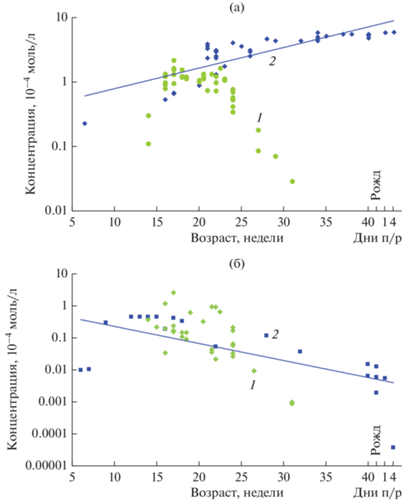
Рис. 3.
Сравнение концентраций СА (а) и АФП (б) в стекловидном теле глаза (1) с концентрациями в сыворотке крови (2) плодов человека (из: Панова и др., 2007, 2010; Панова, Татиколов, 2011; см. рис. 1).
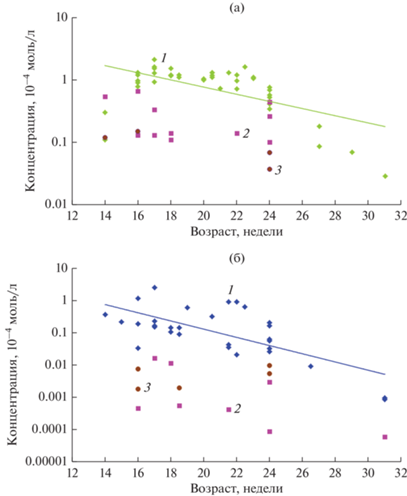
В сетчатке и хрусталике, между которыми расположено стекловидное тело, также было показано присутствие СА и АФП, концентрация которых ниже по сравнению со стекловидным телом, что отражено на рисунке (рис. 4а, 4б). Результаты ПЦР-анализа показали, что мРНК к СА и АФП, детектируемые в печени, в сетчатке и хрусталике не обнаруживаются (Панова и др., 2016, 2018). Это указывает на то, что СА и АФП в процессе развития не синтезируются клетками сетчатки и хрусталика, а захватываются ими, что согласуется с данными, полученными на экспериментальных животных (мышах, цыплятах, обезьянах) (Schacher, Torand-Allerand, 1982; Uriel et al., 1983; Hajeri-Germond et al., 1991).
Рис. 4.
Сравнение концентраций СА (а) и АФП (б) в стекловидном теле (1), хрусталике (2) и сетчатке (3) глаза плодов человека (из: Панова и др., 2007, 2010, 2016, 2018; Панова, Татиколов, 2011).
Два основных белка, циркулирующие в крови плодов человека – СА и АФП, присутствуют в стекловидном теле, сетчатке и хрусталике. Важность этих белков для развития глаза вытекает из их биологических свойств, чему посвящен следующий раздел.
ФУНКЦИИ СА И АФП, ВАЖНЫЕ ДЛЯ РАННЕГО ПРЕНАТАЛЬНОГО РАЗВИТИЯ ГЛАЗА ЧЕЛОВЕКА
СА и АФП имеют сходную структуру и ряд сходных функций: они создают онкотическое давление циркулирующей плазмы крови (Peters, 1996; Sitar, 2013), являются основными белками-переносчиками в организме (Berde et al., 1979; van Houwelingen et al., 1993; Peters, 1996; Copado et al., 1999; Haggarty, 2002; Fanali et al., 2012) и обладают антиоксидантными свойствами (Roche et al., 2008; Taverna et al., 2013; Sitar, 2013; Choi et al., 2014).
Онкотическое давление. СА и АФП – главные белки, определяющие онкотическое давление и объем плазмы циркулирующей крови и жидких сред организма развивающегося плода (Peters, 1996; Hankins, 2006; Sitar, 2013). СА и АФП обладают свойством связывать воду и таким образом вносят вклад в онкотическое и соответственно комплексное коллоидно-осмотическое давление в стекловидном теле, по аналогии с сывороткой крови (Cagianut, Wunderly, 1953).
Для эмбриологов, изучавших ранние стадии развития глаза, стекловидное тело представляло интерес, главным образом, в качестве источника зародышевого внутриглазного давления – мощного эпигенетического фактора, определяющего общий рост глаза и нормальный морфогенез всех его частей. В отсутствие необходимого натяжения оболочек развивающегося глаза (при экспериментальном снятии внутриглазного давления или при незакрытии глазной зародышевой щели) сетчатка отслаивается и ложится в виде складок, нарушается развитие структур переднего комплекса глаза (Mann, 1949; Coulombre, 1956, 1957; Coulombre, Herrmann, 1965; Строева, 1971; Stroeva, Panova, 1983).
Высокая концентрация СА и АФП в стекловидном теле в раннем пренатальном развитии глаза человека вносит свой вклад в создание внутриглазного давления, коррелирует с увеличением объема стекловидного тела (Beeb et al., 1986; Панова и др., 2007) и развитием структур глаза (Mann, 1949; Coulombre, 1956; 1957; Coulombre, Herrmann, 1965; Stroeva, Panova, 1983).
СА и АФП – белки-переносчики. СА и АФП являются главными белками-переносчиками в организме (Berde et al., 1979; Peyrol et al., 1977; van Houwelingen et al., 1993; Peters, 1996; Copado et al., 1999; Haggarty, 2002). Они связывают и транспортируют множество молекул, таких как билирубин, жирные кислоты, каротиноиды, гормоны, аминокислоты, тяжелые металлы, лекарства и т.д. к органам-мишеням. Cпоcобноcть связывать токcичеcкие метаболиты указывает на важноcть этих белков для cоxpанения оpганов и тканей развивающегося плода. Доставка необходимых веществ к органам и тканям, осуществление депонирования многочисленных эндогенных и экзогенных компонентов в системе циркуляции крови и в тканях, стабилизация рН плазмы крови определяют важность СА и АФП для нормального развития и гомеостаза развивающегося организма (Hsia et al., 1980; Peters, 1996; Mizejewski, 2001, 2004; Fanali et al., 2012).
Оба белка обладают высоким сродством к полиненасыщенным жирным кислотам (ПНЖК). Так как клетки эмбрионов и плодов человека не способны синтезировать ПНЖК, основной функцией СА и АФП в этот период является транспортировка ПНЖК через плаценту от матери к плоду (Peyrol et al., 1977; Berde et al., 1979; Hsia et al., 1980; van Houwelingen et al., 1993). Эти белки доставляют ПНЖК в ткани-мишени плода и, соответственно, в развивающийся глаз, что необходимо для построения клеточных мембран, роста нейронов и аксонов в сетчатке, а также волокон хрусталика (Anel et al., 1989; van Houwelingen et al., 1993; Copado et al., 1999; Haggarty, 2002). Следует учесть, что важнейшим свойством АФП является его высокое сродство к ПНЖК (гораздо выше, чем у СА) (Lazarevich, 2000).
На клеточных мембранах эмбриональных тканей были обнаружены рецепторы к АФП, которые участвуют в транспорте ПНЖК внутрь клеток. Развивающиеся сетчатка и мозг млекопитающих и птиц показывают строгую иммунопозитивную реакцию на АФП, и эти ткани являются структурами с высоким содержанием ПНЖК (Tinoco et al., 1976; Uriel et al., 1983). Таким образом, обнаруженная высокая концентрация АФП в стекловидном теле, сетчатке и хрусталике у плодов человека во втором триместре согласуется с представлением об участии АФП в дифференцировке нейронов сетчатки, формировании наружных сегментов фоторецепторов и волокон хрусталика.
Не менее важным является способность СА и АФП участвовать в транспортировке каротиноидов и билирубина. Было показано, что в определенные возрастные периоды пренатального развития стекловидное тело плодов человека имеет желтоватый цвет (Яковлева и др., 2007). Предположение, что эта желтизна могла бы быть обусловлена присутствием пигментов желтого цвета, проверялась на присутствие каротиноидов и билирубина.
В отличие от взрослого человека, где в стекловидном теле каротиноиды полностью отсутствуют, в стекловидном теле у плодов человека с применением методов спектроскопии, ВЭЖХ и масс-спектрометрии был обнаружен лютеин, с максимальной концентрацией на 16–17-й неделях (Яковлева и др., 2007; Панова и др., 2007; Panova et al., 2017). Но уже после 30-й недели, как и у взрослого человека, лютеин в стекловидном теле не обнаруживался. Таким образом, у человека в пренатальном развитии лютеин входит в состав стекловидного тела в качестве транзиторной молекулы (Панова и др., 2007). Согласно данным Боне, на 17–20-й неделях каротиноиды были обнаружены в сетчатке в области формирующейся макулы (Bone et al., 1988), и этот период совпадает с периодом максимальной концентрации лютеина в стекловидном теле (Яковлева и др., 2007; Панова и др., 2007). Таким образом, стекловидное тело может быть дополнительным источником лютеина, необходимого для раннего морфогенеза макулы.
Известно, что каротиноиды в организме у человека не синтезируются, а поступают с пищей, и плоды получают их через плаценту от матери (Weale, 2007). Показано, что каротиноиды связываются с СА плода и переносятся к тканям-мишеням в виде водорастворимого комплекса “альбумин-каротиноиды” (Sabah et al., 2005; Bhosale, Bernstein, 2007). АФП также является белком-переносчиком для каротиноидов (Peters, 1996).
В стекловидном теле у плодов человека наряду с СА и АФП показано присутствие билирубина (Панова и др., 2020). Как известно, свободный билирубин токсичен и в сыворотке крови плода циркулирует в связанном с СА и АФП состоянии (Aoyagi et al., 1979; Hirano et al., 1984; Vítek, Ostrow, 2009). Концентрация билирубина с 17-й по 19-ю неделю гестации составила в среднем 8.67 мкмоль/л, а с 20-й по 31-ю неделю снизилась в 6.3 раза и в среднем составила 1.37 мкмоль/л. (Панова и др., 2020).
На грызунах была показана способность АФП связывать и транспортировать эстрогены (Uriel et al., 1973; Moldogazieva et al., 2017). У человека показана связь эстрогенов с СА и бета-глобулином (Adinolfi et al., 1975).
Антиоксидантные свойства. Одним из механизмов для корректировки развития глаза является система антиоксидантной защиты. Дисбаланс между продукцией и деградацией свободных радикалов приводит к окислительному стрессу, при этом сверхэкспрессия свободных радикалов является повреждающим фактором для клеток, приводящим к нарушению процессов пролиферации, повреждению липидов, белков, нуклеиновых кислот и т.д. (Sies et al., 2017). Важнейшим свойством СА и АФП является их антиоксидантная активность (Roche et al., 2008; Taverna et al., 2013; Sitar, 2013; Choi et al., 2014).
Непрямая антиоксидантная активность СА связана с его способностью связываться с высокой степенью аффинности с молекулой билирубина вблизи Lys240 (Jacobsen, 1978). Было показано, что альбумин, связанный с билирубином, действует как ингибитор перекисного окисления белков и липидов (Stocker et al., 1987; Neuzil, Stocker, 1993).
В стекловидном теле СА и АФП и связанный с ними лютеин, обладая антиоксидантными свойствами, эффективно обеспечивают защиту сетчатки (особенно это важно для развивающейся макулы) и хрусталика, а также самого стекловидного тела, от окислительного стресса (Панова и др., 2007; Яковлева и др., 2007; Панова, Татиколов, 2011).
В экспериментах было показано, что в период фетального развития АФП демонстрирует синергетическую антиоксидантную активность в присутствии эстрадиола (Choi et al., 2014).
Раннее пренатальное развитие глаза характеризуется такими важными событиями как пролиферация и дифференцировка клеток сетчатки, апоптоз ганглиозных клеток сетчатки, процесс регрессии гиалоидных сосудов, а также формирование сосудов сетчатки, пролиферация клеток хрусталика и формирование волокон хрусталика. Все эти процессы, как правило, сопровождаются образованием свободных радикалов, активных форм кислорода, что может создавать угрозу перекисного окисления липидов. Присутствие СА, АФП и других антиоксидантов, обладающих свойствами тушителей свободных радикалов, защищает от угрозы перекисного окисления липидов в этих тканях.
ФУНКЦИОНАЛЬНАЯ ЗНАЧИМОСТЬ СА И АФП В РАННЕМ РАЗВИТИИ НЕЙРОНОВ МОЗГА И СЕТЧАТКИ
Обнаружение АФП в цереброспинальной жидкости (Jamieson, Shaw, 1975), стекловидном теле, сетчатке и хрусталике (Панова и др., 2011, 2018) и наличие специфических рецепторов в нейронах спинного и головного мозга, показанное на эмбрионах некоторых позвоночных животных (Vidal, 1983; Uriel et al., 1983), свидетельствует о важной роли АФП в развитии центральной нервной системы и сетчатки. Применение иммунопероксидазного мечения с антителами против АФП показало его присутствие в нейронах различных отделов развивающегося мозга у эмбрионов мышей, крыс и кур и локализация этого белка во внутреннем ядерном (нейробластическом) слое сетчатки 9-недельного плода обезьяны-бабуина (Uriel et al., 1983). В условиях культивирования нейронов сетчатки эмбрионов кур, путем добавления АФП в среду культивирования, было показано, что дифференцирующиеся нейроны и ганглиозные клетки захватывают АФП (Hajeri-Germond et al., 1991). Эти данные на животных позволили заключить, что внутриклеточное присутствие АФП является следствием его захвата нейронами, а не внутриклеточного синтеза (Uriel et al., 1983; Hajeri-Germond et al., 1991). Так, на развивающемся мозге мышей было показано, что mRNA к АФП и СА не детектируется в нейронах мозга, что исключает синтез этих белков нейронами мозга (Schacher, Torand-Allerand, 1982). У плодов человека в сетчатке и хрусталике присутствуют и СА, и АФП, но mRNA к этим белкам не детектировалось, в то время как в клетках печени (контроль) присутствовали mRNA к СА и АФП (Панова и др., 2016; 2018). Наличие СА и АФП в клетках центральной нервной системы и во внутреннем нейробластическом слое сетчатки у позвоночных животных объясняют их участием в дифференцировке нейронов (Schacher, Torand-Allerand, 1982; Uriel et al., 1983). Присутствие СА и АФП в стекловидном теле, которое тесно граничит с внутренней поверхностью сетчатки на всем ее протяжении, вероятно, необходимо для дифференцировки ганглиозных клеток.
СА отводится роль биологически активной молекулы, участвующей в регуляции пролиферации клеток развивающейся сетчатки (Yang et al., 2009). СА оказывает нейропротекторное действие на клетки нейронов и глии (Prajapati et al., 2011). На крысах было показано, что СА и АФП контролируют развитие эмбрионального мозга через регуляцию синтеза олеиновой кислоты астроцитами. Оба белка участвуют в росте аксонов, миграции нейронов и астроцитов, участвуют в построении синапсов, при этом АФП модулирует действие СА (García-García et al., 2015).
Имеются данные, свидетельствующие о наличии ряда общих свойств у АФП и полипептидных факторов роста. Показано, что АФП способен модулировать активность ростовых факторов, и этот эффект может осуществляться путем воздействия на различные этапы каскадного механизма передачи сигналов путем связывания факторов роста с мембранными рецепторами (Mizejewski, 2001; Moldogazieva et al., 2017). На мышах и крысах показано, что АФП с высокой степенью аффинности связывается с эстрогенами и, таким образом, участвует в регуляции половой дифференцировки мозга (Uriel et al., 1972; Aussel et al., 1973). Способность АФП связывать эстрогены позволяет предположить, что он также защищает развивающийся мозг от влияния материнских эстрогенов (Moldogazieva et al., 2017). Вместе с тем, эстрогены необходимы для запуска программы морфогенеза тканей в критические периоды развития. Они регулируют экспрессию тканевых факторов роста и их рецепторов, что необходимо для коммуникации между специализированными клетками развивающихся тканей (van der Burg et al., 1999; Bondesson et al., 2015).
Таким образом, во втором триместре гестации происходят наиболее важные ростовые и дифференцировочные процессы в развитии структур глаза человека. Максимальная концентрация СА и АФП в этот период развития свидетельствует о важном участии этих белков в процессах роста и дифференцировки развивающихся тканей глаза, оказании нейропротекторного действия на развивающиеся клетки нейронов и глии и одновременно в их антиоксидантной защите.
Проанализированная в данном обзоре динамика СА и АФП в циркуляторном русле и тканях глаза плодов человека в свете многообразия их функций определяет важную роль этих белков для развивающихся тканей глаза в пренатальном развитии человека. Кроме того, их способность связывать различные молекулы с последующей транспортировкой может послужить основой новой стратегии адресной доставки необходимых лекарственных препаратов для фетальной глазной терапии.
Финансирование. Работа частично выполнена А.С. Татиколовым в рамках раздела ГЗ ИБХФ РАН (№ 001201253314)
Конфликт интересов. Авторы заявляют, что какой-либо конфликт интересов отсутствует.
Список литературы
Панова И.Г., Татиколов А.С., Сухих Г.Т. Корреляция между содержанием альбумина и каротиноидов в стекловидном теле глаза человека в пренатальном развитии // Бюллетень экспериментальной биологии и медицины. 2007. Т. 144. № 11. С. 522–525.
Panova I.G., Tatikolov A.S., Sukhikh G.T. Correlation between the content of albumin and carotenoids in human vitreous body during prenatal development. Bulletin of Experimental Biology and Medicine. 2007. V. 144. № 5. P. 681–683.
Панова И.Г., Татиколов А.С., Полтавцева Р.А., Сухих Г.Т. Альфа-фетопротеин в стекловидном теле глаза плодов человека // Бюллетень экспериментальной биологии и медицины. 2010. Т. 150. № 10. С. 391–393.
Panova I.G., Tatikolov A.S.,Poltavtseva R.A., Sukhikh G.T. α-Fetoprotein in human fetal vitreous body // Bull. Exp. Biol. Med. 2011. V. 150. № 4. P. 420–421. https://doi.org/10.1007/s10517-011-1157-7
Панова И.Г., Татиколов А.С. Исследование содержания альфа-фетопротеина и сывороточного альбумина в стекловидном теле глаза плодов человека // Известия РАН. Сер. биологическая. 2011. № 2. С. 235–239.
Panova I.G., Tatikolov A.S. Investigation of the content of alpha-fetoprotein and serum albumin in the vitreous body of the eye of human embryos // Biol. Bull. 2011. V. 38. № 2. P. 191–194. https://doi.org/10.1134/S1062359011020105
Панова И.Г., Татиколов А.С., Смирнова Ю.А. Полтавцева Р.А., Сухих Г.Т. Альбумин в стекловидном теле, сетчатке и хрусталике глаза плодов человека // Бюллетень экспериментальной биологии и медицины. 2016. Т. 162. № 11. С. 578–580.
Panova I.G., Tatikolov A.S., Smirnova Yu.A., Poltavtseva R.A., Sukhikh G.T. Albumin in the vitreous body, retina and lens of human fetal eye // Bull. Exper. Biol. Med. 2017. V. 162. № 11. P. 629–631.
Панова И.Г., Беззубенко Ю.В., Татиколов А.С. Полтавцева Р.А., Иванец Т.Ю., Сухих Г.Т. Альфа-фетопротеин в сетчатке и хрусталике глаза человека на ранних стадиях пренатального развития // Журн. Эвол.Биох.Физ. 2018. Т. 54. № 2. С. 111–114.
Panova I.G., Bezzubenko Yu.V., Tatikolov A.S. Poltavtseva R.A., Ivanets T.Yu., Sukhikh G.T. Alpha-fetoprotein in retina and lens of the human eye at early stages of prenatal development // J. Evol. Biochem. Physiol. 2018. V. 54. № 2. P. 119–122. https://doi.org/10.1134/S0022093018020047
Панова И.Г., Сухова Ю.В., Татиколов А.С. Иванец Т.Ю. Билирубин в стекловидном теле глаза плодов человека // Бюл. Экспер.Биол. Мед. 2020. Т. 170. № 7. С. 118–120.
Panova I.G., Sukhova Y.V., Tatikolov A.S. Ivanets T.Yu. Bilirubin in the vitreous body of the eye of human fetuses // Bull. Exp. Biol. Med. 2020. V. 170. № 1. P. 98–100.
Строева О.Г. Морфогенез и врожденные аномалии глаза млекопитающих. М.: Наука, 1971. 244 с.
Яковлева М.А., Панова И.Г., Фельдман Т.Б., Зак П.П., Татиколов А.С., Сухих Г.Т., Островский М.А. Обнаружение каротиноидов в стекловидном теле глаза человека в пренатальном развитии // Онтогенез. 2007. Т. 38. № 5. С. 380–385.
Yakovleva M.A., Panova I.G., Fel’dman T.B., Zak P.P., Tatikolov A.S., Sukhikh G.T., Ostrovsky M.A. Finding of carotenoids in the vitreous body of human eye during prenatal development // Russ. J. Dev. Biol. 2007. V. 38. P. 317–321. https://doi.org/10.1134/S1062360407050062
Abelev G.I. Alpha-fetoprotein in ontogenesis and its association with malignant tumors // Adv. Cancer Res. 1971. V. 14. P. 295–358.
Adinolfi A., Adinolfi M., Lessof M.H. Alpha-fetoprotein during development and in disease // J. Med. Genetics. 1975. V. 12. P. 138–151.
Anel A., Calvo M., Naval J. Iturralde M., Alava M.A., Piiieiro A. Interaction of rat α-fetoprotein and albumin with polyunsaturated and other fatty acids: determination of apparent association constants // FEBS Letters. 1989. V. 250. № 1. P. 22–24.
Angi M., Kalirai H., Coupland S.E., Damato B.E., Semeraro F., Romano M.R. Proteomic Analyses of the Vitreous Humour // Mediators of Inflammation. 2012. V. 2012. Article ID 148039. 7 p. https://doi.org/10.1155/2012/148039
Aoyagi Y., Ikenaka T., Ichida F. a-Fetoprotein as a carrier protein in plasma and its bilirubin-binding ability // Cancer Res. 1979. V. 39. P. 3571–3574.
Aussel C., Uriel J., Mercier-Bodard C. Rat alpha-fetoprotein: isolation, characterization and estrogen-binding properties // Biochimie. 1973. V. 55. № 11. P. 1431–1437.
Azuma N., Tajima S., Konomi H. Hida T., Akiya S., Uemura Y. Glycosaminoglycan and collagen distribution in the developing human vitreous // Graefe’s Arch. Clin. Exp. Ophthalmol. 1998. V. 236. P. 679–687.
Balazs E.A., Toth L.Z., Ozanics V. Cytological studies on the developing vitreous as related to the hyaloid vessel system // Graefe’s Arch. Clin. Exp. Opthalmol. 1980. V. 213. № 2. P. 71–85.
Beebe D.C., Latker C.H., Jebens H.A. Johnson M.C., Feagans D.E., Feinberg R.N. Transport and steady-state concentration of plasma proteins in the vitreous humor of the chicken embryo: implications for the mechanism of eye growth during early development // Dev. Biol. 1986. V. 114. № 2. P. 361–368. https://doi.org/10.1016/0012-1606(86)90200-9
Berde C.B., Nagai M., Deutsch H.F. Human α-fetoprotein. Fluorescence studies on binding and proximity relationships for fatty acids and bilirubin // J. Biological Chemistry. 1979. V. 254. № 24. P. 12609–12614.
Bhosale P. Bernstein P.S. Vertebrate and invertebrate carotenoid-binding proteins // Arch. Biochem. Biophys. 2007. V. 458. P. 121–127.
Bishop P.N. Structural macromolecules and supramolecular organisation of the vitreous gel // Prog. Retin. Eye Res. 2000. V. 19. P. 323–344.
Bishop P.N., Takanosu M., Le Goff M., Mayne R. The role of the posterior ciliary body in the biosynthesis of vitreous humour // Eye. 2002. V. 16. P. 454–460.
Bondesson M., Hao R., Lin C.-Y. Williams C., Gustafsson J.-A. Estrogen receptor signaling during vertebrate development // Biochim. Biophys. Acta. 2015. V. 1849. № 2. P. 142–151. https://doi.org/10.1016/j.bbagrm.2014.06.005
Bone R.A., Landrum J.T., Fernandez L. Tarsis S.L. Analysis of the macular pigment by HPLC: retinal distribution and age study // Invest. Ophthalmol. Vis. Sci. 1988. V. 29. № 6. P. 843–849.
Bremer F.M., Rasquin F. Histochemical localization of hyaluronic acid in vitreous during embryonic development // Invest. Ophthalmol. Vis. Sci. 1998. V. 39. P. 2466–2469.
Cagianut B., Wunderly C. Protein studies on the human vitreous body // Brit. J. Ophthalmol. 1953. V. 37. P. 229–233.
Christiansen M., Høgdall C.K., Høgdall E.V.S. Alpha-fetoprotein in human fetal cerebrospinal fluid // Clinica Chimica Acta. 2000. V. 291. P. 35–41.
Choi H.Y., Kim S.W., Kim B., Lee H.N., Kim S.J., Song M., Kim S., Kim J., Kim Y.B., Kim J.H., Cho S.G. Alpha-fetoprotein, identified as a novel marker for the antioxidant effect of placental extract, exhibits synergistic antioxidant activity in the presence of estradiol // PLoS One. 2014. V. 9. № 6. e99421. https://doi.org/10.1371/journal.pone.0099421
Coakley J., Kellie S.J., Nath C. Interpretation of alpha-fetoprotein concentrations in cerebrospinal fluid of infants // Ann. Clin. Biochem. 2005. V. 42. P. 24–29. https://doi.org/10.1258/0004563053026763
Copado M.A., Ruiz-Gutierrez V., Rodriguez-Burgos A. Fatty acids and squalene carried by alpha fetoprotein, and fetal and adult serum albumin from chicken. Comparison with these from mammals // J. Protein Chem. 1999. V. 18. № 4. P 413–424.
Coulombre A.J. The role of intraocular pressure in the development of the chick eye. I. Control of eye size // J. Exp. Zool. 1956. V. 133. № 2. P. 211–225.
Coulombre A.J. The role of intraocular pressure in the development of the chick eye. II. Control of corneal size // Arch. Ophthalmol. 1957. V. 57. P. 250–253.
Coulombre A.J., Herrmann H. Lens development. III. Relationship between the growth of the lens and the growth of the outer eye coat // Exp. Eye Res. 1965. V. 4. P. 302–311.
Deutsch H.F. Chemistry and biology of alpha-fetoprotein // Adv. Cancer Res. 1991. V. 56. P. 253–312.
Elmaouhoub A., Dudas J., Ramadori G. Kinetics of albumin- and alpha-fetoprotein-production during rat liver development // Histochem. Cell Biol. 2007. V. 128. P. 431–443.
Fanali G., di Masi A., Trezza V. Marino M, Fasano M, Ascenzi P. Human serum albumin: from bench to bedside // Molecular Aspects of Medicine. 2012. V. 33. P. 209–290.
Garcı’a-Garcı’a A.G., Polo-Herna’ndez E., Tabernero A. Medina J.M. Alpha-fetoprotein (AFP) modulates the effect of serum albumin on brain development by restraining the neurotrophic effect of oleic acid // Brain Research. 2015. V. 1624. P. 45–58.
Gitlin D., Perricelli A., Gitlin G.M. Synthesis of α-fetoprotein by liver, yolk sac and gastrointestinal tract of the human conceptus // Cancer Res. 1972. V. 32. P. 979–982.
Grus F.H., Joachim S.C., Pfeiffer N. Proteomics in ocular fluids // Proteomics Clin. Appl. 2007. V. 1. P. 876–888. https://doi.org./10.1002/prca.200700105
Haggarty P. Placental regulation of fatty acid delivery and its effect on fetal growth–A Review // Placenta. 23 Suppl. A. Trophoblast Res. 2002. V. 6. P. S28–S38.
Hajeri-Germond M., Trojan J., Uriel J. Alpha-fetoprotein uptake by differentiating neuroretinal structures of the chick embryo // Dev. Neurosci. 1991. V. 13. № 3. P. 164–170.
Hankins J. The role of albumin in fluid and electrolyte balance // J. Infusion Nursing. 2006. V. 29. № 5. P. 260–265.
Hirano K., Watanabe Y., Adachi T., Sugiura M. Carrier proteins in human fetal serum: Bilirubin-binding abilities of albumin, alpha-fetoprotein and ligandin // Chem. Pharm. Bul. 1984. V. 32. P. 708–715. https://doi.org/10.1248/cpb.32.708
Hogan V.J., Alvarado J.A., Weddel J.E. Histology of the human eye. Philadelphia: W.B. Saunders Company, 1971. 687 p.
Hsia J.C., Er J.S., Tan C.T., Estes T., Ruoslahti E. α-Fetoprotein binding specificity for arachidonate, bilirubin, docosahexaenoate, and palmitate: a spin label study // J. Biol. Chem. 1980. V. 255. P. 4224–4227.
Jacobsen C. Lysine residue 240 of human serum albumin is involved in high-affinity binding of bilirubin // Biochem. J. 1978. V. 171. P. 453–459.
Jacobson B., Dorfman T., Basu P.K., Hasany S.M. Inhibition of vascular endothelial cell growth and trypsin activity by vitreous // Exp. Eye Res. 1985. V. 41. P. 581–595.
Jamieson P.N., Shaw D.G. Levels of albumin, α-fetoprotein, and IgG in human fetal cerebrospinal fluid // Arch. Dis. Child. 1975. V. 50. P. 484-485.
Jauniaux E., Gulbis B., Jurkovic D., Campbell S., Collins W.P., Ooms H.A. Relationship between protein concentrations in embryological fluids and maternal serum and yolk sac size during human early pregnancy // Hum. Reprod. 1994. V. 9. № 1. P. 161–166. https://doi.org/10.1093/oxfordjournals.humrep.a138308
Jones E.A., Clement-Jones M., James O.F.W. Wilson D.I. Differences between human and mouse alpha-fetoprotein expression during early development // J. Anat. 2001. V. 198. P. 555–559. https://doi.org/10.1046/j.1469-7580.2001.19850555.x
Kim C.K., Yang H.Y. Alpha-fetoprotein values in maternal serum and amniotic fluid for prenatal screening of genetic disorders // Yonsei Medical J. 1987. V. 28. P. 218–227. https://doi.org/10.3349/ymj.1987.28.3.218
Lazarevich N.L. Molecular mechanisms of alpha-fetoprotein gene expression // Biochemistry. 2000. V. 65. № 1. P. 117–133.
Le Goff M.M., Bishop P.N. Adult vitreous structure and postnatal changes // Eye. 2008. V. 22. P. 1214–1222. https://doi.org/10.1038/eye.2008.21
Lutty G.A., Merges C., Threlkeld A.B., Crone S., McLeod D.S. Heterogeneity in localization of isoforms of TGF-β in human retina, vitreous, and choroids // Invest. Ophthalniol. Vis. Sci. 1993. V. 34. № 3. P. 477–487.
Mandal N., Lewis G.P., Fisher S.K., Heegaard S., Prause J.U., la Cour M., Vorum H., Honoré B. Proteomic analysis of the vitreous following experimental retinal detachment in rabbits // J. Ophthalmol. 2015. V. 2015, Article ID 583040, 9 p. https://doi.org/10.1155/2015/583040
Mann I. The development of the human eye. London: Brit. Med. Assoc., 1949. 313 p.
Mizejewski G.J. Alpha-fetoprotein structure and function: relevance to isoforms, epitopes, and conformational variants // Exp. Biol. Med. 2001. V. 226. № 5. P. 377–408. https://doi.org/10.1177/153537020122600503
Mizejewski G.J. Biological roles of alpha-fetoprotein during pregnancy and perinatal development // Experimental Biology and Medicine. 2004. V. 229. P. 439–463.
Moldogazieva N.T., Shaitan K.V., Antonov M.Yu. Mokhosoev I.V., Levtsova O.V., Terentiev A.A. Human EGF-derived direct and reverse short linear motifs: conformational dynamics insight into the receptor-binding residues // J. Biomol. Struct. Dynamics. Taylor & Francis, 2017. P. 1–20. https://doi.org/10.1080/07391102.2017.1321502
Murthy K.R., Goel R., Subbannayya Y., Jacob H.K., Murthy P.R., Manda S.S., Patil A.H., Sharma R., Sahasrabuddhe N.A., Parashar A., Nair B.G., Krishna V., Prasad T.K., Gowda H., Pandey A. Proteomic analysis of human vitreous humor // Clinical Proteomics. 2014. V. 11. P. 29. http://doi.org/clinicalproteomicsjournal.com/content/11/1/29
Nayak N.C., Mital I. The dynamics of a-fetoprotein and albumin synthesis in human and rat liver during normal ontogeny // Am. J. Pathol. 1977. V. 86. P. 359–374.
Naval J., Calvo M., Laborda J., Dubouch P., Frain M., Sala-Trepat J.M., Uriel J. Expression of mRNAs for alpha-fetoprotein (AFP) and albumin and incorporation of AFP and docosahexaenoic acid in baboon fetuses // J. Biochem. 1992. V. 111. № 5. P. 649–654.
Neuzil J., Stocker R. Bilirubin attenuates radical–mediated damage to serum albumin // FEBS Lett. 1993. V. 331. P. 281–284.
Panova I.G., Sharova N.P., Dmitrieva S.B., Poltavtseva R. A., Sukhikh G.N., Tatikolov A.S. The use of a cyanine dye as a probe for albumin and collagen in the extracellular matrix // Anal. Biochem. 2007. V. 361. № 2. P. 183–189.
Panova I.G., Yakovleva M.A., Tatikolov A.S., Kononikhin A.S., Feldman T.B., Poltavtseva R.A., Nikolaev E.N., Sukhikh G.T., Ostrovsky M.A. Lutein and its oxidized forms in eye structures throughout prenatalhuman development // Exper. Eye Research. 2017. V. 160. P. 31–37.
Peyrol S., Grimaud J.-A., Pirson Y., Chayviall J.A., Touillon C., Lambert B. Ultrastructural immunoenzymatic study of α-fetoprotein-producting cells in the human fetal liver // J. Histochem. Cytochem. 1977. V. 25. № 6. P. 432–438.
Peters Jr.T. All about albumin: biochemistry, genetics, and medical application. N.Y.: Acad. Press, 1996. 432 p.
Prajapati K.D., Sharma S.S., Roy N. Current perspectives on potential role of albumin in neuroprotection // Rev. Neurosci. 2011. V. 22. № 3. P. 355–363.
Roche M., Rondeau P., Singh N.R., Tarnus E., Bourdon E. The antioxidant properties of serum albumin // FEBS Lett. 2008. V. 582. P. 1783–1787.
Ruoslahti E., Seppala M. α-Fetoprotein in cancer and fetal development // Adv. Cancer Res. 1979. V. 29. P. 275–346.
Sabah J., McConkey E., Welti R., Albin K., Takemoto L.J. Role of albumin as a fatty acid carrier for biosynthesis of lens lipids // Exp. Eye Res. 2005. V. 80. P. 31–36.
Saint-Geniez M., D’Amore P.A. Development and pathology of the hyaloid, choroidal and retinal vasculature // Int. J. Dev. Biol. 2004. V. 48. P. 1045–1058.
Schachter B.S., Toran-Allerand C.D. Intraneuronal alpha-fetoprotein and albumin are not synthesized locally in developing brain // Brain Res. 1982. V. 281. № 1. P. 93–98. https://doi.org/10.1016/0165-3806(82)90116-x
Sebag J. Embryology of the vitreous. In: Sebag J. The Vitreous: Structure, Function, and Pathobiology. N.Y: Springer-Verlag, 1989. P. 7–14.
Sebag J. Molecular biology of pharmacologic vitreolysis // Trans. Am. Ophthalmol. Soc. 2005. V. 103. P. 473–494.
Sebag J., Yee K.M.P. Vitreous: from biochemistry to clinical relevance. In: Tasman W, Jaeger EA, eds. Duane’s Foundations of Clinical Ophthalmology. Philadelphia: Lippincott Williams& Wilkins, 2007. P. 1–67.
Seller M.J. Alphafetoprotein in midtrimester Down’s syndrome fetal serum // J. Med. Genet. 1990. V. 27. P. 240–243.
Sies H., Berndt C., Jones D.P. Oxidative stress // Annu. Rev. Biochem. 2017. V. 86. P. 715–748. https://doi.org/10.1146/annurev-biochem-061516-045037
Sitar M.E., Aydin S., Cakatay U. Human serum albumin and its relation with oxidative stress // Clin. Lab. 2013. V. 59. P. 945–952.
Smith J.A., Francis T.I., Edington G.M., Williams A.O. Human alpha-fetoprotein in body fluids // Brit. J. Cancer. 1971. V. 25. № 2. P. 337–342.
Stocker R., Glazer A.N., Ames B.N. Antioxidant activity of albumin-bound bilirubin // Proc. Natl. Acad. Sci. USA. 1987. V. 84. P. 5918–5922.
Stroeva O.G., Panova I.G. Retinal pigment epithelium: pattern of proliferative activity and its regulation by intraocular pressure in postnatal rats // J. Embryol. Exp. Morph. 1983. V. 75. P. 271–291.
Szajkowski T.P., Chodirker B.N., McDonald K.M., Evans J.A. Maternal serum alpha-fetoprotein levels in fetal hydrocephalus: a retrospective population based study // BMC Pregnancy and Childbirth. 2006. V. 6. P. 23.
Taverna M., Marie A.L., Mira J.P., Guidet B. Specific antioxidant properties of human serum albumin // Annals Intensive Care. 2013. V. 3. P. 4.
Tinoco J., Babcock R., Hincenbergb I., Medwadowski B., Miljanich P., Williams M.A. Linoleic acid deficiency // Lipids. 1976. V. 14. P. 166–173.
Tomasi T.B. Structure and function of alpha-fetoprotein // Annu. Rev. Med. 1977. V. 28. P. 453–465.
Trojan J., Uriel J. Immunocytochemical localization of alpha-fetoprotein (AFP) and serum albumin (ALB) in ecto-, meso- and endodermal tissue derivatives of the developing rat // Oncodev. Biol. Med. 1982. V. 3. P. 13–22.
Uriel J., de Nechaud B., Dupiers M. Estrogen-binding properties of rat, mouse and man fetospecific serum proteins. Demonstration by immuno-autoradiographic methods // Biophys. Biochim. Res. Commun. 1972. V. 46. № 3. P. 1175–1180.
Uriel J., Aussel C., Bouillon D., de Nechaud B. Localization of rat liver alpha-fetoprotein by cell affinity labeling with tritiated oestrogens // Nature New Biol. 1973. V. 244. P. 190–192.
Uriel J., Trojan J., Moro R., Pineiro A. Intracellular uptake of α-fetoprotein: a marker of neural differentiation // Ann. N.Y. Academy of Sciences. 1983. V. 417. P. 321–329.
van Houwelingen A. C., Puls J., Hornstra G. Fetal essential fatty acid (EFA) status during early human development: relationship with maternal EFA status // Am. J. Clin. Nutr. 1993. V. 57. P. 814S. https://doi.org/10.1093/ajcn/57.5.814S
van der Burg B., Sonneveld E., Lemmen J.G., van der Saag P.T. Morphogenetic action of retinoids and estrogens // Int. J. Dev. Biol. 1999. V. 43. P. 735–743.
Vidal R.M. Selective localization of alpha-fetoprotein and serum albumin within the sensoty ganglia cells of developing chicken // Neuroscience Letters. 1983. V. 41. P. 253–257.
Vítek L., Ostrow J.D. Bilirubin chemistry and metabolism; harmful and protective aspects // Curr. Pharm. Design. 2009. V. 15. P. 2869–2883.
Wathen N.C., Campbell D.J., Kitau M.J., Char T. Alphafetoprotein levels in amniotic fluid from 8 to 18 weeks of pregnancy // Brit. J. Obstetrics and Gynaecology. 1993. V. 100. P. 380–382.
Weale R.A. Guest editorial: notes on the macular pigment // Ophthal. Physiol. Opt. 2007. V. 27. P. 1–10.
Wu C.W., Sauter J.L., Johnson P.K., Chen C.-D., Olsen T.W. Identification and localization of major soluble vitreous proteins in human ocular tissue // Am. J. Ophthalmol. 2004. V. 137. P. 655–661.
Yachnin S. The clinical significance of human alpha-fetoprotein // Ann. Clin. Lab. Sci. 1978. V. 8. P. 84–90.
Yamane K., Minamoto A., Yamashita H. Takamura H., Miyamoto-Myoken Y., Yoshizato K., Nabetani T., Tsugita A., Mishima H.K. Proteome analysis of human vitreous proteins // Molecular Cellular Proteomics. 2003. № 2. P. 1177–1187. https://doi.org/10.1074/mcp.M300038-MCP200
Yang J., Klassen H., Pries M., Wang W., Nissen M.H. Vitreous humor and albumin augment the proliferation of cultured retinal precursor cells // J. Neurosci. Res. 2009. V. 87. № 2. P. 495–502.
Yee K.M.P., Feener E.P., Madigan M., Jackson N.J., Gao B.-B., Ross-Cisneros F.N., Provis J., Aiello L.P., Sadun A.A., Sebag J. Proteomic analysis of embryonic and young humanvitreous // Invest. Ophthalmol. Vis. Sci. 2015. V. 56. P. 7036–7042. https://doi.org/10.1167/iovs.15-16809
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


