Известия РАН. Серия биологическая, 2023, № 3, стр. 235-245
Фотохимия и сигнальная активность криптохромов растений. Обзор
Г. Я. Фрайкин 1, *, Н. С. Беленикина 1
1 Московский государственный университет им. М.В. Ломоносова, биологический ф-т
119234 Москва, Россия
* E-mail: nata.belenikina@ya.ru
Поступила в редакцию 05.04.2022
После доработки 10.07.2022
Принята к публикации 11.07.2022
- EDN: HKBFVO
- DOI: 10.31857/S1026347022700111
Аннотация
Криптохромы составляют обширный класс сенсорных рецепторов синего света, которые у растений регулируют процессы развития и циркадный ритм. Эти фоторецепторы могут также действовать как магниторецепторы. Криптохромы связывают в качестве хромофора флавинадениндинуклеотид (ФАД) в гомологичном ДНК-фотолиазе домене PHR; вблизи ФАД-связывающего сайта к нему присоединено C-концевое удлинение CCE. Активация криптохрома инициируется фотореакциями ФАД с переносом электрона/протона и образованием редокс-форм. При фотовосстановлении ФАД белок подвергается конформационному изменению, вызывающему разобщение PHR-домена и CCE, что сопровождается образованием функционально активных олигомеров криптохромных молекул. Фотоолигомеризация рассматривается как ключевой процесс, необходимый для сигнальной активности криптохромов.
Свет – источник энергии для растений, которые в процессе фотосинтеза трансформируют световую энергию в биохимически доступную форму энергии. Вместе с тем свет действует как ключевой регуляторный сигнал, необходимый для роста и морфогенетического развития растений. Восприятие растениями световых сигналов осуществляется несколькими фоторецепторами, включая сенсор ультрафиолетового света (УФ-света) B-области (УФВ, 290–320 нм), белок UV resistance 8 (UVR8), сенсоры УФ-света А-области (УФА)/синего света (320–400 нм/400–500 нм), криптохромы и фототропины, а также сенсоры красного/дальнего красного света (600–750 нм) фитохромы (Фрайкин, 2018).
Криптохромы (cryptochromes, CRY) – флавопротеиновые фоторецепторы, найденные у организмов всего биологического царства (Chaves et al., 2011; Losi, Gartner, 2012; Dasgupta et al., 2016; Michael et al., 2017). Криптохромы растения Arabidopsis thaliana CRY1/2 ближе к N-концу содержат консервативный домен PHR (photolyase homology region), который выполняет фотосенсорную функцию и имеет высокую степень гомологии с фотолиазами – ферментами, осуществляющими светозависимую репарацию ДНК. В PHR-домене имеются два кармана для хромофорных группировок: ближе к C-концу связывается флавин (ФАД), ближе к N-концу может располагаться птерин (5,10-methenyltetrahydrofolate, MTHF). Индуцированный синим светом внутримолекулярный перенос электрона/протона к возбужденному состоянию ФАД считается первичным механизмом фотоактивации криптохрома. Образование в результате этой реакции нейтрального радикала ФАДН• определяет способность фоторецептора поглощать зеленый, желтый и красный свет в области 500–650 нм in vitro. Зеленый свет, добавленный к синему свету, ингибирует опосредованный криптохромом фотофизиологический ответ. Поэтому криптохром с ФАДН рассматривается как биологически активное состояние фоторецептора. При поглощении зеленого света этим радикалом равновесие сдвигается в сторону формирования неактивного состояния криптохрома с анион-восстановленной формой флавина ФАДН− (Ahmad, 2016). Таким образом, активация криптохрома посредством фотовосстановления ФАД является обратимым механизмом и, как продемонстрировано при изучении фотоиндуцированного удлинения гипокотиля A. thaliana, криптохромы – это не только сенсоры синего света, но и сенсоры отношения синего света к зеленому свету (Sellaro et al., 2010). В этом проявляется определенная аналогия криптохромов с фитохромами – сенсорами красного (К)/дальнего красного (ДК) света. Фитохром в неактивной форме, поглощающей К-свет с максимумом при 660–670 нм, под действием К-света переходит в физиологически активную форму, поглощающую ДК-свет с максимумом при 730 нм. Фотоиндуцированное взаимопревращение двух форм фитохрома – результат прямой и обратной изомеризации его билинового хромофора. Эти реакции лежат в основе действия фитохрома как молекулярного фотопереключателя в растительной клетке. В процессе фотообратимого перехода между двумя формами фитохрома устанавливается зависимое от длины волны равновесие, делающее эту фоторецепторную систему эффективным сенсором фотонов в К/ДК-области спектра, а также сенсором отношения К-света к ДК-свету. Хотя первичные фотохимические реакции хромофоров у фитохромов и криптохромов различаются, криптохромы тоже можно считать молекулярными фотопереключателями при действии синего и зеленого света на растительную клетку (Фрайкин и др., 2013).
Помимо фотосенсорного PHR-домена белки CRY1/2 имеют также удлиненную C-концевую часть (CCE); она менее консервативна и отвечает за связывание криптохрома с сигнальными белками и трансдукцию сигнала (Zoltowski, 2015). У CRY1 и CRY2 CCE-домен состоит из 180 и 110 аминокислотных остатков (а.о.) соответственно. В темноте CCE-домен сильно связан PHR-доменом, но после фотоактивации высвобождается из ядра PHR и переходит в неупорядоченное состояние. Деструктурированная часть CCE из 80 а.о. становится затем доступной для взаимодействия с некоторыми белками – компонентами сигнальных путей криптохромов. У фотолиаз CCE-домен отсутствует, а у криптохромов играет роль эффекторного домена. Ранее считалось, что PHR криптохромов растений действует только как фотосенсорный домен. Однако полученные недавно данные о физическом взаимодействии большинства известных в настоящее время сигнальных белков с PHR-доменом криптохромов позволяют считать, что PHR, как и CCE, тоже может выполнять функцию эффекторного домена (Wang et al., 2018).
Принято считать, что криптохромы эволюционировали от фотолиазного предшественника. Подтверждением общих эволюционных корней фотолиаз и криптохромов может служить открытие у гриба Aspergillus nidulans гена, кодирующего белок с двойной функцией – фотолиазной и регуляторной. Белки с комбинированной функцией обнаружены также у диатом и зеленых водорослей (Konig et al., 2017; Kottke et al., 2017; Вечтомова и др., 2020). Криптохромы, как и фотолиазы, содержат в качестве основного хромофора ФАД, однако, в отличие от его каталитической функции у фотолиаз, у криптохромов ФАД определяет главным образом их фотосенсорные свойства. Большинство криптохромов не способны катализировать фоторепарацию ДНК. Однако отдельные их представители, относящиеся к семейству криптохромов/фотолиаз (CPF), сохраняют эту способность. Эти криптохромы обладают как ДНК-репарирующей активностью, так и фоторегуляторными свойствами.
Согласно современной филогенетической и функциональной классификации (Ozturk, 2017; Вечтомова и др., 2020), белки CPF подразделяются на четыре класса. Среди них отметим два основных: растительные криптохромы и подобные им белки (plant-like, pCRY) и криптохромы животных и схожие с ними белки (animal-like, aCRY). Водоросль Chlamydomonas reinhardtii содержит два белка: pCRY (Chlamydomonas photolyase homologue 1, CPH1), а также aCRY (CraCRY) – бифункциональный белок, проявляющий фотолиазную активность и функцию регуляторов экспрессии генов (Kottke et al., 2017).
Почти все белки CPF подвергаются светоиндуцированной реакции, называемой фотоактивацией, в которой каталитически неактивный ФАД при фотовозбуждении отрывает электрон от соседнего триптофана. В восстановленном состоянии флавиновый хромофор либо инициирует трансдукцию сигнала (ФАДН•), либо после дальнейшего поглощения фотона катализирует репарацию ДНК (ФАДН–). Быстрый перенос электрона с поверхности белка на ФАД обеспечивается триадой триптофанов. Этот внутримолекулярный путь переноса электрона удлиняется у CraCRY и криптохрома Drosophila melanogaster (dCRY) за счет четвертого ароматического остатка (Paulus et al., 2015; Oldemeyer et al., 2016) – триптофана (dCRY) или тирозина (CraCRY).
По современным представлениям, фотоактивация криптохромов растений начинается с поглощения фотона синего света хромофором ФАД и его фотовосстановления. Это приводит к конформационным изменениям, вызывающим разобщение PHR- и CCE-доменов и последующий переход фоторецептора из конформации с закрытым CCE-доменом в конформацию с открытым CCE-доменом. Такие изменения сопровождаются формированием гомодимеров и гомотетрамеров криптохромов, которые необходимы для образования их комплексов с различными сигнальными белками (Chen et al., 2022). Взаимодействия в таких комплексах изменяют активность сигнальных белков, обеспечивая тем самым регуляцию ими экспрессии генов и программ развития растений.
Цель работы – обобщение и анализ недавно полученных данных о молекулярных основах фотосенсорных и сигнальных процессов, запускаемых фотореакциями ФАД-хромофора у криптохромов растений.
Фотовозбужденные состояния и редокс-формы флавиновых хромофоров
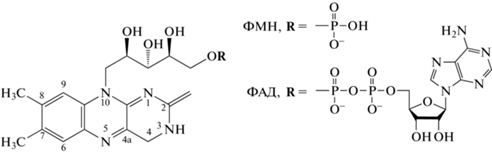
Фотофизические, фотохимические и спектроскопические свойства флавинов определяются системой сопряженных двойных связей их изоаллоксазинового кольца (рис. 1). При поглощении фотона УФА/синего света происходит перераспределение заряда в изоаллоксазиновом кольце и изменение редокс-потенциала флавина, что инициирует его фотохимические превращения, вовлекающие перенос электрона/протона и образование редокс-форм. Результаты теоретического изучения изоаллоксазинового кольца свидетельствуют, что как первое синглетное (S1), так и триплетное (T1) возбужденные состояния флавинов соответствуют π–π*-переходам. Однако свойства этих состояний ФАД и флавинмононуклеотида (ФМН), служащего хромофором у фототропинов, отличаются. У ФМН T1-состояние формируется с высоким квантовым выходом (φ = 0.5–0.7). При этом эффективное заселение T1-уровня ФМН, ответственное за фотохимическую активность этого хромофора, определяется исключительно внутренним свойством изоаллоксазинового кольца. Хромофор криптохромов ФАД отличается от ФМН тем, что на проявление свойств фотовозбужденного изоаллоксазина влияет пространственная близость второго гетероцикла – аденина. Создаваемое ими стэкинг расположение (стопочная U-образная конфигурация) обусловливает фотоиндуцированный внутримолекулярный перенос электрона. Это приводит к тушению S1-состояния, снижению интенсивности флуоресценции с максимумом при 520–530 нм и значительному ослаблению формирования T1-состояния ФАД (Losi, Gartner, 2012).
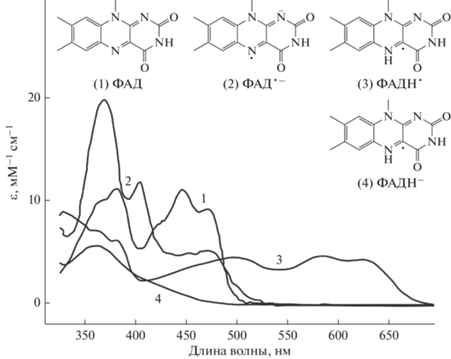
У криптохромов растений ФАД может существовать в четырех формах: полностью окисленной (ФАД), анион-радикальной (ФАД•–), нейтральной радикальной (ФАДH•) и анион-восстановленной (ФАДН–). Восстановление фотовозбужденного флавина (ФАД*) включает следующие реакции:
Согласно теоретически рассчитанным абсорбционным электронным спектрам с колебательно разрешенной структурой, у всех редокс-форм ФАД энергетически наинизший максимум представлен одним электронным переходом типа π–π*, сосредоточенным в центре изоаллоксазинового кольца (Schwinn et al., 2020). Анализ этих спектров показывает, что в целом они согласуются с экспериментальными абсорбционными спектрами ФАД (рис. 2). Все редокс-формы ФАД имеют в спектрах поглощения максимум в области УФА при 360–370 нм. У анион-восстановленной формы ФАДН– максимум в этой области единственный (видимый свет ФАДН– поглощает очень слабо). У полностью окисленной формы ФАД максимум в видимой области спектра расположен при 450 нм, анион-радикал ФАД•– имеет максимумы при 410 нм и 470 нм. У ФАДН• максимумы сильно сдвинуты из синей области в зеленую и красную области спектра между 500 и 650 нм; это принципиальное отличие нейтрального радикала от ФАД и ФАД•–. Как видно из приведенных данных, каждая редокс-форма ФАД характеризуется специфическими максимумами в спектрах поглощения. Поэтому абсорбционные спектры в области УФА и видимой области предоставляют важную информацию о редокс-состояниях хромофора ФАД в фоторецепторных белках.
Фотохимия ФАД-хромофора в белках CPF и фотоактивация криптохромов
Структурное сходство между PHR-доменом криптохромов и фотолиазами, особенно в белковом кармане, связывающем флавин, определяет общий принцип их реагирования на свет: у обоих типов белков фотоиндуцированное возбуждение хромофора инициирует реакции переноса электрона. Однако механизмы фотохимических процессов у криптохромов и фотолиаз фундаментально различаются. Это, в частности, выражается в редокс-состояниях хромофора ФАД в ходе его фотоциклов. Активация светом фотолиаз происходит с участием двух хромофоров: каталитического ФАД, существующего в основном состоянии в анион-восстановленной форме (ФАДН–), и антенного хромофора. У большинства фотолиаз функцию антенного хромофора выполняют MTHF или 8-гидроксидезазафлавин (8-hydroxydeazaflavin, 8-HDF). Указанные хромофоры имеют более высокие коэффициенты молярного поглощения в области УФА (ε370 нм = 29 000 M–1 см–1 у MTHF или ε400 нм = = 25 000 M–1 см–1 у 8-HDF) по сравнению с ФАДН– (ε370 нм = 8000 M–1 см–1 или ε400 нм = = 2800 M–1 см–1). Это увеличивает количество поглощенных фотонов, используемых для фотофизического резонансного переноса энергии возбуждения к ФАДН–, повышая его потенциал восстанавливать повреждения ДНК как первый этап в процессе репарации. Кроме того, может значительно повышаться скорость репарации ДНК, что важно в условиях слабой освещенности.
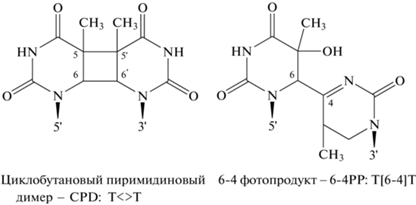
Главные индуцированные УФ-излучением повреждения ДНК – это циклобутановые пиримидиновые димеры (cyclobutane pyrimidine dimers, CPD) и пиримидин (6-4) пиримидоновые фотопродукты (pyrimidine 6-4 pyrimidone photoproducts, 6-4PP) (рис. 3). Ферменты, репарирующие CPD или 6-4PP, названы соответственно CPD-фотолиазами или (6-4) фотолиазами (Zhang et al., 2017). Несмотря на сходство структур двух типов фотолиаз и первичной фотохимии их флавинового кофактора, квантовый выход фоторепарации (6-4) фотолиазами (φ = 0.1) значительно меньше квантового выхода фоторепарации CPD-фотолиазами (φ = 0.7–0.9). Это обусловлено тем, что фоторепарация 6-4PP по сравнению с CPD более сложная реакция.
Рис. 3.
Индуцированные УФ-излучением повреждения ДНК на примере оснований тимина (T), расположенных в одной цепи ДНК.
При связывании фотолиазы с участком ДНК, содержащим CPD или 6-4PP, образуется стабильный комплекс. В нем эти фотопродукты оказываются в тесном (в пределах действия ван-дер-ваальсовых сил) контакте с ФАДН–. В каталитическом акте происходит перенос электрона от фотовозбужденного ФАДН– к повреждению ДНК, что приводит к образованию комплекса с переносом заряда между нейтральным радикалом флавина (ФАДН•) и анион-радикалом CPD или 6-4PP. Далее, в анион-радикале CPD происходит перераспределение электронной плотности и расщепление циклобутанового кольца на два исходных пиримидина, а ФАДН• восстанавливается обратным переносом избыточного электрона в активную форму ФАДН–, участвующую в последующих фотокаталитических циклах.
В анион-радикале 6-4PP C6 5'-основания соединен с C4 3'-основания; при этом OH-группа при C4 3'-основания перемещена к C5 5'-основания (рис. 3). В отличие от CPD, в котором разрыв 5–6-связей восстанавливает основания в их исходные формы, в анион-радикале 6-4PP разрыв связей C6–C4 и C5–OH приводил бы к формированию двух поврежденных оснований, т.е. репарации ДНК не происходило бы. Поэтому для репарации 6-4PP фермент должен катализировать не только реакции разрыва связей, но и реакцию переноса OH-группы. Однако поскольку интермедиат в форме анион-радикала 6-4PP не может подвергаться этим двум согласованным реакциям, была предложена модель, согласно которой формирование неповрежденных пиримидинов (после разрыва связей C4–C6 и C5–OH) возможно при условии превращения анион-радикала в другой интермедиат – оксетан (Zhang et al., 2017).
Недавно этот механизм подтвержден данными кристаллографического анализа структуры комплекса PHR CraCRY с фрагментом ДНК, содержащим 6-4PP (Franz et al., 2018). Из анализа следует, что в формировании интермедиата оксетана ключевую роль играют два остатка гистидина в активном сайте, которые вовлекаются в перенос протонов. В соответствии с полученными результатами механизм репарации ДНК (6-4) фотолиазой предполагает поглощение второго фотона для перехода от интермедиата оксетана к разрыву связей C4–C6 и C5–OH. Эта вторая стадия аналогична однофотонной репарации димеров пиримидинов CPD-фотолиазами.
Большинство данных по фотохимии криптохромов получено при изучении CRY1/CRY2 A. thaliana, CPH1 и CraCRY C. reinhardtii и dCRY D. melanogaster (Hense et al., 2015; Paulus et al., 2015; Ahmad, 2016; Lacombat et al., 2019; Oldemeyer et al., 2020; Goett-Zink, Kottke, 2021). В отличие от фотолиаз, эти криптохромы в основном состоянии содержат ФАД в окисленной форме и обычно (за исключением CraCRY, который дополнительно встраивает хромофор 8-HDF,) не связывают антенный хромофор.
В исследованиях CRY1 и CPH1 с применением спектроскопии временного разрешения установлено, что при поглощении синего света ФАД в синглетном возбужденном состоянии восстанавливается в анион-радикал (ФАД•–) посредством переноса электрона от соседнего остатка триптофана – компонента консервативной триады триптофанов. Сверхбыстрые реакции переноса электрона от триптофана (Три1Н) к ФАД и между концевым триптофаном (Три3Н) и (Три1Н) происходят за 0.4 пикосекунды и 31 пикосекунду соответственно. Они сопровождаются формированием катион-радикала концевого триптофана (Три3Н•+), который после депротонирования переходит в радикал ${\text{Три}}_{3}^{\centerdot }$. Последующее взаимодействие нейтрального радикала триптофана с остатком тирозина (ТирОН) вызывает его восстановление до Три3Н и образование радикала тирозина (ТирО•) в течение нескольких миллисекунд (Thoing et al., 2015).
Образующийся при фотовосстановлении ФАД анион-радикал (ФАД•–) протонируется у CRY1 и CPH1 в течение нескольких микросекунд и переходит в нейтральный радикал (ФАДН•). Согласно полученным данным, донором протона в этой реакции может служить близко расположенный к изоаллоксазиновому кольцу флавина остаток аспарагиновой кислоты (Асп396). Очевидно, что исчезновение радикала ФАД•– отделено от процессов внутри триады триптофанов, поскольку его протонирование и переход в форму ФАДН• задержано во времени на 6–7 порядков по отношению к изначальному переносу электрона. Однако такое отчетливое разделение двух процессов представляется удивительным, если учесть, что донор протона Асп396 находится в непосредственной близости к флавину. Объяснение этого противоречия может состоять в том, что для переноса протона аспарагиновой кислоте требуется предварительная структурная реорганизация, так как Асп396 формирует водородную связь с атомом кислорода белковой структуры (Thoing et al., 2015).
Интересно, что Асп396 сохранен только у криптохромов растений, тогда как у криптохрома дрозофилы dCRY он замещен остатком цистеина. Вероятно, этим объясняется отсутствие сопряженного с переносом электрона протонирования при фотовосстановлении ФАД у dCRY и образование только анион-радикала ФАД•–. В пользу этого предположения свидетельствуют данные, согласно которым замена Асп396 на цистеин в PHR-домене CPH1 полностью блокирует перенос протона (Thoing et al., 2015).
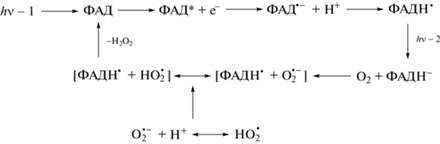
Важное следствие реакции протонирования – стабилизация радикала флавина в состоянии ФАДН˙ и продление его времени жизни до нескольких миллисекунд in vitro и нескольких минут in vivo (Herbel et al., 2013; Hense et al., 2015). Как отмечено выше, в отличие от всех других редокс-форм флавина, имеющих поглощение только в синей области, ФАДН• поглощает в зеленой и красной области (500–650 нм). Это свойство ФАДН˙ способствовало установлению его роли как сигнальной формы флавинового хромофора у криптохромов растений. Было показано, что добавление зеленого света подавляет контролируемый криптохромом физиологический ответ на синий свет. Антагонистическое действие зеленого света по отношению к синему свету коррелировало с уменьшением концентрации ФАДН• в результате его фотовосстановления в неактивную форму ФАДН−. Последующая реакция ФАДН− с кислородом приводит к регенерации исходного окисленного состояния ФАД (Ahmad, 2016). Фотоцикл ФАД, включающий последовательные его редокс превращения в криптохромах растений, можно представить в виде схемы, приведенной на рис. 4.
Рис. 4.
Схема фотоцикла ФАД-хромофора в криптохромах растений с последовательными его превращениями в три редокс-формы. Цикл завершается окислением ФАДН− молекулярным кислородом в исходную форму ФАД. На первой стадии окисления интермедиатом может быть радикальная пара [ФАДН• + ${\text{O}}_{2}^{{\centerdot - }}$]. На второй стадии в радикальной паре супероксид ${\text{O}}_{2}^{{\centerdot - }}$ заменен на свою протонированную форму ${\text{HO}}_{2}^{\centerdot },$ с которой он находится в равновесии и которая окисляет ФАДН• в ФАД с выходом H2O2 (Muller, Ahmad, 2011); hν-1 – фотон синего света (450 нм), hν-2 – фотон длинноволнового видимого света в области 500–650 нм.
Как уже было отмечено, сигнальная активность криптохромов обеспечивается их CCE-доменом, тогда как PHR-домен осуществляет регулируемый светом контроль над функцией CCE. После фотоактивации CCE высвобождается и может затем взаимодействовать с компонентами сигнальных путей криптохрома. Однако до недавнего времени вопрос о том, как высвобождение CCE связано с фотохимией криптохрома, оставался невыясненным.
В исследовании с применением ИК-спектроскопии временного разрешения обнаружено, что после формирования сигнальной формы ФАДН•, в N-концевом α/β-субдомене PHR CPH1 в течение 500 микросекунд происходит заметное изменение структуры β-листа. На основании полученных результатов выдвинуто предположение о ключевой роли β-листа во взаимодействии PHR и CCE, а также роли его деструктуризации в сигнальном процессе (Thoing et al., 2015). Интересно, что у CRY1 переход CCE в неупорядоченное состояние происходит за время 100 миллисекунд после формирования ФАДН•, т.е. намного позже. В предложенной на основе этих данных модели показано, как структурные изменения согласуются во времени с фотохимией флавинового хромофора у криптохромов растений.
Структурные аспекты фотоолигомеризации криптохромов и их взаимодействия с сигнальными белками
Как следует из рассмотренных выше данных, криптохромы с фотовосстановленным ФАД подвергаются конформационным изменениям, приводящим к разобщению PHR- и CCE-доменов. В последнее время показано, что этот процесс может вызывать изменения во взаимодействии между молекулами криптохромов, сопровождаемые их олигомеризацией. Фотоолигомеризация требуется для функциональной активности криптохромов растений, так как обеспечивает повышение их сродства к другим белкам (Yang et al., 2017; Liu et al., 2020). К известным в настоящее время 30 белкам, взаимодействующим с криптохромами, относятся, например, транскрипционные факторы CRY-interacting basing helix-loop-helix – bHLHs (CIBs), комплекс репрессоров фотоморфогенеза constitutive photomorphogenic1 (COP1)/supressors of phytochrome A (SPAs) и ингибиторы криптохромов (blue-light inhibitors of CRYs, BICs). В результате взаимодействия в комплексе гомоолигомера криптохрома с белками изменяется их сигнальная активность, что приводит к изменению экспрессии генов и регуляции программ развития растений (Wang, Lin, 2020b).
Комплексы CRY–CIB. Фотоактивированный CRY2 при взаимодействии с CIB1 опосредует регуляцию им транскрипции гена flowering locus T (FT), кодирующего центральный регулятор инициации цветения. При этом CRY2 не изменяет сродство CIB1-белка к ДНК или хроматину (Liu et al, 2008). Однако, как недавно показано, CIB1 напрямую взаимодействует с другим транскрипционным фактором – CONSTANS (CO), и это вызывает активацию транскрипции гена FT (Liu et al., 2018). На основании установленного факта предполагается, что CRY2 может опосредованно регулировать FT-транскрипцию путем изменения CIB1–CO-взаимодействия. Точный механизм, лежащий в основе CRY2-индуцированной активации белка CIB1 или его комплекса с белком CO, пока неизвестен.
Взаимодействие криптохромов с COP1–SPA-комплексами. Ключевой репрессор фотоморфогенеза растений сигнальный белок COP1 действует в комплексе с белками SPA (SPA1–SPA4). Этот тетрамерный комплекс из двух COP1- и двух SPA-белков выполняет функцию E3 убиквитин лигазы, связанную с убиквитинизацией и протеасомной деградацией различных белков – компонентов сигнальных путей фоторецепторов (Hoecker, 2017). Взаимодействие фотоактивированных криптохромов с белком SPA1 в комплексе CRY–COP1–SPA1 и подавление ими COP1–SPA1-лигазной активности обеспечивает стабилизацию транскрипционных факторов, таких как long hypocotyl 5 (HY5) и CO (Lian et al., 2011). Один из предложенных механизмов инактивации криптохромом COP1–SPA1 заключается в диссоциации взаимодействия между этими белками.
Интересно, что CRY1 и CRY2 взаимодействуют с белком SPA1разными структурными элементами. У CRY2 PHR-домен взаимодействует с киназным доменом SPA1 в ответ на синий свет, и это инициирует усиление CRY2–COP1-взаимодействия (Zuo et al., 2011). Вопрос о том, как конкретно взаимодействие CRY2 с белком SPA1 в комплексе COP1–SPA1 ингибирует убиквитин-лигазную активность, остается пока нерешенным. В противоположность этому, у CRY1 CCE-домен взаимодействует с WD-40-доменом белка SPA1в ответ на синий свет, и это приводит к подавлению взаимодействия COP1–SPA1 и, соответственно, к ингибированию лигазной активности (Lian et al., 2011; Liu et al., 2011). Таким образом, CRY1 действует, очевидно, как светозависимый конкурентный ингибитор взаимодействия в комплексе COP1–SPA1 и его E3-лигазной активности.
Хотя о деталях сложных взаимодействий в тройном комплексе CRY–COP1–SPA1 пока известно мало, представляется очевидным, что криптохромы могут напрямую взаимодействовать с COP1(возможно, независимо от света), тогда как их взаимодействие с белком SPA1 – процесс светозависимый. Необходимо, однако, отметить, что в растительных клетках определено светозависимое формирование комплекса CRY1–COP1 (Holtkotte et al., 2017), объясняемое светозависимым CRY1–SPA1-взаимодействием in vivo. При взаимодействии CRY–SPA световой сигнал трансформируется в изменение тройного комплекса CRY–SPA–COP1, сопровождаемое подавлением убиквитин-лигазной активности, что лежит в основе регуляции стабильности сигнальных белков и экспрессии генов.
Фотоолигомеризация криптохромов. Как уже отмечалось, для функциональной активности криптохромных белков требуется их фотоолигомеризация. Однако ключевые детали структурных основ этого процесса не были точно определены. Особенно это касается структурных изменений в гомодимере криптохрома, на основании которых можно было бы его отличить от структуры мономера.
Для решения этого вопроса проведено генетическое изучение связи структуры и функции у криптохромов растений (Gao et al., 2015; Liu et al., 2019). Показано, что мутации остатков триптофана Три-триады у CRY1 или CRY2 блокируют каскад переноса электрона и фотовосстановление ФАД in vitro, но не влияют на их физиологическую активность in vivo. Мутант Три374аланин (Ала) у CRY2 проявляет конститутивную, т.е. не зависимую от света, физиологическую активность. Используя преимущество этого мутанта, недавно определены структуры гомоолигомеров криптохромов. В отличие от дикого типа CRY2, который подвергается фотоолигомеризации, мутант Три374Ала CRY2 проявляет гомоолигомеризацию in vitro. Этот результат согласуется с данными о том, что фотоолигомеризация требуется для функциональной активности CRY2 и что мутант Три374Ала CRY2 конститутивно активен in vivo (Wang, Lin, 2020a).
Методом низкотемпературной электронной микроскопии с визуализацией выявлены конфигурации гомодимера и гомотетрамера мутанта Три374Ала CRY2, у которого эти олигомеры формируются посредством взаимодействий поверхностей PHR-доменов. Мутации в интерфейсе CRY2 приводили к уменьшению сродства гомодимера к сигнальному белку CIB1. На основании этого факта предположено, что CIB1 взаимодействует с CRY2 в интерфейсе гомодимера, и, вероятно, поэтому именно олигомеры, а не мономеры являются активными формами криптохромов (Shao et al., 2020). Отметим, что большинство остатков, находящихся в одном из двух интерфейсов CRY-тетрамера, являются консервативными у криптохромов растений, но не у криптохромов животных. В этой связи было бы интересно определить, требуется ли гомоолигомеризация для функционирования данной группы криптохромов, которые могли развить иные структуры интерфейсов, или зависимый от димеризации механизм фотоактивации криптохромов растений уникален.
Комплексы CRY–BIC и инактивация криптохромов. Aктивированные светом криптохромы растений могут подвергаться инактивации путем спонтанной темновой реверсии гомоолигомеров в мономеры, взаимодействия с ингибиторами (BICs) и убиквитин-зависимого протеолиза. Среди этих механизмов только ингибирование криптохромов, вызываемое BICs, является светочувствительным процессом. Это предполагает, что взаимодействие CRY–BIC может играть более динамичную роль в регуляции активности криптохромов у растений, растущих на свету (Wang et al., 2016).
Недавно проведенный анализ кристаллической структуры комплекса PHR CRY2 с BIC2 выявил два возможных механизма, проясняющих вопрос о том, как белки BIC могут инактивировать криптохромы растений (Ma et al., 2020). Во-первых, BIC может ингибировать фотовосстановление ФАД. Порядка десяти остатков CRY2 находятся в непосредственной близости от ФАД. Связывание BIC2 с PHR CRY2 увеличивает расстояние между донором электрона (Три397) и акцептором (изоаллоксазиновое кольцо ФАД) на 1 ангстрем, что может затруднить перенос электрона. Кроме того, такое связывание может привести к вращению карбоксильной боковой цепи предполагаемого донора протона (Асп393) на 50о, что увеличит расстояние между донором протона и акцептором протона в хромофоре на 5 ангстрем. Такое изменение делает протонирование практически невозможным. Соответственно, BIC2 может блокировать фотовосстановление ФАД в ФАД•− и его протонирование в сигнальную форму ФАДН•.
Во-вторых, BICs могут действовать как конкурентные ингибиторы гомоолигомеризации CRY2. В комплексе PHR CRY2 с BIC2 фрагмент BIC2 проявляет структуру, определяющую его способность опоясывать паз между двумя субдоменами PHR-домена CRY2. PHR CRY2 и BIC2 имеют по 16 остатков, которые вовлекаются в формирование комплекса между ними. Индивидуальные мутации нескольких остатков в интерфейсе комплекса снижали выраженное сродство между PHR CRY2 и BIC2 in vitro. Интерфейсы гетеродимера CRY–BIC и гомодимера CRY–CRY содержат два остатка CRY2 – Три349 и аргинин (Арг208). В гетеродимере остаток Три349 гидрофобно взаимодействует с изолейцином (Иле57) BIC2, тогда как Арг208 формирует солевой мостик и водородную связь с глутамином (Глу50) BIC2. В гомодимере CRY2– CRY2 Три349 и Арг208 находятся в интерфейсе. Эти данные убеждают, что связывание BICs с CRYs конкурентно ингибирует фотоолигомеризацию CRY, блокируя тем самым его фотоактивацию (Wang, Lin, 2020a).
В соответствии с рассмотренными выше данными можно констатировать, что познание первичных механизмов восприятия света криптохромами растений и их перехода в фотоактивированное состояние значительно возросло за последние несколько лет. Достигнуты успехи и в изучении структурных основ трансдукции сигнала криптохромами. Они связаны главным образом с идентификацией и исследованием белков, взаимодействующих с фотоолигомерами криптохромных молекул. В результате таких взаимодействий изменяется активность сигнальных белков, что приводит к регуляции экспрессии генов и фотобиологическим ответам. Внимания заслуживают результаты исследования криптохромных фоторецепторов, выявленных у зеленой водоросли C. reinhardtii (CPH1, CraCRY). Эти фоторецепторы охарактеризованы в отношении структуры и функций; у них детально изучены фотоциклы флавиновых хромофоров, которые отличаются из-за природы и числа ароматических остатков и других аминокислот, участвующих в каскаде переноса электрона/протона при фотовосстановлении флавина (Petersen et al., 2021). У криптохромов растений поглощение света хромофором инициирует перенос электрона к флавину через триаду триптофанов. У криптохрома CraCRY этот электронно-транспортный путь включает четвертый ароматический остаток – тирозин.
Несмотря на то, что механизм фотовосстановления ФАД детально изучен in vitro, вопрос о том, как конкретно перенос электрона к ФАД вовлекается в фотоактивацию криптохромов, остается нерешенным. Показано, что мутации остатков Три-триады у CRY1/CRY2, которые блокируют перенос электрона и фотовосстановление ФАД in vitro, не влияют на их биохимическую и физиологическую активность in vivo (Gao et al., 2015; Liu et al., 2019). Иными словами, зависимое от Три-триады фотовосстановление ФАД не требуется для функционирования криптохромов. Очевидно, для раскрытия механизма фотоактивации криптохромных белков необходимо дальнейшее исследование альтернативного пути переноса электрона с применением новых и инновационных подходов.
Другой вопрос, связанный с фотоциклом ФАД, относится к магниточувствительной функции криптохромов. Принято считать, что в основе магниточувствительности криптохромных белков лежит формирование радикальных пар, на которые могут влиять слабые магнитные поля (Hore, Mouritsen, 2016). Следствием этого может быть изменение химических констант скоростей редокс-реакций ФАД, создающее отличие в концентрации активированного состояния фоторецептора и, соответственно, измененную биологическую активность. Однако природа магниточувствительных радикальных пар и стадии, на которых они действуют в течение редокс-цикла криптохромов, пока точно не определены и являются предметом дискуссий. На основании большого числа экспериментальных и теоретических работ предложены две альтернативные модели формирования разных радикальных пар, определяющих магниточувствительность криптохромов.
Согласно модели 1, радикальная пара [ФАД•– Три•+] образуется путем инициирующей реакции переноса электрона к фотовозбужденному ФАД от остатка триптофана, включенного в триаду (тетраду) триптофанов. Эта радикальная пара подвергается магниточувствительной интерконверсии между синглетным состоянием и триплетным: 1[ФАД•– Три•+] ↔ 3[ФАД•– Три•+]. При протонировании ФАД•– может переходить в форму ФАДН• и после фотовосстановления – в неактивную форму ФАДН– (Zoltowski et al., 2019).
Темновое реокисление ФАДН– в реакции с кислородом принято за основу в модели 2, предполагающей, что интермедиатом в этом процессе может быть радикальная пара [ФАДН•${\text{O}}_{2}^{{\centerdot - }}$]. Она также может подвергаться магниточувствительному взаимопревращению между синглетным состоянием и триплетным; при этом синглетное состояние переходит в исходную форму ФАД после высвобождения перекиси водорода, как показано на приведенной выше схеме редокс фотоцикла ФАД-хромофора (рис. 4).
В недавнем исследовании получено частичное подтверждение такого механизма (Pooam et al., 2019). Показано, что ответы CRY1 на свет in vivo усиливаются в магнитном поле, причем даже в случае его воздействия во время темновых интервалов между освещением. Поэтому считается, что магниточувствительная реакция в фотоцикле криптохрома происходит на стадии реокисления ФАДН– и может вовлекать активные формы кислорода (АФК). Однако конкретная природа АФК пока не определена. Кроме того, в соответствии с данными теоретического анализа радикальная пара флавин/супероксид кислорода вряд ли может быть магниточувствительным интермедиатом у криптохромов из-за очень быстрой релаксации спина супероксида. Очевидно, для идентификации магниточувствительных интермедиатов требуются дальнейшие теоретические и экспериментальные исследования.
Финансирование. Работа выполнена в рамках научного проекта государственного задания МГУ (121032500058-7).
Список литературы
Вечтомова Ю.Л., Телегина Т.А., Крицкий М.С. Эволюция белков семейства ДНК-фотолиаз/криптохромов // Успехи биол. химии. 2020. Т. 85. С. 277–316.
Фрайкин Г.Я. Белковые сенсоры света: фотовозбужденные состояния, сигнальные свойства и применение в оптогенетике. М.: АР-Консалт, 2018. 87 с.
Фрайкин Г.Я., Страховская М.Г., Рубин А.Б. Биологические фоторецепторы светозависимых регуляторных процессов // Биохимия. 2013. Т. 78. С. 1576–1594.
Ahmad M. Photocycle and signaling mechanisms of plant cryptochromes // Curr. Opin. Plant Biol. 2016. V. 33. P. 108–115.
Chaves I., Pokorny R., Byrdin M., Hoang N., Ritz T., Brettel K., Essen L.O., van der Horst G.T., Batschauer A., Ahmad M. The cryptochromes: blue light photoreceptors in plants and animals // Annu. Rev. Plant Biol. 2011. V. 62. P. 335–364.
Chen Z., Li M., Liu S., Chen X., Zhang W., Zhu Q., Kohnen M.V., Wang Q. The function and photoregulatory mechanisms of cryptochromes from moso bamboo (Phyllostachys edulis) // Front. Plant Sci. 2022. V.3. 866057.
Dasgupta A., Fuller K.K., Dunlap J.C., Loros J.J. Seeing the world differently: variability in the photosensory mechanisms of the model fungi // Environ. Microbiol. 2016. V. 18. P. 15–20.
Franz S., Ignatz E., Wenzel S., Zielosko H., Putu E., Maestre-Reyna M., Tsai M.-D., Yamomoto J., Mittag M., Essen L.-O. Structure of the bifunctional cryptochrome aCRY from Chlamydomonas reinhardtii // Nucl. Acids Res. 2018. V. 46. P. 8010–8022.
Gao J., Wang X., Zhang M., Bian M., Deng W., Zuo Z., Yang Z., Zhong D., Lin C. Trp triad-dependent rapid photoreduction is not required for the function of Arabidopsis CRY1 // Proc. Natl. Acad. Sci. USA. 2015. V. 112. P. 9135–9140.
Goett-Zink L., Kottke T. Plant cryptochromes illuminated: a spectroscopic perspective on the mechanism // Front. Chem. 2021.V. 9: 780199.
Hense A., Herman E., Oldemeyer S., Kottke T. Proton transfer to flavin stabilizes the signaling state of the blue light receptor plant cryptochrome // J. Biol. Chem. 2015. V. 290. P. 1743–1751.
Herbel V., Orth C., Wenzel R., Ahmad M., Bittl R., Batschauer A. Lifetimes of Arabidopsis cryptochrome signaling states in vivo // Plant J. 2013. V. 74. P. 583–592.
Hoecker U. The activities of the E3 ubiquitin ligase COP1/SPA, a key repressor in light signaling // Curr. Opin. Plant Biol. 2017. V. 37. P. 63–69.
Holtkotte X., Ponnu J., Ahmad M., Hoecker U. The blue light-induced interaction of cryptochrome 1 with COP1 requires SPA proteins during Arabidopsis light signaling // PLOS Genet. 2017. V. 13: e1007044.
Hore P.J., Mouritsen H. The radical-pair mechanisms of magnetoreception // Annu. Rev. Biophys. 2016. V. 4. P. 299–344.
Konig S., Juhas M., Jager S., Kottke T., Buchel C. The cryptochrome-photolyase protein family in diatoms // J. Plant Physiol. 2017. V. 217. P. 15–19.
Kottke T., Oldemeyer S., Wenzel S., Zou Y., Mittag M. Cryptochrome photoreceptors in green algae: unexpected versatility of mechanisms and functions // J. Plant Physiol. 2017. V. 217. P. 4–14.
Lacombat F., Espagne A., Dozova N., Plaza P., Muller P., Brettel K., Franz-Badur S., Essen L.-O. Ultrafast oxidation of a tyrosine by proton-coupled electron transfer promotes light activation of an animal-like cryptochrome // J. Am. Chem. Soc. 2019. V. 141. P. 13394–13409.
Lian H.L., He S.B., Zhang Y.C., Zhu D.M., Zhang J.Y., Jia K.P., San S.X., Li L., Yang H.Q. Blue-light-dependent interaction of cryptochrome 1 with SPA1 defines a dynamic signaling mechanism // Genes Dev. 2011. V. 25. P. 1023–1028.
Liu B., Zuo Z., Liu H., Liu X., Lin C. Arabidopsis cryptochrome 1 interacts with SPA1 to suppress COP1 activity in response to blue light // Genes Dev. 2011. V. 25. P. 1029–1034.
Liu H., Su T., He W., Wang G., Lin C. The universally conserved residues are not universally required for stable protein expression or functions of cryptochromes // Mol. Biol. Evol. 2019. V. 37. P. 327–340.
Liu H., Yu X., Li K., Klejnot J., Yang H., Lisiero D., Lin C. Photoexcited CRY2 interacts with CIB1 to regulate transcription and floral initiation in Arabidopsis // Science. 2008. V. 322. P. 1535–1539.
Liu Q., Su T., He W., Ren H., Liu S., Chen Y., Gao L., Hu X., Lu H., Cao S., Huang Y., Wang X., Wang Q., Lin C. Photooligomerization determines photosensitivity and photoreactivity of plant cryptochromes // Mol. Plant. 2020. V. 13. P. 398–413.
Liu Y., Li X., Ma D., Chen Z., Wang J.W., Liu H. CIB and CO interact to mediate CRY2-dependent regulation of flowering // EMBO Rep. 2018. 19: e45762.
Losi A., Gartner W. The evolution of flavin-binding photoreceptors: an ancient chromophore serving trendy blue-light sensors // Annu. Rev. Plant Biol. 2012. V. 63. P. 49–72.
Ma L., Wang X., Guan Z., Wang L., Wang Y., Zheng L., Gong Z., Shen C., Wang J., Zhang D., Liu Z., Yin P. Structural insight into BIC-mediated inactivation of Arabidopsis cryptochrome 2 // Nat. Struct. Mol. Biol. 2020. V. 27. P. 472–479.
Michael A.K., Fribourgh J.L., Van Gelder R.N., Partch C.L. Animal cryptochromes: divergent roles in light perception, circadian timekeeping and beyond // Photochem. Photobiol. 2017. V. 93. P. 128–140.
Muller P., Ahmad M. Light-activated cryptochrome reacts with molecular oxygen to form a flavin-superoxide radical pair consistent with magnetoreception // J. Biol. Chem. 2011. V. 286. P. 21033–21040.
Oldemeyer S., Franz S., Wenzel S., Essen L-O., Mittag M., Kottke T. Essential role of an unusual long-lived tyrosil radical in the response to red light of the animal-like cryptochrome aCRY // J. Biol. Chem. 2016. V. 291. P. 14062–14071.
Oldemeyer S., Haddat A.Z., Fleming G.R. Interconnection of the antenna pigment 8-HDF and flavin facilitates red-light reception in bifunctional animal-like cryptochrome // Biochemistry. 2020. V. 59. P. 594–604.
Ozturk N. Phylogenetic and functional classification of the photolyase/cryptochrome family // Photochem. Photobiol. 2017. V. 93. P. 104–111.
Paulus B., Bajzath C., Melin F., Heidinger L., Kromm V., Herkersdorf C., Benz U., Mann L., Stehle P., Hellwig P., Weber S., Schleicher E. Spectroscopic characterization of radicals and radical pairs in fruit fly cryptochrome – protonated and nonprotonated flavin radical-states // FEBS J. 2015. V. 282. P. 3175–3189.
Petersen J., Rredhi A., Szyttenholm J., Oldemeyer S., Kottke T., Mittag M. The world of algae reveals a broad variety of cryptochrome properties and functions // Front. Plant Sci. 2021. V. 12. P. 748760.
Pooam M., Arthaut L.-D., Burdick D., Link J., Martino C.F., Ahmad M. Magnetic sensitivity mediated by the Arabidopsis blue-light receptor cryptochrome occurs during flavin reoxidation in the dark // Planta. 2019. V. 249. P. 319–332.
Schwinn K., Ferre N., Huix-Rotllant M. UV-visible absorption spectrum of FAD and its reduced forms embedded in a cryptochrome protein // Phys. Chem. Chem. Phys. 2020. V. 22. P. 12447–12455.
Sellaro R., Crepy M., Trupkin S.A., Karayakov E., Buchovsky A.S., Rossi C., Casal J.J. Cryptochrome as a sensor of the blue/green ratio of natural radiation in Arabidopsis // Plant Physiol. 2010. V. 154. P. 401–409.
Shao K., Zhang X., Li X., Hao Y., Huang X., Ma M., Zhang M., Yu F., Liu H., Zhang P. The oligomeric structures of plant cryptochromes // Nat. Struct. Mol. Biol. 2020. V. 27. P. 480–488.
Thoing C., Oldemeyer S., Kottke T. Microsecond deprotonation of aspartic acid and response of the α/β subdomain precede C-terminal signaling in the blue light sensor plant cryptochrome // J. Am. Chem. Soc. 2015. V. 137. P. 5990–5999.
Wang Q., Lin C. A structural view of plant CRY2 photoactivation and inactivation // Nat. Struct. Mol. Biol. 2020a. V. 27. P. 401–403.
Wang Q., Lin C. Mechanisms of cryptochrome-mediated photoresponses in plants // Annu. Rev. Plant Biol. 2020b. V. 71. P. 103–129.
Wang Q., Zuo Z., Wang X., Gu L., Koshizumi T., Yang Z., Yang L., Liu Q., Liu W., Han Y.J., Kim J.I., Liu B., Wohlschlegel J.A., Matsui M., Oka Y., Lin C. Photoactivation and inactivation of Arabidopsis cryptochrome 2 // Science. 2016. V. 354. P. 343–347.
Wang Q., Zuo Z., Wang X., Liu Q., Gu L., Oka Y., Lin C. Beyond the photocycle – how cryptochromes regulate photoresponses in plants // Curr. Opin. Plant Biol. 2018. V. 45. P. 120–126.
Yang Z., Liu B., Su J., Liao J., Lin C., Oka Y. Cryptochromes orchestrate transcription regulation of diverse blue light responses in plants // Photochem. Photobiol. 2017. V. 93. P. 112–127.
Zhang M., Wang L., Zhong D. Photolyase: dynamics and electron-transfer mechanisms of DNA repair // Arch. Biochem. Biophys. 2017. V. 632. P. 158–174.
Zoltowski B.D., Chelliah Y., Wickramaratne A., Jarecha L., Karki N., Xu W., Mouritsen H., Hore P.J., Hibbs R.E., Green C.B., Takahashi J.S. Chemical and structural analysis of a photoactive vertebrate cryptochrome from pigeon // Proc. Natl. Acad. Sci. USA. 2019. V. 116. P. 19449–19457.
Zoltowski B.D. Resolving cryptic aspects of cryptochrome signaling // Proc. Natl. Acad. Sci. USA. 2015. V. 112. P. 8811–8812.
Zuo Z., Liu H., Liu B., Liu X., Lin C. Blue light dependent interaction of CRY2 with SPA1 regulates COP1 activity and floral initiation in Arabidopsis // Curr. Biol. 2011. V. 21. P. 841–847.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая