Известия РАН. Серия биологическая, 2023, № 2, стр. 211-224
Сосуществование конкурирующих видов обыкновенной куторы (Neomys fodiens) и обыкновенной бурозубки (Sorex araneus) во флуктуирующей среде: коммуникабельность и пространственные взаимодействия в “сухом” местообитании
Н. А. Щипанов 1, *, М. В. Касаткин 2
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
2 Государственный биологический музей им. К.А. Тимирязева
Москва, Россия
* E-mail: shchipa@mail.ru
Поступила в редакцию 24.09.2022
После доработки 19.10.2022
Принята к публикации 19.10.2022
- EDN: HKCJBL
- DOI: 10.31857/S1026347022700123
Аннотация
Устойчивое (отсутствие тренда к изменению обилия взаимодействующих видов) сосуществование видов может поддерживаться благодаря флуктуациям их численности и биотопического распространения в гетерогенной среде. У обыкновенной куторы и обыкновенной бурозубки совместные поселения существуют на околоводных участках и эпизодически возникают в “сухих” местообитаниях, куда кутора периодически вселяется. С учетом хорошо известного перекрывания пищевых ниш этих видов можно было бы ожидать обнаружения механизмов, снижающих конкуренцию, однако в “сухих” местообитаниях, мы таких механизмов не обнаружили. Использование пространства характеризуется случайным совмещением домашних участков зверьков. В тесте выбора (контейнер со зверьком против пустого контейнера) индивидуальная повторяемость коммуникабельности выявлена в тестах со стимулятором конспецификом, но отсутствует в тестах со стимулятором другого вида. Присутствие куторы (в качестве стимулятора) в поведенческом тесте не вызвало обеспокоенности обыкновенных бурозубок, а лишь повышало тщательность исследования. Реакции кутор на бурозубок в межвидовых тестах не обнаружено. В отсутствие специфических адаптаций, направленных на пространственную сегрегацию зверьков, сосуществование куторы и бурозубки достаточно хорошо объясняется “флуктуационно-зависимыми” моделями сосуществования.
Межвидовые взаимодействия – один из ведущих экологических и эволюционных факторов увеличения биологического разнообразия и формирования сообществ (Day, Young, 2004; Grant, Grant, 2006; Pfennig et al., 2007; Levine et al., 2017; Adler et al., 2018). Экологически близкие виды, заселяющие общую территорию, неизбежно конкурируют за жизненно важные ресурсы (Бигон и др., 1989; Adler et al., 2018). Межвидовая конкуренция может быть ослаблена за счет экологического разобщения видов, и рассматривается как одна из движущих сил возникновения межвидовых различий (Hutchinson, 1957; Бигон и др., 1989; Freeman, Herron 2001; Day, Young, 2004; Grant, Grant, 2006; Pfennig et al., 2007). Вместе с тем, хорошо известна избыточность встречающихся совместно видов, и вопрос Хатчинсона (Hutchinson, 1959) о природе избыточного видового разнообразия ясного ответа до сих пор не имеет (Day, Young, 2004). Предположительно, устойчивое сосуществование (отсутствие долгосрочного тренда к изменению обилия) экологически близких видов может поддерживаться благодаря флуктуациям численности и занятого в неоднородной среде пространства, (Chesson 1994, 2000). “Флуктуационно-зависимая” (fluctuation-dependent) модель включает модели относительной “нелинейности конкуренции” (relative nonlinearity) и “эффекта накопления” (storage effect) (Chesson, 2000). Модель “нелинейной конкуренции” оценивает коэффициент размножения конкурирующих видов (r) с учетом варьирования лимитирующего фактора. Более выраженная нелинейность r делает вид конкурентно слабее, но варьирование лимитирующего фактора оказывает стабилизирующий эффект, предотвращая элиминацию более слабого вида. “Эффект накопления”, стабилизирующий сосуществование, возникает как совокупный результат трех составляющих: “дифференцированный ответ” на изменения среды (differential responses to the environment), “ковариация между средой и конкуренцией” (covariance between environment and competition) и “буферный эффект” (buffer effect). “Дифференцированный ответ” подразумевает различия в реакции видов на флуктуации среды; “ковариация” – различия в уровне конкуренции, связанные с флуктуациями (например, ухудшение среды ослабляет, а улучшение – увеличивает конкуренцию); “буферный эффект” – компенсирует уменьшение r вида вселенца при неблагоприятном состоянии среды, и, у мелких млекопитающих, может быть обусловлен различными биотопическими предпочтениями (Chesson, 1990, 2000).
С учетом морфологической однотипности, симпатрии и синтопичности многих видов землероек, их сходных требований к среде, и, хорошо известного, высокого метаболизма, у этих млекопитающих следовало бы ожидать особенно острой конкуренции за пространство (Churchfield, 1990, 2002). Землеройки (Soricidae) являются хищниками, охотящимися на беспозвоночных среднего и мелкого размера (Churchfield, 1990). Эволюционный успех в этой таксономической группе определяется “уникальным механизмом жевания”, обеспеченного морфологическими особенностями краниального скелета, который определяет возможность одновременного удержания и поедания жертв (Зайцев, 2005). Особенности морфологии позволяют зверькам использовать жертвы из разных таксонов беспозвоночных, но ограничивают их в других источниках пищи. Пищевые ниши землероек перекрываются на 40–90%, причем перекрывание пищевых ниш выше у близких по размеру видов (Churchfield, Sheftel, 1994; Churchfield et al., 1999; Churchfield, Ryhclik, 2006). Конкурирующие виды насекомоядных взаимно влияют на пищевую базу (Dickman, 1991). Согласно принципу конкурентного исключения, такие виды не должны образовывать устойчивые многовидовые сообщества. Однако у бурозубочьих (Soricinae) часто сосуществуют 4–9 видов (напр. Churchfield, Sheftel, 1994; Churchfield et al., 1997, 1999; Churchfield, Rychlik, 2006).
Предположительно, сосуществованию землероек должно способствовать их различие в размерах: ожидается различие в размерах предпочитаемых жертв, и сужение пищевой ниши у мелких видов (Kirkland, 1991, Churchfield, Sheftel, 1994; Churchfield, 2002). Однако, в паре Sorex araneus – Sorex minutus (более чем двукратная разница в размерах) в горных лесах Словении обнаружено практически полное совпадение пищевых ниш и совместное использование микроместообитаний (Klenovšek et al., 2013). Обсуждая результаты, авторы последней публикации предполагают обратить внимание на возможность временнóго разделения ниш, что может препятствовать реализации конкурентного исключения.
Ряд видов землероек характеризуется выраженной динамикой обилия. В частности, обыкновенная бурозубка на всем ареале демонстрирует колебания численности, циклические (Большаков и др, 1996; Бобрецов, 2004; Sheftel, 1989; Tkadlec, Stenseth, 2001; Tast et al., 2005) или нециклические (Henttonen et al., 1989; Churchfield et al., 1995; Tomášková et al., 2005). В местностях с периодически меняющейся влажностью климата численность и биотопическое распространение обыкновенной куторы также может резко изменяться (Панов, Карпенко, 2004). С учетом флуктуаций обилия и распространения по местообитаниям в паре видов обыкновенная кутора – обыкновенная бурозубка, речь может идти о “природной модели” для изучения “флуктуационно-зависимых” механизмов сосуществования. Ареалы этих видов практически полностью совпадают (Mitchell-Jones et al., 1999; Harris, Yalden, 2004). Обыкновенная бурозубка встречается практически во всех местообитаниях умеренной и бореальной зон, способна использовать широкий спектр пищевых объектов, легко переключается на наиболее обильные и доступные (и сезонно и локально) жертвы (Churchfield, 1990; Hanski, 1994). Обыкновенная кутора является полуводным видом, имеет специфические адаптации к плаванию и нырянию (Greenwood et al., 2002; Champneys 2012), а обыкновенная бурозубка – наземный вид (Churchfield, 1990; Shchipanov et al., 2019). Однако, несмотря на различия в предпочитаемых местообитаниях, оба вида сосуществуют на влажных территориях: болотах, сырых лугах, по берегам различных водотоков (Churchfield, 1984 a, b; Rychlik, 2000; Churchfield, Rycрlik, 2006; Czabán et al., 2015). Оба вида характеризуются как территориальные (Krushinska, Rychlik, 1993; Rychlik, 1998) и можно было бы ожидать проявления наиболее острой, интерференционной, конкуренции, приводящей к вытеснению одного из видов. Однако, обыкновенную бурозубку нельзя рассматривать как территориальный вид в полном смысле этого слова. Зверьки специально не охраняют территорию, а разобщение особей в пространстве определяется случайными столкновениями (Щипанов, 2021). При использовании радиоактивного мечения отмечено наложение участков и у кутор (Lardet, 1988). Сосуществование обыкновенной куторы (Neomys fodiens) и обыкновенной бурозубки (Sorex araneus) в “сухих” местообитаниях, ранее не изучали.
В настоящей работе: 1) проведен анализ многолетней динамики этих видов на модельном участке в “сухом” местообитании, 2) охарактеризовано использование пространства и его совместное использование обоими видами, 3) изучена коммуникабельность (sociability) в одновидовых и межвидовых тестах предпочтения и 4) с привлечением известных данных по экологии сравниваемых видов, предпринята попытка сопоставить полученные результаты с “флуктуационно-зависимыми” моделями сосуществования.
МАТЕРИАЛЫ И МЕТОДЫ
Место работы и животные. Материал собран в окрестностях деревни. Баканово, Старицкого р-на, Тверской области (56°18′ С.Ш.; 34°54′ В.Д.). Основные данные получены на площадке мечения (“сухое” местообитание) в 2014–2021 гг. Площадка расположена на заброшенной части деревни, соседствует с оврагом, в котором весной, осенью и во влажные годы протекает ручей, рядом расположены два небольших пруда (рис. 1). Территория заросла крапивой, кипреем, имеются пятна злакового разнотравья; есть участок молодого березняка, смешанного с ольхой, отдельные старые липы, кусты ивняка. Ловушки (всего 87) выставлены как пять линий с интервалом 10 м между линиями (четыре линии по 18, и одна – 15 ловушек), между ловушками в линии – 7.5 м. Наблюдаемая площадь – 0.65 га.
Рис. 1.
Место работы: 1 – постоянный ручей, 2 – пересыхающий ручей, 3 – места дополнительных отловов, 4 – пруды, 5 – заросли болотной растительности (осоки, таволга, камыш), 6 – площадка мечения, 7 – пространство занятое участками обыкновенной куторы (2021 г.), 8 – пространство занятое участками обыкновенной бурозубки (2021 г.).
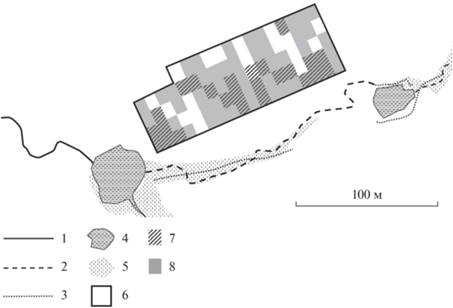
В 2014, 2015, 2018 и 2021 гг. проведены отловы вдоль водотоков (влажное местообитание) на участках, заросших камышом, таволгой, смородиной и ивняком (рис. 1). Ловушки (50 шт.) выставляли линией.
Мечение животных проводили в соответствии с разработанным для бурозубок протоколом (Щипанов и др., 2000): использовали оригинальную ловушку, в качестве приманки – геркулес, смоченный нерафинированным подсолнечным маслом, проверка не реже, чем через 1.5 ч. После проверки ловушки оставляли открытыми, ненастороженными, доступными для свободного посещения. В данном исследовании мы ограничивались одной проверкой в сутки. При таком режиме животное может свободно перемещаться более 90% времени суток, и частота поимок особи отражает частоту ее присутствия в месте расположения ловушки. Зверьков метили ампутацией когтевых фаланг. У бурозубок такое мечение не влияет на выживание зверьков (Shchipanov et al., 2005). Для кутор использовали номера, требующие обрезания максимум двух пальцев. Оседлыми считали зверьков, пойманных повторно в течение одной сессии отлова (14 дней). Всего на площадке в августе 2014-2021 гг. было поймано 223 обыкновенных бурозубки (1005 поимок) и 29 обыкновенных кутор (65 поимок). При отловах вдоль водотоков было поймано 38 обыкновенных бурозубок и 21 кутора.
Поведение изучали в 2021 г. Животных на 3 ч изымали с площадки во время проверки (до 9 ч утра), помещали в отсадники с кормом в избытке (измельченные куриные сердца и кузнечики) и использовали в тестах сразу по окончания проверки. Испытания заканчивали не позже 11.30, затем зверьков возвращали на место поимки. Особи в повторных (и разнотипных) экспериментах использованы в разные дни. Всего в тестах участвовало 20 сеголеток обыкновенных бурозубок и 15 обыкновенных кутор (12 молодых кутор весом до 16 г и 3 взрослые самки с весом >17 г). Из них в 36 одновидовых тестах участвовали 17 бурозубок, а в 21 одновидовом тесте – 10 кутор, в 12 межвидовых тестах кутора – бурозубка (стимулятор) – 11 кутор и 6 бурозубок, в 22 опытах бурозубка – кутора (стимулятор) – 16 бурозубок и 8 кутор. Для оценки повторяемости коммуникабельности в одновидовых тестах использованы данные, полученные в первом и втором испытаниях особи (9 бурозубок и 4 куторы; 18 и 8 испытаний соответственно); в межвидовых тестах использовали результаты первых одновидового и межвидового тестов особи (14 бурозубок и 7 кутор, 28 и 14 испытаний).
Оценки увлажненности территории. Для характеристики увлажненности в “сухом” местообитании использовали количество выпадающих в теплое время года (май–август) осадков для ближайшего (20 км от места наблюдений) г. Старица (Погода и климат). Летнее высыхание временного ручья происходило в 2016, 2019 и 2020 гг.
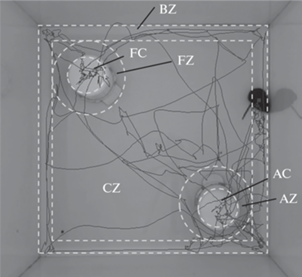
Оценка коммуникабельности. Склонность зверьков к социальному контакту – коммуникабельность (Moy et al., 2004) оценивали в модифицированном тесте выбора (preference test) (Crawley, 2000). Схема эксперимента и оценка валидности результатов подробно описаны ранее (Shchipanov, Demidova, 2020, 2022). Тест проводили в квадратном открытом поле (50 × 50 см), с двумя сетчатыми цилиндрическими контейнерами (10 см высотой и 8 см в диаметре), в один из которых помещали стимулирующее животное. Зверьки могли визуально, ольфакторно и акустически взаимодействовать через сетчатую стенку. Крышка контейнера – сплошная, препятствует контактам. Контейнеры помещали в фиксированных положениях (рис. 2). Фокусное животное выпускали в центре арены из пластикового стаканчика вручную, затем оператор покидал помещение. Испытание записывали на видеокамеру Sony Handycam в формате MPEG-2. Оцифровку записи теста проводили в пакете программ EthoVision XT (Noldus), с момента, когда оператор покидал помещение, чистое время оцифрованного испытания – 5 мин. Оценивали пройденную фокусным животным дистанцию, время пребывания и среднюю скорость перемещения в зоне. Выделяли виртуальные зоны (рис. 2): BZ – краевая зона – 3 см полоса вдоль стенок арены; зоны контейнера с животным (AZ) и пустого (FZ) – 3 см вокруг стенок контейнеров; крышки контейнеров с животным (AC) и пустого (FC); и центральную зону (CZ) – пространство арены за исключением площади перечисленных зон (рис. 2). Выбор 3 см полосы определяли тем, что цифровой след особи, находится в пределах 3 см от границы исследуемого объекта (рис. 2).
Рис. 2.
Пример оцифрованной дистанции (следа) в эксперименте с фокусным видом – кутора и стимулятором в контейнере – обыкновенная бурозубка. Пунктиром обозначены виртуальные зоны (пояснения в тексте).
Используемые характеристики и индексы. Обилие животных (N) на площадке мечения оценено как количество присутствовавших на ней оседлых животных. Вслед за Кантони (Cantoni, 1993) на линии вдоль водотоков обилие оценено как количество особей, пойманных на 100 м линии. Варьирование обилия (нелинейность) оценивали с использованием индекса SI = SDLgN (Stenseth, Framstad, 1980; Henttonen et al., 1985).
Для количественной характеристики совмещения резидентов в пространстве оценивали долю ловушек, посещенных совместно (Hj) с конспецификами или, в зависимости от задачи, особями чужого вида:
где Tx – число ловушек, посещенных только хозяином участка, а Tj – число ловушек, посещенных совместно с соседями. Совмещение пространственной активности Aj оценено как относительная частота посещения ловушек участка хозяином, свои поимки, (Ch) и другими особями своего или иного вида – чужие поимки (Ca):
При оценке коммуникабельности использовали две группы индексов: индексы предпочтения (I) и мобильности (D) (Shchipanov, Demidova, 2020, 2022). Индексы предпочтения характеризуют предпочтение обследования “социального” объекта – контейнера со зверьком (стимулятором). Индексы предпочтения во времени It и в пространстве Id рассчитаны как:
где t время присутствия, а d – пройденная дистанция в зонах контейнера со стимулятором – AZ и пустого – FZ. Индексы изменяются от –0.5 до +0.5, положительное значение – преобладающая активность в зоне стимулятора.
Индекс мобильности характеризует относительную плотность обследования анализируемой зоны (Z):
где dZ – дистанция, пройденная в анализируемой зоне, dT – общая дистанция, пройденная в испытании, SZ – площадь анализируемой зоны, а Sa – общая площадь арены. Индекс равен 1, если плотность следов в зоне соответствует случайному блужданию по арене.
Анализ данных и статистика. Нормальность распределения проверяли в тесте Шапиро–Уилка. При необходимости проводили нормализацию данных с использованием логарифмирования или арксинусной трансформации (в случае It. и Id к величине индекса прибавляли 0.5). Варьирование нормально распределенных данных в тексте и на рисунках показано как ±SD, если не даны соответствующие пояснения. Корреляции нормально распределенных данных оценивали коэффициентом Пирсона (r), ненормально распределенных данных – ранговым коэффициентом Спирмена (RS). Синхронность динамики обилия оценивали, используя коэффициент ранговой корреляции Спирмена для логарифмированных показателей обилия, как эти было ранее предложено для полевок (Saitoh et al., 1998). При сравнениях выборок, в зависимости от типа данных, использовали параметрические или непараметрические тесты (указаны в тексте).
Для оценки возможности случайного совпадения посещенных ловушек в пространстве N особями, каждая из которых, в среднем, посещает k (округлено до целого) ловушек, в компьютерном эксперименте определено ожидаемое число совместно посещаемых ловушек. При этом модель предполагает генерирование случайных номеров в Nk испытаниях. По результатам 1000 итераций в среде Excel 2016 с использованием встроенного генератора случайных чисел определено математическое ожидание и 95% доверительный интервал (CI) – 1.96SD (подробнее см. Щипанов, 2021).
Для выявления устойчивых индивидуальных поведенческих реакций в среде R с использованием функции rpt в пакете rptR (Stoffel et al., 2017) рассчитана скорректированная повторяемость (Nakagawa, Schielzeth, 2010) – R: внутригрупповая дисперсия среди особей, деленная на общую дисперсию. В каждом вычислении индивидуальный номер животного (ID) являлся случайным, а номер эксперимента – фиксированным фактором. Для определения 95% CI проведено 1000 итераций. Статистическая значимость R оценена с помощью пермутаций и теста максимального правдоподобия (LRT) в пакете rptR.
РЕЗУЛЬТАТЫ ИССЛЕДОВНИЯ
Обилие. Обыкновенная бурозубка преобладала по численности: в “сухом” местообитании на площадке за все время наблюдений, число кутор составило 10.6% от общего количества пойманных особей обоих видов; во “влажных” местообитаниях – 35.6%. По средней геометрической обилия (за все годы отловов) преобладание бурозубки еще заметнее: на площадке – 1.3 куторы против 30.1 обыкновенных бурозубок, вдоль водотоков – 1.4 куторы против 3.2 бурозубок. Динамика обилия этих видов на площадке независима (Rs = 0.47, p > > 0.2). Обыкновенная бурозубка не показала существенных колебаний (рис. 3): SI на площадке составил 0.09, т.е. много меньше 0.5 – критического значения для флуктуирующих популяций (Henttonen et al., 1985). Колебания обилия кутор на “сухой” площадке мечения ярко выражены, SI = 0.79. На околоводных участках в годы проведения учетов обилие кутор практически не изменялось (рис. 3): SI = 0.07.
Рис. 3.
Динамика обилия на площадке мечения (Lg числа оседлых) – сплошная линия: обыкновенная кутора (квадратный маркер) и обыкновенная бурозубка (круглый маркер). На месте дополнительных учетов (Lg числа обнаруженных на 100 м дистанции) – отдельные маркеры: обыкновенная кутора черный квадрат, обыкновенная бурозубка – серый круг.
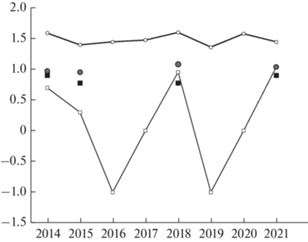
Влияние увлажненности территории мы могли корректно оценить лишь для “сухого” местообитания – площадки мечения. У кутор на площадке мечения обнаружена значимая отрицательная корреляция обилия c суммарным количеством осадков в конце лета, в июле и августе, но лишь тенденция (p < 0.1) к увеличению обилия при меньшем суммарном количестве осадков за лето, и более сухом августе (табл. 1). Летнее количество осадков текущего года не связано с наличием проточной воды в ручье, которая сохранялась в сухие годы и, по-видимому, зависела от накопленной в почве влаги. Если в годы с проточной водой маркировать как 1, а сухие как 0, мы обнаружим, что обилие куторы на площадке положительно коррелирует с наличием воды в ручье (RS = 0.80, p < 0.02).
Таблица 1.
Ранговый коэффициент корреляции Спирмена (RS) Lg числа оседлых зверьков на площадке мечения и количеством осадков (мм). Жирным шрифтом выделены коэффициенты с p < 0.05, жирным курсивом – с p < 0.1
| Вид | За год | Май-Август | Июнь | Июль | Август | Июль + Август |
|---|---|---|---|---|---|---|
| S. araneus | –0.19 | –0.51 | 0.26 | –0.06 | –0.40 | –0.22 |
| N. fodiens | –0.43 | –0.65 | 0.25 | –0.45 | –0.64 | –0.75 |
Использование пространства. Достаточно полные данные для анализа получены только в “сухом” местообитании. Оседлые обыкновенные бурозубки посещали, в среднем, 72.6 ± 13.2% ловушек (от всех 87 на площадке), в 2021 – 77%. От 30 до 61% (в 2021 – 49%) ловушек на участке обыкновенной бурозубки посещались также и бурозубками соседями. Доля совместно посещаемых ловушек (Hj) коррелировала (RS = 0.91, p < 0.01) с долей ловушек (от всех 87) посещаемых оседлыми бурозубками (рис. 4).
Рис. 4.
Использование пространства сеголетками обыкновенной бурозубки. Hj – доля ловушек на участке, посещаемых совместно с конспецификами, Aj – доля поимок в ловушки, посещаемые совместно с оседлыми соседями.
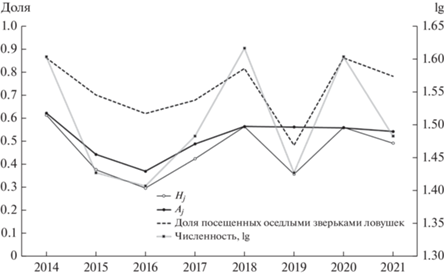
Ранее было показано, что совмещение обыкновенных бурозубок в ловушках в период 2014–2020 гг. соответствует ожиданию для случайного совпадения номеров ловушек (Щипанов, 2021). Эта ситуация не изменилась и в 2021 г. Всего бурозубки посетили 68 ловушек, из них двумя и более особями посещалось 30 ловушек, т.е. Hj = 0.49; среднее число ловушек на участке особи – 4.5, суммарное число ловушек на участках всех 25 оседлых зверьков – Nk = 113; при таком количестве испытаний в модели случайно совпадают, в среднем, 32 номера ловушек, границы 95% CI – 26–38 совпадающих номеров. Таким образом, фактическое число ловушек, посещенных бурозубками совместно с соседями – 30, не выходит за пределы доверительного интервала, ожидаемого для случайного совпадения. Посещаемость пространства пропорциональна доле совместно посещаемых ловушек. Фактическая частота посещения ловушек хозяевами участка совместно с “чужаками” – Aj = = 0.54 (74:88), не отличается (χ2 = 1.58, df = 1, p > > 0.20) от ожидаемой – 0.51 (82 : 80).
В 2021 г. при высокой плотности на площадке мы смогли оценить вероятность случайного совпадения посещаемых ловушек и для кутор. Всего обыкновенные куторы посетили 26 ловушек, из них двумя и более особями посещалось 6 ловушек, т.е. Hj = 0.23. Среднее число ловушек на участке куторы равно 4, суммарное число ловушек на участках всех 8 оседлых зверьков – Nk = 32. В модели случайно совпадают, в среднем, 4 номера ловушек, 95% CI от 1.1 до 7.5. Таким образом, и у кутор число ловушек, посещенных совместно с соседями – 6, находится в пределах доверительного интервала, ожидаемого для случайного совпадения. Частота посещения ловушек хозяевами участка совместно с “чужаками” Aj = 0.18 (8 : 36) не отличается (χ2 = 0.52, df = 1, p > 0.47) от ожидаемой – 0.23 (10 : 34) для соотношения пропорционального доле совместно посещаемых ловушек.
Совмещение в ловушках обыкновенной бурозубки и куторы соответствовало случайному совпадению номеров, посещаемых ловушек. Из 68 посещаемых обыкновенной бурозубкой ловушек, 25 посещалось так же и куторами. Случайные номера ловушек были генерированы для каждого из видов в отдельных моделях. Совпадающие номера определены в парах моделей кутора–бурозубка по результатам 1000 итераций. В итоге, среднее количество случайно совпадающих у обоих видов номеров ловушек составило 26, а 95% CI от 20 до 32. Таким образом, фактическое число совместно посещенных обоими видами ловушек – 25, не выходят за пределы доверительного интервала, ожидаемого для случайного совпадения.
Для проверки предположения влияния занятости ловушек на частоту их посещения особями разных видов мы оценили частоту попаданий в ловушки, посещаемые конспецификами и “чужим” видом. В результате не обнаружено зависимости частоты посещений ловушки одним из видов, от частоты посещений ловушки другим видом (Rs = 0.096, p > 0.6), а количество посещений ловушек своим и чужим видом (медиана числа попаданий бурозубки в ловушки, посещаемые и конспецификами и куторой равна 2 в обоих случаях), не различаются (Манн–Уитни U = 487.5, p > 0.37).
Достоверная положительная корреляция числа занимаемых на площадке обыкновенными бурозубками ловушек и Lg обилия кутор в период 2014–2021 гг. (r = 0.78, p < 0.023), показывает, что пригодность пространства площадки для резидентов и бурозубки, и куторы меняется синхронно.
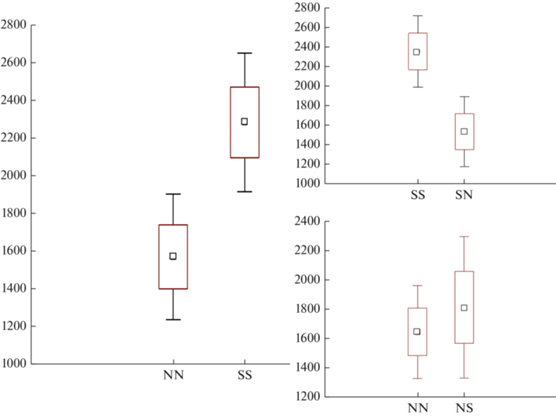
Поведение. Общая активность в тесте, т.е. средняя скорость перемещений и суммарная дистанция, пройденная в тесте, значимо (ANOVA, ID – random, p < 0.05) больше у обыкновенной бурозубки (рис. 5). У обыкновенной бурозубки активность в открытом поле в присутствии стимулятора куторы значимо (t = 3.65, df = 32, p < 0.001) уменьшилась: общая дистанция в одновидовых тестах – 2960 ± 1124 см, а с куторой – 1671 ± 903 см. У кутор изменение общей дистанции в тестах со стимулятором обыкновенной бурозубкой (рис. 5) незначимо (p > 0.18).
Рис. 5.
Среднее значение суммарной дистанции перемещений (см) в одновидовых экспериментах с куторой (NN) и обыкновенной бурозубкой (SS); в экспериментах с куторой и бурозубкой в качестве стимулятора (NS); в экспериментах с бурозубкой и куторой в качестве стимулятора (SN). Ящик – SE, усы – 1.96SE.
Распределение пространственной активности в разных зонах арены (D-индекс) у куторы и обыкновенной бурозубки однотипно (рис. 6). Во всех типах тестов, плотность посещения центральной части арены, DCZ, значимо меньше 1 (табл. 2). Мобильность в одновидовых тестах в центральной части вольеры (DCZ) у бурозубки значимо (t = –2.34, df = 56, p < 0.023) меньше, чем у куторы, что свидетельствует о большей осторожности зверьков этого вида. В межвидовых экспериментах обыкновенная бурозубка значимо уменьшила перемещения в краевой зоне (t = 2.41, df = 58, p < 0.019) и увеличила подвижность в зоне пустого контейнера – FZ (t = –2.3, df = 58, p < 0.023), другие изменения в межвидовых тестах обоих видов не значимы (рис. 6).
Рис. 6.
Плотность перемещений в краевой зоне – DBZ, центральной зоне – DCZ, на крышке пустого контейнера – DFC и контейнера со стимулирующим животным – DFC, в зоне пустого контейнера – DFZ и контейнера со стимулирующим животным – DAZ. Обыкновенная бурозубка в одновидовых тестах (SS), в испытаниях с куторой в качестве стимулятора (SN), и кутора в одновидовых тестах (NN) и испытаниях с бурозубкой в качестве стимулятора (NS). Показаны средние значения, для нормально распределенных (см. табл. 2) и медианы (Ме) для ненормально распределенных данных. Достоверные различия с одновидовыми тестами (p < 0.05) показаны квадратными скобками.
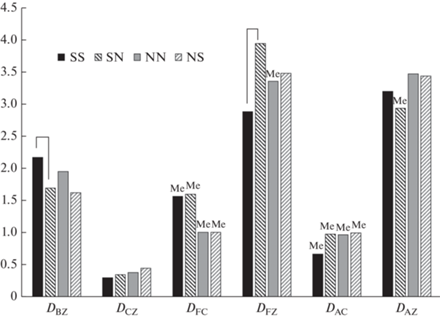
Таблица 2.
Величина индекса мобильности в разных зонах арены. Для нормально распределенных данных показано среднее значение ±SD и результаты t теста для сравнения с 1; для не нормально распределенных – медиана и результаты теста знаков. Индексы достоверно меньше 1 выделены жирным, ненормально распределенные данные – курсивом. Тип поведенческого теста обозначен как на рис. 5. **** – p < 0.00001, *** – p < 0.0001, ** – p < 0.001, значения p > 0.001 показаны цифрами
| Тип теста | Характеристики | DBZ | DCZ | DFC | DFZ | DAC | DAZ |
|---|---|---|---|---|---|---|---|
| SS (n = 38) | Shapiro–Wilk W; p | 0.96; 0.15 |
0.96; 0.26 |
0.87; 0.0006 | 0.94; 0.059 | 0.80; 0.0001 | 0.97; 0.28 |
| Ср./Me | 2.18 ± 0.69 | 0.30 ± 0.11 | 1.57 | 2.87 ± 1.47 | 0.67 | 3.20 ± 1.85 | |
| t/% < 1 | 10.37 | –38.88 | 34.21 | 7.91 | 60.53 | 7.35 | |
| p | **** | **** | 0.07 | **** | 0.26 | **** | |
| NN (n = 20) | Shapiro–Wilk W; p | 0.95; 0.41 |
0.98; 0.97 |
0.85; 0.006 |
0.92; 0.13 |
0.85; 0.005 |
0.96; 0.53 |
| Ср./Me | 1.95 ± 0.69 | 0.38 ± 0.14 | 1.01 | 3.02 ± 1.67 | 0.97 | 3.47 ± 2.26 | |
| t/% < 1 | 6.16 | –20.24 | 50.00 | 5.38 | 50.00 | 4.88 | |
| p | **** | **** | 0.82 | *** | 0.82 | *** | |
| SN (n = 21) | Shapiro–Wilk W; p | 0.95; 0.42 |
0.94; 0.19 |
0.54; 0.0001 | 0.89; 0.03 | 0.86; 0.001 |
0.88; 0.02 |
| Ср./Me | 1.67 ± 0.82 | 0.34 ± 0.14 | 1.6 | 3.36 | 0.98 | 2.94 | |
| t/% < 1 | 3.77 | –20.24 | 38.10 | 0.00 | 47.62 | 14.29 | |
| p | ** | **** | 0.38 | **** | 0.99 | 0.002 | |
| NS (n = 12) | Shapiro–Wilk W; p | 0.93; 0.38 |
0.95; 0.61 |
0.93; 0.38 |
0.90; 0.20 |
0.91; 0.22 |
0.93; 0.43 |
| Ср./Me | 1.95 ± 0.69 | 0.38 ± 0.14 | 1.01 | 3.48 ± 2.03 | 1.00 ± 0.82 | 3.44 ± 2.26 | |
| t/% < 1 | 6.16 | –20.24 | 50.00 | 4.23 | 0.02 | 4.88 | |
| p | 0.005 | **** | 0.11 | ** | 0.98 | ** |
Плотность посещения крышек контейнеров не отличалась от 1 у обоих видов, что позволяет говорить о случайном посещении этой зоны. Однако можно заметить, что плотность посещения крышки пустого контейнера – несоциального исследуемого объекта в одновидовых тестах у бурозубок превышала тот же показатель у кутор на уровне тенденции (Mann–Whitney U = 272.5, p < 0.08), свидетельствуя о большей тщательности исследования.
Плотность посещения зон контейнеров была во всех случаях достоверно выше плотности перемещений в краевой зоне (табл. 3), что свидетельствует об интересе зверьков к исследованию этих объектов. Достоверно меньшая скорость перемещения в зоне стимулятора (AZ) обнаружена в одновидовых экспериментах у обоих видов (табл. 4). В межвидовых тестах у бурозубки это различие пропадает, так как высоко достоверно (t = 3.96, df = 31, p < 0.001) снижается скорость перемещения в зоне обследования пустого контейнера (FZ). У кутор заметных изменений в межвидовых тестах не наблюдалось (табл. 4).
Индекс предпочтения перемещений, Id, у бурозубок составлял от –0.48 до 0.28 (в среднем, в одновидовых тестах – 0.01, со стимулятором куторой – –0.06), у кутор – от –0.44 до 0.43 (в среднем – ‒0.01 в одновидовых тестах и 0.01 в тестах со стимулятором бурозубкой). Во всех выборках Id не отличался от 0. Учитывая значимые различия в скорости перемещения в зонах объекта, более показательным является индекс предпочтения во времени, It. Этот индекс у обыкновенной бурозубки в одновидовых тестах изменялся от –0.49 до 0.38, в среднем, по выборке составлял 0.11, и был достоверно (критерий знаков) больше 0 (n = 38, % It > 0 = 68, p < 0.034). У кутор It (от –0.41 до 0.49) в среднем составил 0.09, и достоверно от 0 не отличался. В межвидовых тестах It у бурозубок значимо (t = –2.58, df = 57, p < 0.013) уменьшился, стал слабо отрицательным (–0.04), не отличающимся от 0. У кутор значимых изменений не обнаружено, в среднем It составил 0.06.
Таблица 3.
Результаты попарного t теста сравнения плотности посещения зон контейнеров со стимулятором (DAZ) и пустым контейнером (DFZ) с плотностью посещения краевой зоны (DBZ). Тип поведенческого теста обозначен как на рис. 5
| Тип теста | DFZ | DAZ | ||||
|---|---|---|---|---|---|---|
| t | df | p | t | df | p | |
| SS | –2.14 | 37.00 | 0.04 | –2.64 | 37.00 | 0.012 |
| NN | –2.24 | 19.00 | 0.04 | –2.60 | 19.00 | 0.018 |
| SN | –4.14 | 21.00 | 0.001 | –2.79 | 21.00 | 0.011 |
| NS | –2.62 | 11.00 | 0.02 | –3.69 | 11.00 | 0.004 |
Таблица 4.
Средние скорости перемещения фокусного животного в зоне стимулятора (AZ) и в зоне пустого контейнера (FZ) и величина различий (критерий знаков). Значимые различия выделены жирным шрифтом. Тип теста как на рис. 5
| Тип теста | FZ | AZ | n | %FZ < AZ | Z | p< |
|---|---|---|---|---|---|---|
| NN | 7.4 ± 2.7 | 4.1 ± 1.6 | 17 | 11.8 | 2.91 | 0.004 |
| SS | 9.5 ± 3.4 | 6.2 ± 3.0 | 17 | 5.9 | 3.4 | 0.001 |
| SN | 5.4 ± 2.3 | 5.1 ± 1.5 | 16 | 43.8 | 0.25 | 0.80 |
| NS | 6.2 ± 1.8 | 4.8 ± 1.4 | 12 | 50.0 | –0.29 | 0.77 |
Повторяемость (R) индексов предпочтения была обнаружена только в одновидовых тестах, т.е., у обоих видов выявлены устойчивые индивидуальные различия в коммуникабельности с конспецификом и “социальное безразличие” в отношении “чужого” вида (табл. 5).
Таблица 5.
Повторяемость (R) индексов предпочтения во времени – It и в пространстве – Id в одновидовых и межвидовых тестах (тип теста по рис. 5). CI – доверительный интервал, p – вероятность, оцененная в тесте пермутаций, LRT – в тесте отношения правдоподобия (Likelihood-ratio test). Достоверные значения выделены жирным шрифтом
| Тип теста | Индекс | R | CI | p | LRT |
|---|---|---|---|---|---|
| SS | Id | 0.718 | 0.182, 0.934 | 0.021 | 0.006 |
| It | 0.755 | 0.283, 0.950 | 0.011 | 0.003 | |
| NN | Id | 0.891 | 0.285, 0.994 | 0.04 | 0.006 |
| It | 0.855 | 0.121, 0.992 | 0.06 | 0.011 | |
| SN | Id | 0.171 | 0, 0.643 | 0.338 | 0.26 |
| It | 0.029 | 0, 0.554 | 0.517 | 0.457 | |
| NS | Id | 0.463 | 0, 0.926 | 0.224 | 0.114 |
| It | 0.169 | 0, 0.843 | 0.409 | 0.338 |
Индексы предпочтения (Id и It) высоко достоверно (p < 0.0001) связаны между собой: у бурозубки (r = 0.89) и у куторы (r = 0.95), однако у бурозубки индекс предпочтения по времени – It положительно коррелирует с плотностью перемещений в зоне стимулятора (AZ) и на крышке контейнера со стимулятором (AC), а индекс предпочтения в пространстве – Id, отрицательно связан с перемещениями в зоне (FZ) и на крышке (FC) пустого контейнера (табл. 6). Таким образом, у обыкновенных бурозубок It в основном отражает социальную составляющую поведения, а Id – исследовательскую активность. У кутор оба индекса, достоверно связаны с зонами контейнеров: положительно со стимулятором и отрицательно с пустым. Перемещения на крышке контейнера со стимулятором коррелируют с обоими индексами предпочтения, тогда как перемещения на крышке пустого контейнера с индексами не связаны (активность на крышках контейнеров показывает, является ли препятствием для обследования объекта наличие в нем стимулятора). Подвижность в центральной и краевой зонах арены с индексами предпочтения у этих видов не связана (табл. 6).
Таблица 6.
Коэффициенты корреляции (r) индексов предпочтения во времени – It и в пространстве – Id и плотности перемещения в разных зонах открытого поля (D-индексы) в одновидовых тестах с обыкновенными бурозубками (SS) и куторами (NN). Достоверные корреляции выделены жирным шрифтом
| Тип теста | Индекс | DBZ | D CZ | D FC | D FZ | D AC | D AZ | |
|---|---|---|---|---|---|---|---|---|
| SS | It | r | –0.2084 | –0.1223 | –0.1548 | –0.2384 | 0.3482 | 0.6794 |
| p | 0.209 | 0.464 | 0.353 | 0.149 | 0.032 | 0.0001 | ||
| Id | r | –0.038 | –0.0305 | –0.3521 | –0.4639 | 0.1757 | 0.5706 | |
| p | 0.821 | 0.856 | 0.030 | 0.003 | 0.291 | 0.0001 | ||
| NN | Id | r | –0.1542 | –0.3347 | 0.0131 | –0.5436 | 0.4877 | 0.8607 |
| p | 0.516 | 0.149 | 0.956 | 0.013 | 0.029 | 0.0001 | ||
| It | r | –0.2997 | –0.2334 | 0.1831 | –0.4473 | 0.54 | 0.8807 | |
| p | 0.199 | 0.322 | 0.440 | 0.048 | 0.014 | 0.0001 | ||
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Колебания обилия куторы обыкновенной в постоянно влажных, околоводных местообитаниях обычно не выражены (Churchfield, 1984a, Michelat, Giraudoux, 2006). В то же время, обилие кутор связано с колебанием уровня воды: в болотах Малого Балатона численность и распространенность значительно возрастают в периоды большего заливания территории (Czabán et al., 2015). В Барабинской низменности, где чередуются сухие и влажные фазы климатического цикла, обилие обыкновенной куторы многократно возрастает во годы наибольшей увлажненности, периодически достигая пиковых значений, и тогда кутора занимает свыше 40% в общем улове землероек (Панов, Карпенко, 2004). В периоды повышения численности куторы выходят в примыкающие, более сухие, местообитания (Панов, Карпенко, 2004). Заметим, что обилие кутор в Барабе было связано не с текущим обилием осадков, а с уровнем воды в болотах, который повышался спустя несколько лет после обильных осадков. В рассматриваемом нами случае выселение куторы в “сухие” местообитания коррелировало с более сухой погодой, однако, при этом наблюдалось лишь в те годы, когда не пересыхал ближайший к площадке ручей. По-видимому, появление кутор на площадке мечения определялось сочетанием успешного размножения во влажных местообитаниях и возникшим в засушливый период дефицитом благоприятных микроместообитаний около воды. Обнаруженный нами в “сухом” местообитании уровень популяционной плотности сопоставим с плотностью во влажных местообитаниях: у нас от 0 до 12.3 (во время пика) особей на га, в среднем – 2.7 ос/га; на заливаемых плантациях жерухи обыкновенной – 3–5 особей на га (Churchfield, 1984a). Показатель обилия вдоль ручья – 1.4 особи на 100 м (у нас) близок показателю обилия вдоль каналов в Швейцарии: 1.8 на 100 м (Cantoni, 1993). Обилие бурозубки на площадке, 30–40 особей на га, соответствует известным уровням плотности этого вида в травянистых местообитаниях (Shchipanov et al., 2019). Обыкновенная бурозубка обитает на ареале с повсеместно густой сетью рек и ручьев, и наблюдаемое нами периодическое сосуществование с куторой в “сухих” местообитаниях не уникально.
В питании обыкновенной куторы, обитающей около воды, преобладают водные животные (DuPasquier, Cantoni, 1992), но, в более сухих местообитаниях и в более сухое время года (с середины лета) кутора использует, в основном, наземные виды беспозвоночных (Haberl, 2002; Churchfield, 1984b). Обыкновенные бурозубки чувствительны к кормообеспеченности территории (Лукьянова и др., 2021). Во влажных местообитаниях снижение конкуренции у кутор и бурозубок может достигаться за счет предпочтения разных микроместообитаний (Churchfield, Rychlik, 2006). Однако в “сухом” местообитании нами обнаружена положительная корреляция числа посещаемых оседлыми обыкновенными бурозубками ловушек и числа оседлых кутор. Это позволяет предполагать, что благоприятные условия для резидентов обоих видов в этом месте сходны.
Как замечает О.А. Жигальский (2007) требования видов к среде “скорее указывают на возможность существования межвидовой конкуренции, чем служат ее непосредственным доказательством”. Мы не обнаружили в “сухом” местообитании пространственного разобщения оседлых обыкновенных бурозубок и кутор: совмещение в пространстве соответствовало вероятности случайного совпадения домашних участков. Не выявлено и каких-либо специфических поведенческих реакций, способных снизить вероятность прямого контакта зверьков. И обыкновенная кутора, и обыкновенная бурозубка агрессивны и во внутривидовых, и в межвидовых взаимодействиях, обладают сходным набором поведенческих паттернов, причем, как у других землероек более крупный вид доминирует в контактах (Калинин и др., 1998; Rychlik, Zwolak, 2006). Поведение обыкновенных кутор в межвидовых взаимодействиях неоднократно изучали в вольерах и в контактных тестах. В частности, во взаимодействиях обыкновенной и малой куторы (Neomys anomalus) было обнаружено, что число агрессивных контактов между оседлыми зверьками намного меньше, чем у нерезидентных особей этих видов, и, с учетом, обнаруженного (в этом эксперименте) снижения в течение 1–3 дней числа конфликтов, предполагалось быстрое обоюдное обучение (Krushinska et al., 1994). В экспериментах, в паре N. fodiens – N. anomalus меньшая по размеру малая кутора, субординант в межвидовых контактах, избегает более крупную обыкновенную кутору, ориентируясь, в числе прочего, на акустические и ольфакторные сигналы (Krushinska, Rychlik, 1993). Можно было бы ожидать, что совместное обитание с куторой будет подобным образом влиять и на поведение обыкновенной бурозубки. Вопреки ожиданиям, в паре S. araneus – N. fodiens нами не выявлено реакций, направленных на избегание или вытеснение “чужого” вида. Оба вида показали устойчивые индивидуальные различия (повторяемость коммуникабельности) в одновидовых тестах и безразличие к “социальному объекту” в межвидовых тестах. В межвидовых тестах оба вида проявили одинаковую заинтересованность в исследовании контейнера со зверьком и пустого контейнера. Реакция на присутствие “чужого” вида наблюдалась только у бурозубки: общая двигательная активность существенно понижалась, но одновременно снижалась посещаемость краевой зоны открытого поля, и скорость перемещений около контейнеров (возросла тщательность исследования). Таким образом, кутора воспринималась бурозубками не как угрожающий субъект, а, скорее, как беспокоящий объект, стимулирующий общую исследовательскую активность. Это предположение соответствует наблюдениям, в которых при совместном содержании с обыкновенными куторами доминировали обыкновенные бурозубки, а число внутривидовых конфликтов превышало число межвидовых (Köhler, 1985).
Таким образом, в сухих местообитаниях мы не обнаружили пространственного разобщения и каких-либо поведенческих механизмов способных снизить вероятность прямых контактов обыкновенной куторы и обыкновенной бурозубки. Вместе с тем, рассмотренная ситуация хорошо соответствует моделям “флуктуационно-зависимого” сосуществования. Оба вида имеют устойчивый тренд обилия (Hutterer, Kryštufek, 2016; Hutterer et al., 2016). Оба вида имеют нелинейную динамику численности, но в “сухих” местообитаниях доминирующий в прямых столкновениях вид – кутора (Rychlik, Zwolak, 2006) имеет больший коэффициент нелинейности (SI), что, согласно модели “нелинейной конкуренции”, снижает давление на конкурента (Chesson, 2000). На месте вселения благоприятные для оседлого существования обоих видов условия совпадают, и мы видим положительную ковариацию между средой и конкуренцией. Однако, если обилие кутор связано с увлажнением территории, то на обыкновенных бурозубок этот фактор не влияет. Увлажненность территории можно рассматривать, как “лимитирующий фактор”, варьирование которого мы наблюдаем у кутор. “Буферный эффект” в данном случае проявляется как разделение предпочитаемых местообитаний в неблагоприятных условиях среды: в маловодные периоды обыкновенная кутора сохраняется на ограниченных по площади околоводных участках. Таким образом, рассматривая сосуществование обыкновенной бурозубки и куторы, можно говорить о реализации “эффекта накопления”, как результата трех составляющих: “дифференцированного ответа” на изменения среды, “ковариации между средой и конкуренцией” и “буферного эффекта”, как это и предполагается в моделях (Chesson, 1990, 2000).
Нам представляется, что взаимодействия в этой паре видов могут являться хорошей природной моделью для проверки предпосылок следующих из теоретических моделей “флуктуационно-зависимого” сосуществования и заслуживают более глубокого изучения.
Финансирование. Работа выполнена в рамках государственного задания (АААА-А18-118042490060-1).
Соответствие этическим норма. Соблюдались все применимые международные, национальные и/или институциональные рекомендации по уходу и использованию животных. Все процедуры с участием животных были одобрены Биоэтическим комитетом по исследованиям на животных и людях при Институте им. Северцов РАН (разрешение № 30 от 27 февраля 2019 г.) в соответствии со всеми соответствующими законами и нормативными актами.
Список литературы
Бигон М., Харпер Д., Таунсенд К. Экология. Особи, популяции и сообщества. Межвидовая конкуренция. М.: Мир, 1989. Т. 1. С. 341–395.
Бобрецов А.В. Млекопитающие Печоро-Илычского заповедника. Обыкновенная бурозубка. Ред. Куприянов А.Г. Сыктывкар: Коми Книж. Изд-во, 2004. С. 46–64.
Большаков В.Н., Васильев А.Г., Шарова Л.П. Фауна и популяционная экология землероек урала (Mammalia, Soricidae). Екатеринбург: Изд-во Екатеринбург, 1996. 268 с.
Жигальский О.А. Пространственно-временные взаимоотношения трех симпатрических видов полевок (Mammalia: Rodentia) на Южном Урале // Журн. общей биологии. 2007. Т. 68. Вып. 6. С. 468–478.
Зайцев М.В. Эколого-морфологические особенности функционирования жевательного аппарата землероек. Эволюционные факторы формирования разнообразия животного мира. М.: КМК, 2005. С. 135–145.
Калинин А.А., Щипанов Н.А., Демидова Т.Б. Поведение четырех видов землероек-бурозубок Sorex isodon, S. araneus, S. caecutiens, S. minutus (Insectivora, Soricidae) при межвидовых контактах. Зоологический журн. 1998. Т. 77. Вып. 7. С. 838–849.
Лукьянова Л.Е., Ухова Н.Л., Ухова О.В., Городилова Ю.В. Население обыкновенной бурозубки (Sorex araneus, Eulipotyphla) и кормообеспеченность ее местообитаний в экологически контрастной среде // Экология. 2021. № 4. С. 298–311.
Панов В.В., Карпенко С.В. Динамика популяции куторы обыкновенной – Neomys fodiens (Mammalia: Soricidae) и ее гельминтофауны в северной Барабе // Паразитология. 2004. Т. 38. № 5. С. 448–456.
Погода и климат. http://www.pogodaiklimat.ru/history/26499_2.htm.
Щипанов Н.А. Случайные процессы и использование территории обыкновенной бурозубкой (Sorexaraneus L.) // Экология. 2021. № 2. С. 153–160.
Щипанов Н.А., Калинин А.А., Олейниченко В.Ю., Демидова Т.Б., Гончарова О.Б., Нагорнев Ф.В. К методике изучения использования пространства землеройками-бурозубками // Зоол. журн. 2000. Т. 79. Вып. 3. С. 362–371.
Adler P.B., Smull D., Beard K.H., Choi R.T., Furniss T., Kulmatiski A. et al. Competition and coexistence in plant communities: intraspecific competition is stronger than interspecific competition // Ecology Letters. 2018. V. 21. P. 1319–1329.
Cantoni D. Social and spatial organization of free-ranging shrews, Sorex coronatus and Neomys fodiens (Insectivora, Mammalia) //Animal Behaviour. 1993. V. 45. I. 5. P. 975–995.
Champneys A. Factors affecting distribution and habitat selection of water shrews Neomys fodiens. Thesis PHD: Nottingham Trent University (United Kingdom). 2012. 282 p.
Chesson P.L. Geometry, heterogeneity and competition in variable environments // Philos. Trans. R. Soc. London Ser. B. 1990. V. 330. P. 165–173.
Chesson P. Multispecies competition in variable environments // Theor. Popul. Biol. 1994. V. 45. P. 227–276.
Chesson P. Mechanisms of maintenance of species diversity // Annual review of Ecology and Systematics. 2000. P. 343–366.
Churchfield S. An investigation of the population ecology of syntopic shrews inhabiting water-cress beds // J. Zoology. 1984a. V. 204. I. 2. P. 229–240.
Churchfield S. Dietary separation in three species of shrew inhabiting water-cress beds // J. Zoology. 1984b. V. 204. I. 2. P. 211–228.
Churchfield S. The natural history of shrews: Cornell University Press. 1990. 178 p.
Churchfield S. Why are shrews so small? The costs and benefits of small size in northern temperate Sorex species in the context of foraging habits and prey supply // Acta theriologica. 2002. V. 47. I. 1. P. 169–184.
Churchfield S., Rychlik L. Diets and coexistence in Neomys and Sorex shrews in Białowieża forest, eastern Poland // J. Zoology. 2006. V. 269. I. 3. P. 381–390.
Churchfield S., Sheftel B.I. Food niche overlap and ecological separation in a multi-species community of shrews in the Siberian taiga // J. Zoology. 1994. V. 234. I. 1. P. 105–124.
Churchfield S., Nesterenko V.A., Shvarts E.A. Food niche overlap and ecological separation amongst six species of coexisting forest shrews (Insectivora: Soricidae) in the Russian Far East // J. Zoology. 1999. V. 248. I. 3. P. 349–359.
Churchfield S., Sheftel B.I., Moraleva N.V., Shvarts E.A. Habitat occurrence and prey distribution of a multi-species community of shrews in the Siberian taiga // J. Zoology. 1997. V. 241. I. 1. P. 55–71.
Churchfield S., Hollier J., Brown V.K. Population dynamics and survivorship patterns in the common shrew Sorex araneus in southern England // Acta Theriologica. 1995. V. 40. P. 53–68.
Crawley J. What’s Wrong with My Mouse? Behavioral phenotyping of transgenic and knockout mice. N.Y.: John Wiley & Sons, Inc. 2000. 544 p.
Czabán D., Zsebok S., Cserkész T., Farkas J. Impact of changing water level on shrew populations in the kis-balaton wetlands, Western Hungary // Applied Ecology and Environmental Research. 2015. V. 13. I. 2. P. 349–360.
Day T., Young K.A. Competitive and facilitative evolutionary diversification // BioScience. 2004. V. 54. I. 2. P. 101–109.
Dickman C.R. Mechanisms of competition among insectivorous mammals // Oecologia. 1991. V. 85. P. 464–471.
DuPasquier A., Cantoni D. Shifts in benthic macroinvertebrate community and food habits of the water shrew, Neomys fodiens (Soricidae, Insectivora) // Acta oecologica. 1992. V. 13. I. 1. P. 81–99.
Freeman S, Herron J.C. Evolutionary Analysis. 2nd ed. Upper Saddle River (NJ): Prentice Hall. 2001. 704 p.
Grant P.R., Grant B.R. Evolution of character displacement in Darwin’s finches // Science. 2006. V. 313. P. 224–226.
Greenwood A., Churchfield S., Hickey C. Geographical distribution and habitat occurrence of the Water Shrew (Neomys fodiens) in the Weald of South-East England // Mammal Review. 2002. V. 32. I. 1. P. 40–50.
Haberl W. Food storage, prey remains and notes on occasional vertebrates in the diet of the Eurasian water shrew, Neomys fodiens // Folia zoologica. 2002. V. 51. I. 2. P. 93–102.
Hanski I. Population biological consequence of body size in Sorex // Advances in the biology of shrews. Eds. J.F. Merritt, G.L.Kirkland, Jr., R.K.Rose. 1994. Carnegie Museum of Natural History Special Publikation 18. P. 15–26.
Harris S., Yalden D.W. An integrated monitoring programme for terrestrial mammals // Mammal Rev. 2004. V. 34. P. 157–167.
Henttonen H., Haukisalmi V., Kaikusalo A., Korpimäki E., Norrdahl K, Skarén U.A.P. Long-term population dynamics of the common shrew Sorex araneus in Finland // Annales Zoologici Fennici. 1989. V. 26. P. 349–355.
Henttonen H., McGuire A.D, Hansson L. Comparisons of amplitudes and frequencies (spectral analyses) of density variations in long-term data sets of Clethrionomys species // Annales Zoologici Fennici. 1985. V. 22. I. 3. P. 221–227.
Hutchinson G.E. Homage to Santa Rosalia or why are there so many kinds of animals? // Amer. Naturalist. 1959. V. 93. P. 145–159.
Hutchinson G.E. “Concluding remarks” // Cold Spring Harbor Symposia on Quantitative Biology. 1957. V. 22. I. 2. P. 415–427.
Hutterer R., Kryštufek B. Sorex araneus. The IUCN Red List of Threatened Species. 2016: e.T29661A115170489.
Hutterer R., Meinig H., Bertolino S., Kryštufek B., Sheftel B., Stubbe M., Samiya R., Ariunbold J., Buuveibaatar V., Dorjderem S., Monkhzul Ts., Otgonbaatar M., Tsogbadrakh Neomys fodiens (errata version published in 2017). The IUCN Red List of Threatened Species 2016: e.T29658A115170106.
Kirkland G.L., Jr. Competition and coexistence in shrews (Insectivora, Soricidae). Eds. Findley J.S., Yates. The biology of soricinae. Special Publication. Albuquerque:The Museum of Sowthwestern Biology, University of New Mexico. 1991. P. 15–22.
Klenovšek T., Novak T., Čas M., Trilar T., Janžekovič F. Feeding ecology of three sympatric Sorex shrew species in montane forests of Slovenia // Folia Zoologica. 2013. V. 62. I. 3. P. 193–199.
Köhler D. Zum interspezifischen Verhalten von Neomys fodiens und Sorex araneus //Säugetierkdl. Inf. 1985. B. 2. P. 299–300.
Krushinska N.L., Rychlik L. Intra-and interspecific antagonistic behaviour in two sympatric species of water shrews: Neomys fodiens and N. anomalus //J. Ethology. 1993. V. 11. I. 1. P. 11–21.
Krushinska N.L., Rychlik L., Pucek Z. Agonistic interactions between resident and immigrant sympatric water shrews: Neomys fodiens and N. anomalus //Acta theriologica. 1994. V. 39. I. 3. P. 227–247.
Lardet J.P. Spatial behaviour and activity patterns of the water shrew Neomys fodiens in the field //Acta Theriologica. 1988. V. 33. I. 21. P. 293–303.
Levine J.M., Bascompte J., Adler P.B., Allesina S. Beyond pairwise mechanisms of species coexistence in complex communities // Nature. 2017. V. 546(7656). P. 56–64.
Michelat D., Giraudoux P. Synchrony between small mammal population dynamics in marshes and adjacent grassland in a landscape of the Jura plateau, France: a ten year investigation //Acta Theriologica. 2006. V. 51. I. 2. P. 155–162.
Mitchell-Jones A.J., Amori G., Bogdanowicz W., Kryštufek B., Reijnders P.J.H., Spitzenberger F., Stubble M., Thissen J.B.M., Vohralíc V., Zima J.E. The atlas of European mammals (Vol. 3). London: Academic Press. 1999. 484 p.
Moy S.S., Nadler J.J., Perez A., Barbaro R.P., Johns J.M., Magnuson T.R., Piven J., Crawley J.N. Sociability and preference for social novelty in five inbred strains: an approach to assess autistic-like behavior in mice // Genes, Brain, Behav. 2004. V. 3. I. 5. P. 287–302.
Nakagawa S., Schielzeth H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists // Biol. Rev. 2010. V. 85. P. 935–956.
Pfennig D.W., Rice A.M., Martin R.A. Field and experimental evidence for competition’s role in phenotypic divergence // Evolution. 2007. V. 61. I. 2. P. 257–271.
Rychlik L. Evolution of social systems in shrews. Eds. Wójcik J.M., Wolsan M. Evolution of Shrews. Białowieża: Mammal Reaearch Institute, 1998. P. 347–406.
Rychlik L. Habitat preferences of four sympatric species of shrews // Acta Theriologica. 2000. V. 45. Suppl. 1. P. 173–190.
Rychlik L., Zwolak, R. Interspecific aggression and behavioural dominance among four sympatric species of shrews // Canadian Journal of Zoology. 2006. V. 84. I. 3. P. 434–448.
Saitoh T., Stenseth N.C., Bjørnstad O.N. The population dynamics of the vole Clethrionomys rufocanus in Hokkaido // Japan. Population Ecology. 1998. V. 40. I. 1. P. 61–76.
Shchipanov N.A., Demidova T.B. A test for studying sociability of the common shrew, Sorex araneus // Russian J. Theriology. 2020. V. 19. I. 2. P. 105–111.
Shchipanov N.A., Demidova T.B. Inter-annual fluctuations of sociability in the common shrew (Sorex araneus L.) as determined by a preference test: A case of balancing selection? // Behavioural Processes. 2022. V. 198. 104625.
Shchipanov N.A., Kalinin A.A., Demidova T.B., Oleinichenko V.Yu., Aleksandrov D.Yu., Kouptzov A.V. Population ecology of red-toothed shrews, Sorex araneus, S. caecutiens, S. minutus, and S. isodon, in Central Russia. Advances in the Biology of Shrews II. Eds. Merrit J.F., Churchfield S., Hutterer R., Sheftel B. N.Y.: Special Publication of the International Society of Shrew Biologists, 2005. P. 201–216.
Shchipanov N.A., Zima J., Churchfield S. Introducing the common shrew. Shrews, Chromosomes and Speciation. Eds. Searle J., Polly P., Zima J. Cambridge: Cambridge University Press. 2019. P. 19–67.
Sheftel B.I. Long-term and seasonal dynamics of shrews in Central Siberia //Annales Zoologici Fennici. Finnish Zoological Publishing Board, formed by the Finnish Academy of Sciences, Societas Scientiarum Fennica, Societas pro Fauna et Flora Fennica and Societas Biologica Fennica Vanamo, 1989. P. 357–369.
Stenseth N.C., Framstad E. Reproductive effort and optimal reproductive rates in small rodents // Oikos. 1980. V. 34. № 1. P. 23–34.
Stoffel M.A., Nakagawa S., Schielzeth H., Goslee S. rptR: repeatability estimation and variance decomposition by generalized linear mixed-effects models // Methods Ecol. Evol. 2017. V. 8. P. 1639–1644.
Tast J., Kaikusalo A., Järvinen A. Population fluctuations of Sorex araneus at Kilpsjärvi, Finnish Lapland, as compared with rodent cycles. Advances in the Biology of Shrews II. Eds. Merritt J.F., Churchfield S., Hutterer R., Sheftel B. N.Y.: Special Publication of the International Society of Shrew Biologists, 2005. P. 215–228.
Tkadlec E., Stenseth N.C. A new geographical gradient in vole population dynamics // Proceedings of the Royal Society of London B. 2001. V. 268. P. 1547–1552.
Tomášková L., Bejček V., Sedláček F., et al. (2005). Population biology of shrews (Sorex araneus and Sorex minutus) from a polluted area in central Europe. Advances in the Biology of Shrews II. Eds. Merritt J.F., Churchfield S., Hutterer R., Sheftel B. N.Y.: Special Publication of the International Society of Shrew Biologists, 2005. P. 189–197.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


