Известия РАН. Серия биологическая, 2023, № 3, стр. 269-277
Анатомическое строение и фитохимический анализ листа, стебля и корня гортензии древовидной (Hydrangea arborescens L.)
Ф. К. Мурзабулатова 1, К. А. Пупыкина 2, Е. В. Красюк 2, Н. В. Полякова 1, *, З. Х. Шигапов 1
1 Южно-Уральский ботанический сад-институт ‒ обособленное структурное подразделение Федерального государственного бюджетного научного учреждения Уфимского федерального исследовательского центра Российской академии наук
450080 Уфа, ул. Менделеева, д. 195, корп. 3, Россия
2 Федеральное государственное бюджетное учреждение высшего образования
“Башкирский государственный медицинский университет” Министерства здравоохранения
Российской Федерации
450008 Уфа, ул. Ленина, 3, Россия
* E-mail: bloomerang11@gmail.com
Поступила в редакцию 17.01.2022
После доработки 23.08.2022
Принята к публикации 19.09.2022
- EDN: MULVYW
- DOI: 10.31857/S1026347023700130
Аннотация
Актуальность исследования обусловлена недостаточной изученностью биологических особенностей гортензий. Целью исследований стало выявление анатомо-диагностических признаков, а также химического состава гортензии древовидной (Hydrangea arborescens L.) коллекции Южно-Уральского ботанического сада-института УФИЦ РАН. В результате исследований установлено, что диагностически значимыми признаками листа данного вида гортензии являются строение клеток эпидермиса верхней и нижней стороны листа, наличие аномоцитного устьичного аппарата с нижней стороны листа, кристаллические включения оксалата кальция в виде рафидов с верхней и нижней стороны листа и простые волоски с грубо бородавчатой поверхностью, многоклеточным основанием, а также простые извилистые волоски с нижней стороны листа. Фитохимический анализ листьев, стеблей и корней подтвердил наличие в них кумаринов, аскорбиновой кислоты и дубильных веществ, а в листьях ‒ флавоноидов. Установлено, что наибольшее содержание аскорбиновой кислоты (0.28 ± 0.014%) и дубильных веществ (7.13 ± 0.639%) наблюдается в листьях гортензии древовидной, кумаринов в пересчете на умбеллиферон ‒ в корнях (0.41 ± 0.007%), а содержание флавоноидов в листьях составило 1.14 ± 0.048%.
Гортензии (Hydrangeaceae Dumort.) – листопадные, иногда вьющиеся кустарники, редко деревья, с отслаивающейся корой, очередными, черешковыми листьями и щитковидными или метельчатыми соцветиями (Сааков, 1959; Reed, Rinehart, 2009). По последним данным, род включает около 200 видов (Карпун, 2005), распространенных преимущественно в умеренных, редко субтропических областях северного полушария (Русанов, 1955; Тахтаджян, 1987; Маляровская, 2011а). На территории Российской Федерации в естественных условиях произрастают 2 вида гортензии – метельчатая (Hydrangea paniculata Siebold) и черешковая (Hydrangea petiolaris Siebold et Zucc.) (Пилипенко, 1954; Путенихин, 2007).
Гортензии очень популярны в декоративном садоводстве, где ценятся за крупные красивые соцветия и продолжительный период цветения (Lancaster, Wesley, 2008; Conolly et all., 2010; Коркуленко, 2012). Несмотря на высокую популярность и большое видовое разнообразие рода, некоторые биологические особенности гортензий пока остаются недостаточно изученными. В литературе имеются отрывочные данные по изучению начальных этапов индивидуального развития (Мазуренко, Хохряков, 1977; Мурзабулатова и др., 2021), микроклонального и вегетативного размножения (Ахметова, Пирогова, 2016; Ахметова, Молканова, 2019), зимостойкости и фенологии гортензий в различных климатических зонах (Малюгин, 1981; Мартынов, 2009; Мурзабулатова и др., 2018). Наиболее полное описание морфологии гортензий дано в работах А. Редера (Rehder, 1940), Ф.С. Пилипенко (1954) и E. Макклинток (McClintock, 1957). Что касается анатомических исследований, то в одних случаях в литературе приводится подробное описание анатомии отдельных видов, в других – отдельных частей растений (Solreder, 1908; Burkett, 1931; Цырендоржиева, 2006; Маляровская, 2011б; Нехайченко и др., 2014; Манджиголадзе и др., 2016; Бойко, 2020). Кроме того, данных по изучению анатомического строения корней гортензий в литературе нет. Новейших публикаций по изучению морфологии гортензий также крайне мало (Кокшеева, Нехайченко, 2021).
Химический состав гортензии древовидной до конца не изучен и требует детальной доработки. По литературным данным, в растительном сырье гортензий содержатся следующие соединения: кумарины (умбеллиферон, гидрангетин); флавоноиды (кверцетин, лютеолин, кемпферол, цианидин, рутин); в семенах ‒ алкалоид фебрифунгин; горькие гликозиды; витамины, сапонины, углеводы, эфирные масла (Растительные ресурсы СССР.., 1987; Манджиголадзе и др., 2016; Манджиголадзе и др., 2019; Манджиголадзе, Кузнецова, 2021).
Гортензия древовидная не входит в Государственную Фармакопею и не используется в официальной медицине, однако, данный вид нашел широкое применение в народной медицине и гомеопатии. В лекарственных целях в качестве сырья используют листья, цветки и корни. Корни гортензии древовидной оказывают умеренное ранозаживляющее, мочегонное, противовоспалительное, противомикробное действие, способствует выведению токсинов из организма через почки (Манджиголадзе и др., 2016).
Для полного представления о систематике видов необходимы комплексные данные по изучению морфологии и анатомии всех частей растения. Данные по химическому составу различных частей растения позволяют дать научное обоснование применению данного вида в лекарственных и других целях. В связи с этим в задачи наших исследований входило изучить анатомическое строение листьев, стеблей и корней гортензии древовидной из коллекции Южно-Уральского ботанического сада-института Уфимского федерального исследовательского центра РАН, а также провести исследования по изучению химического состава биологически активных веществ в надземных и подземных частях растения.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследования служили образцы сырья гортензии древовидной из коллекции Южно-Уральского ботанического сада-института (ЮУБСИ).
Гортензия древовидная (Hydrangea arborescens L.) – листопадный кустарник; листья яйцевидные или эллиптические, на вершине остроконечные или удлиненно-заостренные, с округлым или сердцевидным основанием, зазубренные, голые, реже снизу покрыты мелкими волосками. Стебли прямостоячие, округлые, ребристые, облиственные, светло-зеленого цвета, листорасположение супротивное. Корневая система мочковатая. Соцветие щитковидное, 5–15 см в диаметре; стерильные цветки белые, крупные, фертильные – мелкие, невзрачные, лепестки быстро опадающие. Семенная коробочка раскрывающаяся; семена мелкие, яйцевидно-эллипсоидальные. Область естественного распространения – Северная Америка. Коллекционные растения данного вида выращены из семян, полученных в 2006 г. из Ботанического сада г. Вакратот (Венгрия). Сбор образцов проведен в период цветения 20.07.2019 г.
Микроскопическое исследование образцов проводили на временных микропрепаратах, приготовленных по методике, приведенной в Государственной фармакопее (http://resource.rucml.ru/feml/ pharmacopia/14_2/HTML/516/index.html#zoom=z.).
Корни предварительно замачивали в спирто-глицериновой смеси (1 : 1), стебли и листья кипятили в 5% растворе натрия гидроксида. Продольные и поперечные срезы стебля и корня окрашивали раствором флороглюцина с концентрированной хлористоводородной кислотой для выделения механических элементов тканей. Фотографии микропрепаратов выполнены с помощью микроскопа Микромед С-1 LED.
Определение содержания кумаринов в сырье гортензии древовидной проводили спектрофотометрическим методом: 1.0 г сырья (точная навеска), измельченного до размера частиц, проходящих сквозь сито с диаметром отверстия 1 мм, помещали в колбу вместимостью 50 мл, заливали 20 мл 96% спирта этилового, и экстрагировали 30 минут еще четыре раза, добавляя по 10 мл 96% спирта этилового, указанным выше способом. Спиртовые извлечения объединяли, и выпаривали до объема 5 мл. Далее полученное извлечение наносили на хроматографическую пластинку “Sorbfil ПТСХ-П-А-УФ”, размером 15 × 15 см, высушивали на воздухе и помещали в камеру со смесью растворителей “бензол-этилацетат (2 : 1)". Хроматографирование проводили восходящим способом. Когда фронт растворителей прошел около 80–90 % длины пластинки от линии старта, ее вынимали из камеры, обрабатывали 5% спиртовым раствором калия гидроксида, высушивали при температуре 100–105°С 3–5 мин и просматривали в УФ-свете. Окрашенную зону сорбента вырезали, счищали, помещали в центрифужные пробирки на 10 мл, заливали 5 мл хлороформа и центрифугировали 10 мин при 3000 об./мин, отделяли надосадочную жидкость и получали исследуемый раствор. Оптическую плотность полученного раствора измеряли на спектрофотометре при длине волны 324 нм в кювете с толщиной слоя 10 см. В качестве раствора сравнения использовали хлороформ. Содержание суммы кумаринов в пересчете на умбеллиферон в абсолютно сухом сырье в процентах (X) вычисляли по формуле:
где:
Д – оптическая плотность исследуемого раствора;
955.47 – удельный показатель поглощения умбеллиферона в спирте этиловом при длине волны 324 нм;
m – навеска сырья (г);
W – потеря в массе при высушивании (%).
Определение содержания аскорбиновой кислоты проводили титриметрическим методом по методике, приведенной в Государственной фармакопее (http://resource.rucml.ru/feml/pharmacopia/14_2/ HTML/516/index.html#zoom=z.), основанной на способности аскорбиновой кислоты восстанавливать 2,6-дихлорфенолиндофенолят натрия.
Определение содержания дубильных веществ проводили титриметрическим методом по методике, приведенной в Государственной фармакопее (http://resource.rucml.ru/feml/pharmacopia/14_2/ HTML/516/index.html#zoom=z.), основанной на окислении дубильных веществ перманганата калия в кислой среде в присутствии индикатора и катализатора индигосульфокислоты.
Определение содержания флавоноидов проводили методом дифференциальной спектрофотометрии при добавлении комплексообразующей добавки – спиртового раствора алюминия хлорида и при аналитической длине волны 410 нм: 1.0 г (точная навеска), измельченного до размера частиц, проходящих сквозь сито с диаметром отверстия 1 мм, помещали в колбу со шлифом вместимостью 100 мл, прибавляли 100 мл 50% спирта этилового и взвешивали с точностью до ±0.01 г. Колбу с содержимым присоединяли к обратному холодильнику и нагревали на кипящей водяной бане в течение 60 мин. После охлаждения до комнатной температуры колбу взвешивали, доводили ее содержимое спиртом 50% до первоначальной массы, перемешивали и фильтровали через бумажный фильтр (исследуемый раствор А). 2.0 мл раствора А помещали в мерную колбу вместимостью 25 мл, прибавляли 2 мл 5% спиртового раствора алюминия хлорида и 1 мл 3% уксусной кислоты, доводили объем раствора 70% спиртом этиловым до метки и перемешивали (раствор Б). Оптическую плотность полученного раствора Б измеряли через 30 мин на спектрофотометре при длине волны 410 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали раствор, состоящий из 2 мл исследуемого раствора А, 1 капли уксусной кислоты разбавленной 30%, доведенный 70% спиртом этиловым до метки в мерной колбе вместимостью 25 мл.
Параллельно, в тех же условиях, измеряли оптическую плотность раствора комплекса стандартного образца (СО) рутина с алюминия хлоридом: в две мерные колбы вместимостью 25 мл помещали по 2.0 мл раствора СО рутина, в одну колбу прибавляли 2 мл 5% спиртового раствора хлорида алюминия в 95% спирте, а в другую – 1 мл 3% уксусной кислоты и доводили соответствующим спиртом до метки, перемешивали и через 30 мин измеряли оптическую плотность.
Содержание суммы флавоноидов в пересчете на рутин в абсолютно сухом сырье в процентах (Х) вычисляли по формуле:
где
A – оптическая плотность раствора Б исследуемого раствора;
Ao – оптическая плотность раствора Б СО рутина;
а – навеска сырья, г;
aо – навеска СО рутина, г;
W – потеря в массе при высушивании сырья, %.
Статистическую обработку полученных результатов проводили стандартными методами вариационной статистики с применением программ “Excel 7.0”, “Statistica 5.0”, “Statistica 6.0” с использованием критерия Стьюдента (http://resource.rucml.ru/feml/pharmacopia/14_2/HTML/516/ index.html#zoom=z.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анатомическое строение листа, стебля и корня Hydrangea arborescens
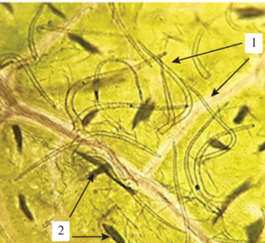
Лист. Микроскопический анализ листьев гортензии древовидной показал, что верхний эпидермис листовой пластинки состоит из многоугольных клеток, стенки которых слегка утолщены, нижний эпидермис представлен извилистыми клетками (рис. 1). Ранее другими авторами (Манджиголадзе и др., 2016) также указывалось, что строение верхней и нижней эпидермы листа гортензии древовидной различается. Устьичный аппарат аномоцитного типа (устьице окружено несколькими клетками), находится на нижней стороне листовой пластинки (рис. 2). На нижней и верхней стороне листовой пластинки расположены включения оксалата кальция в виде игольчатых кристаллов-рафидов, которые располагаются по всей поверхности листовой пластинки (рис. 3). Для гортензии древовидной характерно наличие одноклеточных волосков с грубо бородавчатой поверхностью, образующие на месте прикрепления розетку из шести клеток, а также изогнутых простых волосков. Волоски располагаются вдоль жилки (рис. 4, 5). По данным Т.Ю. Манджиголадзе с соавторами (2016), кроющие волоски являются выростами клеток эпидермиса. У других видов гортензии волосков подобного строения на листьях не обнаружено. Например, у гортензии метельчатой (Hydrangea paniculata Siebold) отмечаются одноклеточные хоботообразные волоски с шипиками по всей поверхности (Нехайченко и др., 2014).
Рис. 1.
Верхний эпидермис листа гортензии древовидной (×100): 1 ‒ многоугольные клетки со слегка утолщенными стенками.
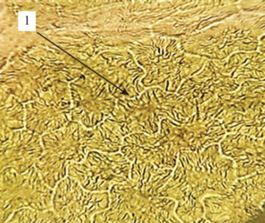
Рис. 2.
Нижний эпидермис листа гортензии древовидной (×100): 1 – извилистые клетки эпидермиса; 2 ‒ устьица аномоцитного типа.
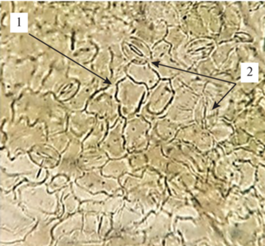
Рис. 3.
Верхний эпидермис листа гортензии древовидной, включения (×100): 1 – кристаллические включения в виде игольчатых кристаллов-рафидов.

Рис. 4.
Нижний эпидермис листа гортензии древовидной (×100): 1 ‒ простой бородавчатый волосок, 2 ‒ многоклеточное основание, образующее розетку.
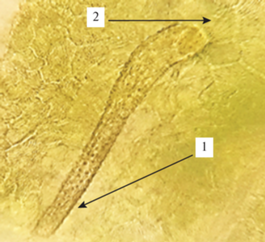
Рис. 5.
Нижний эпидермис листа гортензии древовидной (×100): 1 ‒ простые изогнутые волоски, 2 ‒ кристаллические включения оксалата кальция в виде игольчатых кристаллов-рафидов.
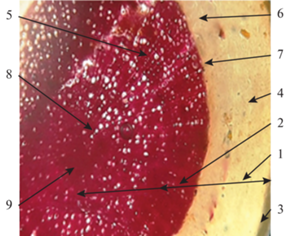
Стебель. На поперечном срезе стебля гортензии древовидной отмечается вторичное строение, пучковый тип, открытые коллатеральные пучки, кора и центральный цилиндр. Кора состоит из покровной ткани – эпидермы, колленхимы и клеток паренхимы. В работе Т.Ю. Манджиголадзе с соавторами (2016) уточняется, что кора стебля гортензии древовидной состоит из уголковой колленхимы, хлоренхимы (овальные клетки с хлоропластами) и столбчатых одревесневших клеток паренхимы. Центральный цилиндр состоит из элементов флоэмы, слоя камбия, вторичной и первичной ксилемы, клеток паренхимы сердцевины (рис. 6).
Рис. 6.
Поперечный срез стебля, вторичное строение стебля, пучкового типа (×100): 1 – кора, 2 центральный цилиндр, 3 – эпидерма, 4 – колленхима, 5 – паренхима, 6 – флоэма, 7 – камбий, 8 – вторичная ксилема, 9 – первичная ксилема, 10 – паренхима сердцевины.
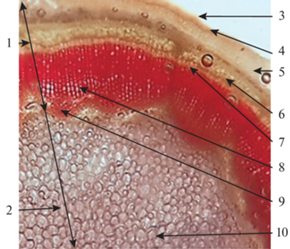
Корень. Литературных данных по изучению анатомического строения корня гортензии древовидной нами не найдено. По нашим исследованиям, строение корня – вторичное, кора состоит из покровной ткани, представленной перидермой и клетками паренхимы. Центральный цилиндр состоит из элементов проводящей системы, представленной вторичной флоэмой, первичной и вторичной ксилемой, разделенных камбием, а также содержит сердцевинные лучи (рис. 7).
Рис. 7.
Поперечный срез корня, вторичное строение (×100): 1 – кора, 2 ‒ центральный цилиндр, 3 – перидерма, 4 – паренхима, 5 – сердцевинный луч, 6 – вторичная флоэма, 7 – камбий, 8 – вторичная ксилема, 9 – первичная ксилема.
Анатомическое строение стебля и корня гортензии древовидной характеризуется как типичное для древесных растений, никаких особенностей в процессе изучения не выявлено.
Содержание биологически активных веществ в Hydrangea arborescens. Анализ литературы показал, что в предыдущих фитохимических исследованиях сырья гортензии древовидной были задействованы, в основном, качественные методы, позволяющие обнаружить наличие тех или иных биологически активных веществ в различных частях растения (Манджиголадзе и др., 2016, 2019; Манджиголадзе, Кузнецова, 2021). Литературных данных по количественному составу сырья практически нет, за исключением работы Т.Ю. Манджиголадзе и Л.С. Кузнецовой (2021), где определено содержание флавоноидов в пересчете на рутин в лекарственной форме – гранулах с экстрактом жидким гортензии древовидной. Наши исследования, которым посвящена данная работа, направлены на определение количества биологически активных веществ в листьях, стеблях и корнях гортензии древовидной.
Кумарины. Для исследования содержания кумаринов в сырье гортензии древовидной использовали методику спектрометрического определения. Из исследуемого сырья получали спиртовые вытяжки, далее растворы наносили на пластинки и хроматографировали восходящим способом в системе растворителей, полученные пятна счищали и растворяли в хлороформе. Полученные растворы спектрофотометрировали при длине волны 324 нм (рис. 8). Содержание суммы кумаринов определяли в пересчете на умбеллиферон. Результаты исследования количественного содержания кумаринов представлены в табл. 1. Проведенный анализ показал, что в корнях содержание кумаринов в пересчете на умбеллиферон составляет 0.41 ± 0.007%, стеблях – 0.25 ± 0.002%, в листьях – 0.22 ± 0.002%. Наибольшее содержание кумаринов наблюдается в корнях гортензии древовидной.
Рис. 8.
Спектры хлороформных извлечений гортензии при λmax = 324 нм: 1 – листья; 2 – стебли, 3 – корни.
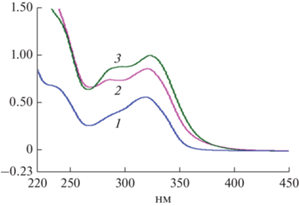
Таблица 1.
Результаты определения кумаринов в сырье гортензии древовидной
| Сырье | n | f | Х | Хср | Sx | P, % | t (P,ƒ) | ΔХ | ε, % |
|---|---|---|---|---|---|---|---|---|---|
| Листья | 1 | 2 | 0.235 | 0.22 | 0.0028 | 95 | 4.30 | 0.0023 | 4.88 |
| 2 | 0.200 | ||||||||
| 3 | 0.225 | ||||||||
| Стебли | 1 | 2 | 0.245 | 0.25 | 0.010 | 95 | 4.30 | 0.0028 | 5.12 |
| 2 | 0.253 | ||||||||
| 3 | 0.243 | ||||||||
| Корни | 1 | 2 | 0.412 | 0.41 | 0.009 | 95 | 4.30 | 0.0079 | 4.92 |
| 2 | 0.398 | ||||||||
| 3 | 0.405 |
Примечание: n – число измерений; f – число степеней свободы (f = n – 1); Х – показатель содержания кумаринов для каждого измерения; Хср – среднее значения содержания кумаринов для трех измерений; Sx – стандартное отклонение; P – доверительная вероятность (95%); t (P,ƒ) – критерий Стьюдента; ΔХ – доверительный интервал; ε, % – относительная ошибка. Для табл. 1–4.
Метрологическая характеристика методики количественного определения кумаринов в сырье гортензии древовидной показала, что при трех независимых выборках ошибка среднего результата листьев не превышает 4.88%, стеблей – 5.12%, корней – 4.92%.
Аскорбиновая кислота. Количественное определение содержания аскорбиновой кислоты проводили методом окислительно-восстановительного титрования. В качестве титранта использовали 2,6-дихлорфенолиндофенолят натрия. В точке эквивалентности наблюдали изменение окраски раствора в розовый цвет за счет восстановления 2,6-дихлорфенолиндофенолята натрия в кислой среде. Результаты определения количества аскорбиновой кислоты представлены в табл. 2.
Таблица 2.
Результаты определения аскорбиновой кислоты в сырье гортензии древовидной
| Сырье | n | f | Х | Хср | Sx | P, % | t(P,ƒ) | ΔХ | ε, % |
|---|---|---|---|---|---|---|---|---|---|
| Листья | 1 | 2 | 0.272 | 0.28 | 0.0034 | 95 | 4.30 | 0.0147 | 5.33 |
| 2 | 0.299 | ||||||||
| 3 | 0.258 | ||||||||
| Стебли | 1 | 2 | 0.233 | 0.24 | 0.0032 | 95 | 4.30 | 0.014 | 5.85 |
| 2 | 0.240 | ||||||||
| 3 | 0.247 | ||||||||
| Корни | 1 | 2 | 0.210 | 0.20 | 0.0032 | 95 | 4.30 | 0.013 | 6.84 |
| 2 | 0.196 | ||||||||
| 3 | 0.205 |
Анализируя полученные результаты, можно отметить, что наибольшее содержание аскорбиновой кислоты наблюдали в листьях – 0.28 ± 0.014%, наименьшее в корнях – 0.20 ± 0.014%.
Количественное определение аскорбиновой кислоты в сырье гортензии древовидной показало, что при трех независимых выборках ошибка среднего результата приблизительно одинакова и не превышает 5.33% в листьях, 5.85% в стеблях и 6.84% в корнях.
Дубильные вещества. Определение содержания дубильных веществ проводили титриметрическим методом окислительно-восстановительного титрования раствором калия перманганата (0.02 моль/л) в присутствии индикатора индигосульфокислоты до золотисто-желтого окрашивания. Результаты определения представлены в табл. 3.
Таблица 3.
Результаты определения дубильных веществ в сырье гортензии древовидной
| Сырье | n | f | Х | Хср | Sx | P, % | t(P,ƒ) | ΔХ | ε, % |
|---|---|---|---|---|---|---|---|---|---|
| Листья | 1 | 2 | 7.578 | 7.13 | 0.1486 | 95 | 4.30 | 0.639 | 8.96 |
| 2 | 7.132 | ||||||||
| 3 | 6.988 | ||||||||
| Стебли | 1 | 2 | 3.106 | 2.66 | 0.0503 | 95 | 4.30 | 0.216 | 8.13 |
| 2 | 2.662 | ||||||||
| 3 | 2.319 | ||||||||
| Корни | 1 | 2 | 0.220 | 0.50 | 0.0111 | 95 | 4.30 | 0.048 | 9.63 |
| 2 | 0.650 | ||||||||
| 3 | 0.421 |
Проведенный анализ показал, что наибольшее содержание дубильных веществ наблюдается в листьях 7.13 ± 0.639%, наименьшее в корнях – 0.50 ± 0.048%.
Метрологическая характеристика методики количественного определения дубильных веществ в сырье гортензии древовидной показала, что при трех независимых выборках ошибка среднего результата листьев не превышает 8.96%, стеблей – 8.13%, корней – 9.63%.
Флавоноиды. Проведенные предварительно хроматографические и денситометрические методы исследования показали, что корни и стебли не содержат флавоноидов, поэтому количественное определение данной группы биологически активных веществ проводили только в листьях. Для количественного определения флавоноидов в листьях гортензии древовидной использовали метод, основанный на образовании комплекса флавоноидов со спиртовым раствором алюминия хлорида(III) и наличием характерных максимумов поглощения. При измерении оптической плотности исследуемого раствора в области 410 нм наблюдался максимум поглощения, который совпадал с максимумом поглощения стандартного образца раствора рутина с алюминия хлоридом (рис. 9). Результаты определения представлены в табл. 4. Содержание суммы флавоноидов в пересчете на рутин составило 1.14 ± 0.048%. Как указывалось выше, в литературе есть данные по определению суммы флавоноидов в пересчете на рутин в лекарственном препарате – гранулах с жидким экстрактом гортензии древовидной (Манджиголадзе, Кузнецова, 2021). Там эта сумма составила 0. 0225%.
Рис. 9.
Дифференциальные спектры спиртовых извлечений из листьев гортензии древовидной (1) и СО рутина (2) λmax = 410 нм.
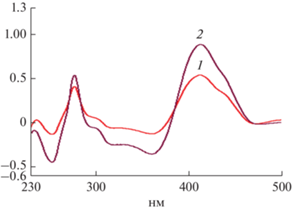
Таблица 4.
Результаты определения суммы флавоноидов в пересчете на рутин в листьях гортензии древовидной
| Сырье | n | f | Х | Хср | Sx | P, % | t(P,ƒ) | ΔХ | ε, % |
|---|---|---|---|---|---|---|---|---|---|
| Листья | 1 | 2 | 1.102 | 1.14 | 0.0113 | 95 | 4.30 | 0.048 | 4.31 |
| 2 | 1.119 | ||||||||
| 3 | 1.115 |
Метрологическая характеристика методики количественного определения флавоноидов в листьях гортензии древовидной показала, что при трех независимых выборках ошибка среднего результата листьев не превышает 4.31%.
ЗАКЛЮЧЕНИЕ
При анатомическом изучении листа, стебля и корня гортензии древовидной выявлены диагностически значимые признаки, позволяющие отличать данный вид гортензии от других, а именно: для верхней стороны листовой пластинки гортензии древовидной характерны многоугольные утолщенные клетки эпидермиса, для нижней стороны листа – извилисто-стенный эпидермис, аномоцитный тип устьичного аппарата, простые волоски с грубо бородавчатой поверхностью и многоклеточным основанием, простые извилистые волоски, а также как с верхней, так и с нижней стороны листа – наличие включений оксалата кальция в виде игольчатых кристаллов-рафидов. В анатомическом строении стебля и корня у данного вида нет особенностей, структура их имеет черты, характерные для древесных растений.
Фитохимическое изучение листа, стебля и корня гортензии древовидной позволило установить присутствие кумаринов, аскорбиновой кислоты, дубильных веществ, а в листьях ‒ флавоноидов. Наибольшее содержание аскорбиновой кислоты (0.28 ± 0.014%), дубильных веществ (7.13 ± 0.639%) наблюдается в листьях гортензии древовидной, а содержание кумаринов в пересчете на умбеллиферон в корнях ‒ 0.41 ± 0.007%. Содержание рутина в листьях гортензии древовидной составило 1.14 ± 0.048%.
Список литературы
Ахметова Л.Р., Молканова О.И. Особенности клонального микроразмножения представителей Hydrangea macrophylla Thunb // Научный альманах. 2019. № 1–3(51). С. 119‒122.
Ахметова Л.Р., Пирогова К.И. Особенности размножения коллекции гортензии РГАУ-МСХА им. К.А. Тимирязева // Вестник ландшафтной архитектуры. 2016. С. 6–10.
Бойко В.И. Внутренняя структура однолетнего стебля гортензии крупнолистной // Актуальные проблемы лесного комплекса: сб. науч. трудов / Под общ. ред. Е.А. Памфилова. Брянск: БГИТУ, 2020. Вып. 56. С. 107–110.
Государственная фармакопея. Издание XIV. Том II. Методы анализа растительного лекарственного сырья. Техника микроскопического и микрохимического исследования лекарственного растительного сырья и лекарственных растительных препаратов. http://resource.rucml.ru/feml/pharmacopia/14_2/HTML/516/index.html#zoom=z.
Карпун Ю.Н. Декоративная дендрология Северного Кавказа. С-Пб: БИН, 2005. 391с.
Кокшеева И.М., Нехайченко Д.В. Модульная структура соцветий двух видов рода Hydrangea L // Изв. РАН. Серия биол. 2021. № 1. С. 44‒54.
Коркуленко О.М. Біоекологічні особливостi видiв роду Hydrangea L. та перспективи їх використання в озелененні м. Києва: автореф. дис. … канд. с.-г. наук. Київ. 2012. 22 с.
Мазуренко М.Т., Хохряков А.П. Структура и морфогенез кустарников. М.: Наука, 1977. 159 с.
Малюгин И.Е. Интродукция гортензии в Донбассе // Растительные ресурсы. 1981. Т. 17. Вып. 2. С. 263‒266.
Маляровская В.И. Изменчивость морфо-анатомических признаков листьев Hydrangea macrophylla в зависимости от условий местообитания // Субтропическое и декоративное садоводство. 2011б. № 45. С. 225‒229.
Маляровская В.И. Историко-систематический обзор представителей рода Hydrangea // Вестник ИрГСХА. 2011а. № 44-8. С. 75‒79.
Манджиголадзе Т.Ю., Романцова Н.А., Арчинова Т.Ю., Елисеева Л.М., Щукина А.Н. Морфолого-анатомический и фитохимический анализ гортензии древовидной травы // Актуальные вопросы современной фармацевтической технологии. Матер. всеросс. науч.-практ. конф. с междун. участием, посвященной памяти выдающегося ученого, засл. деят. науки РСФСР, д. ф. н., проф. И.А. Муравьева. 2016. С. 74–81.
Манджиголадзе Т.Ю., Арчинова Т.Ю., Кузнецова Л.С., Кузнецов В.А. Исследования по разработке ресурсосберегающей технологии гортензии древовидной травы экстракта жидкого // Журн. науч. ст. Здоровье и образование в XXI в. 2019. Т. 21. № 2. С. 21–24.
Манджиголадзе Т.Ю., Кузнецова Л.С. Разработка состава, технологии и анализ гранул с гортензии древовидной экстрактом жидким // Медико-фармацевтический журн. “Пульс”. 2021.Т. 23. № 1. С. 28–33.
Мартынов Л.Г. Интродукция гортензии метельчатой формы крупноцветковой (Hydrangea paniculata f. Grandiflora Siebold) в Республике Коми // Вестник Института Биологии Коми научного центра Уральского отделения РАН. 2009. № 2. С. 11‒14.
Мурзабулатова Ф.К., Полякова Н. В., Жигунов О.Ю. Интегральная оценка перспективности интродукции гортензий в Башкирском Предуралье. // Аграрная Россия. 2018. № 8. С.12‒15.
Мурзабулатова Ф.К., Шигапов З.Х., Полякова Н.В. Начальные этапы онтогенеза представителей рода Hydrangea L. в условиях культуры // Онтогенез. 2021. Т. 52. № 2. С. 137‒145.
Нехайченко Д.В., Кокшеева И.М., Кислов Д.Е. Изменчивость эпидермальных структур листа Hydrangea paniculata (Hydrangeaceae) в условиях культуры // Вестник КрасГАУ. 2014. № 12. С. 52‒57.
Пилипенко Ф.С. Род 5. Гортензия – Hydrangea L. // Деревья и кустарники СССР. М.–Л., 1954. Т. 3. С. 162‒172.
Путенихин В.П. Дендрология с основами декоративного садоводства: Ч. 2. Учебное пособие. Уфа: РИЦ БашГУ, 2007. 242 с.
Растительные ресурсы СССР: Цветковые растения, их химический состав, использование; Семейства Hydrangeaceae ‒ Haloragaceae. Л.: Наука, 1987. 326 с.
Русанов Ф.Н. Деревья и кустарники Ботанического сада Академии Наук Узбекской ССР. Североамериканские деревья и кустарники. Ч 1. Ташкент: Изд. Акад. Наук УзССР, 1955. С. 33–34.
Сааков С.Г. Гортензии. Перово: Изд-во Мин. ком. хоз. РСФСР, 1959. 20 с.
Тахтаджян А.Л. Система магнолиофитов. Л.: Наука, 1987. 439 с.
Цырендоржиева О.Ж. Анатомия стебля лиан Сахалина и Курил: автореферат диссертации на соискание ученой степени кандидата биологических наук / Бурятский государственный университет. Улан-Удэ, 2006.
Burkett G.W. Anatomical studies within the genus Hydrangea // Proc. Ind. Acad. Sci. 1931. V. 41. P. 83‒96.
Conolly N.B., Bassuk N.L., MacRae Jr.P.F. Regponse of five Hydrangea species to foliar salt spray // J. Environ. Hortic. 2010. V. 28. № 3. P. 125‒128.
Lancaster N., Wesley W. Hydrangea paniculate // RHS Plant Trials Bulletin. 2008. V. 2. P. 2‒15.
McClintock E. Hydrangeas // The National Horticultural Magazine. 1957. V. 36. № 3. P. 270‒280.
Reed S.M., Rinehart T.A. Simple-sequence repeat marker analysis of genetic relationships within Hydrangea paniculate // HortScience. 209. V. 44. № 1. P. 27‒31.
Rehder A. Manual of cultivated trees and shrubs. 1940. MacMillan Pub Co. Reprint of 2nd Revised edition. P. 285‒291. MacMillan Pub Co; 2nd Revised edition
Solreder H. Systematics Anatomy of the Dicotyledons. The Clarendon Press. 1908. Oxford. London. P. 58‒67.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


