Известия РАН. Серия биологическая, 2023, № 3, стр. 258-268
Эктопаразитические клещи – переносчики бактериальных симбионтов среди насекомых
Е. В. Шайкевич 1, *, А. А. Горбачева 1, Д. А. Романов 1
1 Федеральное государственное бюджетное учреждение науки Институт общей генетики им. Н.И. Вавилова Российской академии наук
119333 Москва, ул. Губкина, 3, Россия
* E-mail: elenashaikevich@mail.ru
Поступила в редакцию 11.05.2022
После доработки 05.10.2022
Принята к публикации 05.10.2022
- EDN: MUQTVC
- DOI: 10.31857/S1026347023700142
Аннотация
Передающиеся по наследству эндосимбиотические бактерии из родов Rickettsia, Wolbachia и Spiroplasma вызывают гибель потомства мужского пола у божьих коровок (Coleoptera, Coccinellidae). Как правило, бактерии передаются через цитоплазму материнской яйцеклетки потомству – по вертикали. В дополнение к вертикальной передаче, появляется все больше данных о горизонтальном переносе симбионтов между неродственными таксонами насекомых. Потенциальными переносчиками эндосимбиотических бактерий могут быть паразиты насекомых, например, клещи. Паразитический клещ божьих коровок Coccipolipus hippodamiae (McDaniel & Morrill, 1969) (Acarina: Podapolipidae) встречается в природных популяциях Coccinellidae. В данной работе впервые доказана способность C. hippodamiae заражаться Wolbachia и Spiroplasma от хозяев и распространять бактерий среди жуков-кокцинеллид.
Передающиеся по наследству эндосимбиотические бактерии повсеместно распространены в природных популяциях беспозвоночных. Для внутриклеточных бактериальных симбионтов насекомых характерен широкий спектр взаимодействий с хозяином, позволяющих оказывать влияние на экологию, эволюцию и репродуктивную биологию последних. Их исключительной особенностью является способность вызывать у своих хозяев ряд репродуктивных аномалий (цитоплазматическую несовместимость, андроцид, феминизацию или партеногенез), повышающих долю зараженных самок в популяции и, соответственно, эффективность своей вертикальной передачи и распространения в популяции (Werren et al., 1995).
У божьих коровок (Coleoptera, Coccinellidae) в России встречаются три наследуемых симбионта из родов Rickettsia, Wolbachia и Spiroplasma, вызывающие гибель потомства мужского пола – андроцид (Shaikevich, Zakharov 2015; Горячева и др., 2015; Goryacheva et al., 2018; Шайкевич и др., 2019). Частота встречаемости и географическое распределение симбионтов не одинаковы у разных видов. Для Adalia decempunctata характерно заражение Rickettsia (Шайкевич и др., 2019). У Harmonia axyridis обнаружены Wolbachia, Rickettsia и Spiroplasma (Горячева и др., 2015; Goryacheva et al., 2017, 2018; Li et al., 2021). В популяции Adalia bipunctata в России наблюдалось географическое распределение симбиотических бактерий: в Санкт-Петербурге встречались Rickettsia и Spiroplasma в 1999 г. (Schulenburg et al., 2002) и исключительно Spiroplasma в 2009 (Захаров, Шайкевич, 2011), а в Карелии и в Бурятии были обнаружены только Rickettsia (Шайкевич и др., 2012). У божьих коровок A. bipunctata в одной популяции в Москве в 2019-2020 выявлено заражение как минимум тремя штаммами Wolbachia, wAbi-1, wAbi-2 и wAbi-3 (Shaikevich et al., 2021), два из которых не были обнаружены в популяции в 1999 (Schulenburg et al., 2002). Долгосрочные наблюдения показывают, что состав симбионтов в популяциях божьих коровок может меняться во времени из-за потерь одних бактерий и приобретения других.
Внутриклеточные симбиотические бактерии инфицируют клетки зародышевой линии хозяина и передаются через цитоплазму яйцеклетки, т.е. трансовариально от матери потомству – по вертикали. В дополнение к вертикальной передаче, появляется все больше данных о горизонтальном переносе симбионтов между неродственными таксонами насекомых. Известны случаи заражения насекомых бактерией в результате прямых и косвенных контактов (как следствие обитания в одной среде, контакта между хищником и жертвой, или через общий источник пищи) (цит. по Pietri et al., 2016). На возможность горизонтальной передачи в природе также указывают филогенетические данные (O’Neill et al., 1992; Baldo et al., 2008; Gerth et al., 2013; Ahmed et al., 2016; Ilinsky, Kosterin, 2017 и др.).
Потенциальными переносчиками эндосимбиотических бактерий могут быть паразиты насекомых, например, клещи. Было показано, что эктопаразитические клещи Macrocheles subbadius после питания гемолимфой Drosophila nebulosa, инфицированных Spiroplasma, способны передавать инфекцию Drosophila willistoni (Jaenike et al. 2007). У пойманных в природе Drosophila hydei были обнаружены клещи Macrocheles sp., инфицированные Spiroplasma, идентичной симбионту хозяина (Osaka et al., 2013). Совершенно другой механизм обнаружен в основе переноса Wolbachia между лабораторными популяциями дрозофилы через Tyrophagus putrescentiae: эти клещи поедают трупы дрозофилы, в том числе трупы, инфицированные Wolbachia, а личинки дрозофилы поедают клещей и таким образом инфицируются Wolbachia (Brown, Lloyd, 2015).
Паразитический клещ божьих коровок Coccipolipus hippodamiae (McDaniel & Morrill, 1969) (Acarina: Podapolipidae) встречается в природных популяциях Coccinellidae (Coleoptera), в которых он может достигать высокой численности (Webberley et al., 2004). C. hippodamiae был обнаружен у разных видов кокцинеллид: A. bipunctata, A. decempunctata, Oenopia conglobata, Calvia quatuordecimguttata, Coccinella magnifica, Harmonia quadripunctata, Haxyridis, Hippodamia convergens, Exochomus fulvimanus, Exochomus concavus (Knell, Webberley, 2004; Webberley et al., 2004; Rhule et al., 2010; Ceryngier et al., 2012). Некоторые виды божьих коровок, видимо, не заражаются клещом C. hippodamiae: Exochomus quadripustulatus, Coccinula quatuordecimpustulata, Propylea quatuordecimpunctata, Coccinella septempunctata (Webberley et al., 2004). На C. septempunctata паразитирует другой клещ – Coccipolipus macfarlanei (Эйдельберг, 1994; Захаров, Эйдельберг, 1997; Knell, Webberley, 2004). В Европе наибольшая инфицированность клещом C. hippodamiae (до 69.5%) наблюдалась у A. bipunctata, что позволяло считать этот вид коровок его основным хозяином (Webberley et al., 2004). Однако ареал C. hippodamiae не совпадает с ареалом A. bipunctata (Захаров, Эйдельберг, 1997; Webberley et al., 2006).
C. hippodamiae – эктопаразит, обитающий на нижней стороне надкрылий кокцинеллид и передающийся преимущественно при копуляции, а также в плотных скоплениях жуков, готовящихся к диапаузе (Webberley, Hurst, 2002). Взрослые самки клещей ведут неподвижный образ жизни: прикрепляются к надкрыльям, поглощают гемолимфу хозяина и откладывают яйца, из которых выходят подвижные полупрозрачные беловатые личинки. Во время копуляции жуков личинки клещей мигрируют под надкрылья нового хозяина, где молодые самки начинают питаться гемолимфой и претерпевают метаморфоз, превращаясь в имаго. После этого взрослые самки перестают двигаться, со временем увеличиваются в размерах, приобретают желто-оранжевый цвет и начинают откладывать яйца. Оплодотворение самок клещей происходит на стадии нимфы (Ceryngier et al., 2012). Распространение C. hippodamiae зависит, по большей части, от двух факторов: от выраженности промискуитета хозяев, способствующего передаче паразита между особями, и от продолжительности сосуществования разных поколений хозяев в периоды непрерывного размножения, т.к. это обеспечивает передачу C. hippodamiae между поколениями жуков (Webberley et al., 2004). Распространение клещей между кокцинеллидами разных видов было обнаружено в природе в местах, где по крайней мере один вид кокцинеллид был заражен C. hippodamiae (Webberley et al., 2004). В лабораторных экспериментах C. hippodamiae успешно размножались на незараженном прежде хозяине после полового контакта особей гетероспецифичных пар (Rhule et al., 2010). Клещи способны адаптироваться к разным видам и родам божьих коровок, в экспериментах не наблюдалось существенной разницы во времени, необходимом для успешного размножения клещей на H. axyridis и на A. bipunctata (Rhule et al., 2010).
Цель работы: исследовать, могут ли C. hippodamiae осуществлять горизонтальную передачу симбионтов между кокцинеллидами. Мы предположили, что клещ C. hippodamiae может приобретать симбионтов, поглощая гемолимфу инфицированного хозяина, и передавать бактерию потомству. Молодые нимфы таких клещей переползают под надкрылья новых хозяев и, приступив к питанию гемолимфой, могут заражать ранее неинфицированных жуков бактерией.
МАТЕРИАЛЫ И МЕТОДЫ
Имаго божьих коровок (A. bipunctata и H. axyridis) собирали в 2019–2021 гг. путем визуального обследования кустарниковой и древесной растительности (в теплое время года) или стен зданий (осенью), на которых могут быть найдены жуки, готовящиеся к диапаузе. Коровки A. decempunctata, использованные для эксперимента, были выведены из куколок, собранных в природе ранее (Романов, Матвейкина, 2021). Собранным жукам присваивали индивидуальные названия, в которых указывалось место сбора (М – город Москва) и порядковый номер собранного жука. В названиях коровок, относящиеся к видам A. decempunctata и H. axyridis, их видовая принадлежность указывалась строчными латинскими буквами “d” и “a” после порядкового номера (например, М84d и M150a, соответственно). Жуки, собранные в природе и использовавшиеся для получения лабораторных линий, отмечались прописной латинской буквой P (от слова “parenta” – родители). Их потомки отмечались прописной латинской буквой F (от слова “filii” – дети) с указанием номера поколения.
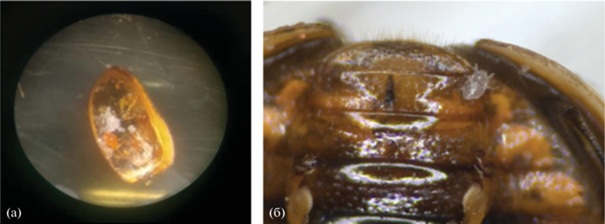
Взрослые самки клеща C. hippodamiae располагаются на внутренней стороне надкрылий божьих коровок (рис. 1а), поэтому их сбор с живого жука затруднен. Нимфы и, возможно, взрослые самцы клещей подвижны, эти формы отмечались нами на поверхности элитр зараженных жуков (рис. 1б). Поэтому мы предполагали, что нимфы клещей будут переползать с зараженных клещами особей божьих коровок на других жуков не только при копуляции (наиболее распространенный естественный тип передачи клещей), но и при совместном содержании. Это предположение подтвердилось, так как в нескольких чашках Петри, где находились исключительно самки божьих коровок, было отмечено заражение клещами подсаженных жуков. Заражение клещами диагностировалось визуально с помощью бинокулярного микроскопа МБС-10 по наличию на элитрах божьих коровок подвижных форм клещей и характеру откладываемых самками кокцинеллид яиц (у зараженных клещами самок божьих коровок яйца сморщиваются через несколько часов после откладывания; эффект начинает проявляться примерно через 3 нед. после заражения). В ряде случаев для проверки успешности заражения клещами божьих коровок усыпляли с помощью диэтилового эфира, под микроскопом аккуратно отгибали элитры и смотрели наличие клещей. Количество жуков, содержащихся в чашке Петри, зависело от ее диаметра: в чашках Петри диаметром 4 см находилось по 3–4 жука, в чашках Петри диаметром 8 см находилось по 6–8 жуков. Таким образом мы имитировали экологическую ситуацию в природе, где божьи коровки заражаются клещами при копуляции или в плотных скоплениях зимующих жуков. После смерти жука с надкрылий снимали индивидуальных клещей и выделяли ДНК из жука и из клещей (индивидуально и из групп по 2–8 клещей) для поиска симбионтов у хозяина и паразита методом ПЦР.
Рис. 1.
а: взрослая самка клеща Coccipolipus hippodamiae (желтый) и ее яйца (белые) в надкрылье божьей коровки Adalia bipunctata; б: подвижная нимфа (личинка) клеща.
Выделение тотальной ДНК из индивидуальных особей клещей и их хозяев-кокцинеллид проводили с помощью набора DNA Prep (Изоген, Москва). Реакцию амплификации с каждым препаратом ДНК проводили в объеме 25 мкл с использованием универсального набора Encyclo Plus PCR kit (Евроген, Москва) в соответствии с протоколом фирмы-производителя. Все реакции выполнялись на амплификаторе MiniAmp Plus (компания Applied Biosystems, США). Для амплификации участка гена cox1 применялись универсальные праймеры: LCO1490 и HCO2198 (Folmer et al., 1994); условия амплификации: начальная денатурация – 4 мин 30 с при 94°C; затем 5 циклов: денатурация – 30 с при 94°C, отжиг – 20 с при 45°C и полимеризация – 1 мин при 72°C; затем 35 циклов: денатурация – 30 с при 94°C, отжиг – 20 с при 55°C и полимеризация – 1 мин при 72°C. ПЦР завершалась заключительной полимеризацией в течение 5 мин 72°C. Амплификация специфического фрагмента гена cox1 жуков проводилась c праймерами C1-jF 5'-GCTGGAATTTCATCAATTTTAGG-3' и C1-nR 5'-GGA-AATCAATGAATAAATCCTGCT-3'. Условия ПЦР: первичная денатурация – 5 мин при 94°С; 38 циклов с использованием Encyclo полимеразы: денатурация при 94°С – 30 с, отжиг при 59°С – 30 с, синтез при 72°С – 60 с; завершающий синтез при 72°С – 5 мин.
Зараженность клещей и божьих коровок Wolbachia проверяли методом ПЦР согласно методике MLST анализа (http://pubmlst.org/wolbachia). Для проверки зараженности клещей бактериями Spiroplasma использовались праймеры Sp_ApDnaA_F1 5'-ATTCTTCAGTAAAAATGCTTGGA-3' и Sp_ApDnaA_R1 5'-ACACATTTACTTCATGCTATTGA-3'; для Rickettsia RicF141 5'-TCGGTT-CTCTTTCGGCATTTTA-3' и RicR548 5'-GCATAT-TTATCACCGCTTCATT-3'. Условия амплификации: начальная денатурация – 4 мин 30 с при 94°C; затем 35 циклов: денатурация – 25 с при 94°C, отжиг – 20 с при 58°C и полимеризация – 35 с при 72°C. ПЦР завершалась заключительной полимеризацией в течение 5 мин 72°C. Анализ результатов ПЦР осуществляли методом электрофореза в 1.5% агарозном геле. Фрагменты амплификации генов cox1 мтДНК и локусов Wolbachia и Spiroplasma секвенировали.
Хроматограммы нуклеотидных последовательностей анализировались с помощью комплекта программ DNASTAR Lasergene 6 (https:// www.dnastar.com/software/lasergene/seqman). Для идентификации видов насекомых посредством сравнения полученных нами последовательностей с уже известными использовались международные базы данных Barcode of Life Database (BOLD) и GenBank. Локусы Wolbachia сравнивали в базе http://pubmlst.org/wolbachia. Вновь полученные последовательности гена dnaA Spiroplasma из A. bipunctata и C. hippodamiae зарегистрированы в GenBank под номерами ON382044 и ON382045, соответственно. Филогенетическая дендрограмма построена в программе MEGA V. 6 с использованием метода Maximum Likelihood, модели Tamura-Nei и бутстреп-поддержки 1000 реплик (Tamura et al., 2013).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Заражение коровок клещами C. hippodamiae в природе и эффект клещей на плодовитость хозяев
Сборы имаго A. bipunctata представлены в табл. 1. Зараженность популяций A. bipunctata клещами зависит от времени и локализации, варьируя от 10.2% до 76.2% (табл. 1). Сборы имаго H. axyridis производились только в августе 2020 г. в Москве (55°41′19′′ с.ш., 37°51′32′′ в.д.), когда было собрано 112 имаго, зараженных клещами среди них не было.
Таблица 1.
Сборы клещей, паразитирующих на A. bipunctata, в Москве в 2019–2021 гг.
| Время сбора (месяц, год) | Место сбора | Собрано жуков | Зараженность клещами (%) | |
|---|---|---|---|---|
| всего | с клещами | |||
| 10.2019 | 55°42′37′′ с.ш., 37°34′37′′ в.д. | 35 | 12 | 34.3 |
| 06.2020 | 55°41′37′′ с.ш., 37°34′14′′ в.д. | 21 | 10 | 47.6 |
| 06.2020 | 55°42′54′′ с.ш., 37°36′45′′ в.д. | 42 | 32 | 76.2 |
| 05.2021 | 55°41′38′′ с.ш., 37°34′05′′ в.д. | 44 | 5 | 11.4 |
| 05.2021 | 55°41′28′′ с.ш., 37°51′01′′ в.д. | 49 | 5 | 10.2 |
| Всего | 191 | 64 | 33.5 | |
Для изучения влияния клещей на вылупляемость личинок A. bipunctata из яиц было проведено сравнение между двумя самками, заразившимися клещами примерно в одно и то же время (табл. 2). Первая M7(P)♀ не инфицирована симбиотической бактерией, вторая M14(P)♀ заражена Wolbachia. В потомстве последней наблюдалось вылупление половины яиц в течение первой недели, что соответствует проявлению андроцида, вызванного Wolbachia. В потомстве незараженной симбионтом самки первые 9 дней клещи не оказывали никакого эффекта на вылупляемость личинок и внешний вид хориона яиц. Примерно на 11–12 день заражения произошло резкое увеличение числа недоразвитых яиц у обеих самок, после чего самки коровок стали полностью стерильными. Через неделю после проявления стерильности у самок, откладываемые ими яйца начинают сморщиваться.
Таблица 2.
Влияние клещей на вылупляемость личинок коровок из яиц
| Линия божьих коровок | Дата | Число яиц | Число личинок |
|
|---|---|---|---|---|
| отложенных | неразвившихся | |||
| M7(P)♀W– заражение клещами было 06.06.2020 |
10.06 | 39 | 2 | 37 |
| 12.06 | 9 | 4 | 5 | |
| 13.06 | 34 | 1 | 33 | |
| 14.06 | 26 | 2 | 24 | |
| 16.06 | 3 | 0 | 3 | |
| 17.06 | 5 | 1 | 4 | |
| 18.06 | 29 | 20 | 9 | |
| 20.06 | 19 | 19 | 0 | |
| 24.06 | 21 | 21* | 0 | |
| M14(P)♀W+ заражение клещами было 07.06.2020 |
12.06 | 9 | 4 | 5 |
| 13.06 | 30 | 13 | 17 | |
| 14.06 | 21 | 16 | 5 | |
| 16.06 | 4 | 2 | 2 | |
| 17.06 | 16 | 9 | 7 | |
| 18.06 | 23 | 20 | 3 | |
| 19.06 | 23 | 23 | 0 | |
| 20.06 | 19 | 19 | 0 | |
| 21.06 | 9 | 9 | 0 | |
| 24.06 | 3 | 3* | 0 | |
Заражение клещей (взрослых самок) и жуков бактериальными симбионтами в сборах из природы
Мы выделяли ДНК из самок клещей C. hippodamiae (рис. 1а), снятых из-под надкрылий жуков и из самих 12 жуков A. bipunctata, которые были собраны в природе в 2019 (табл. 1). Wolbachia была обнаружена с помощью ПЦР с праймерами для гена ftsZ бактерии у пары A. bipunctata и C. hippodamiae (образец М3). Позже, шесть генов Wolbachia из клеща и жука были секвенированы, последовательности всех генов (gatB MZ056866, coxA MZ056869, hcpA MZ056871, fbpA MZ056874, ftsZ-95 и wsp-392) идентичны у клеща и коровки и соответствуют штамму wAbi-1 (рис. 2). В 2020 не было обнаружено C. hippodamiae, зараженных симбионтами. В 2021 две самки C. hippodamiae были заражены Wolbachia; причем в случае A. bipunctata М109 заражены и клещ, и коровка, а в случае A. bipunctata М90 – только клещ. Были заложены семь линий C. hippodamiae: две линии клещей, инфицированных Wolbachia, и пять линий, незараженных симбиотическими бактериями (табл. 3). Spiroplasma или Rickettsia у C. hippodamiae из природы не обнаружены.
Рис. 2.
Дендрограмма сходства на основе сравнения соединенной последовательности генов coxA-ftsZ Wolbachia и гена dnaA Spiroplasma. Обозначены хозяева симбионтов – жуки или клещи, гены бактерий и штаммы Wolbachia (справа). При обозначении клещей в скобках указаны коровки, с которых они были сняты: например, C.h.52 снят с коровки линии (М88).
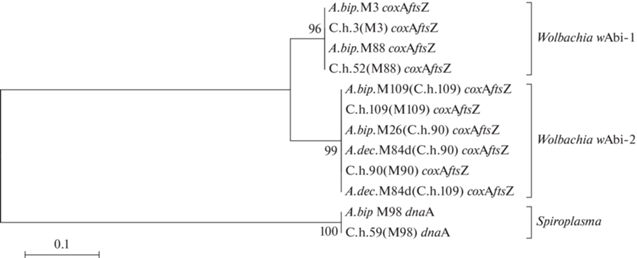
Таблица 3.
Эксперимент по переносу симбионтов через укусы клещей
| Реципиент симбионта | Донор симбионта из природы | |||
|---|---|---|---|---|
| жуки | Клещи (жук-хозяин) | |||
| M88 W+ (C.h.–) | M98 S+ (C.h.–) | C.h.109 W+ (M109W+) | C.h.90 W+(M90W–) | |
| Клещи (жук-хозяин) | ||||
| C.h.52 W– (M52 W–) | W+ | |||
| C.h.68 W– (M68 W–) | W– | |||
| C.h.59 S– (M59 S–) | S+ | |||
| C.h.85 S– (M85 S–) | S– | |||
| C.h.99 S– (M99 S–) | S– | |||
| Жуки | ||||
| M84d(F1-3) W– (C.h.–) | W+ | |||
| M70 W– (C.h.–) | W– | |||
| M26(F1-4) W– (C.h.–) | W+ | |||
| M26(F1-6) W– (C.h.–) | W– | |||
| M84d(F1-8) W– (C.h.–) | W+ | |||
| M84d(F1-9) W– (C.h.–) | W– | |||
| M19(F1-7) W– (C.h.–) | W– | |||
| M116(F1-4)♀ W– (C.h.–) | W– | |||
Среди жуков из сборов 2021, в потомстве одной особи A. bipunctata М98 обнаружена Spiroplasma и заложена лабораторная линия жуков, инфицированных Spiroplasma. Также линия A. bipunctata М88, инфицированных Wolbachia, поддерживается в лаборатории от найденной в природе. Симбионты стабильно сохраняются в поколениях жуков в лаборатории в 2021–2022 гг., и получены жуки 3‑го поколения в линиях М88 (с вольбахией) и М98 (со спироплазмой). Зараженность симбионтами проверяли с помощью ПЦР с праймерами к ftsZ и coxA генам Wolbachia и dnaA гена Spiroplasma.
Для проведения экспериментов в 2021 г. были заложены и поддерживались 8 линий божьих коровок: 1 линия A. decempunctata (М84d), 1 линия H. axyridis (М150а), 6 линий A. bipunctata – М88 (источник вольбахии), М98 (источник спироплазмы) и М19, М26, М69, М116 (свободные от бактерий). В экспериментах также использовали 18 жуков, собранных в природе, которые не были выведены в линии (Приложение 1 ).
Для изучения способности клещей C. hippodamiae заражать разные виды божьих коровок был поставлен следующий эксперимент: к божьим коровкам A. bipunctata, инфицированным клещами, были подсажены незараженные коровки A. decempunctata и H. axyridis. Для изучения возможности заражения клещей C. hippodamiae бактерией Wolbachia или Spiroplasma в лабораторных условиях мы спланировали следующий эксперимент: в чашки Петри к жукам A. bipunctata, зараженным бактериальным симбионтом, но без клещей, были подсажены имаго A. bipunctata, инфицированные клещами. Для изучения способности клещей C. hippodamiae распространять бактериальных симбионтов среди божьих коровок был выполнен следующий эксперимент: к божьим коровкам A. bipunctata, инфицированным зараженными симбионтами клещами, были подсажены незараженные коровки A. bipunctata, A. decempunctata и H. axyridis.
Экспериментальное доказательство заражения клещей симбионтами от коровок
Для доказательства инфицирования клещей C. hippodamiae (C.h.) бактериями непосредственно от жуков-хозяев в чашки Петри к жукам A. bipunctata 1) из линии М88W+ (без клещей, но источник Wolbachia), 2) линии M98S+ (без клещей, но источник Spiroplasma) были подсажены имаго A. bipunctata, инфицированные клещами C. hippodamiae (C.h.+). В эти же чашки подсаживались жуки A. decempunctata и H. axyridis без клещей (C.h.–). Заражение жуков клещами диагностировалось по наличию подвижных форм C. hippodamiae на поверхности элитр хозяина; все виды кокцинеллид заражались клещами C. hippodamiae. Заражение симбионтом проверяли методом ПЦР после смерти жука. Для проверки контаминации образцов ДНК клещей при выделении ДНК от хозяев-жуков мы ставили ПЦР с праймерами C1-jF и C1-nR, специфичными к ДНК только божьих коровок. В случае положительных сигналов с ДНК клещей, такой образец исключался из анализа. В результате мы получили доказательства, что клещи заразились Wolbachia и Spiroplasma (табл. 3). После анализа последовательностей генов coxA, ftsZ бактерии Wolbachia показано, что C.h.52 W+ и донор М88 W+ инфицированы штаммом wAbi-1 (рис. 2). Идентичные последовательности гена dnaA Spiroplasma получены для C.h.59 S+ и донора М98S+ (рис. 2).
Вновь инфицированные симбионтами клещи C.h.52 W+ и C.h.59 S+ сохраняли симбионтов при заражении ими других божьих коровок (М69, М151а и М47, М150а, М162а, соответственно) через подвижных нимф, что доказывает наследуемость приобретенных инфекций Wolbachia и Spiroplasma в клещах. Заражения симбионтами коровок М69, М151а от C.h.52 W+ и жуков М47, М150а, М162а от C.h.59 S+ не произошло. В линии клещей C.h.59 Spiroplasma передавалась на протяжении 3 поколений клещей, а в линии C.h.109 Wolbachia передавалась на протяжении 4 поколений клещей (Приложение 1 ). Число поколений клещей определяли по времени жизни жуков, зараженных клещами, сопоставляя его с датами подсаживания новых жуков. Так как взрослые самки клещей ведут неподвижный образ жизни, перебраться на нового жука могут только их потомки.
Экспериментальное доказательство заражения коровок через клещей
Для проверки способности клещей быть переносчиком симбиотических бактерий в чашки с 3) A. bipunctata M109W+, Ch109W+ (зараженной одновременно клещами C.h.109 и Wolbachia), 4) A. bipunctata М90W–, C.h.90W+ были подсажены жуки без симбионтов и клещей. Результаты, доказывающие способность кокцинеллид заражаться Wolbachia через клещей, представлены в табл. 3. Для доказательства отсутствия следов ДНК жуков в образцах ДНК клещей мы ставили ПЦР с общими праймерами LCO и HCO с последующим секвенированием амплификатов. Хроматограммы не содержали двойных пиков. Последовательности мтДНК зараженных и незараженных Wolbachia клещей идентичны. Результаты сравнения последовательностей ДНК клещей и божьих коровок представлены на рис. 3. Идентичные последовательности генов Wolbachia (аллели coxA-1, ftsZ-3) получены для A. bipunctata M26(C.h.90)W+, A. decempunctata M84d(F1-3)(C.h.90)W+ и донора C.h.90W+; A. decempunctata M84d(F1-8)(C.h.109)W+ и донора C.h.109W+ (табл. 3). В данных случаях инфицирование произошло штаммом wAbi-2 (рис. 2).
Рис. 3.
Сравнение последовательностей генов cox1 клеща Coccipolipus hippodamiae и Adalia bipunctata.

Всего 58 особей жуков (без клещей) содержались в чашках Петри с 7 клещевыми культурами (коровками, зараженными клещами) (Приложение 1 ). В табл. 3 показаны только случаи, когда жуки заразились клещами. В результате, клещи заразились Wolbachia и Spiroplasma; в трех случаях жуки, не инфицированные изначально Wolbachia, приобрели симбионта после укусов клещей.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Клещи C. hippodamiae были найдены на имаго A. bipunctata в природных сборах в Москве, тогда как имаго H. axyridis оказались не заражены. Это свидетельствует о том, что именно A. bipunctata продолжает быть основным хозяином C. hippodamiae в Москве. Следует отметить высокий уровень зараженности, от 10.2 до 76.2% (табл. 1), в 1989–1997 гг. в Москве было заражено только 3.5% – 6.7% имаго A. bipunctata (Захаров, Эйдельберг, 1997; Webberley et al., 2004). Увеличилось географическое распространение C. hippodamiae и в Европе. Ранее было обнаружено, что C. hippodamiae широко распространены в Центральной, Южной и Восточной Европе, но отсутствовали в северных и северо-западных популяциях A. bipunctata (Захаров, Эйдельберг, 1997; Webberley et al., 2006). Позднее, C. hippodamiae были обнаружены среди H. axyridis в Польше (Rhule et al., 2010). В популяции инвазивного вида божьих коровок H. axyridis в Нидерландах, C. hippodamiae не были обнаружены в 2003–2007, однако начиная с 2008 г. C. hippodamiae встречаются среди зимующих жуков H. axyridis (Raak-van den Berg et al., 2014). Возможно, что на размножение и распространение C. hippodamiae, так же как и многих насекомых, влияет повышение среднегодовых температур.
Заражение кокцинеллид клещами C. hippodamiae постепенно приводит к бесплодию самок-хозяев. Отложенные инфицированными самками яйца приобретают характерный сморщенный вид и высыхают в течение суток после откладки. Предполагается, что заражение клещами препятствует образованию хориона A. bipunctata и это приводит к сморщиванию яиц (Hurst et al., 1995). В экспериментах было показано, что жизнеспособность яиц, откладываемых хозяевами A. bipunctata (Hurst et al., 1995), A. decempunctata и O. conglobata (Webberley et al., 2004), H. axyridis (Rhule et al., 2010) заметно снижалась по мере развития клещевой инфекции. Наши результаты также показали, что сразу после заражения клещами большинство яиц, отложенных зараженной клещами самкой, оставалась оплодотворенными. Однако доля вылупившихся яиц начинала уменьшаться примерно через 10 дней после заражения. Аналогичные результаты получены и в других исследованиях – снижение доли вылупившихся яиц на 10–15 день что, как правило, приводило к стерильности самок через три недели после заражения (Hurst et al., 1995; Webberley et al., 2004). В экспериментах на H. axyridis было показано, что в первые 5 дней после заражения клещами частота выхода личинок из яиц больше 70%, примерно на 19-й день происходит резкое снижение вылупляемости, на 30-й день частота вылупления в среднем составляет меньше 20% (Rhule et al., 2010). Эти данные свидетельствуют о том, что заражение клещами снижает фертильность жуков, но не всегда приводит к абсолютной стерильности.
По нашим наблюдениям, заражение клещами самок A. bipunctata приводит к снижению фертильности, но не оказывает существенного влияния на продолжительность жизни жуков и на их способность к спариванию. Это также отмечали и другие исследователи (Webberley et al., 2004; Hurst et al., 1995). Таким образом, можно предполагать, что в отсутствие стрессовых условий клещи способны обитать под надкрыльями жуков продолжительное время и это дает возможность бактериальным симбионтам достигнуть высокой плотности.
Божьи коровки являются хозяевами трех наследственных симбиотических бактерий из рода Rickettsia, Wolbachia и Spiroplasma. Мы предположили, что эктопаразиты могут заражаться этими бактериями от жуков, что подтверждается результатами экспериментов и идентичностью секвенированных последовательностей генов бактерий Wolbachia и Spiroplasma из жуков-хозяев и их клещей. Rickettsia мы не обнаружили в сборах. Клещи заражаются, наследуют и сохраняют инфекцию как Wolbachia, так и Spiroplasma в поколениях при переходе подвижных нимф с первого жука-хозяина на других жуков. Мы наблюдали сохранение статуса инфицированности Wolbachia и Spiroplasma на протяжении, как минимум, трех жизненных циклов (поколений) C. hippodamiae.
Может ли клещ заразить самку божьей коровки микроорганизмом? Наши результаты показали, что божьи коровки из линий A. bipunctata и A. decempunctata, свободных от симбиотических бактерий, заражаются Wolbachia после укусов клещей. Нам не удалось обнаружить передачу Wolbachia потомству от этих жуков, так как их яйца оказались нежизнеспособны или сами жуки погибли, не отложив яиц. Однако, необходимо отметить, что фертильность яиц божьих коровок не всегда снижается до нуля. Кроме того, так как частота вылупления яиц снижается после заражения клещами постепенно, зараженная клещами самка успевает произвести потомство, пусть и не такое многочисленное в сравнении со здоровыми самками. Также, самки кокцинеллид могут выздоравливать при гибели колонии клещей (Hurst et al., 1995).
Эффективность распространения бактериальных симбионтов среди насекомых зависит от плотности и приспособленности эндосимбионтов внутри хозяев. Так, симбионты, вызывающие цитоплазматическую несовместимость, достигают, как правило, высокой плотности в популяции хозяев за счет очевидного преимущества зараженных самок. Бактерии, вызывающие гибель самцов (андроцид), дают преимущества инфицированным самкам, уменьшая инбридинг и предоставляя им возможность избежать голода, питаясь неразвивающимися яйцами, из которых должны были выйти самцы. Однако, незараженные самки и самцы всегда присутствуют в популяции. Динамика распространенности эндосимбионтов, убивающих самцов, гораздо более чувствительна к изменениям в точности передачи и относительной приспособленности. В естественных популяциях симбионты, вызывающие андроцид, демонстрируют гораздо большую временную и пространственную изменчивость распространенности инфекции, чем эндосимбионты, вызывающие цитоплазматическую несовместимость. Тем не менее, по нашим данным, зараженности Wolbachia и Spiroplasama стабильно сохранялись и наследовались на протяжении трех поколений как жуков, так и клещей.
Могут ли клещи быть векторами горизонтального переноса бактерий в природе? Штаммы Wolbachia, идентичные по последовательностям пяти генов, были обнаружены в A. bipunctata wAbi-3 и H. axyridis kl-34 (Shaikevich et al., 2021). Мы наблюдали как H. axyridis заражались C. hippodamiae при совместном содержании от A. bipunctata в условиях экспериментов. Переносчиком симбионта между такими далекими в филогенетическом отношении видами могут быть паразиты, в том числе и C. hippodamiae. Эктопаразитические клещи C. hippodamiae изучались ранее только в связи с возможностью их использования для контроля численности инвазивных хищных кокцинеллид H. axyridis (Rhule et al., 2010; Riddick, 2010). В данной работе впервые была изучена зараженность клещей божьих коровок C. hippodamiae симбионтами от хозяев и доказана их способность распространять бактерий среди жуков-кокцинеллид.
ЗАКЛЮЧЕНИЕ
Таким образом, в результате проведенного исследования было выявлено, что эктопаразитические клещи C. hippodamiae заражаются бактериями Wolbachia и Spiroplasma от хозяев и способны инфицировать жуков. Взаимоотношения бактериальных симбионтов Wolbachia и Spiroplasma с насекомыми-хозяевами варьируют от паразитизма до мутуализма. Длительное сосуществование симбиотических бактерий и их хозяев представляет широкие возможности не только для совместного использования метаболических путей, но также и для горизонтального переноса генов бактерий в геномы насекомых. В свою очередь, горизонтальный приток генов через эндосимбиоз является источником новых функций и может сыграть роль в эволюции и симбиотической адаптации хозяев. В некоторых случаях заражение новыми бактериальными симбионтами приводит к образованию репродуктивных барьеров и, в конечном счете, к видообразованию. Таким образом, исследования путей и способов горизонтальных переносов наследуемых симбиотических бактерий среди животных имеет большое значение как для изученного, так и для других сообществ.
Список литературы
Горячева И.И., Блехман А.В., Андрианов Б.В., Горелова Т.В., Захаров И.А. Генотипическое разнообразие Wolbachia pipientis в нативных и инвазивных популяциях Harmonia axyridis Pall., 1773 (Coleoptera, Coccinellidae) // Генетика. 2015. Т. 51. № 8. С. 857–863.
Захаров И.А., Эйдельберг М.М. Паразитический клещ Coccipolipus hyppodamia McDaniel et Morrill (Tarsonemina, Podapolipidae) в популяциях двухточечной коровки Adalia bipunctata L. (Coleoptera, Coccinellidae) // Энтомологическое обозрение. 1997. Т. 76. № 3. С. 680–683.
Захаров И.А., Шайкевич Е.В. Полиморфизм мтДНК в петербургской популяции Adalia bipunctata и его связь с зараженностью симбиотической бактерией Spiroplasma // Экологическая генетика. 2011. Т. 9. № 1. С. 27–31.
Романов Д.А., Матвейкина Е.А. Harmonia axyridis (Pallas, 1773) (Coleoptera: Coccinellidae) в г. Москве и г. Ялте: ее конкуренция с нативными видами кокцинеллид и влияние паразитоидов на ее численность // Российский журн. биологических инвазий. 2021. № 4. С. 114–133.
Шайкевич Е.В., Захаров И.А., Хонек А. Экологическая генетика жуков рода Adalia: изменчивость и симбиотические бактерии в европейских популяциях десятиточечной божьей коровки Adalia decempunctata // Экологическая генетика. 2019. Т. 17. № 4. С. 37–45.
Шайкевич Е.В., Ившина Е.В., Захаров И.А. Полиморфизм митохондриальной ДНК и распространение цитоплазматических симбионтов в популяциях двуточечной божьей коровки Adalia bipunctata // Генетика. 2012. Т. 48. № 5. С. 666–671.
Эйдельберг М.М. Клещи семейства Podapolipidae (Heterostigmata, Tarsonemina) Украины и сопредельных территорий с описанием нового вида // Вестн. зоологии. 1994. № 1. С. 37–42.
Ahmed M.Z., Breinholt J.W., Kawahara A.Y. Evidence for common horizontal transmission of Wolbachia among butterflies and moths // BMC Evol. Biol. 2016. V. 16. P. 118.
Baldo L., Ayoub N.A., Hayashi C.Y., Russell J.A., Stahlhut J.K., Werren J.H. Insight into the routes of Wolbachia invasion: high levels of horizontal transfer in the spider genus Agelenopsis revealed by Wolbachia strain and mitochondrial DNA diversity // Mol Ecol. 2008. V. 17(2). P. 557–569.
Brown A.N., Lloyd V.K. Evidence for horizontal transfer of Wolbachia by a Drosophila mite // Exp. Appl. Acarol. 2015. V. 63(3). P. 301–311.
Ceryngier P., Roy H.E., Poland R.L. Natural enemies of ladybird beetles // In: Ecology and behaviour of the ladybird beetles (Coccinellidae) / Ed. by Hodek I., van Emden H.F., Honek A. Chichester: Wiley-Blackwell, 2012. P. 375–443.
Folmer O., Black M., Hoeh W., Lutz R., Vrijenhoek R. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates // Mol. Mar. Biol. Biotechnol. 1994. V. 3. P. 294–299.
Gerth M., Röthe J., Bleidorn C. Tracing horizontal Wolbachia movements among bees (Anthophila): A combined approach using multilocus sequence typing data and host phylogeny // Molecular ecology. 2013. V. 22. https://doi.org/10.1111/mec.12549
Goryacheva I., Blekhman A., Andrianov B., Zakharov I. Heritable bacterial endosymbionts in native and invasive populations of Harmonia axyridis // Biol. Invasions. 2017. V. 19. P. 493–502.
Goryacheva I., Blekhman A., Andrianov B., Romanov D., Zakharov I. Spiroplasma infection in Harmonia axyridis – diversity and multiple infection // PLoS One. 2018. V. 13(5). e0198190.
Hurst G.D.D., Sharpe R.G., Broomfield A.H., Walker L.E., Majerus T.M.O., Zakharov I.A., Majerus M.E.N. Sexually transmitted disease in a promiscuous insect, Adalia bipunctata // Ecological Entomology. 1995. V. 20(3). P. 230–236.
Ilinsky Y., Kosterin O.E. Molecular diversity of Wolbachia in Lepidoptera: prevalent allelic content and high recombination of MLST genes // Mol Phylogenet Evol. 2017. V. 109. P.164–179.
Jaenike J., Polak M., Fiskin A., Helou M., Minhas M. Interspecific transmission of endosymbiotic Spiroplasma by mites // Biol. Lett. 2007. V. 3(1). P. 23–25.
Knell R.J., Webberley K.M. Sexually transmitted diseases of insects: distribution, evolution, ecology and host behaviour // Biological Reviews. 2004. V. 79(3). P. 557–581.
Li H., Shu X., Meng L., Zhou X., Obrycki J.J., Li B. Prevalence in maternally-inherited bacteria in native and invasive populations of the harlequin ladybird beetle Harmonia axyridis // Biol. Invasions. 2021. V. 23. P. 1461–1471.
O’Neill S.L., Giordano R., Colbert A.M., Karr T.L., Robertson H.M. 16S rRNA phylogenetic analysis of the bacterial endosymbionts associated with cytoplasmic incompatibility in insects // Proc. Natl. Acad. Sci. USA. 1992. V. 89(7). P. 2699–2702.
Osaka R., Watada M., Kageyama D., Nomura M. Detection of Spiroplasma from the mite Macrocheles sp. (Acari: Macrochelidae) ectoparasitic to the fly Drosophila hydei (Diptera; Drosophilidae): a possible route of horizontal transmission // Symbiosis. 2013. V. 60(2). P. 79–84.
Pietri J.E., DeBruhl H., Sullivan W. The rich somatic life of Wolbachia // MicrobiologyOpen. 2016. V. 5(6). P. 923–936.
Raak-van den Berg C.L., van Wielink P.S., de Jong P.W., Gort G., Haelewaters D., Helder J., van Lenteren J.C. Invasive alien species under attack: natural enemies of Harmonia axyridis in the Netherlands // BioControl. 2014. V. 59(2). P. 229–240.
Rhule E.L., Majerus M.E.N., Jiggins F.M., Ware R.L. Potential role of the sexually transmitted mite Coccipolipus hippodamiae in controlling populations of the invasive ladybird Harmonia axyridis // Biological Control. 2010. V. 53(2). P. 243–247.
Riddick E.W. Ectoparasitic mite and fungus on an invasive lady beetle: parasite coexistence and influence on host survival // Bulletin of Insectology. 2010. V. 63(1). P. 13–20.
Schulenburg J.H., Hurst G.D., Tetzlaff D., Booth G.E., Zakharov I.A., Majerus M.E. History of infection with different male-killing bacteria in the two-spot ladybird beetle Adalia bipunctata revealed through mitochondrial DNA sequence analysis // Genetics. 2002. V. 160. P. 1075–1086.
Shaikevich E.V., Romanov D.A., Zakharov I.A. The diversity of Wolbachia in a single Adalia bipunctata (Coleoptera: Coccinellidae) population: correlations with host phylogeny and male-killing // Symbiosis. 2021. V. 85(2). P. 249–257.
Shaikevich E.V., Zakharov I.A. Biodiversity in geographically remote natural populations of Adalia ladybirds (Coleoptera: Coccinellidae) // In: Beetles: Biodiversity, Ecology and Role in the Environment / Ed. by Stack C. Nova Science Publishers, Inc., 2015. P. 205–226.
Tamura K., Stecher G., Peterson D. et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0 // Molecular Biology and Evolution. 2013. V. 30. P. 2725–2729.
Webberley K.M., Hurst G.D.D. The effect of aggregative overwintering on an insect sexually transmitted parasite system // J. Parasitology. 2002. V. 88(4). P. 707–712.
Webberley K.M., Hurst G.D.D., Husband R.W., Schulenburg J.H.G.V.D., Sloggett J.J., Isham V., Buszko J., Majerus M.E.N. Host reproduction and a sexually transmitted disease: causes and consequences of Coccipolipus hippodamiae distribution on coccinellid beetles // J. Animal Ecology. 2004. V. 73(1). P. 1–10.
Webberley K.M., Tinsley M.C., Sloggett J.J., Majerus M.E.N., Hurst G.D.D. Spatial variation in the incidence of a sexually transmitted parasite of the ladybird beetle Adalia bipunctata (Coleoptera: Coccinellidae) // European J. Entomology. 2006. V. 103(4). P. 793–797.
Werren J.H., Zhang W., Guo L.R. Evolution and phylogeny of Wolbachia: reproductive parasites of arthropods // Proc. Biol. Sci. 1995. V. 261(1360). P. 55–63.
Дополнительные материалы
- скачать ESM.xlsx
- Приложение 1.
Таблица. Данные эксперимента по заражению жуков и клещей симбионтами в лаборатории
Инструменты
Известия РАН. Серия биологическая


