Известия РАН. Серия биологическая, 2023, № 3, стр. 227-234
Клеточные линии меланомы, как основа для создания модели васкулогенной мимикрии
А. А. Вартанян 1, *, В. С. Косоруков 1
1 Национальный медицинский исследовательский центр онкологии
им. Н.Н. Блохина Минздрава России
115478 Москва, ул. Каширская, 24, Россия
* E-mail: zhivotov57@mail.ru
Поступила в редакцию 15.06.2022
После доработки 24.08.2022
Принята к публикации 24.08.2022
- EDN: MZKDNY
- DOI: 10.31857/S102634702370018X
Аннотация
В опухоли наряду с кровеносными сосудами, выстланными эндотелием, обнаруживаются и высокоструктурированные васкулярные каналы, образованные опухолевыми клетками. Предполагается, что сеть таких каналов компенсирует недостаточно быстрое развитие в опухоли кровеносной системы и предотвращает ранний некроз внутри опухоли. Высокая статистическая корреляция между появлением в опухоли васкулярных каналов и низкой выживаемостью больных подтверждает эту гипотезу. Поэтому поиск ингибитора формирования васкулярных каналов в опухоли приобретает чрезвычайную актуальность. В настоящем обзоре обсуждается функциональное и прогностическое значение васкулогенной мимикрии. Особое внимание уделено оптимизации in vitro модели васкулогенной мимикрии на основе анализа 11 клеточных линий меланомы, полученных из метастазов больных диссеминированной меланомой. Кроме того, обсуждается разработка in vivo модели васкулогенной мимикрии для изучения ее механизмов и репрессии.
Концепция о том, что VEGF-индуцируемый ангиогенез является фактором, лимитирующим рост опухоли, сегодня принята всеми (Al-Ostoot et al., 2021). Отличаясь друг от друга по очень многим параметрам, все опухоли используют одни и те же сигнальные пути для васкуляризации. Терапия, направленная на блокирование формирования новых кровеносных сосудов, должна иметь значительно более широкий спектр применения в качестве общего противоопухолевого воздействия. Казалось бы, в этом правиле не должно быть исключений. Но уже первые клинические испытания препаратов, потенциально направленные на снижение кровоснабжения опухоли, выявили, что антиангиогенная терапия способствует переходу опухоли в фазу более агрессивного роста, хотя изначально и приводит к снижению размеров опухоли (El Alaoui-Lasmaili, Faivre, 2018). Накапливаются факты, свидетельствующие о том, что большинство опухолей практически не отвечают на анти-VEGF-терапию (Jaszai, Schmidt, 2019).
Одной из причин выживаемости опухолевых клеток в условиях антиангиогенной терапии может быть гетерогенность кровеносных сосудов: формирование сосудов в опухоли происходит на фоне неконтролируемой митогенной стимуляции и измененного внеклеточного матрикса. Это приводит к развитию неполноценных сосудов, имеющих нередко нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетками, а иногда и вовсе отсутствовать в сосудах опухоли. Образование микроваскулярной сети опухолевыми клетками de novo, без участия эндотелиальных клеток, т.е. независимо от ангиогенеза, получило название “васкулогенная мимикрия” (ВМ) (Maniotis et al., 1999). Термин этот введен для описания кровоснабжения опухоли, имитирующей васкуляризацию эмбриона цитотрофобластами. Васкулярные каналы формируются опухолевыми клетками с высоко злокачественным фенотипом, слабоагрессивные опухолевые клетки таких структур не образуют (Hendrix et al., 2003). ВМ может иметь неоценимое значение для опухолей, растущих массивными опухолевыми узлами с небольшим количеством васкулярной стромы.
Детальное исследование влияния широко используемых в клинике ингибиторов ангиогенеза на модулирование ВМ in vitro показало, что эти препараты не блокируют формирование васкулярной сети опухолевыми клетками (Van der Schaft et al., 2004; Ribatti et al., 2019).
ВМ представлена неодинаково в разных типах опухолей. В меланоме более 65% кровоснабжения осуществляется через каналы ВМ; при тройном негативном раке молочной железы – более 50%, при саркоме мягких тканей – 33–35%, при раке почки – 30–32%, при раке яичника, раке молочной железы – 15–18%; и меньше всего при раке толстой кишки – 10–12% (Vartanian, Baryshnikov, 2013). Васкулярные каналы в количестве 10–12% вряд ли что изменяют, но 40–65% явно могут иметь существенное значение.
В последние десятилетия усилия многих онкологов были направлены на исследование механизмов инициации и прогрессии злокачественной опухоли. Со временем стало понятно, что основная угроза злокачественных новообразований – распространение опухоли по всему организму. Метастазирование, или процесс миграции клеток опухоли из первичного очага с последующим формированием вторичных опухолевых очагов (метастазов) – одна из главных трудностей в лечении онкологических заболеваний. Появление в опухоли дополнительной системы кровоснабжения (ВМ) предполагает новый путь метастазирования. Это обстоятельство определяет потенциальную возможность использования блокирования ВМ для предотвращения появления метастазов.
В настоящее время не известен ни один физиологический процесс у взрослых или детей – аналог ВМ, что предоставляет определенные возможности для ингибирования роста агрессивной опухоли с минимальным воздействием на физиологические процессы в других тканях. Исследования механизмов инициации и роста васкулярных каналов, выстланных опухолевыми клетками, сталкиваются с определенными трудностями, которые в основном, связаны с методологическими проблемами.
В данном обзоре обобщены результаты исследований, посвященные функциональному и прогностическому значению ВМ в общей выживаемости онкологических больных. Особое внимание уделено оптимизации in vitro модели ВМ на основе анализа 11 клеточных линий меланомы, полученных из метастазов больных диссеминированной меланомой. Кроме того, обсуждается разработка in vivo модели ВМ для изучения ее механизмов и репрессии.
ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ ВМ
Еще до открытия феномена ВМ, гистологическое исследование разных типов опухолей выявило в метастатической опухоли каналы, озера и синусы, окруженные опухолевыми клетками (Timar, Toth, 2000). Интерес к этому процессу заметно возрос после обнаружения в таких каналах форменных элементов крови. Однако как микроциркуляторное русло в опухоли ВМ долгое время считалась сомнительной. Наличие каналов, выстланных опухолевыми клетками, в злокачественных опухолях не отрицалось, но подвергалась сомнению роль таких каналов в кровоснабжении опухоли.
Вовлечение ВМ в микроциркуляцию крови в опухоли впервые было продемонстрировано на модели ишемизированных конечностей мышей (Hendrix et al., 2002). При введении флуоресцентно меченых клеток метастатической меланомы в ишемизированную конечность мыши наблюдалось формирование “мозаичных” сосудов, состоящих из эндотелиальных и опухолевых клеток, а также васкулярных каналов, формированных опухолевыми клетками.
Спустя год группой японских ученых было показано, что в экспериментальной модели рака молочной железы васкулярные каналы присутствуют, в основном, в центре опухоли, тогда как неоангиогенез обнаруживается на периферических ее участках. Контрастирующий флуоресцентный агент окрашивал и периферические, и центральные участки опухоли, что указывало на существование тока крови между участками неоангиогенеза и ВМ. В опухолях без ВМ накопление контрастирующего агента в центре опухоли отсутствовало (Shirakawa et al., 2003). Эти исследования существенно изменили представления о роли ВМ в васкуляризации опухоли.
В настоящее время накоплен большой клинический материал о корреляции появления васкулярных каналов, формированных опухолевыми клетками, с быстрой прогрессией опухоли, повышением метастазирования, и как следствие – короткой выживаемостью больных (Vartanian et al., 2017; Luo et al., 2020). Подобные наблюдения подтверждают способность васкулярных каналов поддерживать рост опухоли.
Определенный интерес вызывает происхождение опухолевых клеток, способных формировать васкулярные каналы.
СТВОЛОВЫЕ КЛЕТКИ ОПУХОЛИ И ВМ
Поиск потенциальных мишеней на основе изменений наследственного аппарата клетки, воздействуя на которые можно было бы добиться подавления роста опухоли, к успеху не привел. Оказалось, что набор генетических поломок индивидуален не только для каждой опухоли, но и для различных популяций клеток внутри одной опухоли (Meacham, Morrison, 2013). Для объяснения разнородного состава опухоли в 2006 г была предложена модель стволовой клетки опухоли (СКО) (Clarke et al., 2006). Концепция СКО сегодня сводится к следующему: СКО – специфическая опухолевая клетка – долгоживущая и медленно пролиферирующая, способная при трансплантации иммунодефицитным животным инициировать рост опухоли, идентичной исходной, в то время как другие короткоживущие и более дифференцированные клетки опухоли этой способностью не обладают (Woodward, Hill, 2016). СКО появляется, по-видимому, в результате сбоя в регуляторной системе поврежденных ткане-специфических стволовых клеток (СК) и накоплению мутаций или при неадекватном ответе СК на внешние сигналы. В опухоли лишь очень небольшая доля клеток обладает такими характеристиками (0.01–1% клеток опухоли) (Dirks, 2010). Не уничтожив эту самую важную часть опухолевых клеток, мы не можем обсуждать возможности регрессии опухоли. В отличие от более дифференцированных клеток основной опухолевой массы, которые относительно неплохо уничтожают существующие средства цитотоксической противоопухолевой терапии, СКО характеризуется чрезвычайной терапевтической устойчивостью, которая в ответ на лечение только возрастает (Najafi et al., 2019). Модель СКО, т.е. функциональной гетерогенности клеток опухоли, объясняет также процессы метастазирования. Сегодня уже достоверно известно, что предрасположенность опухоли к метастазированию заложена в геноме конкретной опухолевой клетки (Shiozawa et al., 2013). За последнее десятилетие накоплен огромный экспериментальный материал, указывающий на то, что СКО вовлекается также в васкуляризацию опухоли и образование стромы (Melzer et al., 2018; Li et al., 2021). Так, многие вопросы клинической онкологии, начиная от возникновения лекарственной резистентности до появления рецидивов спустя десятилетия после кажущегося исцеления, находят объяснение в рамках модели СКО. Теперь мы знаем, что снижение размеров опухоли в результате лечения не столь уж и важно, гораздо важнее судьба СКО. Ибо, если они уцелели, то опухоль в ближайшее время “вернется”.
Два независимых наблюдения послужили основой для инициации экспериментов, подтверждающих участие СКО в ВМ. Первое, окраска гистологических срезов пимонидазолом (маркер гипоксии), показала, что микроокружение каналов ВМ в опухоли характеризуется глубокой гипоксией (Sun et al., 2007). А гипоксия, как известно, – один из важных параметров, необходимых для поддержания недифференцированного статуса СК. Второе, анализ экспрессии генов с использованием ДНК-микрочипов показал, что опухолевые клетки, способные формировать васкулярные каналы, экспрессируют гены, характерные для поддержания полипотентного, эмбрионально-подобного фенотипа, например, Nodal, Notch и Wnt (Hooijkaas et al., 2011). С другой стороны, экспрессия меланоцит-специфических антигенов, таких как Melan-A, MIFT, TYR и TYRP1, снижена в 22; 34; 37 и 100 раз в клетках меланомы, способных формировать васкулярные каналы (Boiko et al., 2010). Более того, в опухолевом материале, где присутствовали васкулярные каналы, выстланные опухолевыми клетками, была обнаружена большая популяция СКО (Monzani, La Porta, 2008). Таким образом, сходство между СКО и опухолевыми клетками, способными формировать васкулярные каналы, по маркерам и сигнальным путям, предполагает, что СКО должна участвовать в формировании васкулярных каналов. Экспериментальное подтверждение этой идеи можно найти в обзорах последних 5–6 лет: клетки, выстилающие васкулярные каналы в опухоли, несут характеристики СКО (Bao et al., 2018; Sun et al., 2019). Однако механизм, иницирующий трансдифференцировку СКО в эндотелий-подобную клетку, все еще неизвестен.
С целью повышения эффективности лечения злокачественных заболеваний в стадии агрессивного роста проводятся многочисленные клинические исследования новых противоопухолевых препаратов. Тем не менее, постоянно возрастающая резистентность к терапии оставляет открытым вопрос о лечении рака. Блокирование формирования васкулярных каналов в опухоли не только могло бы уменьшить рост опухоли и образование отдаленных метастазов, снижая доставку питания опухолевым клеткам, но и изменить характеристики СКО, предотвращая возвращение болезни.
ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ВМ
Для выявления каналов ВМ в опухоли в лабораторной практике используют окрашивание гистологических срезов PAS-реагентом (Periodic acid Schiff). В основе PAS-реакции лежит окисление базального ламинарного матрикса васкулярных каналов периодной кислотой (Folberg et al., 2000). Отрицательная PAS-реакция является индикатором отсутствия в опухоли васкулярных каналов, выстланных опухолевыми клетками. Первые исследования с выявлением васкулярных каналов были проведены на гистологических срезах ювеальной меланомы глаза 20 больных в лаборатории Фолберг (Folberg et al., 1993). Опухоль оценивалась по размеру, ее расположению в области хороидеи или цилиарного тела и наличием или отсутствием PAS-положительных структур. При отсутствии PAS-положительных сетей выживаемость больных без прогрессии составила 10 и более лет. Для подтверждения своих результатов R. Folberg и соавторы провели более масштабное исследование, включающее 234 случая ювеальной меланомой глаза, период наблюдения составлял не менее 10 лет. Кривые выживаемости по Каплану-Мейеру показали, что выживаемость больных, в опухолевой ткани которых отсутствовал компонент ВМ, была значительно выше (91.7%) выживаемости больных, в опухолевой ткани которых такие структуры присутствовали (56.9%, p = 0.0001) (Folberg et al., 1994). Другой важный вывод, который следовал из этого исследования – в ткани меланомы глаза, размер которой превышал 1 см, отсутствовал некроз, что предполагало, что опухоль хорошо васкуляризована.
Исследования прогностической значимости PAS-положительных структур при диссеминированной меланоме кожи были проведены и в нашей лаборатории (Григорьева и др., 2011). В случае определения в опухолевой ткани параллельных с пересечением РAS-положительных структур болезнь возвращалась через 10 мес. по сравнению с 30 мес. при отсутствии в опухолевой ткани таких структур (p = 0.057). Крайне интересным оказался тот факт, что PAS-положительные структуры в образцах опухоли достоверно определялись в тех участках опухоли, где плотность сосудов, выстланных эндотелиальными клетками, была минимальной.
Прогностическое значение PAS-положительных структур при раке молочной железы, раке яичника, мезотелиальной саркоме, рабдомиосаркоме, раке легкого, гепатоцеллюлярной саркоме, раке почки подтверждено рядом лабораторий (Ren et al., 2019; Treps et al., 2021). Отмечается высокий уровень надежности и соответствия результатов гистологического определения данных структур клиническому течению болезни. Статистически значимой зависимости между такими показателями, как локализация, стадия заболевания, возраст пациента и присутствием в ткани опухоли ВМ не выявлено.
КЛЕТОЧНЫЕ ЛИНИИ МЕЛАНОМЫ, КАК ОСНОВА ДЛЯ СОЗДАНИЯ МОДЕЛИ ВМ
Современная антиангиогенная терапия направлена на блокирование пролиферации эндотелиальных клеток или их апоптоз. Снижение плотности кровеносных сосудов приводит к повышению гипоксии в опухоли. Адаптация к условиям гипоксии сопровождается селекцией клеток с более агрессивным фенотипом, которые, скорее всего, для компенсации недостатка питания и кислорода и формируют каналы ВМ. Антиангиогенная терапия непреднамеренно активирует альтернативную, более агрессивную систему кровоснабжения опухоли (Vartanian et al., 2013).
ВМ может быть иницирована и самим терапевтическим воздействием. Химиотерапия является основным, а при некоторых формах и стадиях распространения злокачественной опухоли – единственным методом лечения онкологических больных. Наиболее серьезным препятствием к повышению эффективности химиотерапии остается лекарственная резистентность. Опухоль перестает отвечать на терапию независимо от комбинирования применяемых препаратов. Если при этом исчерпаны другие виды лечения – хирургическое и иммунотерапия – болезнь переходит в терминальную фазу. Нами было получено экспериментальное подтверждение, что резистентные к ДНК-повреждающим агентам опухолевые клетки, в отличие от клеток дикого типа, формируют васкулярные каналы (Vartanian et al., 2017).
К настоящему времени описано небольшое количество охарактеризованных моделей для изучения механизмов инициации и роста васкулярных каналов, выстланных опухолевыми клетками. Анализ исследований последних десяти лет, посвященных изучению молекулярных событий, лежащих в основе патогенеза меланомы, дает основание к выбору меланомы кожи как оптимальной модели для изучения ВМ. Классические подходы (химио- и радиотерапия) в случае меланомы дают менее выраженные эффекты, чем в других опухолях. Меланома практически резистентна к такой терапии, что подтверждает высоко злокачественный фенотип клеток меланомы, а значит и возможность формирования васкулярных каналов (Gogas et al., 2007). Меланома также не отвечает на антиангиогенную терапию, что предполагает существование в опухоли системы циркуляции крови, не зависящей от эндотелия (Cui et al., 2014). Из метастазов больных диссеминированной меланомы нами были получены 11 клеточных линий меланомы (Михайлова и др., 2017). На основе анализа способности этих клеток формировать васкулярные каналы была оптимизирована in vitro и разработана in vivo модель ВМ.
Клеточные линии меланомы, как основа для создания in vitro модели ВМ
В настоящее время in vitro моделью исследования ВМ служит тест на формирование сосудисто-подобных структур (СПС) в 3D-культуре, разработанный для выявления ингибиторов и активаторов ангиогенеза (Maniotis et al., 1999). Если опухолевые клетки на гелевой матрице вместо равномерного монослоя формируют структуры, подобные пчелиным сотам (honey-like comb), то такие клетки будут формировать и тубулярные структуры. Полученные нами клетки меланомы (Mel Z, Mel Mtp, Mel Rac, Mel P, Mel Kor, Mel Si, Mel Ibr, Mel Cher, Mel Gus, Mel Ch) прошли не менее 20 пассажей. Клетки были анеуплодные, модальное число хромосом соответствовало триплоидному набору. Статус меланомы был подтвержден экспрессией пяти тканеспецифичных антигенов: СD63, HMB45, Melan А, Tyrosinase, HMW. Для всех клеточных линий метастатической меланомы кожи была характерна высокая пролиферативная активность (Ki-67 > 60%) (Михайлова и др., 2017).
В in vitro экспериментах в качестве гелевой матрицы мы использовали Матригель. По сравнению с коллагеновым гелем или фибронектином Матригель является более обогащенной матрицей. В ходе работы были выявлены следующие составляющие стандартизированной in vitro модели ВМ: основной детерминантой формирования СПС оказалась механическая жесткость геля – его способность деформироваться в ответ на кооперацию с клетками. Разбавление Матригеля (8.7 мг/мл) более чем в два раза снижало способность клеток меланомы к организации в СПС. Другой детерминантой образования подобных структур оказалась необходимость наличия в культуральной среде факторов роста сыворотки (Вартанян и др., 2005). Биомеханическая способность клеток меланомы формировать СПС зависела также от инвазивного потенциала клетки (Vartanian et al., 2007) и экспрессии опухолевыми клетками эндотелий-специфических генов и маркеров стволовых клеток (Seftor et al., 2002; Оборотова и др., 2015).
Культивирование клеток метастатической меланомы кожи на Матригеле приводило к формированию трех типов СПС. В качестве контроля была использована клеточная линия эндотелиальных клеток SVEC-4-10. Клетки меланомы Mel Cher, Mel P, Mel Ch и Mel Si формировали стабильные СПС, которые сохранялись более 24 ч. Вторую группу составили Mel Kor, Mel Il, Mel Gus и Mel Mtp клетки, которые формировали нестабильные СПС, к 14–16 ч инкубации на Матригеле появлялись разрывы в контактах клеток, нарушалась структура СПС. Три клеточные линии Mel Ksen, Mel Ibr и Mel Me сохраняли способность мигрировать на Матригеле и узнавать друг друга, однако не формировали СПС, при этом наблюдалось организация опухолевых клеток в небольшие кластеры (Вартанян и др., 2005). Поведение всех трех групп клеток на Матригеле воспроизводилось стабильно, от опыта к опыту.
Клеточные линии меланомы, как основа для создания in vivo модели ВМ
К моменту, когда мы начинали разработку in vivo модели ВМ, основной моделью было формирование на Матригеле тубулярных структур клетками ювеальной меланомы человека MUMB2B. Формирование тубулярных структур на Матригеле происходило при высокой плотности MUMB2B клеток и занимало 2 нед. (Maniotis et al., 1999). По данным Maniotis A. и др., предложивших этот метод, для таких тубулярных структур было характерно положительное окрашивание PAS-реагентом, что свидетельствовало о присутствии базальной мембраны, окружающей тубулярные структуры на Матригеле. В литературе отсутствовали сообщения о ксенографтной модели ВМ. При разработке модели роста человеческой меланомы кожи в бестимусных мышах мы фокусировали наше внимание на реализации двух постулатов: in vivo модель ВМ должна обладать параметрами для исследования динамики роста экспериментальной меланомы в условиях блокирования ВМ, и второе, обеспечивать надежную воспроизводимость визуализации сети васкулярных каналов в опухоли.
Клеточная линия Mel Cher была отобрана для имплантации иммунордефицитным мышам. Данная клеточная линия обладала стабильными культуральными и морфологическими характеристиками. Mel Cher клетки для приобретения эндотелий-подобных характеристик экспрессировали с высокой интенсивностью белки VEGF-рецептор-лигандной системы, фактор фон Виллебранда/фактор VIII, белок гомотипического узнавания эндотелиальных клеток, VE-кадхерин и белок, иницирующий васкуляризацию эмбриона, Mig-7 (Vartanian, Baryshnikov, 2013). С другой стороны, наблюдалась экспрессия маркеров, характерных как для стволовой клетки меланомы (СD133, СD271), так и для маркеров стволовой клетки других типов опухоли (СD24, СD44, СD90, СD271 и СD117), что позволяло этим клеткам имитировать поведение ангиобласта (Folberg et al., 2000). На Матригеле Mel Cher клетки формировали СПС. Образованные структуры имели вид упорядоченной сети и сохранялись более 24 ч. Инкубация клеток Mel Cher с низкомолекулярными соединениями позволяла идентифицировать вещества, блокирующие формирование СПС. Также клеточная линия меланомы кожи Mel Cher формировала тубулярные структуры в долгосрочных тестах (до 3 нед.).
При имплантации бестимусным мышам Mel Cher клеток подкожные узлы появлялись на 5 день. К 20 дню средний объем опухоли составил 180 мм3. Гистологическое исследование срезов опухоли, полученных на 25-й день после перевивки, выявила в опухоли PAS-положительные структуры, характерные для опухолей человека (рис. 1а, 1б) (Григорьева и др., 2010; Vartanian et al., 2017).
Рис. 1.
PAS-положительные структуры при меланоме кожи. а – PAS-положительные структуры на гистологических срезах опухоли, б – PAS-положительные структуры в ксенографтах. Масштаб 100 µм.
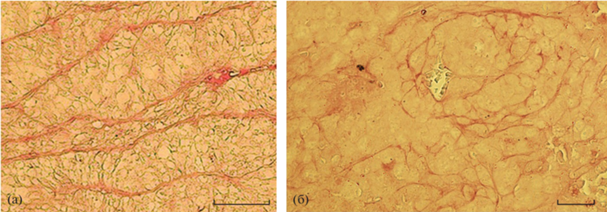
Динамика роста опухоли и гистологические характеристики сохранялись в 3 независимых экспериментах, т.е. получена стабильно перевиваемая ксенографтная модель. Таким образом, клеточная линия меланомы кожи Мel Cher может быть рекомендована в качестве in vitro и in vivo модели ВМ. Мel Cher клетки формируют стабильные СПС на Матригеле. При подкожном введении опухолевых клеток иммунодефицитным мышам формируют опухоль, на гистологических срезах васкулярные каналы визуализуются PAS-окрашиванием (Vartanian et al., 2013).
Впервые о ВМ заговорили в самом конце 1999 г. За прошедшие годы накоплен экспериментальный материал, подтвердивший гипотезу о том, что появление в опухоли ВМ является неблагоприятным фактором, и видимо, может быть инициировано самим терапевтическим воздействием. ВМ – сложный биологический процесс, в который вовлекаются более десяти сигнальных путей. Не определен ее вклад в общую циркуляцию крови в опухоли. Предлагаемые нами in vitro и in vivo модели ВМ существенно расширят возможности исследований в области молекулярных механизмов инициации и роста каналов ВМ в опухоли, а скрининг соединений, ингибирующих ВМ, возможно, позволит повысить эффективность лечения злокачественных заболеваний.
Финансирование. Исследование выполнено при финансовой поддержке Министерста науки и высшего образования Российской Федерации, грант № 075-15-2021-1060.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Вартанян А.А., Степанова Е.В., Барышников А.Ю., Личиницер М.Р. Вовлечение апоптоза в становление васкулогенной мимикрии при злокачественных новообразованиях // Доклады РАН. 2005. Т. 402. № 1. С. 129–132.
Григорьева И.Н., Степанова Е.В., Вартанян А.А., Барышников А.Ю., Михайлова И.Н., Морозова Л.Ф., Бурова О.С. Применение клеточной линии меланомы кожи Mel Cher в качестве положительной модели васкулогенной мимикрии // Патент РФ, RU2402243. Федеральная служба по интеллектуальной собственности, 2010.
Григорьева И.Г., Степанова Е.В., Барышников А.Ю. Клиническое значение васкулогенной мимикрии для больных меланомой кожи // Росс. Биотер Журн. 2011. Т. 10. № 1. С. 22–23.
Михайлова И.Н., Морозова Л.Ф., Голубева В.А., Бурова О.С., Барышников А.Ю. Получение и культивирование клеточных линий меланомы. 2017. С. 15–20. В монографии “Клеточные линии меланомы человека”. Под редакцией Михайловой И.Н. и Давыдова М.И. Санкт-Петербург. Изд. “Наукоемкие технологии”. ISBN 978-5-9909412-3-6.
Оборотова М.В., Бурова О.С., Барышникова М.А., Заботина Т.А, Барышников К.А., Михайлова И.Н., Морозова Л.Ф., Сураева Н.М., Кадагидзе З.Г., Барышников А.Ю. Экспрессия маркеров стволовых опухолевых клеток на клеточных линиях меланомы человека // Росс. Биотер. Журн. 2015. Т. 14. № 1. С. 11–14.
Al-Ostoot F.H., Salah S., Khamees H.A., Khanum S.A. Tumor angiogenesis: Current challenges and therapeutic opportunities // Cancer Treat Res Commun. 2021. V. 28. P. 100422–100426.
Bao Z., Cheng Z., Chai D. The expressions of CD133, ALDH1, and vasculogenic mimicry in osteosarcoma and their clinical significance // Int. J. Clin. Exp. Pathol. 2018. V. 11(7). P. 3656–3663.
Boiko A.D., Razorenova O.V., Johnson D.L., Ly D.P., Butler P.D., Yang G.P., Joshua B., Kaplan M.J., Longaker M.T., Weissman I.L. Human melanoma-initiating cells express neural crest nerve growth factor receptor CD271 // Nature. 2010. V. 466. P. 133–137.
Clarke M.F., Dick J.E., Dirks P.B., Eaves C.J., Jamieson C.H., Jones D.L., Visvader J, Weissman IL, Wahl G.M. Cancer stem cells – perspectives on current status and future directions: AACR workshop on cancer stem cells // Cancer Res. 2006. V. 66. P. 9339–9344.
Cui C., Tang B., Guo J. Chemotherapy, biochemotherapy and anti-VEGF therapy in metastatic melanoma // Chin Clin Oncol. 2014. V. 3(3). P. 36–42.
Dirks P. Cancer stem cells: invitation to a second round // Nature. 2010. V. 466. P. 40–41.
El Alaoui-Lasmaili K., Faivre B. Antiangiogenic therapy: Markers of response, “normalization” and resistance // Crit. Rev. Oncol. Hematol. 2018. V. 128. P. 118–129.
Folberg R., Rummelt R., Parys-Van Ginderdeuren T., Woolson R.F., Pe’er J., Gruman L.M. The prognostic value of tumor blood vessel morphology in primary uveal melanoma // Ophthalmology. 1993. V. 100. P. 1389–1398.
Folberg R., Hendrix M.J.C., Maniotis A.J. Vasculogenic mimicry and tumor angiogenesis // Am. J. Pathol. 2000. V. 156. P. 361–381.
Folberg R., Pe’er J., Gruman L.M., Woolson R.F., Jeng G., Montague P.R., Moninger T.O., Yi H., Moore K.C. The morphologic characteristics of tumor blood vessels as a marker of tumor progression in primary human uveal melanoma: a matched case-control study // Hum Pathol. 1994. V. 23. P. 1298–1305.
Gogas H.J., Kirkwood J.M., Sondak V.K. Chemotherapy for metastatic melanoma: time for a change? // Cancer. 2007. V. 109(3). P. 455–464.
Hendrix M.J., Seftor E.A., Hess A.R., Seftor R.E. Vasculogenic mimicry and tumour-cell plasticity: lessons from melanoma // Nature Reviews Cancer. 2003. V. 3. P. 411–421.
Hendrix M.J., Seftor R.E, Seftor E.A., Gruman L.M., Lee L.M., Nickoloff B.J., Miele L., Sheriff D., Schatteman G.C. Transendothelial function of human metastatic melanoma cells: role of the microenvironment in cell-fate determination // Cancer Res. 2002. V. 62. P. 665–668.
Hooijkaas A.I., Gadiot J., van Boven H., Blank C. Expression of the embryological morphogen Nodal in stage III/IV melanoma // Melanoma Res. 2011. V. 21(6). P. 491–501.
Jászai J., Schmidt M.H.H. Trends and Challenges in Tumor Anti-angiogenic Therapy // Cells. 2019. V. 8(9). P. 1102–1109.
Li F., Xu J., Liu S. Cancer Stem Cells and Neovascularization // Cells. 2021. V. 10(5). P. 1070–1078.
Luo Q., Wang J., Zhao W., Peng Z., Liu X., Li B., Zhang H., Shan B., Zhang C., Duan C. Vasculogenic mimicry in carcinogenesis and clinical applications // J Hematol Oncol. 2020. V. 13(1). P. 19–28.
Maniotis A.J., Folberg R., Hess A., Seftor E.A., Gardner L.M.G., Pe’er J., Trent J.M., Meltzer P.S., Hendrix M.J. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry // Am. J. Pathology. 1999. V. 155(3). P. 739–752.
Meacham C.E., Morrison S.J. Tumour heterogeneity and cancer cell plasticity // Nature. 2013. V. 501(7467). P. 328–337.
Melzer C., von der Ohe J., Hass R. Concise Review: Crosstalk of Mesenchymal Stroma/Stem-Like Cells with Cancer Cells Provides Therapeutic Potential // Stem Cells. 2018. V. 36(7). P. 951–968.
Monzani, E., La Porta C.A. Targeting cancer stem cell to modulate alternative vascularization mechanisms // Stem Cell Rev. 2008. V. 4. P. 51–56.
Najafi M., Mortezaee K., Majidpoo S. Cancer stem cell (CSC) resistance drivers // J. Life Sci. 2019. V. 234. P. 116781–116786.
Ren H.Y., Shen J.X., Mao X.M., Zhang X.Y., Zhou P., Li S.Y., Zheng Z.W., Shen D.Y., Meng J.R. Correlation Between Tumor Vasculogenic Mimicry and Poor Prognosis of Human Digestive Cancer Patients: A Systematic Review and Meta-Analysis // Pathol. Oncol. Res. 2019. V. 25(3). P. 849–858.
Ribatti D., Annese T., Ruggieri S., Tamma R., Crivellato E. Limitations of Anti-Angiogenic Treatment of Tumors // Transl Oncol. 2019. V. 12(7). P. 981–986.
Seftor E.A., Meltzer P.S., Schatteman G.C., Gruman L.M., Hess A.S., Kirschmann D.A., Seftor R.E., Hendrix M.J. Expression of multiple molecular phenotypes by aggressive melanoma tumor cells: role in vasculogenic mimicry // Crit. Rev. Oncol. Hematol. 2002. V. 44(1). P. 17–27.
Shiozawa Y., Nie B., Pienta K.J., Morgan T.M., Taichman R.S. Cancer stem cells and their role in metastasis // Pharmacol. Ther. 2013. V. 138(2). P. 285–293.
Shirakawa K., Kobayashi H., Sobajima J., Hashimoto D., Shimizu H., Wakasugi H. Inflammatory breast cancer: vasculogenic mimicry and its hemodynamics of an inflammatory breast cancer xenograft // Breast Cancer Res. 2003. V. 5. P. 136–139.
Sun B., Zhang D., Zhan S., Zhang W., Guo H., Zhao X. Hypoxia influences vasculogenic mimicry channel formation and tumor invasion-related protein expression in melanoma // Cancer. 2007. V. 249. P. 188–197.
Sun H., Yao N., Cheng S., Li L., Liu S., Yang Z., Shang G., Zhang D., Yao Z. Cancer stem-like cells directly participate in vasculogenic mimicry channels in triple-negative breast cancer // Cancer. Biol. Med. 2019. V. 16(2). P. 299–311.
Tímár J., Tóth J. Tumor sinuses – vascular channels // Pathol. Oncol. Res. 2000. V. 6. P. 83–86.
Treps L., Faure S., Clere N. Vasculogenic mimicry, a complex and devious process favoring tumorigenesis – Interest in making it a therapeutic target // Pharmacol. Ther. 2021. V. 223. P. 107805–107813.
Van der Schaft D.W.J., Seftor R.E., Seftor E.A., Hess A.R., Gruman L.M., Kirschmann D.A., Yokoyama Y., Griffioen A.W., Hendrix M.J. Effects of angiogenesis inhibitors on vascular network formation by human endothelial and melanoma cells // J. Natl. Cancer. Inst. 2004. V. 96(19). P. 1473–1477.
Vartanian A.A., Burova O.S., Stepanova E.V., Baryshnikov A.Yu. The involvement of apoptosis in melanoma vasculogenic mimicry // Melanoma Res. 2007. V. 17(1). P. 1–8.
Vartanian A., Baryshnikov A. Molecular determinants of melanoma vasculogenic mimicry. in “Melanoma, risk factor, molecular biology, and treatment options”.2013. P. 67–92. Eds. A.C. Jones. N.Y. NOVA BioMedical Press.
Vartanian A., Gatsina G., Grigorieva I., Solomko E., Dombrovsky V., Baryshnikov A., Stepanova E. The involvement of Notch signaling in melanoma vasculogenic mimicry // Clin. Exp. Med. 2013. V. 13(3). P. 201–219.
Vartanian A, Golubeva I., Shprakh Z. Is vasculogenic mimicry a hallmark of cancer? // Horizons in Cancer Res. 2017. V. 65. P. 13–34.
Vartanian A., Baryshnikova M., Burova O., Afanasieva D., Misyurin V., Belyavsky A., Shprakh Z. Inhibitor of vasculogenic mimicry restores sensitivity of resistant melanoma cells to DNA-damaging agents // Melanoma Res. 2017. V. 27(1). P. 8–16.
Vartanian A.A., Khochenkov D.A., Khochenkova Yu.A., Machkova Yu.S., Khachatryan D.S., Kolotaev A.V., Osipov V.N. Effect of Derivatives of Hydroxamic Acids on Vasculogenic Mimicry // Bioorg. Chem. 2020. V. 46(2). P. 207–219.
Woodward W.A., Hill R.P. Cancer Stem Cells. Recent Results // Cancer Res. 2016. V. 198. P. 25–44.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


