Почвоведение, 2023, № 1, стр. 89-101
Биологическая активность чернозема выщелоченного при нефтяном и хлоридно-натриевом загрязнении и влияние на нее обработки галотолерантными бактериями-нефтедеструкторами
Е. В. Кузина a, Г. Ф. Рафикова a, С. Р. Мухаматдьярова a, Ю. Ю. Шарипова a, Т. Ю. Коршунова a, *
a Уфимский институт биологии УФИЦ РАН
450054 Уфа, пр. Октября, 69, Россия
* E-mail: korshunovaty@mail.ru
Поступила в редакцию 24.05.2022
После доработки 28.06.2022
Принята к публикации 28.07.2022
- EDN: JKECKN
- DOI: 10.31857/S0032180X22600718
Аннотация
Загрязнение почв нефтью часто сопровождается загрязнением сточными водами нефтепромыслов, содержащими значительное количество NaCl, что усиливает негативное воздействие углеводородов на почву, растения и почвенную микробиоту. Поэтому для биотехнологической очистки таких комплексно контаминированных почв следует использовать устойчивые к засолению углеводородокисляющие бактерии. В модельном эксперименте изучено влияние искусственного загрязнения нефтью (5%) и хлоридом натрия (1 и 3%) и их сочетаниями, а также биоремедиации с использованием галотолерантных углеводородокисляющих бактерий на биологическую активность чернозема выщелоченного (Luvic Chernozem). Контаминация почвы всеми видами загрязнения увеличивала ее фитотоксичность, при этом бактеризация не оказывала положительного эффекта на этот показатель в присутствии NaCl, а также при комбинированном загрязнении, но способствовала уменьшению токсичности для растений нефтесодержащей почвы. Наиболее чувствительными к присутствию нефти и/или NaCl были актиномицеты, численность которых уменьшалось на 1–2 порядка. Интродукция микроорганизмов усиливала разложение углеводородов, в том числе в комплексно загрязненной почве на 10.5–31.8%. Наличие поллютантов подавляло активность почвенных ферментов. Бактеризация способствовала некоторому повышению уровня активности каталазы в почве с нефтью, восстанавливала активность уреазы в нефтесодержащей почве и при совместном действии поллютантов и увеличивала активность инвертазы при комбинированном загрязнении.
ВВЕДЕНИЕ
В настоящее время и в среднесрочной перспективе углеводороды остаются основным источником энергии на планете. В ходе их извлечения и переработки на все компоненты окружающей среды оказывается значительное негативное воздействие [53, 64]. Особенно сильно из всех природных сред страдает почва, причем не только там, где непосредственно происходит процесс добычи, но и на близлежащих территориях, на которых расположены многочисленные коммуникации и промысловые объекты.
Контаминация углеводородами зачастую сопровождается дополнительным загрязнением высокоминерализованными нефтепромысловыми сточными водами (НПСВ), способствующими техногенному засолению почв [4]. Они включают в себя пластовые, то есть извлекаемые вместе с нефтью подземные воды, составляющие 80‒95% объема НПСВ, и производственные сточные воды, образующиеся в процессе сбора, транспортировки и первичной подготовки нефти. Значительная часть солевого компонента НПСВ приходится на хлориды [1], в основном на хлорид натрия [2, 3, 17]. Одновременное присутствие в почве нефти и NaCl приводит к тому, что отрицательные последствия, вызванные углеводородами [26, 32, 55], усугубляются хлоридом натрия, который, в свою очередь, угнетает рост и развитие растений, подавляет жизнедеятельность почвенной микробиоты и ингибирует активность ферментов [12, 38, 42]. Все вышеизложенное затрудняет применение для биотехнологической очистки почв, подвергшихся такому комбинированному загрязнению, микроорганизмов, не являющихся представителями автохтонной микробиоты, адаптированной к выживанию в условиях высокой минерализации среды [33, 38, 42, 56]. Выходом из сложившейся ситуации может стать проведение восстановительных работ с помощью галотолерантных бактерий-нефтедеструкторов. Наиболее информативными критериями для оценки состояния почвы до и после биоремедиации являются биологические показатели, которые первыми реагируют на внешнее воздействие и, как правило, коррелируют с содержанием загрязняющего вещества [28, 36, 55].
Цель работы – исследование влияния обработки галотолерантными бактериями-нефтедеструкторами на содержание углеводородов, фитотоксичность, ферментативную активность и численность некоторых эколого-трофических групп микроорганизмов чернозема выщелоченного, загрязненного нефтью и хлоридом натрия.
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследования. Исследовали верхний горизонт (0–20 см) почвы (чернозем выщелоченный (Luvic Chernozem)), отобранной на территории Уфимского района Республики Башкортостан и имеющей следующие характеристики: гумус – 6.8%, pHKCl – 6.40, Nвал – 0.61%, подвижные P2O5 и K2O (0.2 н. KCl) – 94.5 и 101.7 мг/кг почвы соответственно. Предварительно очищенную от растительных остатков, высушенную до воздушно-сухого состояния и просеянную через сито (размер ячеек 1 см) почву помещали по 3 кг в вегетационные сосуды. Для оптимизации водно-воздушного режима использовали дренаж, в течение опыта поддерживали влажность на уровне 60% от полной влагоемкости и проводили регулярное рыхление. В опытные варианты вносили нефть (плотность – 852 кг/м3, вязкость – 28 мПа с, состав (мас. %): парафины – 3.3, смолы – 8.5, асфальтены – 5–9 (мас. %)) в количестве 50 г/кг почвы (5 мас. %). Хлоридно-натриевое засоление имитировали путем внесения водного раствора соли из расчета 1 и 3% NaCl (х. ч.) от веса почвы. Интродукцию микроорганизмов осуществляли в виде жидкой культуры в количестве 2 × 106 КОЕ (колониеобразующих единиц) на 1 г почвы. В те варианты, в которые не было предусмотрено добавление соли и/или инокулята, вносили соответствующее количество дистиллированной воды. Повторность опыта трехкратная. Контролем служила почва без добавок NaCl, нефти и бактерий. Отбор проб проводили в начале (третьи сутки) и в конце эксперимента (95-е сутки). Образцы сушили на воздухе и просеивали через сито с размером ячеек 2 мм.
Штаммы микроорганизмов. Для биоремедиации использовали бактерии из коллекции микроорганизмов Уфимского Института биологии УФИЦ РАН: Thalassospira xiamenensis UOM 2 (UOM 2), Enterob-acter sp. UOM 3 (UOM 3), Pseudomonas songnenensis UOM 4 (UOM 4), обладающие углеводородокисляющей активностью [21, 27] и микробную композицию (МК), состоящую из всех вышеперечисленных штаммов в соотношении 1 : 1 : 1.
Бактерии культивировали на термостатируемом шейкере при 180 об./мин и температуре 28°C в течение 72 ч на мясо-пептонном бульоне [15]. Предварительно установлено, что микроорганизмы обладали устойчивостью к хлориду натрия (5–7%) и не проявляли антагонизма по отношению друг к другу. Численность каждого штамма при культивировании на среде Раймонда [58] с нефтью (5%) и NaCl (3%) через 3 сут составляла не менее 107 КОЕ/мл, что свидетельствовало о способности бактерий к разложению нефти в присутствии хлорида натрия.
Анализ численности учитываемых эколого-трофических групп микроорганизмов осуществляли путем высева почвенной суспензии на агаризованные питательные среды: гетеротрофных – на мясо-пептонный агар, углеводородокисляющих (УВОМ) – на среду Раймонда со 100 мкл стерильного дизельного топлива в качестве источника углерода, актиномицетов – на крахмало-аммиачный агар, микромицетов – на подкисленную среду Чапека, олигонитрофилов и азотфиксаторов – на среду Эшби [15].
Фитотоксичность образцов почвы оценивали на влажных почвенных пластинках по всхожести семян и росту корней растений редиса (Raphanus sativus L.) согласно ФР.1.39.2006.02264. Фитотоксический эффект (ФЭ) тест-функции (%) рассчитывали, как отношение разности показателя в контроле и в испытуемой почве к показателю в контроле.
Кислотность почвы (pHKCl) определяли потенциометрически согласно ГОСТ 26483-85.
Активность каталазы анализировали газометрически по методу Галстяна, инвертазы – по Галстяну путем определения количества редуцирующих сахаров, уреазы – калориметрически по методу Щербакова и Райхинштейна [19].
Содержание нефтепродуктов в почве устанавливали гравиметрически как описано [50].
Статистическую обработку данных проводили с помощью стандартных программ MS Excel. Достоверность различий оценивали по t-критерию Стьюдента (p < 0.05). Данные на рисунках и в таблицах представлены как среднее ± стандартная ошибка. Взаимосвязь между параметрами рассчитывали с помощью корреляционного анализа (коэффициент корреляции Пирсона (r) по шкале Чеддока).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
рН почвы является одним из ключевых факторов для роста и развития микроорганизмов [24, 51, 65]. Степень кислотности, определяемой в солевой вытяжке, в контрольной почве была нейтральной (6.40–6.42) (табл. 1). В вариантах, загрязненных нефтью без внесения NaCl (включая варианты с бактеризацией), на третьи и 95-е сутки эксперимента она составляла 6.35–6.41 и 6.10–6.37 соответственно. Некоторое уменьшение показателей pH в процессе очистки могло произойти в результате постепенного разложения нефтяных углеводородов до органических кислот [56, 60]. Внесение хлорида натрия в количестве 1 и 3% усиливало подкисление среды в начале опыта до 5.91–6.15, что объясняется перестройкой почвенно-поглощающего комплекса. Внедрение в него Na+ сопровождается активным вытеснением и выходом в почвенный раствор обменных Н+ и А13+. Присутствие свободного иона Cl‒ в почвенном растворе приводит к тому, что наряду с остаточным количеством нейтрального NaCl в нем появляются такие соединения, как HCl и AlCl3, дополнительно подкисляющие почву [3]. К концу экспозиции наблюдалось подщелачивание среды, что, скорее всего, связано с высокой кислотно-основной буферностью черноземов [9, 13] и приближение водородного показателя к значениям, характерным для контрольной почвы. Таким образом, поступление нефти и NaCl отдельно и совместно приводит к изменению кислотно-основных свойств почвы. Тем не менее, реакция среды оставалась благоприятной для микроорганизмов, так как pH в пределах 6–8 считается оптимальным для их роста и развития [51, 54].
Таблица 1.
Численность некоторых эколого-трофических групп микроорганизмов и рН чернозема выщелоченного
| Вариант опыта | Гетеротрофные микроорганизмы, ×106 КОЕ/г |
Углеводородокисляющие микроорганизмы, ×105 КОЕ/г |
Актиномицеты, ×105 КОЕ/г |
Микромицеты, ×104 КОЕ/г |
Олигонитрофильные и азотфиксирующие микроорганизмы, ×105 КОЕ/г |
pHKCl | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| сутки | ||||||||||||
| 3 | 95 | 3 | 95 | 3 | 95 | 3 | 95 | 3 | 95 | 3 | 95 | |
| Контроль | 1.0 ± 0.1 | 5.0 ± 0.2 | 0.1 ± 0.004 | 0.2 ± 0.008 | 90.0 ± 4.60 | 80.0 ± 3.60 | 5.0 ± 0.30 | 1.5 ± 0.10 | 5.0 ± 0.30 | 3.2 ± 0.10 | 6.40 | 6.42 |
| НЗП | 2.0 ± 0.1 | 100.0 ± 4.8 | 2.0 ± 0.090 | 100.0 ± 4.700 | 11.0 ± 0.60 | 1.0 ± 0.04 | 2.5 ± 0.10 | 0.3 ± 0.01 | 1.2 ± 0.10 | 0.8 ± 0.03 | 6.35 | 6.19 |
| НЗП + UOM 2 | 12.0 ± 0.5 | 310.0 ± 14.2 | 9.0 ± 0.400 | 360.0 ± 17.600 | 5.0 ± 0.20 | 1.0 ± 0.03 | 0.5 ± 0.02 | 0.1 ± 0.01 | 3.7 ± 0.10 | 3.1 ± 0.20 | 6.39 | 6.21 |
| НЗП + UOM 3 | 8.0 ± 0.3 | 120.0 ± 5.1 | 3.0 ± 0.100 | 54.0 ± 2.400 | 3.5 ± 0.10 | 0.5 ± 0.02 | 0.7 ± 0.02 | 0.2 ± 0.01 | 4.2 ± 0.30 | 1.9 ± 0.10 | 6.38 | 6.10 |
| НЗП + UOM 4 | 9.0 ± 0.4 | 145.0 ± 5.7 | 3.0 ± 0.100 | 71.0 ± 3.200 | 0.5 ± 0.03 | 0.1 ± 0.01 | 1.0 ± 0.04 | 0.3 ± 0.02 | 3.3 ± 0.20 | 0.3 ± 0.02 | 6.37 | 6.16 |
| НЗП + МК | 5.0 ± 0.2 | 150.0 ± 6.1 | 3.0 ± 0.200 | 40.0 ± 1.800 | 1.1 ± 0.03 | 0.5 ± 0.02 | 0.8 ± 0.02 | 0.1 ± 0.01 | 0.2 ± 0.01 | 0.1 ± 0.01 | 6.41 | 6.37 |
| Контроль + 1% NaCl | 1.0 ± 0.1 | 2.0 ± 0.2 | 0.1 ± 0.003 | 0.1 ± 0.002 | 6.0 ± 0.40 | 3.4 ± 0.10 | 2.2 ± 0.10 | 1.0 ± 0.02 | 2.9 ± 0.20 | 1.4 ± 0.10 | 6.15 | 6.31 |
| Контроль + 3% NaCl | 2.0 ± 0.1 | 1.3 ± 0.1 | 0.1 ± 0.002 | 0.1 ± 0.003 | 1.0 ± 0.03 | 0.3 ± 0.02 | 0.9 ± 0.01 | 0.5 ± 0.01 | 0.9 ± 0.01 | 0.5 ± 0.01 | 5.94 | 6.29 |
| НЗП + 1% NaCl | 1.5 ± 0.1 | 6.0 ± 0.3 | 3.0 ± 0.100 | 16.0 ± 2.100 | 4.0 ± 0.10 | 4.0 ± 0.30 | 2.0 ± 0.10 | 0.8 ± 0.02 | 2.7 ± 0.01 | 1.4 ± 0.20 | 5.98 | 6.36 |
| НЗП + 1% NaCl + UOM 2 | 2.3 ± 0.2 | 1.9 ± 0.2 | 2.1 ± 0.100 | 15.0 ± 1.400 | 3.5 ± 0.10 | 2.7 ± 0.10 | 2.0 ± 0.10 | 0.9 ± 0.01 | 4.2 ± 0.10 | 4.6 ± 0.04 | 5.96 | 6.30 |
| НЗП + 1% NaCl + UOM 3 | 3.1 ± 0.1 | 5.7 ± 0.3 | 3.9 ± 0.200 | 19.0 ± 1.100 | 4.5 ± 0.20 | 1.8 ± 0.20 | 1.0 ± 0.04 | 1.2 ± 0.10 | 5.7 ± 0.10 | 6.3 ± 0.30 | 6.03 | 6.28 |
| НЗП + 1% NaCl + UOM 4 | 4.7 ± 0.2 | 8.4 ± 0.3 | 3.2 ± 0.300 | 36.2± 1.500 | 5.4 ± 0.20 | 2.5 ± 0.20 | 1.8 ± 0.20 | 1.3 ± 0.10 | 5.1 ± 0.20 | 3.4 ± 0.20 | 5.91 | 6.33 |
| НЗП + 1% NaCl + МК | 4.0 ± 0.1 | 2.7 ± 0.1 | 6.0 ± 0.400 | 9.7 ± 0.700 | 1.9 ± 0.10 | 2.4 ± 0.30 | 2.1 ± 0.04 | 1.1 ± 0.03 | 1.0 ± 0.01 | 3.6 ± 0.10 | 5.98 | 6.29 |
| НЗП + 3% NaCl | 5.2 ± 0.2 | 2.8 ± 0.2 | 1.0 ± 0.030 | 11.3 ± 0.500 | 1.0 ± 0.02 | 1.2 ± 0.03 | 0.5 ± 0.01 | 0.3 ± 0.01 | 1.0 ±0.02 | 0.7 ± 0.02 | 5.94 | 6.30 |
| НЗП + 3% NaCl + UOM 2 | 2.1 ± 0.1 | 1.0 ± 0.1 | 2.9 ± 0.200 | 8.3± 0.200 | 1.4 ± 0.10 | 1.7 ± 0.03 | 0.5 ± 0.02 | 0.2 ± 0.01 | 1.2 ± 0.10 | 1.0 ± 0.02 | 5.96 | 6.24 |
| НЗП + 3% NaCl + UOM 3 | 3.0 ± 0.1 | 2.6 ± 0.2 | 3.1 ± 0.100 | 9.0 ± 0.500 | 2.2 ± 0.10 | 1.6 ± 0.20 | 0.7 ± 0.01 | 0.7 ± 0.02 | 1.7 ± 0.20 | 2.1 ± 0.10 | 5.91 | 6.23 |
| НЗП + 3% NaCl + UOM 4 | 4.3 ± 0.2 | 1.1 ± 0.1 | 2.1 ± 0.100 | 10.0 ± 0.400 | 1.1 ± 0.03 | 1.2 ± 0.03 | 0.2 ± 0.01 | 0.6 ± 0.01 | 2.1 ± 0.20 | 1.4 ±0.10 | 5.96 | 6.27 |
| НЗП + 3% NaCl + МК | 1.7 ± 0.1 | 1.0 ± 0.1 | 5.0 ± 0.200 | 11.2 ± 0.500 | 1.7 ± 0.10 | 1.3 ± 0.02 | 0.1 ± 0.01 | 0.1 ± 0.01 | 2.2 ± 0.10 | 2.5 ± 0.20 | 5.92 | 6.27 |
Численность эколого-трофических групп микроорганизмов. На попадание поллютантов в почву первой реагирует микробиота, при этом уже на начальных этапах загрязнения изменяется ее состав и плотность популяции, а также метаболизм [14]. Поэтому численность микроорганизмов является важным показателем биологической активности почвы, который свидетельствует о ее состоянии. Загрязнение нефтью приводило к значительному возрастанию количества гетеротрофных микроорганизмов (в 20 раз), что, скорее всего, связано с присутствием дополнительного источника углерода в виде углеводородов (табл. 1). Наибольший вклад в увеличение численности данной группы вносили УВОМ, плотность популяции которых выросла на 3 порядка (высокая степень корреляции, r = 0.89, p > 99%). Обработка изучаемыми штаммами (особенно UOM 2) на фоне нефти, также сопровождалась ростом популяций гетеротрофных и углеводородокисляющих микроорганизмов, вероятно, за счет активного развития интродуцированных бактерий-деструкторов.
Внесение как в чистую, так и в нефтезагрязненную почву NaCl, особенно в 3%-ной концентрации, вызывало уменьшение численности всех изучаемых групп микроорганизмов, что подтверждает данные о негативном воздействии этого вещества на рост и разнообразие микроорганизмов [42, 56].
Наиболее заметный отклик на присутствие нефти и хлорида натрия (в том числе совместное) наблюдался у представителей порядка Actinomycetales – их количество уменьшалось на 1–2 порядка по сравнению с контролем. Вероятная причина этого в том, что они плохо переносят загрязнение углеводородами [29, 41, 61] и чутко реагируют на изменение кислотности среды [6]. Возможно, в составе актиномицетного комплекса изначально превалировали виды, имеющие более узкий диапазон значений pH среды, пригодных для роста.
Количество микроскопических грибов снижалось на протяжении всего эксперимента (не более чем на один порядок). В вариантах с бактеризацией это могло быть связано с конкуренцией между УВОМ и микромицетами за источники углерода.
Внесение в почву нефти и/или хлорида натрия вызывало некоторое уменьшение суммарного количества (в пределах одного порядка) олигонитрофильных и азотфиксирующих микроорганизмов. Скорее всего, причиной такой реакции является изменение соотношения C : N в загрязненной почве в сторону углерода, что приводит к ухудшению доступности азота как источника питания для этих групп микроорганизмов. Интродукция УВОМ способствовала увеличению численности олигонитрофильных и азотфиксирующих микроорганизмов в ряде случаев. Данный показатель был равен или даже несколько превышал контрольные значения при обработке штаммом UOM 2 почвы с нефтью и всеми тремя штаммами и МК ‒ почвы с нефтью и NaCl (1%). Это, вероятно, связано с активным разложением углеводородов в случае применения указанных бактерий (рис. 1), нормализовавшим углеродно-азотный баланс в почве.
Биодеструкция углеводородов. Самоочищение как комплексно загрязненной почвы, так и той, в которой присутствовала только нефть, происходило с одинаковой интенсивностью – биодеградация углеводородов к концу эксперимента составляла 51.8–53.0% соответственно. Общеизвестно, что уменьшение содержания органических поллютантов происходит в основном за счет биоразложения [14, 38], хотя физико-химические процессы (испарение, сорбция и пр.) также могут вносить свой вклад [49]. В настоящем эксперименте интродукция галотолерантных бактерий ускоряла деструкцию углеводородов (на 10.5–30.8% – в нефтезагрязненной почве, на 17.6–31.8% и 16.6–27.6% – в почве с нефтью и NaCl (1 и 3% соответственно). Наиболее эффективно на фоне нефти зарекомендовал себя штамм UOM 2, благодаря применению которого деградация углеводородов достигла 83.8%. В условиях хлоридно-натриевого засоления самые высокие показатели зафиксированы для штамма UOM 4 (79.4 и 84.2%), а UOM 2 и UOM 3 проявили себя одинаково (75.3–77.0 и 68.4–69.8% в присутствии 1 и 3% NaCl соответственно). Обработка МК во всех вариантах опыта приводила к более низким результатам (63.5–70.0%), чем интродукция отдельных штаммов, но все равно была более действенной, чем самоочищение.
Считается, что содержание хлорида натрия является основным фактором, влияющим на процесс биоремедиации нефтяных углеводородов в почве, так как стресс, вызванный возрастанием осмотического потенциала клеток из-за повышенного содержания соли, приводит к торможению разложения загрязняющих веществ [34, 47, 49]. Однако в работе [30] обнаружено, что низкий уровень NaCl (0.3%) незначительно усиливал скорость минерализации гексадекана в арктической почве, а Звягинцевой с соавт. [67] показано, что деградация турбинного масла культурами Rhodococcus erythropolis и Dietzia maris увеличивалась при содержании в среде 0.5 и 2.5% NaCl соответственно. Такое стимулирующее влияние может объясняться тем, что некоторое количество соли обеспечивает более ионно-сбалансированную среду для микроорганизмов или способствует диспергированию глинистых минералов в почве [35] и тем самым создает большую площадь поверхности для прикрепления бактериальных клеток или для доступа к микроэлементам. В настоящем исследовании положительное воздействие малой концентрации хлорида натрия (1%) на разложение нефти наблюдалось при использовании штаммов UOM 3 и UOM 4. Эффективность биодеструкции в этих вариантах была несколько выше (72.0 и 84.2% соответственно), чем при использовании указанных бактерий в почве только с нефтью (65.8 и 79.8%) и в почве с нефтью, содержащей 3% NaCl (68.4 и 79.4%) (рис. 1).
Фитотоксичность активно используется в качестве показателя, оценивающего уровень загрязнения почв поллютантами [10, 44, 62, 63]. Согласно ФР.1.39.2006.02264, выделяют 5 степеней (классов) токсичности почв: практически не токсичные (снижение всхожести семян и угнетение роста корней по сравнению с контрольной пробой в пределах 20%), мало- и умеренно токсичные, опасно токсичные и высоко опасно токсичные (угнетение 20–40, 40–60, 60–80 и 80–100% соответственно). В конце опыта всхожесть семян и удлинение корня в контрольной почве составили 93.3 и 98.0% соответственно, тогда как в нефтезагрязненной – только 63.1 и 46.2% (табл. 2), что объясняется прямым токсическим действием углеводородов, а также образованием на поверхности семян нефтяной пленки, уменьшающей доступность воды и препятствующей процессу прорастания [25, 39]. На фоне нефти интродукция УВОМ положительно сказывалась на измеряемых показателях растений, переводя контаминированную почву из умеренно токсичной в категорию малотоксичных и практически не токсичных (в случае штамма UOM 2), что, вероятно, связано с увеличением скорости биоразложения углеводородов и, как следствие, уменьшением количества токсичных компонентов нефти [39].
Таблица 2.
Фитотоксичность чернозема выщелоченного в конце эксперимента
| Вариант опыта | Всхожесть семян | ФЭ | Удлинение корня | ФЭ | Средний ФЭ по двум тест-функциям | Токсичность проб |
|---|---|---|---|---|---|---|
| % | ||||||
| Контроль | 93.3 | – | 98.0 | – | – | – |
| НЗП | 63.1 | 32.4 | 46.2 | 52.9 | 42.7 | Умеренно токсичная |
| НЗП + UOM 2 | 92.4 | 0 | 74.5 | 24.0 | 12.0 | Практически не токсичная |
| НЗП + UOM 3 | 74.8 | 19.8 | 70.3 | 28.3 | 24.1 | Малотоксичная |
| НЗП + UOM 4 | 82.2 | 11.9 | 67.0 | 31.6 | 21.8 | Малотоксичная |
| НЗП + МК | 79.4 | 14.9 | 62.0 | 36.7 | 25.8 | Малотоксичная |
| Контроль + 1% NaCl | 58.3 | 37.5 | 8.6 | 91.2 | 64.4 | Опасно токсичная |
| НЗП + 1% NaCl | 59.0 | 36.8 | 18.0 | 81.6 | 59.2 | Умеренно токсичная |
| НЗП + 1% NaCl + UOM 2 | 75.2 | 19.4 | 20.5 | 79.1 | 49.3 | Умеренно токсичная |
| НЗП + 1% NaCl + UOM 3 | 65.1 | 30.2 | 19.0 | 80.6 | 55.4 | Умеренно токсичная |
| НЗП + 1% NaCl + UOM 4 | 66.7 | 28.5 | 20.0 | 79.6 | 54.1 | Умеренно токсичная |
| НЗП + 1% NaCl + МК | 60.0 | 35.7 | 22.0 | 77.6 | 56.7 | Умеренно токсичная |
Известно, что отрицательное воздействие хлорида натрия сказывается на растениях уже на самых ранних этапах развития, в период набухания и прорастания семян [38]. Причиной этого является вызываемое им повышение осмотического потенциала клеток, снижение скорости поглощения воды, ионный дисбаланс и т.п. [22].
Внесение NaCl в количестве 3% полностью подавляло всхожесть и прорастание семян во всех вариантах опыта, делая почву полностью непригодной для роста и развития растений редиса (данные в табл. 2 не представлены). 1%-ное содержание NaCl вызывало уменьшение всхожести (до 58.3 и 59.0%) и резкое сокращение длины корней (до 8.6 и 18.0%) как в контрольной, так и в нефтезагрязненной почве. В результате этого контрольная почва по степени фитотоксичности перешла в класс опасно токсичных, а нефтесодержащая почва стала считаться умеренно токсичной (табл. 2). Применение бактерий привело к некоторому уменьшению среднего ФЭ по двум тест-функциям в комплексно загрязненной почве (с 59.2 до 49.3–56.7), которое оказалось недостаточным для отнесения почвы к классу малотоксичных.
Ферментативная активность почвы. Важнейшим звеном в ходе восстановления почв являются почвенные ферменты, которые катализируют специфические процессы биодеградации загрязняющих веществ [20, 55]. Реактивность ферментов является объективным показателем биологической активности почвы, отражающим интенсивность и направленность протекающих биохимических процессов. Она предложена как потенциальный индикатор качества почвы из-за ее связи с почвенной биотой, легкости определения и быстрого отклика на присутствие различных поллютантов [37, 43]. Однако данные о связи между уровнем загрязнения и ферментативной активностью трудно интерпретировать из-за высокой лабильности последней [31], поэтому на сегодняшний день для проведения экологических исследований не существует единого перечня почвенных ферментов и методов их определения. Но большинство авторов сходятся в том, что необходимо изучать активность комплекса ферментов, среди которых должны быть представители окислительно-восстановительных и гидролитических ферментов [23].
Активность каталазы. Деструкция нефти в почве является результатом окислительно-восстановительных процессов, происходящих в основном при участии ферментов класса оксидоредуктаз. Входящая в него каталаза ускоряет разложение образующегося в процессе биологического окисления (в том числе нефти [48]) пероксида водорода на воду и молекулярный кислород, тем самым обеспечивая им микроорганизмы, участвующие в процессах разложения углеводородов. Каталаза относится к числу индикаторных ферментов: ее активность, наряду с численностью основных групп почвенной микробиоты, отражает интенсивность процессов очищения почвы от нефти [7, 11]. На начальном этапе эксперимента в нефтезагрязненной почве происходило увеличение каталазной активности (КА), однако на 95-е сутки ее значения были ниже контрольных показателей в 1.4–2.1 раза (рис. 2a), что свидетельствует об отрицательном воздействии углеводородов и промежуточных продуктов их распада на активность данного фермента [46, 55].
Рис. 2.
Активность каталазы (а), уреазы (b) и инвертазы (c) чернозема выщелоченного в начале и конце эксперимента.
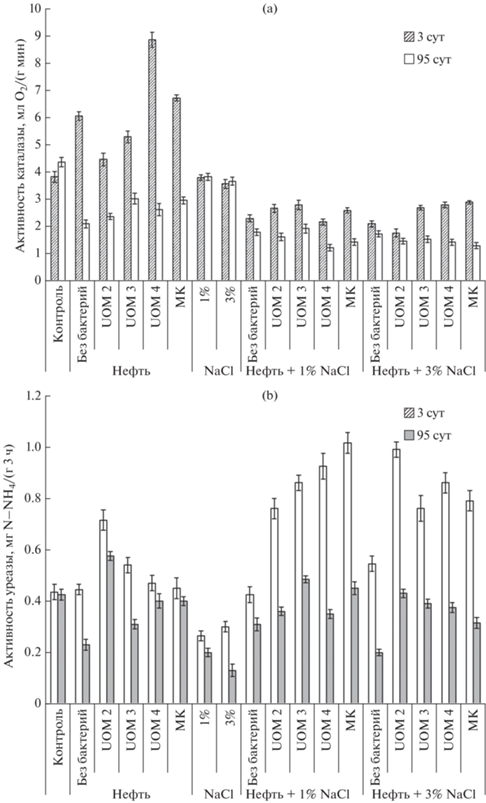
Рис. 2.
Окончание

Бактеризация способствовала некоторому повышению КА в конце опыта по сравнению с вариантом без интродукции микроорганизмов, вероятно, за счет биодеградации поллютанта [66].
Показатели КА в почве с 1 и 3% NaCl были близки, а их начальные и конечные значения практически не менялись (3.8–3.8 и 3.6–3.7 мл О2/(г мин) соответственно), что указывает на стабильность почвенных условий на фоне засоления. КА в почве с хлоридом натрия на третьи сутки опыта была сопоставима, а на 95-е сутки – меньше, чем в контроле, что соответствует данным других исследователей [5]. В почве только с NaCl, активность фермента в конце опыта была больше, чем в почве с нефтью (с бактеризацией и без нее).
Одновременное присутствие нефти и хлорида натрия приводило к максимальному снижению активности фермента по сравнению с другими вариантами. При этом существенных отличий в КА в нефтезагрязненной почве с 1- или 3%-ным содержанием NaCl (с интродукцией микроорганизмов и без нее) не обнаружено, ее значения находились в пределах 1.77–2.90 и 1.23–1.93 мл О2/(г мин) в начале и конце эксперимента соответственно. Возможной причиной более высокой КА в почве с нефтью (2.10–3.03 мл О2/(г мин)) по сравнению с таковой в почве с комплексным загрязнением является то, что рН в нефтесодержащей почве (с интродукцией бактерий и без нее) была слабокислая, а по мнению некоторых авторов [8], в слабокислых почвах активность каталазы несколько выше, чем в щелочных.
Активность уреазы. Уреаза – это фермент, который катализирует гидролиз мочевины до аммиака и углекислого газа, тем самым способствуя преобразованию органического азота в почве. На третьи и 95-е сутки эксперимента уреазная активность (УА) в контрольной почве была одинаковой (рис. 2b). Внесение нефти не оказало влияния на этот показатель в начале опыта, однако после его завершения значения УА снизились практически в 2 раза. Считается, что изменение активности уреазы находится в соответствии с ростом численности гетеротрофных микроорганизмов [18], но в настоящем испытании степень корреляции между этими показателями была слабой (r = 0.41, p > 95%).
Ранее было обнаружено отрицательное воздействие загрязнения нефтью и нефтепродуктами на УА почвы [48], которое может быть результатом прямого токсического действия углеводородов на микроорганизмы и/или следствием ухудшения физических и химических свойств почвы (например, рН) в результате загрязнения. Бактеризация способствовала поддержанию реактивности фермента на уровне, сопоставимом с контрольным, а в начале эксперимента даже стимулировала ее. Особенно эффективно зарекомендовал себя штамм UOM 2, при использовании которого УА составила 0.72 и 0.58 мг N–NH4/(г 3 ч).
В настоящем исследовании, как и в некоторых других работах [40], выявлено ингибирующее влияние засоления на активность уреазы. Одновременное загрязнение нефтью и хлоридом натрия в обеих концентрациях приводило в начале опыта к возрастанию УА до контрольного значения и выше с последующим снижением на 95-е сутки эксперимента. Обработка бактериями в условиях комбинированного загрязнения (независимо от содержания NaCl) изначально стимулировала активность фермента, которая в 1.7–2.3 раза превышала таковую в контроле. К концу экспозиции УА уменьшалась в 1.8–2.8 раза и была меньше или сопоставима с контрольными значениями. Депрессия реактивности уреазы на завершающем этапе биоремедиации может быть связана с массовым потреблением микроорганизмами питательных веществ и уменьшением количества легкоразлагаемых компонентов нефти при увеличении содержания труднодоступных фракций [18], а также с образованием промежуточных продуктов с высокой токсичностью на протяжении всего процесса очистки [59] или ослаблением биохимических процессов обмена азотсодержащих соединений. Еще одной причиной первоначального увеличения и последующего ингибирования УА может быть подкисление, а потом подщелачивание среды [52].
Активность инвертазы. Инвертаза гидролизует сахарозу с образованием глюкозы и фруктозы, которые представляют источник питания для микроорганизмов. Высокий уровень активности этого фермента способствует развитию микробной биомассы и поддерживает определенный уровень биогенности почвы. Как и в предыдущих исследованиях [45], нами была обнаружена корреляционная зависимость между инвертазной активностью (ИА) и общей численностью микроорганизмов в почве (r = 0.75, p > 95%).
Внесение нефти приводило к уменьшению активности инвертазы (рис. 2c), что уже было показано в работе [16]. Наиболее вероятное объяснение этого явления заключается в том, что, инвертаза – экстрацеллюлярный фермент и разрушение некоторой части бактериальных клеток под воздействием поллютанта может вызвать сокращение ее продукции и, соответственно, уменьшение ИА почвы [57]. Интродукция микроорганизмов не оказала положительного влияния на реактивность фермента, за исключением случая с применением штамма UOM 2 (95-е сутки).
Внесение хлорида натрия в обеих концентрациях вызывало ингибирование ИА, особенно заметное в конце экспозиции – ее значения были в 2.9–3.3 раза меньше по сравнению с контрольным значением. Такое негативное воздействие засоления на ИА отмечается некоторыми авторами [2]. При совместной контаминации нефтью и NaCl (1%) при использовании микроорганизмов в начале эксперимента наблюдалось увеличение ИА, по сравнению с контролем. На завершающем этапе активность фермента уменьшилась в 2.4–3.4 раза, но все равно была больше, чем в случае без бактеризации. Содержание NaCl в количестве 3% в почве с нефтью оказывало более заметное негативное воздействие на ИА по сравнению со всеми другими вариантами. При этом интродукция штаммов незначительно смягчала воздействие солевого стресса на реактивность фермента. В целом внесение хлорида натрия как в чистую, так и в нефтезагрязненную почву приводило в конце опыта к депрессии и стабилизации активности инвертазы на уровне 1–2 мг глюкозы/(г 24 ч).
ЗАКЛЮЧЕНИЕ
В модельном эксперименте установлено, что загрязнение почвы нефтью и хлоридом натрия отдельно и совместно, а также обработка галотолерантными углеводородокисляющими бактериями Thalassospira xiamenensis UOM 2, Enterobacter sp. UOM 3, Pseudomonas songnenensis UOM 4 и микробной композицией, состоящей из этих штаммов, влияла на биологическую активность чернозема выщелоченного.
Внесение галотолерантных бактерий-деструкторов ускоряло разложение углеводородов в нефтесодержащей и в комплексно контаминированной почве. Наиболее результативно на фоне нефти зарекомендовал себя штамм T. xiamenensis UOM 2, а при комплексном загрязнении – P. songnenensis UOM 4.
Интродукция микроорганизмов снижала отрицательное воздействие почвы, контаминированной нефтью, на растения редиса и переводила ее в категорию малотоксичных и практически нетоксичных (в случае использования штамма T. xiamenensis UOM 2), но не оказывала положительного эффекта в присутствии NaCl и в условиях комбинированного загрязнения нефтью и хлоридом натрия.
Наличие нефти приводило к подавлению каталазной активности, а дополнительное внесение хлорида натрия усугубляло этот процесс. При этом существенных отличий в значениях данного показателя в комплексно загрязненной почве (с интродукцией микроорганизмов и без нее) в зависимости от содержания NaCl не обнаружено. Бактеризация способствовала некоторому увеличению активности фермента в почве с нефтью, вероятно, за счет биодеградации поллютанта. В почве, загрязненной только NaCl, активность каталазы была выше, чем в почве с нефтью (с бактеризацией и без нее) и не зависела от уровня засоления.
Нефть и хлорид натрия отдельно и в комплексе вызывали депрессию уреазной активности. В целом бактеризация положительно влияла на восстановление активности фермента в нефтезагрязненной почве и при совместном действии поллютантов.
Засоление чистой и нефтесодержащей почвы оказывало более значительное негативное влияние на активность инвертазы, чем нефтяное загрязнение. При одновременном присутствии поллютантов NaCl в большей концентрации сильнее ингибировал активность фермента. Обработка галотолерантными микроорганизмами увеличивала этот показатель при комбинированном загрязнении, вероятно, за счет уменьшения общей токсичности почвы в результате разложения углеводородов.
Список литературы
Белозерцева И.А. Интегральная оценка экологического состояния почвенного покрова при добыче газа в среднем Приангарье // Почвоведение. 2020. № 2. С. 244–258. https://doi.org/10.31857/S0032180X20020021
Габбасова И.М., Сулейманов Р.Р. Трансформация серых лесных почв при техногенном засолении и осолонцевании и в процессе их рекультивации в нефтедобывающих районах Южного Приуралья // Почвоведение. 2007. № 9. С. 1120–1128.
Габбасова И.М., Сулейманов Р.Р., Гарипов Т.Т. Деградация и мелиорация почв при загрязнении нефтепромысловыми сточными водами // Почвоведение. 2013. № 2. С. 226–233. https://doi.org/10.7868/S0032180X13020056
Гилязов М.Ю., Гайсин И.А. Техногенный галогенез в районах нефтедобычи. М., 2009. 423 с.
Еремченко О.З., Четина О.А., Лузина Е.В., Сыромятников К.И. Биоиндикация почв при высоком уровне загрязненности в условиях модельного опыта // Вестник Пермского университета. Сер. Биология. 2011. № 3–4. С. 56–59.
Зенова Г.М., Закалюкина Ю.В., Селянин В.В., Звягинцев Д.Г. Выделение и рост почвенных ацидофильных актиномицетов рода Micromonospora // Почвоведение. 2004. № 7. С. 847‒852.
Кабиров Р.Р., Киреева Н.А., Кабиров Т.Р., Дубовик И.Е., Якупова А.Б., Сафиуллина Л.М. Оценка биологической активности нефтезагрязненных почв с помощью интегрального показателя // Почвоведение. 2012. № 2. С. 184–188.
Кайгородов Р.В., Попова Е.И. Хемоэкологические, физико-химические и биохимические свойства почв транспортной зоны урбанизированных экосистем // Вестник Пермского ун-та. Сер. Биология. 2017. № 3. С. 321–327. http://press.psu.ru/index.php/bio/article/view/1872
Колесников С.И., Казеев К.Ш., Татосян М.Л., Вальков В.Ф. Влияние загрязнения нефтью и нефтепродуктами на биологическое состояние чернозема обыкновенного // Почвоведение. 2006. № 5. С. 616–620.
Николаева О.В., Терехова В.А. Совершенствование лабораторного фитотестирования для экотоксикологической оценки почв // Почвоведение. 2017. № 9. С. 1141–1152. https://doi.org/10.7868/S0032180X17090052
Новосeлова Е.И., Киреева Н.А. Ферментативная активность почв в условиях нефтяного загрязнения и ее биодиагностическое значение // Теоретическая и прикладная экология. 2009. № 2. С. 4–12.
Овсянникова И.В., Пряничникова В.В., Пашкина К.В., Лебедь И.В., Сурина А.Г., Гизетдинов А.Н. Оценка фитотоксичности попутных нефтяных вод // Нефтегазовое дело. 2018. № 4. С. 141–145. https://doi.org/10.17122/ngdelo-2018-4-141-145
Покатилова А.Н. Динамика буферности чернозема выщелоченного северной лесостепи Челябинской области при длительном орошении // Вестник Оренбургского гос. ун-та. 2017. № 12(212). С. 16–18.
Поляк Ю.М., Сухаревич В.И. Почвенные ферменты и загрязнение почв: биодеградация, биоремедиация, биоиндикация // Агрохимия. 2020. № 3. С. 83–93. https://doi.org/10.31857/S0002188120010123
Практикум по микробиологии / Под ред. А.И. Нетрусова. М.: Академия, 2005. 608 с.
Руденко Е.Ю. Исследование влияния нефти на биологическую активность черноземной почвы // Известия вузов. Прикладная химия и биотехнология. 2020. Т. 10. № 4. С. 719–727. https://doi.org/10.21285/2227-2925-2020-10-4-719-727
Сангаджиева Л.Х., Самтанова Д.Э. Химический состав пластовых вод и их влияние на загрязнение почвы // Геология, география и глобальная энергия. 2013. № 3(50). С. 168–178.
Филатов Д.А., Иванов А.А., Сваровская Л.И., Юдина Н.В. Активация биохимических процессов в нефтезагрязненной почве с применением светокорректирующей пленки и гуминовых кислот // Почвоведение. 2011. № 2. С. 226–232.
Хазиев Ф.Х. Методы почвенной энзимологии. М.: Наука, 2005. 252 с.
Хазиев Ф.Х. Экологические связи ферментативной активности почв – Обзор // Экобиотех. 2018. № 2. С. 80–92. https://doi.org/10.31163/2618-964X-2018-1-2-80-92
Четвериков С.П., Бакаева М.Д., Коршунова Т.Ю., Кузина Е.В., Рафикова Г.Ф., Четверикова Д.В., Высоцкая Л.Б., Логинов О.Н. Новый штамм Enterobacter sp. UOM 3 – деструктор нефти и продуцент индолилуксусной кислоты // Естественные и технические науки. 2019. № 7. С. 37–40. https://doi.org/10.25633/ETN.2019.07.13
Alwan A., Hussein Kh., Jaddoa Kh. Effect of sodium chloride on response of two wheat cultivars (Triticum aestivum L.) at germination and early seedling // Int. J. Appl. Agricult. Sci. 2015. V. 1(3). P. 60–65. https://doi.org/10.11648/j.ijaas.20150103.13
Amat D., Thakur J.K., Mandal A., Patra A.K., Reddy K.K.K. Microbial indicator of soil health: conventional to modern approaches // Rhizosphere microbes: soil and plant functions. V. 23. Microorganisms for sustainability. Springer Nature, Singapore, 2021. P. 213–233.
Anderson C.R., Peterson M.E., Frampton R.A., Bulman S.R., Keenan S., Curtin D. Rapid increases in soil pH solubilise organic matter, dramatically increase denitrification potential and strongly stimulate microorganisms from the Firmicutes phylum // Peer. J. 2018. 6. V. e6090 https://doi.org/10.7717/peerj.6090
Athar H., Ambreen S., Javed M., Hina M., Rasul S., Zafar Z.U., Manzoor H., Ogbaga C.C., Afzal M., Al-Qurainy F, Ashraf M. Influence of sub-lethal crude oil concentration on growth, water relations and photosynthetic capacity of maize (Zea mays L.) plants // Environ. Sci. Pollut. Res. Int. 2018. V. 23. P. 18320–18331. https://doi.org/10.1007/s11356-016-6976-7
Atoufi D.H., Lampert D.J. Impacts of oil and gas production on contaminant levels in sediments // Curr. Pollut. Rep. 2020. V. 6. P. 43–53. https://www.x-mol.com/paperRedirect/1247933436069613568
Bakaeva M., Kuzina E., Vysotskaya L., Kudoyarova G., Arkhipova T.Y., Rafikova G., Chetverikov S., Korshunova T., Chetverikova D., Loginov O. Capacity of Pseudomonas strains to degrade hydrocarbons, produce auxins and maintain plant growth under normal conditions and in the presence of petroleum contaminants // Plants. 2020. V. 9. Articale 379. https://doi.org/10.3390/plants9030379
Baldan E., Basaglia M., Fontana F., Shapleigh J.P., Casella S. Development, assessment and evaluation of a biopile for hydrocarbons soil remediation // Int. Biodeter. Biodegrad. 2015. V. 98. P. 66–72. https://doi.org/10.1016/j.ibiod.2014.12.002
Bao T., Zhao Y., Yang X., Ren W., Wang S. Effects of disturbance on soil microbial abundance in biological soil crusts on the Loess Plateau, China // J. Arid Environ. 2019. V. 163. P. 59–67. https://doi.org/10.1016/j.jaridenv.2019.01.003
Børresen M.H., Rike A.G. Effects of nutrient content, moisture content and salinity on mineralization of hexadecane in an Arctic soil // Cold Reg. Sci. Technol. 2007. V. 48. P. 129–138. https://doi.org/10.1016/j.coldregions.2006.10.006
Bünemann E.K., Bongiorno G., Bai Z., Creamer R.E., de Deyn G., de Goede R., Fleskens L., Geissen V., Kuyper T.W., Mäder. P, Pulleman M., Sukkel W., van Groenigen J.W., Brussaard L. Soil quality – A critical review // Soil Biol. Biochem. 2018. V. 120. P. 105–125. https://doi.org/10.1016/j.soilbio.2018.01.030
Buzmakov S.A., Khotyanovskaya Y.V. Degradation and pollution of lands under the influence of oil resources exploitation // Appl. Geochem. 2020. V. 113. e104443. https://doi.org/10.1016/j.apgeochem.2019.104443
Cai B., Ma J., Yan G., Dai X., Li M., Guo S. Comparison of phytoremediation, bioaugmentation and natural attenuation for remediating saline soil contaminated by heavy crude oil // Biochem. Eng. J. 2016. V. 112. P. 170–177. https://doi.org/10.1016/j.bej.2016.04.018
Camacho-Montealegre C.M., Rodrigues E.M., Morais D.K., Tótola M.R. Prokaryotic community diversity during bioremediation of crude oil contaminated oilfield soil: effects of hydrocarbon concentration and salinity // Braz. J. Microbiol. 2021. V. 52(2). P. 787–800. https://doi.org/10.1007/s42770-021-00476-5
Charpentier S., Bourrié G. Deformation of saturated clays under mechanical and osmotic stress and its relation with the arrangement of the clays // Eur. J. Soil Sci. 1997. V. 48. P. 49–57.
Chen M., Xu P., Zeng G., Yang Ch., Huang D., Zhang J. Bioremediation of soils contaminated with polycyclic aromatic hydrocarbons, petroleum, pesticides, chlorophenols and heavy metals by composting: Applications, microbes and future research needs // Biotechnol. Adv. 2015. V. 33. P. 745–755. https://doi.org/10.1016/j.biotechadv.2015.05.003
Datt N., Singh D. Enzymes in relation to soil biological properties and sustainability // Sustainable management of soil and environment. Springer Nature, Singapore, 2019. P. 383–406.
Ebadi A., Khoshkholgh Sima N.A., Olamaee M., Hashemi M., Ghorbani Nasrabadi R. Remediation of saline soils contaminated with crude oil using the halophyte Salicornia persica in conjunction with hydrocarbon-degrading bacteria // J. Environ. Manage. 2018. V. 219. P. 260–268. https://doi.org/10.1016/j.jenvman.2018.04.115
El Fels L., Zamama M., El Asli A., Hafidi M. Assessment of biotransformation of organic matter during co-composting of sewage sludge-lignocelullosic waste by chemical, FTIR analyses, and phytotoxicity tests // Int. Biodeter. Biodegrad. 2014. V. 87. P. 128–137. https://doi.org/10.1016/j.ibiod.2013.09.024
Ergasheva Y., Egamberdieva D. Impact of salinity on enzyme activities in calcareous soils of Uzbekistan // J. Biol. Chem. Research. 2014. V. 31(2). P. 1072–1077.
Gamzaeva R.S. Influence of oil pollution on the surface of the microbial community and catalase activity of sod – podzolic soil // IOP Conf. Ser.: Earth Environ. Sci. 2021. V. 723. P. 052023. https://doi.org/10.1088/1755-1315/723/5/052023
Gao Y., Wang J., Guo S., Hu Y.-L., Li T., Mao R. Effects of salinization and crude oil contamination on soil bacterial community structure in the Yellow River Delta region, China // Appl. Soil Ecol. 2015. V. 86. P. 165–173. https://doi.org/10.1016/j.apsoil.2014.10.011
Gospodarek J., Rusin M., Barczyk G., Nadgórska-Socha A. The effect of petroleum-derived substances and their bioremediation on soil enzymatic activity and soil invertebrates // Agronomy. 2021. V. 11. P. 80.https://doi.org/10.3390/agronomy11010080
Haider F.U., Ejaz M., Cheema S.A., Khan M.I., Zhao B., Liqun C., Salim M.A., Naveed M., Khan N., Núñez-Delgado A. Phytotoxicity of petroleum hydrocarbons: Sources, impacts and remediation strategies // Environ. Res. 2021. V. 197. P. 111031.https://doi.org/10.1016/j.envres.2021.111031
Hu J., Lin X., Wang J., Dai J., Chen R., Zhang J., Wong M.H. Microbial functional diversity, metabolic quotient, and invertase activity of a sandy loam soil as affected by long-term application of organic amendment and mineral fertilizer // J. Soil. Sediment. 2011. V. 11(2). P. 271–280. https://doi.org/10.1007/s11368-010-0308-1
Huang X., He J., Wei H.-F., Zhao X.-Y., Liu Y., Ji Z.-X. Influence of Suaeda heteroptera – microorganisms – Nereis succinea on soil enzyme activities in oil-contaminated soil // Int. J. Environ. Analytical Chemistry. 2020. https://doi.org/10.1080/03067319.2020.1733542
Kalami R., Pourbabaee A.-A. Investigating the potential of bioremediation in aged oil-polluted hypersaline soils in the south oilfields of Iran // Environ. Monit. Assess. 2021. V. 193(8). P. 517. https://doi.org/10.1007/s10661-021-09304-7
Kolesnikov S.I., Myasnikova M.A., Minnikova T.V., Ter-Misakyants T.A., Kazeev R.S., Akimenko Y.V. Assessment of meadow soil resistance of the Azov sea region to pollution with heavy metals and oil // Ecol. Env. Cons. 2017. V. 23(4). P. 2346–2351.
Minai-Tehrani D., Herfatmanesh A., Azari-Dehkordi F., Minuoi S. Effect of salinity on biodegradation of aliphatic fractions of crude oil in soil // Pakistan J. Biol. Sci. 2006. V. 9(8). P. 1531–1535. https://doi.org/10.3923/pjbs.2006.1531.1535
Mishra S., Jyot J., Kuhad R.C., Lal B. In situ bioremediation potential of an oily sludge-degrading bacterial consortium // Curr. Microbiol. 2001. V. 43(5). P. 328–335.
Neina D. The role of soil pH in plant nutrition and soil remediation // Appl. Environ. Soil Sci. 2019. P. 5794869. https://doi.org/10.1155/2019/5794869
Olkova A.S., Tovstik E. Comparison of natural abiotic factors and pollution influence on the soil enzymative activity // Ecol. Engin. Environ. Technol. 2022. V. 23(1). P. 42–48. https://doi.org/10.12912/27197050/143003
Ossai I.C., Ahmed A., Hassan A., Hamid F.S. Remediation of soil and water contaminated with petroleum hydrocarbon: a review // Environ. Technol. Innov. 2020. V. 17. P. 100526. https://doi.org/10.1016/j.eti.2019.100526
Pawar R.M. The effect of soil pH on bioremediation of polycyclic aromatic hydrocarbons (PAHs) // Bioremed. Biodegrad. 2015. V. 6. Article 291. https://doi.org/10.4172/2155-6199.1000291
Polyak Y.M., Bakina L.G., Chugunova M.V., Mayachkina N.V., Gerasimov A.O., Bure V.M. Effect of remediation strategies on biological activity of oil-contaminated soil – A field study // Int. Biodeterior. Biodegrad. 2018. V. 126. P. 57–68. https://doi.org/10.1016/j.ibiod.2017.10.004
Qin X., Tang J.C., Li D.S., Zhang Q.M. Effect of salinity on the bioremediation of petroleum hydrocarbons in a saline-alkaline soil // Lett. Appl. Microbiol. 2012. V. 55. P. 210–217. https://doi.org/10.1111/j.1472-765x.2012.03280.x
Raiesi F., Salek-Gilani S. The potential activity of soil extracellular enzymes as an indicator for ecological restoration of rangeland soils after agricultural abandonment // Appl. Soil Ecol. 2018. V. 126. P. 140–147. https://doi.org/10.1016/j.apsoil.2018.02.022
Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons // Dev. Ind. Microbiol. 1961. V. 2. P. 23–32.
Riffaldi R., Levi-Minzi R., Cardelli R., Palumbo S., Saviozzi A. Soil biological activities in monitoring the bioremediation of diesel oil-contaminated soil // Water Air Soil Pollut. 2006. V. 170. P. 3–15. https://doi.org/10.1007/s11270-006-6328-1
Rodríguez-Uribe M.L., Peña-Cabriales J.J., Rivera-Cruz M. del C., Délano-Frier J.P. Native bacteria isolated from weathered petroleum oil-contaminated soils in Tabasco, Mexico, accelerate the degradation petroleum hydrocarbons in saline soil microcosms // Environ. Technol. Innov. 2021. V. 23. P. 101781. https://doi.org/10.1016/j.eti.2021.101781
Sambuu G., Garetova L.A., Imranova E.L., Kirienko O.A., Fischer N.K., Gantumur K., Kharitonova G.V. Biogeochemical characteristics of soils in the Dzunbayan oil-producing area (Eastern Mongolia) // Biogeosystem Technique, 2019. V. 6(1). P. 46–58. https://doi.org/10.13187/bgt.2019.1.46
Shulaev N.S., Pryanichnikova V.V., Kadyrov R.R., Bykovsky N.A., Damineva R.M., Ovsyannikova I.V. Phytotoxic properties of electrically-cleaned oil-contaminated soils (the use of Lepidium sativum L. biotest) // IOP Conf. Ser.: Mater. Sci. Eng. 2020. V. 862. ID 062021. https://doi.org/10.1088/1757-899X/862/6/062021
Sivkov Y.V., Nikiforov A.S. Study of oil-contaminated soils phytotoxicity during bioremediation activities // J. Ecol. Engin. 2021. V. 22(3). P. 67–72. https://doi.org/10.12911/22998993/132435
Sui X., Wang X., Li Y., Ji H. Remediation of petroleum-contaminated soils with microbial and microbial combined methods: advances, mechanisms, and challenges // Sustainability. 2021. V. 13. P. 9267. https://doi.org/10.3390/su13169267
Wang C.-Y., Zhou X., Guo D., Zhao J.-H., Yan L., Feng G.-Z., Gao Q., Yu H., Zhao L.-P. Soil pH is the primary factor driving the distribution and function of microorganisms in farmland soils in northeastern China // Ann. Microbiol. 2019. V. 69. P. 1461–1473. https://doi.org/10.1007/s13213-019-01529-9
Wolińska A., Kuźniar A., Szafranek-Nakonieczna A., Jastrzębska N., Roguska E., Stępniewska Z. Biological activity of autochthonic bacterial community in oil contaminated soil // Water Air Soil Pollution. 2016. V. 227. P. 130. https://doi.org/10.1007/s11270-016-2825-z
Zvyagintseva I.S., Poglazova M.N., Gotoeva M.T., Belyaev S.S. Effect on the medium salinity on oil degradation by nocardioform bacteria // Mикpoбиoлoгия. 2001. T. 70. № 6. C. 759–754.
Дополнительные материалы отсутствуют.



