Почвоведение, 2023, № 5, стр. 676-688
Почвенный микробиом в зоне воздействия выбросов горно-металлургического комбината Печенганикель (Мурманская область)
М. В. Корнейкова a, b, *, Д. А. Никитин c
a Российский университет дружбы народов
117198 Москва, ул. Миклухо-Маклая, 6, Россия
b Институт проблем промышленной экологии Севера – обособленное подразделение ФИЦ КНЦ РАН
184209 Апатиты, Академгородок, 14а, Россия
c Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
* E-mail: korneykova.maria@mail.ru
Поступила в редакцию 04.07.2022
После доработки 28.12.2022
Принята к публикации 28.12.2022
- EDN: IDXUOP
- DOI: 10.31857/S0032180X22600883
Аннотация
Проанализированы параметры микробиома Al–Fe-гумусовых подзолов на песчаной морене (Albic Podzols) по градиенту загрязнения соединениями меди, никеля и другими металлами на различном расстоянии (3, 16, 30, 50 км) от горно-металлургического комбината “Печенганикель” (Мурманская область). Проведена оценка запасов и структуры биомассы прокариот и грибов методом люминесцентной микроскопии; определено содержание копий рибосомальных генов микроорганизмов методом полимеразной цепной реакции в реальном времени; изучено таксономическое разнообразие и численность культивируемых почвенных микромицетов. Выявлено увеличение количества копий рибосомальных генов бактерий, архей и грибов вблизи источника выбросов по сравнению с удаленными участками. На всех участках наибольшее количество копий генов отмечено для бактерий от 3.21 × 1010 до 12 × 1010 копий генов/г почвы. Для грибов и архей их количество изменялось в пределах от 0.53 × 1010 до 1.59 × 1010 и от 0.55 × 1010 до 11.41 × 1010 копий генов/г почвы соответственно. Минимум рибосомальных генов всех групп микроорганизмов: археи, бактерии и грибы – выявлен в 50 км от комбината, а максимум – в 3–16 км от источника выбросов. Численность прокариот изменялась от 1.04 × 108 до 8.6 × 108 кл./г почвы, а биомасса – от 0.2 до 18.3 мкг/г почвы. Биомасса грибов варьировала от 122 до 572 мкг/г почвы. Отмечено существенное снижение биомассы всех групп микроорганизмов вблизи завода. Мицелий и споры грибов на всех участках преимущественно представлены мелкими формами диаметром 2–3 мкм. Длина грибного мицелия изменялась от 51.2 м/г вблизи комбината до 397 м/г на удаленных участках, при этом закономерностей в его распределении по градиенту загрязнения не выявлено. Отмечено сокращение разнообразия культивируемых почвенных микромицетов на уровне родов и вышестоящих таксонов по градиенту загрязнения выбросами завода. Выявлена смена структуры сообществ с полидоминантной (фоновый участок) на монодоминантную (вблизи завода). Вид Penicillium raistrickii доминировал на всех участках. В зоне 16 км от источника выбросов доминировали представители Aureobasidium pullulans и Trichoderma viride (16 км), темноокрашенные дрожжи Torula lucifuga (3 км). На фоновом участке к доминирующим относились представители порядков Mucorales и Umbelopsidales.
ВВЕДЕНИЕ
В последнее время острой проблемой мирового масштаба становится загрязнение окружающей среды. Одними из наиболее актуальных поллютантов выступают тяжелые металлы (ТМ) – химические элементы с плотностью >5 (8) г/см3 или относительной атомной массой >50 [49]. В то же время ТМ часто рассматривают не с химической, а с природоохранной и медицинской точек зрения, поскольку они полезны или токсичны при различных условиях и концентрациях [33]. Многие ТМ (Zn, Fe, Cu, Mo, Mn и др.) необходимы для нормальной жизнедеятельности организмов, так как участвуют в окислительно-восстановительных процессах, осморегуляции, формировании кофакторов ферментов и т.д., однако они становятся чрезвычайно губительными для экосистем в высоких концентрациях [32, 25, 46 ].
Резкое увеличение мощностей тяжелой промышленности сопряжено с рисками техногенного загрязнения, часто обусловленного ростом концентрации ТМ [6, 7]. Эта проблема особенно актуальна для хрупких арктических экосистем, любое воздействие на которые может привести к необратимым нарушениям [25, 46, 53]. Почва является основой существования и буфером всех наземных экосистем, которая может частично нивелировать негативные последствия загрязнений [7, 24]. Одновременно с этим почва – ведущий резервуар аккумуляции ТМ в биогеоценозах, переполнение которого при катастрофическом загрязнении приводит к нарушению функционирования экосистем и угнетению всей биоты [33, 49].
Почвенные микроорганизмы – неотъемлемый и важный компонент всех наземных экосистем [5]. Для большинства микроорганизмов ТМ малотоксичны, а некоторые прокариоты и грибы способны разлагать соединения ТМ до нетоксичных веществ [31]. Подвижность и биодоступность ТМ для растений и животных снижаются микроорганизмами посредством биосорбции и биоосаждения [57], что способствует иммобилизации ТМ и интоксикации почвы [24]. Микроорганизмы имеют несколько механизмов для смягчения негативных воздействий ТМ. Одним из главных среди них является хелатирование, т.е. образование металлоорганических комплексных соединений, которые обычно осаждаются на клеточных мембранах. Например, эффективными хелаторными метаболитом у грибов являются гликопротеин гломалин, глюканы, хитин и хитозан, связывающие ионы Cu2+, Cd2+, Co2+, Pb2+ и Zn2+ в почве [31]. Кроме того, некоторые прокариоты и грибы снабжены генами, которые позволяют им накапливать ТМ сверх определенного предела, обладают способностью модифицировать или преобразовывать ТМ в менее токсичные формы [31]. В настоящее время эти преимущества активно используются в области биоремедиации почв, загрязненных ТМ [57], в том числе с помощью микоризных грибов [52].
Микроорганизмы являются частью почвенной биоты, наиболее быстро реагирующей на изменения окружающей среды, в том числе на повышенное содержание ТМ [24]. Сокращение численности и таксономического разнообразия микроорганизмов может служить индикатором нарушенности экосистем [9, 21]. Особое внимание стоит уделить почвенным грибам, поскольку они в существенной степени определяют здоровье и плодородие почвы [39, 42].
Существуют работы, посвященные изучению влияния выбросов медно-никелевых предприятий на Кольском полуострове, в том числе комбината “Печенганикель”, на физико-химические свойства почв [11, 18, 23, 28], а также исследования по биоремедиации нарушенных территорий этого региона [13, 15, 28]. Почвенная микробиота [1, 6, 7, 15] и влияние ТМ на биологическую активность местных почв [10] изучены мало. В вышеуказанных работах рассматривали только культивируемую часть сообщества почвенных микроорганизмов, что не в полной мере отражает реальную структуру и состояние микробиома [2, 26].
Актуальность исследований возрастает так как с 2020 г. началось закрытие цехов и вывод из эксплуатации комбината “Печенганикель”. Полученные в настоящей работе результаты позволят в дальнейшем проводить оценку скорости восстановления микробного сообщества нарушенных территорий.
Цель работы – изучение количественных показателей (биомассы и содержания рибосомальных копий генов) прокариот и грибов, определение таксономического разнообразия и структуры сообществ культивируемых почвенных микромицетов в зоне воздействия выбросов медно-никелевого комбината “Печенганикель”.
ОБЪЕКТЫ И МЕТОДЫ
Характеристика участков. Комбинат “Печенганикель” находится в северо-западной части Кольского полуострова. Климат в районе умеренный, характеризуется сильной изменчивостью, так как подвержен влиянию теплого Северо-Атлантического течения Гольфстрим. С 1998 г. на предприятии добывали и обогащали сульфидные медно-никелевые руды (около 7.5 млн т/год) до файнштейна. В результате дальнейшей переработки получали Ni, Cu, Co и H2SO4, являющиеся приоритетными загрязнителями в зоне воздействия выбросов завода.
Работу проводили на стационарных участках, ранее выделенных сотрудниками лаборатории экологии микроорганизмов ИППЭС КНЦ РАН на основании зонирования территории по степени загрязнения почвы ТМ [7]. Согласно системе, предложенной Обуховым с соавт. [22], выделены следующие зоны по градиенту (трансекте) загрязнения воздушными выбросами комбината “Печенганикель”:
– сильного загрязнения, распространяющаяся до 3 км от источника выбросов;
– среднего загрязнения – от 3 до 16 км;
– слабого – от 16 до 30 км:
– условно фоновый участок на расстоянии от 30 до 50 км от комбината (рис. 1).
Почвы на изучаемой территории представлены Al–Fe-гумусовым подзолами с содержанием в органогенном горизонте Сорг 39.0–55.7% и Nобщ 1.1–1.7%. [7]. В табл. 1 приведена характеристика участков.
Таблица 1.
Характеристика участков по градиенту загрязнения от комбината “Печенганикель”, n = 18
| Расстояние от завода, км | Степень загрязнения | Координаты | Растительность | Содержание микроэлемента, мг/кг | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ni | Cu | Co | Zn | Cr | Mn | Pb | Cd | ||||
| 3 | Сильная | 69°23′44″ N, 30°10′42″ E |
Сосняк брусничный с примесью березы | 2143 ± 168 | 1587 ± 162 | 86 ± 24 | 159 ± 40 | 61 ± 7 | 453 ± 297 | 29 ± 5 | 2.3 ± 0.2 |
| 16 | Средняя | 69°21′45″ N, 29°52′28″ E |
Сосняк кустарничковый с примесью березы. Напочвенный покров: брусника > вороника > багульник | 182 ± 12 | 99 ± 6 | 8 ± 0.4 | 41 ± 3 | 3.7 ± 0.5 | 104 ± 27 | 12 ± 3 | 1.3 ± 0.2 |
| 30 | Слабая | 69°17′47″ N, 29°34′08″ E |
Сосняк брусничный с примесью березы. Напочвенный покров: брусника > багульник, лишайники | 45 ± 6 | 33 ± 4 | 3.2 ± 0.4 | 68 ± 9 | 3.6 ± 0.2 | 27 ± 4 | 21 ± 0.7 | 1.0 ± 0.06 |
| 50 | Отсутствует | 69°07′56″ N, 29°16′32″ E |
Сосняк лишайниково-кустарничковый. Напочвенный покров: голубика > черника > вороника, лишайники | 22 ± 1.3 | 26 ± 0.4 | 1.6 ± 0.03 | 52 ± 4 | 2.5 ± 0.03 | 40 ± 10 | 35 ± 11 | 0.9 ± 0 |
Примечание. В табл. 1 и 3 приведены средние значения ± ошибка среднего.
Отбор почвенных образцов проводили в июне 2019 г. на стационарных участках площадью 100 м2, расположенных в 3, 16, 30 и 50 км от завода, из органогенного горизонта по стандартной методике отбора образцов для микробиологического анализа с возможными мерами по предотвращению контаминаций. Всего отобрано и проанализировано 100 почвенных образцов. Образцы хранили при температуре –18°С для флуоресцентной микроскопии и при –70°С для молекулярных анализов. Все исследования проводили со свежими образцами в течение 14–21 сут после их отбора.
Численность клеток и биомассу прокариот определяли методом люминесцентной микроскопии (микроскоп Zeiss Axioskop 2 plus, Германия), объектив ×100, масляная иммерсия) с применением флуоресцентного красителя акридинового оранжевого. Десорбцию клеток с почвенных частиц проводили ультразвуком, используя прибор УДНЗ-1 (2 мин, 22 кГц, 0.44 А), а препараты готовили по стандартной методике [8]. Из каждого образца готовили 6 препаратов, в каждом из которых подсчитывали клетки в 30 полях зрения.
Таблица 2.
Информация о праймерах и стандартах, используемых в ПЦР в реальном времени
| Группа | Целевой ген | Праймер | Нуклеотидная последовательность праймеров (F, R) | Стандарты концентрации генов | Ссылка |
|---|---|---|---|---|---|
| Бактерии | 16S рРНК | Eub338 | ACCTCTACGGGAGGCAGCAG | Escherichia coli | [40] |
| Eub518 | ATTACCGCGGCTGCTGCTGG | ||||
| Археи | 16S рРНК | 915f 1059r | AGGAA TTGGC GGGGG AGCAC | Strain FG08 | [59] |
| GCCAT GCACC WCCTC T | Halobacterium salinarum | ||||
| Грибы | ITS region | ITS1f | TCC GTA GGT GAA CCT GCG G | Saccharomyces cerevisiae | [40] |
| 5.8s | CGC TGC GTT CTT CAT CG | Meyen 1B-D1606 |
Количество грибных пропагул и длину мицелия микобиоты определяли методом люминесцентной микроскопии (микроскоп Биомед 5ПР ЛЮМ, Россия), объектив ×40) с применением флуоресцентного красителя калькофлуор белый. Десорбцию клеток с почвенных частиц проводили вортексом (MSV-3500, Латвия) при скорости 3500 об./мин в течение 10 мин), а приготовление препаратов – по стандартной методике [8]. Из каждого образца готовили 3 препарата, на каждом из которых подсчитывали клетки в 90 полях зрения. Длину грибного и актиномицетного мицелия в грамме образца определяли по стандартной методике [8].
Количественную оценку содержания рибосомальных генов бактерий, архей и грибов осуществляли методом ПЦР в реальном времени. Для учета архей и бактерий использовали праймеры на ген 16S рРНК, для учета грибов – на регион ITS. Реакцию проводили в амплификаторе Real-Time CFX96 Touch (Bio-Rad). Реакционную смесь готовили из препарата SuperMix Eva Green (Bio-Rad). В качестве количественных стандартов концентрации генов 16S рРНК для бактерий использовали растворы клонированных фрагментов рибосомального оперона штамма К12 Escherichia coli, для архей – штамма FG-07 Halobacterium salinarum, для грибов – штамма дрожжей Saccharomyces cerevisiae Meyen 1B-D1606. Для каждого образца реакцию проводили в трех повторностях. Концентрацию генов рассчитывали с помощью программного обеспечения CFX Manager. Количество генов в препаратах ДНК пересчитывали на грамм почвы с учетом разведений и массы навески.
Таблица 3.
Биомасса микроорганизмов и ее структура, n = 18
| Расстояние от завода, км | Численность прокариот, ×107 кл/г | Биомасса прокариот, ×10–3 мг/г | Длина актиномицетного мицелия, м/г | Биомасса актиномицетного мицелия, ×10–3 мг/г | Мицелий (d = 3 мкм) | Споры (диаметр, мкм) | Общая биомасса спор, мг/г почвы | Суммарная биомасса грибов, мг/г почвы | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| биомасса, мг/г | длина, м | доля мицелия в общей биомассе, % | 2 | 3 | 5 | ||||||||||
| численность, ×105 шт./г | масса, мг/г | численность, ×104 шт./г | масса, мг/г | численность, ×103 шт./г | масса, мг/г | ||||||||||
| 3 | 10.4 ± ± 0.9 | 0.2 ± ± 0.0 | 1.7 ± ± 0.3 | 0.06 ± ± 0.0 | 0.06 ± ± 0.008 | 51.2 ± ± 6.6 | 52.7 ± ± 4.8 | 0.81 ± ± 0.01 | 0.027 ± ± 0.001 | 2.41 ± ± 0.34 | 0.030 ± ± 0.004 | − | − | 0.126 ± ± 0.004 | 0.397 ± ± 0.005 |
| 16 | 21.6 ± ± 1.2 | 0.5 ± ± 0.0 | 22.6 ± ± 1.7 | 0.85 ± ± 0.0 | 0.49 ± ± 0.09 | 396.9 ± ± 64.91 | 84.6 ± ± 3.04 | 1.34 ± ± 0.09 | 0.045 ± ± 0.003 | 2.74 ± ± 0.16 | 0.032 ± ± 0.002 | 0.87 ± ± 0.20 | 0.052 ± ± 0.002 | 0.100 ± ± 0.006 | 0.449 ± ± 0.089 |
| 30 | 86.6 ± ± 2.2 | 18.3 ± ± 0.0 | 16.4 ± ± 7.5 | 0.61 ± ± 0.2 | 0.35 ± ± 0.04 | 276.7 ± ± 28.95 | 75.8 ± ± 3.42 | 0.93 ± ± 0.06 | 0.031 ± ± 0.002 | 3.81 ± ± 0.71 | 0.044 ± ± 0.008 | 3.12 ± ± 0.43 | 0.024 ± ± 0.011 | 0.083 ± ± 0.020 | 0.572 ± ± 0.025 |
| 50 | 70.9 ± ± 24.3 | 2.9 ± ± 0.9 | 20.5 ± ± 8.8 | 0.77 ± ± 0.33 | 0.27 ± ± 0.01 | 214.5 ± ± 10.4 | 68.7 ± ± 3.4 | 0.66 ± ± 0.05 | 0.022 ± ± 0.002 | 5.68 ± ± 2.16 | 0.066 ± ± 0.025 | 6.93 ± ± 1.25 | 0.037 ± ± 0.007 | 0.057 ± ± 0.023 | 0.122 ± ± 0.031 |
Численность колониеобразующих единиц (КОЕ) и разнообразие культивируемых микромицетов сахаролитической группы определяли методом микробиологического посева на среду Чапека с добавлением молочной кислоты (4 мл/л) для ингибирования роста бактерий [8]. Культурально-морфологические признаки измеряли с помощью микроскопа Olympus CX41 с использованием определителей [19, 38, 55]. Наименование видов и систематическое положение дано по базе данных: CABI Bioscience Databases (http://www.indexfungorum.org). Для ряда видов, выделенных в виде стерильного мицелия, идентификацию осуществляли на основании анализа участка рибосомальных генов ITS1-5.8S-ITS2 рДНК. Выделение ДНК проводили по методике, описанной ранее [3], но культуры подвергали трем циклам обработки, поскольку мицелиальные грибы более устойчивы к внешним воздействиям, чем дрожжи. Секвенирование участков ДНК выполняли с помощью набора реактивов BigDye Terminator V. 3.1 Cycle Sequencing Kit (Applied Biosystems, США) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130l Genetic Analyzer в научно-производственном центре “Синтол” (Москва).
Таблица 4.
Таксономическое разнообразие комплексов микроскопических грибов по градиенту загрязнения выбросами медно-никелевого комбината
| Вид | Расстояние от завода, км | |||
|---|---|---|---|---|
| 3 | 16 | 30 | 50 | |
| Отдел Ascomycota Класс Dothideomycetes Порядок Capnodiales Семейство Cladosporiaceae |
||||
| Cladosporium cladosporioides (Fresen.) G.A. de Vries | – | 8.3 | 3.2 | 2.1 |
| Порядок Dothideales Семейство Saccotheciaceae |
||||
| Aureobasidium melanogenum (Herm.-Nijh.) Zalar, Gostinčar & Gunde-Cim. | – | – | 28.8 | 12.1 |
| A. pullulans (de Bary & Löwenthal) G. Arnaud | 11.2 | 38.5 | 5.6 | 4.3 |
| Порядок Pleosporales Семейство Didymellaceae |
||||
| Juxtiphoma eupyrena (Sacc.) Valenz.-Lopez, Crous, Stchigel, Guarro & Cano | – | – | – | 13.2 |
| Семейство Pleosporaceae | ||||
| Alternaria alternata (Fr.) Keissl. | – | 0.5 | 0.8 | – |
| Семейство Torulaceae | ||||
| Torula lucifuga Oudem. | 65.2 | – | – | – |
| Класс Eurotiomycetes Порядок Eurotiales Семейство Aspergillaceae |
||||
| Penicillium canescens Sopp | – | – | – | 3.5 |
| P. chermesinum Biourge | – | – | – | 2.3 |
| P. decumbens Thom | – | – | 5.6 | – |
| P. glabrum (Wehmer) Westling | – | – | – | 33 |
| P. hirsutum var. hirsutum Dierckx | – | 1.3 | 3.0 | 2.1 |
| P. implicatum Biourge | – | – | – | 3.3 |
| P. lividum Westling | – | – | – | 1 |
| P. miczynskii K.M.Zaleski* | 3.2 | 3.1 | 46.8 | 14 |
| P. raistrickii G. Sm. | 29.4 | 51.6 | 27.6 | 24.7 |
| P. simplicissimum (Oudem.) Thom | – | – | 2.5 | – |
| P. spinulosum Thom* | 5.5 | 9.8 | 9.4 | 34.1 |
| P. thomii Maire* | – | 13.2 | 10.1 | 25.4 |
| Класс Leotiomycetes Порядок Helotiales Семейство Myxotrichaceae |
||||
| Myxotrichum deflexum Berk. | – | – | – | 10.2 |
| Класс Sordariomycetes Порядок Hypocreales Семейство Hypocreaceae |
||||
| Trichoderma viride Pers.* | – | 29.7 | – | 3.8 |
| Семейство Incertae sedis | ||||
| Gliomastix murorum var. murorum (Corda) S. Hughes | – | – | – | 1.8 |
| Семейство Stachybotryaceae | ||||
| Stachybotrys echinatus (Rivolta) G. Sm. | – | – | – | 1.5 |
| Отдел Mucoromycota Класс Mucoromycetes Порядок Incertae sedis Семейство Cunninghamellaceae |
||||
| Gongronella butleri (Lendn.) Peyronel & Dal Vesco | 0.3 | 2.2 | – | – |
| Порядок Mucorales Семейство Mucoraceae |
||||
| Mucor hiemalis Wehmer | 2.7 | 3.3 | 0.7 | 2.3 |
| Класс Umbelopsidomycetes Порядок Umbelopsidales Семейство Umbelopsidaceae |
||||
| Umbelopsis sp. | – | – | – | 53.3 |
| U. angularis W. Gams & M. Sugiy* | – | – | – | 42.4 |
| Всего видов | 7 | 11 | 12 | 21 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Численность копий рибосомальных генов 16S рРНК архей в зоне воздействия выбросов медно-никелевого предприятия изменялась от 0.55 × 1010 на фоновом участке до 11.41 × 1010 копий генов/г почвы вблизи завода (рис. 2). На расстоянии 16–30 км от источника выбросов отмечено резкое увеличение количества копий генов архей, в 6 раз и более превышающее фоновое. В ранее проведенных исследованиях на Кольском полуострове не выявлено изменений в численности копий генов этой группы микроорганизмов вблизи алюминиевого завода по сравнению с фоном [17]. В городских почвах Кольского полуострова (Апатиты и Мурманск) их количество было близко к нижнему пределу численности на обследуемой территории, а в Мурманске на некоторых участках на 4 порядка меньше [48]. Существенная разница между выявленными значениями численности генов архей может быть объяснена неравномерным распределением генетического материала по клеткам прокариот [34, 37]. Можно отметить, что вблизи медно-никелевого комбината количество копий генов архей было максимальным по сравнению с другими районами полуострова, изученными применяемыми нами методами. Многие представители архей имеют специфическую экологию, из-за уникальной физиологии и биохимии, так как существенная часть архей является хемоавтотрофами [36], они способны использовать в качестве источника энергии ионы некоторых ТМ, обилие и разнообразие которых значительно возрастает вблизи комбината. Увеличение количества генетического материала архей могло происходить в почве по мере приближения к “Печенганикелю” при использовании разных ТМ в качестве субстрата для получения энергии. Часть ТМ могла служить кофактором для работы особых ферментов архей [54]. По-видимому, длительная эволюция архей позволила им сформировать специфические экологические группы, которые более толерантны к ТМ, чем многие другие почвенные микроорганизмы [35]. Невысокая численность генов архей на фоновом участке может быть связана с усиливающейся конкуренцией представителей данного домена с бактериями в условиях ограниченности ресурсов питания и энергии [26, 36], характерных для полярных экосистем.
Рис. 2.
Количество копий рибосомальных генов архей (a), бактерий (b) и грибов (c) по градиенту загрязнения выбросами медно-никелевого комбината. Приведены средние значения ± ошибка среднего, n = 30.
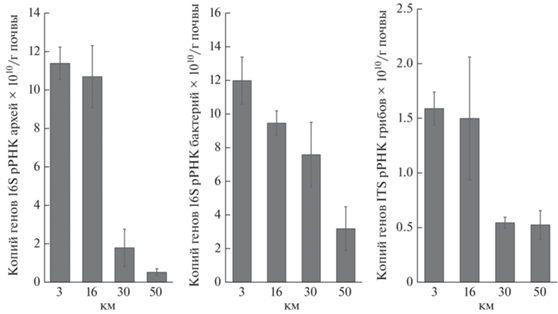
Численность копий генов 16S рРНК бактерий была приблизительно на том же уровне, что и архей, и изменялась от 3.21 × 1010 до 12 × 1010 копий генов/г почвы. В отличие от архей численность копий генов бактерий постепенно увеличивалась от фонового участка к источнику выбросов (рис. 2). Данный результат можно объяснить повышенной устойчивостью и даже тропизмом отдельных таксонов почвенных бактерий к ТМ [51 , 58]. Небольшие концентрации ТМ способствуют лучшему росту некоторых штаммов бактерий, поскольку напрямую вовлечены в пути их метаболизма [51]. Количество копий генов бактерий вблизи завода было максимальным по сравнению с другими антропогенно-измененными и фоновыми участками Кольского полуострова [48]. В почвах городов района исследований, вблизи алюминиевого предприятия и на побережье Баренцева моря обнаружено схожее по порядку количество копий генов бактерий [48].
Численность рибосомальных генов ITS рРНК грибов была на порядок меньше, чем бактерий и архей, и изменялась от 0.53 × 1010 до 1.59 × 1010 копий генов/г почвы. По-видимому, это обусловлено неравномерностью распределения генетического материала грибов по клеткам, которые могут содержать, как по одному, так и по несколько ядер c различной концентрацией ДНК [44]. Диапазон колебаний численности копий генов грибов по градиенту загрязнения несущественный по сравнению с археями и бактериями. Как и для группы архей, отмечено резкое увеличение количества копий генов на расстоянии 16–30 км от источника выбросов. Известно, что грибы относительно устойчивы к ТМ и способны накапливать их в больших количествах. Почвенные грибы обладают разносторонними и узкоспециализированными физиологическими механизмами, которые действуют как фильтр для блокирования ТМ в их мицелии [52]. Грибы в загрязненных экосистемах часто накапливают больше ТМ, чем те же виды в фоновых экосистемах [4]. Для сравнения в городских почвах Кольского Севера [48] и на побережье Баренцева моря их численность была на 1–3 порядка меньше [48].
Микробная биомасса и ее структура. Методом прямого учета выявлена существенная разница в численности прокариот по градиенту загрязнения (табл. 3). Зависимость была противоположной результатам по количеству копий генов. Численность прокариот изменялась от 86.6 × 107 кл./г почвы на фоновом участке до 10.4 × 107 кл./г почвы вблизи завода. На расстоянии 16–30 км от источника выбросов отмечается наиболее существенное сокращение численности прокариот по сравнению с фоном. Диапазон колебаний значений биомассы прокариот в почве на разном расстоянии от завода существенен – от 0.2 до 18.3 × 10–3 мг/г почвы с максимальным значением в зоне среднего загрязнения. Рост численности прокариот в почвах, удаленных от комбината “Печенганикель” более чем на 30 км, по-видимому, обусловлен увеличением сомкнутости и видовой сменой растительного покрова. Другое таксономическое разнообразие сообществ растений формирует специфические ризосферные локусы, что приводит к росту общей численности микроорганизмов в почве [27]. Отметим, что ризосферный эффект наиболее ярко проявляется в бедных почвах приполярных регионов [13].
Отмечается существенное уменьшение длины и биомассы мицелия актиномицетов вблизи комбината (зона 3 км) – 1.7 и 0.06 × 10–3 мг/г соответственно, тогда как на удаленных участках (16–50 км) эти параметры изменялись от 16.4 до 22.6 и от 0.61 до 0.85 × 10–3 мг/г соответственно. Данную закономерность можно объяснить значительной чувствительностью группы актиномицетов к различным негативным факторам по сравнению с грибами или бактериями [56]. Для сравнения вблизи алюминиевого предприятия актиномицеты были наиболее устойчивой частью микробного сообщества: снижение активности конкурентных микроорганизмов, изменение рН почвы в щелочную сторону позволило им развиваться даже при наличии высокого количества загрязнителей [17]. При этом выбросы завода не оказывали влияния на численность и биомассу других групп прокариот. Факт угнетения актиномицетов в зоне воздействия медно-никелевого и стимуляции вблизи алюминиевого завода и ранее отмечен для культивируемой микробиоты [1, 7, 17].
Выявлено существенное (на порядок) угнетение грибного мицелия вблизи медно-никелевого комбината по сравнению с удаленными участками. На расстоянии 16 км (в зоне среднего загрязнения) отмечались максимальные значения биомассы и длины мицелия, они составили 0.49 и 396.9 м/г почвы соответственно. В ранее проведенных работах вблизи медно-никелевого комбината выявлено снижение грибной биомассы по сравнению с удаленными участками, ее значения были на порядок выше [15], чем в настоящем исследовании. Можно предположить, что почти десятилетнее воздействие комбината оказало угнетающее воздействие на почвенные микроскопические грибы. В предшествующих работах определение грибной биомассы проводили по иной методике [50] без разделения на споры и мицелий, поэтому сравнение полученных результатов не считаем корректным. Для сравнения в зоне воздействия алюминиевого завода в рассматриваемом районе Кольского полуострова отмечалось небольшое увеличение биомассы и длины грибного мицелия, существенных изменений по градиенту загрязнения не выявлено [17]. В целом биомасса почвенных грибов на исследуемой территории была существенно больше, чем в городских почвах Апатитов, и меньше, чем в Мурманске [16, 48].
Длина грибного мицелия в исследованных почвах варьировала от 51.2 до 396.9 м/г почвы. Как и в случае биомассы, максимальные значения отмечались на расстоянии 16 км от источника выбросов, а минимальные – в 3 км зоне. Более половины грибной биомассы (69–85%) приходилось на мицелий в почве удаленных участков (16 км и далее), тогда как вблизи комбината только 52% грибов имели мицелиальную форму. Отмечалось увеличение доли спор вблизи источника выбросов. Такая тенденция наблюдалась для всех антропогенно-нарушенных почв Кольского полуострова [47, 48] и других регионов [30].
Несмотря на то, что почва – естественная среда обитания большей части грибов, в ней часто складываются неблагоприятные условия для развития пропагул микобиоты [8, 43]. Поэтому необходимо оценивать не только долю активной биомассы – мицелия, но и процент покоящихся клеток [21]. Численность грибных спор изменялась от нескольких сотен до нескольких сотен тысяч на грамм почвы, что на порядок меньше, чем для почв Большеземельской тундры [12], но соответствует результатам для почв баренцевоморского побережья Кольского полуострова [47]. На участках, расположенных в 16 км и далее от источника выбросов, 96% спор представлено мелкими формами до 3 мкм (табл. 3), что характерно для почв полярных регионов [20]. Крупные споры встречались только на удаленных участках и составляли 1–3% от общей биомассы спор. Наименьшая численность и биомасса крупных спор отмечена на сильнозагрязненном участке. Большая часть (от 65 до 100%) пропагул микобиоты представлена экземплярами мелкого размера, 2–3 мкм. Наименьшая доля мелких пропагул (65–88%) выявлена в почвах, наиболее удаленных от комбината, где отмечены крупные споры и дрожжи диметром 5 мкм. Такой факт может свидетельствовать о сильном стрессовом воздействии ТМ у комбината, которое сокращает долю крупных клеток грибов [4, 45]. Около 68% выявленных пропагул грибов имело округлую форму с гладкой поверхностью; 15% округлые и шероховатые; 12% – овальные с гладкой поверхностью; 5% – имеют овальную форму с неровностями.
Таксономическое разнообразие микромицетов в почве по градиенту загрязнения от комбината “Печенганикель” представлено 26 видами, 13 родами, 13 семействами (Aspergillaceae, Cladosporiaceae, Cunninghamellaceae, Didymellaceae, Hypocreaceae, Mucoraceae, Myxotrichaceae, Pleosporaceae, Saccotheciaceae, Stachybotryaceae, Torulaceae, Umbelopsidaceae, Incertae Sedis), 9 порядками (Capnodiales, Dothideales, Eurotiales, Helotiales, Hypocreales, Mucorales, Pleosporales, Umbelopsidales, Incertae Sedis), 6 классами (Eurotiomycetes, Leotiomycetes, Sordariomycetes, Dothideomycetes, Mucoromycetes, Umbelopsidomycetes), 2 отделами (Ascomycota, Mucoromycota) (табл. 4).
Выявлено сокращение видового разнообразия микроскопических грибов по мере приближения к источнику выбросов. Если на фоновом участке таксономическое разнообразие микромицетов представлено 21 видом, то на расстоянии 30–16 км оно существенно сократилось до 12–10 видов соответственно. В зоне сильного загрязнения оно представлено всего 7 видами. В почве исследуемых участков по разнообразию доминировали грибы рода Penicillium, как и на всем Кольском полуострове, они составили почти 50% от общего количества выделенных видов. В число доминирующих по обилию в почве всех участков входили представители Penicillium raistrickii. Данный вид относится к часто встречающимся на Кольском полуострове [14]. В зоне 16 км от источника выбросов доминировали представители Aureobasidium pullulans и Trichoderma viride (16 км), темноокрашенные дрожжи Torula lucifuga (3 км). Доминирование темноокрашенных микромицетов в антропогенно-нарушенных почвах отмечалось и ранее [29, 41]. По мере удаления от источника выбросов структура грибного сообщества менялась с монодоминантной на полидоминантую. На расстоянии 30–50 от источника выбросов отмечалось увеличение количества доминирующих видов.
Степень сходства видового состава комплексов микроскопических грибов сильнозагрязненного и фонового участков составляла всего 34%, тогда как для других участков 50–82%. Полученные результаты свидетельствуют о существенном изменении видового состава комплексов почвенных микромицетов вблизи комбината по сравнению с фоном.
Наибольшее видовое разнообразие грибов характерно для 30–50 км зоны: 11 видов встречались только на этих участках (Gliomastix murorum var. murorum, Juxtiphoma eupyrena, Myxotrichum deflexum, Penicillium canescens, P. chermesinum, P. glabrum, P. implicatum, P. lividum, Stachybotrys echinatus, Umbelopsis sp., U. angularis) и не были выделены из почвы участков, расположенных ближе к комбинату “Печенганикель”. Грибы порядка Mucorales и Umbelopsidales являются типичными представителями почв холодных и умеренно-холодных регионов, относятся к группам психротолерантов и олиготрофов [38]. В фоновых почвах отмечено их большое разнообразие и обилие.
Поскольку видовое разнообразие и структура грибных сообществ зависят от множества факторов (погодные условия, физико-химические свойства почвы, особенности процедуры отбора образцов и их анализа и пр.), полученные в разное время результаты имеют ряд сходств и различий. Выявленные общие для разных периодов исследований тенденции: уменьшение видового разнообразия по мере приближения к источнику выбросов, доминирование темноокрашенных микромицетов вблизи комбината, а представителей отдела Mucoromycota – на фоновой территории позволяют определить чувствительные и устойчивые виды микроскопических грибов и использовать их в целях биоиндикации нарушенных экосистем. Наибольший потенциал к ремедиации загрязненных территорий отмечен у толерантных к ТМ штаммов Aureobasidium pullulans, Trichoderma viride и Torula lucifuga. По всей видимости они способны адсорбировать и обезвреживать поллютанты, рационально заняться разработкой биопрепаратов-ремедиантов на основе пропагул данных микромицетов. В дальнейшем перспективно продолжить работу в направлении поиска микроорганизмов, способных восстановить территории горно-металлургического комбината в условиях Арктики.
ЗАКЛЮЧЕНИЕ
Выбросы медно-никелевого комбината, расположенного на Кольском полуострове, оказали существенное влияние на количественные и качественные показатели почвенных микробных сообществ. Выявлено увеличение количества копий генов всех групп микроорганизмов по мере приближения к источнику выбросов. Вблизи комбината “Печенганикель” обнаружено наибольшее количество копий генов архей, бактерий и грибов по сравнению с другими районами Кольского полуострова, как фоновыми, так и антропогенно-измененными, что может быть связано с ростом доли штаммов, толерантных к ТМ.
Биомасса прокариот, напротив, уменьшалась по мере приближения к заводу. Грибная биомасса практически не изменялась по градиенту загрязнения, что свидетельствует об устойчивости этой группы микроорганизмов к выбросам комбината, способности аккумулировать ТМ в мицелии и переводить их в малотоксичное состояние.
Оценка количественных показателей почвенных микробных сообществ с применением разных методов (молекулярно-генетических и флуоресцентной микроскопии), несмотря на противоречивость полученных результатов, очень важна, так как позволяет оценить структуру микробных сообществ и выявить тенденции ее изменений под воздействием выбросов комбината. Различия в результатах могут быть связаны с особенностью методик, специфичностью праймеров в случае молекулярно-генетического анализа и неравномерностью распределения ДНК в клетках микроорганизмов.
Выбросы медно-никелевого комбината оказывают сильное воздействие на культивируемую часть сообщества, что выражается в изменении видового состава и структуры сообществ микроскопических грибов. Выявлено сокращение видового разнообразия комплексов почвенных микромицетов, перестройка структуры их сообществ.
Полученные данные можно использовать в целях биоиндикации нарушенных экосистем. Показано кардинальное изменение структуры биомассы микроорганизмов и смена таксономического состава сообществ почвенных микромицетов с полидоминантной на монодоминантную в зоне воздействия выбросов горно-металлургического комбината. Метод ПЦР в реальном времени также хорошо подходит для выявления нарушенных экосистем, поскольку показал резкое увеличение численности рибосомальных генов всех рассмотренных групп микроорганизмов (археи, бактерии и грибы) по мере приближения к комбинату. Отмечено, что в зоне наибольшего загрязнения доминировали Aureobasidium pullulans, Trichoderma viride и Torula lucifuga, в то время как на фоновом участке преобладали представители порядков Mucorales и Umbelopsidales. Виды, доминирующие вблизи комбината, могут обладать большим потенциалом к биоремедиации загрязненных ТМ почв и быть использованы для разработки биопрепаратов.
Список литературы
Благодатская Е.В., Пампура Т.В., Богомолова И.Н., Копцик Г.Н., Лукина Н.В. Влияние выбросов мeдно-никелевого комбината на микробные сообщества почв лесных биогеоценозов Кольского полуострова // Известия РАН. Сер. биологическая. 2008. № 2. С. 232–242.
Вечерский М.В., Семенов М.В., Лисенкова А.А., Степаньков А.А. Метагеномика – новое направление в экологии // Известия РАН. Сер. биологическая. 2022. № 1. С. 70–81. https://doi.org/10.31857/S1026347022010152
Глушакова А.М., Качалкин А.В., Чернов И.Ю. Особенности динамики эпифитных и почвенных дрожжевых сообществ в зарослях недотроги железконосной на перегнойно-глеевой почве // Почвоведение. 2011. № 8. С. 966–972.
Горбунова Е.А., Терехова В.А. Тяжелые металлы как фактор стресса для грибов: проявление их действия на клеточном и организменном уровнях // Микология и фитопатология. 1995. № 29(4). С. 63–69.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1096. https://doi.org/10.7868/S0032180X15090038
Евдокимова Г.А., Корнейкова М.В., Мозгова Н.П., Редькина В.В. Микроорганизмы воздушной среды обитания по градиенту загрязнения от комбината “Печенганикель” к заповеднику “Пасвик” // Вестник Кольского научного центра РАН. 2012. № 3. С. 22–25.
Евдокимова Г.А., Мозгова Н.П., Корнейкова М.В. Содержание и токсичность тяжелых металлов в почвах зоны воздействия газовоздушных выбросов комбината “Печенганикель” // Почвоведение. 2014. № 5. С. 625–625. https://doi.org/10.7868/S0032180X14050049
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. С. 60.
Иванова Е.А., Першина Е.В., Карпова Д.В., Тхакахова А.К., Железова А.Д., Рогова О.Б., Семенов М.В., Стифеев А.И., Никитин Д.А., Колганова Т.В., Андронов Е.Е. Прокариотные сообщества почвогрунтов отвалов Курской магнитной аномалии // Экологическая генетика. 2020. № 18(3). С. 331–342. https://doi.org/10.17816/ecogen17901
Кадулин М.С., Копцик Г.Н. 2013. Эмиссия СО2 почвами в зоне влияния горно-металлургического комбината “Североникель” в Кольской Субарктике // Почвоведение. № 11. С. 1387–1387. https://doi.org/10.7868/S0032180X13110063
Кашулина Г.М., Кубрак А.Н., Коробейникова Н.М. Кислотность почв в окрестностях медно-никелевого комбината “Североникель”, Кольский полуостров // Почвоведение. 2015. № 4. С. 486–486. https://doi.org/10.7868/S0032180X15040048
Ковалева В.А., Денева С.В., Панюков А.Н. Микробиологические показатели почвы постагрогенного биогеоценоза в тундровой зоне // Вестник Института биологии Коми НЦ УрО РАН. 2016. № 4(198). С. 2–9. https://doi.org/10.31140/j.vestnikib.2016.4(198).1
Копцик Г.Н., Копцик С.В., Смирнова И.Е. Альтернативные технологии ремедиации техногенных пустошей в Кольской Субарктике // Почвоведение. 2016. № 11. С. 1375–1391. https://doi.org/10.7868/S0032180X16090082
Корнейкова М.В., Евдокимова Г.А., Лебедева Е.В., Чапоргина А.А. Комплексы микромицетов в воздухе антропогенно-загрязненных территорий Кольского полуострова // Микология и фитопатология. 2015. № 49(4). С. 218–225.
Корнейкова М.В., Лебедева Е.В. Комплексы микроскопических грибов в лесных экосистемах в зоне воздействия выбросов медно-никелевых предприятий на Кольском полуострове // Проблемы лесной фитопатологии и микологии / IX Межд. конф., посвященная 90-летию со дня рожд. проф. Н.И. Федорова. Минск, 19–24 октября 2015 г. Минск. 2015. С. 98–101.
Корнейкова М.В., Никитин Д.А., Долгих А.В., Сошина А.С. Микобиота почв города Апатиты (Мурманская область) // Микология и фитопатология. 2020. № 54(4). С. 264–277. https://doi.org/10.31857/S0026364820040078
Корнейкова М.В., Никитин Д.А. Качественные и количественные характеристики почвенного микробиома в зоне воздействия выбросов Кандалакшского алюминиевого завода // Почвоведение. 2021. № 6. С. 725–734. https://doi.org/10.31857/S0032180X21060083
Кузьменкова Н.В., Кошелева Н.Е., Асадулин Э.Э. Тяжелые металлы в почвах и лишайниках тундровой и лесотундровой зон (cеверо-запад Кольского полуострова) // Почвоведение. 2015. № 2. С. 244–244. https://doi.org/10.7868/S0032180X14100062
Литвинов М.А. Определитель почвенных микроскопических грибов. Л.: Наука, 1967. 303 с.
Никитин Д.А. Экологические особенности грибов Антарктиды // Микология и фитопатология. 2021. № 55(2). С. 79–104. https://doi.org/10.31857/S0026364821020070
Никитин Д.А., Семенов М.В., Чернов Т.И., Ксенофонтова Н.А., Железова А.Д., Иванова Е.А., Хитров Н.Б., Степанов А.Л. Микробиологические индикаторы экологических функций почв (обзор) // Почвоведение. 2022. № 2. С. 1–16. https://doi.org/10.31857/S0032180X22020095
Обухов А.Я., Ефремова Л.Л. Охрана и рекультивация почв, загрязненных тяжелыми металлами // Тяжелые металлы в окружающей среде и охрана природы. Мат-лы 2-й Всесоюз. конф. М., 1988. Ч. 1. С. 23.
Одинцов П.Е., Караванова Е.И., Степанов А.А. Трансформация водорастворимых органических веществ подстилок подзолов фоновых и техногенных территорий Кольского полуострова // Почвоведение. 2018. № 8. С. 1022–1032. https://doi.org/10.1134/S0032180X18080099
Плеханова И.О., Золотарева О.А., Тарасенко И.Д., Яковлев А.С. Оценка экотоксичности почв в условиях загрязнения тяжелыми металлами // Почвоведение. 2019. № 10. С. 1243–1258. https://doi.org/10.1134/S0032180X19100083
Попов С.С., Попова Л.Ф., Малков А.В., Трофимова А.Н., Никитин Д.А. Оценка распределения тяжелых металлов в почвах о. Северный (Новая Земля) // Журн. Сиб. федер. ун-та. Биология. 2022. № 15(1). С. 128–141. https://doi.org/10.17516/1997-1389-0379
Семенов М.В. Метабаркодинг и метагеномика в почвенно-экологических исследованиях: успехи, проблемы и возможности // Журн. общ. биол. 2019. № 80(6). С. 403–417. https://doi.org/10.1134/S004445961906006X
Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355–369. https://doi.org/10.1134/S0032180X19010131
Трегубова П.Н., Копцик Г.Н., Степанов А.Л., Степанов А.А., Корнеечева М.Ю., Куприянова Ю.В. Влияние гуминовых препаратов на свойства деградированных почв техногенных пустошей // Бюл. Почв. ин-та им. В.В. Докучаева. 2019. № 97. С. 129–149. https://doi.org/10.19047/0136-1694-2019-97-129-149
Фокина А.И., Дабах Е.В., Домрачева Л.И., Скугорева С.Г., Лялина Е.И., Ашихмина Т.Я., Зыкова Ю.Н., Леонова К.А. Методические подходы к химико-биологической диагностике состояния почв техногенно-преобразованных территорий // Почвоведение. 2018. № 5. С. 589–600. https://doi.org/10.7868/S0032180X18050088
Шумилова Л.П., Куимова Н.Г., Терехова В.А., Александрова А.В. Разнообразие и структура комплексов микроскопических грибов в почвах города Благовещенска // Микология и фитопатология. 2014. № 48(4). С. 240–247.
Abdu N., Abdullahi A.A., Abdulkadir A. Heavy metals and soil microbes. // Environ. Chem. Lett. 2017. V. 15(1). P. 65–84. https://doi.org/10.1007/s10311-016-0587-x
Agarwal S.K. Heavy metal pollution. New Delhi: A.P.H. Publishing Corporation, 2009. 259 p.
Alloway B.J. (Ed.). Heavy metals in soils: trace metals and metalloids in soils and their bioavailability. Springer Science & Business Media, 2012. V. 22. P. 597.
Andronov E.E., Petrova S.N., Pinaev A.G., Pershina E.V., Rakhimgalieva S.Z., Akhmedenov K.M., Gorobets A.V., Sergaliev N.K. Analysis of the structure of microbial community in soils with different degrees of salinization using T-RFLP and real-time PCR techniques // Eurasian Soil Science. 2012. V. 45(2). P. 147–156. https://doi.org/10.1134/S1064229312020044
Baker B.J., De Anda V., Seitz K.W., Dombrowski N., Santoro A.E., Lloyd K.G. Diversity, ecology and evolution of Archaea // Nature Microbiol. 2020. V. 5. P. 887–900. https://doi.org/10.1038/s41564-020-0741-x
Bergauer K., Sintes E., van Bleijswijk J., Witte H., Herndl G.J. Abundance and distribution of archaeal acetyl-CoA/propionyl-CoA carboxylase genes indicative for putatively chemoautotrophic Archaea in the tropical Atlantic’s interior // FEMS Microbiology Ecol. 2013. V. 84(3). P. 461–473. https://doi.org/10.1111/1574-6941.12073
Boyce K.J., Andrianopoulos A. Fungal dimorphism: the switch from hyphae to yeast is a specialized morphogenetic adaptation allowing colonization of a host // FEMS Microbiol. Rev. 2015. V. 39(6). P. 797–811. https://doi.org/10.1093/femsre/fuv035
Domsch K.H., Gams W., Anderson T.H. Compendium of soil fungi / Ed. W. Gams. Eching: IHW-Verlag, 2007. 627 p.
Ferris H., Tuomisto H. Unearthing the role of biological diversity in soil health. Soil Biol. Biochem. 2015. V. 85. P. 101–109. https://doi.org/10.1016/j.soilbio.2015.02.037
Fierer N., Jackson J.A., Vilgalys R., Jackson R.B. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays. Appl Environ Microbiol. 2005. V. 71(7). P. 4117–4120. https://doi.org/10.1128/AEM.71.7.4117-4120.2005
Fokina N.V., Korneykova M.V., Redkina V.V., Myazin V.A., Sukhareva T.A. Biological activity and chemical properties of tundra soils of the Chukotka autonomous okrug in conditions of anthropogenic pollution // Eurasian Soil Science. 2022. V. 55. P. 45–55. https://doi.org/10.1134/S1064229322010045
Frąc M., Hannula S.E., Bełka M., Jędryczka M. Fungal biodiversity and their role in soil health // Front. Microbiol. 2018. V. 9. P. 707. https://doi.org/10.3389/fmicb.2018.00707
Garrett S.D. Soil fungi and soil fertility: an introduction to soil mycology. Elsevier, 2016. 147 p.
Glöckner F.O., Yilmaz P., Quast C., Gerken J., Beccati A., Ciuprina A., Brunsa G., Yarzac P., Pepliesc J., Westram R., Ludwig W. 25 years of serving the community with ribosomal RNA gene reference databases and tools // J. Biotechnology. 2017. V. 261. P. 169–176. https://doi.org/10.1016/j.jbiotec.2017.06.1198
Gube M. Fungal molecular response to heavy metal stress / Biochem. and molecular biology. Springer, 2016. P. 47–68. https://doi.org/10.1007/978-3-319-27790-5_4
Ji X., Abakumov E., Polyakov V. Assessments of pollution status and human health risk of heavy metals in permafrost-affected soils and lichens: A case-study in Yamal Peninsula, Russia Arctic // Human and Ecolog. Risk Assessment. 2019. V. 25(8). P. 2142–2159. https://doi.org/10.1080/10807039.2018.1490887
Korneykova M., Nikitin D.A., Myazin V.A. Qualitative and quantitative characteristics of soil microbiome of Barents Sea coast, Kola Peninsula // Microorganisms. 2021. V. 9(10). P. 2126. https://doi.org/10.3390/microorganisms9102126
Korneykova M.V., Vasenev V.I., Nikitin D.A., Dolgikh A.V., Soshina A.S., Myazin V.A., Nakhaev M.R. Soil microbial community of urban green infrastructures in a polar city // Urban Ecosystems. 2022. P. 1–17. https://doi.org/10.1007/s11252-022-01233-8
Masindi V., Muedi K.L. Environmental contamination by heavy metals // Heavy Metals. 2018. P. 115–132.
Olsen R.A., Hovland J. Fungal Flora and Activity in Norway Spruce Needle Litter: Report. Ås: Agricultural University of Norway, 1985.
Pal A., Bhattacharjee S., Saha J., Sarkar M., Mandal P. Bacterial survival strategies and responses under heavy metal stress: A comprehensive overview // Critical Rev. Microbiol. 2022. V. 48(3). P. 327–355. https://doi.org/10.1080/1040841X.2021.1970512
Riaz M., Kamran M., Fang Y., Wang Q., Cao H., Yang G., Deng L., Wang Y., Zhou Y., Anastopoulos I., Wang X. Arbuscular mycorrhizal fungi-induced mitigation of heavy metal phytotoxicity in metal contaminated soils: a critical review // J. Hazard. Materials. 2021. V. 402. P. 123919. https://doi.org/10.1016/j.jhazmat.2020.123919
Schmidt N.M., Hardwick B., Gilg O., Høye T.T., Krogh P.H., Meltofte H., Michelsen A., Mosbacher J.B., Raundrup K., Reneerkens J., Stewart L., Wirta H., Roslin T. Interaction webs in arctic ecosystems: Determinants of arctic change? // Ambiol. 2017. V. 46. P. 12–25. https://doi.org/10.1007/s13280-016-0862-x
Seelmann C.S., Willistein M., Heider J., Boll M. Tungstoenzymes: occurrence, catalytic diversity and cofactor synthesis // Inorganics. 2020. V. 8(8). P. 44. https://doi.org/10.3390/inorganics8080044
Seifert K.A., Gams W. The genera of Hyphomycetes – 2011 update // Persoonia: Molecular Phylogeny and Evolution of Fungi. 2011. V. 27. P. 119. https://doi.org/10.3767/003158511X617435
Singh S., Pandey S., Chaudhary H.S. Actinomycetes: tolerance against heavy metals and antibiotics // Int. J. Bioassays. 2014. V. 3. P. 3376–3383.
Sun W., Cheng K., Sun K.Y., Ma X. Microbially mediated remediation of contaminated sediments by heavy metals: a critical review // Current Poll. Rep. 2021. V. 7(2). P. 201–212. https://doi.org/10.1007/s40726-021-00175-7
Van Elsas J.D., Hartmann A., Schloter M., Trevors J.T., Jansson J.K. The bacteria and archaea in soil // Modern Soil Microbiol. CRC Press, 2019. P. 49–64.
Yu Y., Lee C., Hwang S. Analysis of community structures in anaerobic processes using a quantitative real-time PCR method. Water Sci. Technol. 2005. V. 52. P. 85–91. https://doi.org/10.2166/wst.2005.0502
Дополнительные материалы отсутствуют.
Инструменты
Почвоведение