Почвоведение, 2023, № 5, стр. 626-639
Изменение бактериального сообщества почвы при разложении соломы в зависимости от содержания доступного органического вещества
О. В. Орлова a, *, А. А. Кичко a, Е. Л. Чирак b, А. О. Зверев a, Т. О. Лисина a, Е. Е. Андронов a, c
a Всероссийский НИИ сельскохозяйственной микробиологии
196608 Санкт-Петербург, ш. Подбельского, 3, Россия
b АТГ Сервис Ген
199178 Санкт-Петербург, пр-т Малый В.О., 57, Россия
c Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
* E-mail: falenki@hotmail.com
Поступила в редакцию 30.08.2022
После доработки 22.12.2022
Принята к публикации 27.12.2022
- EDN: IEECPH
- DOI: 10.31857/S0032180X22601074
Аннотация
Рассмотрено влияние содержания почвенного доступного органического вещества на состав и функционирование микробного сообщества при трансформации соломы ячменя в почве. Дерново-подзолистую почву (Umbric Albic Retisols (Abruptic)), слой 0–20 см, инкубировали (25°С, 60% ППВ) 4 мес. и получили модельную почву с пониженным содержанием доступного органического вещества. Провели лабораторный эксперимент с внесением соломы ячменя в нативную и модельную почву. В динамике (0, 7, 40 и 70 сут) анализировали дыхание почв, микробную биомассу, численность микроорганизмов и таксономический состав микробного сообщества (секвенирование по 16S рРНК). Качество органического вещества почвы оценивали по содержанию общего органического углерода (Собщ) и его фракций: доступного (Сдост), водорастворимого (Свод), лабильного. Показано, что в модельной почве вдвое снижается количество Свод и Сдост при отсутствии достоверных различий по содержанию Собщ. Кроме того, отмечено видимое ухудшение агрегатной структуры почвы и ускорение в ней трансформации соломы, на 25% больше, чем в нативной. На таксономический состав бактериального сообщества почвы влияли количество в почве исходного доступного органического вещества, внесение соломы и время инкубации. Уменьшение содержания доступного органического вещества изменяло состав микробного сообщества: уменьшались доли филумов Acidobacteria и Firmicutes, возрастали доли Actinobacteria, Bacteroidetes, Chloroflexi, Planctomycetes и архей. Выявлено, что доминирующая часть (50% от суммы) микробного сообщества обедненной почвы характеризуется большим разнообразием и олиготрофностью. Предлагаются индикаторы для сравнения почв по олиготрофности микробного сообщества на основе таксономического состава.
ВВЕДЕНИЕ
Органическое вещество (ОВ) – важнейшая составляющая почв, определяющая их плодородие и глобальные биохимические процессы, включая изменение климата. Ключевым фактором в этих процессах является микробная трансформация ОВ, в связи с чем важной характеристикой почвенного ОВ будет его доступность для микроорганизмов. В зависимости от доступности (или времени оборачиваемости) ОВ почвы подразделяют на активный и пассивный пулы [14, 15, 29, 32, 35]. Доступное ОВ является основным источником энергии и питательным субстратом, а также влияет на водно-физические свойства и агрегатное состояние почв [3, 6, 8–10, 14, 15, 19, 21, 29, 30, 32].
Известно, что понятия подвижное (лабильное) и доступное (активное) ОВ почвы не идентичны [8, 9, 14, 19]. Количество в почве доступного ОВ, время оборачиваемости которого от <3 до 10 лет, определяется с использованием биокинетических методов на основе минерализации ОВ микроорганизмами [11, 14, 19, 35]. Подвижное ОВ определяется прочностью связи с минеральной частью почвы, для его выделения используют различные экстрагенты [3, 8–10, 14, 23, 35]. В таких экстрактах из-за отсутствия селективности присутствуют органические вещества различного состава, питательного и энергетического статуса [5, 8, 9, 15]. Следовательно, не все подвижное ОВ является активным, однако подвижную фракцию допустимо считать потенциальным резервом минерализуемого ОВ.
В современных условиях (обезлесивание, опустынивание, водная и ветровая эрозия, недостаток органических удобрений и др.) отмечается значительное сокращение содержания ОВ в пахотных почвах России [14, 20]. Прежде всего, почва теряет доступное ОВ, что приводит к увеличению олиготрофности ее микробного сообщества (МС). Известна экологическая классификация микроорганизмов (r- и k-стратеги) на основе способности утилизировать органический углерод почвы [28]. Микроорганизмы, обладающие высокими темпами роста и имеющие численное преимущество в средах, обогащенных доступным ОВ, относят к r-стратегам (копиотрофам). K-стратеги (олиготрофы) – медленнорастущие микроорганизмы, с мощным ферментативным аппаратом, более эффективно разлагающие ОВ меньшей доступности и пониженной концентрации в среде [28, 33, 39, 42]. Для почв, различающихся по землепользованию, влияющему на накопление ОВ, метагеномными исследованиями показан значительный контраст по представленности популяций копиотрофов и олиготрофов, например, выявлен рост доли олиготрофов при снижении содержания ОВ [33, 39, 42]. Олиготрофное МС характеризуется преобладанием Alpha- и Deltaproteobacteria, Planctomycetes, Chloroflexi и Acidobacteria [26, 33, 37, 38, 41, 42]. Существует мнение, что почвы с преобладанием олиготрофов могут иметь низкий оборот углерода [39].
Наиболее эффективно различия почв по качественному составу МС проявляются при определенных внешних воздействиях [4]. В качестве внешнего фактора рекомендуют использовать внесение свежего ОВ (метод инициированного МС) [4]. В настоящем эксперименте инициирующим фактором служила солома. Возможны два сценария разложения соломы в почве с олиготрофным МС: ускоренное разложение со значительными потерями СО2 из почвы и, напротив, замедленное с повышенным закреплением углерода (рост секвестрации).
Изучение влияния количества почвенного доступного ОВ на функционирование МС осложнено трудностью в подборе почв, различающихся только по данному признаку. В связи с этим разработан способ получения таких модельных почв искусственно.
Цель работы – оценка влияния уменьшения количества доступного ОВ в почве на состав и функционирование МС.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили с дерново-подзолистой почвой (Umbric Albic Retisols (Abruptic)) под залежью, отобранной из слоя 0–20 см в ОПХ “Родина” (Псковская область). Для получения модельной почвы с пониженным содержанием доступного ОВ проводили четырехмесячную предварительную инкубацию (при 25°С, 60% полной полевой влагоемкости (ППВ) и перемешивании раз в неделю). Оба варианта почвы: исходную, нативную (далее П1) и обедненную за 4 мес. предварительной инкубации доступным ОВ (далее П2) использовали для дальнейшего эксперимента (табл. 1). Варианты: П1 контроль, П1 + солома; П2 контроль, П2 + солома. Опыт проводили в чашках Петри (повторность 17-кратная на вариант) и 500 мл флаконах для учета выделения СО2 (5-кратная повторность). Навеска сухой почвы 50 г на чашку и 30 г на флакон. В соответствующие варианты в почву вносили 1% измельченной до 2–3 мм соломы ячменя (зольность 7.6%, Nобщ 1.95%, Pобщ 1.1%, Kобщ 2.47%). Почву в чашках и флаконах увлажняли до 50% ППВ с учетом воды, необходимой для увлажнения соломы. Инкубацию проводили под стеклянными колпаками для сохранения влажности на постоянном уровне (контроль по весу 1 раз в 10 сут) при 23–25°С. В динамике (0, 7, 40 и 70 сут) оценивали выделение СО2, содержание нитратов, аммонийного азота, водорастворимого углерода, микробной биомассы и таксономическую структуру микробиома (на основании высокопроизводительного секвенирования библиотек гена 16S-рРНК). Анализы проводили из смешанного образца в 3–5-кратной повторности.
Таблица 1.
Химические показатели дерново-подзолистой почвы (П1 – нативная; П2 – обедненная доступным ОВ)
| Показатель | П1 | П2 | ||||
|---|---|---|---|---|---|---|
| до инкубации | через 70 сут | до инкубации | через 70 сут | |||
| без соломы | + солома | без соломы | + солома | |||
| Собщ, % | 1.20 ± 0.04 | 1.11 ± 0.05 | 1.22 ± 0.05 | 1.18 ± 0.02 | 1.09 ± 0.03 | 1.25 ± 0.03 |
| Свод, мг/100 г | 41.2 ± 1.6 | 28.4 ± 2.7 | 31.3 ± 0.4 | 19.4 ± 0.9 | 16.6 ± 1.9 | 29.4 ± 1.0 |
| Слаб, мг/100 г | 160 ± 17.8 | 120 ± 16.2 | 142 ± 7.5 | 136 ± 7.7 | 115 ± 7.2 | 128 ± 10.4 |
| Потери с дыханием, | – | 143.5 ± 5.0 | 571.6 ± 11.9 | – | 70.3 ± 2.7 | 474.9 ± 18.4 |
| мг С–СО2/100 г | (428.1)* | (404.6)* | ||||
| Nобщ, % | 0.230 ± 0.03 | 0.214 ± 0.01 | 0.220 ± 0.03 | 0.239 ± 0.07 | 0.219 ± 0.03 | 0.216 ± 0.04 |
| рНKCl | 5.22 ± 0.01 | 5.32 ± 0.02 | 5.17 ± 0.02 | 5.56 ± 0.02 | 4.82 ± 0.05 | 5.23 ± 0.03 |
| Рподв, мг Р2О5 /100 г | 1.47 ± 0.17 | 2.01 ± 0.37 | 2.07 ± 0.26 | 1.57 ± 0.13 | 1.60 ± 0.20 | 1.77 ± 0.13 |
| Кподв, мг K/100 г | 1.98 ± 0.06 | 2.53 ± 0.54 | 5.65 ± 0.21 | 2.88 ± 0.04 | 2.46 ± 0.96 | 6.83 ± 1.3 |
| Нитраты, мг N/ 100 г | 0.11 ± 0.0 | 6.22 ± 0.65 | 1.32 ± 0.49 | 7.7 ± 0.52 | 10.0 ± 0.71 | 2.35 ± 0.00 |
Химическую характеристику почвы и соломы выполняли общепринятыми методами [1, 17]. Общий углерод (Собщ) почвы определяли по Тюрину, сжигание в сушильном шкафу, окончание титриметрическое. Количество остаточной соломы в почве оценивали методом флотации в 0.5 н. Na2SO4 [13]. Водорастворимые соединения (Свод) выделяли горячей водной вытяжкой [23]. Подвижные гумусовые соединения (Слаб, лабильный гумус в терминологии конца XX в.) из почв выделяли 0.1 н. пирофосфатом Na (рН 10.0). Содержание органического углерода в вытяжках исследовали по Паникову с соавт. [12] на спектрофотометре Ultraspec (LKB, Швеция; λ = 340 нм). Эмиссию СО2 из почв определяли газохроматографическим методом на хроматографе Цвет (ОКБА НПО “Химавтоматика”, Россия), газ носитель – гелий, детектор – катарометр. Биомассу микроорганизмов оценивали методом субстрат индуцированного дыхания [40]. Количество доступного ОВ определяли инкубационным методом [11]. Численность физиологических групп микроорганизмов – стандартными методами [18].
Таксономический состав бактериального сообщества почв определяли с применением высокопроизводительного секвенирования библиотек гена 16S рРНК. Для этого выделяли ДНК с использованием наборов MoBio (CША) из навески 0.2 г замороженной почвы с добавлением приблизительно равного по объему количества матрикса (шариков) [2]. Для получения библиотеки гена 16S-рРНК бактерий использовали пару праймеров fBD1/rBD1: 642f 5'-HAATHYGTGCCAGCAGC-3', 1445r 5'-GTCRTCCYDCCTCCTC-3' с соответствующими баркодами и служебными последовательностями. Реакцию проводили в автоматическом амплификаторе Thermal Cycler T100 (Bio-Rad, США) в следующем режиме: начальная денатурация при 95°С – 3 мин, 32 цикла, 94°С – 30 с, 55°С – 30 с, 72°С – 1 мин, завершающий синтез – 72°С 5 мин [7]. Библиотеки секвенировали с использованием секвенатора Junior GS (Roche, США) в соответствии с руководством к прибору.
Результаты секвенирования обрабатывали в программе QIIME [25] согласно рекомендациям авторов, по следующему алгоритму: демультиплексинг библиотек и фильтрация по качеству прочтения; de novo ОТЕ-пикинг и аннотация референсных последовательностей при помощи встроенного классификатора GreenGenes [27]; удаление синглетонов; удаление химер проводили с помощью алгоритма uchime в программе vsearch [36]; анализ представленности таксонов; анализ бета-разнообразия; нормализация прочтений и анализ альфа-разнообразия. Статистическую обработку остальных данных осуществляли с использованием программы Excel.
РЕЗУЛЬТАТЫ
Исходно П2 по сравнению с нативной П1 содержала меньше подвижных (в водной и пирофосфатной вытяжках) и доступных (соответственно 6 и 12% от Собщ) ОВ, при этом различия по содержанию общего углерода статистически недостоверны. Снижение количества доступного ОВ в П2 по сравнению с П1 было больше для легкоминерализуемого (соответственно 383 и 922 мг С/кг), чем для среднедоступного (320 и 513 мг С/кг для П2 и П1) углерода (разделение на фракции по Орловой [11]). За счет интенсивной минерализации в процессе получения П2 в ней было больше содержание минеральных соединений азота, подвижных калия и фосфора.
Отмечено, что при одинаковой влажности (17.62 ± 0.32 и 17.78 ± 0.12% соответственно П1 и П2, среднее из трех повторностей и стандартное отклонение) обедненная доступным ОВ почва потеряла агрегатную структуру и выглядела переувлажненной (рис. 1), подтверждая мнение о том, что лабильное ОВ является “клеем” почвенных агрегатов [8–10, 15, 21, 22]. Существенных различий по влагоемкости почв (соответственно 37.92 ± ± 0.35 и 38.72 ± 1.2%) не выявлено.
Условия лабораторного эксперимента способствовали минерализации ОВ, что привело к сокращению, как общего, так и подвижного углерода в контрольных вариантах к концу опыта. Для обедненной доступным ОВ почвы снижение содержания подвижных соединений было меньше: соответственно для П1 и П2 убыль Слаб составляла 25.0 и 15.9%, Свод – 31.1 и 14.4%. Внесение соломы приводило к сохранению, и даже некоторому увеличению, содержания Собщ и Свод в почве, за исключением Слаб для П1. Потери СО2 за счет соломы из почвы П1 и П2 были практически одинаковы.
За счет минерализации соломы произошло увеличение содержания подвижных фосфора (прибавка на 3 и 10% для П1 и П2 соответственно) и калия (прибавка 123 и 178%) в почве относительно контрольных вариантов. Содержание нитратного азота в вариантах с соломой снижалось на 79% для П1 и на 76.5% для П2.
Функционирование микробного сообщества почв оценивали по разложению соломы, дыханию и величине микробной биомассы. Наблюдали увеличение скорости минерализации соломы в почве, обедненной доступным ОВ: соответственно в П2 и П1 разложилось к концу опыта 67.1 и 41.7% от внесенной соломы. Выделение СО2 из П1 было больше по сравнению с П2 (рис. 2) на всем протяжении эксперимента, в том числе для вариантов с внесением соломы. Активное разложение соломы наблюдали до 40–45 сут, далее разница по эмиссии СО2 практически нивелируется для вариантов с соломой и без. Содержание микробной биомассы отражает количество доступного углерода в почве [14, 35, 30 ]. Биомасса микроорганизмов при внесении соломы существенно увеличивается на 7 и 40 сут как в П1, так и в П2, к 70 сут различия становятся несущественными. За редким исключением в П2 содержание микробной биомассы меньше, чем в соответствующих вариантах П1.
Рис. 2.
Динамика дыхания почв (a) и содержания микробной биомассы (b). Варианты здесь и далее: П1 – почва 1; П1 + С – почва 1 с внесением соломы; П2 – почва 2; П2 + С – почва 2 с внесением соломы.
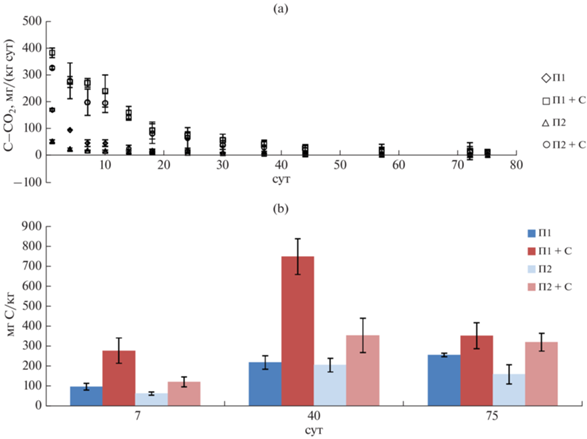
Отмечено, что в П2 ниже не только дыхание и биомасса микроорганизмов, но и их численность: средние за опыт значения в П1 и П2 соответственно: аммонифицирующих 13.0 ± 0.3 и 5.4 ± ± 0.1 млн КОЕ/г, амилолитических – 13.2 ± 1.0 и 4.4 ± 0.8 млн КОЕ/г. Показано, что в П2 в 2.6 раза больше целлюлозолитических микроорганизмов (среда Гетчинсона) – 16.7 против 6.5 тыс. КОЕ/г в П1. Внесение соломы ожидаемо увеличило численность почвенных микроорганизмов: в 1.7–2 раза аммонифицирующих и амилолитических, и в 5.6 и 6.2 раза целлюлозолитических. Однако для варианта П2 + солома в течение всего опыта численность аммонифицирующих и амилолитических микроорганизмов была меньше, чем для П1 в 2.1 и 3.6 раза, а целлюзолитических, напротив, выше в 2.8 раза. Следовательно, по численности физиологических групп микроорганизмов в П2 наблюдали сдвиг состава МС в сторону большей олиготрофности.
В результате секвенирования получено 136 332 прочтений, 107 445 из которых прошли фильтры качества. Всего в анализе использовали данные 48 образцов, со средней глубиной секвенирования 4703 прочтения на образец, средняя длина прочтений составила 309 п.н. Для анализа альфа-разнообразия проводили нормирование количества последовательностей до 1471 последовательности на образец.
Филогенетический анализ по данным высокопроизводительного секвенирования библиотек гена 16S рРНК выявил в вариантах в разные сроки от 400 до 615 операционных таксономических единиц. Внесение соломы в оба варианта почвы во все сроки анализа снизило количество операционных таксономических единиц. Показано, что в начале эксперимента в нативной почве П1 выше количество видов (Chao1) и разнообразие МС (индекс Шеннона), при дальнейшей инкубации величина индексов в вариантах почвы выравнивается и меняется на противоположное – МС в П2 становится более олиготрофным по биоразнообразию (табл. 2). Внесение соломы в П1 и П2 снижает разнообразие МС по обоим индексам, особенно на 7 сут. При сравнении МС вариантов П1 + солома и П2 + солома прослеживается тенденция роста биоразнообразия при меньшем количестве доступного ОВ.
Таблица 2.
Индексы биоразнообразия микробного сообщества почвы
| Вариант | 0 сут | 7 сут | 40 сут | 70 сут |
|---|---|---|---|---|
| Индекс Chao1 | ||||
| П1 контроль | 1925 ± 111 | 1519 ± 40 | 1252 ± 38 | 1644 ± 303 |
| П1 + солома | 1377 ± 99 | 1246 ± 37 | 1294 ± 121 | 2191 ± 231 |
| П2 контроль | 1540 ± 224 | 1157 ± 182 | 1158 ± 92 | 1754 ± 339 |
| П2 + солома | 1300 ± 276 | 1173 ± 72 | 1305 ± 22 | 2219 ± 123 |
| Индекс Шеннона | ||||
| П1 контроль | 8.00 ± 0.20 | 7.52 ± 0.12 | 7.19 ± 0.05 | 7.87 ± 0.13 |
| П1 + солома | 7.21 ± 0.24 | 6.03 ± 0.14 | 6.68 ± 0.21 | 7.05 ± 0.17 |
| П2 контроль | 7.33 ± 0.37 | 7.32 ± 0.08 | 7.55 ± 0.26 | 7.88 ± 0.24 |
| П2 + солома | 7.14 ± 0.78 | 6.30 ± 0.13 | 6.94 ± 0.09 | 7.57 ± 0.10 |
В бактериальном сообществе доминируют филумы Acidobacteria, Actinobacteria, Proteobacteria и Firmicutes (рис. 3), достигающие в сумме для П1 80–85%, а П2 – 75–80%. При сравнении таксономического состава МС контрольных вариантов выявлено, что для обедненной доступным ОВ почвы характерно уменьшение доли Acidobacteria и Firmicutes и увеличение Actinobacteria, Bacteroidetes, Chloroflexi, Planctomycetes и архей, т.е. возрастает доля филотипов, относимых к олиготрофам (к‑стратегам). Наиболее чувствительными к количеству доступного ОВ оказались филы Proteobacteria и Armatimonadetes. Среди Proteobacteria в П2 увеличиваются доли Alphaproteobacteria и Deltaproteobacteria, при снижении Betaproteobacteria. Для более мелких таксонов также можно выделить реагирующих на содержание доступного ОВ в почве. Так, исходно в П2 ниже доля представителей отряда Solirubrobacterales (семейства Conexibacteraceae, Patulibacteraceae и Solirubrobacteraceae), семейства Koribacteraceae (в 2.5–5 раз), родов Geodermatophilus (с 0.26 до 0.07%) и Streptomyces (с 2.42 до 0.56%). Практически на порядок уменьшается доля рода Alicyclobacillus, тогда как доля Bacillus снижается незначительно. Увеличивается доля представителей семейства Frankiaceae (с 0.18 до 0.33%), значительно (от 2 до 8 раз) почти всех представителей семейств Intrasporangiaceae и Micrococcaceae, несколько слабее – Pseudonocardiaceae. Все это свидетельствует о существенном влиянии содержания доступного ОВ (почва П1 или П2) на состав бактериального сообщества.
Рис. 3.
Таксономический состав микробного сообщества (a) почв и отношение в нем r- и k-стратегов (b).
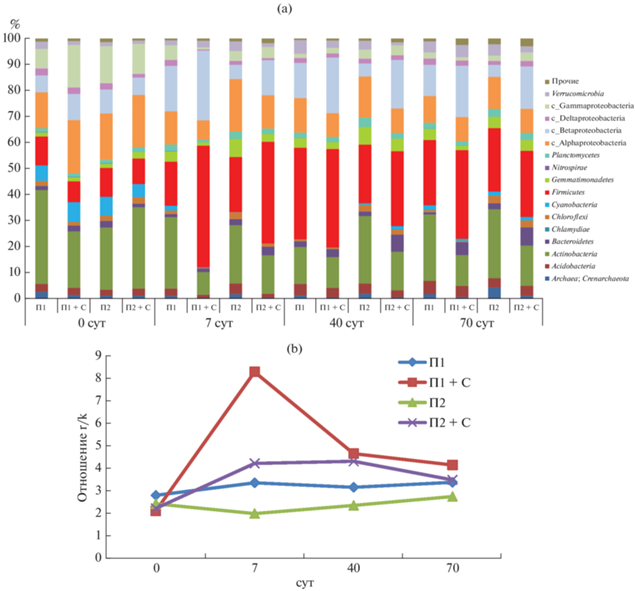
Обеднение почвы доступным ОВ имело эффект накопительной культуры для олиготрофной части МС с получением преимуществ в нем над условными r-стратегами (Actinobacteria, Betaproteobacteria, Bacteroidetes, Firmicutes и Gemmatimonadetes) k-стратегов (Alpha- и Deltaproteobacteria, Planctomycetes, Chloroflexi и Acidobacteria) [33, 42], обычно вступающих в процесс разложения субстратов на последних стадиях. Условность разделения понятна: из-за огромного филогенетического и физиологического разнообразия внутри каждого бактериального типа маловероятно, что весь тип будет демонстрировать одинаковые экологические характеристики [39]. В эксперименте наблюдали, что в П2 во все сроки анализа соотношение r/k ниже, чем в П1. В пользу преобладания в почве П2 k-стратегов свидетельствуют и данные по меньшим потерям СО2 из внесенной соломы, несмотря на больший объем разложившейся, так как считается, что почвы с преобладанием олиготрофов могут иметь меньшие выбросы СО2 [39]. Следовательно, МС П2 приобрело олиготрофные черты.
Внесение соломы в оба варианта почвы приводит, с одной стороны, к сходным изменениям: снижается доля актинобактерий, особенно в первые сроки, возрастает доля Firmicutes, меняется на противоположное соотношение альфа- и бета-протеобактерий (первые относят к k-, вторые – к r-стратегам). С другой стороны, выявлены и различия: в П2 ниже доля бацилл, но выше представленность актинобактерий и бактероидов, среди последних много целлюлозоразлагающих микроорганизмов (например, представители семейства Cytophagaceae).
Анализ таксономического состава бактериальных сообществ методом главных компонент выявил, что основной фактор различия – это варианты почвы, т.е. в итоге содержание доступного ОВ. Даже по невзвешенным данным (качественные различия, без учета представленности филотипов) исследуемые почвы четко разделялись, несмотря на то, что доля объясненной дисперсии по наиболее значимой оси не выше 8.1% (рис. 4b). Различия между почвами усиливаются, если учитывать количественные данные по филотипам (взвешенные данные), доля объясненной дисперсии достигает 34.2%.
Рис. 4.
Анализ данных таксономической структуры микробных сообществ методом главных компонент. Красный цвет – П1, синий – П2, a – взвешенные данные, b – невзвешенные.
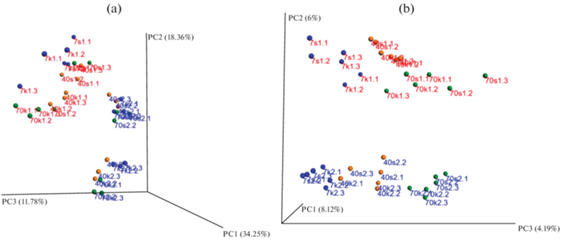
Следующими важными факторами являются внесение соломы и срок отбора образцов, т.е. время инкубации. На рис. 4 видно, что образцы П2 разделяются по взвешенным данным на две группы в зависимости от наличия или отсутствия соломы. Для нативной почвы (П1) большее значение имел фактор времени инкубации, чем внесение соломы. Следует отметить, что сукцессия МС более видна на невзвешенных данных, т.е. изменения МС в зависимости от срока отбора образцов – качественные (изменения таксономического состава).
ОБСУЖДЕНИЕ
Предложен способ получения модельной почвы для изучения влияния количества доступного ОВ в почве на различные показатели, в том числе состав и функционирование МС. Снижение количества доступного ОВ без существенных потерь Собщ достигается предварительной инкубацией почвы при оптимальных для минерализации ОВ условиях в течение 3–4 мес. Достоинством модели является отсутствие различий по гранулометрическому, минералогическому составу и другим показателям почв, что сложно выполнить для естественных почв с разным уровнем доступного ОВ.
Известна главенствующая роль химически подвижных и биологически активных компонентов ОВ почвы в процессах образования агрономически ценной структуры почвы [9, 15, 21, 22]. Показано, что уменьшение в почве П2 содержания подвижных и доступных фракций углерода в 2 раза, несмотря на неизменность содержания Собщ, привело к дезагрегации почвы. Исходя из того, что в П2 в наибольшей степени истощалась легкоминерализуемая фракция доступного ОВ (убыль на 60% относительно П1), можно полагать именно ее связующим материалом агрегатов. Снижение количества агрегатов размером 3–2, 2–1 и 1–0.5 мм при обеднении дерново-подзолистой почвы активным ОВ показано и другими исследователями [9].
Во фракцию Слаб входят различные по составу вещества, в том числе водорастворимые и легкоминерализуемые, а не только устойчивые гумусовые соединения [5, 9]. Тем не менее, в П2 содержание Слаб было меньше на 15%. Исходное обеднение возможных источников Слаб в П2 может быть причиной его меньшей относительной убыли в процессе инкубации, как в контрольных вариантах (на 15 и 25% в П2 и П1), так и при внесении соломы (соответственно на 6.0 и 15.4%).
Увеличение скорости минерализации соломы в П2 относительно П1 (соответственно к концу опыта разложилось 67 и 41.7% от внесенной соломы) связано не только с большей обеспеченностью П2 минеральным азотом, но возможен существенный вклад состава МС. Во-первых, содержание минерального азота в почве ниже оптимального для разложения соломы ячменя (в наличии 0.7% N, надо – 1.0–1.5% на вес соломы). Во-вторых, эффективность разложения труднодоступного субстрата, каким является солома ячменя, МС олиготрофной и естественной почвы будет различаться.
Наблюдаемая в контрольных вариантах сукцессия МС, по-нашему мнению, вызвана использованием для опыта сухой почвы, без предварительного увлажнения и компостирования. Известно, что при увлажнении сухой почвы происходит увеличение количества доступного ОВ [24, 30, 31].
Значительный интерес представляют индикаторные показатели, дающие возможность интерпретации микробного филогенетического состава с экологическими функциями МС и качеством ОВ. Такие индикаторы ценны, так как прямое определение потенциально минерализуемого ОВ биокинетическими методами занимает длительное время – 100–150 сут [9, 11, 14, 35]. В то же время снижение количества доступного ОВ в почве является первым шагом к деградации ОВ почвы. Поэтому индикаторы будут полезны при оценке различных вариантов обработки почвы, систем удобрений, севооборотов и др.
В качестве индикаторов обеспеченности почвы доступным ОВ предлагается использовать соотношения филумов МС, которые стабильно (во все сроки) существенно ниже или выше в одной из почв. В табл. 3 представлен результат деления соотношения филумов в почве П1 на аналогичное в П2 отдельно для контролей и вариантов с внесением соломы. Такой показатель взят для удобства, чтобы можно было отбросить значения, близкие к 1, оставив более значимые. Выбранные в качестве индикаторов истощения доступным ОВ в почве соотношения выделены в таблице желтым. Интересно, что таких индикаторных отношений выявлено для контролей меньше, чем для вариантов с соломой (соответственно 8 и 18), т.е. подтверждается, что различия между составом МС усиливаются при внесении свежих растительных остатков. Для контрольных почв индикаторами обедненности почв доступным ОВ служат бóльшие соотношения Proteobacteria/Chloroflexi, Firmicutes/Chloroflexi, Acidobacteria/Chloroflexi и Actinobacteria/Chloroflexi, а также низкие значения отношений Bacteroidetes/Verrucomicrobia, Bacteroidetes/Proteobacteria, Bacteroidetes/Firmicutes и Acidobacteria/Proteobacteria. Среди представителей Chloroflexi, Verrucomicrobia и Planctomycetes много олиготрофных микроорганизмов [26, 28, 33, 42], с чем связано их увеличенное количество в П2 и, соответственно, возможность использовать соотношения с этими филами в качестве индикатора. Применимость данных соотношений в качестве индикаторных для других почв нуждается в проверке.
Таблица 3.
Соотношения представленности фил в парных сравнениях (Acido/Acidobacteria, Actin/Actinobacteria, Bact/Bacteroidetes, Chloro/Chloroflexi, Gemm/Gemmatimonadetes, Firm/Firmicutes, Planct/Planctomycetes, Proteo/Proteobacteria, Verruc/Verrucomicrobia), определяемое, как [(P1/P2)П1:(P1/P2)П2], где P1 и P2 – представленности фил в микробиомах П1 и П2
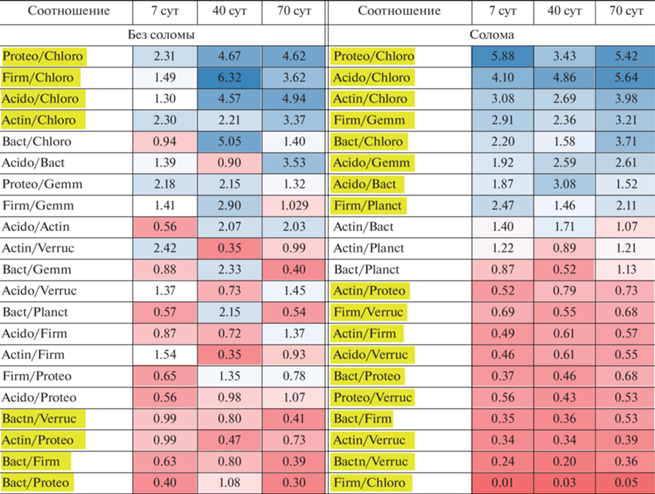
Примечание. Интенсивность окраски соответствует большим различиям между почвами; синий цвет (значения >1) – соотношение фил больше в нативной почве, красный (значения <1) – соотношение фил больше при обеднении почвы доступным ОВ (П2). Желтым выделены соотношения, предлагаемые в качестве индикаторов олиготрофности.
Анализ доминирующей части МС (рис. 5) провели, взяв филотипы, дающие в сумме 50% от суммы обнаруженных, и получили известные из классической микробиологии закономерности сукцессии микроорганизмов при внесении свежего органического субстрата [4]. На первом этапе наблюдали резкое увеличение численности r-стратегов, при доминировании 2–3 видов. Далее, с исчерпанием наиболее легкодоступных соединений, все большее участие начинают принимать другие виды, способные перерабатывать более стойкие соединения, в результате разнообразие МС увеличивается.
Рис. 5.
Динамика доминирующих филотипов в почвах на 40 и 70 сут опыта, П1 – исходная почва, П2 – почва, обедненная доступным ОВ; П1 + С – почва 1 с внесением соломы; П2 – почва 2; П2 + С – почва 2 с внесением соломы, где
| Условное обозначение | Порядок | Cемейство | Род |
|---|---|---|---|
| Bacill | Bacillales | Bacillaceae | Bacillus |
| Alic-bacil | Alicyclobacillaceae | Alicyclobacillus | |
| Bacillal | Burkholderiales | f__*** | g__*** |
| Oxalob | Oxalobacteraceae | g__*** | |
| Burkh | Burkholderiaceae | Burkholderia | |
| Comam | Comamonadaceae | Other | |
| Chthon | [Chthoniobacterales] | [Chthoniobacteraceae] | DA101** |
| Enterob | Enterobacteriales | Enterobacteriaceae | g__*** |
| Micrococ-1 | Actinomycetales | Micrococcaceae | Rothia |
| Micrococ-2 | Micrococcaceae | g__*** | |
| Streptom | Streptomycetaceae | Streptomyces | |
| Gaiel | Gaiellales | Gaiellaceae | g__*** |
| Ellin5301 | Gemmatimonadales | Ellin5301** | g__*** |
| Ellin5301 | Gemmatimonadales | Ellin5301** | g__*** |
| Strept | Lactobacillales | Streptococcaceae | Streptococcus |
| Nitros | Nitrososphaerales | Nitrososphaeraceae | Candidatus Nitrososphaera |
| Hypho | Rhizobiales | Hyphomicrobiaceae | Rhodoplanes |
| Rhizob | f__*** | g__*** | |
| Chitino | [Saprospirales] | Chitinophagaceae | g__*** |
| Sphing-1 | Sphingomonadales | Sphingomonadaceae | Kaistobacter |
| Sphing-2 | Sphingomonadaceae | Other | |
| SC-I-84 | SC-I-84** | f__*** | g__*** |
| Solir | Solirubrobacterales | f__*** | g__*** |
| Solirubr | Solirubrobacteraceae | g__*** | |
| Conexi | Conexibacteraceae | g__*** | |
| Patuli | Patulibacteraceae | g__*** | |
| Xanth | Xanthomonadales | Xanthomonadaceae | g__*** |
| Other | Other* | Other* | Other* |
| WD2101 | WD2101** | f__*** | g__*** |
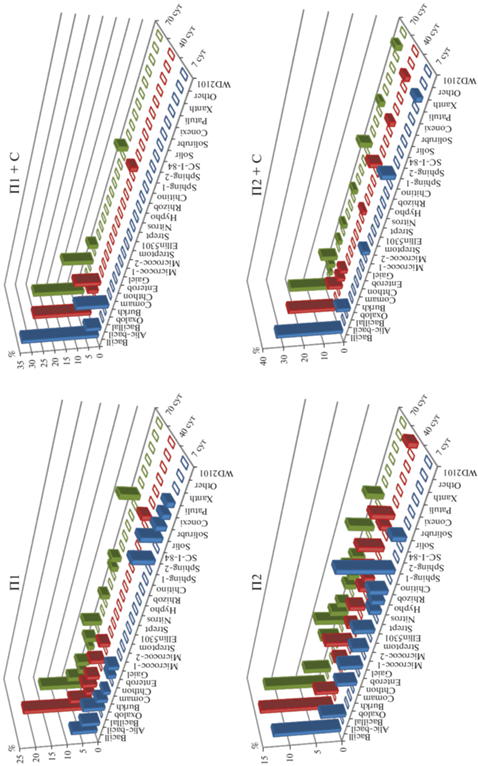
Интересно, что доминирующие филотипы в почве с разным количеством доступного ОВ совпадают не более чем на 50%. Почва П2 характеризуется более зрелым бактериальным сообществом [4], включающим большее количество доминирующих филотипов.
Внесение соломы в почвы снижает количество доминирующих филотипов относительно контроля. Однако в П2 сохраняется большее разнообразие доминирующих микроорганизмов и при внесении соломы. Для использованной в опыте почвы отмечена очень высокая доля микроорганизмов рода Bacillus, она колеблется от 32.7–33.4 на 7 сут до 23.5–19.9% на 70 сут. Кроме рода Bacillus в разложении соломы в П1 участвуют и другие бациллы, например род Alicyclobacillus. Для П2 заметно участие с первых сроков протеобактерий и актинобактерий. Через 40 сут, особенно в П2, среди доминирующих микроорганизмов, разлагающих солому, появляются целлюлозоразлагающие микроорганизмы такие, как Chitinophagaceae, Chthoniobacteraceae, Micrococcaceae, Xanthomonadaceae, входящие в филумы Actinobacteria, Bacteroidetes и Verrucomicrobia. Выделение доминирующих филотипов, свидетельствует о более олиготрофном МС в П2, что служит косвенным обоснованием ускоренного разложения соломы.
ЗАКЛЮЧЕНИЕ
Предложен способ получения модели для изучения влияния количества доступного ОВ в почве на состав и функционирование микробных сообществ, свободной от недостатков, возникающих при использовании естественных почв, таких как различия в минералогическом и/или гранулометрическом составе, рН, истории поля и прочего.
Показано увеличение скорости минерализации соломы в П2 относительно П1: минерализовалось к концу опыта соответственно 67 и 41.7% от внесенной соломы.
Обеднение почвы доступным органическим веществом (для П2) имело эффект накопительной культуры для олиготрофной части микробного сообщества, с получением преимуществ в нем над условными r-стратегами (Actinobacteria, Betaproteobacteria, Bacteroidetes, Firmicutes, и Gemmatimonadetes) k-стратегов (Alpha- и Deltaproteobacteria, Planctomycetes, Chloroflexi и Acidobacteria). В пользу преобладания в почве П2 k-стратегов свидетельствуют и данные по меньшим потерям СО2 из внесенной соломы, несмотря на ее большее разложение.
В качестве индикатора обеспеченности почвы доступным органическим веществом предлагается использовать соотношения филумов в П1 к аналогичным в П2, которые стабильно (во все сроки) существенно ниже или выше в одной из почв. Так как среди представителей филумов Chloroflexi, Verrucomicrobia и Planctomycetes много олиготрофных микроорганизмов, то именно соотношение более копиотрофных филумов Proteobacteria, Bacteroidetes, Firmicutes к вышеназванным олиготрофным и принято за индикатор.
Список литературы
Агрохимические методы исследования почв / Под ред. Соколова А.В. М., 1975. 656 с.
Андронов Е.Е., Пинаев А.Г., Першина Е.В., Чижевская Е.П. Научно-методические рекомендации по выделению высокоочищенных препаратов ДНК из объектов окружающей среды. СПб., 2011. 27 с.
Бакина Л.Г. Роль фракций гумусовых веществ в почвенно-экологических процессах. Автореф. дис. … докт. биол. наук. СПб., 2012. 50 с.
Звягинцев Д.Г. Почва и микроорганизмы. М.: Изд-во Моск. ун-та, 1987. 256 с.
Заварзина А.Г., Данченко Н.Н., Демин В.В., Артемьева З.С., Когут Б.М. Гуминовые вещества – гипотезы и реальность (обзор) // Почвоведение. 2021. № 12. С. 1449–1480. https://doi.org/10.31857/S0032180X21120169
Еськов А.И., Лукин С.М., Тарасов С.И. Методические подходы к оценке гумусного состояния почв при длительном применении различных систем удобрений // Методы исследований органического вещества почв. М., 2005. С. 111–134.
Коростик Е.В., Пинаев А.Г., Ахтемова Г.А. и др. Универсальные 16S rRNA праймеры для описания генетического разнообразия сообщества почвенных прокариот // Экологическая генетика. 2006. № 4(4). С. 33–38.
Когут Б.М. Принципы и методы оценки содержания трансформируемого органического вещества в пахотных почвах // Почвоведение. 2003. № 3. С. 308–316.
Когут Б.М., Яшин М.А., Семенов В.М., Авдеева Т.Н., Маркина Л.Г., Лукин С.М., Тарасов С.И. Распределение трансформированного органического вещества в структурных отдельностях дерново-подзолистой супесчаной почвы // Почвоведение. 2016. № 1. С. 52–64. https://doi.org/10.7868/S0032180X1601007X
Новицкий М.В., Илющенко В.А. Содержание и состав лабильного гумуса в дерново-подзолистых супесчаных почвах разной степени окультуренности // Агрохимия. 1997. № 4. С. 19–22.
Орлова О.В. Кинетический метод оценки содержания в почве и удобрениях органического углерода, доступного для микроорганизмов // Сб. докл. Междунар. науч.-пр. конф. “Агроэкологические функции органического вещества почв и использование органических удобрений и биоресурсов в ландшафтном земледелии”. Владимир, 1–5 июля 2004 г. С. 103–106.
Паников Н.С., Горбенко А.Ю., Светлов С.В. Способ определения суммарного содержания водорастворимых органических веществ в почве. Пат. № 1318909 (СССР) МКП G 01 N 33/24. 1887.
Сафонов А.П. К методике подготовки образцов почв для определения гумуса // Гумус и азот в земледелии нечерноземной зоны РСФСР. Л., 1987. С. 14–16.
Семенов А.М., Семенов В.М., Ван Бругген А.Х.К. Диагностика здоровья и качества почвы // Агрохимия. 2011. № 12. С. 4–20.
Семенов В.М., Лебедева Т.Н., Зинякова Н.Б., Хромычкина Д.П., Соколов Д.А., де Гереню Л.В.О., Кравченко И.К., Ли Х., Семенов М.В. Зависимость разложения органического вещества почвы и растительных остатков от температуры и влажности в длительных инкубационных экспериментах // Почвоведение. 2022. № 7. С. 860–875. https://doi.org/10.31857/S0032180X22070085
Семенов В.М., Тулина А.С. Сравнительная характеристика минерализуемого пула органического вещества в почвах природных и сельскохозяйственных экосистем // Агрохимия. 2011. № 12. С. 53–63.
Справочник по анализу органических удобрений / Под ред. А.И. Еськова М., 2000. 221 с.
Теппер Е.З., Шильникова В.К., Переверзева Г.И. Практикум по микробиологии. М.: Агропромиздат, 1987. 239 с.
Тулина А.С., Семенов В.М. Оценка чувствительности минерализуемого пула почвенного органического вещества к изменению температуры и влажности // Почвоведение. 2015. № 8. С. 952–952. https://doi.org/https://doi.org/10.7868/S0032180X15080109
Чекмарев П.А. Состояние плодородия почв и мероприятия по его повышению в 2012 г. // Агрохимический вестник. 2012. № 1. С. 2–4.
Шарков И.Н. Концепция воспроизводства гумуса в почвах // Агрохимия. 2011. № 12. С. 21–27.
Шеин Е.В., Милановский Е.Ю. Роль и значение органического вещества в образовании и устойчивости почвенных агрегатов // Почвоведение. 2003. № 1. С. 53–61.
Шульц Э., Кершенс М. Характеристика разлагаемой части органического вещества почв и ее трансформации при помощи экстракции горячей водой // Почвоведение. 1998. № 7. С. 890–894.
Birch H.F. The effect of soil drying on humus decomposition and nitrogen availability // Plant and soil. 1958. № 10(1). P. 9–31.
Bolyen E., Rideout J.R., Dillon M.R., Bokulich N.A., Abnet C.C., Al-Ghalith G.A., Alexander H. et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2 // Nature Biotechnology. 2019. № 37. P. 852–857. https://doi.org/10.1038/s41587-019-0209-9
Cleveland C.C., Nemergut D.R., Schmidt S.K., Townsend A.R. Increases in soil respiration following labile carbon additions linked to rapid shifts in soil microbial community composition // Biogeochemistry. 2007. № 82(3). P. 229–240. https://doi.org/10.1007/s10533-006-9065-z
DeSantis T.Z., Hugenholtz P., Larsen N., Rojas M., Brodie E.L., Keller K. et al. Greengenes, a Chimera-Checked 16S rRNA Gene Database and Workbench Compatible with ARB // Appl. Environ. Microbiol. 2006. V. 72. № 7. P. 5069–5072. https://doi.org/10.1128/AEM.03006-05
Fierer N., Bradford M.A., Jackson R.B. Toward an ecological classification of soil bacteria // Ecology. 2007. № 88(6) P. 1354–1364. https://doi.org/10.1890/05-1839
Gregorich E.G., Beare M.H., McKim U.F., Skjemstad J.O. Chemical and biological characteristics of physically uncomplexed organic matter // Soil Sci. Soc. Am. J. 2006. № 70. P. 975–985.
Haynes R.J. Labile organic matter as an indicator of organic matter quality in arable and pastoral soils in New Zealand // Soil Biol. Biochem. 2000. V. 32. № 2. P. 211–219. https://doi.org/10.1016/S0038-0717(99)00148-0
Jarvis P., Rey A., Petsikos C., Wingate L., Rayment M., Pereira J., Banza J. et al. Drying and wetting of Mediterranean soils stimulates decomposition and carbon dioxide emission: the “Birch effect” // Tree Physiology. 2007. V. 27. P. 929–940.
Janzen H.H. Beyond carbon sequestration: soil as conduit of solar energy // Eur. J. Soil Sci. 2015. V. 66. P. 19–32.
Li H., Yang S., Semenov M.V., Yao F., Ye J., Bu R. et al. Temperature sensitivity of SOM decomposition is linked with a K-selected microbial community // Global Change Biol. 2021. V. 27. № 12. P. 2763–2779.
Pascault N., Nicolardot B., Bastian F., Thiébeau P., Ranjard L., Maron P.A. In situ dynamics and spatial heterogeneity of soil bacterial communities under different crop residue management // Microbial Ecology. 2010. V. 60. P. 291–303. https://doi.org/10.1007/s00248-010-9648-z
Paul E.A., Morris S.J., Conant R.T., Plante A.F. Does the Acid Hydrolysis–Incubation Method Measure Meaningful Soil Organic Carbon Pools? // Soil Sci. Soc. Am. J. 2006. № 70. P. 1023–1035. https://doi.org/10.2136/SSSAJ2005.0103
Rognes T., Flouri T., Nichols B., Quince C., Mahé F. VSEARCH: a versatile open-source tool for metagenomics // Peer J. 2016. V. 4. P. e2584. https://doi.org/10.7717/peerj.2584
Schlesinger W.H., Andrews J.A. Soil respiration and the global carbon cycle // Biogeochemistry. 2000. V. 48. № 1. P. 7–20. https://doi.org/10.1023/A:1006247623877
Schmidt S.K., Costello E.K., Nemergut D.R., Cleveland C.C., Reed S.C., Weintraub M.N., Martin A.M. Microbial turnover and seasonal succession drive biogeochemical cycles in the alpine // Ecology. 2007. V. 88. P. 1379–1385.
Trivedi P., Anderson I.C., Singh B.K. Microbial modulators of soil carbon storage: integrating genomic and metabolic knowledge for global prediction // Trends in Microbiology. 2013. V. 21. № 12. P. 641–651. https://doi.org/10.1016/j.tim.2013.09.005
West A.W., Sparling G.P. Modification to the substrate-induced respiration method to permit measurement of microbial biomass in soils of different water contents // J. Microbiol. Meth. 1986. № 5. P. 177–189. https://doi.org/10.1016/0167-7012(86)90012-6
Wickings K., Grandy S., Reed S., Johnson N. The origin of litter chemical complexity during decomposition // Ecology Lett. 2012. № 15(10). P. 1180–1188. https://doi.org/10.1111/j.1461-0248.2012.01837
Yang S., Wu H., Wang Z., Semenov M.V., Ye J., Yin L., Wang X. et al. Linkages between the temperature sensitivity of soil respiration and microbial life strategy are dependent on sampling season // Soil Biol. Biochem. 2022. V. 172. P. 108758. https://doi.org/10.1016/j.soilbio.2022.108758
Дополнительные материалы отсутствуют.



