Почвоведение, 2023, № 5, стр. 640-653
Влияние внесения соломы на состояние микробиома дерново-подзолистой почвы
Д. А. Никитин a, *, М. В. Семенов a, Н. А. Ксенофонтова a, А. К. Тхакахова a, И. В. Русакова b, С. М. Лукин b
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b Всероссийский научно-исследовательский институт органических удобрений и торфа – филиал
“Верхневолжский ФАНЦ”
601390 Владимирская обл., Судогодский р-н, Вяткино, Прянишникова ул., 2, Россия
* E-mail: dimnik90@mail.ru
Поступила в редакцию 29.09.2022
После доработки 29.12.2022
Принята к публикации 30.12.2022
- EDN: IEEOCD
- DOI: 10.31857/S0032180X22601189
Аннотация
Потеря органического вещества почвы при сельскохозяйственном использовании земель оказывает негативное влияние на ее свойства и является одним из серьезных факторов роста концентрации СО2 в атмосфере. Доступным способом одновременного восстановления запасов почвенного органического вещества и депонирования секвестрированного углерода является внесение соломы в почву. Целью исследования была оценка влияния соломы на количественные показатели различных групп микроорганизмов дерново-подзолистой почвы (Albic Retisol) в рамках длительного полевого эксперимента. Многократное (суммарно 42 т/га) внесение соломы зерновых и зернобобовых культур в 1.25–2 раза повышало содержание углерода микробной биомассы (Смик) в пахотном слое, наибольший рост биомассы отмечен в вариантах без удобрений. Базальное дыхание и дыхательный коэффициент (qСО2) увеличивались в ряду: контроль < NPK < NPK + солома < солома. Применение минеральных удобрений снижало qСО2, биомассу грибов и численность копий генов архей в 1.5–3.0 раза. Соотношение грибы/бактерии по методу люминесцентной микроскопии изменялось от 4 до 15, а по результатам количественной ПЦР – от 0.17 до 0.33. Минимальные значения соотношений грибы/бактерии характерны для вариантов с внесением минеральных удобрений, а максимальные – с заделкой соломы. Таким образом, систематическое поступление свежего органического вещества соломы является важным технологическим приемом для повышения микробиологической активности почвы и нивелирования негативного влияния минеральных удобрений на почвенную микробиоту.
ВВЕДЕНИЕ
Почвенное органическое вещество (ПОВ) представляет собой резервуар углерода, азота и других питательных элементов для растений, поддерживая агроэкологические функции почвы [17, 31]. Потеря органического углерода (Сорг) при сельскохозяйственном использовании земель оказывает негативное влияние на физические, химические и биологические свойства почв и является одним из наиболее серьезных факторов, ведущих к их деградации [25, 57, 61]. Доступным способом одновременного восстановления запасов ПОВ и депонирования секвестрированного углерода является внесение растительных остатков в почву [14, 15, 21, 25, 40, 42]. Наиболее распространенным и доступным для использования типом растительных остатков является солома [26, 55, 59, 61], внесение которой обеспечивает повторное вовлечение в биогеохимический круговорот до 50% азота, фосфора и калия и поступление нескольких тонн на гектар органического вещества [14, 25, 37, 41]. Кроме того, в связи с экономическим развитием солома сельскохозяйственных культур превратилась из ценного сырья и корма для скота в органические отходы, требующие утилизации [37, 42]. Практикуемое сжигание соломы недопустимо с природоохранных позиций. Таким образом, заделывание соломы в почву позволяет решить одновременно три задачи: компенсировать потери ПОВ, утилизировать растениеводческие отходы и повысить плодородие почвы [25, 40].
Почва является олиготрофной средой, в которой подавляющая часть микроорганизмов обитает в условиях дефицита субстрата [28, 47]. Послеуборочные растительные остатки зерновых и зернобобовых культур характеризуются повышенным содержанием целлюлозы, гемицеллюлозы и лигнина, являясь энергетическим субстратом для гетеротрофных микроорганизмов [16, 41]. При внесении растительных остатков в почву происходит увеличение эмиссии СО2 и биомассы почвенных микроорганизмов [4, 59, 61, 63]. Таким образом, заделка соломы, как агротехнологический прием биологизации земледелия, активизирует почвенную микробиоту [47], что, с одной стороны, повышает микробный пул ПОВ, но, с другой стороны, может активизировать прайминг-эффект дополнительной минерализации Сорг [25, 55, 61].
Внесение растительных остатков является важным приемом почвенной секвестрации углерода, составляя в среднем 168 ± 67 кг С/(га год) [52]. Сохранность секвестрируемого с растительными остатками органического вещества во многом определяется численностью и структурой почвенного микробного сообщества, в том числе соотношением грибы/бактерии [10, 24, 43, 49, 50]. Преобладание микобиоты и высокие значения отношения грибы/бактерии обычно выявляют в почвах с повышенной секвестрирующей способностью и более низкими значениями C/N [43, 49, 50, 55]. Уменьшение отношения грибы/бактерии указывает на снижение секвестрирующей способности почв [34, 43].
Применение минеральных удобрений является обязательным условием получения высоких урожаев [31, 36], но их внесение, чаще всего, негативно отражается на микробиологических показателях почвы [22, 30, 31, 35]. Обнаружено уменьшение таксономического разнообразия прокариот и грибов в почве и ризосфере удобренных сельскохозяйственных растений [20, 30, 46, 48, 62]. Можно предположить, что совместное внесение минеральных удобрений и соломы будет не только устранять негативные эффекты, но и оптимизировать численность и структуру почвенных микроорганизмов.
Цель работы – оценка влияния свежего органического вещества соломы на численность клеток и копий рибосомальных генов, а также величину и структуру биомассы различных групп микроорганизмов в дерново-подзолистой почве в условиях длительного полевого эксперимента.
ОБЪЕКТЫ И МЕТОДЫ
Почва. Исследования проводили с образцами агродерново-подзолистой супесчаной почвы (Umbric Retisol), отобранными в многолетнем полевом опыте, заложенном в 1997 г. на опытном поле Всероссийского научно-исследовательского института органических удобрений и торфа (ВНИИОУ) – филиале ФГБНУ “Верхневолжский ФАНЦ” в Судогодском районе Владимирской области (56°3′16″ N, 40°29′28″ E), в пятипольном зернопропашном севообороте: озимая пшеница, люпин (на зерно), картофель, ячмень, однолетние травы (люпин + овес). Условия проведения длительных опытов ВНИИОУ подробно описаны в работе [7]. Климат территории умеренно континентальный с теплым летом (средняя температура июля +18°C) и умеренно холодной зимой (средняя температура января −12°C). Среднегодовое количество осадков составляет от 500 до 550 мм.
Для проведения данного исследования выбрали следующие варианты опыта: контроль без удобрений (V1 и V5); N54P51K57 (среднегодовая доза) (V2 и V6); N54P51K57 + солома озимой пшеницы, люпина, ячменя по 3 т/га (V3 и V7); солома озимой пшеницы, люпина, ячменя по 3 т/га (V4 и V8). Суммарно с начала полевого опыта в пахотный слой почвы в вариантах V3, V4, V7, V8 внесено 42 т/га соломы. Площадь делянок составляла 42–47 м2. Минеральные удобрения вносили ежегодно весной под предпосевную культивацию. Солому измельчали во время уборки зерна комбайном АМПО-500, равномерно распределяли по площади делянок согласно схеме опыта и заделывали в верхний слой 0–10 см тяжелой дисковой бороной. Через 3–4 нед. производили вспашку с равномерным распределением в толще 0–20 см прокомпостированной соломы [14]. Образцы почвы для анализов отбирали в агроценозе ячменя в июне (1-й срок отбора, V1–V4) и августе (V5–V8) из слоя 0–15 см в трехкратной повторности. Почвенные пробы для микробиологических анализов отбирали с соблюдением требований по контролю контаминации. Пробы почвы для определения биомассы микроорганизмов хранили в стерильных емкостях в течение месяца в холодильнике при температуре +4°С, а для молекулярно-генетических анализов – в морозильной камере при –70°С. Для определения химических свойств почв использовали воздушно-сухие образцы.
Химические свойства почвы. Содержание органического углерода (Сорг) и общего азота (Nобщ) в почве определяли на автоматическом HCNS-анализаторе Leco 932 (США). Величины водного pH почвы измеряли потенциометрическим способом при соотношении почва/вода, равном 1/2.5. Содержание подвижных соединений фосфора (Pподв) и калия (Kподв) определяли по методу Кирсанова.
Определение углерода микробной биомассы, базального дыхания и метаболического коэффициента. Углерод микробной биомассы (Смик) оценивали методом субстрат-индуцированного дыхания (СИД) [3]. Навеску почвы помещали во флакон и добавляли водный раствор глюкозы. Обогащенный образец почвы инкубировали (3.5–5 ч, +22°С) и измеряли концентрацию СО2 на газовом хроматографе КристаллЛюкс 4000М (Россия). Углерод микробной биомассы рассчитывали по формуле:
Базальное дыхание (БД) определяли так же, как СИД, только вместо раствора глюкозы в почву добавляли дистиллированную воду. Время инкубации флаконов с почвой 24 ч. Скорость БД выражали в мкг С–СО2/(г почвы ч).
Микробный дыхательный коэффициент (qCO2) рассчитывали по формуле:
Биомассу прокариот оценивали с помощью метода люминесцентной микроскопии с применением флуоресцентного красителя акридина оранжевого (микроскоп Биомед 5 ПР ЛЮМ (Россия)) при увеличении 1000× с масляной иммерсией [5]. Десорбцию клеток с почвы проводили при помощи ультразвуковой установки УЗДН-1 (2 мин, сила тока 0.40 А, частота 22 кГц). Число клеток прокариот на 1 г субстрата рассчитывали по формуле:
Биомассу грибов определяли методом люминесцентной микроскопии с применением флуоресцентного красителя калькофлуора белого [5]. Учет спор и длины мицелия осуществляли на люминесцентном микроскопе Биомед 5 ПР ЛЮМ (Россия) при увеличении 400×. Десорбцию клеток с почвы проводили при помощи вортекса MSV-3500 (Латвия) при скорости 3500 об./мин в течение 10 мин. Расчет количества грибных спор на 1 г субстрата вели по формуле:
Экстракция тотальной ДНК из почвы и количественная ПЦР в реальном времени. Тотальную ДНК выделяли из 0.25 г образцов почвы с использованием набора DNeasy PowerSoil ProKit (Qiagen, Германия) и гомогенизатора Precellys 24 (Bertin Technologies, Франция) при скорости 6500 об./мин в течение 40 с. Количественную оценку содержания рибосомальных генов микроорганизмов осуществляли методом полимеразной цепной реакции (ПЦР) в реальном времени. Для амплификации целевых участков ДНК разных групп микроорганизмов использовали следующие праймеры: Eub338/Eub518 – для бактерий, arc915f/arc1059r – для архей, ITS1f/5.8S – для грибов [46, 48]. Проводили калибровку зависимости интенсивности флуоресценции от логарифма концентрации ДНК стандартных растворов, по которой определяли численность копий генов в образцах с помощью программного обеспечения CFX Manager. В качестве контроля для бактерий использовали растворы клонированных фрагментов рибосомального оперона Escherichia coli, для архей – штамма FG-07 Halobacterium salinarum, для грибов – Saccharomyces cerevisiae Meyen 1 B-D1606. Реакцию проводили по следующему протоколу: 1) +95°C – 3 мин; 2) денатурация двухцепочечной ДНК при +95°C – 10 с; 3) отжиг праймеров на матрице при +50°C – 10 с; 4) удлинение цепи ДНК при +72°C – 20 с; 5) считывание значений флуоресценции, 49-кратное повторение этапов 2‒5. Анализ кривых плавления проводили для проверки размера амплифицированных продуктов. ПЦР проводили для трех повторностей образца с пересчетом на средние значения содержания копий генов в грамме почвы.
Статистический анализ и визуализация экспериментальных данных проводили в программной среде R 4.2.1. Соответствие экспериментальных данных нормальному распределению проверяли критерием Шапиро–Уилка (p > 0.05). Для оценки различий между средними значениями разных вариантов эксперимента осуществляли дисперсионный анализ методом One-Way ANOVA с проверкой нормальности распределения ошибок, гомогенности дисперсий и идентичности размера выборок. Поправку на множественные сравнения делали с помощью post-hoc теста Тьюки. Силу и достоверность связей между химическими и микробиологическими свойствами почв оценивали с помощью коэффициента корреляции Пирсона. В качестве поправки на множественные сравнения использовали поправку Холма–Бонферрони. Для многомерного анализа данных использовали метод главных компонент.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химические свойства почвы. Внесение минеральных удобрений и соломы приводило к незначительному уменьшению рН по сравнению с контролем (табл. 1). Содержание Cорг изменялось от 0.49 в вариантах с минеральными удобрениями до 0.72% в образцах с соломой. Содержание Nобщ варьировало от 0.05 до 0.07%, отношение C/N находилось в диапазоне от 9.0 до 11.8. Для обоих сроков отбора выявлено увеличение C/N, Cорг и Nобщ в ряду: контроль < NPK < NPK + солома < солома. Содержание Kподв менялось от 54 до 107 мг/кг; Рподв – от 98 до 173 мг/кг; аммонийного азота – от 5.07 до 8.5 мг/кг. Минимальные значения Kподв и Рподв отмечены для контроля, а максимальные – для вариантов NPK и NPK + солома.
Таблица 1.
Основные химические свойства агродерново-подзолистой почвы
| Индекс | Срок отбора | Наличие соломы | Наличие удобрений | Сорг | Nобщ | С/N | pHводн | N–NH4 | Pподв | Кподв |
|---|---|---|---|---|---|---|---|---|---|---|
| % | мг/кг | |||||||||
| V1 | Июнь | – | – | 0.55 | 0.06 | 9.2 | 6.29 | 5.07 | 98 | 54 |
| V2 | – | + | 0.60 | 0.06 | 9.7 | 5.81 | 7.36 | 170 | 107 | |
| V3 | + | + | 0.67 | 0.07 | 9.9 | 5.49 | 8.50 | 173 | 107 | |
| V4 | + | – | 0.70 | 0.06 | 11.2 | 5.72 | 6.86 | 105 | 67 | |
| V5 | Август | – | – | 0.49 | 0.05 | 9.2 | 5.99 | 5.79 | 106 | 64 |
| V6 | – | + | 0.62 | 0.07 | 9.0 | 5.76 | 5.57 | 160 | 88 | |
| V7 | + | + | 0.65 | 0.06 | 10.0 | 5.57 | 6.21 | 158 | 81 | |
| V8 | + | – | 0.72 | 0.06 | 11.8 | 5.78 | 5.14 | 114 | 62 | |
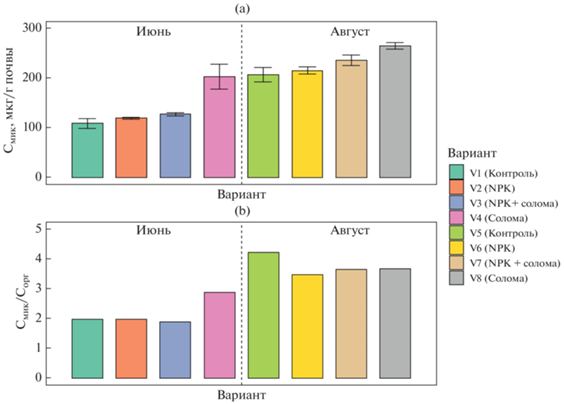
Значения углерода микробной биомассы (Смик) варьировали от 109 до 265 мкг С/г почвы (рис. 1). Увеличение значений Смик происходило только в вариантах с заделыванием соломы, причем наибольший рост биомассы (1.25–2 раза) отмечен в вариантах без внесения минеральных удобрений. Таким образом, подтверждается гипотеза о том, что заделывание в почву соломы повышает углерод микробной биомассы [26, 45, 59]. Подобный существенный рост значений Смик выявлен для второго срока отбора образцов. В целом, наблюдалось последовательное увеличение содержания Смик в ряду: контроль < NPK < NPK + солома < солома. Определяющими факторами уровня биомассы микроорганизмов в проанализированных почвах были срок отбора (F = 504, p < 0.0001) и заделка соломы (F = 136, p < 0.0001).
Для вариантов первого срока отбора заделка соломы увеличивала содержание Смик почти в 2 раза, в то время как внесение минеральных удобрений и одновременное добавление к почве соломы с NPK приводило к росту углерода микробной биомассы лишь на 5–10% по сравнению с контролем. Данный результат говорит об ингибировании части микробного сообщества минеральными удобрениями и подтверждается в предыдущих исследованиях [30, 48, 54]. Значения Смик в образцах второго срока отбора были идентичны (в случае контроля и NPK) либо выше (на 20% для варианта NPK + солома и на 30% для варианта с заделыванием соломы без минеральных удобрений) по сравнению с результатами для аналогичных вариантов первого срока. Таким образом, свежее органического вещество соломы стимулировало рост микробной биомассы и нивелировало ингибирующее действие минеральных удобрений, что отмечено в работах [29, 47]. Следует подчеркнуть, что величины углерода микробной биомассы в почвах значительно варьировали в зависимости от срока отбора, что характерно и для модельных экспериментов с внесением в почву соломы [54].
C помощью метода люминесцентной микроскопии определена структура биомассы микроорганизмов. Суммарная биомасса прокариот (одноклеточных и мицелиальных) составляла от 1.07 до 2.96 мкг/г почвы. Биомасса одноклеточных прокариот варьировала от 0.86 до 2.78 мкг/г почвы, а численность их клеток – от 4.00 × 108 до 1.32 × 109 кл./г почвы соответственно (табл. 2). Минимальные значения выявлены для контроля, а максимальные – для варианта NPK + солома. Полученные результаты сопоставимы с данными для широкого спектра дерново-подзолистых почв средней полосы России [12] и были в 1.5–2 раза выше, чем численность клеток прокариот в серых лесных и аллювиально-луговых почвах юга Московской области [18].
Таблица 2.
Структура биомассы почвенных микроорганизмов
| Индекс | Срок отбора | Наличие соломы | Наличие удобрений | Грибы | Прокариоты | Суммарная биомасса микроорганизмов (грибы и прокариот) | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| мицелий (преимуществ d = 3 мкм) |
споры (диаметр, мкм) | общая биомасса спор, мкг/г почвы | доля мелких (2–3 мкм) спор по массе, % | суммарная биомасса грибов, мкг/г почвы | численность клеток прокариот, × 109 кл./г почвы | биомасса одноклеточных прокариот, мкг/г почвы | длина актиномицетного мицелия, м/г почвы | биомасса актиномицетного мицелия, мкг/г почвы | доля мицелия актиномицетов в биомассе прокариот, % | общая биомасса прокариот, мкг/г почвы | ||||||||||||
| биомасса, мкг/г почвы | длина, м/г почвы | доля мицелия грибов, % | 2 | 3 | 5 | |||||||||||||||||
| численность, шт/г почвы × 104 | масса, мкг/г почвы | численность, шт/г почвы × 104 | масса, мкг/г почвы | численность, шт/г почвы × 103 | масса, мкг/г почвы | |||||||||||||||||
| V1 | Июнь | – | – | 121 ± ± 22 | 82.65 ± ±14.88 | 48.4 | 9.92 ± ±1.79 | 34 ± 6 | 6.45 ± ± 1.16 | 75 ± 14 | 2.08 ± ± 0.37 | 20 ± 4 | 129 ± ± 23 | 84.5 | 250 ± ± 45 | 0.40 ± ± 0.07 | 0.86 ± ± 0.15 | 5.73 ± ± 1.03 | 0.21 ± ± 0.04 | 19.63 ± ± 3.53 | 1.07 ± ± 0.19 | 251.07 ± ± 45 |
| V2 | – | + | 49 ± ± 9 | 33.9 ± ± 6.10 | 31.6 | 13.81 ± ± 2.49 | 47 ± 8 | 4.52 ± ± 0.81 | 52 ± 9 | 0.69 ± ± 0.12 | 7 ± 1 | 106 ± ± 19 | 93.4 | 155 ± ± 28 | 0.51 ± ± 0.09 | 1.09 ± ± 0.20 | 20.47 ± ± 3.68 | 0.76 ± ± 0.14 | 41.08 ± ± 7.39 | 1.85 ± ± 0.33 | 156.85 ± ± 28 | |
| V3 | + | + | 80 ± ± 14 | 55.14 ± ± 9.93 | 62.5 | 8.64 ± ± 1.56 | 29 ± 5 | 1.61 ± ± 0.29 | 19 ± 3 | – | – | 48 ± ± 9 | 100 | 128 ± ± 23 | 0.50 ± ± 0.09 | 1.07 ± ± 0.19 | 2.24 ± ± 0.40 | 0.08 ± ± 0.01 | 6.96 ± ± 1.25 | 1.15 ± ± 0.21 | 129.15 ± ± 23 | |
| V4 | + | – | 174 ± ± 31 | 119.59 ± ± 21.53 | 77.3 | 73.40 ± ± 13.21 | 25 ± 5 | 2.26 ± ± 0.41 | 26 ± 5 | – | – | 51 ± ± 9 | 100 | 225 ± ± 41 | 0.57 ± ± 0.10 | 1.22 ± ± 0.22 | 1.79 ± ± 0.32 | 0.07 ± ± 0.01 | 5.43 ± ± 0.98 | 1.29 ± ± 0.23 | 226.29 ± ± 42 | |
| V5 | Август | – | – | 74 ± ± 13 | 58.72 ± ±10.57 | 41.6 | 11.21 ± ± 2.02 | 38 ± 7 | 4.51 ± ± 0.81 | 66 ± 11 | – | – | 104 ± ± 19 | 100 | 178 ± ± 32 | 0.77 ± ±0.14 | 1.62 ± ± 0.29 | 13.89 ± ± 2.50 | 0.51 ± ± 0.09 | 23.94 ± ± 4.31 | 2.13 ± ± 0.38 | 180.13 ± ± 33 |
| V6 | – | + | 52 ± ± 9 | 41.25 ± ± 7.43 | 38.2 | 8.19 ± ± 1.47 | 28 ± 5 | 3.82 ± ± 0.69 | 56 ± 10 | – | – | 84 ± ± 15 | 100 | 136 ± ± 24 | 1.04 ± ±0.19 | 2.20 ± ± 0.40 | 3.73 ± ± 0.67 | 0.14 ± ± 0.03 | 5.98 ± ±1.08 | 2.34 ± ± 0.42 | 138.34 ± ± 25 | |
| V7 | + | + | 66 ± ± 12 | 52.03 ± ± 9.36 | 73.3 | 6.04 ± ± 1.09 | 20 ± 4 | 2.78 ± ± 0.50 | 40 ± 8 | – | – | 24 ± ± 4 | 100 | 90 ± ± 16 | 1.32 ± ± 0.24 | 2.78 ± ± 0.50 | 4.78 ± ± 0.86 | 0.18 ± ± 0.03 | 6.08 ± ±1.09 | 2.96 ± ± 0.53 | 92.96 ± ± 17 | |
| V8 | + | – | 108 ± ± 19 | 85.11 ± ± 15.32 | 45.4 | 9.92 ± ± 1.79 | 34 ± 6 | 6.59 ± ± 1.19 | 96 ± 17 | – | – | 130 ± ± 23 | 100 | 238 ± ± 43 | 0.56 ± ±0.10 | 1.19 ± ± 0.21 | 8.36 ± ± 1.50 | 0.31 ± ± 0.06 | 20.67 ± ±3.72 | 1.50 ± ± 0.27 | 239.5 ± ±43 | |
Доля мицелия актиномицетов в биомассе прокариот варьировала от 5% для вариантов с минеральными удобрениями и соломой до 21% для варианта с соломой второго срока отбора и контроля. Биомасса прокариот в большинстве образцов была представлена, преимущественно, одноклеточными формами. Длина актиномицетных гиф коррелировала с его долей в биомассе прокариот и составляла от 1.79 до 20.47 м/г почвы. Доля мелких клеток (наноформ) прокариот, которые включены в общую численность прокариот, была незначительна и увеличивалась от 3 до 8% в ряду: контроль < NPK < NPK + солома < солома.
Биомасса грибов изменялась от 90 в варианте с минеральными удобрениями и соломой до 250 мкг/г почвы в контроле. Полученные значения биомассы грибов в 1.5 раза меньше, чем в залежных дерново-подзолистых почвах Московской области [8], но в 1.5–2 раза больше по сравнению таковыми для темно-гумусовых лесных почв Костромской области [13]. Доля мицелия – активного компонента грибной биомассы – варьировала от 31.6 до 77.3%. Наименьшая длина грибных гиф (33.9 м/г почвы) выявлена в варианте с внесением минеральных удобрений, а наибольшая (119.59 м/г почвы) – в варианте с внесением соломы. Все показатели, характеризующие биомассу грибов, снижались ко второму сроку отбора. Внесение минеральных удобрений уменьшало длину мицелия микобиоты, как и в других исследованиях [34], а присутствие соломы, наоборот, увеличивало данный показатель. В целом, длина мицелия грибов в изученных вариантах была сопоставима с таковой для залежных дерново-подзолистых почв Московской области [8], но была почти в 3 раза меньше, чем для залежных выщелоченных черноземов Нижегородской области [12]. Численность одноклеточных грибных пропагул (спор и дрожжей) в образцах составляла 105–106 кл./г почвы.
Соотношение Смик/Сорг варьировало от 1.89 в варианте NPK + солома до 4.22 в контроле, с преобладанием в первом сроке отбора. Данный показатель характеризует физиологическое состояние почвенного микробиома и является индикатором доступности почвенного углерода для микроорганизмов [1, 10]. Уменьшение значений этого соотношения в почве указывает на тенденцию к стабилизации ПОВ и наличие экологических условий, препятствующих потреблению субстрата микроорганизмами [18, 23].
Активность базального дыхания почвенных микроорганизмов варьировала от 0.24 в 0.71 мкг С–СО2/(г ч) (рис. 2), что соответствует значениям для пахотных дерново-подзолистых почв Костромской области [2]. Для обоих сроков отбора образцов отмечено повышение БД в ряду контроль < NPK < NPK + солома < солома. Во второй срок отбора активность БД повышалась по сравнению с первым отбором для всех образцов. Факторами, определяющими интенсивность БД, в первую очередь являлась заделка соломы (F = 145, p < 0.0001), срок отбора образцов (F = 69, p < 0.0001) и внесение минеральных удобрений (F = 63, p < 0.0001).
Рис. 2.
Активность базального дыхания микроорганизмов (мкг С–СО2/г ч) (a) и величины дыхательного коэффициента (мкг С–СО2 (мг Смик ч)) (b).
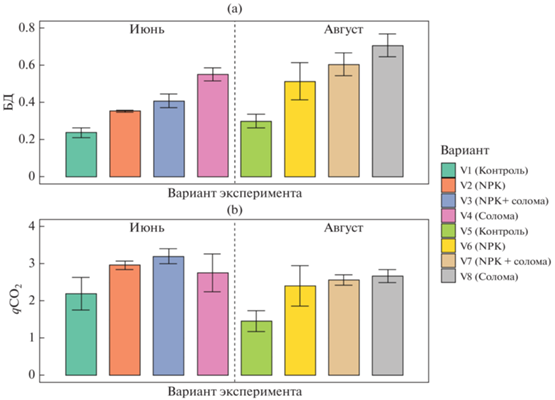
Для обоих сроков отбора внесение свежего органического вещества соломы приводило к резкому росту (в 2.5 раза) значений БД по сравнению с контролем, что соответствует результатам других исследований [61]. Одновременное внесение соломы с минеральными удобрениями также повышало БД по сравнению с контролем, но давало меньший эффект (в 1.7–2 раза). Таким образом, внесение минеральных удобрений значительно снижает БД, индуцированное при добавлении растительных остатков в почву. Такой вывод подтверждают другие исследования [38]. Ранее продемонстрирована бóльшая отрицательная корреляция между внесением NPK и содержанием Смик по сравнению с БД [27]. Судя по результатам нашей работы, внесение минеральных удобрений снижает интенсивность роста Смик, вызванную заделыванием соломы [27, 40].
Значения дыхательного коэффициента (qСО2) изменялись от 1.46 до 3.2, что характерно для пахотных дерново-подзолистых почв средней полосы России [15]. В среднем для двух сроков отбора характерна тенденция к увеличению значений qСО2 в ряду: контроль < NPK < солома < NPK + + солома. Таким образом, подтверждена гипотеза об увеличении дыхательного коэффициента при заделке соломы [15, 58]. Для qCO2 определяющими факторами являлись внесение минеральных удобрений (F = 27, p < 0.0001), срок отбора образцов (F = 19, p < 0.0001) и внесение соломы (F = 18, p < 0.0001).
Численность копий рибосомальных генов архей варьировала в диапазоне от 6.75 × 107 до 4.44 × × 108 копий генов/г почвы; численность генов бактерий – от 1.96 × 109 до 5.98 × 109 копий генов/г почвы; численность генов грибов – от 3.74 × 108 до 1.31 × 109 копий генов/г почвы (рис. 3). Применение соломы значительно повышало численность копий генов грибов и бактерий до 2 раз, а также архей до 1.5 раз. Данные результаты по порядку значений соответствовали таковым для сельскохозяйственных почв южной Бразилии с внесением соломы [44].
Рис. 3.
Численность генов микроорганизмов в почве методом количественной ПЦР (копий генов/г почвы): бактерии (a), грибы (b), археи (c), соотношение грибы/бактерии (d).
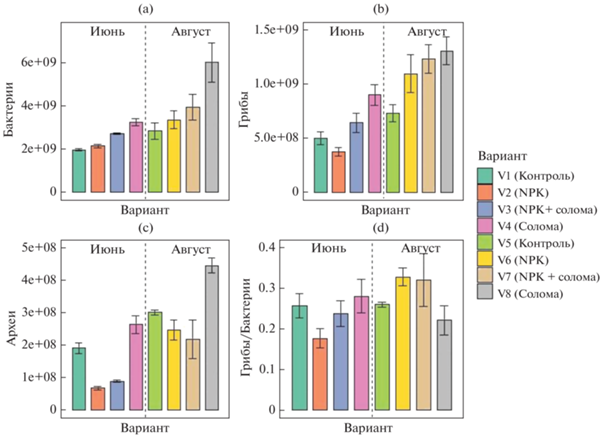
Внесение минеральных удобрений резко (в 1.5–3 раза) снижало численность архей по сравнению с контрольным вариантом, в том числе в варианте NPK + солома. При этом внесение соломы позволяло нивелировать негативное воздействие минеральных удобрений на микобиоту, что показано и в других работах [44, 48]. Численность копий рибосомальных генов бактерий не зависела отприменения минеральных удобрений.
Главным фактором, в наибольшей степени оказывающим влияние на численность копий генов всех рассматриваемых групп микроорганизмов, был срок отбора образцов (F = 174 для архей, F = 72 для бактерий и F = 122 для грибов; для всех вариантов p < 0.0001) (рис. 4). Применение соломы оказывало ведущее влияние на численность бактерий и грибов (F = 62, p < 0.0001), а количество копий генов архей в значительной степени определялось внесением минеральных удобрений (F = 163, p < 0.0001).
Рис. 4.
Матрица корреляций между химическими и микробиологическими свойствами почв. Числами указаны коэффициенты корреляции. Значения приведены только для коэффициентов корреляции с p < 0.05.
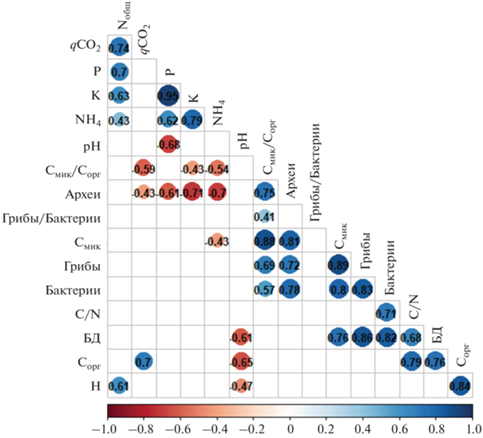
Полученные значения численности копий генов 16S рРНК архей и бактерий, а также ITS грибов были на 1–2 порядка ниже, чем для агрочерноземов Ставропольского края [9] и серых лесных почв юга Московской области [18]. Положительный эффект от внесения свежего органического вещества растительных остатков на численность генов почвенных микроорганизмов был показан ранее в длительных полевых экспериментах в Швеции [56].
Соотношение грибы/бактерии. По результатам люминесцентной микроскопии в микробной биомассе почвы доминировали грибы, доля которых колебалась от 79.7% для варианта NPK + солома до 94.0% в контроле. Соответственно, соотношение грибы/бактерии по методу люминесцентной микроскопии изменялось от 4 в вариантах с NPK и NPK + солома до 15 в вариантах с заделыванием соломы и контроле. Однако по результатам количественной ПЦР соотношение грибы/бактерии варьировало в диапазоне от 0.17 в вариантах с минеральными удобрениями до 0.33 в варианте с соломой. Факторами, в наибольшей степени определяющими соотношение грибы/бактерии, были срок отбора образцов (F = 35, p < 0.0001) и внесение минеральных удобрений (F = 30, p < 0.0001).
По двум примененным методам (люминесцентная микроскопия и количественная ПЦР) получены сильно отличающиеся значения соотношений грибы/бактерии в почвах. В первую очередь это обусловлено тем, что количественная ПЦР не отражает информацию о количестве клеток и биомассе микроорганизмов, в отличие от метода люминесцентной микроскопии. Для разных таксонов содержание рибосомальных генов неодинаково и может варьировать в диапазоне от 1 до 16 [19, 51]. Кроме того, за счет мицелиального строения в клетках грибов содержится гораздо меньше ДНК на единицу биомассы по сравнению с прокариотами [39].
Матрица корреляций между химическими и биологическими свойствами почв. Интенсивность БД характеризовалась высокой положительной корреляцией с количеством копий генов грибов (r = 0.88) и бактерий (r = 0.83), а также Смик и Сорг (r = 0.76). Смик положительно коррелировал с количеством копий генов грибов (r = 0.89), архей (r = 0.81) и бактерий (r = 0.80). Таким образом, хотя численность копий генов микроорганизмов не тождественна Смик, эти показатели характеризуются высокой положительно корреляцией, поэтому численность генов прокариот и грибов может являться хорошим дополнительным микробиологическим индикатором состояния почв.
Отрицательная корреляция обнаружена между численностью копий генов архей и содержанием аммонийного азота (r = –0.70), а также между qCO2 и отношением Смик/Сорг (r = –0.59). Негативное влияние аммонийного азота на численность копий генов архей может быть связано с тем, что преобладающей среди них группой являются представители филума Thaumarchaeota, развитие которых происходит в условиях низких концентраций аммония [19, 32]. Кроме того, в случае окисления аммония археи и бактерии выступают конкурентами за ресурсы [32]. Внесение соломы в почву существенно стимулирует нитрификацию аммонийного азота археями филума Thaumarchaeota, по сравнению с аммонийокисляющими бета- и гаммапротеобактериям [56, 60].
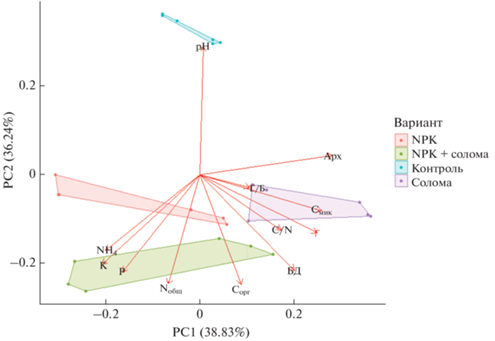
Метод главных компонент. На основе анализа химических и микробиологических показателей агродерново-подзолистой почвы, рассмотренные варианты были разделены на 4 непересекающихся кластера (рис. 5). Внесение соломы способствовало росту значений C/N, Смик, численности грибов и соотношению грибы/бактерии. Соотношение грибы/бактерии связывают с углеродсеквестрирующей способностью почвы: рост грибной биомассы и соотношений грибы/бактерии положительно сказывается на накоплении ПОВ [43, 55]. При этом следует отметить уменьшение прироста грибной биомассы при совместном внесении соломы и минеральных удобрений [29]. Тем не менее, большинство рассмотренных микробиологических показателей агродерново-подзолистой почвы (Смик/Сорг, биомасса прокариот, БД, численность копий рибосомальных генов микроорганизмов) по отдельности характеризовалось значительным временным варьированием, которое часто оказывало даже больший эффект по сравнению с внесением соломы или минеральных удобрений [31]. Этот факт подчеркивает зависимость функционирования микробного сообщества почвы от гидротермических условий и стадии вегетации растений. Например, отмечены различия в величинах целлюлазной активности в почве под вико-овсяной смесью, выращиваемой в мае и сентябре [6]. Кроме того, следует иметь в виду возможность волнообразной динамики целлюлазной активности и численности прокариотов и микромицетов со строгой зависимостью числа и пиков осцилляций от внесения минеральных или органических удобрений [6, 33, 53].
ЗАКЛЮЧЕНИЕ
Многократная заделка соломы оказывала положительное действие на большинство микробиологических параметров агродерново-подзолистой почвы. Минеральные удобрения, напротив, уменьшали величину qСО2, биомассу грибов и численность копий генов 16S рРНК архей. Поэтому заделка свежего органического вещества соломы может быть использована для повышения микробиологической активности почвы и ее плодородия, а также для устранения негативного влияния минеральных удобрений на почвенную микробиоту. Для части микробиологических показателей (Смик, Смик/Сорг, биомасса прокариот, БД, численность копий генов 16S рРНК бактерий и ITS рРНК грибов) фактор временной динамики превышал влияние как минеральных удобрений, так и соломы.
Список литературы
Ананьева Н.Д., Благодатская Е.В., Демкина Т.С. Оценка устойчивости микробных комплексов к природным и антропогенным воздействиям // Почвоведение. 2002. № 5. С. 580–587.
Ананьева Н.Д., Стольникова Е.В., Сусьян Е.А., Ходжаева А.К. Грибная и бактериальная микробная биомасса (селективное ингибирование) и продуцирование CO2 и N2O дерново-подзолистыми почвами постагрогенных биогеоценозов // Почвоведение. 2010. № 11. С. 1387–1393.
Ананьева Н.Д., Сусьян Е.А., Гавриленко Е.Г. Особенности определения углерода микробной биомассы почвы методом субстрат-индуцированного дыхания // Почвоведение. 2011. № 11. С. 1327–1333.
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК, 2016.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. 302 с.
Лаврентьева Е.В., Семенов А.М., Зеленев В.В., Чжун Ю., Семенова Е.В., Семенов В.М., Намсараев Б.Б., Ван Бругген А.К.Х. Ежедневная динамика целлюлазной активности в пахотной почве в зависимости от обработки // Почвоведение. 2009. № 8. С. 952–961.
Лукин С.М. История научных исследований по плодородию почв и применению удобрений (к 105-летию с образования Судогодского опытного поля ФГБНУ ВНИИОУ) // История науки и техники. 2018. № 3. С. 3–17.
Никитин Д.А., Чернов Т.И., Железова А.Д., Тхакахова А.К., Никитина С.А., Семенов М.В., Ксенофонтова Н.А., Кутовая О.В. Сезонная динамика биомассы микроорганизмов в дерново-подзолистой почве // Почвоведение. 2019. № 11. С. 1356–1364. https://doi.org/10.1134/S0032180X19110078
Никитин Д.А., Иванова Е.А., Железова А.Д., Семенов М.В., Гаджиумаров Р.Г., Тхакахова А.К., Чернов Т.И., Ксенофонтова Н.А., Кутовая О.В. Оценка влияния технологии no-till и вспашки на микробиом южных агрочерноземов // Почвоведение. 2020. № 12. С. 1508–1520. https://doi.org/10.31857/S0032180X20120084
Никитин Д.А., Семенов М.В., Чернов Т.И., Ксенофонтова Н.А., Железова А.Д., Иванова Е.А., Хитров Н.Б., Степанов А.Л. Микробиологические индикаторы экологических функций почв (обзор) // Почвоведение. 2022. № 2. С. 228–243. https://doi.org/10.31857/S0032180X22020095
Полянская Л.М., Звягинцев Д.Г. Содержание и структура микробной биомассы как показатель экологического состояния почв // Почвоведение. 2005. № 6. С. 706–714.
Полянская Л.М., Суханова Н.И., Чакмазян К.В., Звягинцев Д.Г. Особенности изменения структуры микробной биомассы почв в условиях залежи // Почвоведение. 2012. № 7. С. 792–792.
Полянская Л.М., Юмаков Д.Д., Тюгай З.Н., Степанов А.Л. Соотношение грибов и бактерий в темногумусовой лесной почве // Почвоведение. 2020. № 9. С. 1094–1099. https://doi.org/10.31857/S0032180X20090129
Русакова И.В. Влияние соломы зерновых и зернобобовых культур на содержание углерода, агрохимические свойства и баланс элементов питания в дерново-подзолистой почве // Агрохимический вестник. 2015. № 6. С. 6–10.
Русакова И.В. Микробиологические и экофизиологические параметры дерново-подзолистой почвы при длительном применении соломы и минеральных удобрений, их связь с урожайностью // Сельскохозяйственная биология. 2020. № 55(1). С. 153–162. https://doi.org/10.15389/agrobiology.2020.1.153rus
Семенов B.М., Ходжаева А.К. Агроэкологические функции растительных остатков в почве // Агрохимия. 2006. № 7. С. 63–81.
Семенов В.М., Когут Б.М. Почвенное органическое вещество. М.: ГЕОС, 2015. 233 с.
Семенов В.М., Паутова Н.Б., Лебедева Т.Н., Хромычкина Д.П., Семенов Н.А., Лопес де Гереню В.О. Разложение растительных остатков и формирование активного органического вещества в почве инкубационных экспериментов // Почвоведение. 2019. № 10. С. 1172–1184. https://doi.org/10.1134/S0032180X19100113
Семенов М.В. Метабаркодинг и метагеномика в почвенно-экологических исследованиях: успехи, проблемы и возможности // Журн. общ. биологии. 2019. № 80(6). С. 403–417. https://doi.org/10.1134/S004445961906006X
Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355–369. https://doi.org/10.1134/S0032180X19010131
Семенов М.В., Манучарова Н.А., Краснов Г.С., Никитин Д.А., Степанов А.Л. Биомасса и таксономическая структура микробных сообществ в почвах правобережья р. Оки // Почвоведение. 2019. № 8. С. 974–985. https://doi.org/10.1134/S0032180X19080124
Чернов Т.И., Семенов М.В. Управление почвенными микробными сообществами: возможности и перспективы (обзор) // Почвоведение. 2021. № 12. С. 1506–1522.
Angst G., Mueller K.E., Nierop K.G., Simpson M.J. Plant-or microbial-derived? A review on the molecular composition of stabilized soil organic matter // Soil Biol. Biochem. 2021. V. 156. P. 108189. https://doi.org/10.1016/j.soilbio.2021.108189
Bailey V.L., Smith J.L., Bolton H., Jr. Fungal-to-bacterial ratios in soils investigated for enhanced C sequestration // Soil Biol. Biochem. 2002. V. 34. P. 997–1007. https://doi.org/10.1016/S0038-0717(02)00033-0
Berhane M., Xu M., Liang Z., Shi J., Wei G., Tian X. Effects of long-term straw return on soil organic carbon storage and sequestration rate in North China upland crops: A meta-analysis // Global Change Biol. 2020. V. 26. P. 2686–2701. https://doi.org/10.1111/gcb.15018
Chen X., Liu M., Kuzyakov Y., Li W., Liu J., Jiang C., Meng Wu, Li Z. Incorporation of rice straw carbon into dissolved organic matter and microbial biomass along a 100-year paddy soil chronosequence // Appl. Soil Ecol. 2018. V. 130. P. 84–90. https://doi.org/10.1016/j.apsoil.2018.06.004
Chen X., Xia Y., Rui Y., Ning Z., Hu Y., Tang H., He H., Li H., Kuzyakov Y., Ge T., Wu J., Su Y. Microbial carbon use efficiency, biomass turnover, and necromass accumulation in paddy soil depending on fertilization // Agriculture, Ecosystems Environment. 2020. V. 292. P. 106816. https://doi.org/10.1016/j.agee.2020.106816
Craine J., Elmore A.J., Wang L., Aranibar J., Bauters M., Boeckx P. et al. Isotopic evidence for oligotrophication of terrestrial ecosystems // Nature Ecology and Evolution. 2018. V. 2. P. 1735–1744.
Fan F., Yu B., Wang B., George T.S., Yin H., Xu D., Li D., Song A. Microbial mechanisms of the contrast residue decomposition and priming effect in soils with different organic and chemical fertilization histories // Soil Biol. Biochem. 2019. V. 135. P. 213–221. https://doi.org/10.1016/j.soilbio.2019.05.001
Francioli D., Schulz E., Lentendu G., Wubet T., Buscot F., Reitz T. Mineral vs. organic amendments: microbial community structure, activity and abundance of agriculturally relevant microbes are driven by long-term fertilization strategies // Frontiers in Microbiology. 2016. V. 7. P. 1446. https://doi.org/10.3389/fmicb.2016.01446
Han P., Zhang W., Wang G., Sun W., Huang Y. Changes in soil organic carbon in croplands subjected to fertilizer management: a global meta-analysis // Scientific Reports. 2016. V. 6(1). P. 1–13. https://doi.org/10.1038/srep27199
He J.Z., Hu H.W., Zhang L.M. Current insights into the autotrophic thaumarchaeal ammonia oxidation in acidic soils // Soil Biol. Biochem. 2012. V. 55. P. 146–154. https://doi.org/10.1016/j.soilbio.2012.06.006
He M., Ma W., Zelenev V.V., Khodzaeva A.K., Kuznetsov A.M., Semenov A.M., Semenov V.M., Blok W.W., van Bruggen A.H.C. Short-term dynamics of greenhouse gas emissions and cultivable bacterial populations in response to induced and natural disturbances in organically and conventionally managed soils // Appl. Soil Ecol. 2017. V. 119. P. 294–306. https://doi.org/10.1016/j.apsoil.2017.07.011
Heděnec P., Nilsson L.O., Zheng H., Gundersen P., Schmidt I.K., Rousk J., Vesterdal L. Mycorrhizal association of common European tree species shapes biomass and metabolic activity of bacterial and fungal communities in soil // Soil Biol. Biochem. 2020. V. 149. P. 107933. https://doi.org/10.1016/j.soilbio.2020.107933
Geisseler D., Scow K.M. Long-term effects of mineral fertilizers on soil microorganisms – A review // Soil Biol. Biochem. 2014. V. 75. P. 54–63. https://doi.org/10.1016/j.soilbio.2014.03.023
Geng Y., Cao G., Wang L., Wang S. Effects of equal chemical fertilizer substitutions with organic manure on yield, dry matter, and nitrogen uptake of spring maize and soil nitrogen distribution // PloS One. 2019. V. 14. P. e0219512. https://doi.org/10.1371/journal.pone.0219512
Jin Z., Shah T., Zhang L., Liu H., Peng S., Nie L. Effect of straw returning on soil organic carbon in rice–wheat rotation system: A review // Food and Energy Security. 2020. V. 9(2). P. e200. https://doi.org/10.1002/fes3.200
Iovieno P., Morra L., Leone A., Pagano L., Alfani A. Effect of organic and mineral fertilizers on soil respiration and enzyme activities of two Mediterranean horticultural soils // Biol. Fertil. Soils. 2009. V. 45. P. 555–561. https://doi.org/10.1007/s00374-009-0365-z
Landenmark H.K., Forgan D.H., Cockell C.S. An estimate of the total DNA in the biosphere // PLoS Biology. 2015. V. 13. P. e1002168. https://doi.org/10.1371/journal.pbio.1002168
Liang Y., Al-Kaisi M., Yuan J., Liu J., Zhang H., Wang L., Cai H., Ren J. Effect of chemical fertilizer and straw-derived organic amendments on continuous maize yield, soil carbon sequestration and soil quality in a Chinese Mollisol // Agriculture, Ecosystems Environment. 2021. V. 314. P. 107403. https://doi.org/10.1016/j.agee.2021.107403
Liu C., Lu M., Cui J., Li B., Fang C. Effects of straw carbon input on carbon dynamics in agricultural soils: a meta-analysis // Global Change Biology. 2014. V. 20. P. 1366–1381. https://doi.org/10.1111/gcb.12517
Lu F. How can straw incorporation management impact on soil carbon storage? A meta-analysis // Mitigation and Adaptation Strategies for Global Change. 2015. V. 20. P. 1545–1568. https://doi.org/10.1007/s11027-014-9564-5
Malik A.A., Chowdhury S., Schlager V., Oliver A., Puissant J., Vazquez P.G., Jehmlich N., Bergen M., Griffiths R.I., Gleixner G. Soil fungal: bacterial ratios are linked to altered carbon cycling // Frontiers in Microbiology. 2016. V. 7. P. 1247. https://doi.org/10.3389/fmicb.2016.01247
Morais M.C., Ferrari B.M., Borges C.D., Cherubin M.R., Tsai S.M., Cerri C.C., Cerri C.E.P, Feigl B.J. Does sugarcane straw removal change the abundance of soil microbes? // BioEnergy Research. 2019. V. 12. P. 901–908. https://doi.org/10.1007/s12155-019-10018-5
Saleem M., Law A.D., Sahib M.R., Pervaiz Z.H., Zhang Q. Impact of root system architecture on rhizosphere and root microbiome // Rhizosphere. 2018. V. 6. P. 47–51. https://doi.org/10.1016/j.rhisph.2018.02.003
Semenov M.V., Krasnov G.S., Semenov V.M., van Bruggen A.H. Long-term fertilization rather than plant species shapes rhizosphere and bulk soil prokaryotic communities in agroecosystems // Appl. Soil Ecol. 2020. V. 154. P. 103641. https://doi.org/10.1016/j.apsoil.2020.103641
Semenov M.V., Krasnov G.S., Semenov V.M., Ksenofontova N., Zinyakova N.B., van Bruggen A.H. Does fresh farmyard manure introduce surviving microbes into soil or activate soil-borne microbiota? // J. Environ. Managem. 2021. V. 294. P. 113018.
Semenov M.V., Krasnov G.S., Semenov V.M., van Bruggen A. Mineral and organic fertilizers distinctly affect fungal communities in the crop rhizosphere // J. Fungi. 2022. V. 8. P. 251. https://doi.org/10.3390/jof8030251
Six J., Frey S.D., Thiet R.K., Batten K.M. Bacterial and fungal contributions to carbon sequestration in agroecosystems // Soil Sci. Soc. Am. J. 2006. V. 70(2). P. 555–569. https://doi.org/10.2136/sssaj2004.0347
Soares M., Rousk J. Microbial growth and carbon use efficiency in soil: Links to fungal-bacterial dominance, SOC-quality and stoichiometry // Soil Biol. Biochem. 2019. V. 131. P. 195–205. https://doi.org/10.1016/j.soilbio.2019.01.010
Suzuki M.T., Taylor L.T., DeLong E.F. Quantitative analysis of small-subunit rRNA genes in mixed microbial populations via 5′-nuclease assays // Appl. Environ. Microbiol. 2000. V. 66(11). P. 4605–4614. https://doi.org/10.1128/AEM.66.11.4605-4614.2000
Tiefenbacher A., Sandén T., Haslmayr H.-P., Miloczki J., Wenzel W., Spiegel H. Optimizing Carbon Sequestration in Croplands: A Synthesis // Agronomy. 2021. V. 11. P. 882. https://doi.org/10.3390/agronomy11050882
van Bruggen A.H.C., He M., Zelenev V.V., Semenov V.M., Semenov A.M., Semenova E.V., Kuznetsova T.V., Khodzaeva A.K., Kuznetsov A.M., Semenov M.V. Relationships between greenhouse gas emissions and cultivable bacterial populations in conventional, organic and long-term grass plots as affected by environmental variables and disturbances // Soil Biol. Biochem. 2017. V. 114. P. 145–159. https://doi.org/10.1016/j.soilbio.2017.07.014
Wang D., Zhu Z., Shahbaz M., Chen L., Liu S., Inubushi K., Wu J., Ge T. Split N and P addition decreases straw mineralization and the priming effect of a paddy soil: a 100-day incubation experiment // Biol. Fertil. Soils. 2019. V. 55. P. 701–712. https://doi.org/10.1007/s00374-019-01383-6
Wang Y., Wu P., Mei F., Ling Y., Qiao Y., Liu C., Legharic S.J., Guan X., Wang T. Does continuous straw returning keep China farmland soil organic carbon continued increase? A meta-analysis // J. Environ. Management. 2021. V. 288. P. 112391. https://doi.org/10.1016/j.jenvman.2021.112391
Wessén E., Nyberg K., Jansson J.K., Hallin S. Responses of bacterial and archaeal ammonia oxidizers to soil organic and fertilizer amendments under long-term management // Appl. Soil Ecol. 2010. V. 45. P. 193–200. https://doi.org/10.1016/j.apsoil.2010.04.003
Wu L., Zhang W., Wei W., He Z., Kuzyakov Y., Bol R., Hu R. Soil organic matter priming and carbon balance after straw addition is regulated by long-term fertilization // Soil Biol. Biochem. 2019. V. 135. P. 383–391. https://doi.org/10.1016/j.soilbio.2019.06.003
Yan D., Long X.E., Ye L., Zhang G., Hu A., Wang D., Ding S. Effects of salinity on microbial utilization of straw carbon and microbial residues retention in newly reclaimed coastal soil // Eur. J. Soil Biol. 2021. V. 107. P. 103364. https://doi.org/10.1016/j.ejsobi.2021.103364
Yang H., Fang C., Meng Y., Dai Y., Liu J. Long-term ditch-buried straw return increases functionality of soil microbial communities // Catena. 2021. V. 202. P. 105316. https://doi.org/10.1016/j.catena.2021.105316
Yansheng C., Fengliang Z., Zhongyi Z., Tongbin Z., Huayun X. Biotic and abiotic nitrogen immobilization in soil incorporated with crop residue // Soil Till. Res. 2020. V. 202. P. 104664. https://doi.org/10.1016/j.still.2020.104664
Zhao X.M., He L., Zhang Z.D., Wang H.B., Zhao L.P. Simulation of accumulation and mineralization (CO2 release) of organic carbon in chernozem under different straw return ways after corn harvesting // Soil Till. Res. 2016. V. 156. P. 148–154. https://doi.org/10.1016/j.still.2015.11.001
Zhao M., Zhao J., Yuan J., Hale L., Wen T., Huang Q., Vivanco J.M., Zhou J., Kowalchuk G.A., Shen Q. Root exudates drive soil-microbe-nutrient feedbacks in response to plant growth // Plant, Cell Environ. 2021. V. 44. P. 613–628. https://doi.org/10.1111/pce.13928
Zhu L.Q., Li J., Tao B.R., Hu N.J. Effect of different fertilization modes on soil organic carbon sequestration in paddy fields in South China: A meta-analysis // Ecol. Indic. 2015. V. 53. P. 144–153. https://doi.org/10.1016/j.ecolind.2015.01.038
Дополнительные материалы отсутствуют.