Почвоведение, 2023, № 5, стр. 536-549
Мицелиальный компонент эутрофных торфяных почв в зоне активной деструкции органического детрита
А. В. Головченко a, *, Т. А. Грачева a, Т. А. Семенова b, А. А. Морозов a, b, С. Р. Самигуллина a, Т. В. Глухова c, Л. И. Инишева d
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт проблем эволюции и экологии РАН
117071 Москва, Ленинский пр-т, 35, Россия
c Институт лесоведения РАН
143030 Московская область, Успенское, ул. Советская, 21, Россия
d Томский государственный педагогический университет,
634061 Томск, ул. Киевская, 60, Россия
* E-mail: golovchenko.alla@gmail.com
Поступила в редакцию 06.10.2022
После доработки 26.12.2022
Принята к публикации 28.12.2022
- EDN: IENPSQ
- DOI: 10.31857/S0032180X22601232
Аннотация
Проведен анализ структурных показателей (обилие, разнообразие) грибных и актиномицетных комплексов эутрофных торфяных почв в зоне основной деструкции органического детрита, представленной подстилкой (слоями L и F) и эутрофно-торфяным горизонтом (ТЕ). Образцы отбирали в заболоченных лесах Тверской и Томской областей (черноольшанник, сосняк, березняк, смешанный лес) в летний период 2021 г. Показатели обилия мицелиальных организмов выявляли люминесцентно-микроскопическим и чашечным методами. Видовую идентификацию культивируемых представителей проводили на основании фенотипических признаков. В подстилках по сравнению с эутрофно-торфяными горизонтами зафиксировано превышение длины грибного мицелия в 2‒10 раз, численности культивируемых грибов на 2‒3 порядка и актиномицетов на 1‒2 порядка. Ферментативный слой подстилки характеризовался максимальным содержанием углерода мицелиального компонента (3‒10 мг С/г). Запасы актиномицетной биомассы в зоне основной деструкции органического детрита исследуемых почв варьировали от 23 до 60 кг/га, грибной ‒ от 1593 до 3718 кг/га. Доля подстилки в профильном запасе мицелиальной биомассы была более весома в лиственных лесах. Из зоны основной деструкции органического детрита исследуемых почв было выделено 70 видов культивируемых грибов из 43 родов и 42 вида актиномицетов из 12 серий и 4 секций. В грибном комплексе преобладали представители родов Penicillium, Talaromyces, Trichoderma, в актиномицетном ‒ рода Streptomyces. Подстилки не уступали эутрофно-торфяному горизонту по видовому разнообразию грибов и актиномицетов. Видовое сходство комплексов грибов подстилок и горизонта ТЕ ‒ 0.68, комплексов актиномицетов ‒ 0.27.
ВВЕДЕНИЕ
Одной из важнейших экологических функций, осуществляемой грибами и актиномицетами в почве, является разложение органического детрита. Схожесть экологических стратегий этих организмов в почве обусловливает их мицелиальная организация и формирование спор. Считается, что грибы являются основными аэробными деструкторами органического детрита в торфяниках [10, 32, 35, 36]. Исследования полных профилей низинных торфяников показали, что грибы активно функционируют только в деятельном слое, где были выявлены высокие показатели их обилия, разнообразия и активности. В инертном слое торфяников грибная биомасса была представлена спорами грибов, о жизнеспособности которых косвенно свидетельствовало обнаружение в нем культивируемых представителей грибов [11].
Локальное развитие и увеличение численности актиномицетов наблюдается тогда, когда создаются условия для использования сравнительно труднодоступных субстратов [17]. Выявление мицелия по всему профилю мощных низинных торфяников и обнаружение высокой плотности и разнообразия в их деятельном слое говорит о том, что актиномицеты, способные разлагать сложные полимеры, являются неотъемлемым компонентом прокариотного комплекса этих почв [6].
Динамика концентрации органического углерода, формирующего профиль почвы, зависит от процессов его поступления с опадом, перемещения вглубь почвы и микробной трансформации. Особенностью эутрофных торфяных почв (низинных торфяников) является то, что микробная трансформация органического детрита активно происходит в верхних горизонтах этих почв и дальнейшей консервации подвергается уже хорошо разложившийся торф.
Как правило, исследователи этих почв изучают торфяные горизонты в границах деятельного слоя и не анализируют подстилки, хотя они в совокупности с деятельным слоем представляют зону основной деструкции органического детрита в этих почвах. Подстилка занимает особое место среди биогеоценотических горизонтов лесных экосистем, недаром ее выделяют как отдельный компонент. Стратификация подстилки отражает этапы сукцессии, связанные с конвейерной переработкой растительного опада.
Цель исследования – дать количественную и качественную характеристику грибным и актиномицетным комплексам в зоне основной деструкции органического детрита эутрофных торфяных почв. Особое внимание в настоящем исследовании будет уделено подстилкам – малоизучаемым субстратам болотных лесов. Данная работа продолжает цикл статей, отражающих результаты исследования микробных сообществ низинных торфяников России [5‒7, 11].
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования были мощные низинные торфяники различного генезиса, расположенные в Тверской и Томской областях: низинный торфяник ТЛ1 лесного заболачивания под черноольшанником крупнотравно-папоротниковым (56°10′15″ N, 32°08′16″ E); торфяник ТО озерного заболачивания под сосняком болотно-травяным (56°09′55″ N, 32°08′13″ E); торфяник ТЛ2 лесного заболачивания под березняком сосново-сфагновым (56°23′25″ N, 84°38′47″ E); торфяник ТП пойменного заболачивания под смешанным лесом (56°31′09″ N, 84°38′27″ E). Подробное описание объектов приведено ранее [3, 7].
Исследуемые торфяники отнесены к типу эутрофные торфяные, подтипу перегнойно-торфяные (ТЛ1) и типичные (ТО, ТЛ2, ТП) мощные почвы [18], по WRB – Sapric Histosols [22].
Анализировали подстилку (О) и эутрофно-торфяный горизонт (ТЕ) исследуемых почв. Эти горизонты представляют зону основной деструкции органического детрита в этих почвах. По болотной терминологии эта зона без подстилки соответствует деятельному слою эвтрофных торфяников.
Подстилка в исследуемых лесах состоит из двух слоев: L и F. Слой L, мощностью 1–2 см, представляет собой преимущественно прошлогодний опад, слой F (ферментативный слой, мощностью 2–3 см) – измельченные остатки растений, затронутые разложением. Эутрофно-торфяный горизонт в исследуемых почвах представлен низинными торфами: древесным сильноразложившимся (в ТЛ1); древесным и древесно-осоковым среднеразложившимися (в ТО), осоковым и травяным среднеразложившимися (в ТЛ2) и осоковым среднеразложившимся (в ТП). Значения ${\text{р}}{{{\text{Н}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ в этом горизонте близки к нейтральным, кроме среднекислых в почве под березняком (ТЛ2). С/N варьирует от 15 до 23 [6].
На каждом из объектов исследования во второй декаде июля 2021 г. методом смешанного образца отбирали подстилки (слоев L и F) и торф (в пределах эутрофно-торфяного горизонта на глубинах 0‒20, 20‒30 и 30‒50 см). Образцы помещали в стерильные пластиковые емкости, которые загружали в сумки-холодильники и доставляли в лабораторию.
Исследование образцов люминесцентно-микроскопическим методом [21] (для получения данных относительно длины и биомассы грибного и актиномицетного мицелия, а также численности и биомассы грибных спор) включало следующие этапы:
1. Приготовление суспензии. 1 г образца (подстилки, торфа) помещали в колбу со 100 мл стерильной воды. Полученную суспензию обрабатывали ультразвуком на диспергаторе Bandelin Sonopuls HD 2070 (Германия) в течение 2 мин.
2. Приготовление препаратов. Для учета актиномицетного мицелия в одном образце готовили 6 препаратов на двух тщательно обезжиренных предметных стеклах. На каждый препарат наносили 0.01 мл обработанной ультразвуком суспензии, которую равномерно распределяли на площади 4 см2. Для учета грибов проделывали ту же процедуру, только аликвота на каждый препарат составляла 0.02 мл.
3. Фиксация препаратов. Приготовленные препараты высушивали на воздухе при комнатной температуре, а затем фиксировали легким нагреванием над пламенем газовой горелки.
4. Окрашивание препаратов. Препараты для учета актиномицетного мицелия окрашивали акридином оранжевым (использовали рабочий раствор красителя в концентрации 1 : 10 000). Время экспозиции препаратов в красителе – 3 мин. Промывка в стоячей водопроводной воде – 2 раза по 5 мин. Грибные препараты окрашивали водным раствором калькофлуора белого (использовали рабочий раствор красителя в концентрации 1 : 10 000). Время экспозиции препаратов в красителе – 10 мин. Промывка в стоячей водопроводной воде – 30 с. Окрашенные препараты высушивали на воздухе, затем убирали в емкости для хранения.
5. Просмотр препаратов. Готовые препараты для учета актиномицетного мицелия просматривали на микроскопе Люмам-ИЗ (Россия). Использовали светофильтры ЖС-19, ЖС-18, объектив – (×90 Л), окуляры – (×4 или ×5). На каждом препарате в 50 полях зрения измеряли с помощью окулярной линейки длину актиномицетного мицелия. Готовые грибные препараты просматривали в 50 полях зрения на микроскопе БиОптик В-300 FL (Россия), объектив – (×100 Л). Длину грибного мицелия подсчитывали с помощью окулярной линейки. Для каждого фрагмента грибного мицелия и для каждой грибной споры измеряли диаметр, который фиксировали в лабораторном журнале.
Расчет показателей обилия грибов и актиномицетов на основании данных, полученных люминесцентно-микроскопическим методом, проводили по формулам, приведенным в статье [5]. В расчетах микробной биомассы содержание воды и углерода в клетках исследуемых микроорганизмов соответствовало 80 и 50% [23].
Исследование образцов методом посева [21] (для определения численности и таксономического статуса культивируемых актиномицетов и грибов). Численность культивируемых актиномицетов определяли методом поверхностного посева из серии разведений на агаризованную среду Гаузе I [16], культивируемых грибов (микромицетов) ‒ на среду Чапека [16] в пятикратной повторности. Перед посевом актиномицетов образцы предварительно высушивали при комнатной температуре до воздушно-сухого состояния, далее из них готовили суспензии, которые обрабатывали ультразвуком на диспергаторе Bandelin Sonopuls HD 2070 (Германия) в течение 2 мин. Для посевов микромицетов использовали ту же суспензию, что и для приготовления препаратов для люминесцентной микроскопии. Чашки с посевами актиномицетов инкубировали в термостате при 28°C в течение 7–10 сут, с посевами микромицетов ‒ при комнатной температуре в течение 7 сут, затем вели общий подсчет выросших колоний.
Численность культивируемых микроорганизмов (Nпосев, КОЕ/г субстрата), выявляемых на средах, рассчитывали по формуле
Все показатели обилия актиномицетов и грибов пересчитывали на 1 г сухого субстрата. Для этого определяли влажность образцов подстилки и торфа, высушивая их при 105°С в течение 6 ч.
Определение таксономического статуса актиномицетов начинали с учета их культурально-диагностических признаков, затем оценивали под бинокуляром при малом увеличении их морфологические признаки [16]. Идентификацию актиномицетов рода Streptomyces проводили на ряде диагностических сред (Гаузе I, Гаузе II, овсяном, глицерин-нитратном и пептонно-дрожжевом агарах), рецепты которых представлены в определителе актиномицетов [4].
Таксономическую идентификацию микромицетов проводили на основании фенотипических признаков с помощью классических определителей [27, 28, 30, 31, 34]. Таксономическое положение видов микромицетов сверяли с базами данных: The MycoBank Fungal databases (http:/www.mycobank.org) и GABI Bioscience Databases Index Fungorum (indexfungorum.org).
Для таксономической единицы (вида) рассчитывали частоту встречаемости (ЧВ) – отношение числа образцов, в которых присутствовал данный вид, к общему числу проанализированных образцов. На основании величины ЧВ выделяли следующие классы обилия: доминирующие (ЧВ > 60%), частые (ЧВ = 30‒60%), редкие (ЧВ = 10‒30%), случайные (ЧВ < 10%). Для сравнения сходства микробных комплексов горизонтов и почв использовали коэффициент Серенсена [20].
Обработку массивов данных проводили с использованием пакета программ StatSoft Statistica 8.0 и Microsoft Excel 10.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
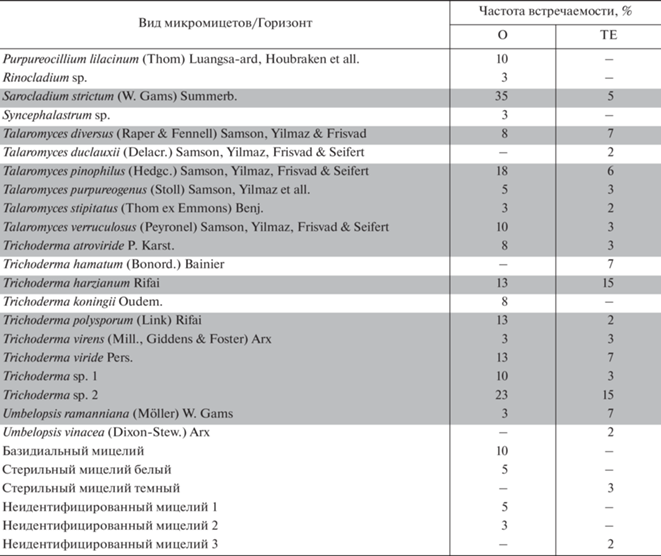
Показатели обилия актиномицетов и грибов, полученные люминесцентно-микроскопическим методом. В подстилках исследуемых почв длина актиномицетного мицелия варьировала в широком диапазоне ‒ от 0.2 до 2.6 км/г субстрата (табл. 1). В слое L подстилки, представляющей собой преимущественно прошлогодний опад деревьев, диапазон колебаний длины мицелия составил 0.2‒0.5 км/г. Значения этого показателя в лиственных лесах (черноольшаннике и березняке) были в 2 раза больше, чем в хвойном (сосняке) и смешанном лесах. В ферментативном слое подстилки (F), состоящем из измельченных остатков растений, затронутых разложением, значения длины актиномицетного мицелия в 2‒6 раз превосходили таковые в слое L.
Таблица 1.
Пределы колебаний длины актиномицетного, грибного мицелия (км/г) и численности спор грибов (млн спор/г) в подстилке (О) и эутрофно-торфяном горизонте (ТЕ) исследуемых почв
| Горизонт | Торфяник, тип леса | |||
|---|---|---|---|---|
| ТЛ1, черноольшанник | ТО, сосняк |
ТЛ2, березняк |
ТП, смешанный |
|
| Актиномицетный мицелий | ||||
| О1(L) | 0.3‒0.5 | 0.2‒0.3 | 0.4‒0.5 | 0.2‒0.3 |
| О2(F) | 2.0‒2.6 | 0.8‒1.3 | 0.6‒1.1 | 1.0‒1.2 |
| TЕ (0‒20 см) | 0.9‒1.4 | 0.9‒1.1 | 0.5‒0.7 | 2.7‒3.8 |
| TЕ (20‒30 см) | 0.5‒0.8 | 0.7‒1.2 | 0.5‒0.7 | 1.3‒1.6 |
| TЕ (30‒50 см) | 0.5‒0.8 | 0.6‒0.8 | 0.6‒1.3 | 0.9‒1.3 |
| Грибной мицелий | ||||
| О1(L) | 0.7‒0.9 | 0.5‒0.6 | 1.5‒1.4 | 0.6‒0.8 |
| О2(F) | 3.2‒3.5 | 2.8‒3.2 | 3.2‒3.7 | 3.0‒3.2 |
| TЕ (0‒20 см) | 0.6‒0.8 | 1.5‒1.8 | 0.3‒0.4 | 0.9‒1.1 |
| TЕ (20‒30 см) | 0.2‒0.3 | 1.2‒1.4 | 0.3‒0.4 | 0.2‒0.4 |
| TЕ (30‒50 см) | 0.2‒0.3 | 0.6‒0.8 | 0.3‒0.4 | 0.2‒0.4 |
| Численность спор грибов | ||||
| О1(L) | 16‒19 | 13‒14 | 27‒30 | 15‒17 |
| О2(F) | 30‒36 | 35‒40 | 30‒35 | 68‒81 |
| TЕ (0‒50 см) | 14‒30 | 13‒24 | 11‒27 | 15‒36 |
В эутрофно-торфяном горизонте (ТЕ) исследуемых почв длина актиномицетного мицелия колебалась от 0.5 до 3.8 км/г почвы. Среди анализируемых слоев этого горизонта максимально обогащенным мицелием был слой 0‒20 см, среди почв ‒ почва пойменного заболачивания под смешанным лесом. В остальных почвах пределы колебаний длины актиномицетного мицелия в ТЕ были схожими – от 0.5 до 1.4 км/г.
Рассматривая целиком зону основной деструкции органического детрита исследуемых почв, можно выделить в ней горизонты с максимальным обилием актиномицетного мицелия. Для почв лесного (ТЛ1) и озерного (ТО) заболачивания – это ферментативный слой подстилки, для почвы пойменного (ТП) заболачивания – верхняя часть горизонта ТЕ. В почве лесного заболачивания под березняком (ТЛ2) такой горизонт выделить проблематично, так как в пределах зоны основной деструкции детрита длина актиномицетного мицелия флуктуировала слабо (рис. 1а).
Рис. 1.
Распределение актиномицетного (а) и грибного (b) мицелия в зоне основной деструкции органического детрита эутрофных торфяных почв.
Длина грибного мицелия в слое L подстилок исследуемых торфяников варьировала от 0.5 до 1.5 км/г субстрата, в слое F – от 2.8 до 3.2 км/г, в горизонте ТЕ – от 0.2 до 1.8 км/г. Численность спор грибов в подстилках находилась в диапазоне 13‒81 млн спор/г, в ТЕ ‒ 11‒36 млн спор/г.
В зоне основной деструкции органического детрита ферментативный слой подстилки оказался горизонтом с максимальной концентрацией грибов. В нем длина грибного мицелия была в 2‒6 раз больше, чем в опаде (слой L подстилки) и в 2‒10 раз больше, чем в слое ТЕ, а численность спор грибов характеризовалась наибольшими абсолютными значениями.
При переходе от слоя подстилки F к эутрофно-торфяному горизонту (ТЕ) содержание грибного мицелия убывало: плавно в почве под сосняком и резко ‒ в почвах под лиственными породами и смешанным лесом (рис. 1b). В вертикальном градиенте горизонта ТЕ происходило дальнейшее уменьшение длины грибного мицелия, и в слое 30‒50 см большинства торфяников она составляла 0.2‒0.4 км/г.
Исследование микробных комплексов лесных почв (бело-подзолистой и бурозема) Центрального лесного государственного биосферного заповедника (Тверская область) люминесцентно-микроскопическим методом также показало, что численность всех групп микроорганизмов (бактерий, мицелия актиномицетов, спор и мицелия грибов) максимальна в подстилках и затем резко убывает по профилю [23]. Длина грибного мицелия в подстилках этих почв варьировала от 0.6 до 3 км/г, длина актиномицетного мицелия измерялась сотнями метров, численность спор грибов составляла десятки ‒ сотни миллионов на 1 г субстрата. Среди исследуемых слоев подстилки (L, F, Н) максимальными показателями обилия микроорганизмов характеризовался слой F [9]. Эти данные, полученные для лесных почв, согласуются с установленными в этом исследовании.
Биомасса актиномицетного мицелия в зоне основной деструкции органического детрита исследуемых почв варьировала от 9 до 136 мкг/г, биомасса грибного мицелия ‒ от 746 до 19 208 мкг/г, биомасса спор грибов ‒ от 108 до 603 мкг/г. Ферментативный слой подстилок характеризовался максимальными значениями как актиномицетной, так и грибной биомассы, тогда как верхняя часть эутрофно-торфяного горизонта ‒ только актиномицетной (табл. 2).
Таблица 2.
Экстремальные значения биомассы актиномицетного (АМ), грибного (ГМ) мицелия, спор грибов (СГ) и углерода микробной биомассы мицелиального компонента (АМ + ГМ) в подстилке (О) и эутрофно-торфяном горизонте (ТЕ) исследуемых почв
| Горизонт | Биомасса, мкг/г сухого субстрата | Углерод биомассы, мг С/г сухого субстрата | ||
|---|---|---|---|---|
| АМ | ГМ | СГ | АМ + ГМ | |
| О1(L) | 9‒21 | 1424‒4095 | 108‒330 | 0.7‒2.1 |
| О2(F) | 34‒92 | 6669‒19 208 | 230‒603 | 3.3‒9.6 |
| TЕ (0‒20 см) | 32‒136 | 862‒4276 | 158‒374 | 0.4‒2.2 |
| TЕ (20‒30 см) | 24‒56 | 658‒7296 | 135‒242 | 0.3‒3.7 |
| TЕ (30‒50 см) | 26‒43 | 746‒4043 | 210‒387 | 0.4‒2.0 |
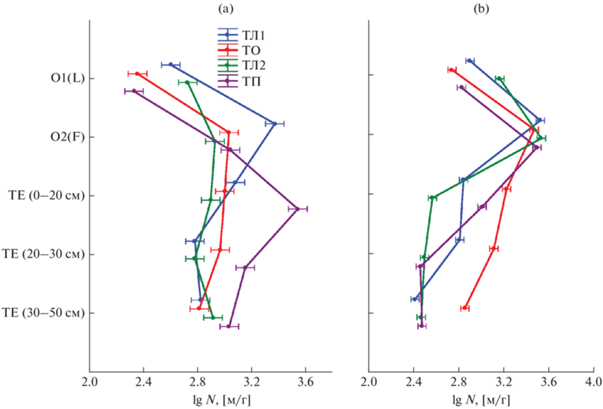
Запасы актиномицетной биомассы в зоне основной деструкции органического детрита исследуемых почв варьировали от 23 до 60 кг/га. Вклад подстилки в профильный запас актиномицетной биомассы составлял 4‒17%, вклад эутрофно-торфяного горизонта ‒ 83‒96% (рис. 2а).
Рис. 2.
Доли подстилки (О) и эутрофно-торфяного горизонта (ТЕ) в профильном запасе (0.55 м) актиномицетной (а) и грибной (b) биомассы.
Запасы грибной биомассы в зоне основной деструкции органического детрита исследуемых почв находились в диапазоне 1593‒3718 кг/га, т.е. были на 2 порядка больше, чем запасы актиномицетной биомассы. Вклад подстилки в профильный запас грибной биомассы колебался от 8 до 67%, вклад эутрофно-торфяного горизонта соответственно ‒ от 33 до 92% (рис. 2b).
Следует отметить, что вклад подстилки в профильный запас биомассы (как грибной, так и актиномицетной) был больше в почвах под лиственными лесами (ТЛ1 и ТЛ2).
В горизонтах исследуемых почв углерод биомассы мицелиального компонента варьировал от 0.3 до 9.6 мг С/г. Максимальные значения этого показателя обилия были выявлены в ферментативном слое подстилок. Они превосходили в 4‒10 раз таковые для слоя L и горизонта ТЕ. В верхних слоях (0‒5 и 5‒10 см) серой лесной, темно-каштановой и каштановой почв под лиственными лесами содержание углерода мицелиального компонента находилось в диапазоне 0.7‒4.7 мг С/г почвы [1]. В такой же диапазон попадали значения, выявленные для слоя L подстилки исследуемых почв, а для слоя F они были в 2‒5 раз больше.
Запасы углерода микробной биомассы (грибной и актиномицетной) в подстилках исследуемых лесов в учитываемый период года варьировали от 140 до 535 кг С/га, общее содержание углерода ‒ от 25 329 до 47 237 кг С/га; в горизонте ТЕ эти значения составили (273‒1731 кг С/га) и (312 144‒422 913 кг С/га) соответственно. На основании этих данных были рассчитаны доли углерода микробной биомассы в общем содержании углерода органического вещества исследуемых горизонтов. В подстилках доля углерода учитываемой микробной биомассы в летний сезон составила 0.6‒1.5%, в эутрофно-торфяном горизонте ‒ 0.1‒0.5%. Максимальных значений она достигала в подстилке под березняком (1.5%). Для сравнения в почвах верхового болота доля углерода микробной биомассы в общем содержании углерода органического вещества колебалась от 0.2 до 3% [10]; в подстилках заповедных ельников ‒ от 5.5 до 17.2%, в минеральных горизонтах почв (бело-подзолистой и бурозема) под этими же ельниками ‒ от 48 до 68% [23].
Показатели обилия актиномицетов и грибов, полученные методом посева. В зоне основной деструкции органического детрита исследуемых почв численность культивируемых актиномицетов варьировала в широком диапазоне – от 104 до 107 КОЕ/г. Наибольшие значения выявляли в подстилках исследуемых почв. Максимально обогащенными актиномицетами оказались слой L подстилки в лиственных лесах и ферментативный слой подстилки в смешанном лесе (табл. 3). Содержание мицелиальных прокариот в подстилках исследуемых болотных лесов сопоставимо с таковым для лесов европейской части России [9, 13, 15, 24] и северо-востока Китая [25]. Вероятно, близкие значения показателей обилия актинобиоты в подстилках, территориально удаленных лесных биогеоценозов, обусловлены сходством растительных полимеров (целлюлоза, крахмал, лигнин, хитин), составляющих основу питания мицелиальных прокариот.
Таблица 3.
Пределы колебаний численности культивируемых актиномицетов и грибов в подстилке (О) и эутрофно-торфяном горизонте (ТЕ) исследуемых почв
| Торфяник, тип леса | Горизонт | Численность, 103 КОЕ/г | |
|---|---|---|---|
| актиномицетов | грибов | ||
| ТЛ1, черноольшанник | О1(L) | 2800‒6160 | 2778‒2944 |
| О2(F) | 540‒740 | 10 526‒12 263 | |
| TЕ (0‒20 см) | 20‒80 | 39‒72 | |
| TЕ (20‒30 см) | 20‒60 | 35‒135 | |
| TЕ (30‒50 см) | 20‒80 | 75‒150 | |
| ТО, сосняк | О1(L) | 40‒80 | 1266‒1656 |
| О2(F) | 120‒160 | 1500‒4700 | |
| TЕ (0‒20 см) | 80‒140 | 74‒184 | |
| TЕ (20‒30 см) | 120‒140 | 33‒56 | |
| TЕ (30‒50 см) | 40‒80 | 40‒80 | |
| ТЛ2, березняк | О1(L) | 6880‒11 120 | 1795‒2564 |
| О2(F) | 320‒560 | 1739‒3478 | |
| TЕ (0‒20 см) | 20‒80 | 29‒52 | |
| TЕ (20‒30 см) | 20‒40 | 47‒65 | |
| TЕ (30‒50 см) | 20‒30 | 8‒23 | |
| ТП, смешанный лес | О1(L) | 500‒680 | 1111‒4627 |
| О2(F) | 3080‒4600 | 4117‒11 765 | |
| TЕ (0‒20 см) | 100‒120 | 133‒267 | |
| TЕ (20‒30 см) | 140‒220 | 15‒46 | |
| TЕ (30‒50 см) | 20‒40 | 10‒30 | |
Если рассматривать распределение культивируемых актиномицетов в вертикальном градиенте зоны основной деструкции органического детрита исследуемых почв, то можно отметить, что оно не совпадает с выявленным ранее люминесцентно-микроскопическим методом. Так, в почвах под лиственными лесами содержание актиномицетов было максимальным в слое L подстилки, далее оно уменьшалось на порядок – в слое F подстилки и еще на порядок – в эутрофно-торфяном горизонте. Следует отметить, что численность актиномицетов на разных глубинах горизонта ТЕ не менялась и поддерживалась на уровне 104 КОЕ/г. В почве под хвойным лесом численность актиномицетов в зоне основной деструкции органического детрита флуктуировала в интервале (40‒160) × 103 КОЕ/г и не имела ярко выраженных максимумов и минимумов. Почва под смешанным лесом, напротив имела горизонт с выраженным максимумом – это ферментативный слой подстилки. В нем содержание актиномицетов было на порядок больше, чем в слое L и на 1‒2 порядка больше, чем в горизонте ТЕ (табл. 3).
Многолетнее изучение актиномицетных комплексов в разных типах лесных биогеоценозов Центрального лесного государственного биосферного заповедника показало, что наибольшее количество актиномицетов находится в ферментативном слое лесных подстилок, выявлено плавное уменьшение их численности с глубиной [14].
В зоне основной деструкции органического детрита исследуемых почв численность микромицетов варьировала в широком диапазоне от 103 до 107 КОЕ/г. В подстилках исследуемых почв она была на 2‒3 порядка выше, чем в эутрофно-торфяном горизонте. Закономерности распределения грибов в зоне основной деструкции органического детрита, установленные люминесцентно-микроскопическим методом, подтверждены методом посева. Оба метода фиксировали численное преимущество грибов в ферментативном слое подстилок исследуемых почв.
Анализ подстилок и гумусово-аккумулятивных горизонтов широкого спектра лесных почв (торфяно-глеевая, бело-подзолистая, дерново-палево-подзолистая, бурозем, торфяная низинная) выявил, что численность микромицетов в них составляла в большинстве случаев сотни тысяч КОЕ/г и была на порядок ниже в иллювиальных горизонтах и подстилающей породе [8]. Численность микромицетов, установленная в подстилках исследуемых лесов, характеризуется бóльшими показателями, что может быть связано как с особенностями местообитания, так и с пересчетом численности на сухой субстрат.
Таксономическая структура выделенных комплексов актиномицетов и микромицетов. Из зоны основной деструкции органического детрита исследуемых почв было выделено 89 штаммов актиномицетов, подавляющее большинство из них (70) были идентифицированы до рода Streptomyces, 3 – до рода Micromonospora. Доминирование в образцах подстилки и эутрофно-торфяного горизонта представителей рода Streptomyces не случайно, так как они являются наиболее многочисленной группой почвенных мицелиальных прокариот [26, 38].
Стрептомицеты были отнесены к 42 видам из 12 серий и 4 секций (табл. 4). Из торфяных почв ТЛ1 и ТО было выделено по 13 видов, из ТП – 12 видов, из ТЛ2 – 10 видов рода Streptomyces. Видовое сходство комплексов стрептомицетов исследуемых почв оказалось низким (коэффициент Серенсена (Ks) не превышал 0.17). Общими в индивидуальных почвенных списках были только 1‒2 вида.
Таблица 4.
Видовой состав стрептомицетов в зоне основной деструкции органического детрита исследуемых почв
| Секция | Серия | Вид |
|---|---|---|
| Cinereus | Achromogenes | S. aburaviensis S. albogriseolus S. bikiniensis S. recifensis S. tanashiensis |
| Aureus | S. griseoluteus S. zaomyceticus |
|
| Chrysomallus | S. astroolivaceus S. malachitorectus S. viridobrunneus S. viridogenes |
|
| Chromogenes | S. albaduncus S. globosus S. globisporus S. canofumeus S. xanthocidius S. polychromogenes S. purpeofuscus S. nashvillensis S. erythermus |
|
| Violaceus | S. litmocidini S. prunicolor S. ramulosus S. tubercidicus S. violaceoruber |
|
| Roseus | Lavenduale-roseus | S. cattleya S. filamentosus S. roseus |
| Fradiae | S. luridus | |
| Fuscus | S. phaeochromogenes | |
| Ruber | S. longispororuber | |
| Helvolo-Flavus | Helvolus | S. xantochromogenes |
| Albus | Albus | S. albolongus S. alborubidus S. candidus S. longisporus S. sindenensis S. varsoviensis |
| Albocoloratus | S. brunneofungus S. alboflavus S. baarensis S. griseloalbus |
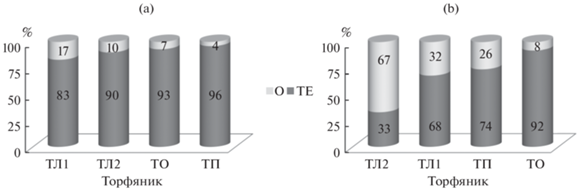
Проанализированы списки видов стрептомицетов, выделенных из подстилок и эутрофно-торфяного горизонта исследуемых почв. В подстилках спектр включал 26 видов, в горизонте ТЕ – 23 вида. Ks для этих горизонтов составил 0.27. Подавляющее большинство видов, типичных для подстилок, не было отмечено в эутрофно-торфяном горизонте. Общими оказались только 5 видов: S. cattleya, S. globosus, S. griseloalbus, S. sindenensis, S. viridogenes (рис. 3). В подстилках наиболее часто встречались виды S. griseloalbus (ЧВ – 50%) и S. zaomyceticus (ЧВ – 38%). Большинство видов попадало в группу редких и случайных (ЧВ < 30%). Аналогичную картину наблюдали в горизонте ТЕ, в котором ЧВ выявляемых видов не превышала 25%.
Рис. 3.
Видовой состав стрептомицетов в подстилке (О) и эутрофно-торфяном горизонте (ТЕ) исследуемых почв.
Виды стрептомицетов S. griseloalbus и S. zaomyceticus были впервые выделены из почв, они являются продуцентами антибиотиков гризеина и заомицина. Природные изоляты Streptomyces zaomyceticus обладают широким спектром антимикробной активности в отношении грамположительных и грамотрицательных бактерий, в том числе и Stafillococcus aureus, который чрезвычайно устойчив к бета-лактамам и другим классам антибиотиков [33]. Природные изоляты Streptomyces griseoloalbus являются фитопатогенами, которые продуцируют ферменты, разрушающие клеточную стенку. Их используют для борьбы с болезнью увядания огурцов, вызванной оомицетами Pythium aphanidermatum [29]. Следует отметить, что виды стрептомицетов S. griseloalbus и S. zaomyceticus выделены из подстилок болотных лесов впервые.
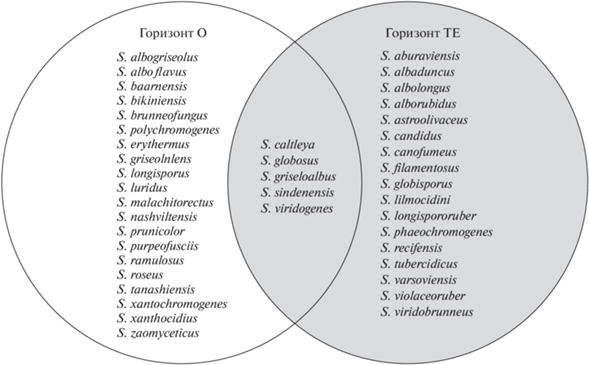
Анализ таксономической структуры микромицетных комплексов показал, что зона основной деструкции органического детрита исследуемых почв характеризуются высоким видовым разнообразием. Выделено 70 видов культивируемых грибов из 43 родов, включая две формы стерильного мицелия (табл. 5). Большинство родов микромицетов (35) из отдела Ascomycota. Отдел Mucoromycota был представлен 7 родами: Absidia, Cunninghamella, Linnemannia, Mucor, Mortierellа, Syncephalastrum, Umbelopsis. Отдел Basidiomycota ‒ одним родом. По числу видов преобладали род Penicillium (10 видов) c родом Talaromyces (5 видов), а также род Trichoderma (9 видов). Остальные рода представлены одним, редко двумя видами. Таксономическая структура микромицетных комплексов эутрофно-торфяных почв согласуется с данными, приведенными в обзорных и научно-практических статьях исследователей, изучавших микобиоту болотных и лесных экосистем бореальной зоны [8, 35, 37].
Таблица 5.
Видовой состав микромицетов и частота их встречаемости в подстилке (О) и эутрофно-торфяном горизонте (ТЕ) исследуемых почв
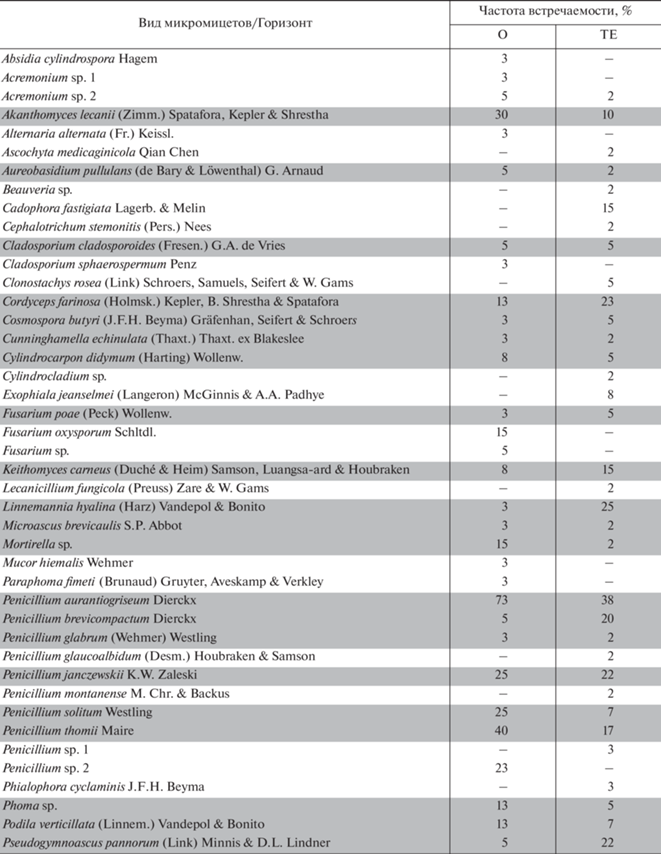
Видовое богатство в почвах под лиственными лесами (ТЛ1 и ТЛ2) составило 26 и 34 соответственно, в почве под смешанным лесом (ТП) – 27, в почве под хвойным лесом (ТО) – 38. Количество общих видов микромицетов, обнаруженных в почвах под различными лесами, варьировало от 8 до 16. Видовое сходство микромицетных комплексов (Ks) в зоне основной деструкции органического детрита исследуемых почв было невысоким ‒ от 0.31 до 0.50. Наибольшее сходство отмечено между почвами под сосняком (ТО) и березняком (ТЛ2).
Видовые списки микромицетов, выделенных из подстилок и эутрофно-торфяного горизонта исследуемых почв, насчитывали по 53 представителя, из которых 36 видов были общими. Большое количество общих видов обусловило высокую степень сходства микробиоты подстилок и горизонта ТЕ, Ks составил 0.68.
Представители доминирующих родов (Penicillium, Talaromyces, Trichoderma) встречались как в подстилках, так и в горизонте ТЕ. Отличия проявлялись на уровне видов, как их спектров, так и частоты встречаемости (табл. 5). Доминирование этих грибов характерно для различных почв бореальной зоны, в том числе болотных. Это типичные почвенные сапротрофы, способные развиваться при низкой доступности питательных веществ и усваивать трудноразлагаемые полимерные растительные субстраты [19].
В подстилках доминирующим видом был Penicillium aurantiogriseum, частота встречаемости которого составляет 73%. Часто встречались виды Penicillium thomii, Sarocladium strictum и Akanthomyces lecanii. Однако подавляющее большинство видов, изолированных как из подстилки, так и из горизонта ТЕ, были отнесены по ЧВ к редким и случайным (табл. 5). Более высокое видовое разнообразие микромицетов в горизонте ТЕ было сопряжено с более низкими показателями доминирования.
Сравнение слоев подстилки (L и F) между собой выявило большее видовое разнообразие микромицетов в ферментативном слое. В каждой почве оно достигалось за счет представителей разных родов. Так, в слое F подстилки соснового леса активно развивались быстрорастущие грибы из родов Cylindrocarpon, Mortierella, Mucor, а в слое F подстилки черноольшанника ‒ рода Trichoderma.
В подстилках, в отличие от эутрофно-торфяного горизонта, обильно развивались мукоровые грибы (Absidia cylindrospora, Mucor hiemalis, Syncephalastrum sp.), а также факультативные фитопатогенные грибы (Alternaria alternata, Paraphoma fimeti, Fusarium poae, F. oxisporum). Мукоровые грибы являются сапротрофами-сахаролитиками. Они используют легкодоступные сахара и повсеместно встречаются в слаборазложившихся органических субстратах, каковыми являются подстилки. Они стоят в начале сукцессионной цепочки микроорганизмов-деструкторов растительного опада [2, 12]. Факультативные фитопатогенные грибы обитают на растениях как эпифиты или фитопатогены, а при попадании в почву с опадом переходят на сапротрофный тип питания, участвуя в деструкции растительного детрита.
ЗАКЛЮЧЕНИЕ
Проведено комплексное исследование актиномицетных и грибных комплексов в зоне основной деструкции органического детрита эутрофных торфяных почв, представленной подстилкой (со слоями L и F) и эутрофно-торфяным горизонтом (ТЕ).
Установлено, что подстилки в болотно-лесных экосистемах являются субстратами, которые активно колонизируют грибы и актиномицеты, о чем свидетельствуют их высокие показатели обилия, установленные как прямым микроскопическим, так и чашечным методами.
Показано, что среди слоев подстилки ее ферментативный слой (F) был максимально обогащен мицелием, как грибным, так и актиномицетным (его содержание было в 2‒6 раз больше, чем в слое L). Аналогичная тенденция выявлена для численности культивируемых грибов. Численность актиномицетов зависела от типа подстилки: в лиственных лесах она была больше в слое L, тогда как в смешанном и хвойном лесе – в слое F.
Выявлено, что в подстилках больше, чем в эутрофно-торфяных горизонтах, длина грибного мицелия (в 2‒10 раз), численность микромицетов (на 2‒3 порядка) и актиномицетов (на 1‒2 порядка).
В зоне основной деструкции органического детрита эутрофных торфяных почв ферментативный слой подстилки характеризовался максимальным содержанием углерода мицелиального компонента (3‒10 мг С/г сухого субстрата). Запасы актиномицетной биомассы в зоне основной деструкции органического детрита исследуемых почв варьировали от 23 до 60 кг/га, грибной ‒ от 1593 до 3718 кг/га. Доля подстилки в профильном запасе как актиномицетной, так и грибной биомассы была более весома в лиственных лесах. Доля углерода учитываемой микробной биомассы в общем содержании углерода органического вещества исследуемых горизонтов не превышала 1.5% в подстилках и 0.5% ‒ в эутрофно-торфяных горизонтах.
Актиномицеты, выделенные из зоны основной деструкции органического детрита исследуемых почв, принадлежали к родам Streptomyces и Micromonospora. Представители доминирующего рода Streptomyces были отнесены к 42 видам из 12 серий и 4 секций. Видовое сходство актиномицетных комплексов рассматриваемых горизонтов и почв оказалось низким (Ks не превышал 0.27), что свидетельствуют об их специфичности, а также уникальности болотных биоценозов, из которых они выделены.
Из зоны основной деструкции органического детрита исследуемых почв выделено 70 видов культивируемых грибов из 43 родов. Большая часть изолятов принадлежала отделу Ascomycota. Преобладали представители родов Penicillium, Talaromyces, Trichoderma. Микобиота была представлена преимущественно редкими и случайными видами. Доминирующим видом в подстилках был Penicillium aurantiogriseum, часто встречающимися видами ‒ Penicillium thomii, Sarocladium strictum и Akanthomyces lecanii. Видовое сходство микромицетных комплексов почв было средним (Ks варьировал от 0.31 до 0.50), а горизонтов – высоким (Ks составил 0.68). Сравнение слоев подстилки (L и F) между собой выявило большее видовое разнообразие микобиоты в ферментативном слое, которое достигалось в каждой почве за счет представителей разных родов.
Подстилки не уступают эутрофно-торфяному горизонту (по болотной терминологии соответствующему деятельному слою эвтрофных торфяников) по видовому разнообразию и превосходят по обилию мицелиальных прокариот и эукариот, что делает их значимым компонентом болотно-лесных экосистем эвтрофного типа. В подстилках этих экосистем активно идут процессы деструкции органического детрита, так как следующий за подстилками эутрофно-торфяный горизонт представлен низинными торфами со средней и высокой степенью разложения. Таким образом, подстилки болотных лесов являются перспективными природными локусами для выделения активных штаммов грибов и актиномицетов, обладающих способностью деполимеризовать и минерализовать целлюлозу, лигнин и другие органические субстраты. В дальнейшем будет оценен функциональный и антагонистический потенциал коллекционных штаммов грибов и актиномицетов, выделенных из подстилок болотных лесов.
Список литературы
Ананьева Н.Д., Полянская Л.М., Сусьян Е.А., Васенкина И.В., Вирт С., Звягинцев Д.Г. Сравнительная оценка микробной биомассы почв, определяемой методами прямого микроскопирования и субстрат-индуцированного дыхания // Микробиология. Т. 77. № 3. С. 404‒412.
Берсенева О.А., Саловарова В.П., Приставка А.А. Почвенные микромицеты основных природных зон // Известия Иркутского гос. ун-та. Сер. Биология. Экология. 2008. Т. 1. № 1. С. 1‒9.
Вомперский С.Э., Сирин А.А., Глухов А.И. Формирование и режим стока при гидролесомелиорации. М.: Наука, 1988. 168 с.
Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. Определитель актиномицетов. М.: Наука, 1983. 247 с.
Головченко А.В., Волкова Е.М. Запасы и структура микробной биомассы в торфяниках карстовых ландшафтов Тульской области // Почвоведение. 2019. № 3. С. 370–376.
Головченко А.В., Грачева Т.А., Лыпкань В.А., Добровольская Т.Г., Манучарова Н.А. Актиномицетные комплексы низинных торфяников // Почвоведение. 2022. № 8. С. 990‒999.
Головченко А.В., Дмитриенко Ю.Д., Морозов А.А., Поздняков Л.А., Глухова Т.В., Инишева Л.И. Микробная биомасса в низинных торфяниках: запасы, структура, активность // Почвоведение. 2021. № 7. С. 838–848.
Головченко А.В., Добровольская Т.Г., Максимова И.А., Терехова В.А., Звягинцев Д.Г., Трофимов С.Я. Структура и функции микробных сообществ почв южной тайги // Микробиология. 2000. Т. 69. № 4. С. 1‒12.
Головченко А.В., Добровольская Т.Г., Полянская Л.М. Численность и структура микробных комплексов в контрастных почвах мезоморфного ряда ельников южной тайги // Вестн. Моск. ун-та. Сер. 17. Почвоведение. 1995. № 3. С. 57‒63.
Головченко А.В., Кураков А.В., Семенова Т.А., Звягинцев Д.Г. Обилие, разнообразие, жизнеспособность и факторная экология грибов в торфяниках // Почвоведение. 2013. № 1. С. 80–97.
Головченко А.В., Семенова Т.А., Морозов А.А., Глухова Т.В., Инишева Л.И. Микобиота низинных торфяников // Почвоведение. 2022. № 3. С. 337‒346.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1096.
Звягинцев Д.Г., Зенова Г.М. Экология актиномицетов. М.: ГЕОС, 2001. 257 с.
Зенова Г.М., Грачева Т.А., Манучарова Н.А., Звягинцев Д.Г. Актиномицетные сообщества лесных экосистем // Почвоведение. 1996. № 2. С. 1347‒1351.
Зенова Г.М., Грядунова А.А., Дорошенко Е.А., Лихачева А.А., Початкова Т.Н., Судницын И.И., Звягинцев Д.Г. Влияние влажности на жизнедеятельность актиномицетов в низинной торфяной почве // Почвоведение. 2007. № 5. С. 616–621.
Зенова Г.М., Кураков А.В. Методы определения структуры комплексов почвенных актиномицетов и грибов. М.: Изд-во Моск. ун-та, 1988. 54 с.
Зименко Т.Г., Самсонова А.С., Мисник А.Г., Гаврилкина В.В., Филлипшанова Л.И. Микробные ценозы торфяных почв и их функционирование. Минск: Наука и техника, 1983. 181 с.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Кураков А.В., Семенова Т.А. Видовое разнообразие микроскопических грибов в лесных экосистемах южной тайги европейской части России // Микология и фитопатология. 2016. Т. 50. № 6. С. 367‒378.
Мегарран Э. Экологическое разнообразие и его измерение. М.: Мир, 1992. 181 с.
Методы почвенной биохимии и микробиологии. М.: Изд-во Моск. ун-та, 1991. 304 с.
Национальный атлас почв Российской Федерации / Под ред. Шоба С.А. М.: Астрель: АСТ, 2011. 632 с.
Полянская Л.М., Головченко А.В., Звягинцев Д.Г. Микробная биомасса в почвах // Доклады АН. 1995. Т. 344. № 6. С. 846‒848.
Широких И.Г., Широких А.А. Антогонизм и резистентность к антибиотикам актиномицетов из почв трех особо охраняемых природных территорий // Почвоведение. 2019. № 10. С. 1203–1210.
Широких И.Г., Широких А.А. Почвенные актиномицеты национального лесного парка на северо-востоке Китая // Почвоведение. 2017. № 1. С. 86–92.
Chater K.F., Biro S., Lee K.J., Palmer T., Schrempf H. The complex extracellular biology of Streptomyces // FEMS Microbiol. Rev. 2010. V. 34. № 2. P. 171–198. https://doi.org/10.1111/j.1574-6976.2009.00206.x
Domsch K.H., Gams W., Anderson T.H. Compendium of soil fungi. Eching: IHW-Verlag, 2007. 672 p.
Ellis M.B. Dematiaceous Hyphomycetes. Kew: Commonw. Mycol. Inst., 1971. 607 p.
El-Tarabily Khaled A. Rhizosphere-competent isolates of streptomycete and non-streptomycete actinomycetes capable of producing cell-wall-degrading enzymes to control Pythium aphanidermatum damping-off disease of cucumber // Can. J. Botan. 2006. V. 84 № 2. P. 211‒222. https://doi.org/10.1139/b05-153
Gams W. Cephalosporium-artige Schimmelpilze (Hyphomycetes). Stuttgart: Fischer, 1971. 262 p.
Hoog G.S. The genera Beauveria, Isaria, Tritirachium and Acrodontium gen. nov. // Studies in Mycology. 1972. V. 1. 41 p.
Juan-Ovejero R., Brionesa M.J.I., Öpikb M. Fungal diversity in peatlands and its contribution to carbon cycling // Appl. Soil Ecol. 2020. V. 146. P. 103393. https://doi.org/10.1016/j.apsoil.2019.103393
Naik G., Shukla S., Mall R., Mishra S.K. Optimization of culture conditions of Streptomyces zaomyceticus RC 2073 by shake flask method // Eur. J. Biomedical Pharmaceutical Sci. 2015. V. 2. № 4. P. 620–629.
Pitt J.I. The Genus Penicillium and its teleomorphic states Eupenicillium and Talaromyces. L.: Acad. Press, 1979. 634 p.
Thormann M.N. Diversity and function of fungi in peatlands: A carbon cycling perspective // Can. J. Soil Sci. 2006. V. 86. P. 281–293. https://doi.org/10.4141/s05-082
Thormann M.N. The role of fungi in boreal peatlands // Ecological Studies. Boreal Peatland Ecosystems / Eds. Wieder R.F., Vitt D.H. Berlin: Springer-Verlag, 2006. V. 88. P. 101‒123.
Thormann M.N., Rice A.V. Fungi from peatlands // Fungal Diversity. 2007. V. 24. P. 241–299.
Ventorino V., Ionata E., Birolo L., Montella S.,Marcolongo L., de Chiaro A., Espresso F., Faraco V., Pepe O. Lignocellulose-adapted endo-cellulase producing Streptomyces strains for bioconversion of cellulose-based materials // Front. Microbiol. 2016. V. 7. 2061. https://doi.org/10.3389/fmicb.2016.02061
Дополнительные материалы отсутствуют.