Почвоведение, 2023, № 5, стр. 664-675
Коэффициенты пересчета содержания двухцепочечной ДНК в углерод микробной биомассы почв
Е. В. Чернышева a, *, Ф. Форназьер b, А. В. Борисов a
a Институт физико-химических и биологических проблем почвоведения РАН
142290 Пущино, ул. Институтская, 2а, Россия
b Soliomics
33100 Удине, Виа дель Котонифичо, 129/В, Италия
* E-mail: e.chernyysheva@yandex.ru
Поступила в редакцию 13.10.2022
После доработки 29.12.2022
Принята к публикации 30.12.2022
- EDN: IEOYRG
- DOI: 10.31857/S0032180X2260127X
Аннотация
Проведено исследование взаимосвязи концентрации почвенной ДНК и микробной биомассы, определенной методом субстрат-индуцированного дыхания, в широком ряду почв, различающихся по гранулометрическому составу, кислотности, содержанию органического углерода, микробной биомассе, различных по характеру хозяйственного использования в древности и в настоящее время. В качестве объектов исследования выбраны темногумусовые почвы сельскохозяйственных угодий на Центральном Кавказе, стратоземы земледельческих террас позднего средневековья – нового времени в среднегорной зоне Восточного Кавказа, каштановые почвы и солонцы на участках с различной интенсивностью выпаса в сухостепной зоне (Ростовская область). Показано, что определение концентрации почвенной двухцепочечной ДНК является надежным и простым методом исследования микробной биомассы в почвах со средне-, тяжелосуглинистым гранулометрическим составом, содержанием органического углерода не более 2%, микробной биомассы не более 700 мкг С/г сухой почвы. Пересчетный коэффициент FДНК в таких почвах варьировал в узком диапазоне от 5.24 до 5.41. В почвах с высоким содержанием органического углерода наблюдалось завышение FДНК (6.56 и 10.56) из-за присутствия устойчивой к разложению внеклеточной ДНК. Почва легкого гранулометрического состава на песчаниках характеризовалась меньшей степенью сохранности ДНК, что привело к уменьшению определяемой микробной биомассы (FДНК = 4.22). Пониженный коэффициент пересчета FДНК (4.78) выявлен в почвах естественных пастбищ в сухостепной зоне, что подтверждает известные ограничения возможностей использования метода субстрат-индуцированного дыхания в щелочных почвах. Хозяйственная деятельность не оказывает значимого влияния на взаимосвязь количества почвенной ДНК и микробной биомассы.
ВВЕДЕНИЕ
Определение микробной двухцепочечной ДНК (дцДНК) является альтернативным методом исследования почвенной микробной биомассы при наличии условий, ограничивающих применение других методов. В отличие от методов, основанных на определении непрямых показателей, ДНК-метод позволяет оценивать микробную биомассу, измеряя непосредственное количество базового клеточного компонента, универсального для всех живых организмов [33].
Одним из традиционных методов определения микробной биомассы в почвах является метод субстрат-индуцированного дыхания (СИД) [6]. Его преимущества – высокая воспроизводимость, чувствительность, относительно невысокие время- и трудозатратность. Метод лишен некоторых недостатков других способов определения микробной биомассы в почвах. Например, для методов прямой микроскопии таковыми являются высокая субъективность исследователя, для метода фумигации–экстракции – высокая трудозатратность, существенное влияние растительных остатков [29] и потенциальные риски для здоровья человека в случае выброса паров хлороформа. Метод СИД имеет существенные ограничения: не применим для почв с сильнокислой (рН < 2.5) и сильнощелочной реакцией среды (рН > 8.5) [9]. Поэтому необходимо привлечение новых молекулярно-генетических методов для оценки микробной биомассы в почвах, различающихся по физико-химическим свойствам, и лишенных недостатков традиционных методов.
При исследовании широкого ряда почв показано, что суммарный вклад растений, бактерий и грибов не превышал 50% от всей выделенной дцДНК, доля растительной дцДНК составила 2.6%, на бактериальную и грибную дцДНК приходилось 22.2 и 46.5% соответственно [16]. Определение концентрации дцДНК в почве может быть надежным методом исследования именно микробной биомассы в почве.
Во многих исследованиях показана тесная взаимосвязь количества почвенной ДНК и микробной биомассы [7, 10, 25, 33], но в ряде работ выявлено отсутствие взаимосвязи [19, 24, 27], что связано со следующими ограничениями:
– отсутствие единого подхода к выделению дцДНК. Различные коммерческие наборы для выделения почвенной ДНК обладают различной эффективностью экстракции [18];
– различия эффективности экстракции ДНК в зависимости от почвенных характеристик. На количество определяемой ДНК может существенно влиять присутствие гуминовых веществ [8], почвенная структура, гранулометрический состав [24] и степень фрагментация дцДНК [17];
– присутствие в образце растительных остатков и внеклеточной ДНК. Внеклеточная ДНК может закрепляться на почвенных минералах и становиться недоступной для микробного разложения [28]. Кроме того, некоторое количество ДНК выделяется растениями и сохраняется в почве в течение нескольких месяцев [35];
– структура микробного сообщества. Почвы, различающиеся физико-химическими свойствами, могут обладают различной структурой микробного сообщества, что оказывает влияние на содержание ДНК в пересчете на единицу углерода микробной биомассы. Например, грибное сообщество вносит меньший вклад генетического материала в почвенный пул ДНК по сравнению с бактериальным [18].
Как правило, в исследованиях пересчетный коэффициент (FДНК) дцДНК в углерод микробной биомассы, определенный методом СИД (Смик–СИД), варьирует в узком диапазоне от 5 до 6 [7, 10, 25, 33]. Значения FДНК ≈ 6 указывает, что 13% углерода микробной биомассы составляет ДНК [21]. Однако есть исследование [18], в котором величина пересчетного коэффициента значительно больше и составляет 38.11, но при его применении удалось получить микробную биомассу, близкую к величинам микробной биомассы, определенной методом фумигации–экстракции. В настоящей работе использовали протокол NanoDrop™ для определения ДНК в почве, в отличии от вышеупомянутых исследований, где применяли PicoGreen®, что могло вызвать различия в величине пересчетного коэффициента.
Следует отметить, что в вышеуказанных работах не приведены результаты исследования большого числа почв из разных природных зон и не приводятся данные для почв антропогенно-нарушенных и ненарушенных экосистем, что может ограничивать точность пересчетного коэффициента концентрации ДНК в микробную биомассу. В недавней работе Х. Гонг с соавт. [18] эта проблема рассмотрена наиболее глубоко и комплексно, проведено исследование 124 образцов почв из различных экосистем: пустыня, типичная степь, степной луг, лес и пашня.
Цель настоящей работы – установить взаимосвязь между концентрацией почвенной дцДНК и углеродом микробной биомассы в широком ряду почв, различающихся не только по физико-химическим свойствам, но и временем (древняя, современная) и формам (распашка, выпас) антропогенной нагрузки. Предполагали, что величина пересчетного коэффициента определяется почвенными свойствами: гранулометрическим составом, содержанием органического углерода, рН, временем и характером хозяйственного освоения территории. Исходили из предположения, что антропогенная нагрузка в древности и в настоящее время вызывает нарушение корреляции между содержанием почвенной дцДНК и микробной биомассой. В связи с этим регрессионный анализ проводили отдельно для каждой группы объектов.
ОБЪЕКТЫ ИССЛЕДОВАНИЯ
Почвы земледельческих угодий. В качестве объектов исследования выбраны почвы потенциальной земледельческой периферии поселения аланской культуры Подкумское-3 (V–VIII вв. н.э., Карачаево-Черкесская Республика). Объекты исследования располагались на северных отрогах Пастбищного хребта. Климат региона умеренно континентальный. Количество осадков составляет около 600 мм, среднегодовая температура около +8°C. Сумма температур >10°С составляет 2400–2600°С [2]. Почвенный покров представлен карболитоземами темногумусовыми (Calcaric Leptosols) и темногумусовыми почвами (Leptic Phaeozems). Почвообразующими породами служат карбонатные продукты выветривания древних осадочных пород: известняки, доломиты, мергели, перекрытые глинами и суглинками. Растительный покров представлен разнотравной луговой растительностью. Абсолютные высоты 1200–1400 м. В эпоху средневековья территория распахивалась и удобрялась навозом, после чего находилась в залежном состоянии до настоящего времени [13]. В пределах потенциальной сельскохозяйственной зоны поселения Подкумское-3 заложили серию почвенных разрезов по единой катене, ориентированной в направлении водораздел–мыс на удалении 60, 120, 250, 600, 1200 и 2300 м от поселения. Разрезы закладывали в зоне регулярной распашки с внесением навоза, в зоне распашки без внесения навоза и на фоновой территории без внесения навоза и распашки. Результаты морфологического, химического и биологического исследований представлены ранее [13].
Вторым объектом изучения стали почвы земледельческих террас в среднегорной зоне Восточного Кавказа (Республика Дагестан). Террасы, предположительно, созданы в эпоху развитого Средневековья и функционировали до 80–90 гг. прошлого столетия. Исследовали антропогенные почвы земледельческих террас, сформированных на разных породах:
– стратозем темногумусовый (Plaggic Anthrosol) ключевого участка Гуниб (3 км к западу от с. Гуниб, абсолютная высота 1690 м) сформирован на смешанном делювий глин, аргиллитов и песчаников с включениями известняков нижнего мела; почвы террас находятся в залежном состоянии более 150 лет;
– стратозем темногумусовый (Plaggic Anthrosol) ключевого участка Акуша (2.5 км к северо-западу с. Акуша, абсолютная высота 1440 м) сформирован на элювии песчаников с включениями аргиллитов; находится в залежном состоянии не более 10–20 лет;
– стратозем темногумусовый (Hortic Anthrosol) ключевого участка Муги (1.5 км к западу от с. Муги, абсолютная высота 1530 м) развит на известняках верхней юры–нижнего мела; почва находится в залежном состоянии более 50 лет;
– стратозем темногумусовый (Plaggic Anthrosol) ключевого участка Джаба (3.5 км к юго-востоку от с. Джаба, абсолютная высота 1960 м) сформирован на глинистых сланцах и аргиллитах средней юры; почва находится в залежном состоянии более 50 лет.
Подробное описание морфологических и химических свойств данных объектов представлено ранее [3].
Почвы пастбищ. Объекты исследования расположены в Донской провинции каштановых почв в пределах Сальско-Манычской гряды, Ростовская область. Климат региона умеренно континентальный. Среднегодовое количество осадков составляет около 350 мм [1]. Сумма температур воздуха >10°С равна 2900–3100°С. Среднегодовая температура +6°С. Почвообразующие породы преимущественно представлены лёссовидными суглинками и опесчаненными отложениями Ергенинской свиты. Наиболее характерными для данной территории являются каштановые и светло-каштановые солонцеватые почвы в комплексе с солонцами [4]. Растительный покров неоднородный: на солонцовых пятнах развита, в основном, полукустарничковая (полынная) растительность, ареалы каштановых почв заняты злаковой растительностью. Оценку микробной биомассы почв проводили в условиях интенсивного, умеренного и эпизодического выпаса. Подробное описание ключевого участка и результатов морфологического и химического анализа представлено ранее [22].
МЕТОДЫ ИССЛЕДОВАНИЯ
Наиболее репрезентативные участки выбирали по результатам низковысотной съемки с квадрокоптера. На данных участках выполняли морфолого-генетическое описание профилей почв. Образцы для химических и микробиологических анализов отбирали по генетическим горизонтам и послойно через 10 см в случае недифференцированного профиля. Образцы для микробиологических анализов отбирали с соблюдением условий стерильности.
Содержание органического углерода определяли в воздушно-сухой почве методом мокрого сжигания по Тюрину, рН водной вытяжки – потенциометрическим методом, содержание карбонатов – ацидиметрическим методом, гранулометрический состав – пипеточным методом11 [5]. Физические и химические свойства исследовали в воздушно-сухой почве.
Почвенную ДНК выделяли с использованием коммерческого набора FastDNA® SPIN kit for Soil (MP Biomedicals, Германия). Для экстракции использовали навеску нативной почвы 0.3 г и 1.25 мл натрий-фосфатного буфера (0.12 M, pH 7.8) вместе с керамическими и стеклянными шариками. Далее почвенную суспензию гомогенизировали с помощью гомогенезатора FastPrep® (Thermo Savant, США). Затем почвенные вытяжки центрифугировали, дцДНК в супернатанте измеряли флуорометрически с использованием красителя пикогрина (Life Technologies, США) на микропланшетном ридере FLUOstar omega (BMG Labtech, Германия). Пикогрин селективно связывается с дцДНК, увеличивая интенсивность флуоресценции в 1000 раз, пропорционально концентрации ДНК [33]. Высокая селективность пикогрина позволяет использовать его для количественного определения тотальной почвенной дцДНК даже в присутствие примесей гуминовых веществ и остатков клеточных стенок [8]. Полученные результаты выражали в мкг дцДНК/г сухой почвы [15]. Для определения концентрации дцДНК образцы хранили при –20°С, перед исследованием почву размораживали и предынкубировали при 22°С в течение 2 сут. Микробную биомассу (Смик–ДНК) рассчитывали путем умножения пересчетного коэффициента (FДНК) на концентрацию дцДНК в образце. Полученные FДНК для каждой группы объектов будут описаны ниже. Кроме того, для расчета Смик–ДНК использовали средний коэффициент FДНК = 6.
Микробную биомассу (Смик–СИД) рассчитывали по скорости СИД после обогащения почвы глюкозой с использованием коэффициента пересчета 40.04 [6]. Для определения микробной биомассы почву предварительно инкубировали при 22°С и влажности 60% полной влагоемкости в течение 7 сут. Всего исследован 121 образец.
Полученные результаты выражали на абсолютно сухую навеску почвы. Показаны средние значения из трех повторностей ± ошибка среднего. Для оценки взаимосвязи средней концентрации дцДНК и средней микробной биомассы проводили регрессионный анализ методом робастной регрессии, позволяющим снизить влияние “выбросов” в выборке при построении модели, благодаря чему в некоторых случаях он является предпочтительнее метода наименьших квадратов [12]. Статистическую обработку данных проводили в программе Past 4.03.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химические и физические свойства почв. Исследованные почвы существенно различались по химическим и физическим свойствам (табл. S1 ). Гранулометрический состав почв древних полей в окрестностях поселения Подкумское-3 имел тенденцию к сокращению доли крупных фракций по мере удаления от памятника. Наиболее легким гранулометрическим составом характеризовалась ближайшая к поселению почва, в зоне регулярного внесения навоза в средневековье.
Гранулометрический состав почв земледельческих террас Горного Дагестана различался существенно. Наиболее тяжелый гранулометрический состав отмечен у почв ключевых участков Муги и Джаба, сформированных на известняках и глинистых сланцах соответственно, наиболее легкий – у почв ключевого участка Акуша, сформированных на песчаниках. Почвы естественных пастбищ сухостепной зоны характеризовались среднесуглинистым гранулометрическим составов в верхних горизонтах, который сменялся на тяжелосуглинистый в иллювиальных. В солонцах текстурная дифференциация верхней части профиля выражена наиболее резко.
Содержание органического углерода в исследованных почвах существенно различалось. Наибольшее количество Сорг выявлено в почвах средневековых полей в окрестностях поселения Подкумское-3, где оно варьировало от 3.6 до 8.8% в горизонте AU, и от 0.9 до 3.9% в срединных горизонтах. Высокое содержание органического углерода в почвах бывших сельскохозяйственных угодий связано с внесением органических удобрений в период возделывания [20] и длительностью пребывания в залежном состоянии.
Среди агростратифицированных почв земледельческих террас наибольшее содержание Сорг выявлено в профиле почвы, сформированной на известняках (ключевой участок Муги). В почвах террас, сформированных на других почвообразующих породах, содержание органического углерода было существенно меньше, хотя, судя по обилию керамики, углей и бытового мусора в почвах, можно предполагать, что в древности эти террасы удобрялись. Возможно, в данном случае почвообразующая порода выступала в качестве предиктора, влияющего на стабилизацию почвенного органического углерода [34], что связано с содержанием карбонатов, так как Са2+ может влиять на накопление органического вещества за счет уменьшения скорости его минерализации [30, 31].
Минимальное содержание Сорг выявлено в почвах выпаса сухостепной зоны, где оно варьировало от 0.3 до 1.7%.
Все исследованные почвы характеризовались нейтральной или щелочной реакцией среды. Древние пахотные почвы в окрестностях аланского поселения Подкумское-3 отличались заметным варьированием значений рН от 6.1 на наиболее удаленных от поселения участках до 7.9 в зоне древней распашки, непосредственно прилегающей к памятнику. В почвах земледельческих террас слабощелочная реакция среды (рН 7.5–8.0) в верхних горизонтах сменялась на средне- и сильнощелочную (8.1–8.6) в нижней части профиля. Близкие к нейтральным значения рН были в почве на делювии глин, аргиллитов и песчаников (ключевой участок Гуниб); наиболее щелочная реакция отмечена в почве ключевого участка Джаба, сформированной на глинистых сланцах. Среди всех исследованных почв максимальные значения рН выявлены в почвах естественных пастбищ сухостепной зоны. Здесь на участках с наиболее интенсивным выпасом значения рН достигали 9.4.
Все изученные почвы характеризовались высоким содержанием карбонатов, однако только в случае с пастбищными почвами сухостепной зоны и террасовой почвой на песчаниках они имели педогенную природу. В почвах предгорной и среднегорной зоны карбонаты имели литогенную природу и не оказывали существенного влияния на реакцию среды этих почв.
Взаимосвязь микробной биомассы и концентрации почвенной ДНК. Микробная биомасса, определенная методом СИД, варьировала в пределах от 8.9 до 1440 мкг С/г сухой почвы. Максимальные значения наблюдались в почвах в зоне регулярного внесения навоза в окрестностях поселения Подкумское-3 (рис. 1). В почвах террас микробная биомасса в верхних слоях составляла 428–511 мкг С/г сухой почвы и определялась даже в глубинных слоях при высоких значениях рН (рис. 2).
Рис. 1.
Распределение микробной биомассы в почвах ключевого участка Подкумское-3: a – зона с регулярным внесением навоза в средневековье; b – зона без внесения навоза. 1 – Cмик–СИД; 2 – Cмик–ДНК, определенная по литературному FДНК = 6; 3 – Cмик–ДНК, определенная с использованием FДНК, полученным в настоящей работе.
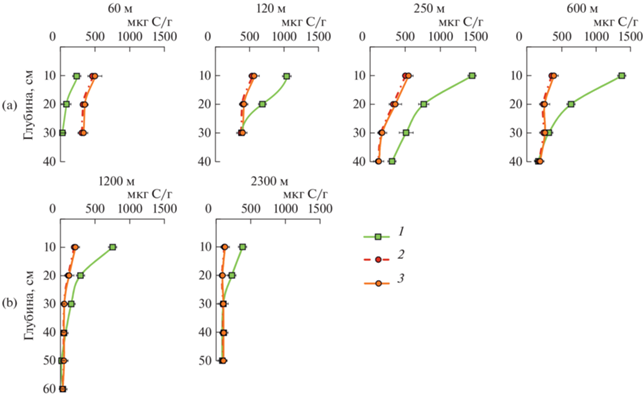
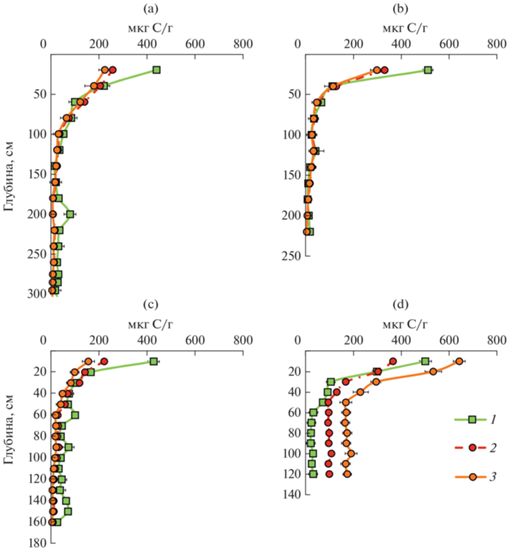
Рис. 2.
Распределение микробной биомассы в агростратифицированных почвах земледельческих террас: a – ключевой участок Джаба; b – ключевой участок Гуниб; c – ключевой участок Акуша; d – ключевой участок Муги. 1 – Cмик–СИД; 2 – Cмик–ДНК, определенная по литературному FДНК = 6; 3 – Cмик–ДНК, определенная с использованием FДНК, полученным в настоящей работе.
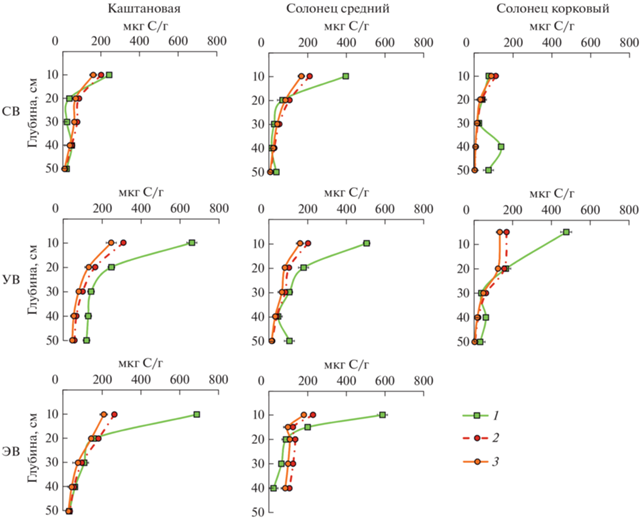
В почвах пастбищ сухостепной зоны микробная биомасса достигала 690 мкг С/г сухой почвы (рис. 3), при этом отмечена взаимосвязь этого показателя с интенсивностью пастбищной нагрузки. В частности, максимальные значения выявлены в зонах умеренного и эпизодического выпаса, минимальные – в зоне сильного выпаса. При исследование сильнощелочных почв полупустынной зоны Смик–СИД не определялась в глубоких слоях в связи с поглощением СО2 из воздуха почвенными карбонатами [33]. В настоящем исследование в сильнощелочных горизонтах почв занижение микробной биомассы, по-видимому, было незначительным. Однако, если в сильнощелочных почвах земледельческих террас Дагестана наблюдалось равномерное уменьшение Смик–СИД с глубиной, то в почвах сухостепной зоны, в некоторых случаях, отмечен дополнительный выброс СО2 на глубине 30–50 см, что привело к завышению значений микробной биомассы на этой глубине, где значения Смик–СИД больше, чем в верхних горизонтах.
Рис. 3.
Распределение микробной биомассы в почвах выпаса. СВ – сильный выпас; УВ – умеренный выпас; ЭВ – эпизодический выпас. 1 – Cмик–СИД; 2 – Cмик–ДНК, определенная по литературному FДНК = 6; 3 – Cмик–ДНК, определенная с использованием FДНК, полученным в настоящей работе.
Масштабы варьирования концентрации дцДНК в различных горизонтах изученных почв были весьма значительными и изменялись более, чем на два порядка: от 0.8 до 87.1 мкг/г сухой почвы. При этом закономерности распределения дцДНК, как между ключевыми участками, так и в пределах отдельного почвенного профиля аналогичны таковым для микробной биомассы. Данные характеризуются положительной линейной связью со следующими коэффициентами ранговой корреляции Спирмана: для почв естественных пастбищ сухостепной зоны R2 = 0.90; для древних унаваживаемых почв R2 = 0.82. Для почв земледельческих террас сила корреляционной связи между содержанием дцДНК и микробной биомассой во многом определялась литологическими условиями: в почвах на известняках и делювии глин, аргиллитов и песчаников (ключевые участки Муги и Гуниб соответственно) этот показатель составлял R2 = 0.99; в почве на глинистых сланцах (Джаба) он был несколько меньше, R2 = 0.93; и наименьшее значение выявлено для почв на песчаниках (ключевой участок Акуша) – R2 = 0.90.
Для установления взаимосвязи между Смик–СИД и концентрацией дцДНК в выборку для регрессионного анализа не включали почвенные слои с микробной биомассой >1000 мкг С/г почвы, так как определяемые значения ДНК могут оказаться ниже при очень высоких значениях микробной биомассы [7]. Не были включены слои почв, в которых наблюдалось завышение микробный биомассы, определяемой методом СИД, предположительно вызванное вкладом абиогенного СО2 почвенных карбонатов.
Из уравнения регрессии получен пересчетный коэффициент FДНК, равный 5.7 (n = 104), что близко к коэффициентам пересчета, используемым другими исследователями, однако коэффициент детерминации был невысоким (R2 = 0.69). В связи с этим в дальнейшем регрессионный анализ проводили отдельно для каждой группы объектов.
Тесная достоверная корреляция характерна для почв земледельческих террас Горного Дагестана (рис. 4a–4d). Из уравнений регрессии получены следующие коэффициенты пересчета для почв, сформированных на разных почвообразующих породах:
Рис. 4.
Регрессия между концентрацией дцДНК и Смик–СИД в почвах ключевых участков: a – ключевой участок Джаба; b – ключевой участок Гуниб; c – ключевой участок Акуша; d – ключевой участок Муги; e – ключевой участок Подкумское-3; f – почвы выпаса. 1 – зона регулярного внесения навоза в средневековье; 2 – зона без внесения навоза; 3 – сильный выпас; 4 – умеренный выпас; 5 – эпизодический выпас.
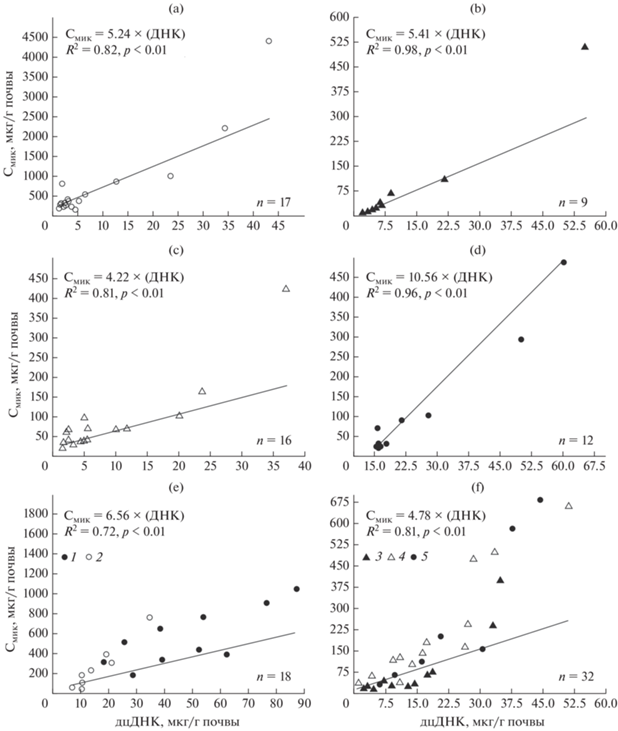
– на известняках – FДНК = 10.56 (R2 = 0.96);
– на делювии глин, аргиллитов и песчаников – FДНК = 5.41 (R2 = 0.98);
– на глинистых сланцах – FДНК = 5.24 (R2 = 0.82);
– на песчаниках – FДНК = 4.22 (R2 = 0.81).
С использованием этих коэффициентов рассчитана микробная биомасса Смик–ДНК. В результате пересчета получились практически идентичные значения Смик–ДНК и Смик–СИД в почвах ключевых участков Гуниб (делювий глин) и Джаба (сланцы), за исключением верхнего слоя 0–20 см, где Смик–ДНК в 2 раза меньше, чем Смик–СИД, что может указывать на неполноту выделения дцДНК из-за недостаточного лизиса микробных клеток и сорбции коллоидными частицами [27].
В почве террасы на известняках Смик–СИД в 1.3–2.8 раз меньше Смик–ДНК в почвенной толще до глубины 50 см, а в нижележащей толще в 5.2–8.1 раз. Повышение концентрации ДНК в этой почве могло произойти за счет устойчивой внеклеточной ДНК, источником которой являются растительные остатки и мертвые микробные клетки [24]. Сохранению внеклеточной ДНК способствовал тяжелый гранулометрический состав, насыщенность почвы основаниями и высокое содержание органического углерода по всему профилю. Известно, что гуминовые вещества способны связывать внеклеточную ДНК с помощью катионной связи [14].
Обратная ситуация отмечена в террасовой почве на песчаниках. Здесь по всему профилю наблюдали существенно меньшие значения микробной биомассы, определенной методом измерения дцДНК, особенно в нижних горизонтах. Так, значения Смик–СИД вниз по профилю уменьшались от 430 до 28 мкг С/г сухой почвы, а значения Смик–ДНК – от 157 до 7 мкг С/г почвы. Причиной может быть меньшая степень сохранности дцДНК и ее большая фрагментация в данной почве [17], что связано с более легким гранулометрическим составом. Установлено, что способность песка связывать ДНК на три порядка меньше, чем у глины [11, 26, 32].
В почвах окрестностей средневекового поселения Подкумское-3 корреляционная связь между концентрацией дцДНК и микробной биомассой существенно меньше (рис. 4e), полученный коэффициент FДНК = 6.56 (R2 = 0.72). В почвах в зоне регулярного внесения навоза (на удалении 120, 250 и 600 м от поселения), как правило, значения Смик–СИД заметно больше Смик–ДНК. В почве, непосредственно прилегающей к поселению, наблюдалась аналогичная ситуация, как и с террасовой почвой на известняках: полученные значения Смик–ДНК оказались больше, по-видимому, за счет высокой концентрации внеклеточной ДНК. В то же время на удалении более 500–700 м от поселения, где почвы не удобрялись и содержание Сорг заметно меньше, значения микробной биомассы, рассчитанные по концентрации ДНК, близки к биомассе, определенной методом СИД. В почвах с высоким содержанием органического вещества ослабляется взаимосвязь между концентрацией дцДНК и Смик–СИД и увеличивается величина коэффициента пересчета FДНК. Выделение дцДНК может быть существенно затруднено в почвах с высоким содержанием органического вещества. Так, не удалось выявить прямую взаимосвязь между концентрацией ДНК и углеродом микробной биомассы в лесных подстилках под туей (Thuja plicata) и тсугой (Tsuga heterophylla) (Британская Колумбия, Канада) [23].
Тесная коррекционная связь выявлена в почвах естественных пастбищ сухостепной зоны (рис. 4f), где коэффициент пересчета FДНК из уравнения регрессии составил 4.78 (R2 = 0.81). Занижение коэффициентов пересчета и детерминации обусловлено высокими значениями рН и большим содержанием карбонатов в почвах. На этом ключевом участке в верхних горизонтах почв, как правило, значения Смик–СИД больше Смик–ДНК. При этом оба метода давали практически одинаковую биомассу в солонцах и каштановых почвах в зоне интенсивного выпаса, а также в каштановой почве в зоне умеренного выпаса. Несмотря на сильнощелочную реакцию среды, меньшие значения Смик–СИД относительно Смик–ДНК наблюдались только в каштановой почве и солонце среднем в зоне сильного выпаса, и в солонце среднем в зоне эпизодического выпаса.
ЗАКЛЮЧЕНИЕ
Полученные результаты подтверждают, что определение количества почвенной дцДНК является надежным альтернативным методом определения микробной биомассы в антропогенно-преобразованных почвах. В результате анализа широкого ряда почв, различающихся по физико-химическим, биологическим свойствам, интенсивности и длительности антропогенного преобразования, уточнены коэффициенты пересчета концентрации дцДНК в углерод микробной биомассы. Показано, что в связи со слабой чувствительностью метода СИД в сильнощелочных почвах сухостепной зоны наиболее предпочтительным и надежным способом исследования микробной биомассы является метод определения содержания дцДНК в почвах.
Максимальная точность определения Смик–ДНК имеет место в почвах средне- и тяжелосуглинистого гранулометрического состава с содержанием органического углерода <2% и микробной биомассой <700 мкг С/г сухой почвы. Отклонение от этих параметров снижает достоверность пересчетного коэффициента. Так, в почвах легкого гранулометрического состава отмечается уменьшение значений Смик–ДНК, в связи с меньшей сохранностью ДНК в почве. В почвах с высоким содержанием органического углерода, напротив, наблюдается завышение Смик–ДНК за счет внеклеточной ДНК, источником которой являются растительные остатки и мертвые микробные клетки. Если говорить о литологических условиях, то наиболее надежные данные по Смик–ДНК можно получить для почв средне- и тяжелосуглинистого гранулометрического состава, развитых на глинистых сланцах и карбонатных породах. Высокое содержание глины, ила и обменных оснований (в первую очередь Ca2+) замедляет скорость минерализации почвенного органического вещества и повышает сохранность ДНК в почве. И напротив, в почвах на кислых породах с низким содержанием ила и низкой степенью насыщенности основаниями условия для сохранения дцДНК наименее благоприятные (почвы на песчаниках). В таких случаях пересчетный коэффициент FДНК оказывается, как правило, ниже.
Предположение о влияние антропогенной деятельности в древности и в настоящее время на взаимосвязь содержания дцДНК и микробной биомассы подтвердилось лишь частично. Наибольшее ослабление корреляционной связи наблюдалось в древних унавоженных почвах окрестностей поселения Подкумское-3. Распашка с внесением высоких доз органических удобрений на протяжении 200–300 лет привела к накоплению и стабилизации органического вещества, сохранению внеклеточной ДНК как микробного, так и растительного происхождения. Это мешает точному определению Смик–ДНК и ослабляет взаимосвязь микробной биомассы и концентрацией ДНК в почве. В почвах земледельческих террас Восточного Кавказа, где практиковалась экстенсивная система земледелия с меньшими нормами внесения органических удобрений, ослабление корреляционной связи между содержанием дцДНК и Смик–СИД не наблюдалось. То же можно сказать и о почвах естественных пастбищ. Интенсивная пастбищная нагрузка приводит к уменьшению микробной биомассы в целом, но соотношение Смик–СИД и концентрации ДНК в почве не изменяется в условиях перевыпаса. Можно заключить, что на взаимосвязь количества почвенной ДНК и микробной биомассы в почвах в большей степени оказывает влияние не хозяйственное использование, а почвенные условия: содержание органического углерода, гранулометрический состав, насыщенность основаниями и биологическая активность.
Список литературы
Агроклиматические ресурсы Калмыцкой АССР. Л.: Гидрометеорологическое изд-во, 1974. 124 с.
Агроклиматические ресурсы Ставропольского края. Л.: Гидрометеорологическое изд-во, 1971. 238 с.
Борисов А.В., Каширская Н.Н., Ельцов М.В., Пинской В.Н., Плеханова Л.Н., Идрисов И.А. Почвы древних земледельческих террас Восточного Кавказа // Почвоведение. 2021. № 5. С. 542–557. https://doi.org/10.31857/S0032180X2105004X
Минкин М.Б., Бабушкин В.М., Садименко П.А. Солонцы юго-востока Ростовской области. Ростов-на-Дону: Изд-во Рост. ун-та, 1980. 271 с.
Теории и методы физики почв. Коллективная монография / Под ред. Е.В. Шеина и Л.О. Карпачевского. М.: Гриф и К, 2007. 616 с.
Anderson J.P.E., Domsch K.H. Physiological method for quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. P. 215–221.https://doi.org/10.1016/0038-0717(78)90099-8
Anderson T.-H., Martens R. DNA determinations during growth of soil microbial biomasses // Soil Biol. Biochem. 2013. V. 57. P. 487–495.https://doi.org/10.1016/j.soilbio.2012.09.031
Bachoon D.S., Otero E., Hodson R.E. Effects of humic substances on fluorometric DNA quantification and DNA hybridization // J. Microbiological Methods. 2001. V. 47. P. 73–82. https://doi.org/10.1016/S0167-7012(01)00296-2
Beck T., Joergensen R.G., Kandeler E., Makeschin F., Nuss E., Oberholzer H.R., Scheu S. An inter-laboratory comparison of ten different ways of measuring soil microbial biomass // Soil Biol. Biochem. 1997. V. 29. P. 1023–1032. https://doi.org/10.1016/S0038-0717(97)00030-8
Blagodatskaya E.V., Blagodatskii S.A., Anderson T.-H. Quantitative isolation of microbial DNA from different types of soils of natural and agricultural ecosystems // Microbiology. 2003. V. 72(6). P. 744–749. https://doi.org/10.1023/B:MICI.0000008379.63620.7b
Blum S.A.E., Lorenz M.G., Wackernagel W. Mechanism of retarded DNA degradation and prokaryotic origin of DNases in nonsterile soils // Systematic and Applied Microbiology. 1997. V. 20. P. 513–521. https://doi.org/10.1016/S0723-2020(97)80021-5
van den Boogaart K.G., Filzmoser P., Hron K., Templ M., Tolosana-Delgado R. Classical and robust regression analysis with compositional data // Mathematical Geosciences. 2021. V. 53. P. 823–858. https://doi.org/10.1007/s11004-020-09895-w
Chernysheva E., Khomutova T., Fornasier F., Kuznetsova T., Borisov A. Effects of long-term medieval agriculture on soil properties: A case study from the Kislovodsk basin, Northern Caucasus, Russia // J. Mountain Sci. V. 15. P. 1171–1185. https://doi.org/10.1007/s11629-017-4666-7
Crecchio C., Stotzky G. Binding of DNA on humic acids: effect on transformation of Bacillus subtilis and resistance to DNase // Soil Biol. Biochem. 1998. V. 30. P. 1060–1067. https://doi.org/10.1016/S0038-0717(97)00248-4
Fornasier F., Ascher J., Ceccherini M.T., Tomat E., Pietramellara G. A simplified rapid, low-cost and versatile DNA-based assessment of soil microbial biomass // Ecological Indicators. 2014. V. 45. P. 75–82. https://doi.org/10.1016/j.ecolind.2014.03.028
Gangneux C., Akpa-Vincesla M., Sauvage H., Desaire S., Houot S., Laval K. Fungal, bacterial and plant dsDNA contributions to soil total DNA extracted from silty soils under different farming practices: relationships with chloroform-labile carbon // Soil Biol. Biochem. 2011. V. 43. P. 431–437. https://doi.org/10.1016/j.soilbio.2010.11.012
Georgiou C.D., Papapostolou I. Assay for the quantification of intact/fragmented genomic DNA // Analyt. Biochem. 2006. V. 358. P. 247–256.https://doi.org/10.1016/j.ab.2006.07.035
Gong H., Du Q., Xie S., Hu W., Akram M.A., Hou Q., Dong L., Sun Y., Manan A., Deng Y., Ran J., Deng J. Soil microbial DNA concentration is a powerful indicator for estimating soil microbial biomass C and N across arid and semi-arid regions in northern China // Appl. Soil Ecology. 2021. V. 160. P. 103863. https://doi.org/10.1016/j.apsoil.2020.103869
Griffiths, B.S., Díaz-Raviña, M., Ritz, K., McNicol, J.W., Ebblewhite, N., Bååth, E. Community DNA hybridisation and % G + C profiles of microbial communities from heavy metal polluted soils // FEMS Microbiol. Ecol. 1997. V. 24. P. 103–112. https://doi.org/10.1111/j.1574-6941.1997.tb00427.x
Homburg J.A., Sandor J.A. Anthropogenic effects on soil quality of ancient agriculture systems of the American Southwest // Catena. 2011. V. 85. P. 144–154. https://doi.org/10.1016/j.catena.2010.08.005
Joergensen R.G., Emmerling C. Methods for evaluating human impact on soil microorganisms based on their activity, biomass, and diversity in agricultural soils // J. Plant Nutrition Soil Sci. 2006. V. 169. P. 295–309. https://doi.org/10.1002/jpln.200521941
Khomutova T.E., Fornasier F., Yeltsov M.V., Chernysheva E.V., Borisov A.V. Influence of grazing on the structure and biological activity of dry steppe soils of the southern Russian Plain // Land Degradation Development. V. 32. P. 4832–4844. https://doi.org/10.1002/ldr.4032
Leckie S.E., Prescott C.E., Grayston S.J., Neufeld J.D., Mohn W.W. Comparison of chloroform fumigation-extraction, phospholipid fatty acid, and DNA methods to determine microbial biomass in forest humus // Soil Biol. Biochem. V. 36. P. 529–532. https://doi.org/10.1016/j.soilbio.2003.10.014
Levy-Booth D.J., Campbell R.G., Gulden R.H., Hart M.M., Powell J.R., Klironomos J. N., Pauls K.P., Swanton C.J., Trevors J.T., Dunfield K.E. Cycling of extracellular DNA in the soil environment // Soil Biol. Biochem. 2007. V. 39. P. 2977–2991. https://doi.org/10.1016/j.soilbio.2007.06.020
Lloyd-Jones G., Hunter D.W.F. Comparison of rapid DNA extraction methods applied to contrasting New Zealand soils // Soil Biol. Biochem. 2001. V. 33. P. 2053–2059. https://doi.org/10.1016/S0038-0717(01)00133-X
Lorenz M.G., Wackernagel W. Adsorption of DNA to sand and variable degradation rates of adsorbed DNA // Appl. Environ. Microbiol. 1987. V. 53. P. 2948–2952. https://doi.org/10.1128%2Faem.53.12.2948-2952.1987
Marstorp H., Witter E. Extractable dsDNA and product formation as measures of microbial growth in soil upon substrate addition // Soil Biol. Biochem. 1999. V. 31. P. 1443–1453. https://doi.org/10.1016/S0038-0717(99)00065-6
Morrissey E.M., McHugh T.A., Preteska L., Hayer M., Dijkstra P., Hungate B.A., Schwartz E. Dynamics of extracellular DNA decomposition and bacterial community composition in soil // Soil Biol. Biochem. 2015. V. 86. P. 42–49. https://doi.org/10.1016/j.soilbio.2015.03.020
Mueller T., Joergensen R.G., Meyer B. Estimation of soil microbial biomass C in the presence of living roots by fumigation-extraction // Soil Biol. Biochem. 1992. V. 24. P. 179–181. https://doi.org/10.1016/0038-0717(92)90275-3
Muneer M., Oades J.M. The role of Ca-organic interactions in soil aggregate stability. 1. Laboratory studies with glucose-C-14, CaCO3 and CaSO4·H2O // Austral. J. Soil Res. 1989. V. 27. P. 389–399. https://doi.org/10.1071/SR9890389
Muneer M., Oades J.M. The role of Ca-organic interactions in soil aggregate stability. 2. Field studies with C-14-labeled straw, CaCO3 and CaSO4·H2O // Austral. J. Soil Res. 1989b. V. 27. P. 401–409. https://doi.org/10.1071/SR9890401
Paget E., Monrozier L.J., Simonet P. Adsorption of DNA on clay minerals: protection against DNase I and influence on gene transfer // FEMS Microbiol. Lett. 1992. V. 97. P. 31–40. https://doi.org/10.1016/0378-1097(92)90359-V
Semenov M., Blagodatskaya E., Stepanov A., Kuzyakov Ya. DNA-based determination of soil microbial biomass in alkaline and carbonaceous soils of semi-arid climate // J. Arid Environ. 2018. V. 150. P. 54–61. https://doi.org/10.1016/j.jaridenv.2017.11.013
Wiesmeier M., Urbanski L., Hobley E., Lang B., von Lützow M., Marin-Spiotta E., van Wesemael B., Rabot E., Liess M., Garcia-Franco N., Wollschläger U., Vogen H.-J., Kögel-Knabner I. Soil organic carbon storage as a key function of soils - A review of drivers and indicators at various scales // Geoderma. 2019. V. 333. P. 149–162. https://doi.org/10.1016/j.geoderma.2018.07.026
Yokoyama S., Yuri K., Nomi T., Komine M., Nakamura S., Hattori H., Rai H. The high correlation between DNA and chloroform-labile N in various types of soil // App-l. Soil Ecol. 2017. V. 117–118. P. 1–9. https://doi.org/10.1016/j.apsoil.2017.04.002
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Таблица S1. Некоторые физические и химические свойства изученных почв.


