Почвоведение, 2023, № 5, стр. 579-585
Влияние внесения минерального азота и глюкозы на температурную чувствительность (Q10) минерализации органического вещества почв
А. И. Матвиенко a, *, М. С. Громова a, О. В. Меняйло b
a Институт леса им. В.Н. Сукачева СО РАН, ФИЦ КНЦ СО РАН
660036 Академгородок, Красноярск, Россия
b Joint FAO/IAEA Centre of Nuclear Techniques in Food and Agriculture,
Soil and Water Management and Crop Nutrition Laboratory
2444 Seibersdorf, Austria
* E-mail: matvienko.ai@ksc.krasn.ru
Поступила в редакцию 14.10.2022
После доработки 29.12.2022
Принята к публикации 30.12.2022
- EDN: IEQGJH
- DOI: 10.31857/S0032180X22601281
Аннотация
Изучена температурная чувствительность (Q10) минерализации С в почвах двух типов: серая лесная (Phaeozems, экосистема лесная поляна) и дерново-подзолистая (Retisols, экосистема сосняк мертвопокровный). Показано, что температурная чувствительность больше на лесной поляне, чем в сосняке, и возрастает вниз по почвенному профилю. Глубина почв оказалась самым сильным фактором, определяющим вариацию Q10. Внесение азота (NH4NO3) увеличило Q10 в верхних горизонтах почв, а внесение глюкозы, наоборот уменьшило Q10 в обеих экосистемах. Наиболее сильно эффект внесения глюкозы проявлялся в нижних горизонтах. Совместное внесение глюкозы и азота влияло на Q10 также, как внесение только глюкозы, указывая, что доступность легкоразлагаемого субстрата – более сильный фактор, влияющий на температурную чувствительность, чем азот. Полученные данные позволяют прогнозировать изменение вклада гетеротрофной составляющей эмиссии СО2 из почв при глобальном потеплении, увеличении поступления корневых экссудатов, фитодетрита и экзогенного азота в почву.
ВВЕДЕНИЕ
Почвы – главный источник атмосферного СО2. Микробное разложение почвенного органического вещества (гетеротрофное дыхание) – один из основных процессов образования СО2 в почве, сильно зависимый от температуры [10, 14, 20]. Температурная чувствительность гетеротрофного дыхания определяет будут ли почвы в условиях потепления накапливать–стабилизировать С или терять его в процессе разложения, выделяя СО2 и дополнительно увеличивая скорость климатических изменений [10]. Температурная чувствительность, показателем которой является коэффициент Q10, может варьировать в зависимости от типа почв, типа экосистемы и глубины почвенного горизонта [2, 3, 6, 15]. Однако факторы, определяющие вариацию Q10, такие как доступный углерод и азот, остаются малоизученными. Это особенно актуально в связи с повышенной экссудацией органического углерода тонкими корнями и микоризой из-за повышенной концентрации СО2 в атмосфере [24, 26] и эффективностью корневых экссудатов в стабилизации почвенного С [23]. Поступление азота в почвы с удобрениями и азотными депозициями из атмосферы неодинаково влияет на скорость образования СО2 [4, 8, 12, 25, 27, 28], этот механизм остается недостаточно изученным. Настоящая работа призвана восполнить пробел в знаниях о влиянии минерального азота или легкодоступного органического вещества (глюкозы) на температурную чувствительность Q10 разных генетических горизонтов почв, расположенных в двух экосистемах: лесной поляне и сосняка мертвопокровного.
ОБЪЕКТЫ И МЕТОДЫ
Объект исследования. Исследовали образцы разных генетических горизонтов серой лесной почвы (Phaeozems, лесная поляна, профиль AY–AEL–BEL–BT) и дерново-подзолистой почвы (Retisols, 80-летний сосняк мертвопокровный [7], профиль AY–EL–BEL–BT), расположенных в районе пос. Памяти 13 борцов, Емельяновский район, Красноярский край [17, 18]. После сбора образцы сразу доставляли в лабораторию для подготовки и измерения потока СО2. Свежие образцы минеральных горизонтов просеивали через сито диаметром 2 мм для гомогенизации и удаления органических остатков и корней. В почвах определяли содержание C, N, соотношение C/N и ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ (табл. 1).
Таблица 1.
Химические свойства исследуемых почв в двух экосистемах. Приведены средние значения и стандартные ошибки (в скобках) для трех повторностей
| Почва | Горизонт | Глубина, см | C, % | N, % | C/N | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ |
|---|---|---|---|---|---|---|
| Серая лесная | AY | 0–10 | 4.27 (1.02) | 0.31 (0.12) | 13.83 (0.45) | 6.14 (0.22) |
| (лесная поляна) | AEL | 10–20 | 2.73 (0.61) | 0.18 (0.02) | 15.00 (1.43) | 5.99 (0.13) |
| BEL | 20–30 | 1.63 (0.13) | 0.12 (0.01) | 13.54 (1.03) | 5.83 (0.13) | |
| BT | 30–50 | 1.9 (0.34) | 0.15 (0.01) | 12.7 (0.64) | 5.79 (0.12) | |
| Дерново- | AY | 0–10 | 2.86 (0.02) | 0.18 (0.02) | 16.34 (0.61) | 5.88 (0.02) |
| подзолистая | EL | 10–15 | 2.50 (0.13) | 0.17 (0.03) | 15.07 (0.42) | 5.94 (0.03) |
| (сосновый лес) | BEL | 15–20 | 2.07 (0.44) | 0.15 (0.01) | 13.96 (0.44) | 5.87 (0.15) |
| BT | 20–35 | 1.7 (0.21) | 0.13 (0.02) | 13.1(0.32) | 5.69 (0.14) |
Измерение скорости образования СО2, расчет Q10 и варианты обработки. Каждый почвенный образец распределяли по 16 стеклянным сосудам объемом 0.5 л, по 100 г почвы в каждом. Шестнадцать сосудов включали 4 варианта и 4 повторности. Варианты опыта: а) добавление 10 мл воды (контроль), б) внесение 10 мл водного раствора глюкозы (концентрация 2.5 мг С г–1 почвы), в) 10 мл водного раствора нитрата аммония (концентрация 170 мкг N г–1 почвы), г) водного раствора (10 мл) глюкозы и нитрата аммония в вышеуказанных концентрациях.
Схема оборудования для измерения потока СО2 при разной температуре детально описана ранее [1]. Кратко, сосуды помещали в инкубатор с программируемым температурным режимом. Каждый сосуд соединяли через 16-портовый мультиплексер Li-Cor 8150 с инфракрасным анализатором СО2 Li-Cor 8100 (Li-Cor Incorporated, США). Пока в одном сосуде происходило измерение, остальные сосуды продували комнатным воздухом для предотвращения накопления СО2, избыточная концентрация которого лимитирует скорость его образования. Инкубацию почвенных образцов проводили 82 ч при 20°С с регулярным (каждые 8 ч) кратковременным (на 2 ч) понижением температуры на 10°С. Температурный режим во время инкубации соответствовал 10–20°С, влажность 60% полной полевой влагоемкости. Скорость образования СО2 измеряли каждые 2 ч, получая одно измерение при 10°С на каждые четыре измерения при 20°С.
Для оценки температурной чувствительности минерализации почвенного органического вещества использовали коэффициент Q10. Разница при инкубации в 10°С позволила вычислить коэффициент Q10 как отношение скорости образования СО2 при большей температуре к скорости при меньшей [11]. Q10 рассчитывали для каждого цикла понижения/повышения температуры по формуле:
По средней скорости выделения СО2 при 20°С за 82 ч рассчитывали общее количество СО2, выделившегося за время инкубации. Среднее Q10 рассчитывали как среднее значение из всех Q10, полученных для каждого цикла измерений.
Статистический анализ данных. Скорости образования СО2 и рассчитанные значения Q10 тестировали на нормальность распределения (тест Колмогорова–Смирнова) и однородность выборки (тест Левина). Затем раздельно для скорости образования СО2 и для значений Q10 проводили многофакторный дисперсионный анализ вариации с повторяющимися измерениями (40 временных точек для скорости образования СО2 и 8 точек для Q10). Для потока СО2 и средних Q10 выполняли многофакторный дисперсионный анализ (табл. 2). Главными факторами были тип экосистемы (2 уровня, соответствующих двум видам экосистемы), глубина почвенного горизонта (4 уровня – 4 горизонта для каждого образца), добавление углерода (2 уровня – контроль, внесение) добавление азота (2 уровня – контроль, внесение). В вариантах, где эффекты главных факторов были значимы, проводили попарное сравнение методом Фишера для определения в каком горизонте или в какой экосистеме эффект был статистически значим. Все эффекты считали достоверными при Р < 0.050.
Таблица 2.
Результаты многофакторного дисперсионного анализа для общего количества выделившегося СО2 и средних значений Q10 в образцах почв двух экосистем с различными добавками. Жирным шрифтом выделены уровни значимости достоверных эффектов главных факторов и их взаимодействий
| Факторы и их взаимодействия | СО2 | Q10 | ||
|---|---|---|---|---|
| F | P | F | P | |
| Экосистема | 268 | >0.001 | 1.6 | 0.203 |
| Горизонт | 2445 | >0.001 | 343.9 | >0.001 |
| Глюкоза | 2859 | >0.001 | 429.4 | >0.001 |
| Азот | 315 | >0.001 | 33.3 | >0.001 |
| Экосистема × горизонт | 98 | >0.001 | 3.2 | >0.05 |
| Экосистема × глюкоза | 72 | >0.001 | 14 | >0.001 |
| Горизонт × глюкоза | 755 | >0.001 | 69 | >0.001 |
| Экосистема × азот | 5 | >0.05 | 2.5 | 0.119 |
| Горизонт × азот | 74 | >0.001 | 0.5 | 0.682 |
| Глюкоза × азот | 282 | >0.001 | 0.6 | 0.43 |
| Экосистема × горизонт × глюкоза | 9 | >0.001 | 10.9 | >0.001 |
| Экосистема × горизонт × азот | 1 | 0.367 | 0.4 | 0.743 |
| Экосистема × глюкоза × азот | 3 | 0.076 | 5.9 | >0.05 |
| Горизонт × глюкоза × азот | 61 | >0.001 | 2 | 0.117 |
| Экосистема × горизонт × глюкоза × азот | 2 | 0.159 | 4.2 | >0.01 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Скорость образования СО2. Все образцы почв реагировали на внесение добавок примерно одинаково, поэтому на рис. 1 для примера приведена динамика скорости образования СО2 за все время инкубации только для одного почвенного образца, отобранного из горизонта AY дерново-подзолистой почвы соснового леса. Скорость в течение первых 24 ч инкубации снижалась достаточно быстро от 0.19 до 0.10 мкмоль СО2 кг–1 с–1 в дерново-подзолистой почве сосняка и от 0.15 до 0.07 мкмоль СО2 кг–1 с–1 в серой лесной почве лесной поляны (данные не приведены), а затем до конца эксперимента намного медленнее. Двукратное уменьшение скорости выделения СО2 обусловлено быстрым расходованием микроорганизмами легкодоступного углерода в почвах, как правило, этот процесс в лабораторных условиях заметен уже в первые сутки [21].
Рис. 1.
Динамика скорости образования СО2 в течение инкубации при 20°С в образцах верхнего горизонта почв из сосняка при внесении различных добавок (1 – контроль, 2 – глюкоза, 3 – азот, 4 – глюкоза и азот).
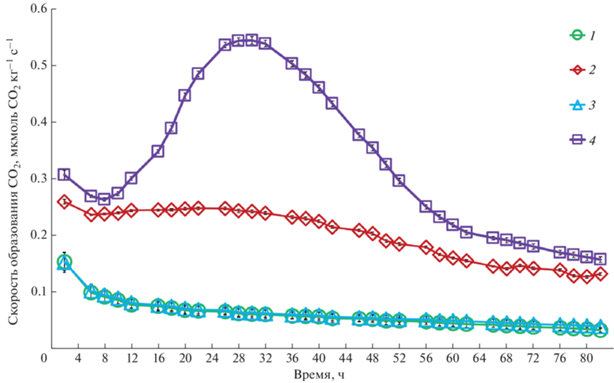
В целом полученные данные по влиянию добавок соответствуют классическим представлениям о действии внесения азота и глюкозы на активность почвенных гетеротрофов. Так, добавление только азота не привело к изменению скоростей образования СО2 во всех образцах, поскольку влияние азота либо слабое, либо проявляется в более длительных инкубационных экспериментах. Напротив, добавление глюкозы сразу увеличило скорость выделения СО2 примерно в 3 раза, как в почве сосняка, так и лесной поляны. Однако дальнейшего увеличения скорости выделения СО2 в течение инкубации не наблюдалось, что свидетельствует об отсутствии роста микробной биомассы. Как известно, микробное сообщество лимитировано в первую очередь по углероду, его добавление моментально увеличивает скорость минерализации [13]. Совместное добавление глюкозы и азота еще больше увеличило скорость выделения СО2 из почв. Динамика эмиссии СО2 в этом варианте за весь период инкубации четко показывает наличие лаг-фазы (0–8 ч), фазы экспоненциального роста (8–22 ч), фазы замедления (22–28 ч), стационарную фазу (28–32 ч) и фазу отмирания (до 82 ч). Наличие этих фаз в динамике выделения СО2 свидетельствует о росте микробной биомассы за время инкубации, и что в исследуемых почвах для роста микроорганизмов необходима не только глюкоза, но и азот. Таким образом, скорость минерализации С определяется субстратом, а для роста микроорганизмов углеродсодержащего безазотистого субстрата недостаточно, нужен еще азот.
За время эксперимента из почв верхнего горизонта AY лесной поляны во всех вариантах выделилось большее количество СО2, чем из соответствующих вариантов горизонта AY соснового леса (рис. 2). Это говорит о большей микробиологической активности в почвах поляны. Известно, что влияние типа экосистемы (лес или поляна) на свойства почв наиболее заметно проявляется в подстилках и верхних минеральных горизонтах почв и значительно меньше – в нижних [5].
Рис. 2.
Вертикальная стратификация общего количества выделившегося СО2 за 82 ч инкубации по почвенному профилю в почвах лесной поляны (a) и соснового леса (b) с различными добавками (подпись вертикальной оси: C – контроль, N – с азотом, G – с глюкозой, G + N – с глюкозой и азотом). Разные строчные латинские буквы обозначают статистическую значимость различий между выделившимся СО2 в соответствующих горизонтах почв в разных экосистемах и вариантах опыта.
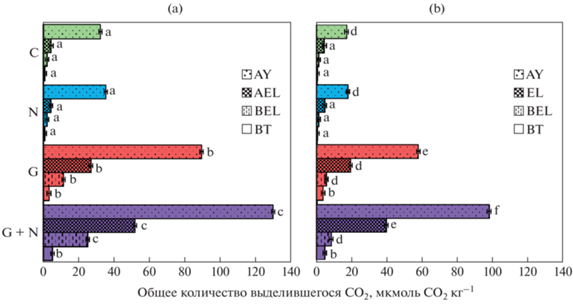
С глубиной в исследуемых почвах уменьшалось содержание органического углерода, азота, и увеличивалось pH, что привело к сокращению скорости выделения СО2 с глубиной в почвах обеих экосистем. Статистически значимой разницы в количестве выделившегося СО2 между нижними горизонтами не было, как внутри профиля (AEL, BE, BT – в почвах поляны и EL, BEL, BT – в почвах сосняка), так и между типами почв.
Добавление азота увеличило количество выделившегося СО2 на 5–9% в верхних горизонтах и уменьшило на 1–2% в нижних, но статистической значимости это не имело. Положительный эффект внесения азота становится значимым, только благодаря взаимодействию факторов: горизонт, внесение глюкозы и азота. Причем сильнее влияние было в почвах поляны, где совместное внесение глюкозы и азота достоверно увеличило поток СО2 во всех горизонтах. По сравнению с контролем в зависимости от типа экосистем и глубины горизонта наблюдалось увеличение скорости выделения СО2 на: 178–533% при добавлении только глюкозы и 304–1176% при добавлении глюкозы и азота совместно.
Температурная чувствительность образования СО2. Несмотря на уменьшение активности выделения СО2 в течение эксперимента, рассчитанные значения Q10 практически не изменялись со временем, что позволило рассчитать средние Q10 за весь эксперимент для образцов каждого горизонта двух типов почв с добавками и без (рис. 3).
Рис. 3.
Распределение по почвенным горизонтам средних значений Q10 в почвах двух экосистем – лесной поляны (a) и соснового леса (b) с различными добавками (подпись вертикальной оси: C – контроль, N – с азотом, G – с глюкозой, G + N – с глюкозой и азотом). Разные строчные латинские буквы обозначают статистическую значимость различий между Q10 в соответствующих горизонтах почв в разных экосистемах и вариантах опыта.
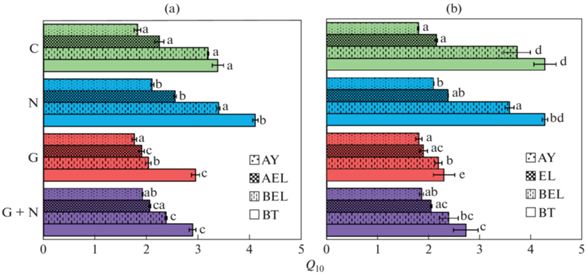
Значения Q10 не отличались между типами почв в верхних горизонтах, но сильно и достоверно увеличивались с глубиной почвенного профиля и варьировали от 1.8 до 3.4 в почвах поляны и от 1.8 до 4.3 в почвах сосняка. Увеличение значений Q10 вниз по профилю было ожидаемо, так как подтверждалось ранее [15]. Однако в настоящей работе получены количественные оценки увеличения температурной чувствительности дыхания с глубиной, позволяющие утверждать, что глубина – наиболее сильный фактор из исследованных, определяющих вариацию температурной чувствительности (Q10).
Добавление азота увеличило значения Q10 в обеих экосистемах, но влияние азота на разной глубине определялось типом экосистемы. В лесной поляне азот увеличивал значения Q10 во всех горизонтах, но статистически незначимо в горизонте BEL. В образцах из соснового леса положительный эффект азота наблюдался только в верхних горизонтах. Особенность лесных почв по сравнению с полянами – более четкая вертикальная стратификация содержания углерода: много в верхних, мало в нижних горизонтах [16]. Напротив, в лесной поляне, как в травянистой экосистеме, корни более глубоко проникают в почвенный профиль, обеспечивая нижние слои свежим углеродом [22]. Возможно, причина наличия эффекта азота на Q10 во всех горизонтах поляны объясняется именно этим.
Внесение глюкозы, как показано ранее [1], уменьшало значения Q10 в обеих экосистемах, но только в нижних горизонтах, что объясняется низкой доступностью С для микроорганизмов. Внесение глюкозы более резко увеличивает доступность С в нижних горизонтах, что и приводит к уменьшению величины Q10. В верхних горизонтах эффект от внесения глюкозы отсутствовал. Совместное внесение азота и глюкозы имело схожий эффект с вариантом с глюкозой.
В целом обнаружено разнонаправленное действие добавок на Q10. Внесение азота увеличивает температурную чувствительность в образцах с большим количеством почвенного органического вещества, а внесение глюкозы ее уменьшает в почвах нижних горизонтов, где активность микроорганизмов наиболее лимитирована углеродом.
ЗАКЛЮЧЕНИЕ
Изучена температурная чувствительность минерализации органического вещества в двух контрастных экосистемах: лесной поляны и сосняка. Несмотря на большие различия в свойствах почв, структуре микробного сообщества, обнаружены общие закономерности: в обеих экосистемах значения Q10 резко увеличиваются с глубиной, добавление глюкозы уменьшает Q10 в глубоких горизонтах, добавление азота, наоборот, увеличивает Q10 в верхних горизонтах, относительно богатых легкодоступным органическим веществом. Сделаны следующие выводы:
1. Глубина почвы определяет температурную чувствительность С минерализации сильнее, чем тип экосистемы, добавление азота или углерода.
2. Внесение азота значимо не влияло на количество выделяющегося углерода, но увеличивало температурную чувствительность минерализации С в почвах обеих экосистем, в горизонтах, богатых доступным органическим веществом.
3. Добавление легкоразлагаемого субстрата (глюкозы) уменьшало температурную чувствительность минерализации С в нижних горизонтах до уровня значений Q10 верхних горизонтов, что указывает на обусловленность высоких Q10 нижних горизонтов недостатком органического вещества.
4. В почвах Красноярской лесостепи скорость минерализации С определяется наличием легкодоступного субстрата, а для роста микроорганизмов, углеродсодержащего безазотистого субстрата недостаточно, еще необходим азот. При увеличении поступления С в почву из-за повышенного содержания СО2 в атмосфере рост микробной биомассы будет определяться поступлением азота извне. Экспериментально показано, что внутреннего потенциала почв произвести минеральный азот для поддержки роста биомассы недостаточно.
Из-за контрастных различий изученных экосистем, обнаруженные закономерности, скорее всего, носят общий характер и будут проявляться в других почвах умеренной и бореальной лесной зоны. Лабораторные инкубационные эксперименты не заменяют полевых исследований, но данные, полученные в строго контролируемых условиях, помогают выявить влияние отдельных факторов на температурную чувствительность, что необходимо для моделирования процессов углеродного цикла [19]. Верификация моделей должна осуществляться в полевых опытах.
Список литературы
Громова М.С., Матвиенко А.И., Макаров М.И., Ченг Ш.К., Меняйло О.В. Температурная чувствительность (Q10) базального дыхания как функция количества доступного углеродного субстрата, температуры и влажности // Почвоведение. 2020. № 3. С. 366–371.
Каганов В.В., Курганова И.Н. Оценка скорости минерализации органического вещества основных типов почв европейской части России при различных температурных режимах // Региональные геосистемы. 2011. Т. 16. № 15. С. 145–153.
Ларионова А.А., Квиткина А.К., Евдокимов И.В., Быховец С.С., Стулин А.Ф. Влияние температуры на интенсивность разложения лабильного и устойчивого органического вещества агрочернозема // Почвоведение. 2013. № 7. С. 803.
Меняйло О.В., Матвиенко А.И., Макаров М.И., Ченг Ш.К. Роль азота в регуляции цикла углерода в лесных экосистемах // Лесоведение. 2018. № 2. С. 143–159.
Солодовников А.Н., Рожков В.А. Исследование влияния древесной породы на почву методом дискриминантного анализа // Бюл. Почв. ин-та им. В.В. Докучаева. 2019. № 96. С. 22–46.
Тархов М.О., Матышак Г.В., Рыжова И.М., Гончарова О.Ю., Бобрик А.А., Петров Д.Г., Петржик Н.М. Температурная чувствительность дыхания почв бугристых торфяников севера Западной Сибири // Почвоведение. 2019. № 8. С. 946–955.
Тонконогов В.Д., Герасимова М.И., Лебедева И.И. Классификация почв России: 1997–2004–2008 // Ґрунтознавство. 2008. № 9. С. 142–146.
Chen J., Luo Y., Li J., Zhou X., Cao J., Wang R.W. et al. Costimulation of soil glycosidase activity and soil respiration by nitrogen addition // Global Change Biology. 2017. V. 23. № 3. P. 1328–1337.
Craine J.M., Fierer N., McLauchlan K.K. Widespread coupling between the rate and temperature sensitivity of organic matter decay // Nature Geoscience. 2010. V. 3. № 12. P. 854–857.
Davidson E.A., Janssens I.A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change // Nature. 2006. V. 440. P. 166–169.
Fang C., Moncrieff J.B. The dependence of soil CO2 efflux on temperature // Soil Biol. Biochem. 2001. V. 33. № 2. P. 155–165.
Janssens I.A., Dieleman W., Luyssaert S., Subke J.A., Reichstein M., Ceulemans R. et al. Reduction of forest soil respiration in response to nitrogen deposition // Nature geoscience. 2010. V. 3. № 5. P. 315–322.
Karhu K., Alaei S., Li J., Merilä P., Ostonen I., Bengtson P. Microbial carbon use efficiency and priming of soil organic matter mineralization by glucose additions in boreal forest soils with different C : N ratios // Soil Biol. Biochem. 2022. V. 167. P. 108615.
Kuzyakov Y. Sources of CO2 efflux from soil and review of partitioning methods // Soil Biol. Biochem. 2006. V. 38. № 3. P. 425–448.
Li J., Pei J., Pendall E., Reich P.B., Noh N.J., Li B. et al. Rising temperature may trigger deep soil carbon loss across forest ecosystems // Adv. Sci. 2020. V. 7. № 19. P. 2001242.
Menyailo O.V., Huwe B. Denitrification and C, N mineralization as function of temperature and moisture potential in organic and mineral horizons of an acid spruce forest soil // J. Plant Nutrition Soil Sci. 1999. V. 162. № 5. P. 527–531.
Menyailo O.V., Hungate B.A., Zech W. The effect of single tree species on soil microbial activities related to C and N cycling in the Siberian artificial afforestation experiment // Plant and Soil. 2002. V. 242. № 2. P. 183–196.
Menyailo O.V., Hungate B.A., Zech W. Tree species mediated soil chemical changes in a Siberian artificial afforestation experiment // Plant and Soil. 2002. V. 242. № 2. P. 171–182.
Patel K.F., Bond–Lamberty B., Jian J., Morris K.A., McKever S.A., Norris C.G. et al. Carbon flux estimates are sensitive to data source: a comparison of field and lab temperature sensitivity data // Environ. Res. Lett. 2022. V. 17. № 11. P. 113003.
Phillips C.L., Nickerson N. Soil Respiration, Reference Module in Earth Systems and Environmental Sciences, Elsevier, 2015.
Schädel C., Beem-Miller J., Aziz Rad M., Crow S.E., Hicks Pries C.E., Ernakovich J. et al. Decomposability of soil organic matter over time: The Soil Incubation Database (SIDb, version 1.0) and guidance for incubation procedures // Earth System Science Data. 2020. V. 12. № 3. P. 1511–1524.
Shahzad T., Rashid M.I., Maire V., Barot S., Perveen N., Alvarez G. et al. Root penetration in deep soil layers stimulates mineralization of millennia-old organic carbon // Soil Biol. Biochem. 2018. V. 124. P. 150–160.
Sokol N.W., Kuebbing S.E., Karlsen-AyalaE., Bradford M.A. Evidence for the primacy of living root inputs, not root or shoot litter, in forming soil organic carbon // New Phytologist. 2019. V. 221. № 1. P. 233–246.
Uselman S.M., Qualls R.G., Thomas R.B. Effects of increased atmospheric CO2, temperature, and soil N availability on root exudation of dissolved organic carbon by a N-fixing tree (Robinia pseudoacacia L) // Plant and soil. 2000. V. 222. № 1. P. 191–202.
Yang Y., Li T., Pokharel P., Liu L., Qiao J., Wan Y. et al. Global effects on soil respiration and its temperature sensitivity depend on nitrogen addition rate // Soil Biol. Biochem. 2022. V. 174. P. 108814.
Zak D.R., Pregitzer K.S., King J.S., Holmes W.E. Elevated atmospheric CO2, fine roots and the response of soil microorganisms: a review and hypothesis // The New Phytologist. 2000. V. 147. № 1. P. 201–222.
Zhao G., Zhang Y., Cong N., Zheng Z., Zhao B., Zhu J. et al. Climate warming weakens the negative effect of nitrogen addition on the microbial contribution to soil carbon pool in an alpine meadow // Catena. 2022. V. 217. P. 106513.
Zhou L., Zhou X., Zhang B., Lu M., Luo Y., Liu L., Li B. Different responses of soil respiration and its components to nitrogen addition among biomes: a meta-analysis // Global change biology. 2014. V. 20. № 7. P. 2332–2343.
Дополнительные материалы отсутствуют.


