Почвоведение, 2023, № 5, стр. 613-625
Влияние глифосата на биологическую активность и фитотоксичность дерново-подзолистой почвы в условиях краткосрочного модельного эксперимента
Н. В. Костина a, *, М. В. Горленко a, К. А. Мазуров a, О. И. Филиппова a, И. В. Плющенко a, И. А. Родин a, Н. А. Куликова a, b
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт биохимии РАН им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Ленинский пр-т, 33, Россия
* E-mail: nvkostina@mail.ru
Поступила в редакцию 16.10.2022
После доработки 30.12.2022
Принята к публикации 30.12.2022
- EDN: IEVLQD
- DOI: 10.31857/S0032180X22601293
Аннотация
В модельном лабораторном эксперименте с пахотным горизонтом дерново-подзолистой почвы (Albic Retisol (Loamic)), имеющим низкое содержание органического вещества и низкую биологическую активность, установлено, что внесение глифосата приводит к кратковременному изменению интенсивности основных процессов микробной трансформации азота в почве. При инкубировании почвы с глифосатом в максимальной рекомендуемой дозе 8 л/га в течение 22 сут наблюдается рост азотфиксирующей и денитрифицирующей активности на 30–80 и 300% и снижение процесса нитрификации на 20–40%. Эффекты носят кратковременный характер и не отражают всего комплекса протекающих микробиологических процессов: на эмиссию CO2, являющегося интегральным показателем биологической активности, влияния глифосата не обнаружено. В конце инкубирования в почве с внесенным глифосатом отмечен рост численности бактерий на 40% и снижение численности микромицетов на 70%. В целом в выбранных условиях внесение глифосата привело к выраженному снижению биологической активности почвы по сравнению с контролем. Изучение функционального биоразнообразия почвенных микробных сообществ методом мультисубстратного тестирования показало, что под действием гербицида происходит снижение устойчивости почвенного микробного сообщества, выражающееся в увеличении значения коэффициента рангового распределения спектров потребления субстратов d, сопровождающееся уменьшением удельной метаболической работы W и интегрального индекса витальности G. Впервые показано, что при внесении глифосата в почву с низкой биологической активностью и обеспеченностью доступным фосфором наблюдается выраженное отрицательное действие препарата на почвенные микроорганизмы, что приводит к угнетению роста растений пшеницы.
ВВЕДЕНИЕ
В настоящее время гербицид глифосат (N-(фосфонометил)-глицин) широко применяется во всем мире. В России доля посевных площадей, обрабатываемых препаратами на основе глифосата, варьирует в диапазоне от 10 до 30%. Согласно заключению экспертов, в нашей стране на сегодняшний день нет каких-либо предпосылок снижения объемов потребления глифосата, как законодательных, так и рыночных. В краткосрочной перспективе возможен даже рост его использования вследствие ввода новых площадей в сельскохозяйственный оборот [10]. Общепринятым является мнение, что в почве глифосат быстро инактивируется из-за связывания с глинистыми частицами, а также железом и алюминием в составе оксидов и гидроксидов [14]. Кроме того, микроорганизмы могут его использовать в качестве источника азота (биодеградация с разрывом связи C–N) или фосфора (биодеградация с разрывом связи C–P) [42]. Тем не менее, недавние исследования показывают, что существует опасность отрицательного последействия глифосата на рост сельскохозяйственных культур [21, 23, 42].
Среди причин последействия глифосата в большинстве случаев рассматривают накопление в почвах остаточных количеств гербицида или его наиболее часто встречающегося метаболита – аминометилфосфоновой кислоты (АМФК). АМФК, образующаяся при деградации глифосата с разрывом связи C–N, представляет собой структурный аналог антибиотиков группы производных фосфоновой кислоты, ингибирует развитие бактерий путем нарушения синтеза клеточной стенки [13] и обладает фитотоксичностью [22]. Преимущественная деградация глифосата с образованием АМФК широко распространена в пахотных почвах, что связано с присутствием в них легкодоступных источников фосфора, вносимых с удобрениями, в то время как микробиологическое разрушение связи C–P наблюдается только в условиях низкой концентрации доступных фосфатов [19]. Оценка содержания глифосата и АМФК в пахотном горизонте почв Европейского союза показала, что почти в 50% случаев в почвах обнаруживается гербицид или его метаболит. Из 317 исследованных образцов 21% содержали глифосат, а 42% – АМФК. Максимальное содержание глифосата и АМФК достигало 2.05 мг/кг почвы и 1.92 мг/кг соответственно [39]. Оба соединения могут оказывать негативное действие на рост и развитие сельскохозяйственных культур [21, 22, 24] и высвобождаться из комплексов с почвенными минералами при внесении фосфорных удобрений [32].
В полевых экспериментах установлено, что при посеве фасоли, овса и рапса в почву через 14 сут после внесения глифосата в дозе 3 кг/га, соответствующей максимальной рекомендуемой, наблюдается задержка прорастания семян этих культур [23]. В работе [21] показано, что остаточные количества глифосата (доза внесения составила 3 кг/га, посев проводили через 24 сут после внесения гербицида) снижают в растениях овса уровень фитогормонов, биосинтез которых вовлекает использование хоризмата в качестве предшественника (индол-3-уксусная кислота, фенилуксусная кислота). Наблюдаемый эффект объясняется механизмом действия глифосата – ингибированием 5-энолпирувил-шикимат-3-фосфат синтазы (ЕПШФ синтаза, EC 2.5.1.19), являющейся компонентом ферментной системы шикиматного пути биосинтеза ароматических аминокислот и осуществляющего превращение шикимата в хоризмат – предшественник фенилаланина, тирозина и триптофана. Фитотоксичность АМФК также была неоднократно показана: установлено, что она ингибирует биосинтез хлорофилла и нарушает проводимость устьиц [22]. Таким образом, и глифосат в остаточных количествах, и АМФК токсичны для растений.
С другой стороны, многочисленными исследованиями показано, что внесение глифосата в почву может приводить к нарушениям функционирования почвенных микробных сообществ, таким как снижение численности ризосферных бактерий и грибов [34]. Это связано в первую очередь с присутствием у некоторых микроорганизмов ЕПШФ синтаз, чувствительных к действию глифосата. В частности, наличие ЕПШФ синтазы, чувствительной к ингибированию глифосатом шикиматного пути биосинтеза ароматических аминокислот, экспериментально показано для почвенных бактерий Bradyrhizobium japonicum [43] и некоторых видов бактерий рода Pseudomonas [12]. Согласно проведенным биоинформатическим оценкам, 82% видов архей и 57% видов бактерий имеют чувствительные к глифосату ЕПШФ синтазы, т.е. большинство прокариот может угнетаться глифосатом [30]. Изменения в составе микробного сообщества впоследствии оказывают влияние на экологические функции микроорганизмов в почве, включая круговорот биофильных элементов, образование почвенных агрегатов и биодеградацию органических соединений. Следовательно, воздействие на микроорганизмы отражается на плодородии почвы и урожайности сельскохозяйственных культур [24]. Особенно актуальным это является для почв с низким содержанием биофильных элементов и органического вещества, характеризующихся низким уровнем биологической активности.
Цель работы – оценить влияние глифосата на активность почвенных микроорганизмов и фитотоксичность почвы в условиях пахотной почвы с низким содержанием питательных элементов и органического вещества, в том числе доступных фосфатов. Согласно существующим данным, наиболее чувствительными к токсическому действию глифосата являются микроорганизмы, участвующие в процессах превращения азота [26]. Поэтому в рамках исследования была проведена оценка влияния глифосата на азотфиксирующую, нитрифицирующую и денитрифицирующую активность почвы. Для получения интегральных оценок воздействия глифосата на почвенные микроорганизмы использовали определение эмиссии углекислого газа и общей численности микроорганизмов, а для определения функционального биоразнообразия и устойчивости почвенных микробных сообществ – метод мультисубстратного тестирования (МСТ). Оценку фитотоксичности проводили методом биотестирования с использованием в качестве тест-культуры растений пшеницы. Для определения пути преимущественной биодеградации гербицида в почве определяли содержание глифосата и АМФК.
ОБЪЕКТЫ И МЕТОДЫ
Образцы дерново-подзолистой почвы (соответствует Albic Retisol по WRB) отбирали в Ногинском районе Московской области (55°48.173′ N, 38°14.908′ E) из пахотного горизонта почвы с глубины 0–20 см. Из пяти индивидуальных образцов, отобранных методом конверта на площадке площадью около 1 м2, составляли объединенную пробу, из которой получали средний образец [1]. Актуальную кислотность и содержание подвижных форм калия и фосфора методом Кирсанова в модификации ЦИНАО определяли согласно [1], содержание C и N – каталитическим сжиганием при 960°С в токе кислорода [25] на элементном анализаторе Vario Macro Cube (Elementar Analysensysteme GmbH, Германия); содержание подвижных форм азота – согласно [27]. Общая характеристика почвы: ${\text{p}}{{{\text{Н}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ 5.3; содержание органического углерода C 1.83%; общее содержание азота N 0.12%; содержание обменного калия K2O 46 мг/кг почвы; содержание подвижного фосфора P2O5 175 мг/кг; содержание нитратов и аммония 2.9 и 40.6 мг/кг соответственно. Почву можно охарактеризовать как слабокислую, с низкой обеспеченностью подвижными фосфатами и обменным калием, очень низкой обеспеченностью нитратами и средней – суммарным количеством нитратов и аммония.
Влияние глифосата на микробиологические процессы оценивали с помощью модельного лабораторного эксперимента. Для этого почву высушивали и просеивали через сито 2 мм, предварительно удалив остатки корней. Далее навески почвы (100.00 ± 0.02) г помещали в пластиковые вегетационные сосуды объемом 100 см3. Глифосат (Раундап ВР 360 г/л, АО “Август”, РФ) вносили в виде водного раствора до влажности почвы, соответствующей 70% наименьшей влагоемкости (НВ). Начальное содержание гербицида в почве было 9.6 мг/кг, что соответствует дозе внесения 8 л/га (2.88 кг/га по действующему веществу). Выбор концентрации глифосата был основан на максимальной рекомендуемой дозе внесения 8 л/га и предположения, что весь гербицид удерживается в верхнем слое почвы 2–5 см [15]. В контрольные сосуды с почвой вносили такой же объем дистиллированной воды. Для инкубирования сосуды помещали в термостат при температуре (24 ± 2)°С. Поддержание 70% НВ проводили путем периодического взвешивания сосудов и внесения необходимого количества воды. Повторность трехкратная. Через 1, 8, 15 и 22 сут часть сосудов извлекали для определения содержания глифосата и его основного метаболита – АМФК. Влияние на микробное сообщество оценивали на 1, 8, 15 и 22 сут эксперимента на основании определения азотфиксирующей, нитрифицирующей и денитрифицирующей активности, эмиссии углекислого газа, общей численности микроорганизмов и функционального разнообразия микроорганизмов методом МСТ. Кроме того, оценивали фитотоксичность почвы по отношению к растениям пшеницы.
Определение азотфиксирующей активности проводили ацетиленовым методом согласно [7], основанном на способности нитрогеназы азотфиксирующих микроорганизмов восстанавливать ацетилен С2Н2 до этилена С2Н4. Для определения актуальной азотфиксации навески почвы 5 г помещали в пенициллиновые флаконы объемом 10 мл, флаконы укупоривали резиновой пробкой, вводили 1 мл ацетилена и инкубировали в термостате при постоянной температуре 28°С в течение 1 сут. После этого производили измерения образовавшегося этилена. Для определения потенциальной азотфиксации, навески почвы 5 г помещали в пенициллиновые флаконы объемом 10 мл и вносили раствор глюкозы в расчете 1% глюкозы от массы воздушно-сухой почвы. Далее почву перемешивали стеклянной палочкой для равномерного распределения глюкозы, флаконы закрывали ватной пробкой и помещали в термостат при температуре 28°С на 1 сут. Затем флаконы укупоривали резиновой пробкой, вводили 1 мл ацетилена и инкубировали в термостате при 28°С в течение 1 ч. Определение образовавшегося этилена проводили на хроматографе Кристалл-2000 (Хроматэк, РФ), оборудованном колонкой Porapak N 80/100 (1 м × 3 мм) и пламенно-ионизационным детектором (ПИД). Условия определения: температура колонки 60°С, температура детектора 160°С, температура испарителя 100°С, расход газа-носителя (N2) 50 мл/мин, воздуха 280 мл/мин, водорода 28 мл/мин. Определение проводили в трехкратной повторности.
Определение нитрифицирующей активности по Кравкову проводили согласно [27]. Навески почвы 5 г инкубировали (влажность 60% НВ, 28°С) в течение 8 сут, после чего проводили определение свободных ${\text{NO}}_{3}^{ - }$-ионов согласно [9]. В пробирку, содержащую 5 г почвы после инкубирования, приливали 12.5 мл 0.25 М раствора Mg(CH3COO)2, взбалтывали перемешиванием со скоростью 25 об./мин в течение 1 ч на встряхивателе Intelli-Mixer (ELMI, Латвия), центрифугировали при 2000 об./мин (760g) в течение 15 мин в центрифуге CM-6M (ELMI, Латвия). В центрифугате при помощи ион-селективного электрода Эком-NO3 и иономера Экотест-120 (НПП “Эконикс”, РФ) измеряли содержание азота в нитратной форме. В случае определения потенциальной нитрифицирующей способности перед началом инкубирования в почву вносили (NH4)2SO4 (0.2 г/кг). Повторность трехкратная.
Определение денитрифицирующей активности проводили по методу Федоровой, основанному на способности ацетилена ингибировать редуктазу закиси азота N2О, что позволяет оценивать активность процесса денитрификации по накоплению N2О в газовой фазе [7]. Для определения актуальной денитрификации навеску почвы 5 г помещали в пенициллиновые флаконы объемом 10 мл, герметично закрывали резиновыми пробками и в течение 1 мин продували аргоном. Далее вводили 1 мл ацетилена и инкубировали при температуре 28°С в течение 5 сут. Измерение концентрации N2О проводили на газовом хроматографе Кристалл-2000 (Хроматэк, РФ), оборудованном колонкой Porapak N 80/100 (1 м × 3 мм) и детектором электронного захвата (ДЭЗ). Условия определения: расход газа-носителя (азот) 90 мл/мин, температура детектора 240°С, температура колонки 50°С, испарителя 100°С. Определение потенциальной денитрификации проводили аналогично, но с внесением в почву перед началом инкубирования глюкозы (2.5 мг/г) и нитрата калия KNO3 (0.3 мг/г) и сокращением времени инкубирования до 1 сут. Повторность трехкратная.
Определение эмиссии углекислого газа проводили согласно [7]. Для определения актуальной эмиссии CO2 навеску почвы 2 г помещали в пенициллиновые флаконы, герметично закрывали резиновыми пробками и проводили инкубирование в течение 1 сут при температуре 28°С. Далее определяли содержание CO2 на газовом хроматографе 3700 (ОАО “Хроматограф”, РФ) с колонкой Полисорб-1 (3 м × 3 мм) и детектором по теплопроводности. Условия определения: температура испарителя 30°С, температура катарометра 100°С, измерительных элементов 150°С, сила тока 148 мА, расход газа-носителя (гелия) 30 мл/мин. Для оценки потенциальной эмиссии CO2 перед началом инкубирования в почву вносили глюкозу из расчета 2.5 мг/г. Повторность трехкратная.
Определение общей численности микроорганизмов проводили методом люминесцентной микроскопии в падающем свете с окрашиванием акридином оранжевым [5]. Водно-почвенные суспензии (1 : 10) обрабатывали на ультразвуковом диспергаторе Sonopuls (Bandelin, ФРГ) (22 кГц, 0.44 А, 2 мин). Далее микропипеткой наносили по 0.01 мл суспензии на обезжиренные предметные стекла и равномерно распределяли ее петлей на площади 4 см2. После полного высыхания капли препарат фиксировали легким нагреванием на пламени горелки. Препараты для учета микроорганизмов окрашивали раствором акридина оранжевого (1 : 10 000) в течение 2–3 мин. Прямое микроскопирование препаратов проводили на микроскопе Axioskop 2+ (Carl Zeiss, Швейцария). На каждом мазке просматривали по 50–100 полей зрения. На основании полученных данных оценивали общую численность бактерий и длину мицелия грибов. Повторность трехкратная.
Определение функционального разнообразия микроорганизмов методом МСТ проводили в соответствии с МВИ № 13-06 “Методика выполнения измерений интенсивности потребления тест-субстратов микробным сообществом почв и почвоподобных объектов фотометрическим методом” [4], основанном на анализе потребления изучаемым микробным сообществом 47 органических моносубстратов различных номинальных групп (сахара, спирты, соли органических кислот, азотсодержащие органические соединения и полимеры). Для экстракции микроорганизмов к 0.7 г смешанной пробы, получаемой путем смешивания 3 индивидуальных проб из каждого образца, добавляли 35 мл дистиллированной воды. Получаемые суспензии встряхивали в течение 1.5 мин при 3000 об./мин на орбитальном шейкере типа Vortex и затем центрифугировали в течение 2 мин при 2.2g. Полученный супернатант с внесенным индикатором роста микроорганизмов (тетразолий фиолетовый, восстанавливающийся при росте микроорганизмов до формазана) вносили в 96-луночный тест-планшет Эко-Лог, содержащий набор тест-субстратов. Заполненный планшет инкубировали в течение 3 сут при 28°С. После этого оценивали интенсивность потребления субстратов, определяя концентрацию формазана по поглощению при длине волны 510 нм на многоканальном фотометре Униплан (ЗАО “Пикон”, РФ). На основании данных по оптической плотности в ячейках с различными моносубстратами рассчитывали среднюю интенсивность потребления субстратов различных номинальных групп. Кроме того, данные обрабатывали с помощью оригинального программного обеспечения ЭКОЛОГ, получая трехпараметрическую модель рангового распределения потребления субстратов почвенным микробным сообществом [4]. В качестве выходных параметров использовали коэффициент рангового распределения спектров потребления субстратов d, отражающий стабильность сообщества. Кроме того, оценивали индексы биоразнообразия микробного сообщества, такие как количество потребленных субстратов N; удельная метаболическая работа сообщества W, соответствующая средней интенсивности потребления субстратов и интегральный индекс витальности G.
Содержание глифосата и АМФК определяли методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием на жидкостном хроматографе Ultimate 3000 (Dionex, США) с диодно-матричным детектором и гибридного тандемного тройного квадрупольного масс-спектрометра Qtrap 3200 (ABSciex, Канада), оснащенного источником ионизации электрораспылением. Водную экстракцию гербицида и его основного метаболита осуществляли согласно [20], хроматографическое разделение и масс-спектрометрическое определение – согласно [17].
Фитотоксичность почвы оценивали с помощью лабораторно-вегетационного эксперимента. В сосуды с почвой помещали предварительно откалиброванные, стерилизованные и замоченные (24 ч, 24°С) семена пшеницы мягкой Triticum aestivum L. сорта Л-1, отбирая для посадки только наклюнувшиеся семена. Для поверхностной стерилизации семена заливали на 30 мин 8%-ным раствором H2O2, потом семена промывали 5–6 раз стерильной дистиллированной водой [33]. Посадку производили на глубину ~ 1 см, по 5 семян на 1 сосуд. Для выращивания сосуды с семенами помещали в вегетационную камеру на 21 сут (фотопериод 12 ч, 24°С). Полив проводили по мере необходимости. В конце опыта учитывали длину побегов и воздушно-сухой надземной биомассы. Повторность трехкратная.
Статистическая обработка результатов состояла в расчете среднего и стандартного отклонения. Сравнение средних для вариантов без внесения гербицида (контроль) и с внесением глифосата (глифосат) в каждый день пробоотбора проводили на основании однофакторного дисперсионного анализа при выбранном уровне доверительной вероятности 95%.
РЕЗУЛЬТАТЫ
Оценка содержания глифосата в почве (табл. 1) показала, что уже через сутки после внесения содержание гербицида снизилось от 9.6 мг/кг до 60 мкг/кг, а его наиболее часто встречающийся метаболит – АМФК – не обнаруживается. Полученные результаты совпадают с данными предыдущих исследователей, также отмечавших быстрое исчезновение глифосата в почве после внесения вследствие его связывания по механизму лигандного обмена с почвенными оксидами и глинистыми минералами [14, 38]. Отсутствие АМФК в исследованных образцах может быть обусловлено связыванием этого метаболита с оксидами алюминия/железа или органическим веществом почвы, либо свидетельствовать о преимущественном разложении гербицида с расщеплением связи С–Р (саркозиновый путь), что обычно наблюдается в почвах с низким содержанием подвижного фосфора [6]. Это согласуется с низкой обеспеченностью использованной почвы подвижными фосфатами (175 мг/кг). При деградации по саркозиновому пути на первом этапе происходит образование саркозина (N-метилглицин) и неорганического фосфата ${\text{PO}}_{4}^{{3 - }}.$ Считается, что образующиеся метаболиты не токсичны и быстро утилизируются почвенными микроорганизмами: фосфаты используются как источник фосфора, а саркозин окисляется до глицина, разлагающегося до NH3 и CO2, и формальдегида, идущего на образование комплекса с тетрагидрофолатом – коферментом метаболизма аминокислот и нуклеиновых кислот [14].
Таблица 1.
Динамика содержания глифосата в дерново-подзолистой почве в условиях модельного лабораторного эксперимента. Среднее ± стандартное отклонение (n = 3)
| Время после внесения глифосата, сут | Концентрация глифосата, мкг/кг |
|---|---|
| 1 | 60 ± 9.0 |
| 8 | 44 ± 6.6 |
| 15 | 32 ± 4.8 |
| 22 | 36 ± 5.4 |
Наблюдаемое последующее дальнейшее снижение концентрации глифосата хорошо согласуется с ранее высказанными предположениями о возможности его утилизации различными группами почвенных микроорганизмов [29, 31]. В ряде работ показано, что глифосат используется в качестве субстрата, в частности, α-протеобактериями [18] и γ-протеобактериями [34], следствием чего является увеличение их содержания в почве.
Результаты, отражающие влияние глифосата на интенсивность протекания азотфиксации, нитрификации и денитрификации, представлены в табл. 2. Видно, что показатели всех исследованных процессов трансформации азота были чрезвычайно невысокими. Это свидетельствует о низкой биологической активности использованной почвы, обусловленной, по-видимому, низким содержанием в ней органического вещества и основных биофильных элементов. В пользу этого говорит обнаруженное выраженное превышение потенциальной активности над актуальной. Для азотфиксации наблюдаемое превышение составило 8 раз и более, а для денитрификации – 26 раз и более. Исключением была нитрифицирующая активность, где обнаруженное максимальное превышение потенциальной активности над актуальной было 1.3. Скорее всего, наблюдаемые различия связаны с тем, что для инициации нитрификации вносили соль аммония, тогда как в случае азотфиксации и денитрификации с этой целью использовали глюкозу. Это указывает на то, что низкая биологическая активность почвы в данном случае была обусловлена, главным образом, низким содержанием легкодоступных источников углерода.
Таблица 2.
Влияние глифосата на основные процессы микробиологической трансформации азота в дерново-подзолистой почве в условиях модельного лабораторного эксперимента
| Инкубирование, сут | Активность | |||
|---|---|---|---|---|
| актуальная | потенциальная | |||
| контроль | глифосат | контроль | глифосат | |
| Азотфиксация, нг С2Н4/(г ч) | ||||
| 1 | 0.034 ± 0.005 | 0.047 ± 0.011* | 0.40 ± 0.03 | 0.43 ± 0.04 |
| 8 | 0.023 ± 0.007 | 0.041 ± 0.001* | 0.86 ± 0.03 | 0.79 ± 0.08 |
| 15 | 0.091 ± 0.038 | 0.070 ± 0.003 | 0.96 ± 0.06 | 0.90 ± 0.07 |
| 22 | 0.054 ± 0.002 | 0.052 ± 0.006 | 0.45 ± 0.31 | 0.60 ± 0.31 |
| Нитрификация, мкг N–${\text{NO}}_{3}^{ - }$/(г ч) | ||||
| 1 | 0.006 ± 0.001 | 0.005 ± 0.001 | 0.005 ± 0.001 | 0.004 ± 0.001 |
| 8 | 0.120 ± 0.022 | 0.070 ± 0.033* | 0.130 ± 0.023 | 0.076 ± 0.031* |
| 15 | 0.206 ± 0.010 | 0.204 ± 0.018 | 0.251 ± 0.014 | 0.210 ± 0.018* |
| 22 | 0.181 ± 0.013 | 0.182 ± 0.006 | 0.241 ± 0.025 | 0.218 ± 0.016 |
| Денитрификация, мкг N2O/(г ч) | ||||
| 1 | 0.006 ± 0.003 | 0.006 ± 0.005 | 3.8 ± 0.3 | 3.8 ± 0.2 |
| 8 | 0.077 ± 0.051 | 0.100 ± 0.022 | 2.8 ± 0.2 | 2.7 ± 0.1 |
| 15 | 0.105 ± 0.055 | 0.107 ± 0.066 | 2.7 ± 0.3 | 2.5 ± 0.3 |
| 22 | 0.021 ± 0.026 | 0.064 ± 0.039* | 2.0 ± 0.2 | 2.1 ± 0.2 |
Через сутки после внесения глифосата был отмечен рост актуальной азотфиксации в 1.4 раза, а через 8 сут – в 1.8 раз по сравнению с контролем. Возможность положительного влияния глифосата на рост азотфиксирующих бактерий при внесении доз, соответствующих рекомендуемым, была ранее продемонстрирована на примере 24-часового выращивания Azotobacter sp. на среде Лоури–Бертрана в присутствии гербицида [11]. В остальные сроки пробоотбора значимого влияния глифосата ни на актуальную, ни на потенциальную азотфиксирующую активность почвы не отмечено. При этом динамика азотфиксирующей активности в контрольной почве и почве с гербицидом имела сходный вид: рост в первые сутки инкубирования, сменяющийся снижением активности. Отсутствие влияния глифосата на активность азотфиксации при длительной экспозиции ранее показано в сходном эксперименте на дерново-подзолистой почве при дозах внесения 0.5–50.0 мг/кг и 45-суточном экспонировании [2]. Таким образом, полученные результаты свидетельствуют, что влияние глифосата на азотфиксирующие микроорганизмы проявляется в виде интенсификации этого процесса в первые дни после внесения. Скорее всего, это связано с быстрой утилизацией в почве образующегося аммония при деградации глифосата по саркозиновому пути, что не привело к возможному ингибированию нитрогеназной активности вследствие избытка ионов аммония в почве. Известно, что при внесении глифосата в дозах, значительно превышающих рекомендуемые, рост азотфиксирующих бактерий угнетается [11].
В отличие от азотфиксации, влияние гербицида на нитрифицирующую активность проявлялось позднее. На 8 сут почва с глифосатом имела более низкую нитрифицирующую активность, как актуальную, так и потенциальную, составляя только 59% от контрольных значений. Для потенциальной нитрификации статистически значимое ингибирование (до 84% от контроля) сохранялось и на 15 сут. Негативное влияние глифосата на нитрификацию в почвах сельскохозяйственного использования ранее было продемонстрировано в некоторых работах [16, 45], хотя часто исследователи также отмечают стимулирующее действие гербицида [37] или отсутствие эффекта [40]. Видимо, определяющими факторами в направлении действия глифосата на нитрифицирующую активность являются особенности микробного сообщества почвы, а также история применения на ней глифосата и удобрений [36]. Известно, что в почвах, постоянно загрязняемых глифосатом, происходит развитие микробиома, устойчивого к токсическому действию гербицида. Показано, что обработка глифосатом может приводить к отбору микробных сообществ, способных эффективно метаболизировать аминовые субстраты, что объясняет стимулирующее действие гербицида [37]. Для использованной почвы, напротив, установлено, что внесение глифосата приводит к снижению активности использования азотсодержащих органических соединений (рис. 1), что может косвенно указывать на угнетение гетеротрофных нитрификаторов, преобладание которых обычно наблюдается в кислых почвах [8]. Согласно данным [45], внесение глифосата в кислую почву (${\text{р}}{{{\text{Н}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ 5.0) приводило к снижению в ней количества копий генов amoA, отражающих обилие аммонийокисляющих архей и бактерий, участвующих в процессе окисления аммиака – лимитирующей стадии нитрификации. Таким образом, для более полной оценки влияния глифосата на нитрифицирующую способность почвы необходимо отдельно изучать процесса автотрофной и гетеротрофной нитрификации, а также воздействие на отдельные стадии нитрификации.
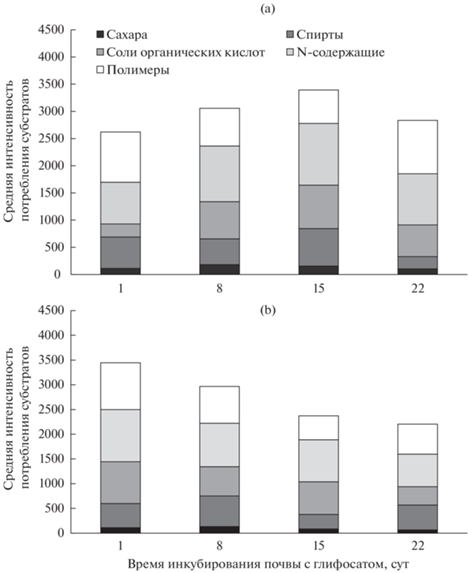
Рис. 1.
Средняя интенсивность потребления субстратов различных номинальных групп по данным МСТ при отсутствии (a) и в присутствии глифосата (b).
Наиболее отдаленным эффект глифосата был на денитрификацию: актуальная денитрификация в присутствии глифосата была значимо выше (в 3 раза), чем в контрольном варианте только через 22 сут после внесения гербицида. Схожие эффекты стимулирования денитрификации часто отмечаются исследователями [40, 41]. Видимо, наблюдаемый эффект усиления денитрификации объясняется угнетением нитрификации, отмеченным на 8 и 15 сут после внесения глифосата и, как следствие, повышением в почве содержания доступных для восстановления нитратов. Несмотря на то, что потенциально усиление процесса денитрификации можно оценить как отрицательное действие глифосата на окружающую среду, так как N2O является парниковым газом, можно ожидать, что этот эффект краткосрочный, потому что уже через 21 сут после внесения гербицида ингибирования нитрификации не отмечали. Высказанное предположение подтверждается сообщениями о том, что внесение глифосата не приводит к значимым изменениям эмиссии N2O почвами или снижает ее [28].
В целом можно сказать, что ингибирующее действие глифосата на процессы трансформации азота в почве при внесении в рекомендуемых дозах было отмечено только для нитрификации, в то время как для процессов азотфиксации и денитрификации наблюдали стимуляцию под действием гербицида. При этом наблюдаемые эффекты имели краткосрочный характер, что может быть обусловлено быстрой минерализацией глифосата по саркозиновому пути, не сопровождающейся образованием токсичных метаболитов, таких как АМФК. Отсутствие выраженной однонаправленной тенденции влияния глифосата на процессы микробной трансформации азота, по-видимому, обусловлено разнообразием возможных физиологических и экологических ответов почвенных микроорганизмов на применение гербицида, что ранее было показано рядом исследователей [2, 3, 31].
Анализ потребления изучаемым микробным сообществом органических моносубстратов различных номинальных групп методом МСТ также выявил разнонаправленность ответов на внесение глифосата (табл. 3). Динамика потребления сахаров была сходной в контрольной почве и почве с внесенным глифосатом: к 8 сут инкубирования происходил рост этого показателя, а затем – снижение. Видимо, обнаруженная тенденция в данном случае отражает обычно наблюдаемую динамику развития микробных сообществ в лабораторных условиях: первоначальный рост при “оживлении почвы”, сменяющийся снижением численности микроорганизмов при истощении в почве доступных субстратов. Динамика потребления полимеров, хотя и отличалась от динамики потребления сахаров, но имела сходный характер для изучаемых вариантов. После первоначального плавного снижения интенсивности их потребления, начиная с 15 сут инкубирования наблюдали интенсификацию этого процесса.
Таблица 3.
Влияние глифосата на функциональное разнообразие микроорганизмов дерново-подзолистой почвы в условиях модельного лабораторного эксперимента
| Инкубирование, сут | Контроль | Глифосат | ||||||
|---|---|---|---|---|---|---|---|---|
| d | N | W | G | d | N | W | G | |
| 1 | 1.33 | 21 | 1206 | 0.34 | 0.72 | 25 | 1529 | 0.74 |
| 8 | 1.45 | 28 | 1326 | 0.41 | 1.00 | 28 | 1212 | 0.60 |
| 15 | 1.49 | 34 | 1273 | 0.49 | 1.51 | 28 | 1051 | 0.40 |
| 22 | 1.17 | 24 | 1276 | 0.44 | 2.13 | 35 | 726 | 0.35 |
В случае азотсодержащих органических соединений, напротив, внесение глифосата привело к принципиальному изменению динамики потребления этих субстратов. Если в контрольном варианте, аналогично потреблению сахаров, наблюдали рост этого показателя во времени с последующим снижением, то в присутствии гербицида – постоянное уменьшение. Обнаруженная динамика средней интенсивности потребления азотсодержащих субстратов совпадает с динамикой численности грибов в присутствии глифосата (табл. 4) и, возможно, свидетельствует об их значительной роли в процессе нитрификации в исследуемой почве. Известно, что органический азот является наиболее предпочтительным субстратом для нитрификации микромицетами, выделяемыми из дерново-подзолистых почв [8].
Таблица 4.
Влияние глифосата на общую численность микроорганизмов в дерново-подзолистой почве в условиях модельного лабораторного эксперимента
| Инкубирование, сут | Бактерии, млрд кл/г | Грибы, м/г | ||
|---|---|---|---|---|
| контроль | глифосат | контроль | глифосат | |
| 1 | 3.2 ± 0.2 | 2.8 ± 0.1* | 103 ± 15 | 97 ± 12 |
| 8 | 1.6 ± 0.2 | 1.4 ± 0.1* | 243 ± 15 | 63 ± 15* |
| 15 | 1.5 ± 0.1 | 1.3 ± 0.1* | 150 ± 28 | 55 ± 7* |
| 22 | 1.0 ± 0.1 | 1.4 ± 0.1* | 150 ± 14 | 45 ± 7* |
В целом микроорганизмы исследуемой почвы характеризовались неравномерностью потребления субстратов различных номинальных групп. Наименьшая средняя интенсивность потребления была обнаружена для сахаров и, в некоторые дни инкубирования, для спиртов (рис. 1a). С другой стороны, для микроорганизмов исследованной почвы наблюдали высокую активность среднего потребления азотсодержащих органических соединений и полимеров. Количество потребляемых субстратов N в почве контрольного варианта не превышало 34 из 47, что свидетельствует о неустойчивости сообщества и нашло отражение в рассчитанном высоком значении коэффициента d, характеризующего крутизну хвоста рангового распределения, и низкого – интегрального индекса витальности G. В процессе инкубирования наблюдали первоначальный рост удельной метаболической работы сообщества W, сменяющийся ее снижением, что совпадает с динамикой нитрификации и денитрификации в исследованной почве и соответствует обнаруженному преобладанию потребления азотсодержащих органических соединений.
Внесение глифосата привело к некоторому уменьшению коэффициента d в первую неделю инкубирования, однако в дальнейшем был отмечен резкий рост этого показателя до 2.13 при снижении удельной метаболической работы на 40% по сравнению с контролем. Это указывает на выраженное отрицательное действие глифосата на почвенные микроорганизмы через 21 сут после внесения.
Определение численности микроорганизмов показало, что более чувствительными к действию гербицида оказались почвенные грибы: начиная с 8 сут после внесения глифосата их численность была значимо ниже, чем в контрольном варианте и составляла не более 30–40% от контрольных значений. Численность бактерий, напротив, уменьшалась под действием глифосата только в первые дни после его внесения, а через 21 сут – превышала контрольные значения на 40%. Отмеченная тенденция совпадает с данными других исследователей, отмечавших рост бактерий, таких как протеобактерии, в присутствии глифосата в условиях, когда его разложение происходит преимущественно с разрывом связи C–P [29]. Это объясняется тем, что среди микроорганизмов, способных разлагать глифосат (бактерии, грибы, микромицеты и актиномицеты), ключевая роль принадлежит в большинстве случаев бактериям [44].
Разнонаправленное влияние глифосата на численность почвенных бактерий и грибов привело к тому, что в целом внесение гербицида не влияло на суммарную эмиссию углекислого газа (табл. 5). Полученные данные согласуются с опубликованными результатами метаанализа 36 исследований, продемонстрировавшими отсутствие влияния глифосата на эмиссию CO2 при внесении в рекомендуемых дозах [35].
Таблица 5.
Влияние глифосата на эмиссию углекислого газа дерново-подзолистой почвой в условиях модельного лабораторного эксперимента
| Инкубирование, сут | Эмиссия CO2, мкмоль/(г ч) | |||
|---|---|---|---|---|
| актуальная | потенциальная | |||
| контроль | глифосат | контроль | глифосат | |
| 1 | 4 ± 4 | 5 ± 10 | 24 ± 13 | 25 ± 11 |
| 8 | 3 ± 2 | 3 ± 2 | 25 ± 8 | 20 ± 10 |
| 15 | 2 ± 2 | 3.9 ± 0.9 | 40 ± 8 | 46 ± 18 |
| 22 | 2 ± 2 | 2.2 ± 0.3 | 33.2 ± 0.2 | 40 ± 16 |
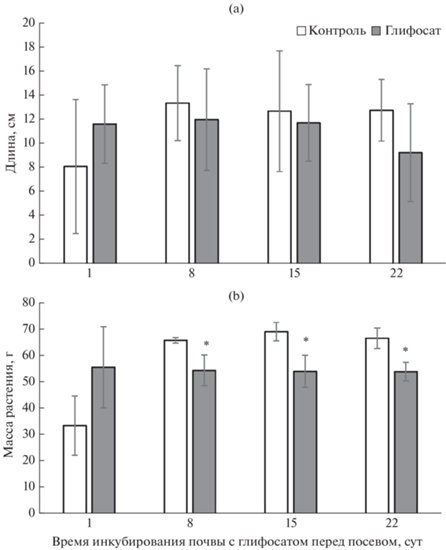
Тем не менее, ухудшение биологических свойств почвы, обнаруживаемое методом МСТ, вызвало угнетение развития растений пшеницы на почве в присутствии глифосата. При выращивании растений на почве, инкубировавшейся с гербицидом в течение 8–22 сут, было отмечено значимое снижение биомассы растений (рис. 2a). Длина растений, полученных на этой почве, составляла 73–92% от контрольных величин, однако это снижение не было статистически значимым (рис. 2b). Следует подчеркнуть, что угнетение растений наблюдали при отсутствии в почве АМФК и при минимальных концентрациях глифосата в почве (32–44 мгк/кг), в то время как при более высоком содержании гербицида (60 мкг/кг), длина и биомасса растений, выращенных на почве с глифосатом, не отличались от контрольных. Это указывает на то, что определяющую роль в данном случае играет именно ухудшение микробиологических свойств почвы.
ЗАКЛЮЧЕНИЕ
Глифосат является одним из наиболее широко применяемых гербицидов. Несмотря на то, что многочисленными исследованиями показано его быстрое исчезновение из почвы вследствие связывания и биодеградации, в ряде работ продемонстрировано его отрицательное последействие на рост сельскохозяйственных культур. Причина этого последействия не всегда очевидна. С одной стороны, существуют данные о высвобождении глифосата из комплексов с почвенными минералами вследствие вытеснения фосфатами, поступающими в почву в виде фосфорных удобрений. С другой стороны, высказываются предположения о возможной фитотоксичности АМФК – первого и наиболее распространенного метаболита глифосата при его биодеградации с разрывом C–N-связи. Впервые показано, что при внесении глифосата в почву с низкой обеспеченностью доступным фосфором и деградации гербицида по саркозиновому пути с разрывом C–P-связи, исключающему образование токсичных метаболитов, наблюдается выраженное отрицательное действие глифосата на почвенные микроорганизмы через 21 сут после внесения гербицида. Это происходит вследствие снижения функционального биоразнообразия почвенного микробного сообщества, и выражается как в увеличении значения коэффициента рангового распределения d, так и в уменьшении удельной метаболической работы W микробного сообщества и интегрального индекса витальности G. Снижение биологической активности почвы привело к угнетению роста пшеницы на почве с внесенным глифосатом, что указывает на ухудшение микробиологических свойств почвы как на одну из возможных причин последействия гербицида. Оценка влияния глифосата на отдельные процессы биологического превращения азота показала, что в первые 21 сут после внесения гербицида может наблюдаться ингибирование процесса нитрификации (на 20–40%) и стимуляция азотфиксации (на 30–80%) и денитрификации (на 300%). Однако наблюдаемые эффекты носят кратковременный характер и не отражают всего комплекса основных эффектов: на ключевой интегральный показатель биологической активности – эмиссию углекислого газа – влияния глифосата обнаружено не было. В выбранных условиях в конце эксперимента наблюдали рост численности бактерий на 40% и снижение – микромицетов на 70%. Полученные результаты показали необходимость проведения исследований, включающих, наряду с изучением отдельных процессов, протекающих при участии микроорганизмов, комплексную оценку разнообразия микробного сообщества почвы, а также определения основного пути деградации глифосата в конкретных условиях и агрохимических характеристик почвы, отражающих уровень обеспеченности питательными веществами.
Список литературы
Аринушкина Е.В. Руководство по химическому анализу почв. М.: Изд-во Моск. ун-та, 1970. 488 с.
Горленко М.В., Якименко О.С., Голиченков М.В., Костина Н.В. Функциональное биоразнообразие почвенных микробных сообществ при внесении органических субстратов различной природы // Вестник Моск. ун-та. Сер. 17, почвоведение. 2012. № 2. С. 20–27.
Железова А.Д., Манучарова Н.А., Горленко М.В. Структурные и функциональные характеристики прокариотного комплекса дерново-подзолистой почвы под воздействием гербицида глифосата // Вестник Моск. ун-та. Сер. 17, почвоведение. 2018. № 2. С. 48–54.
Методика выполнения измерений интенсивности потребления тест-субстратов микробными сообществами почв и почвоподобных объектов фотометрическим методом: ФР.1.37.2010.08619; ПНД ФТ 16.1.17-10. М., 2010.
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М.: Изд-во Моск. ун-та, 1991. 303 с.
Свиридов А.В., Шушкова Т.В., Ермакова И.Т., Иванова Е.В., Эпиктетов Д.О., Леонтьевский А.А. Микробная деградация гербицида глифосата (обзор) // Прикладная биохимия и микробиология. 2015. № 2. С. 183–190. https://doi.org/10.7868/S0555109915020221
Степанов А.Л., Лысак Л.В. Методы газовой хроматографии в почвенной микробиологии. М.: МАКС Пресс, 2002. 88 с.
Умаров М.М., Кураков А.В., Степанов А.Л. Микробиологическая трансформация азота в почве. М.: ГЕОС, 2007. 138 с.
Филиппова О.И., Куликова Н.А., Бычкова Я.С., Воликов А.Б., Перминова И.В. Замедленное высвобождение азота из гуминовых веществ, модифицированных аминоорганосиланами // Проблемы агрохимии и экологии. 2015. № 1. С. 42–47.
Южанинова Л.А. Глифосат: применение на российском и глобальном рынках // Agroxxi.ru: агропромышленный портал. М., 1995–2022. https://www.agroxxi.ru/gazeta-zaschita-rastenii/zrast/glifosat-primenenie-na-rossiiskom-i-globalnom-rynkah.html (дата обращения: 27.07.2022).
Adero V.O., Raju N.S., Supreeth M. Effect of glyphosate herbicide on nitrogen fixing bacteria – Azotobacter species // J. Environ. Chem. Toxicol. 2020. V. 4. № 2. P. 1–7.
Aristilde L., Reed M.L., Wilkes R.A., Youngster T., Kukurugya M.A., Katz V., Sasaki C.R.S. Glyphosate-induced specific and widespread perturbations in the metabolome of soil Pseudomonas species // Frontiers Environ. Sci. 2017. V. 5. 34. https://doi.org/10.3389/fenvs.2017.00034
Atherton F.R., Hall M.J., Hassall C.H., Lambert R.W., Lloyd W.J., Ringrose P.S., Westmacott D. Antibacterial activity and mechanism of action of phosphonopeptides based on aminomethylphosphonic acid // Antimicrobial Agents and Chemotherapy. 1982. V. 22. P. 571–578.
Borggaard O.K., Gimsing L. Fate of glyphosate in soil and the possibility of leaching to ground and surface waters: a review // Pest Management Sci. 2008. V. 64. P. 441–456. https://doi.org/10.1002/ps.1512
Bott S., Tesfamariam T., Kania A., Eman B., Aslan N., Römheld V., Neumann G. Phytotoxicity of glyphosate soil residues re-mobilised by phosphate fertilization // Plant and Soil. 2011. V. 342. P. 249–263. https://doi.org/10.1007/s11104-010-0689-3
Carlisle S.M., Trevors J.T. Effect of the herbicide glyphosate on nitrification, denitrification, and acetylene reduction in soil // Water, Air Soil Poll. 1986. V. 29. P. 189–203. https://doi.org/10.1007/BF00208408
Chen M.X., Cao Z.Y., Jiang Y., Zhu Z.W. Direct determination of glyphosate and its major metabolite, aminomethylphosphonic acid, in fruits and vegetables by mixed-mode hydrophilic interaction/weak anion-exchange liquid chromatography coupled with electrospray tandem mass spectrometry // J. Chromatography A. 2013. V. 1272. P. 90–99.
Cherni A.E., Trabelsi D., Chebil S., Barhoumi F., Rodríguez-Llorente I.D., Zribi K. Effect of glyphosate on enzymatic activities, Rhizobiaceae and total bacterial communities in an agricultural Tunisian soil // Water, Air Soil Poll. 2015. V. 226. 145. https://doi.org/10.1007/s11270-014-2263-8
Dick R.E., Quinn J.P. Glyphosate-degrading isolates from environmental samples: occurrence and pathways of degradation // Appl. Microbiol Biotechnol. 1995. V. 43. P. 545–550. https://doi.org/10.1007/BF00218464
Druart C., Delhomme O., de Vaufleury A., Ntcho E., Millet M. Optimization of extraction procedure and chromatographic separation of glyphosate, glufosinate and aminomethylphosphonic acid in soil // Analyt. Bioanalyt. Chem. 2011. V. 399. P. 1725–1732. https://doi.org/10.1007/s00216-010-4468-z
Fuchs B., Laihonen M., Muola A., Saikkonen K., Dobrev P.I., Vankova R., Helander M.A. Glyphosate-based herbicide in soil differentially affects hormonal homeostasis and performance of non-target crop plants // Frontiers Plant Sci. 2022. V. 12. P. 787958. https://doi.org/10.3389/fpls.2021.787958
Gomes M.P., Smedbol E., Chalifour A., Hénault-Ethier L., Labrecque M., Lepage L., Lucotte M., Juneau Ph. Alteration of plant physiology by glyphosate and its by-product aminomethylphosphonic acid: an overview // J. Experimental Botany. 2014. V. 65. P. 4691–4703. https://doi.org/10.1093/jxb/eru269
Helander M., Pauna A., Saikkonen K., Saloniemi I. Glyphosate residues in soil affect crop plant germination and growth // Sci. Report. 2019. V. 9. P. 19653. https://doi.org/10.1038/s41598-019-56195-3
Helander M., Saloniemi I., Saikkonen K. Glyphosate in northern ecosystems // Trends Plant Sci. 2012. V. 17. P. 569–574.
ISO 10694:1995 Soil quality – Determination of organic and total carbon after dry combustion (elementary analysis).
Jenkins M.B., Locke M.A., Reddy K.N., McChesney D.S., Steinriede R.W. Impact of glyphosate-resistant corn, glyphosate applications and tillage on soil nutrient ratios, exoenzyme activities and nutrient acquisition ratios // Pest Management Sci. 2017. V. 73. P. 78–86.
Kulikova N.A., Philippova O.I., Bychkova Y.S., Volikov A.B., Perminova I.V. Nitrogen release from natural and aminoorganosilane-modified humic substances // Functions of Natural Organic Matter in Changing Environment. Dordrecht: Springer, 2013. https://doi.org/10.1007/978-94-007-5634-2_84
Kyaw K.M., Toyota K. Suppression of nitrous oxide production by the herbicides glyphosate and propanil in soils supplied with organic matter // Soil Sci. Plant Nutrition. 2007. V. 53. P. 441–447. https://doi.org/10.1111/j.1747-0765.2007.00151.x
Lancaster S.H., Hollister E.B., Senseman S.A., Gentry T.J. Effects of repeated glyphosate applications on soil microbial community composition and the mineralization of glyphosate // Pest Management Sci. 2010. V. 66. P. 59–64. https://doi.org/10.1002/ps.1831
Leino L., Tall T., Helander M., Saloniemi I., Saikkonen K., Ruuskanen S., Puigbò P. Classification of the glyphosate target enzyme (5-enolpyruvylshikimate-3-phosphate synthase) for assessing sensitivity of organisms to the herbicide // J. Hazardous Materials. 2020. 124556. https://doi.org/10.1016/j.jhazmat.2020.124556
Milosevic N., Govedarica M. Effect of herbicides on microbiological properties of soil // Matica Srpska J. Natural Sci. 2002. V. 102. P. 5–21.
Munira S., Farenhorst A., Flaten D., Grant C. Phosphate fertilizer impacts on glyphosate sorption by soil // Chemosphere. 2016. V. 153. P. 471–477. https://doi.org/10.1016/j.chemosphere.2016.03.028
Nardi S., Pizzeghello D., Gessa C., Ferrarese L., Trainotti L., Casadoro G. A low molecular weight humic fraction on nitrate uptake and protein synthesis in maize seedlings // Soil Biol. Biochem. 2000. V. 32. P. 415–419.
Newman M.M., Hoilett N., Lorenz N., Dick R.P., Liles M.R., Ramsier C., Kloepper J.W. Glyphosate effects on soil rhizosphere-associated bacterial communities // Sci. Total Environ. 2016. V. 543. P. 155–160. https://doi.org/10.1016/j.scitotenv.2015.11.008
Nguyen D.B., Rose M.T., Rose T.J., Morris S.G., van Zwieten L. Impact of glyphosate on soil microbial biomass and respiration: a meta-analysis // Soil Biol. Biochem. 2016. V. 92. P. 50–57. https://doi.org/10.1016/j.soilbio.2015.09.014
Nivelle E., Verzeaux J., Chabot A., Roger D., Chesnais Q., Ameline A., Catterou M. Effects of glyphosate application and nitrogen fertilization on the soil and the consequences on aboveground and belowground interactions // Geoderma. 2018. V. 311. P. 45–57. https://doi.org/10.1016/j.geoderma.2017.10.0
Nivelle E., Verzeaux J., Chabot A., Roger D., Spicher F., Lacoux J., Nava-Saucedo J.E., Catterou M., Tétu T. Does nitrogen fertilization history affects short-term microbial responses and chemical properties of soils submitted to different glyphosate concentrations // J. PLoS One. 2017. V. 12. e0178342.
Okada E., Costa J.L., Bedmar F. Glyphosate dissipation in different soils under no-till and conventional tillage // Pedosphere. 2019. V. 29. P. 773–783.
Silva V., Montanarella L., Jones A., Fernández–Ugalde O., Mol H.G.J., Ritsema C.J., Geissen V. Distribution of glyphosate and aminomethylphosphonic acid (AMPA) in agricultural topsoils of the European Union // Sci. Total Environ. 2018. V. 621. P. 1352–1359. https://doi.org/10.1016/j.scitotenv.2017.10.093
Stratton G.W., Stewart K.E. Effects of the herbicide glyphosate on nitrogen cycling in an acid forest soil // Water Air Soil Pollution. 1991. V. 60. P. 231–247. https://doi.org/10.1007/BF00282625
Tenuta M., Beauchamp E.G. Denitrification following herbicide application to a grass sward // Can. J. Soil Sci. 1996. V. 76. P. 15–22.
Van Bruggen A.H.C., He M.M., Shin K., Mai V., Jeong K.C., Finckh M.R., Morris J.G., Jr. Environmental and health effects of the herbicide glyphosate // Sci. Total Environ. 2018. V. 616–617. P. 255–268. https://doi.org/10.1016/j.scitotenv.2017.10.309
Zablotowicz R.M., Reddy K.N. Impact of glyphosate on the Bradyrhizobium japonicum symbiosis with glyphosate-resistant transgenic soybean: a mini review // J. Environ. Quality. 2004. V. 33. P. 825–831.
Zhan H., Feng Y., Fan X., Chen S. Recent advances in glyphosate biodegradation // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 5033–5043. https://doi.org/10.1007/s00253-018-9035-0
Zhang M., Wang W., Tang L., Heenan M., Xu Z. Effects of nitrification inhibitor and herbicides on nitrification, nitrite and nitrate consumptions and nitrous oxide emission in an Australian sugarcane soil // Biol. Fertil. Soils. 2018. V. 54. P. 697–706. https://doi.org/10.1007/s00374-018-1293-6
Дополнительные материалы отсутствуют.