Почвоведение, 2023, № 6, стр. 745-757
Влияние длительной и кратковременных засух на гидролитические ферменты серой почвы
А. В. Якушев a, *, А. И. Журавлева b, И. Н. Кузнецова c
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт физико-химических и биологических проблем почвоведения РАН
142290 Пущино, ул. Институтская, 2, Россия
c ООО “Агро-С”
394049 Воронеж, ул. Шишкова, 2г, Россия
* E-mail: a_yakushev84@mail.ru
Поступила в редакцию 16.10.2022
После доработки 06.02.2023
Принята к публикации 07.02.2023
- EDN: FPMQMO
- DOI: 10.31857/S0032180X2260130X
Аннотация
Трансформация органического вещества в почве во многом определяется гидролитическими ферментами. В условиях климатических изменений особенное значение имеет понимание механизмов микробного отклика для прогнозирования цикла углерода. До сих пор мало изучалось влияние продолжительности и частоты засухи на гидролитические ферменты почвы. Проведен многофакторный полевой манипуляционный эксперимент, моделирующий в присутствии растений и без них: две кратковременные засухи, длительную засуху и оптимальный уровень увлажнения почвы. Определяли максимальную скорость реакции Vmax, константу Михаэлиса Km и каталитическую эффективность Ka пяти групп ферментов, участвующих в цикле углерода (целлобиазы, глюкозидазы, ксиланазы), фосфора (фосфатазы) и азота (хитиназы). У фосфатаз, глюкозидаз и ксиланаз Vmax снижалось при кратковременной засухе. В ходе длительной засухи снижалось значение Vmax фосфатаз, целлобиогидролаз, ксиланаз и возрастало у хитиназ, оставаясь при этом неизменным у глюкозидаз. Как длительная, так и кратковременные засухи приводили к увеличению Km и уменьшению Ka почти для всех ферментов. Кратковременные засухи не являлись ослабленным вариантом длительной засухи, но имели свою специфику – снижение у глюкозидаз Km, которое приводило к увеличению Kа. Длительная засуха отличалась увеличением Vmax хитиназ и пространственной вариативности Vmax фосфатаз и глюкозидаз. Влияние присутствия растений было второстепенным и сказывалось только при коротких засухах. Обратимость действия засухи на Vmax, Km, Ka уменьшалась в ряду: первая кратковременная засуха > вторая кратковременная засуха > длительная засуха – за счет увеличения общей продолжительности стрессового воздействия.
ВВЕДЕНИЕ
В условиях наблюдаемого изменения климата возрастает количество и продолжительность различных экстремальных явлений: пожаров, ветровалов, засух, ливней, наводнений и т.д. Ряд климатических моделей предсказывают увеличение частоты и продолжительности засушливых периодов во многих регионах мира в будущем [11].
Почвенные микроорганизмы продуцируют широкий спектр ферментов, которые могут находиться в разном состоянии [3]. Внеклеточные ферменты катализируют реакции превращения сложных С-содержащих полимеров растительного происхождения на биодоступные соединения, которые стимулируют метаболизм и дыхание почвенных микроорганизмов [4]. Прямое воздействие на микробную активность оказывают такие климатические характеристики, как влажность и температура, которые изменяют диффузию, скорость реакций и осмотический потенциал [24]. Температура и влажность определяют состав растительных сообществ, их продуктивность, что косвенно влияет на биологическую почв.
Доступность влаги определяет жизнеспособность и функционирование почвенных микроорганизмов. Кроме того, вода в почве является растворителем большинства веществ, потребляемых микроорганизмами. Сильный дефицит влаги приводит к возникновению осмотического стресса и лизису клеток, вызывая гибель микроорганизмов. Косвенно засушливые условия изменяют физиологическое состояние почвенных микроорганизмов и их ферментативную активность [6]. Метаболический отклик на экстремальный дефицит воды зависит от доступности субстрата [29]. Внеклеточные ферменты имеют небольшой размер и находятся в тесном контакте с субстратом, поэтому для функционирования им требуются более тонкие водные пленки и мелкие заполненные водой поры, по сравнению с крупными микробными клетками [24].
Действие засухи проявлялось в снижении активности гидролитических ферментов [24], однако исследователями показано увеличение активности лейцинаминопептидазы, контролирующей гидролиз белков и участвующей в почвенном цикле азота, в варианте с растениями, что указывало на потребность в азоте в условиях засухи. В этой работе авторы сообщают и об отрицательном влиянии или отсутствии влияния засухи на активность ферментов цикла углерода в почве с растениями. Такой парадокс можно объяснить сложным сочетанием ряда факторов таких, как сезон года, длительность засухи, интенсивность осадков, устойчивость растений, изменчивость почвенных и микробных свойств.
В последнее время для характеристики энзиматической активности в почве все чаще применяют классическую модель ферментативной кинетики Михаэлиса–Ментен. Данная модель в большинстве случаев удовлетворительно объясняет связь между скоростью ферментативной реакции и концентрацией доступного субстрата в почве [30].
Модель имеет вид:
(1)
${{a}_{E}} + {{a}_{S}}\underset{{{{k}_{2}}}}{\overset{{{{k}_{1}}}}{\longleftrightarrow}}\left[ {{{a}_{E}}{{a}_{S}}} \right]\xrightarrow{{{{k}_{3}}}}{{a}_{P}} + {{a}_{E}},$Наиболее реалистично скорость протекания процессов в почве характеризует каталитическая эффективность Ka = Vmax/Km [21, 30]. ${{K}_{a}} = \frac{{{{k}_{1}}{{k}_{3}}{{a}_{E}}}}{{{{k}_{2}} + {{k}_{3}}}},$ которая позволяет оценить константу скорости реакции в ненасыщенных субстратом условиях, характерных для большинства почв: при ${{a}_{s}} \to 0,$ $V({{a}_{s}}) \to {{K}_{a}}{{a}_{s}}.$ Исследователями продемонстрировано, что на Ka сильно влияют физико-химические свойства почвы и доступность субстрата [8].
В работе основное внимание уделялось определению кинетических параметров ферментов в ходе засух и увлажнения почвы для оценки интенсивности стресса и степени восстановления ферментативной активности до уровня исходных значений.
Рабочие гипотезы заключались в следующем:
1. В условиях микрополевого эксперимента циклы высушивания–увлажнения приводят к увеличению пространственной изменчивости кинетических параметров почвенных ферментов из-за неоднородности увлажнения и иссушения почвы, возникновения зон повышенной ферментативной активности возле отмерших корней и погибших почвенных животных. Для того, чтобы проверить эту гипотезу, сравнили коэффициенты вариации (CV) для кинетических параметров до, после и во время засухи.
2. Ферменты одной группы, которые участвуют в цикле углерода (целлобиогидролазы, ксиланазы и β-глюкозидазы), будут реагировать аналогичным образом на высушивание–увлажнение. Для проверки этой гипотезы провели корреляционный анализ.
3. Присутствие растений в большей степени будет влиять на кинетические параметры ферментов при длительной засухе, в основном за счет гибели растений. Это приведет к высвобождению растительных ферментов в почве и всплеску микробной ферментативной активности на свежих растительных остатках.
Изучали влияния засух и увлажнения на кинетические параметры гидролитических ферментов в почве под луговой растительностью и в парующей почве. Цели работы заключались в оценке изменчивости Vmax и Km в почве, подвергшейся высушиванию–увлажнению; степени влияния засухи на Vmax и Km; скорости восстановления ферментативного комплекса почвы после повторного увлажнения.
ОБЪЕКТЫ И МЕТОДЫ
Описание эксперимента и отбор проб почвы. Модельный опыт был заложен в 2021 г. на полевых опытных участках Института физико-химических и биологических проблем почвоведения (г. Пущино Московской области, 54°50′ N, 37°36′ E) на серой почве (Haplic Luvisol по WRB). Экспериментальный участок был разделен на 48 делянок (1 × 1 м). 24 делянки засеяны мятликом луговым, остальные оставлены под черным паром. В пределах каждой делянки образцы гумусово-аккумулятивного горизонта отбирали в 4 точках, а затем в них определяли содержание влажности и ферментативную активность как в четырех отдельных повторностях. Над всеми опытными площадками была установлена прозрачная крыша для предотвращения попадания атмосферных осадков на почву. По ходу эксперимента проводили имитацию следующих условий:
1. Поддержание оптимального уровня влажности почвы (ОВ). Были предусмотрены участки с имитацией осадков в виде дождя 2–3 раза в неделю для поддержания весовой влажности почвы на уровне 20–25% на луговых участках и 17–20% – под паром (что примерно соответствовало 60–70% от предельной полевой влагоемкости (наименьшей влагоемкости) для исследуемых почв. Сумма осадков составила 98 мм, что соответствует метеоданным, собранным за это же время на юге Московской области.
2. Имитация двух кратковременных сезонных засух (летом и осенью) (КЗ). Летняя засуха длилась 30 дней (4.07–3.08), при этом влажность почвы снижалась до 10–14%, затем моделировали сильные дожди 2 раза в сутки с 4 по 8 августа с итоговыми осадками, аналогичными оптимальному режиму увлажнения в соответствующий период засухи. Влажность почвы после полива увеличивалась до 25–30%. Продолжительность осенней засухи составила 48 дней (8.08–23.09), при этом влажность снижалась до 13–18%, с последующими осадками в период 24–27 сентября. Влажность почвы после полива увеличивалась до 27–31%.
3. Имитация длительной засухи (ДЗ), которая продолжалась 82 дня (с 3 июля по 23 сентября), что привело к снижения влажности почвы до 3–7%, затем последовали 4-дневные осадки, имитирующие поступление 20 мм воды. Влажность почвы при этом увеличилась до 20–27%.
Для предотвращения боковой миграции почвенных вод участки были отделены друг от друга пластиковыми барьерами, зарытыми в почву до глубины 30 см. Образцы почв отбирали из верхнего слоя 0–5 см по следующей схеме: 1) перед началом засухи; 2) за один день до повторного увлажнения и 3) через неделю после окончания засухи (данный срок был выбран для того, чтобы микробное сообщество сумело отреагировать на увлажнение почвы). Образцы почвы просеивали влажными через сито диаметром 2 мм, а затем хранили при температуре 4°C до момента проведения анализа не более 7 дней.
Определение кинетических параметров гидролитических почвенных ферментов. Внеклеточную ферментативную активность в почве измеряли с использованием субстратов, меченных флуорохромом – 4-метилумбеллифероном (МУФ) [19]. Метод основан на том, что при гидролизе флуорогенно-меченого субстрата образуется флуоресцирующее соединение МУФ, количество которого измеряют флуорометрически. Использование флуорогенно-меченых субстратов позволяет проводить измерение концентрации продукта реакции в одинаковых единицах (нмоль/мл МУФ), что делает возможным сравнение активности ферментов, осуществляющих разные функции в почве. Ранее для серой почвы установлена прямая линейная зависимость между активностью гидролитических ферментов, определенных этим методом и величиной микробной биомассы [1]. Эффективность и скорость разложения органического вещества серой лесной почвы и растительных остатков больше зависели от вида разлагаемого материала, чем от уровней температуры и влажности [2]. Во многих исследованиях оценивают потенциальную активность ферментов, пренебрегая скоростью диссоциации и образования субстрат-ферментного комплекса. Полагаем, что более глубокий анализ с определением кинетических параметров ферментов позволит получить новые оригинальные результаты, описывающие свойства комплекса гидролитических ферментов.
Следует особо указать, что в почве всегда определяем кинетические параметры не одного конкретного фермента, а интегральные значения целой группы родственных ферментов: хитиназ, фосфатаз и т.д. Всего исследовано 5 групп гидролитических ферментов (Fluka, Германия):
β-1,4-глюкозидазы (ГЛ), катализирующие гидролиз целлюлозы и целлобиозы до глюкозы;
целлобиазы (β-целлобиогидролазы) (ЦЕЛ), участвующие в гидролизе целлобиозы до глюкозы;
хитиназы (N-ацетил-D-глюкозаминидаза) (ХИТ), участвующие в гидролизе хитина и пептидогликана муреина;
ксиланазы (КС), гидролизующие ксилан до ксилозы;
фосфатазы (ФОС), катализирующие гидролиз как сложных эфиров, так и ангидридов фосфорной кислоты.
В анализе использовали серию концентраций растворов, меченных по МУФ субстратов 0, 7, 15, 30, 60, 125, 250, 500 и 1000 нмоль/мл. Свежую почву массой 1 г помещали в пластиковые флаконы объемом 45 мл, добавляли 20 мл H2O и встряхивали на горизонтальном орбитальном шейкере в течение 30 мин. Аликвоту почвенной суспензии 50 мкл помещали в 96-луночные черные микропланшеты с добавлением 100 мкл меченных МУФ-субстратов. Планшеты инкубировали в темноте при 22°С в течение 1 ч для глюкозидазы и фосфатазы и в течение 3 ч для целлобиазы, ксиланазы и хитиназы. Интенсивность флуоресценции измеряли с помощью микропланшетного ридера Filter Max F5 (Molecular Devices, США) с длинами волн эмиссии и возбуждения 355 и 460 нм соответственно. Скорость ферментативной реакции выражали в нмоль 4-МУФ/(г ч) [19].
Расчеты кинетических параметров согласно модели ферментативной кинетики Михаэлиса–Ментен проводили с помощью программы Statistica 8.0 методом наименьших квадратов [16, 30]. На рис. 1 приведены примеры кривых насыщения для двух самых контрастных вариантов опыта: контроль и длительная засуха.
Рис. 1.
Примеры кривых насыщения почвенных ферментов фосфатаз (ФОС) (а) и хитиназ (ХИТ) (b) субстратом реакции (вариант опыта без растений). Точки – экспериментальные данные, линии – аппроксимация зависимости согласно модели Михаэлиса–Ментен. 1, 2, 3, 4 – номера повторностей измерения. ОВ – вариант опыта с оптимальным увлажнением почвы, ДЗ – длительная засуха.
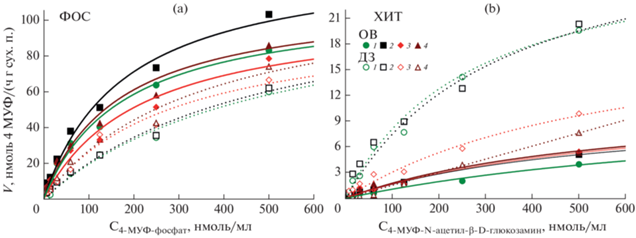
В отличие от большинства работ по изучению ферментативной кинетики [16, 30] Михаэлис–Ментен в почве, полагаем, что Km следует выражать не как нмоль вещества на г почвы или объем почвы [9] или просто нмоль [19, 32], а как нмоль вещества на объем раствора (на л, мл, мкл и т.д.), как [28] или г/л [14]. Поскольку субстрат во время проведения анализа находится в почвенной суспензии в растворенном виде и никак не привязан к массе почвы. Ошибочный пересчет на грамм почвы приводит к тому, что величина Km становится зависимой от степени разведения почвенной суспензии, что неверно. Реакционный раствор следует воспринимать как аналог свободного почвенного раствора. Отметим, что Vmax следует, как и принято выражать на грамм почвы, так как количество ферментов в реакционной смеси прямо пропорционально связано с массой почвы. Таким образом, предлагаем выражать Ka в нмоль продукта реакции мл/(г почвы ч нмоль субстрата реакции). Эта величина отражает количество продукта ферментативной реакции, произведенного в единицу времени (в расчете на единицу субстрата) в 1 г почвы. В этом случае от степени разведения почвенной суспензии величина каталитической эффективности не зависит, т.е. исходя из вышесказанного, представлять размерность Ka как ч–1 [18] неверно.
Статистическая обработка данных. Результаты определения кинетических параметров ферментов статистически обрабатывали в программе Statistica 8.0. Кинетические параметры ферментов определяли с помощью аппроксимации по уравнению Михаэлиса–Ментен отдельно для четырех кривых насыщения – по одной кривой на навеску почвы (рис. 1). Таким образом, на каждый вариант опыта получается по 4 повторности Km и Vmax, которые затем подвергаются статистической обработке. Для оценки достоверности и силы влияния засух и присутствия растений на кинетические параметры ферментов проводили отдельно для длительной и коротких периодических засух медианный тест и двухфакторный дисперсионный анализ данных. В качестве факторов дисперсионного анализа выбрали: 1 – стадия засухи (градации фактора: контроль, засуха, после засухи); 2 – присутствие растений на почве (градации: растения присутствуют, растения отсутствуют). Медианный тест, как метод непараметрической статистики, позволяет проанализировать параметры распределения частот встречаемости значений в независимости от типа функции распределения. Для оценки пространственной неоднородности ферментативной активности в почве (от навески к навеске почвы) рассчитывали СV. Корреляционный анализ проводили для выявления взаимосвязи между кинетическими параметрами разных групп ферментов. Дискриминантный анализ применяли для оценки изменений ферментативной кинетики как в целом, так и для выявления наиболее характерных черт влияния периодических и длительной засух на кинетические параметры ферментов.
РЕЗУЛЬТАТЫ
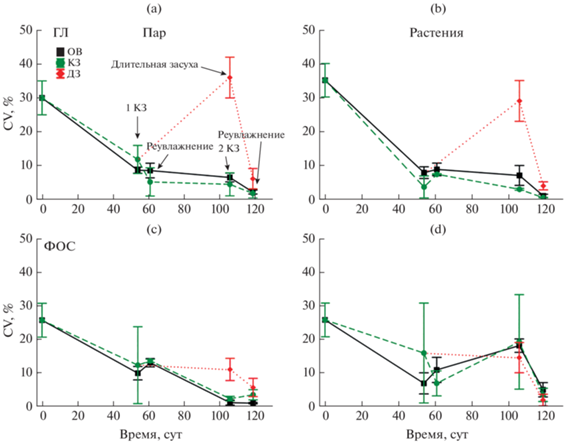
Пространственная изменчивость кинетических параметров почвенных ферментов. Для Km не наблюдалось достоверных изменений значений пространственной изменчивости (оцененной по СV) для всех вариантов опыта. Для Vmax в пределах каждой делянки наблюдается снижение СV от начала лета к осени. Короткие засухи не повлияли на СV. При длительной засухе наблюдалось 3–4-кратное увеличение пространственной изменчивости только для глюкозидаз (вариант с растением и без) (рис. 2а, 2b) и фосфатаз (вариант с растениями) (рис. 2d). Удивительно, но присутствие растений, которые благодаря живым и отмершим корням создают в почве локальные зоны повышенной ферментативной активности не повлияло на CV для параметра Vmax.
Рис. 2.
Динамика значений (точки – среднее арифметическое значение, “усы” – ошибка среднего) коэффициента вариации (CV) для Vmax у глюкозидаз (ГЛ) и фосфатаз (ФОС). ОВ – вариант опыта с оптимальным увлажнением почвы, ДЗ – длительная засуха, КЗ – короткая засуха.
Влияния засухи и присутствия растений на кинетические параметры ферментов. По данным медианного теста (табл. 1) длительная засуха закономерно влияла на Vmax для более широкого спектра почвенных ферментов по сравнению с кратковременными засухами. Только 3 группы ферментов (глюкозидазы, фосфатазы и ксиланазы) реагировали на кратковременный стресс снижением Vmax, тогда как 4 группы ферментов оказались чувствительными к длительной засухе – снижалась Vmax фосфатаз, целлобиаз, ксиланаз и увеличивалась в 4 раза у хитиназ.
Таблица 1.
Знаки и статистически достоверные величины эффектов (по отношению к контролю) от засух и выхода из засух по данным медианного теста
| Фермент | Растения* | Кинетический параметр | КЗ | ДЗ | ПКЗ | ПДЗ |
|---|---|---|---|---|---|---|
| Глюкозидаза | + | Vmax | ↓9.5 | Н.э. | ↓1.3 | ↓1.9 |
| Km | ↓11.2 | Н.э. | Н.э. | Н.э. | ||
| – | Vmax | Н.э. | Н.э. | ↓4.7 | Н.э. | |
| Km | ↓6.8 | Н.э. | ↓10.2 | Н.э. | ||
| Фосфатаза | + | Vmax | ↓6.4 | Н.э. | Н.э. | Н.э. |
| Km | Н.э. | ↑2.5 | Н.э. | ↑1.5 | ||
| – | Vmax | Н.э. | ↓2.2 | Н.э. | Н.э. | |
| Km | ↑6.9 | Н.э. | ↑2.2 | ↑3.0 | ||
| Целлобиогидролаза | + | Vmax | Н.э. | ↓ 6.0 | Н.э. | Н.э. |
| Km | Н.э. | ↑6.1 | Н.э. | Н.э. | ||
| – | Vmax | Н.э. | Н.э. | Н.э. | ↑2.2 | |
| Km | ↑6.4 | ↑14.2 | Н.э. | ↑4.1 | ||
| Хитиназа | + | Vmax | Н.э. | ↑1.5 | Н.э. | ↑4.0 |
| Km | Н.э. | ↑3.0 | Н.э. | ↑3.2 | ||
| – | Vmax | Н.э. | ↑3.7 | Н.э. | ↑2.0 | |
| Km | ↑2.2 | ↑2.3 | Н.э. | Н.э. | ||
| Ксиланаза | + | Vmax | Н.э. | ↓10.8 | Н.э. | Н.э. |
| Km | Н.э. | Н.э. | Н.э. | Н.э. | ||
| – | Vmax | ↓4.0 | Н.э. | Н.э. | Н.э. | |
| Km | Н.э. | Н.э. | Н.э. | Н.э. |
Как длительные, так и кратковременные засухи увеличивали показатель Km для всех групп ферментов, кроме глюкозидаз, для которых Km снижался только при кратковременной засухе. После кратковременной засухи кинетические параметры за неделю восстановились до значений, наблюдавшихся в почвах с оптимальным уровнем влажности, за исключением: Vmax глюкозидаз и Km фосфатаз. Сильное последействие длительной засухи выражалось в отличие параметров Vmax и Km глюкозидаз, фосфатаз, целлобиаз и хитиназ кинетических параметров в контроле в 1.5–3 раза даже через неделю после повторного увлажнения.
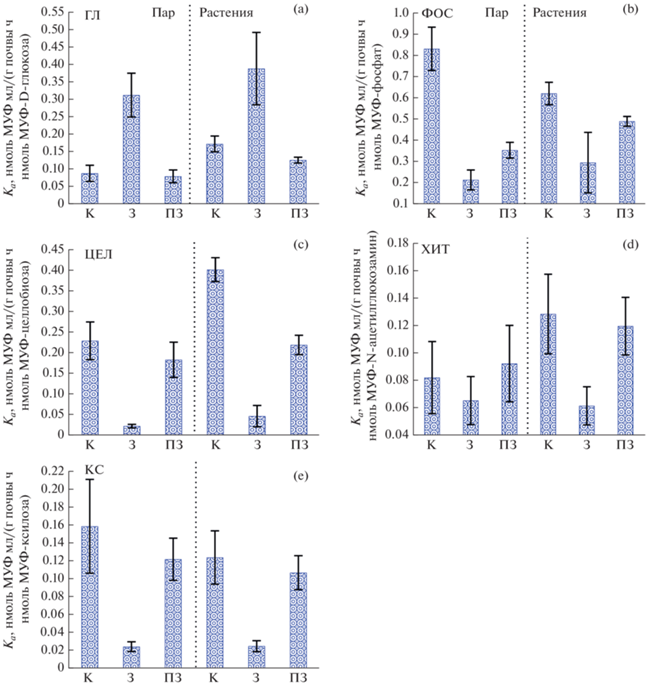
Засухи обратимо снижали каталитическую эффективность (Kа) всех исследуемых ферментов, кроме глюкозидаз, для которых, напротив, наблюдалось обратимое 3–4-кратное увеличение Kа (рис. 3a). Присутствие растений было второстепенным и достоверно приводило к увеличению целлобиазной активности в контрольном варианте опыта (рис. 3c).
Рис. 3.
Каталитическая эффективность ферментов (Kа): при оптимальном уровне влажности (ОВ); в условиях засухи – З (КЗ + ДЗ) и после засухи – ПЗ (ПКЗ + ПДЗ).
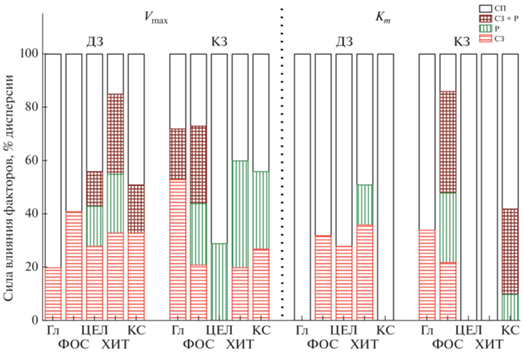
Дисперсионный анализ показал, что для параметра Vmax влияние засухи вносит вклад от 20 до 55% в общую дисперсию (рис. 4). Влияние растений на Vmax было наиболее выражено при кратковременной засухе (20–40% дисперсии), тогда как при длительной засухе влияние растений снижалось и не превышало 20%. На значения Km циклы высушивания–реувлажнения влияли в меньшей степени, чем на Vmax. Присутствие растений влияло на Km трех ферментов: хитиназы (длительная засуха), фосфатазы и ксиланазы (кратковременная засуха).
Рис. 4.
Сила влияния факторов присутствия растений (Р) и стадии засухи (СЗ) на кинетические параметры ферментов по данным дисперсионного анализа. СП – случайные причины.
Взаимосвязь между кинетическими параметрами разных групп ферментов. Корреляционный анализ кинетических параметров разных групп гидролаз показал, что есть статистически достоверная (р < 0.05) положительная корреляция Vmax целлобиогидролаз с хитиназами (r = 0.42) и ксиланазами (r = 0.44), есть положительная корреляция Km фосфатаз и хитиназ (r = 0.43).
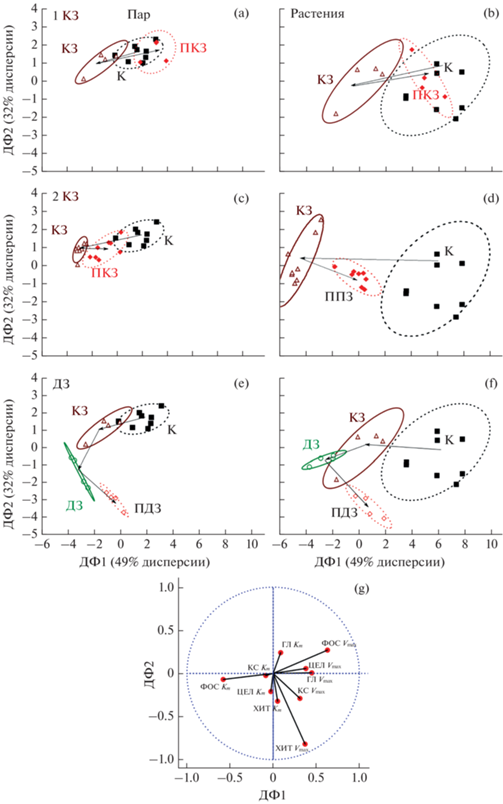
Дискриминантный анализ кинетических параметров ферментов. Дискриминантный анализ кинетических параметров выявил две статистически достоверные (p < 0.05) дискриминантные функции (ДФ1 и ДФ2). ДФ1 интерпретируется как влияние засухи как таковой, так как она разделяет на рис. 5a–5f точки, отображающие образцы контрольной почвы от образцов, отобранных при засухе. ДФ2 интерпретируется как дополнительное влияние длительной засухи, так как разделяет точки отображающие образцы почвы, отобранные при длительной засухе, а также после ее окончания (рис. 5c, 5d) от всех прочих. Анализ рис. 5a–5d показал, что кинетические параметры ферментов от первой и второй коротких засух приближаются к контрольным значениям через неделю после реувлажнения, при этом для первой засухи (рис. 5a, 5b) степень восстановления выше. Длительная засуха приобретает свои отличительные черты (изменяются значения ДФ2), и после длительной засухи через неделю не происходит восстановления кинетических параметров ферментов до контрольного уровня (рис. 5e, 5f). Анализ корреляции между ДФ и кинетическим параметрами ферментов (рис. 5g) показал, что засуха приводит к снижению Vmax ферментов и возрастанию Km у фосфатаз, длительная засуха при этом приводит к возрастанию Vmax хитиназ.
Рис. 5.
Результаты дискриминантного анализа исследованных образцов почв, охарактеризованных по кинетическим параметра Km и Vmax для набора ферментов. a–f – взаиморасположение объектов исследования в плоскости, образованной дискриминантными функциями 1 и 2 (ДФ1 и ДФ2); g – корреляция между ДФ и кинетическими параметрами, использованными в анализе. Корреляционные эллипсы ограничивают область c р ≤ 0.95.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что высушивание оказывают стрессовое воздействие на большинство почвенных микроорганизмов, участвующих в процессах минерализации органического вещества почвы. В процессе минерализации участвуют внеклеточные ферменты микроорганизмов, вот почему столь информативно изучение кинетических параметров гидролитических ферментов, ответственных за цикл углерода в почве. Данное исследование сосредоточено на изучение степени изменения и восстановления параметров Vmax, Km и Ka в зависимости от продолжительности и частоты засухи в почве под травяной растительностью и под паром. Для двух групп ферментов из пяти показано обратимое увеличение пространственной изменчивости Vmax во время длительной засухи. Высокая изменчивость кинетических параметров, скорее всего, связана с увеличением неоднородности свойств почвы. Некоторые микролокусы могут проявлять высокую биологическую активность по мере увеличения концентрации растворенных веществ в почвенных капиллярах [6]. Показано сильное изменение кинетических параметров экзоферментов вглубь по профилю почвы. Авторы предположили, что подобные изменения могут быть вызваны различиями в доступности субстрата реакции, различиями в количестве продуцируемых экзоферментов и/или синтеза качественно различных ферментов [3].
Длительная засуха сильно снижала Vmax целлобиазы, фосфатазы и ксиланазы, но при этом увеличивала максимальную скорость реакции у хитиназ. Предполагаем, что последнее связано с увеличением доли грибов в микробной биомассе, вызванное длительной засухой [34]. Хитиназа участвует в расщеплении хитина клеточных стенок отмирающих грибных гиф. Исследователями показана тесная корреляция между биомассой грибов и активностью ферментов в подстилке [4]. Как бактерии, так и грибы выделяют экзоферменты, но трудноразлагаемые полимеры, такие как лигнин или целлюлоза, расщепляются в основном ферментами грибов, а не бактерий [25]. Другие исследования показали, что кинетические параметры ферментов могут зависеть от биомассы грибов в почвах засушливых регионов, а доступность субстрата и протеолитическую активность, вероятно, определяет изменение ферментативной активности вдоль климатического градиента [4].
Снижение Vmax было примерно одинаковым для ксиланазы, фосфатазы и хитиназы во время обеих типов засух. Vmax глюкозидазы снижалась при кратковременной засухе и не изменялась по сравнению с контролем в ходе длительной засухи. Вероятно, ферменты, участвующие в цикле углерода, были более чувствительны к кратковременной засухе. Кинетические параметры ферментов после короткой засухи почти восстановились до уровня контрольных значений. Сильное последействие длительной засухи привело к тому, что даже через неделю после повторного увлажнения Vmax ферментов в 1.5–3 раза оставалась ниже, чем в контрольном варианте.
Ожидали сильную корреляцию между кинетическими параметрами для ферментов из одной функциональной группы, гидролизующих углеводы (глюкозидаза, целлобиаза, ксиланаза, хитиназа), на что имеется указание в литературе [31]. Однако обнаружили лишь слабую положительную корреляцию Vmax целлобиаз и хитиназ (r = 0.42) и между целлобиазами и ксиланазами (r = 0.44). Слабая положительная корреляция для Km наблюдалась только между фосфатазами и хитиназами (r = 0.43). Некоторые исследования показали значительную разницу в измеренных в лаборатории Km между группами (целлюлазы > лигниназы) и отсутствие существенной разницы в Vmax между целлюлазами и лигниназами [32]. Такая взаимозависимость кинетических параметров может быть результатом сложной суперпозиции ряда абиотических факторов, в том числе местные условия, высокая изменчивость свойств почвы (гранулометрический состав, содержание органического вещества), растительность, локализация ферментов и т.д. Ряд исследований свидетельствует о положительной корреляции между Vmax дегидрогеназ и содержанием глины, рН, общего азота и углерода [12]. Обнаружена положительная корреляция Vmax уреаз практически со всеми основными свойствами почвы, кроме объемной плотности [15]. Изучение кинетических параметров ферментов вдоль климатического градиента показало, что параметр внеклеточных ферментов Vmax может быть обусловлен скоростью оборота ферментов в почве, а не просто продукцией ферментов; этот эффект был наиболее выражен для протеолитических ферментов [4]. В полевых экспериментах длительная засуха не оказала существенного влияния на пул внеклеточных ферментов, хотя микробная биомасса почвы резко уменьшилась в результате этой засухи [27]. Такая стабильность экзогенного ферментного пула, скорее всего, связана с защитой ферментов от протеолитического распада путем их физической фиксации на глинистых частицах и органических остатках в процессе засухи, что приводит к снижению гидролиза протеазами самих ферментов [27]. Показано, что ферментативная активность зависит от свойств почвы и экзогенных факторов (ботанический состав растительности и др.) [23].
Влияние растений на Vmax и Km было достоверным только в случае кратковременной (периодической) засухи. По данным дисперсионного анализа влияние растений вносило 35–45% к дисперсии Vmax для целлобиаз, хитиназ, ксиланаз в почве, подверженной кратковременной засухе. Эти ферменты строго специфичны к субстрату по сравнению с глюкозидазами, которые синтезируются широким спектром организмов [26]. Растения, подвергшиеся кратковременной засухе, вероятно, активизировали свою корневую систему, чтобы добыть влагу из почвы, обеспечивая тем самым дополнительный приток С-субстратов и увеличивая продукцию целлобиаз, хитиназ и ксиланаз. В настоящем исследовании растения сглаживали изменчивость Vmax по сравнению с вкладом частоты засухи. Однако вклад комбинированного воздействия (растение + засуха) на величину Vmax составил 50–80%. В целом засуха сильнее повлияла на значения Vmax, чем на Km. Иными словами, засуха сначала изменяла количество почвенных ферментов, а потом их качество.
Обратимое уменьшение Vmax в сочетании с быстрым обратимым снижением Ka было общей тенденцией как для длительной, так и для краткосрочных засух. Экстремальная засуха замедляет растворение веществ в почвенном растворе и подавляет перенос доступных питательных веществ к почвенным микроорганизмам, тем самым снижая секрецию ферментов. В этом исследовании обнаружено, что кратковременная засуха вызывает снижение Km глюкозидаз и связанное с этим увеличение Ka. Полученные выводы хорошо согласуются с данными [33], которые обнаружили высокую величину каталитической эффективности глюкозидаз при содержании влаги в почве на уровне 10%, а не 20%. Авторы предположили, что почвенные β-глюкозидазы адаптированы к водному дефициту.
Специфической (характерной) особенностью длительной засухи было увеличение параметров Vmax и Km для хитиназ как в почве под растительностью, так и в парующей почве. Увеличение Vmax, вероятно, было вызвано гибелью большей части микроорганизмов во время длительной засухи [4] и развитием на этой некромассе вторичной микробной биомассы, выделяющей дополнительное количество хитиназ. Предполагаем, что увеличение активности хитиназ обусловлено ростом доли и активности грибного блока в микробном сообществе. Исследователями показано, что грибы более устойчивы к засушливым условиям по сравнению с бактериями [5].
ЗАКЛЮЧЕНИЕ
В ходе проведения модельного полевого эксперимента установлено, что длительная засуха оказывала большее влияние на кинетические параметры гидролитических ферментов, чем кратковременная (периодическая), изменяя как количественные показатели фермента (Vmax), так и качественные показатели (Km и Kа). Влияние растений на активность ферментов было статистически значимо, но менее выраженным при длительной засухе, и без каких-либо специфических (характерных) признаков. В условиях длительной засухи явным специфическим (характерным) признаком почвенного пула ферментов является повышение Vmax хитиназ, видимо, обусловленное увеличением доли в микробной биомассе грибов, содержащих хитин в клеточных стенках, являющийся субстратом для хитиназ. Кратковременное (периодическое) засушливое воздействие не являлось ослабленным вариантом действия длительной засухи, с отличительной особенностью – снижением Km глюкозидаз, приводящим к увеличению Kа. Обратимость действия засухи на кинетические параметры ферментов уменьшалась в ряду: первая кратковременная засуха > вторая кратковременная засуха > длительная засуха – за счет увеличения общей продолжительности стрессового воздействия.
Список литературы
Овсепян Л.А., Курганова И.Н., Мостовая А.С., Лопес де Гереню. В.О., Личко В.И., Благодатская Е.В., Кузяков Я.В. Ферментативная активность пост-агрогенных серых лесных почв нагорной дубравы “Лес на Ворскле” // Известия Самарского научного центра РАН. 2017. Т. 19. № 2. С. 151–158.
Семенов В.М., Лебедева Т.Н., Зинякова Н.Б., Хромычкина Д.П., Соколов Д.А., Лопес де Гереню В.О., Кравченко И.К., Ли Х., Семенов М.В. Зависимость разложения органического вещества почвы и растительных остатков от температуры и влажности в длительных инкубационных экспериментах // Почвоведение. 2022. № 7. С. 860–875. https://doi.org/10.31857/S0032180X22070085
Alves R.J., Callejas I.A., Marschmann G., Mooshammer M., Singh H.W., Whitney B., Torn M.S., Brodie E.L. Kinetic Properties of Microbial Exoenzymes Vary with Soil Depth but Have Similar Temperature Sensitivities Through the Soil Profile // Frontiers in Microbiology. 2021. V. 12. P. 735282. https://doi.org/10.3389/fmicb.2021.735282
Baker N.R., Allison S.D. Extracellular enzyme kinetics and thermodynamics along a climate gradient in Southern California // Soil Biol. Biochem. 2017. V. 114. P. 82–92. https://doi.org/10.1016/j.soilbio.2017.07.005
Barnard R.L., Osborne C.A., Firestone M.K. Changing precipitation pattern alters soil microbial community response to wet-up under a Mediterranean-type climate // Int. Soc. Microbial Ecology. 2014. V. 9. P. 946–957. https://doi.org/10.1038/ismej.2014.192
Burns R.G., DeForest J.L., Marxsen J., Sinsabaugh R.L., Stromberger M.E., Wallenstein M.D., Weintraub M.N., Zoppini A. Soil enzymes in a changing environment: Current knowledge and future directions // Soil Biol. Biochem. 2013 V. 58. P. 216–234. https://doi.org/10.1016/j.soilbio.2012.11.009
Davidson E., Janssens I. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change // Nature. 2006. V. 440. P. 165–173. https://doi.org/10.1038/nature04514
Dick R.P., Sandor J.A., Eash N.S. Soil enzyme activities after 1500 years of terrace agriculture in the Colca Valley, Peru // Agriculture, Ecosystems & Environment. 1994. V. 50. P. 123–131. https://doi.org/10.1016/0167-8809(94)90131-7
German D.P., Marcelo K.R.B., Stone M.M., Allison S.D. The Michaelis–Menten kinetics of soil extracellular enzymes in response to temperature: a cross-latitudinal study // Global Change Biol. 2012. V. 18. P. 1468–1479. https://doi.org/10.1111/j.1365-2486.2011.02615.x
Gianfreda L., Rao M.A., Piotrowska A., Palumbo G., Colombo C. Soil enzyme activities as affected by anthropogenic alterations: intensive agricultural practices and organic pollution // Sci. Total Environ. 2005. V. 341. I. 1–3. P. 265–279. https://doi.org/10.1016/j.scitotenv.2004.10.005
IPCC C. W. T. Climate Change 2007: Synthesis Report. Geneva, Switzerland IPCC, 2007. P. 104.
Juan Y., Chen L., Wu Z.J., Wang R. Kinetics of soil urease affected by urease inhibitors at contrasting moisture regimes // J. Soil Sci. Plant Nutrition. 2009. V. 9. P. 125–133.
Khalili B., Nourbakhsh F., Nili N., Khademi H., Sharifnabi B. Diversity of soil cellulase isoenzymes is associated with soil cellulose kinetic and thermodynamic parameters // Soil Biol. Biochem. 2011. V. 43. P. 1639–1648.
Kovárová–Kovar K., Egli T. Growth Kinetics of Suspended Microbial Cells: From Single-Substrate-Controlled Growth to Mixed-Substrate Kinetics // Microbiol. Molecular Biol. Rev. 1998. V. 62. P. 646–666.
Kujur M., Patel A.K. Kinetics of soil enzyme activities under different ecosystems: An index of soil quality // Chilean J. Agricult.Res. 2014. V. 74. P. 96–104. https://doi.org/10.4067/S0718-58392014000100015
Loeppmann S., Blagodatskaya E., Pausch J., Kuzyakov Y. Substrate quality affects kinetics and catalytic efficiency of exoenzymes in rhizosphere and detritusphere // Soil Biol. Biochem. 2016. V. 92. P. 111–118.
von Lützow M., Kogel-Knabner I. Temperature Sensitivity of Soil Organic Matter Decomposition – What Do We Know? // Biol. Fertil. Soils. 2009. V. 46. P. 1–15. https://doi.org/10.1007/s00374-009-0413-8
Liu C., Tian H., Gu X., Li N., Zhao X., Lei M., Alharbi H., Megharaj M., He W., Kuzyakov Y. Catalytic efficiency of soil enzymes explains temperature sensitivity: Insights from physiological theory // Sci. Total Environ. V. 822. 2022. P. 153365. https://doi.org/10.1016/j.scitotenv.2022.153365
Marx M.C., Wood M., Jarvis S.C. A microplate fluorimetric assay for the study of enzyme diversity in soils // Soil Biol. Biochem. 2001. V. 33. P. 1633–1640.
Marx M., Kandeler E., Wood M.K., Wermbter N., Jarvis S.C. Exploring the enzymatic landscape: distribution and kinetics of hydrolytic enzymes in soil particle-size fractions // Soil Biol. Biochem. 2005. V. 37. P. 35–48.
Moscatelli M.C., Lagomarsino A., Garzillo A.M.V., Pignataro A., Grego S. Glucosidase kinetic parameters as indicators of soil quality under conventional and organic cropping systems applying two analytical approaches // Ecological Indicators. 2012. V. 13. P. 322–327.
Nannipieri P., Grego S., Ceccanti B. Ecological significance of the biological activity in soil // Soil Biochem. 1990. V. 6. P. 293–355.
Sanaullah M., Blagodatskaya E., Chabbi A., Rumpel C., Kuzyakov Y. Drought effects on microbial biomass and enzyme activities in the rhizosphere of grasses depend on plant community composition // Appl. Soil Ecology. 2011. V. 48. P. 38–44.
Schimel J. Life in Dry Soils: Effects of Drought on Soil Microbial Communities and Processes // Ann. Rev. Ecology, Evolution, Systematics. 2018 V. 49. P. 409–432.
Schneider T., Keiblinger K.M., Schmid E., Sterflinger–Gleixner K., Ellersdorfer G., Roschitzki B., Richter A., Eberl L., Zechmeister–Boltenstern S., Riedel K. Who is who in litter decomposition? Metaproteomics reveals major microbial players and their biogeochemical functions // The ISME J. 2012. V. 6. P. 1749–1762.
Skujins J. Extracellular enzymes in soil // Critical Rev. Microbiol. 1976. V. 44. P. 383–421.
Steinweg J.M. Sensitivity of microbial community physiology to soil moisture and temperature in an old field ecosystem. Doctoral dissertation, 2011.
Stone M.M., Weiss M.S., Goodale C.L., Adams M.B., Fernandez I.J., German D.P., Allison S.D. Temperature sensitivity of soil enzyme kinetics under N-fertilization in two temperate forests // Global Change Biol. 2012. V. 18. P. 1173–1184.
Stursova M., Baldrian P. Effects of soil properties and management on the activity of soil organic matter transforming enzymes and the quantification of soil-bound and free activity // Plant Soil. 2011. V. 338. P. 99–110.
Tischer A., Blagodatskaya E., Hamer U. Microbial community structure and resource availability drive the catalytic efficiency of soil enzymes under land-use change conditions // Soil Biol. Biochem. 2015. V. 89. P. 226–237.
Wallenstein M.D., McMahon S.K., Schimel J.P. Seasonal variation in enzyme activities and temperature sensitivities in Arctic tundra soils // Global Change Biol. 2009. V. 15. P. 1631–1639.
Wang G., Post W.M., Mayes M.A., Frerichs J.T., Sindhu J. Parameter estimation for models of ligninolytic and cellulolytic enzyme kinetics // Soil Biol. Biochem. 2012. V. 48. P. 28–38.
Zhang Y., Chen L., Wu Z., Sun C. Kinetic parameters of soil β-glucosidase response to environmental temperature and moisture regimes // Revista Brasileira De Ciencia Do Solo. 2011. V. 35. P. 1285–1291.
Yuste J.C., Barba J., Fernández-González A.J., Fernández–López M., Mattana S., Martínez–Vilalta J., Nolis P., Lloret F. Changes in soil bacterial community triggered by drought-induced gap succession preceded changes in soil C stocks and quality // Ecology Evolution. 2012. V. 2. P. 3016–3031.
Дополнительные материалы отсутствуют.


