Почвоведение, 2023, № 5, стр. 550-566
Биотехнологический потенциал прокариотного компонента современных, реликтовых почв и грунтов Антарктиды
Н. А. Манучарова a, *, М. А. Коваленко a, М. Г. Алексеева a, А. Д. Бабенко a, А. Л. Степанов a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: manucharova@mail.ru
Поступила в редакцию 17.10.2022
После доработки 04.01.2023
Принята к публикации 05.01.2023
- EDN: IEWDLZ
- DOI: 10.31857/S0032180X22601311
Аннотация
Установлены закономерности распространения и зависимости функциональной активности метаболически активных прокариот от основных экологических факторов. В исследовании применяли молекулярно-биологические и биоинформатические подходы. Спектр исследуемых образцов включал современные почвы Волгоградской, Тульской, Московской областей, Сибири и северной части Центральной Камчатки, реликтовые местообитания Волгоградской области и Центральной Камчатки, многолетнемерзлые грунты Антарктиды, о. Кинг-Джордж. Рассматривали воздействие антропогенных и абиогенных нагрузок на развитие прокариотного сообщества. В почвах, подверженных антропогенным или абиогенным нагрузкам, наряду с сокращением разнообразия и численности прокариот установлено увеличение количества генов, маркирующих способность сообщества к биодеградации ксенобиотиков, а также генов, кодирующих превращения азота и уровень метаболизма кофакторов и витаминов. Бактериальный комплекс способен к нитрификации при высоком загрязнении почвы нефтью, а его роль возрастает в нижних слоях почвенного профиля. Археи играют ведущую роль в процессе нитрификации в ненарушенных почвах. Выявленные закономерности указывают на высокий метаболический потенциал прокариотного компонента рассматриваемых объектов и открывают возможности для биотехнологического использования штаммов, выделенных из реликтовых местообитаний.
ВВЕДЕНИЕ
К современным научным проблемам микробиологической технологии относятся выяснение свойств почв, способствующих сохранению разнообразия и получение консорциумов микроорганизмов, обладающих биотехнологическим потенциалом (способностью к гидролизу природных полимеров и ксенобиотиков, азотфиксации, синтезу вторичных метаболитов).
Для сохранения биоразнообразия почвенного микробиома в условиях антропогенной и абиогенной нагрузок существенное значение имеет протекторная функция почвы – консервация в жизнеспособном состоянии различных переживающих стадий организмов. Основными механизмами перехода в покоящееся состояние является способность образовывать споры, цистоподобные покоящиеся клетки [6, 7], приобретать некультивируемое состояние [27]. Если способность образовывать споры является строго штаммо- и видоспецифичной чертой, то способность образовывать цистоподобные покоящиеся клетки, предназначенные для длительного выживания и сохранения вида, оказалась свойственна не только неспорообразующим, но и спорообразующим бактериям. Эта способность реализуется в случаях, когда спорообразование репрессировано, например, в условиях катаболитной репрессии [7, 8]. Особое значение феномен торможения жизненной активности приобретает в современной биотехнологии, в частности при хранении и приготовлении активного посевного спорового материала. Например, обработка спор микроорганизмов низкими температурами увеличивает выход конечного продукта, в частности антибиотиков, улучшает качество винной продукции, повышает урожайность сельскохозяйственных культур и содержание в них сахаров [5]. Такие реактивированные покоящиеся формы микроорганизмов часто обладают свойствами, отличными от их коллекционных аналогов, и могут использоваться в биотехнологии [38].
Значительный интерес представляют микроорганизмы, выделенные из экстремальных местообитаний, по мнению некоторых авторов именно они характеризуются большей биологической активностью по сравнению со штаммами, выделенными из почв умеренных широт [8, 38]. Проблема представляет как практический (выявление продуцентов биологически активных веществ), так и теоретический интерес (изучение новых неисследованных ранее таксонов прокариот).
Усиление биотехнологических свойств микроорганизмов путем интродукции высокоактивных метафункциональных селекционных штаммов и создания условий для их деятельности в природных системах и агроценозах – один из перспективных подходов биоремедиации загрязненных систем.
Цель работы – выявление специфики развития прокариот, обладающих биотехнологическим потенциалом (осуществляющих деструкцию биополимеров, углеводородов; способных к синтезу вторичных метаболитов; процессу азотфиксации) в почвенных экосистемах, установление закономерностей их распространения и зависимости функциональной активности от основных экологических факторов.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования являлись прокариотные сообщества современных почв (дерново-подзолистой, торфяной олиготрофной, чернозема, серой лесной, каштановой, бурой пустынно-степной), реликтовых местообитаний (подкурганные каштановые почвы, погребенные вулканические слоисто-пепловые почвы Камчатки), многолетнемерзлых грунтов Антарктиды (табл. 1).
Таблица 1.
Исследуемые почвы
| Почва | Название по WRB | Содержание гумуса, % | pH H2O | Глубина отбора, см | Место отбора |
|---|---|---|---|---|---|
| Каштановая остаточно-солонцеватая глубокозасоленная среднемощная среднесуглинистая на лёссовидных суглинках (современная) | Haplic Arenic Kashtanozem |
2.2 | 7.5 | 2–10 | Волгоградская область 49.39936° N, 46.81083° E |
| Каштановая несолонцеватая незасоленная погребенная, 3.5 тыс. лет | Haplic Arenic Kashtanozem |
0.8 | 8.3 | 50–61 | Волгоградская область юг Приволжской возвышенности Камышинского района (курган Саломатино, XVI–XV вв. до н.э.) |
| Каштановая остаточно-солонцеватая незасоленная погребенная, 4.5 тыс. лет | Haplic Arenic Kashtanozem | 0.1 | 7.6 | 206–215 | Волгоградская область юго-восток Среднерусской возвышенности Клетского района в бассейне Дона (курган Перекопка, середина третьего тысячелетия до н.э.) |
| Вулканическая слоисто-охристая (современная) | Aluandic Andosols Dystric | 2.1 | 5.8 | 10–20 | Северная часть Центральной Камчатки Почвенно-пирокластический чехол северо-западного подножия вулкана Шивелуч 56°49′42″ N, 161°19′28″ E |
| Вулканическая слоисто-охристая Погребенная (2500 кал. л. н.) |
Aluandic Andosols Dystric | 2.5 | 6.2 | 110 | Северная часть Центральной Камчатки почвенно-пирокластический чехол северо-западного
подножия вулкана Шивелуч 56°49′42″ N, 161°19′28″ E |
| Вечномерзлые грунты морской террасы, сильнопромытые флювиогляциальными водами Возраст отложений 7.5 тыс. лет |
Antarctic permafrostrocks | 0.1 | 7.2–9.8 (максимум на глубине 6.5 м) | 940 | о. Кинг-Джордж, станция Беллинсгаузен 62°10′04″ N, 59°12′11″ E |
| Бурая пустынно-степная песчаная почва | Luvic Calcisols | 0.6 | 8.1 | 2–10 | Пустыня Гоби 43°45′00″ N, 111°50′00″ E |
| Чернозем типичный среднемощный среднесуглинистый на лёссовидных суглинках | Voronic Chernozems | 8.0 | 7.5 | 10 | Волгоградская область (модельный эксперимент) Волгоградская область (загрязнение нефтью в течение 7 лет) 51°1′41″ N, 40°43′31″ E |
| Серая лесная (обычная) маломощная среднесуглинистая на покровных суглинках | Haplic Luvisols (Abruptic) | 5.1 | 6.9 | 15 | Тульская область (модельный эксперимент) 53°58′23″ N, 37°10′34″ E |
| Дерново-подзолистая глеевая сверхглубокоосветленная | Umbric Luvisol | 2.9 | 5.3 | 5–10 | Московская область (почва на территории завода, загрязненная ПАУ, под лесной или под луговой растительностью) 55.728016° N, 38.217825° E |
| Торфяная олиготрофная (почва под нефтяной скважиной) | Fluvic Histosol | 5.4 | 4.1 | 0–10 | Сибирь, Ханты-Мансийский район 61.31°24′71″ N 70.26°76′10″ E |
Исследовали воздействие антропогенного фактора на прокариотные сообщества почв как в природных экосистемах (например, на месте разлива нефти или поступления и накопления полициклических ароматических углеводородов), так и в модельных опытах. При проведении модельных экспериментов применяли метод инициации микробной сукцессии увлажнением почвенных образцов водой (до 60% от массы почвы) и добавлением в опытные образцы ресурсов: биополимеров (хитина или пектина) в количестве 0.6% от массы почвы или углеводородов в количестве, превышающем показатели сильнозагрязненных почв (20% от массы почвы) [30].
Для исследования почвенных прокариотных сообществ применяли молекулярно-биологические методы оценки (высокопроизводительное секвенирование и биоинформатический анализ результатов с выявлением доминантов сообщества, обладающих различными биотехнологичными функциями).
Выделение ДНК. Из образцов почвы выделяли тотальную ДНК. Выделение ДНК проводили с помощью PowerSoil DNA IsolationKit компании MOBio в соответствии с рекомендациями производителя в трехкратной повторности. Детекцию качества выделения ДНК проводили при помощи горизонтального гель-электрофореза с окрашиванием этидиум бромидом.
ПЦР в реальном времени гена 16S рРНК. Концентрацию очищенного препарата почвенной ДНК реакцию определяли на детектирующем амплификаторе DТLite4 (ДНК-Технология, Россия) с измерением интенсивности флуоресценции реакционной смеси на каждом цикле в соответствии с рекомендациями производителя. Детектирующий амплификатор DТLite4 совмещает в себе функции программируемого термоциклера и оптической системы, позволяющей регистрировать флуоресценцию реакционной смеси в пробирках в ходе полимеразной цепной реакции. Использовали интеркалирующий краситель SYBR® Green и красители, связанные с праймерами (Lightcyaler – два зонда, связывающие ДНК-мишень на небольшом расстоянии друг от друга). 5'-конец одного зонда и 3'-конец второго содержат флуорофор-донор и флуорофор-акцептор. При их близком расположении флуорофор-донор поглощает свет определенной длины волны и переносит энергию на флуорофор-акцептор, по флуоресценции которого детектируют продукты амплификации. Реакционную смесь готовили из препарата SuperMixEvaGreenBiorad, концентрированный буфер с дезок-сирибонуклеотидами, полимеразой Sso7d-fusion, MgCl2, красителем EvaGreen и стабилизаторами. Прибор калибровали по зависимости интенсивности флуоресценции от логарифма концентрации ДНК стандартных растворов.
Оценивали наличие копий генов, кодирующих синтез ферментов, направленных на деструкцию углеводородов: алкан-монооксигеназы (alkB и alkM) (субстрат n-алканы) [28, 40], катехол-2,3-диоксигеназа (xylE) (субстрат катехолы и прокатехоевые кислоты), 1,2-гидроксинафталиндиоксигеназа (nahC) (субстрат нафталин) [14, 23, 30, 40]. Последовательности праймеров и температурные режимы амплификации представлены в табл. 2, 3.
Таблица 2.
Последовательности праймеров для углеводородокисляющих генов
| Ген | Фермент | Нуклеотидная последовательность праймеров (5'–3') |
|---|---|---|
| alkB | Алкан-монооксигеназа | f TGGCCGGCTACTCCGATGATCGGAATCTGG |
| r CGCGTGGTGATCCGAGTGCCGCTGAAGGTG | ||
| alkM | Алкан-монооксигеназа | f CCTGTCTCATTTGGCGCTCGTTCCTACAGG |
| r GTGATGATCTGAATGTCGTTGTAACTGG | ||
| xylE | Катехол-2,3-диоксигеназа | f CCGCCGACCTGATC(A/T)(C/G)CATG |
| r TCAGGTCA(G/T)CACGGTCA(G/T)GA | ||
| f GTAATTCGCCCTGGCTA(C/T)GTICA | ||
| rGGTGTTCACCGTCATGAAGCG(C/G/T)TC | ||
| nahC | Нафталин-диоксигеназа | f CAAAA(A/G)CACCTGATT(C/T)ATGG |
| R A(C/T)(A/G)CG(A/G)G(C/G)GACTTCTTTCAA |
Таблица 3.
Температурные условия для программы RT-PCR, использованные в работе для определения наличия генов в исследуемых образцах
| Функциональный ген | alkB | alkM | xylE | nahC |
|---|---|---|---|---|
| Температурный профиль | 1 × 94°С 5 мин | 1 × 94°С 5 мин | 1 × 95°С 5 мин | 1 × 94°С 10 мин |
| 30 × 94°С 1 мин 60°С 1 мин 72°С 1 мин |
30 × 94°С 1 мин 60°С 1 мин 72°С 1 мин |
35 × 94°С 1 мин 61.5°С 1 мин 72°С 1 мин |
30 × 95°С 1 мин 49°С 1 мин 72°С 1 мин |
|
| 1 × 72°С 3 мин | 1 × 72°С 3 мин | 1 × 72°С 10 мин | 1 × 72°С 3 мин | |
| 1 × 4°С – hold | 1 × 4°С – hold | 1 × 4°С – hold | 1 × 4°С – hold |
Параллельно проводили оценку функциональной деятельности прокариотного сообщества посредством выявления наличия в системе генов, участвующих в процессах азотного цикла: nifH – нитрогеназнаяактивность [20], amoA (AOB) – монооксигеназная активность аммонийокисляющих бактерий [36], amoA (AOA) – монооксигеназная активность аммонийокисляющих архей [21], а также nirK – нитратредуктазная активность [24]. Последовательности праймеров и температурные режимы амплификации представлены в табл. 4.
Таблица 4.
qPCR-праймеры и температурные условия, использованные в работе для определения наличия генов, участвующих в цикле азота
| Праймер | Последовательность (5'–3') | Температурный профиль |
|---|---|---|
| nifH: Forward Reverse |
GGTTGTGACCCGAAAGCTGA GCGTACATGGCCATCATCTC |
94°C 1 мин; 94°C 30 с, 50°C 1 мин, 72°C 30 с – 40 циклов; 72°C 10 мин |
| amoA (AOB): amoA-1F amoA-2R |
GGG GTT TCT ACT GGT GGT CCC CTC KGS AAA GCC TTC TTC |
95°C 10 мин; 94°C 45 с, 58°C 45 с, 72°C 45 с – 39 циклов; 95°C 15 с, 60°C 30 с, 95°C 15 с |
| amoA (AOA): 23F CrenamoA616 |
ATG GTC TGG CTW AGA CG GCC ATC CAB CKR TAN GTC CA |
94°C 45 с, 55°C 45 с, 72°C 45 с – 39 циклов; 95°C 15 с, 60°C 30 с, 95°C 15 с |
| nirK: nirK876 nirK1040 |
ATY GGC GGV CAY GGC GA GCC TCG ATC AGR TTR TGG TT |
95°C 15 мин; 95°C 15 с, 60°C 30 с, 72°C 30 с, 80°C 15 с – 40 циклов; 95°C 15 с, 72°C 30 с |
Полученные результаты обрабатывали с использованием пакета программы RT-PCR.
Секвенирование и метагеномный анализ. Амплификацию фрагментов гена 16S рРНК осуществляли с помощью вырожденных праймеров, комплементарных последовательностям как бактерий, так и архей: 341F (CCTACGGGRBGCASCAG) и 806R (GGACTACYVGGGTATCTAAT). Протокол реакции (температурный профиль): 95°С – 3 мин → → (95°С – 10 с → 50°С – 10 с → 72°С – 20 с) × 49 циклов. Полученные ПЦР-фрагменты очищали на колонках QIAquick (согласно протоколу производителя). Каждый ПЦР-фрагмент растворяли в 50 мкл ТЕ-буфера, полученного материала было достаточно для дальнейшего анализа. Высокопроизводительное секвенирование ампликонов гена 16S рРНК проводили с использованием прибора GS FLX (Roche, Швейцария) по протоколу Titanium с использованием набора GS FLX TitaniumSequencingKitXL+ и пикотитровальной пластины GS TitaniumPicoTiterPlateKit 70–75. Получены ПЦР-фрагменты препаратов метагеномной ДНК с помощью вырожденных праймеров PRK341F и PRK806R, созданы библиотеки, пригодные для секвенирования и далее определены нуклеотидные последовательности вариабельных фрагментов генов 16S рРНК при помощи секвенатора. Анализ полученных данных проводили при помощи Quantitative Insights Into Microbial Ecology (QIIME) [15]. C помощью инструментов программы осуществляли: 1) проверку качества секвенирования и создание библиотеки сиквенсов; 2) формирование ОТЕ (OTU picking) de novo на основе 97, 94, 91, 88, 85, 81% порога сходства сиквенсов методом UCLUST [18]; 3) удаление синглтонов (singletons – ОТЕ, содержащих только один сиквенс) и последовательностей, относящихся к растительным хлоропластам; 4) определение филогенетического состава сообществ на разных таксономических уровнях при помощи базы данных разнообразия гена RDP classifier [40] и построения филогенетического дерева при помощи алгоритма FastTree [35]; 5) расчет показателей общего разнообразия прокариотных сообществ (альфа-разнообразия): видового богатства, индекса Шеннона (H = Σpilnpi, где pi — доля i-го вида в сообществе), индекса Chao1, оценивающего предположительное реальное количество ОТЕ в сообществе Chao1 = Sobs + a2/2b, где Sobs – число обнаруженных ОТЕ, a – число ОТЕ, содержащих 1 сиквенс, b – число ОТЕ, содержащих 2 сиквенса), индекса филогенетического разнообразия (PD) [19] (при расчете индексов разнообразия проводили нормализацию данных по образцу с минимальным числом полученных сиквенсов); 6) анализ сходства структуры бактериальных сообществ (бетаразнообразия) при помощи метрики Брея–Кертиса [13]. Визуализацию результатов анализа бета-разнообразия проводили при помощи построения двумерных диаграмм по методу главных компонент. Статистический анализ достоверности различий между группами проводили при помощи непараметрического метода permutational ANOVA/MANOVA (PERMANOVA) [10].
Относительная доля родов в образцах представляет собой отношение количества последовательностей, относящихся к таксону, к общему количеству прочтенных последовательностей в образце после нормализации. Поскольку проанализировали большое количество последовательностей, относившихся к различным родам прокариот, провели выборку доминантных родов, относительная доля которых в образцах была ≥1%.
Функциональное разнообразие генов в микробных сообществах предсказывали при помощи программы PICRUSt [29]. Процесс предсказания функциональных генов по результатам секвенирования 16S рРНК состоял из двух этапов. На первом этапе производили предсказание встречаемости генов для каждого отдельно взятого организма согласно референсному филогенетическому древу Greengenes phylogenetic tree of 16S sequences [17]. Затем сопоставляли предсказанные гены для каждого таксона с относительной встречаемостью данного таксона в образце, оцененному по 16S рРНК. Таким образом осуществляли оценку встречаемости гена в образце. Для сопоставления 16S рРНК с уже секвенированными полными геномами использовали базу бактериальных и архейных геномов IMG database [31]. Функциональную классификацию проводили согласно схеме KyotoEncyclopediaofGenesandGenomes (KEGG) Orthology (KOs) [26].
Дальнейшую обработку результатов вели в программе QIIME [15]. При помощи инструментов программы осуществляли удаление синглтонов и нормализацию данных по образцу с наименьшим количеством определенных генов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Современной задачей любого биолога является полифазный подход к изучению живой системы, включающий характеристику как консервативного, так и функционального геномов. В связи с этим интересным представляется вопрос о субстратной специфичности и активности работы ферментных систем в зависимости от принадлежности микробной популяции к той или иной климатической зоне или вертикальной ярусности, обнаружения функциональных генов в образцах исследуемых почв, отвечающих за возможность самовосстановления микробного сообщества.
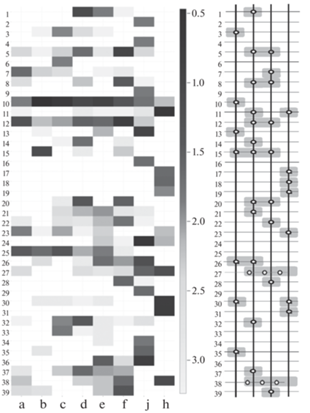
С применением молекулярно-биологических методов исследовано прокариотное сообщество погребенных почв, характеризующееся доминированием представителей филума Actinobacteria, которое становится более выраженным при внесении субстрата (биополимера хитина) (рис. 1). Представители рода Phenylobacterium [32] эффективно разлагающего хлоридазон, антипирин и пирамидон, являющиеся активными трудноразлагаемыми компонентами гербицидов, и род Janthinobacterium, известный своими бактерицидными, фунгицидными и вироцидными свойствами благодаря высокому содержанию виолацеина в клетках [1, 34]. Стоит отметить доминирование рода Chitinophaga, являющегося продуцентом нового антибиотика фальцитидина, обладающего активностью в отношении малярии, в образцах с субстратом [2, 37].
Рис. 1.
Доминирующие роды прокариот в исследованных образцах и их относительная доля, проиллюстрированная с помощью (ОТЕ выделены на уровне 97% сходства; приведены только ОТЕ, идентифицированные на уровне рода; за доминантные приняты роды, составляющие >1% от всех выделенных ОТЕ; приведены значения десятичного логарифма от доли рода). На схеме справа приведены роды, относительная доля которых увеличивается при внесении хитина. a – современная каштановая почва; b ‒ современная каштановая почва; инкубированная с хитином; c – почва, погребенная 3500 л. н.; d ‒ почва, погребенная 3500 л. н., инкубированная с хитином; e ‒ почва, погребенная 3500 л. н.; f ‒ почва, погребенная 4500 л. н., инкубированная с хитином; j – многолетнемерзлый грунт; h ‒ многолетнемерзлый грунт, инкубированный с хитином. Роды: 1 – Saccharothrix, 2 – Corynebacterium, 3 – Agromyces, 4 – Rhodococcus, 5 – Streptomyces, 6 – Euzebya, 7 – Rubrobacter, 8 – Chitinophaga, 9 – Sediminibacterium, 10 – Bacillus, 11 – Brevibacillus, 12 – Paenibacillus, 13 – Bacillus (rRNA group 2), 14 – Paenisporosarcina, 15 – Solibacillus, 16 – Staphylococcus, 17 – Clostridium, 18 – Coprococcus, 19 – Sedimentibacter, 20 – Mycoplana, 21 – Phenylobacterium, 22 – Devosia, 23 – Rhodoplanes, 24 – Rhizobium, 25 – Kaistobacter, 26 – Sphingobium, 27 – Sphingomonas, 28 – Achromobacter, 29 – Schlegelella, 30 – Variovorax, 31 – Cupriavidus, 32 – Janthinobacterium, 33 – Peredibacter, 34 – Halomonas, 35 – Acinetobacter, 36 – Pseudomonas, 37 – Steroidobacter, 38 – Lysobacter, 39 – Thermomonas.
Прокариотное сообщество многолетнемерзлых грунтов отличаются по родовому составу от рассматриваемых погребенных каштановых почв. Так, доминирующим родом в образцах грунтов становится Sediminibacterium, необнаруженный в почвенных образцах (рис. 2). В вариантах с добавлением биополимера хитина гидролитической активностью обладали роды Clostridium, Sedimentibacter, Rhodoplanes, Cupriavidus, отсутствовавшие в почвенных образцах. Роды Clostridium, Sedimentibacter, Rhodoplanes являются облигатными анаэробами [25].
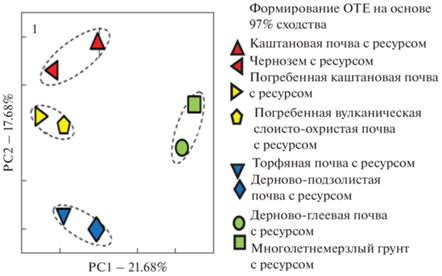
Рис. 2.
Анализ методом главных компонент с применением метрики Брея–Кертиса структуры прокариотных сообществ исследуемых образцов с добавлением субстратов (биополимера хитина или углеводородов).
Ранее исследовали биоразнообразие прокариотного комплекса современных почв в условиях микрокосмов (чернозема, серой лесной и каштановой почв) до и после их загрязнения углеводородами. Установлено, что при внесении субстрата альфа-разнообразие уменьшалось за счет выхода в доминанты определенных родов – автохтонной микрофлоры, специфичной для определенных условий [30]. Установлено уменьшение микробного разнообразия и смена метаболически активных доминантов – представителей доменов Bacteria и Archaea в микрокосмах, загрязненных нефтью, по сравнению с контрольными образцами в процессе микробной сукцессии. В опытных образцах исследуемых почв, загрязненных углеводородами, выявлено формирование специфического комплекса бактерий и архей. Определены метаболически активные и неактивные в отношении нефтяного загрязнения представители почвенного прокариотного комплекса. Эти результаты опубликованы ранее [30].
Определено формирование специфического комплекса бактерий с доминантами определенных родов автохтонной микрофлоры, различающихся в зависимости от типа почв. Для образцов нефтезагрязненных почв южных широт доминирующая роль принадлежала представителям актинобактерий, для почв центральной и северной широт – протеобактериям. Среди актинобактерий в этих вариантах опыта доминировали представители следующих групп: субкласс Rubrobacteridae (роды Gaiella, Solirubrobacter); субкласс Actinobacteridae (субпорядок Propinobacterineae (Nocardiodes, Kribella); Micromonosporineae (Catelliglobosispora, Micromonospora); Corynebacterineae (Rhodococcus); Pseudonocardineae (Pseudonocardia); Micrococcinea (Cellulomonas, Agromyces); Streptomycineae (Streptomyces); Streptosporangineae (Thermomonosporaceae, Streptosporangium)). Отметим, что многие представители родов Ilumatobacter, Aciditerrimonas, принадлежащих группе актинобактерий, обнаруженных в исследуемых образцах с нефтью, способны расти в анаэробных условиях и обладают термо- и ацидофилией [39].
Структура бактериального комплекса в загрязненном нефтью торфе изменялась по сравнению с контрольной почвой [30]. Доля филума Proteobacteria возрастала до 50% от всех выявляемых бактерий (ранее опубликованные данные) [30]. Среди протеобактерий обнаружены альфа-, гамма- и бета-протебактерии. Стоит отметить, что увеличение количества протеобактерий происходит за счет появления видов, которые не встречались в незагрязненной почве, например Sulfuritalea, принадлежащим к Betaproteobacteria семейству Sterolibacteriaceae. Данный организм является хемолитоавтотрофом, окисляющим тиосульфаты, серу и водород [12]. Согласно литературным источникам, его используют для деградации ароматических соединений, в частности, для анаэробного разложения бензоатов и фенилацетатов [13].
Анализ бета-разнообразия методом главных компонент с применением метрики Брея–Кертиса на уровне сходства 97% достоверно разделил доминанты гидролитического сообщества между исследуемыми образцами на четыре кластера: современные почвы южных широт (каштановая, чернозем), современные почвы северной и центральной частей России (дерново-подзолистая, торфяная), погребенные почвы и многолетнемерзлые грунты (рис. 2). Такое разделение указывало на то, что при внесении ресурса (биополимера хитина или углеводорода нефти) доминанты гидролитического сообщества различались между образцами современных почв, принадлежащих разным климатическим зонам, реликтовыми почвами и грунтами, следовательно, тип почвы и экологические факторы оказывали координирующее влияние на развитие доминантных компонентов гидролитического комплекса.
Таким образом, определено формирование специфического комплекса бактерий с доминантами определенных родов автохтонной микрофлоры, различающихся в зависимости от типа почв, который в свою очередь оказывает координирующее влияние на развитие доминантных компонентов гидролитического комплекса.
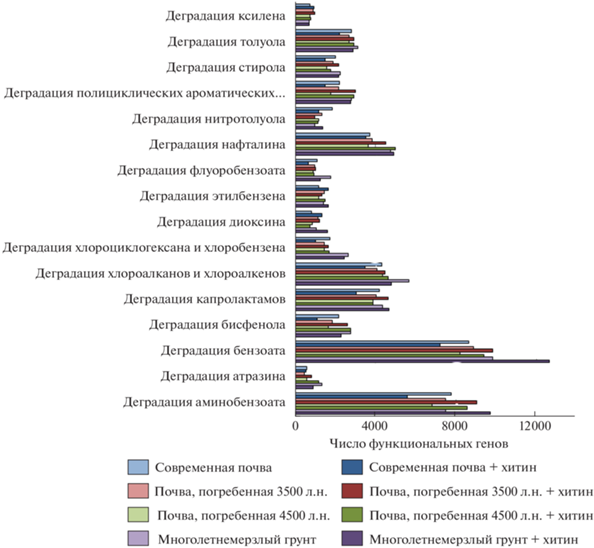
При анализе функционального генетического разнообразия прокариотного сообщества выявлено, что количество генов, маркирующих способность сообщества к биодеградации ксенобиотиков, выше в погребенных почвах и многолетнемерзлых грунтах по сравнению с современными почвами (рис. 3). Уровень метаболизма ксенобиотиков повышается от современных почв к многолетнемезлым грунтам. Это касается таких ксенобиотиков, как толуол, стирол, полициклические ароматические углеводороды, нафталин, флуоробензоат, диоксин, хлороциклогексан, хлорбензен, хлоралканы и хлоралкены, капролактамы, бисфенолы, бензоат, атразин и аминобензоат. Увеличение интенсивности разложения ксенобиотиков отмечали И.П. Соляникова с соавт. [4]. Показано, что при переводе штамма Pseudomonas fluorescens в покоящееся состояние и последующем выводе из него происходило выщепление фенотипов, характеризовавшихся большей скоростью роста на ароматических субстратах. Поскольку известным является факт, что для биоремедиации целесообразно использовать не отдельные штаммы бактерий-деструкторов, а активные ассоциации, следовательно погребенные местообитания могут иметь биотехнологический потенциал для ремедиации загрязнений ксенобиотиками.
Установлено, что потенциальная активность, измеренная по относительному отклику при внесении субстрата, микробного гидролитического сообщества возрастает в ряду от современной к палеовулканической почве. Внесение ресурса-субстрата увеличивает долю генов, ответственных за деградацию ксенобиотиков. Например, при внесении полисахарида (хитина) увеличивается количество генов, ответственных за деградацию полициклических ароматических углеводородов. Стоит заметить, что присутствие функционального гена не обязательно означает его активность, однако позволяет говорить о потенциальной возможности к осуществлению процессов, кодируемых данными генами. Наибольшее число функциональных генов, маркирующих процессы биодеградации ксенобиотиков, обнаружено в образцах многолетнемерзлых грунтов, что говорит о высоком биотехнологическом потенциале реликтовых микробных сообществ.
Многие незамещенные ароматические углеводороды (бензол, нафталин) расщепляются бактериями до катехола или прокатеховой кислоты. Бензоат является центраболитом деградации многих ароматических углеводородов. В рассматриваемых сообществах почв, перечисленных в табл. 1, присутствовали бактерии, обладающие двумя ключевыми ферментами пути аэробной деградации бензоата, которые катаболизируют бензоат до катехола.
При разрыве ароматического кольца в метарасщеплении участвуют ферменты катехол-2,3-диоксигеназа, 1,2-гидроксинафталиндиоксигеназа, которые кодируются соответствующими генами: xylE [22], nahC [22] и dmpB [11], ответственными за преобразование субстратов в полуальдегиды, которые при дальнейшей трансформации образуют пируваты, ацетальдегиды, оксалоацетаты, фумараты, сукцинаты и иные вещества, вовлекаемые в промежуточный метаболизм. У бактериальных сообществ предсказано наличие всех ферментов катаболизма катехола, как до сукцинил-КоА, так и до пирувата/ацетил-КоА. В сообществах дерново-подзолистой и торфяной почв за деградацию бензоата отвечали представители Alphaproteobacteria родов Sphingomonas, Bradyrhizobium и Pseudolabrys.
При исследовании загрязненных современных дерново-подзолистых почв на территориях угледобывающего завода или под нефтяными скважинами с использованием количественного анализа qPCR числа копий функциональных генов nahC, xylE показано, что наибольшее их содержание (5.4, 4.2 мкг ДНК/г почвы соответственно) обнаружено в образцах, отобранных непосредственно на территории завода, и уменьшалось по мере удаления от него (рис. 4а, 4b). Схожие закономерности прослеживались для почвенных образцов, отобранных как под лесом, так и под лугом.
Рис. 4.
Содержание копий гена (мкг ДНК/г) nahC (а) и xylE (б) в исследуемых образцах дерново-подзолистой почвы.
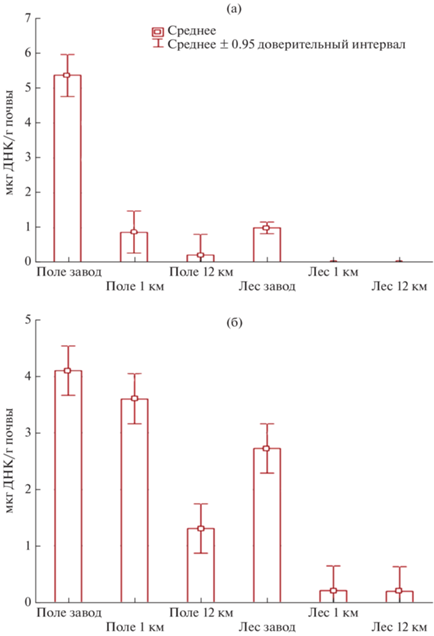
Исследования проводили в разные сроки загрязнения поллютантом. В образцах чернозема с длительным сроком воздействия углеводородов (более 7 лет) отмечалось наибольшее содержание исследуемых генов xylE 18 × 103 копий/мл, тогда как в контрольных, незагрязненных вариантах – их наименьшее содержание 6 × 103 копий/мл. В вариантах свежего нефтяного разлива обнаружено повышенное содержание копий функциональных генов по сравнению с контролем, что может говорить об активной работе метаболически активного микробиологического сообщества, способного к деструкции углеводородов. Анализ современной литературы свидетельствует о высоком микробном потенциале деструкции нефти в почве, который катастрофически снижается из-за формирования анаэробных условий в результате промышленного разлива нефти и нефтепродуктов.
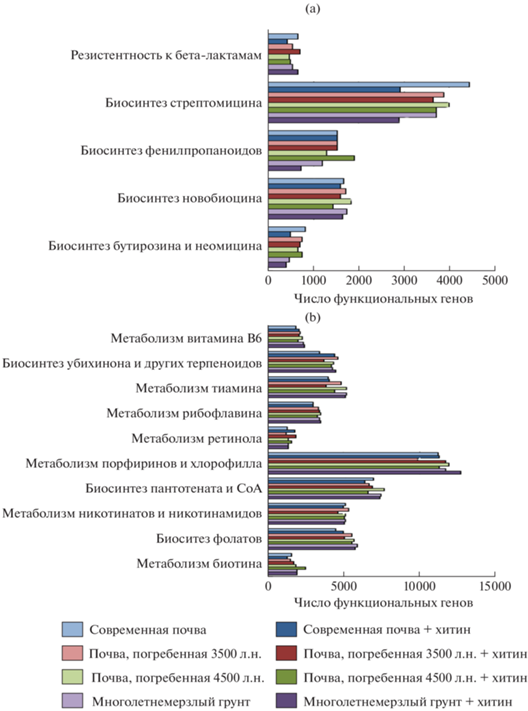
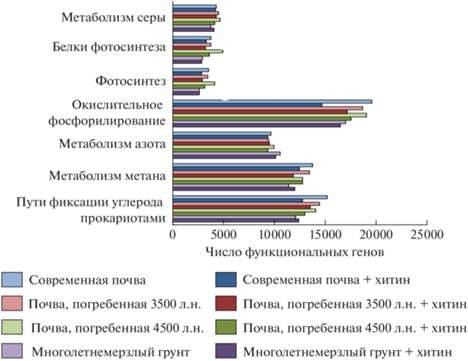
Биосинтез вторичных метаболитов, к которым относятся такие антибиотики, как стрептомицин, новобиоцин, бутирозин, неомицин снижается в ряду от современных почв к многолетнемерзлым грунтам (рис. 5a). Биосинтез антибиотиков группы тетрациклина и ванкомицина примерно одинаков во всех образцах. Несмотря на то, что ранее выявлено, что штаммы, выделенные из многолетнемерзлых грунтов, обладают большей антибиотикоустойчивостью [3], количество генов, кодирующих резистентность к бета-лактамам, в исследуемых образцах не различалось. Уровень метаболизма кофакторов и витаминов в целом повышается в ряду от современных почв к многолетнемерзлым грунтам (рис. 5b). Метаболизм липидов слабо различается между образцами, однако в образцах многолетнемерзлых грунтов повышен синтез глицерофосфолипидов и метаболизм жирных кислот.
Количество генов, кодирующих фотосинтез и окислительное фосфорилирование, закономерно снижалось при переходе от современных почв к погребенным и от погребенных к многолетнемерзлым породам.
Обращает внимание количество генов, кодирующих превращения азота, которое повышено в многолетнемерзлых породах (рис. 6). Показано наличие ряда ключевых генов цикла азота (nifH, amoA, nirK) как в современном, так и погребенном горизонтах исследуемых почв. Наличие копий гена nifH бактерий азотфиксаторов, способных обеспечить систему азотом, можно рассматривать как один из этапов самовосстановления почв.
Рис. 6.
Основные метаболические процессы, осуществляемые микробными сообществами исследуемых почв и грунтов.
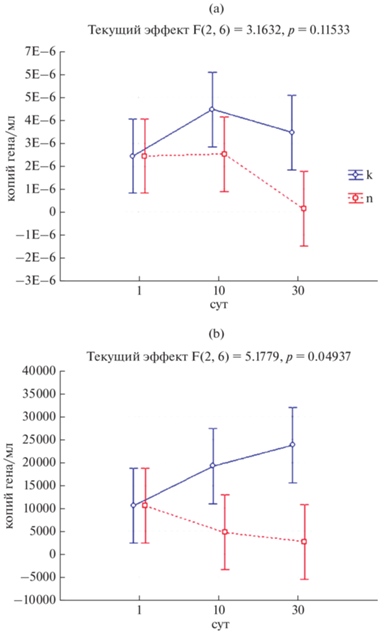
В современных почвах количетсво генов, отвечающих за возможность фиксации молекулярного азота из воздуха, было больше по сравнению с погребенными и достигало 4.54 × 106 копий гена/г почвы, для погребенного горизонта 2.5 × 104 копий гена/г почвы (рис. 7). Внесение субстрата как в погребенную, так и в современную почвы снижало содержание генов nifH. Такую особенность можно объяснить наличием в почве с полимерами (особенно хитином) доступных для микроорганизмов форм азота, что приводит к интенсификации процессов минерализации и снижению нитрогеназной активности. Важно отметить присутствие, хотя и незначительное, гена nifH в более глубоких слоях почвы, что указывает на возможный потенциал обитающих там микробных сообществ. Экстремальные среды обитания являются ценным источником ферментов, применимых в прикладных и промышленных областях [8]. На сегодняшний день известны прокариоты, выделенные из экстремальных сред, синтезирующие широкий спектр органических кислот, продуцирующие молекулярный водород, способные к фиксации атмосферного азота в условиях значительно отличающихся от принятых для этих процессов оптимумов, что позволяет вовлекать эти организмы в процессы ремедиации и промышленного синтеза различных веществ [8].
Рис. 7.
Динамика присутствия гена nifH в современном (a) и погребенном горизонтах (b) вулканической перегнойно-охристой почвы с добавлением субстратов (n) и в контроле (k). F – критерий Фишера (отношение выборочных дисперсий), p – значение. Для каждого значения представлены средние величины и стандартные отклонения. 0.95 доверительный интервал.
В последние годы интенсивно изучаются архейные сообщества почв, осуществляющие окисление аммония [9], что изменило представления о микробных процессах трансформации азота в почвах. В параллельной серии опытов проведена амплификация ключевого гена нитрификации. Для вулканических почв (как современных, так и погребенных) удалось выявить наличие генов аммоний окисляющих бактерий и архей. Следует отметить увеличение концентрации гена в погребенных образцах к 30 сут сукцессии в контрольных вариантах и варианте с нефтью, что указывает на реактивацию нитрификаторов к концу сукцессии. Динамика присутствия гена amoA в современном горизонте вулканической перегнойно-охристой почвы демонстрирует увеличение его концентрации в бактериальном комплексе в вариантах с нефтью (2.3 × 107 копий ДНК/г почвы) к 10 сут сукцессии. В контроле отмечены низкие содержания гена. В архейном комплексе отмечается увеличение концентрации гена в контрольном варианте к 30 сут (2.5 × 106 копий ДНК/г почвы), в то время как в варианте с нефтью показатели остаются очень низкими. На основании полученных данных можно сделать вывод, что в почвах без внесения нефти (ненарушенное сообщество) ведущую роль в процессе нитрификации играют археи. Аналогичные результаты получены в работах [9, 16, 33]. Бактериальный комплекс способен к нитрификации при высоком загрязнении почвы нефтью, а также его роль возрастает в нижних слоях почвенного профиля. Вклад архей в процесс нитрификации уменьшается при внесении нефти, а также уменьшается с глубиной.
В ходе сукцессии в образцах вулканической перегнойно-охристой почвы обнаружены копии гена nirK, использующиеся в качестве молекулярного маркера денитрификации, во всех вариантах опыта (контроль, нефть). Абсолютные значения были наибольшими в современном горизонте (1.25 × 107 копий ДНК/г.п.), в погребенном горизонте они были ниже на два порядка (1.2 × 105 копий ДНК/г.п.).
ЗАКЛЮЧЕНИЕ
В процессе исследований для характеристики биотехнологического потенциала микробного комплекса оценено разнообразие прокариотной составляющей почвенного микробного сообщества; выявлена способность почвенных систем к процессам, направленным на деструкцию труднодоступных соединений, трансформацию окисленных и восстановленных форм азота, определено наличие функциональных генов у микроорганизмов, способных к метаболической активности в почвах, различающихся параметрами основных экологических факторов.
Установлено формирование специфического комплекса бактерий с доминантами определенных родов автохтонной микрофлоры, различающихся в зависимости от типа почв, который в свою очередь оказывает координирующее влияние на развитие доминантных компонентов гидролитического комплекса.
При анализе функционального генетического разнообразия бактериального сообщества (методом восстановления полного метагенома по данным высокопроизводительного секвенирования) установлено, что количество генов, маркирующих способность сообщества к биодеградации ксенобиотиков, кодирующих превращения азота и уровень метаболизма кофакторов и витаминов, больше в реликтовых образцах по сравнению с современными. Показано, что инициация системы ресурсом увеличивает долю генов, ответственных за деградацию ксенобиотиков. Например, при внесении полисахарида повышалось количество генов, ответственных за деградацию полициклических ароматических углеводородов. Стоит отметить, что присутствие функционального гена не обязательно означает его активность, однако позволяет говорить о потенциальной возможности к осуществлению процессов, кодируемых данными генами.
По данным сравнительного количественного анализа генов из разных типов исследуемых почв сделан вывод, что архейные сообщества являются самой многочисленной группой аммоний окисляющих прокариот в почвах. Интерес к исследованию этой группы организмов определяется не только важнейшей ролью нитрификации в азотном цикле почв, но и решением практических вопросов, например, доступностью азота в условиях пониженной концентрации кислорода. Результаты исследований позволят разработать новые подходы биоремедиации почв от загрязнения углеводородами.
Предположительно, доминанты древних гидролитических прокариотных сообществ могут обладать большей активностью по сравнению с их коллекционными аналогами. Из погребенных образцов выделены штаммы бактерий, обладающие высокой гидролитической активностью, которые в дальнейшем могут быть использованы для биотехнологических целей (например, для создания биопрепаратов при борьбе с фитопатогенами).
Выявленные закономерности указывают на высокий метаболический потенциал прокариотного компонента рассматриваемых объектов и открывают возможности для биотехнологического использования штаммов, выделенных из погребенных почв и многолетнемерзлых грунтов.
Список литературы
Добровольская Т.Г., Головченко А.В., Юрченко Е.Н., Якушев А.В., Манучарова Н.А., Лысак Л.В., Костина Н.В. Структура и функции бактериальных сообществ регрессивных пятен верхового торфяника. Микробиология. 2020. Т. 89. № 1. С. 111–120. https://doi.org/10.31857/S0026365620010061
Кольцова Е.М. Cтруктурно-функциональная характеристика гидролитической составляющей реликтовых прокариотных сообществ. Дис. … канд. биол. наук. М., 2017. 139 с.
Кряжевских Н.А., Демкина Е.В., Лойко Н.Г., Баслеров Р.В., Колганова Т.В., Соина В.С., Манучарова Н.А., Гальченко В.Ф., Эль-Регистан Г.И.Сравнение адаптационного потенциала изолятов из вечномерзлых осадочных пород Arthrobacter oxydans и Acinetobacter lwoffii и их коллекционных аналогов // Микробиология. 2013. Т. 82. № 1. С. 27–41. https://doi.org/10.7868/S0026365613010059
Соляникова И.П., Сузина Н.Е., Мулюкин А.Л., Эль-Регистан Г.И., Головлева Л.А. ВлияниесостоянияпокоянаштаммPseudomonas fluorescens 26K – деструкторксенобиотиков // Микробиология. 2013. Т. 82. № 5. С. 552. https://doi.org/10.7868/S0026365613050145
Феофилова Е.П. Торможение жизненной активности как универсальный биохимический механизм адаптации микроорганизмов к стрессовым воздействиям // Прикладная биохимия и микробиология. 2003. Т. 39. № 1. С. 5–24. https://doi.org/10.1023/A:1021774523465
Эль-Регистан Г.И. Покой как форма адаптации микроорганизмов // Механизмы выживания бактерий. М.: Медицина, 2005. С. 11–142. https://search.rsl.ru/ru/record/01002681279
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. № 4. С. 446–456. https://doi.org/10.1134/S0026261706040035
Abraham W.R., Nogales B., Golyshin P.N., Pieper D.H., Timmis K.N. Polychlorinated biphenyl-degrading microbial communities in soils and sediments // Curr. Opin. Microbiol. 2002. V. 5. № 3. P. 246–53. https://doi.org/10.1016/s1369-5274(02)00323-5
Adair K.L. Schwartz E. Evidence that ammonia-oxidizing archaea are more abundant than ammonia-oxidizing bacteria in semiarid soils of northern Arizona, USA // Microb. Ecol. 2008. V. 56. P. 420–426. https://doi.org/10.1007/s00248-007-9360-9
Anderson M.J. A new method for non-parametric multivariate analysis of variance // Austral. Ecol. 2001. V. 26. P. 32–46. https://www.pelagicos.net/MARS6300/homework/hw6/ Anderson_2001.pdf
Bartilson M., Nordlund I., Shingler V. Nucleotide sequence and expression of the catechol 2,3-dioxygenaseencoding gene of phenol catabolizing Pseudomonas CF600 // Gene. 1989. V. 85. P. 233–238. https://doi.org/10.1016/0378-1119(89)90487-3
Boden R., Hutt L.P., Rae A.W. Reclassification of Thiobacillusaquaesulis (Wood & Kelly, 1995) as Annwoodiaaquaesulis gen. nov., comb. nov., transfer of Thiobacillus (Beijerinck, 1904) from the Hydrogenophilales to the Nitrosomonadales, proposal of Hydrogenophilalia class. nov. within the 'Proteobacteria', and four new families within the orders Nitrosomonadales and Rhodocyclales // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 1191–1205. https://doi.org/10.1099/ijsem.0.001927
Bray J.R., Curtis J.T. An Ordination of the Upland Forest Communities of Southern Wisconsin // Ecol. Monogr. 1957. V. 27. № 4. P. 325–349. https://doi.org/10.2307/1942268
Bürgmann H., Widmer F., Sigler W.V., Zeyer J. mRNA extraction and reverse transcription-PCR protocol for detection of nifH gene expression by Azotobacter vinelandii in soil // Appl. Environ. Microbiol. 2003. V. 69. P. 1928–1935. https://doi.org/10.1128/AEM.69.4.1928-1935.2003
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N. et al. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. № 5. P. 335–336. https://doi.org/.1038/nmeth.f.303
Chen J., Del Genio A.D., Carlson B.E., Bosilovich M.G. The spatiotemporal structure of twentieth-century climate variations in observations and reanalyses. P. I: Long-term trend // J. Climate. 2008. V. 21. P. 2611–2633. https://doi.org/10.1175/2007JCLI2011.1
DeSantis T.Z., Hugenholtz P., Larsen N., Rojas M., Brodie E.L., Keller K., Huber T. et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB // Appl. Environ. Microbiol. 2006. V. 72. № 7. P. 5069–5072. https://doi.org/10.1128/AEM.03006-05
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. № 19. P. 2460-1. https://doi.org/10.1093/bioinformatics/btq461
Faith D.P., Baker A.M. Phylogenetic diversity (PD) and biodiversity conservation: some bioinformatics challenges // Evol. Bioinform. Online. 2006. V. 2. P. 121–128. https://doi.org/10.4137/ebo.s0
Gaby J.C., Buckley D.H. A comprehensive aligned nifH gene database: a multipurpose tool for studies of nitrogen-fixing bacteria // Database (Oxford). 2014. V. 2014. P. bau001. https://doi.org/10.1093/database/bau001
Hallin S., Jones C. M., Schloter M., Philippot L. Relationship between n-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment // ISME J. 2009. V. 53. P. 597–605. https://doi.org/10.1038/ismej.2008.128
Harayama S., Rekik M. Bacterial aromatic ring cleavage enzymes are classified into two different gene families // J. Biol. Chem. 1989. V. 264. P. 15328–15333. https://www.jbc.org/article/S0021-9258(19)84830-5/pdf
Hendrickx B., Junca H., Vosahlova J., Lindner A., Ruegg I., Bucheli-Witschel M., Faber F. et al. Alternative primer sets for PCR detection of genotypes involved in bacterial aerobic BTEX degradation: Distribution of the genes in BTEX degrading isolates and in subsurface soils of a BTEX contaminated industrial site // J. Microbiol. Methods. 2006. V. 64. P. 250–265. https://doi.org/10.1016/j.mimet.2005.04.018
Henry S., Baudouin E., López–Gutiérrez J.C., Martin–Laurent F., Brauman A., Philippot L. Quantification of denitrifying bacteria in soils by nirK gene targeted real-time PCR // J. Microbiol. Methods. 2004. V. 59. P. 327–335. https://doi.org/10.1016/J.MIMET.2004.07.002
Hiraishi A., Ueda Y. Rhodoplanes gen. nov., a new genus of phototrophic bacteria including Rhodopseudomonasrosea as Rhodoplanesroseus comb. nov. and Rhodoplaneselegans sp. nov. // Int. J. Syst. Bacteriol. 1994. V. 44. P. 665–673. https://doi.org/10.1099/00207713-44-4-665
Kanehisa M., Goto S., Sato Y., Furumichi M., Tanabe M. KEGG for integration and interpretation of large-scale molecular data sets // Nucleic Acids Res. 2012. V. 40. Database issue. P. 109–114. https://doi.org/10.1093/nar/gkr988
Kaprelyants A.S., Mukamolova G. V., Davey H.M., Kell D.B. Quantitative analysis of the physiological heterogeneity within starved cultures of Micrococcus luteus by flow cytometry and cell sorting // Appl. Environ. Microbiol. 1996. V. 62. № 4. P. 1311–1316. https://doi.org/10.1128/aem.62.4.1311-1316.1996
Kok M., Oldenhuis R., van der Linden M. P. G., Raatjes P., Kingma J., van Lelyveld P.H. The Pseudomonas oleovorans alkane hydroxylase gene, sequence and expression // J. Biological Chem. 1989. V. 264. P. 5435–5441. https://doi.org/10.1016/S0021-9258(18)83564-5
Langille M., Zaneveld J., Caporaso J.G., McDonald D., Knights D., Reyes J., Clemente J., Burkepile D. et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences // Nat. Biotechnol. 2013. V. 31. № 9. P. 814–821. https://doi.org/10.1038/nbt.2676
Manucharova N.A., Ksenofontova N.A., Belov A.A., Kamenskiy N.N., Arzamazova A.V., Zenova G.M., Kinzhaev R.R., Trofimov S.Y., Stepanov A.L. Prokaryotic component of oil-contaminated oligotrophic peat soil under different levels of mineral nutrition: biomass, diversity, and activity // Eurasian Soil Science. 2021. V. 54. № 1. P. 89–97. https://doi.org/10.31857/s0032180x2101010x
Markowitz V.M., Chen I.-M.A., Palaniappan K., Chu K., Szeto E., Grechkin Y., Ratner A. et al. IMG: the Integrated Microbial Genomes database and comparative analysis system // Nucleic Acids Res. 2012. V. 40. Database issue. P. D115-22. https://doi.org/10.1093/nar/gkr1044
McIlroy S.J., Nielsen P.H. The Prokaryotes / Eds E. Rosenberg et al. Berlin: Springer, 2014. P. 863–889. https://doi.org/10.1007/978-3-642-39044-9
Nichols D., Lewis K., Orjala J., Mo S., Ortenberg R., O’Connor P., Zhao C., Vouros P., Kaeberlein T., Epstein S.S. Short peptide induces an “uncultivable” microorganism to grow in vitro // Appl. Environ. Microbiol. 2008. V. 74. № 15. P. 496. https://doi.org/10.1128/AEM.00393-08
Pantanella F., Berlutti F., Passariello C., Sarli S., Morea C., Schippa S.Violacein and biofilm production in Janthinobacteriumlividum // J. Appl. Microbiol. 2007. V. 102. № 4. P. 992–999. https://doi.org/10.1111/j.1365-2672.2006.03155.x
Price M.N., Dehal P.S., Arkin A.P. FastTree 2 – Approximately Maximum-Likelihood Trees for large alignments // PLoS One. 2010. V. 5. № 3. P. e9490. https://doi.org/10.1371/journal.pone.0009490
Rotthauwe J., Witzel K. The ammonia monooxygenase structural gene amoA as a functional marker: Molecular fine-scale analysis of natural ammonia-oxidizing populations // Appl. Environ. Microbiol. 1997. V. 63. P. 4704–4712. https://doi.org/10.1128/aem.63.12.4704-4712.1997
Somanadhan B., Kotturi S.R., Yan Leong C., Glover R.P., Huang Y., Flotow H., Buss A.D., Lear M.J., Butler M.S. Isolation and synthesis of falcitidin, a novel myxobacterial-derived acyltetrapeptide with activity against the malaria target falcipain-2 // J. Antibiot. (Tokyo). 2013. V. 66. № 5. P. 259–264. https://doi.org/10.1038/ja.2012.123
Su X., Chen X., Hu J., Shen C., Ding L. Exploring the potential environmental functions of viable but non-culturable bacteria // World J. Microbiol. Biotechnol. 2013. V. 29. № 12. P. 2213–2218. https://doi.org/10.1007/s11274-013-1390-5
Takashi Itoh, Kaoru Yamanoi, Takuji Kudo, Moriya Ohkuma, Tomonori Takashina. Aciditerrimonas ferrireducens gen. nov., sp. nov., an iron-reducing thermoacidophilic actinobacterium isolated from a solfataric field // Int. J. Systematic Evolutionary Microbiol. 2011. V. 61 P. 1281–1285. https://doi.org/10.1099/ijs.0.023044-0
Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naive Bayesian Classifier for Rapid Assignment of rRNA Sequences into the New Bacterial Taxonomy // Appl. Environ. Microbiol. 2007. V. 73. № 16. P. 5261–5267. https://doi.org/10.1128/AEM.00062-07
Whyte L.G., Schultz A., van Beiden J.B., Luz A.P., Pellizari V., Labbé D., Greer C.W. Prevalence of alkane monooxygenase genes in Arctic and Antarctic hydrocarbon-contaminated and pristine soils // FEMS Microbiol. Ecol. 2002. V. 41. P. 141–150. https://doi.org/10.1111/j.1574-6941.2002.tb00975.x
Дополнительные материалы отсутствуют.