Почвоведение, 2023, № 6, стр. 730-744
Обилие и разнообразие микроорганизмов в почвах и сопряженных субстратах (опаде и “подвешенной почве”) некоторых заповедников Вьетнама
А. В. Князева a, b, *, Л. В. Лысак a, **, Е. В. Лапыгина a, А. В. Александрова a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Пущино, пр-т Науки, 5, Россия
* E-mail: aknyazeva1999@gmail.com
** E-mail: lvlysak@mail.ru
Поступила в редакцию 18.10.2022
После доработки 26.12.2022
Принята к публикации 28.12.2022
- EDN: FPMROX
- DOI: 10.31857/S0032180X22601323
Аннотация
Проведено комплексное исследование почвенного прокариотного сообщества зональных ферралитных и интразональных аллювиальных почв Вьетнама, а также сопряженных с ними растительного опада и “подвешенной почвы” из корзинок эпифитных папоротников. Наибольшая численность бактерий, определенная прямым люминесцентным методом, отмечена в образцах ферралитных почв (5.59 млрд кл./г), тогда как длина грибного (2038 м/г) и актиномицетного мицелия (1086 м/г) была наибольшей в аллювиальных почвах. В среднем, наибольшие показатели общей численности и длины актиномицетного и грибного мицелия зарегистрированы в горных ферралитных почвах. Актинобактерии, в частности бактерии рода Streptomyces, вносят значительный вклад в деструкцию растительного материала. В прокариотном сообществе зональной красно-желтой гумусно-ферралитной почвы преобладали бактерии филумов Firmicutes (80%) и Proteobacteria (15%), в образце “подвешенной почвы” – филумы Proteobacteria (51%), Actinobacteria (38%). Значительно меньше представлены филумы Chloroflexi, Acidobacteria, Bacteroidetes и Cyanobacteria. При значительных различиях на уровне родов в исследованных субстратах выделены следующие функциональные группировки микроорганизмов: деструкторы ксенобиотиков, бактерии цикла азота, экстремофилы, а также бактерии-ингибиторы роста микромицетов. Метаболически активная часть прокариотного сообщества, представленная филумами Proteobacteria, Actinobacteria и Acidobacteria, была наибольшей в “подвешенной почве”, меньшей – в опаде и горизонте А красно-желтой гумусно-ферралитной почвы, что соотносилось с высокой численностью этих филумов и значительным таксономическим разнообразием бактерий в этом локусе. Функциональные гены: nifH – ген, кодирующий субъединицу нитрогеназы, и alkB, кодирующий алкан гидроксилазу – детектированы во всех исследованных субстратах. Численность копий функциональных генов была наибольшей в образце “подвешенной почвы”, что делает этот локус перспективным для выделения штаммов с высоким биотехнологическим потенциалом.
ВВЕДЕНИЕ
Почвоведение, как наука, изучающая почву в виде самостоятельного обособленного природного тела, охватывает широкий спектр вопросов, связанных с ее генезисом, распространением и использованием. Почва является не только корнеобитаемым слоем земной поверхности, но и представляет собой место обитания, питания, развития и размножения многих микроорганизмов. Наибольшее разнообразие почвенных прокариот приурочено к субтропической и тропической зоне, а именно муссонным тропическим лесам Южной Америки, Африки и Юго-Восточной Азии [23]. Изучение микробных сообществ целинных почв представляется важным из-за усиливающейся разнообразной антропогенной нагрузки на природные биогеоценозы. Одним из лидеров по темпам развития экономики на территории Юго-Восточной Азии является Вьетнам, который представляет собой аграрное государство с развивающимся промышленным сектором. Значительные площади земельного фонда страны в XX в. подвергались сильнейшему антропогенному воздействию, поэтому изучение разнообразия почвенных организмов с целью сохранения сообществ в ненарушенных почвах заповедников и национальных парков представляется актуальным.
Одной из наиболее широко обследованных особо охраняемых природных территорий (ООПТ) Вьетнама является заповедник Донг Най и его сектор национальный парк Кат Тьен. На протяжении всего XX в. заповедник Донг Най подвергался антропогенному воздействию: в течение Американско-Вьетнамской войны на территории национального парка Кат Тьен были неоднократно применены дефолианты и обработка территории напалмовым огнем, затем значительная часть оставшихся лесов была подвергнута очистительной вырубке. Только в конце столетия флора национального парка начала возвращаться к исходному состоянию за счет интенсивных лесовосстановительных мероприятий [5, 9, 23]. Большая часть исследований биологической направленности в последние 10 лет проводится именно на территории биосферного заповедника Донг Най ввиду высокого биологического разнообразия и обилия местообитаний различных организмов, в частности микроскопических грибов и актиномицетов, тогда как другие ООПТ Вьетнама изучены в гораздо меньшей степени [1, 6, 8, 17]. Практически не проводились микробиологические исследования почв и сопряженных субстратов, включающие как классические (посев на питательные среды, учет численности и биомассы отдельных групп микроорганизмов прямым микроскопическим методом), так и современные молекулярные методы (анализ таксономического разнообразия на основании баркодинга гена 16SрРНК, RT-ПЦР, FISH) микробиологии, на других ООПТ Вьетнама.
Цель работы – получение комплексной характеристики прокариотных сообществ зональных и интразональных почв и сопряженных субстратов ООПТ Вьетнама на основании классических и современных методов микробной экологии.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили на территории заповедников и национальных парков: Бинь Чау Фуок Буу, Сонгхинь, Кон Тю Ранг, Донгнай, Сонгтхань, а также экологической станции Тропического центра Дамбей. Объектами исследования служили образцы зональных (красно-желтых гумусно-ферралитных) и интразональных (аллювиальных) почв и сопряженных субстратов (растительный опад на поверхности почвы), а также “подвешенная почва” из корзинок эпифитных папоротников на стволах деревьев. Координаты точек отбора образцов, типы почв и экотопы, сформированные в данных точках, представлены в табл. 1.
Таблица 1.
Экотопы и типы почв в местах отбора образцов
| ООПТ | Точка пробоотбора (координаты; высота) | Почва (авторские названия) | Почва (WRB) |
|---|---|---|---|
| Зональные почвы | |||
| Природный заповедник Кон Тю Ранг | Широколиственный лес на хребте (14.472191° N, 108.547049° E, 1000 м) | Горная красно-желтая гумусно-ферралитная (ГКжГферр) | Skeletic Ferralsol (Humic) |
| Низкогорный широколиственный лес (14.514043° N, 108.571246° E, 1025 м) | Красно-желтая гумусно-ферралитная (КжГферр) | Ferralsol (Humic) | |
| “Подвешенная почва” | Suspended soil | ||
| Охраняемый лес Сонгхинь | Низкогорный полидоминантный лес на хребте (12.789184° N, 109.013610° E, 800 м) | Горная красно-желтая гумусно-ферралитная (ГКжГферр) | Skeletic Ferralsol (Humic) |
| Национальный парк Пу Мат | Полидоминантный лес в долине реки Кхе Чоанг (18.955816° N, 104.685032° E, 200 м) | Красно-желтая ферралитная (КжФерр) | Haplic Ferralsol |
| Природный заповедник Сонгтхань | Горный полидоминантный лес на хребте (15.57974° N, 107.379022° E, 960 м) | Горная красно-желтая гумусно-ферралитная (ГКжГферр) | Skeletic Ferralsol (Humic) |
| “Подвешенная почва” | Suspended soil | ||
| Интразональные почвы | |||
| Охраняемый лес Сонгхинь | Переувлажненный лес в долине реки (12.816058° N, 109.001590° E, 220 м) | Аллювиальная луговая кислая (АлЛуг) | Fluvisol (Arenic) |
| Природный заповедник Бинь Чяу Фуок Буу | Долинный лес на приморской равнине (10.497945° N, 107.459833° E, 20 м) | Аллювиальная бурая опесчаненная (АлБурОпесч) | Fluvisol (Arenic, Humic) |
| Сектор Нам Кат Тьен заповедника Донгнай | Заливаемый полидоминантный лес (11.487105° N, 107.378735° E, 140 м) | Аллювиальная светло-бурая глинистая оглеенная (АлБурСб) | Gleyic Fluvisol (Clayic) |
| Заливаемый долинный лес (11.445177° N, 107.404373° E, 150 м) | Аллювиальная темно-бурая оглеенная (АлБурТб) | Gleyic Histic Fluvisol | |
На территории Вьетнама зарегистрировано несколько типов почв, образованных в условиях среднегодового колебания увлажненности и высоких температур, распространение которых зависит, в основном, от положения в рельефе и почвообразующих пород [23]. Наиболее широко используются в земледелии зональные ферралитные и интразональные аллювиальные почвы. Гораздо реже встречаются на южных территориях Вьетнама мангровые засоленные и болотные почвы.
Ферраллитные почвы (Ferralsols (WRB)) развиваются под лесной растительностью условиях влажного субтропического климата на продуктах выветривания основных изверженных пород [2, 15]. Общая площадь ферралитных почв в мире оценивается около 750 млн га, они приурочены, в основном, к влажным тропическим лесам Америки, Африки и Юго-Восточной Азии. При общих благоприятных физических свойствах данные почвы обладают низкими показателями кислотности (рН 3.8–5.6) и достаточно низким уровнем плодородия (Сорг 1.5–5.7%) [16]. Образцы исследованных равнинных ферралитных почв были, в среднем, менее гумусированными (2.2–2.8%) и имели более кислую реакцию почвенного раствора (рН 4.0–4.2) по сравнению с горными ферралитными почвами (4.6–5.1% гумуса, рН 5.3–5.5).
Аллювиальные почвы (Fluvisols) имеют повсеместное распространение во всех климатических зонах [20]. На территории заповедников Вьетнама особо место занимают аллювиальные почвы с протекающим в них процессом формирования темно-гумусовых аккумуляций (бурые аллювиальные почвы) [21]. Аллювиальные бурые почвы имеют более высокое содержание Сорг в гумусовых горизонтах 4.3–6.8% по сравнению с зональными ферралитными почвами и, в среднем, более кислую реакцию среды (pH 4.0–4.6). Изученные аллювиальные почвы характеризовались содержанием Cорг, варьировавшим в диапазоне от 4.8 до 5.2%, а также несколько менее кислой реакцией среды (рН 4.5–5.1).
Растительный опад, отобранный с поверхности исследованных почв, формировался разнообразными видами растений, характерными для муссонных лесов Вьетнама. Опад с поверхности интразональных почв был сформирован деревьями рода Lagerstroemia (Lythraceae (сем. Дербенниковые)) (Бинь Чяу Фуок Буу); деревьями из семейств Dilleniaceae (Диллениевые), Anardicaceae (Анакардиевые), Euphorbiaceae (Молочайные), Fagaceae (Буковые) (Сонгхинь); деревьями Terminalia sp. (Терминалия, сем. Комбретовые), Aglaia odorata var. Gigantean (Аглая душистая, сем. Мелиевые) (Пу Хоат); деревьями Hydnocarpus anthelmintica (Гиднокарпус, сем. Kiggelariaceae (Киггелариевые)), Livistonia saribus (сем. Arecaceae (Пальмовые)) (Нам Кат Тьен, Донгнай). Опад с поверхности зональных ферралитных почв включал в себя растительный материал деревьев из семейств Dipterocarpaceae (Диптерокарповые), Clusiaceae (Клузиевые), Ebenaceae (Эбеновые), Fabaceae (Бобовые) (Кон Тю Ранг); деревьев из семейств Dipterocarpaceae (Диптерокарповые), Myrthaceae (Миртовые), Anacardiaceae (Анакардиевые), Euphorbiaceae (Молочайные), Fagaceae (Буковые) (Сонгхинь). Растительный опад состоял из слабо или частично фрагментированных листьев и веток на разных стадиях разложения.
Специфической особенностью растительных сообществ тропических вечнозеленых лесов является формирование “подвешенной почвы” в корзинках растений-эпифитов – органо-минерального субстрата, формирующегося на корнях аккумулятивных эпифитов [3, 40]. Данный субстрат относится к категории органогенных почв или почвоподобных субстратов [4]. “Подвешенные почвы” в процессе формирования подвержены значительным суточным и сезонным колебаниям влажности и температуры, а также подвергаются сильному влиянию факторов эрозии (атмосферные осадки и ветер) [29]. На создание структуры и свойств “подвешенной почвы” оказывают влияние ризодепозиты (разлагающиеся ткани растений, муцигели, растительные экссудаты) и летучие органические вещества [40]. Экссудаты создают более кислые условия среды в “подвешенных почвах” по сравнению с почвами под растениями-форофитами, также за счет корневых выделений в субстрате депонируется углерод [24]. В настоящей работе исследовали образцы “подвешенных почв”, сформированных в корзинках эпифитных папоротников сем. Dryopteridaceae (Щитовниковые) на территории заповедников Кон Тю Ранг и Сонгтхань.
Образцы почв и сопряженных субстратов отбирали в декабре 2020 г.–январе 2021 г., хранили в воздушно-сухом состоянии при комнатной температуре (20–22°С). Экспериментальные исследования проводили спустя 14–21 сут после отбора образцов.
Общую численность бактерий и длину актиномицетного мицелия определяли с помощью прямого люминесцентно-микроскопического метода с применением красителя акридина оранжевого; длину грибного мицелия регистрировали при помощи красителя калькофлуора белого [12]. Исследования проводили с использованием люминесцентного микроскопа ZEISS Axioscope 2+. Численность бактерий, длину грибного и актиномицетного мицелия, а также биомассу микроорганизмов рассчитывали по общепринятым формулам [12].
Для определения численности и таксономической структуры сапротрофного бактериального комплекса проводили посев почвенной суспензии изучаемых образцов на питательную глюкозо-пептонно-дрожжевую среду из различных разведений: 1 : 100, 1 : 1000, 1 : 10 000, в 3–5-кратной повторности для каждого разведения. На 7–10 сут учитывали колоний бактерий, выросших на агаризованной среде: подсчитывали общее количество колоний на чашках, синхронно учитывали численность отдельных таксономических групп бактерий и актиномицетов. Представителей отдельных морфотипов изолировали в пробирки со скошенным агаром и определяли до рода на основании культуральных, микроморфологических и физиолого-биохимических признаков.
Структуры сапротрофного бактериального комплекса определяли на основании критериев, разработанных на кафедре биологии почв МГУ [12]. Были выделены следующие группы обилия: доминанты (>30%), субдоминанты (20–30%), группа среднего обилия (10–20%) и минорные компоненты (<10%).
Таксономическую структуру прокариотного сообщества определяли методом высокопроизводительного секвенирования (Next Generation Sequencing: NGS) с использованием платформы Illumina MiSeq методом парно-концевого чтения (2 × 300 пар оснований) генерацией не менее 10 000 парных прочтений на образец по последовательностям гена гипервариабельного региона V3–V4 16S рРНК. Подготовку проводили по двухстадийной ПЦР: амплификация V3–V4 16S рРНК, а затем амплификация ПЦР продукта с целью баркодирования библиотеки. Получаемые ампликоны после очистки на магнитных частицах и измерения концентрации флуориметрическим методом являлись готовыми ДНК-библиотеками.
Данные секвенирования обрабатывали с использованием автоматизированного алгоритма QIIME, включающего объединение прямых и обратных прочтений, удаление технических последовательностей, фильтрации последовательностей с низкими показателями достоверности прочтения отдельных нуклеотидов (качество <Q20), фильтрации химерных последовательностей. Для разбиения последовательностей на операционные таксономические единицы использовали алгоритм с открытым референсным порогом классификации 97%. Выравнивание прочтений на последовательность 16S рРНК и распределение последовательностей по таксономическим единицам проводили с использованием базы данных Silva версии 132.
Разнообразие и сходство бактериальных сообществ исследованных субстратов оценивали с помощью индексов альфа-разнообразия, рассчитанных при объединении сиквенсов в операционные таксономические единицы с уровнем схожести нуклеотидного состава сиквенсов 97%.
Пул метаболически активных прокариот определяли методом in situ-гибридизации с рРНК-специфичными флуоресцентно-мечеными олиго-нуклеотидными зондами (FISH), меченными Cy-3 красителем. Использовали зонды, специфичные для доменов Archaea и Bacteria (филумы α-, β-, γ-, δ-Proteobacteria, Acidobacteria, Actinobacteria) [13].
Количественную оценку содержания функциональных генов (nifH и alkB) прокариот осуществляли методом количественной ПЦР в реальном времени. Реакцию проводили в амплификаторе DТLite4 ДНК-технология. Реакционную смесь готовили из препарата Super Mix Eva Green (Bio-Rad). Для каждого варианта эксперимента реакцию проводили в трех повторностях. Результаты измерений обрабатывали с использованием пакета программы Real time_PCR [14, 34]. Для определения наличия гена применяли ряд стандартных праймеров и условий [7].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определение общей численности бактерий, длины актиномицетного и грибного мицелия. Результаты определения общей численности бактерий с помощью прямого люминесцентно-микроскопического метода в исследованных образцах почвы и сопряженных субстратов ООПТ Вьетнама представлены в табл. 2.
Таблица 2.
Общая численность бактерий, длина актиномицетного и грибного мицелия в исследуемых субстратах со значениями доверительного интервала
| ООПТ | Субстрат | Численность бактерий, млрд кл./г почвы | Длина актиномицетного мицелия, м/г почвы | Длина грибного мицелия, м/г почвы |
|---|---|---|---|---|
| Зональные почвы | ||||
| Охраняемый лес Сонгхинь | ГКжГферр, гор. А (0–10 см) | 2.51 ± 0.13 | 620 ± 38 | 594 ± 29 |
| Лиственный опад | 3.46 ± 0.16 | 920 ± 40 | 390 ± 22 | |
| Природный заповедник Кон Тю Ранг | КжГферр, гор. А (0–10 см) | 1.60 ± 0.06 | 280 ± 10 | 430 ± 19 |
| КжГферр, гор. АВ (10–20 см) | 1.59 ± 0.09 | 360 ±15 | 424 ±26 | |
| Лиственный опад | 1.38 ± 0.07 | 200 ± 14 | 406 ± 21 | |
| “Подвешенная почва” | 4.36 ± 0.24 | 680 ± 34 | 196 ± 9 | |
| ГКжГферр , гор. А (0–10 см) | 1.62 ± 0.074 | 430 ± 24 | 892 ± 46 | |
| Лиственный опад | 0.40 ± 0.02 | 764 ± 32 | 386 ± 19 | |
| Национальный парк Пу Мат | КжФерр, гор. А (0–5 см) | 5.59 ± 0.28 | 670 ± 29 | 520 ±34 |
| КжФерр, гор. АB (5–20 см) | 2.56 ± 0.11 | 700 ± 16 | 406 ± 21 | |
| Лиственный опад | 3.56 ± 0.06 | 920 ± 54 | 410 ± 27 | |
| Природный заповедник Сонгтхань | ГКжГферр, гор. А (0–5 см) | 4.52 ± 0.08 | 280 ± 12 | 430 ± 20 |
| ГКжГферр, гор. АB (5–20 см) | 1.95 ± 0.01 | 420 ± 22 | 190 ± 8 | |
| Лиственный опад | 2.91 ± 0.02 | 358 ± 30 | 633±16 | |
| “Подвешенная почва” | 5.01 ± 0.06 | 690 ± 45 | 520 ± 25 | |
| Интразональные почвы | ||||
| Природный заповедник Бинь Чяу Фуок Буу | АлБур, гор. А (0–5 см) | 0.10 ± 0.004 | 242 ± 11 | 322 ± 14 |
| Лиственный опад | 0.37 ± 0.017 | 480 ± 21 | 812 ± 38 | |
| Охраняемый лес Сонгхинь | АлЛуг, гор. А (0–5 см) | 0.13 ± 0.059 | 368 ± 18 | 412 ± 25 |
| Лиственный опад | 0.29 ± 0.015 | 790 ± 30 | 786 ± 36 | |
| Сектор Нам Кат Тьен биосферного заповедника Донгнай | АлБурСб, гор. А (0–5 см) | 0.29 ± 0.014 | 314 ± 16 | 762 ± 42 |
| Лиственный опад | 0.27 ± 0.01 | 256 ± 10 | 616 ± 33 | |
| АлБурТб, гор. А (0–10 см) | 3.36 ± 0.17 | 1086 ± 56 | 2038 ± 116 | |
| Лиственный опад | 2.79 ± 0.15 | 964 ± 46 | 1196 ± 65 | |
Видно, что общая численность бактериальных клеток в изученных образцах красно-желтой гумусно-ферралитной почвы варьировала от 1.59 до 5.59 млрд кл./г в горизонте А, максимальные показатели зафиксированы в горной ферралитной почве заповедника Пу Мат. В образцах аллювиальных почв численность бактерий варьировала от 0.10 до 3.36 млрд кл./г, максимальные показатели приурочены к образцам аллювиальной темно-бурой почвы. В целом показатели численности бактерий в большинстве образцов аллювиальных почв были ниже, чем в образцах гумусно-ферралитных почв. Бóльшие показатели были приурочены к образцам горных почв, что связано с большим содержанием в них органического вещества [20].
В образцах опада на поверхности красно-желтых гумусно-ферралитных почв показатели численности бактерий значительно варьировали от 0.40 до 3.56 млрд кл./г и в большинстве были выше, чем аналогичные показатели для образцов почвы. В опаде на поверхности аллювиальных почв численность бактерий также значительно варьировала (от 0.27 до 0.37 млрд кл./г), при этом показатели численности в среднем были значительно ниже, чем в опаде на поверхности ферралитных почв [11, 19].
Длина актиномицетного мицелия варьировала в образцах ферралитных почв от 280 до 670 м/г и была максимальной в горной красно-желтой гумусно-ферралитной почве заповедника Сонгтхань, ниже показатели зарегистрированы в равнинных почвах. В аллювиальных бурых и луговых кислых почвах в целом длина актиномицетного мицелия была сравнима или даже превышала показатели для гумусно-ферралитных почв (от 242 до 1086 м/г). Обращают на себя внимание более высокие показатели длины актиномицетного мицелия, приуроченные к образцам растительного опада с поверхности аллювиальных почв – в значительной части исследованных биотопов данный показатель превышал аналогичный для зональных почв в 1.5–2 раза.
Длина грибного мицелия в образцах зональных ферралитных почв варьировала от 190 до 892 м/г и была меньше или сравнима с аналогичными показателями для аллювиальных почв: от 322 м/г в аллювиальной бурой почве до 2038 м/г в аллювиальной темно-бурой оглеенной. В образцах растительного опада показатели изменялись от 386 до 1196 м/г, причем минимальные значения длины грибного мицелия были приурочены к образцам лиственного опада на поверхности аллювиальной темно-бурой почвы.
Исследование микробных сообществ тропических почв Вьетнама показало, что общая численность бактерий и длина актиномицетного мицелия сравнимы и превышают численность бактерий в лесных почвах умеренной зоны [11, 19]. В противоположность почвам умеренной зон, в подстилке зафиксированы меньшие показатели общей численности бактерий, чем в нижележащем горизонте А. Аналогичные закономерности ранее отмечены при изучении красных ферралитных почв Кубы [10]. Следует отметить, что длина актиномицетного мицелия была в целом больше, чем в почвах лесов умеренной зоны, а длина грибного мицелия меньше, чем в лесах умеренной зоны [19].
Показатели численность бактерий, длины актиномицетного и грибного мицелия были определены также в образцах “подвешенных почв”. Показатели численности бактерий и длины актиномицетного мицелия превышали таковые во всех изученных образцах почвы и растительного опада и составляли 4.36–5.01 млрд кл./г и 680–690 м/г. При этом длина грибного мицелия была меньше, чем в почве и опаде. Вероятно, столь высокая бактериальная численность обусловлена значительно более активной по сравнению с другими субстратами деятельностью фауны (муравьи) и выделением корневых экссудатов, которые создают благоприятные условия для роста и размножения микроорганизмов [4].
На основании полученных данных об общей численности бактерий, длине актиномицетного и грибного мицелия были рассчитаны показатели биомассы прокариот (бактерий, актиномицетов) и грибов, общая микробная биомасса, а также вклад прокариотных организмов в общую биомассу микроорганизмов. Полученные результаты представлены в табл. 3. В образцах красно-желтых ферралитных почв запасы общей микробной биомассы сильно варьировали и составляли от 1.42 (заповедника Сонгтхань) до 3.91 мг/г (Кон Тю Ранг). В образцах аллювиальных почв значения варьировали от 1.30 до 3.12 мг/г почвы, максимальные значения были обнаружены в образцах аллювиальной темно-бурой оглеенной почвы (8.86 мг/г почвы). Содержание прокариотной биомассы составляло от 0.66 до 8.71% что сравнимо с аналогичным показателем для почв лесов умеренной зоны [19]. Максимальное содержание прокариотной биомассы было приурочено к аллювиальной темно-бурой почве.
Таблица 3.
Биомасса бактерий, актиномицетов и грибов, общая микробная биомасса и содержание прокариотной биомассы (% от общей микробной биомассы) в исследуемых субстратах со значениями доверительного интервала
| ООПТ | Субстрат | Биомасса бактерий, мг/г | Биомасса актиномицетов, мг/г | Биомасса грибов, мг/г | Общая биомасса, мг/г | Доля прокариотной биомассы, % |
|---|---|---|---|---|---|---|
| Зональные почвы | ||||||
| Охраняемый лес Сонгхинь | ГКжГферр, гор. А (0–10 см) | 0.05 ± 0.003 | 0.02 ± 0.002 | 2.38 ± 0.116 | 2.63 ± 0.120 | 2.93 ± 0.34 |
| Лиственный опад | 0.07 ± 0.003 | 0.04 ± 0.002 | 1.56 ± 0.088 | 1.67 ± 0.093 | 6.43 ± 0.52 | |
| КжГферр, гор. А (0–10 см) | 0.03 ± 0.001 | 0.01 ± 0.001 | 1.68 ± 0.076 | 1.72 ± 0.078 | 2.33 ± 0.21 | |
| КжГферр, гор. АВ (10–20 см) | 0.03 ± 0.001 | 0.01 ± 0.001 | 1.70 ± 0.104 | 1.74 ± 0.106 | 2.30 ± 0.23 | |
| Природный заповедник Кон Тю Ранг | Лиственный опад | 0.03 ± 0.002 | 0.01 ± 0.001 | 1.58 ± 0.084 | 1.62 ± 0.086 | 2.47 ± 0.23 |
| “Подвешенная почва” | 0.09 ± 0.01 | 0.03 ± 0.001 | 0.78 ± 0.036 | 0.9 ± 0.042 | 14.63 ± 1.46 | |
| ГКжГферр, гор. А (0–10 см) | 0.32 ± 0.005 | 0.02 ± 0.001 | 3.57 ± 0.184 | 3.91 ± 0.186 | 8.71 ± 1.31 | |
| Лиственный опад | 0.08 ± 0.002 | 0.03 ± 0.001 | 1.54 ± 0.076 | 1.65 ± 0.078 | 6.79 ± 0.22 | |
| Национальный парк Пу Мат | КжФерр, гор. А (0–5 см) | 0.12 ± 0.002 | 0.01 ± 0.002 | 1.58 ± 0.042 | 1.71 ± 0.091 | 7.60 ± 0.98 |
| КжФерр, гор. АB (5–20 см) | 0.04 ± 0.001 | 0.02 ± 0.001 | 0.27 ± 0.026 | 0.33 ± 0.01 | 18.18 ± 2.14 | |
| Лиственный опад | 0.05 ± 0.001 | 0.03 ± 0.001 | 0.78 ± 0.033 | 0.86 ± 0.02 | 9.30 ± 0.62 | |
| Природный заповедник Сонгтхань | ГКжГферр, гор. А (0–5 см) | 0.09 ± 0.002 | 0.01 ± 0.001 | 1.32 ± 0.031 | 1.42 ± 0.06 | 7.04 ± 0.34 |
| ГКжГферр, гор. АB (5–20 см) | 0.03 ± 0.001 | 0.02 ± 0.001 | 0.58 ± 0.027 | 0.63 ± 0.002 | 7.94 ± 0.40 | |
| Лиственный опад | 0.06 ± 0.001 | 0.01 ± 0.001 | 1.60 ± 0.018 | 1.67 ± 0.12 | 4.19 ± 0.16 | |
| “Подвешенная почва” | 0.10 ± 0.002 | 0.03 ± 0.001 | 1.65 ± 0.023 | 1.78 ± 0.19 | 7.30 ± 0.23 | |
| Интразональные почвы | ||||||
| Природный заповедник Бинь Чяу Фуок Буу | АлБур, гор. А (0–5 см) | 0.001 ± 0.001 | 0.01 ± 0.001 | 1.29 ± 0.056 | 1.30 ± 0.057 | 0.84 ± 0.92 |
| Лиственный опад | 0.01 ± 0.003 | 0.02 ± 0.001 | 3.25 ± 0.152 | 3.28 ± 0.153 | 1.61 ± 0.77 | |
| Охраняемый лес Сонгхинь | АлЛуг, гор. А (0–5 см) | 0.001 ± 0.001 | 0.01 ± 0.001 | 1.65 ± 0.1 | 1.66 ± 0.102 | 0.66 ± 0.19 |
| Лиственный опад | 0.01 ± 0.001 | 0.03 ± 0.001 | 3.14 ± 0.144 | 3.18 ± 0.146 | 1.26 ± 0.10 | |
| Сектор Нам Кат Тьен биосферного заповедника Донгнай | АлБурСб, гор. А (0–5 см) | 0.06 ± 0.001 | 0.01 ± 0.001 | 3.05 ± 0.168 | 3.12 ± 0.169 | 2.24 ± 0.54 |
| Лиственный опад | 0.05 ± 0.001 | 0.01 ± 0.001 | 2.46 ± 0.132 | 2.52 ± 0.133 | 2.38 ± 0.45 | |
| АлБурТб, гор. А (0–10 см) | 0.67 ± 0.001 | 0.04 ± 0.002 | 8.15 ± 0.464 | 8.86 ± 0.470 | 8.01 ± 1.2 | |
| Лиственный опад | 0.56 ± 0.001 | 0.04 ± 0.002 | 4.78 ± 0.26 | 5.38 ± 0.265 | 11.15 ± 1.82 | |
В образцах растительного опада наименьшая общая микробная биомасса была приурочена к образцам опада на поверхности равнинной зональной ферралитной почвы (1.62 мг/г), наибольшие значения обнаружены в образцах опада на поверхности горной красно-желтой гумусно-ферралитной почвы (1.71 мг/г). При этом вклад прокариот в общую микробную биомассу более, в большинстве образцов выше в опаде, чем в почве. Максимальный вклад прокариот в общую биомассу был приурочен к образцам “подвешенной почвы” на территории ООПТ Сонгтхань и Кон Тю Ранг, 7.30 и 14.63% соответственно.
Полученные результаты позволяют предположить, что максимальная концентрация почвенной микробиоты в почвах тропических лесных биогеоценозов происходит в горизонте А, в противоположность лесным и степным биогеоценозам умеренной зоны, где таким локусом является подстилка [19]. Значительное содержание прокариотной биомассы в опаде и “подвешенной почве” может свидетельствовать о значительной роли прокариот в трансформации органического вещества в этих локусах.
Численность и таксономический состав комплекса культивируемых сапротрофных бактерий. Численность сапротрофного бактериального комплекса (СБК) значительно варьировала во всех исследованных почвах (табл. 4). В таблице представлены данные по зональным и интразональным почвам с наиболее типичными результатами по численности и таксономическому составу по сравнению со всеми исследованными образцами. Максимальная численность культивируемых бактерий была приурочена к образцам красно-желтой гумусно-ферралитной почвы (4.8 млн КОЕ/г) и снижалась значительно по почвенному профилю (2.24 млн КОЕ/г), меньше были показатели численности в аллювиальной луговой кислой почве (0.6 млн КОЕ/г почвы). Численность сапротрофного бактериального комплекса в образцах опада была в 4–9 раз больше, чем в образцах почв. Численность культивируемых бактерий в образцах “подвешенной почвы” была сравнима с численностью СБК в растительном опаде, приуроченном исследуемому локусу (9 млн КОЕ/г почвы).
Таблица 4.
Численность и структура сапротрофного бактериального комплекса некоторых исследованных почв и сопряженных субстратов со значениями доверительного интервала
| Субстрат | Численность СБК, млн КОЕ/г | Доминанты | Субдоминанты | Группа среднего обилия | Минорные компоненты |
|---|---|---|---|---|---|
| Природный заповедник Кон Тю Ранг | |||||
| КжГферр, гор. А (0–10 см) | 4.8 ± 0.20 | Bacillus, Streptomyces | Micrococcus | Myxococcus | Arthrobacter |
| КжГферр, гор. А (0–10 см) | 2.24 ± 0.11 | Bacillus | Myxococcus | Streptomyces | Micrococcus, Rhodococcus |
| Опад | 14.8 ± 0.9 | Myxococcus, Bacillus | Arthrobacter, Micrococcus | Streptomyces | Azotobacter, Rhodococcus |
| “Подвешенная почва” | 9 ± 0.58 | Streptomyces | Rhodococcus | Myxococcus | Bacillus, Micrococcus, Beijerinckia |
| Природный заповедник Сонгтхань | |||||
| ГКжГферр, гор. А (0–5 см) | 0.146 ± 0.14 | Bacillus | Micrococcus, Streptomyces | Myxococcus | Aquaspirillum |
| ГКжГферр, гор. АВ (5–20 см) | 0.033 ± 0.001 | Streptomyces, Bacillus | Myxococcus | Micrococcus, Arthrobacter | Cytophaga |
| Опад | 0.046 ± 0.002 | Myxococcus, Bacillus | Arthrobacter, Microcococcus | Streptomyces | Beijerinckia |
| “Подвешенная почва” | 0.076 ± 0.004 | Streptomyces | Myxococcus | Bacillus, Micrococcus | Aquaspirillum, Cytophaga, Rhodococcus |
| Охраняемый лес Сонгхинь | |||||
| АлЛуг, гор. А (0–5 см) | 0.60 ± 0.01 | Micrococcus, Bacillus | Myxococcus | Streptomyces | Arthrobacter, Rhodococcus, Aquaspirillum |
| Опад | 9.03 ± 0.50 | Streptomyces | Arthrobacter, Myxococcus | Bacillus | Promicromonospora |
Таксономическая структура исследованных почв проявляла значительное сходство: в качестве доминантов в СБК всех исследованных почв и опада выступали бактерии рода Bacillus и Streptomyces, в качестве субдоминантов и группы среднего обилия обнаружены представители родов Myxococcus, Micrococcus, Arthrobacter, Rhodococcus.
В “подвешенной почве” доминировали представители рода Streptomyces. Значительная представленность в изученных образцах опада и “подвешенной почвы” рода Streptomyces подтверждает результаты прямого учета длины актиномицетного мицелия и свидетельствуют о значительном вкладе актинобактерий в деструкцию растительного материала на поверхности почв и в корзинках эпифитных растений Вьетнама [1, 7]. В качестве минорных компонентов во всех исследованных субстратах выступали протеобактерии родов Rhizobium, Azotobacter, Chromobacterium, Serratia, Cytophaga, Beijerinckia, а также некоторые представители, не идентифицированные до рода. Полученные данные по численности и разнообразию СБК “подвешенной почвы” указывают на близость прокариотного сообщества изученного субстрата к сообществу ризосферной почвы, расположенной в прикорневой зоне растений и отличающейся повышенной микробной активностью [22].
Высокое содержание в опаде и “подвешенной почве” представителей рода Streptomyces, известных как активные продуценты антибиотиков, позволяет рассматривать эти локусы как перспективные для выделения штаммов с высоким биотехнологическим потенциалом.
Таксономическая структура прокариотного сообщества (баркодинг гена 16S рРНК). Для исследования таксономической структуры прокариотного сообщества зональных и интразональных почв Вьетнама выбраны образцы с наиболее репрезентативными данными по общей численности микроорганизмов и структуре СБК: зональная красно-желтая гумусно-ферралитная почва заповедника Кон Тю Ранг и интразональная аллювиальная бурая почва заповедника Пу Хоат. Данные типы почв являются наиболее распространенными и используемыми в сельском хозяйстве на территории Вьетнама, поэтому их подробное изучение представлялось наиболее интересным. Ранее проведен метагеномный анализ (баркодинг гена 16S рРНК) бактериального сообщества данной интразональной почвы, опада и “подвешенной почвы” [7]. В настоящей работе приведены результаты анализа метагенома образцов горизонта А почвы, растительного опада и “подвешенной почвы”, а также данные по изучению филогенетического разнообразия красно-желтой гумусно-ферралитной почвы заповедника Кон Тю Ранг и сопряженной с ней “подвешенной почве”.
Представлялось интересным выявить основные роды микроорганизмов, представленные в доминирующих филумах микроорганизмов образцов, приуроченных к аллювиальной бурой почве. Во всех изученных образцах для филума Proteobacteria показано доминирование альфа-протеобактерий и порядка Rhizobiales в общем пуле микроорганизмов. Среди выявленных родов микроорганизмов присутствует значительное число бактерий-продуцентов вторичных метаболитов (Haliangum, Sorangium, Novosphongobium, Phenylobacterium, Pseudomonas) и прокариот, способных осуществлять фиксацию и превращения азота в почве (Bradyrhizobium, Variibacter) [26, 31].
Наибольшей представленностью в сапротрофном бактериальном комплексе исследованных субстратов характеризовался филум Actinobacteria. В изученных субстратах выявлено значительное количество актиномицетов, способных к деструкции и минерализации растительного материала (Acidothermus, Mycobacterium) [39, 45]. Наиболее широко представленными в сапротрофном бактериальном комплексе являлись бактерии рода Streptomyces, тогда как в изученных при помощи метагеномного анализа образцах субстратов преобладали роды Kitasatospora и Streptomyces, причем представленность данных родов значительно варьировала.
Одним из трех наиболее распространенных в изученных субстратах таксонов является типично почвенный филум Acidobacteria. В исследованных образцах были детектированы роды Koribacter, Bryobacter, Granulicella, Terriglobus, а также некоторые роды-кандидаты. Предположительно, развитие данных таксонов в образцах опада и “подвешенной почвы” связано с сильной степенью минерализации органического вещества, а также кислой реакцией среды (рН 4.2–5.1) и экссудатов эпифитных растений.
Проведен сравнительный анализ метагенома красно-желтой гумусно-ферралитной почвы и “подвешенной почвы” из корзинок эпифитных папоротников (табл. 5).
Таблица 5.
Филогенетическое разнообразие прокариотного сообщества красно-желтой гумусно-ферралитной почвы и “подвешенной почвы” (% от всех представителей домена Bacteria)
| Домен | Филум | “Подвешенная почва” | Гор. А (0–5 см) |
|---|---|---|---|
| Bacteria | Proteobacteria | 51 | 15 |
| Cloroflexi | 0.7 | 0.2 | |
| Firmicutes | 8 | 80 | |
| Acidobacteria | 0.7 | 0.5 | |
| Actinobacteria | 38 | 2 | |
| Verrucomicrobia | Не обн. | 1 | |
| Bacteroidetes | 2 | 0.05 | |
| Planctomycetes | Не обн. | 1 | |
| Cyanobacteria | 0.7 | 0.09 |
Полученные в ходе работы закономерности в распределении филогенетического разнообразия красно-желтой гумусно-ферралитной почве были сходны с аналогичными результатами изучения прокариотного сообщества аллювиальной почвы и сопряженных субстратов [7]. В исследованных образцах красно-желтой ферралитной почвы и “подвешенной почвы” детектированы бактериальные филумы Firmicutes, Proteobacteria, Actinobacteria, меньше содержание филумов Bacteroidetes, Cloroflexi, Acidobacteria, Verrucomicrobia, Planctomycetes, Cyanobacteria. Полученные результаты согласуются с данными других авторов, изучавших филогенетическое разнообразие почв [18, 32, 33, 35]. При этом представленность различных филумов в исследованных почвах была различной. В “подвешенной почве” доминировали представители филума Proteobacteria (51%), меньше было содержание Acidobacteria (38%) и Firmicutes (8%), наименьшим было содержание других филумов. Полученные данные по основным доминирующим филумам бактерий соотносились с результатами посева на универсальные питательные среды, а также с литературными данными [33]. В горизонте А красно-желтой гумусно-ферралитной почвы доминировал филум Firmicutes (80%), меньше было содержание Proteobacteria (15%), Actinobacteria (2%) и прочих филумов. Следует отметить, что в ранее исследованных аллювиальной почве, опаде и “подвешенной почве” [7] отмечены те же закономерности на уровне филумов.
При изучении общего разнообразия прокариотных микроорганизмов в образцах горизонта А красно-желтой гумусно-ферралитной почвы и “подвешенной почвы” выявлены некоторые общие закономерности. В изученных субстратах выявлено большое количество родов бактерий, способных к деструкции ксенобиотиков (Amaricoccus, Sphingomonas, Pseudomonas, Skermanella и др.) [28, 37]. Показано наличие большого числа бактерий, связанного с различными этапами цикла азота (Paracoccus, Ensifer, Nocardia, Pseudolabrys и др.) [42, 43], а также бактерий-экстремофилов, способных переживать длительные неблагоприятные условия (Brevundimonas, Janthinobacterium и др.) [25, 46]. Также выявлен значительный вклад в микробное сообщество субстратов ацидофильных актинобактерий рода Acidimicrobium, что связано с низкими значениями рН исследуемых ферралитных почв. В образце горизонта А почвы было определено большое количество бактериальных родов-антагонистов развития грибов (Ornithinimicrobium, Janthinobacterium, Kocuria) [36, 38, 44]. Исследуя сообщества на родовом уровне, стоит заметить, что сообщество “подвешенной почвы” имеет низкое сходство с сообществом ферралитной почвы – при значительном сходстве функциональных группировок микроорганизмов их родовой состав существенно различается, что подтверждает ранее опубликованные результаты других исследователей, согласно которым “подвешенная почва” имеет большее сходство с сообществом почвы, чем с сообществами растения-форофита или его опада [33]. Однако в других работах для “подвешенных почв” тропических лесов Борнео и Амазонии выявлен гораздо больший уровень корреляции сообщества “подвешенной почвы” с растением-форофитом и значительная разница между сообществами “подвешенных почв” двух разных территорий [32, 35]. Для более подробного исследования данного субстрата необходимо расширить локальную выборку, а также учитывать свойства “подвешенной почвы”, обусловленные ее генезисом.
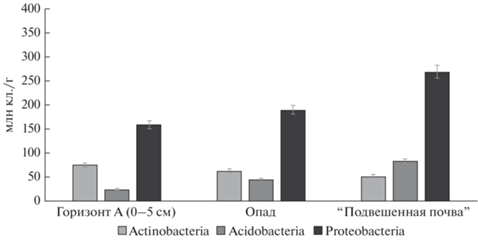
Характеристика метаболически активных представителей прокариотного комплекса зональной почвы и сопряженных субстратов. В дополнение к проведенному метагеномному анализу (секвенирование гена 16S рРНК) бактериального сообщества зональной красно-желтой гумусно-ферралитной почвы, опада и “подвешенной почвы” представляло значительный интерес сравнить численность и соотношение метаболически активных представителей доминирующих филумов в изученных субстратах, полученные методом FISH результаты представлены на рис. 1. Для характеристики выбраны филумы, наиболее значительно представленные в образцах почвы, опада и “подвешенной почвы” на основании проведенных ранее исследований [7]. Содержание метаболически активных клеток, относящихся к филумам Proteobacteria, Actinobacteria, Acidobacteria было ниже в почве и выше в “подвешенной почве”. Однако соотношение таксонов в этих субстратах различалось. Доминирующей группой во всех субстратах были протеобактерии, минорной – Actinobacteria. При этом наибольшая численность филума Proteobacteria обнаружена в образцах “подвешенной почвы” (454.97 млн кл./г почвы), наименьшая приурочена к образцам горизонта А (116.37 млн кл./г) и составляла всего 25% от общей представленности данного таксона в “подвешенной почве”. Для актинобактерий, напротив, максимальное содержание показано в верхнем горизонте почвы и более низкие значения – в опаде и “подвешенной почве”. При помощи метагеномного анализа данных субстратов показан значительный вклад филума Firmicutes в общее разнообразие прокариотных организмов, что требует проведения дополнительных исследований для выявления пула метаболически активных представителей. Интересно, что максимальная численность метаболически активных протеобактерий соотносилась с высоким таксономическим разнообразием этого филума в “подвешенной почве”, выявленным с помощью метабаркодинга.
Рис. 1.
Численность метаболически активных прокариотных микроорганизмов в образцах красно-желтой гумусно-ферралитной почвы и сопряженных субстратах.
Детекция функциональных генов (nifH и alkB) в исследованных образцах. Для образцов зональной красно-желтой гумусно-ферралитной почвы, растительного опада и “подвешенной почвы” исследовано содержание функциональных генов nifH и alkB. Выбор данных генов был обусловлен возможностью использования микроорганизмов-носителей в биотехнологических целях для создания бактериальных препаратов, повышающих уровень фиксации атмосферного азота и деструкции органических ксенобиотиков. Предположительно, содержание гена alkB в образцах почв и растительного материала Вьетнама может быть завышено по сравнению с почвами умеренной зоны в связи с обработкой тропических лесов дефолиантами во второй половине ХХ в. [5].
Содержание копий функциональных генов alkB и nifH в образцах, приуроченных к красно-желтой гумусно-ферралитной почве, было примерно в 10 раз меньше, чем в образцах исследованной ранее аллювиальной бурой почвы и сопряженных субстратах [7]. Так, число копий гена, кодирующего алканмонооксигеназу, было наибольшим в образцах “подвешенной почвы” (0.32 млн копий/г), меньше в образцах растительного опада (0.18 млн копий/г) и почвенного гор. А (0.2 млн копий/г). Зафиксированные численности функционального гена alkB значительно меньше данных, полученных для почв умеренных лесов [13]. Ген nifH был также обнаружен во всех исследованных образцах; его численность варьировала от 0.03 млн копий гена/г почвы в образцах растительного опада и почвы до 0.9 млн копий/г в образцах “подвешенной почвы”.
ЗАКЛЮЧЕНИЕ
Проведено комплексное исследование прокариотного сообщества некоторых почв Вьетнама и сопряженных с ними субстратов. Показатели численности бактерий в большинстве образцов аллювиальных почв были меньше, чем в образцах гумусно-ферралитных почв, тогда как при исследовании длины актиномицетного мицелия выявлена обратная закономерность. Обращают на себя внимание бóльшие показатели длины актиномицетного мицелия, приуроченные к образцам растительного опада с поверхности аллювиальных почв – в значительной части исследованных биотопов данный показатель превышал аналогичный для зональных почв в 1.5–2 раза. На поверхности почв в тропической зоне именно растительный опад и горизонте А почв является локусом наибольшей концентрации микробной биомассы в отличие от лесных экосистем умеренного пояса, где наибольшая численность микроорганизмов регистрируется в подстилке. В результате активной деструкции растительного материала микроорганизмами в тропических лесах Вьетнама сам горизонт подстилки не формируется, тогда как горизонт А почвы в значительной мере несет черты подгоризонта H. Длина грибного мицелия в образцах интразональных почв и сформированного на них растительного опада была в среднем больше, чем в аналогичных зональных образцах.
По результатам проведенного комплексного исследования выявлено, что значительный вклад в деструкцию растительного материала вносят актиномицеты рода Streptomyces, выявленные в СБК и при помощи метагеномного анализа, а также бактерии-гидролитики, широко представленные в пуле почвенных прокариот. Численность сапротрофного бактериального комплекса в растительном опаде превышала таковую в горизонте А почв в 4–9 раз. Практически во всех исследованных почвах и сопряженных субстратах доминировали бактерии рода Streptomyces, что подтверждает ранее выдвинутую гипотезу о значительном вкладе актиномицетов в разложении растительных остатков по сравнению с почвами умеренной зоны.
С помощью молекулярных методов (высокопроизводительное пиросеквенирование) исследования детектировано потенциально высокое разнообразие бактерий-продуцентов биологически активных веществ, деструкторов ксенобиотиков, экстремофилов, а также организмов, вовлеченных в круговорот азота и способных к фиксации атмосферного азота. Метаболически активная составляющая прокариотного сообщества красно-желтой гумусно-ферралитной почвы и сопряженных субстратов представлена филумами Proteobacteria, Actinobacteria и Acidobacteria, достигала максимальных значений в “подвешенной почве”, что соотносилось с высокой численностью филумов и их значительным таксономическим разнообразием в этом локусе, определенным классическими и современными микробиологическими методами. Функциональные гены (nifH и alkB) детектированы в значимом количестве в красно-желтой гумусно-ферралитной почве и сопряженных субстратах. Численность копий функциональных генов была максимальна в образцах “подвешенной почвы”, что делает этот локус перспективным для выделения штаммов с высоким биотехнологическим потенциалом в отношении фиксации атмосферного азота и разложению алканов.
Изучение особого биогеоценотического “узла”, характерного для тропических лесов – “подвешенной почвы” – с применением комплексного подхода позволило выявить специфические характеристики микробного разнообразия данного субстрата, а также подтвердить данные, полученные при изучении научной литературы. Исходя из полученной информации, можно сделать заключение о близости изученного почвоподобного тела к ризосферной почве исходя из общего микробного разнообразия, значительного количества метаболически активных организмов, способных к проведению процессов азотфиксации и деструкции ксенобиотиков.
Список литературы
Дорченкова Ю.А., Грачева Т.А., Лысак Л.В. Характеристика актиномицетных комплексов заповедника Пу Хоат // Почвоведение. 2022. № 4. С. 482–487.
Егоров В.В., Иванова Е.Н., Фридланд В.М., Розов Н.И. Классификация и диагностика почв СССР. М.: Колос, 1977. 30 с.
Еськов А.К. Экофизиологическая классификация сосудистых эпифитов как теоретическая предпосылка формирования коллекций и сообществ эпифитных растений в условиях оранжерейной культуры // Естественные и техн. науки. 2012. № 4. С. 93–98.
Еськов А.К., Абакумов Е.В., Тиунов А.В., Кузнецова О.А., Дубовиков Д.А., Прилепский Н.Г., Антипина В.А., Кузнецов А.Н. Агеотропные воздушные корни-улавливатели гнездовых эпифитов и их роль в формировании подвешенных почв // Журн. общ. биол. 2017. Т. 78. № 3. С. 54–68.
Еськов А.К., Прилепский Н.Г., Антипина В.А., Абакумов Е.В., Ван Тхинь Н. Формирование эпифитных сообществ в искусственных лесных посадках Южного Вьетнама // Экология. 2020. № 3. С. 171–180. https://doi.org/10.31857/S0367059720030075
Калашникова К.А., Коновалова О.П., Александрова А.В. Почвообитающие микроскопические грибы муссонного диптерокарпового леса (заповедник Донг Най, Южный Вьетнам) // Микология и фитопатология. 2016. Т. 50. № 2. С. 97–107.
Князева А.В., Лысак Л.В., Манучарова Н.А., Лапыгина Е.В., Александрова А.В. Численность и таксономическое разнообразие прокариот аллювиальной бурой почвы и сопряженных субстратов (Вьетнам, заповедник Пу Хоат) // Почвоведение. 2022. № 10. С. 1290–1300.
Ковязин В.Ф., Данг Т.Л., Данг В.Х. Прогноз состояния растительного покрова лесных угодий заповедника Донг Най Вьетнама // Вестник СГУГиТ. 2020. Т. 25. № 3. С. 214–228.
Кузнецов А.Н., Кузнецова С.П. Структура и функции почвенного населения муссонного тропического леса национального парка Кат Тьен, Южный Вьетнам. М.: Лесная растительность, 2011. С. 16–43.
Лапыгина Е.В., Лысак Л.В., Грачева Т.А., Кудинова А.Г. Структура микробных сообществ красных ферралитных почв национального парка Варадеро (провинция Матансас, остров Куба) // Изв. РАН. Сер. биол. 2015. С. 244–249.
Лысак Л.В., Лапыгина Е.В., Конова И.А., Звягинцев Д.Г. Численность и таксономический состав наноформ бактерий в некоторых почвах России // Почвоведение. 2010. № 7. С. 819–824.
Лысак Л.В., Добровольская Т.Г., Скворцова И.Н. Методы оценки бактериального разнообразия почв и идентификации почвенных бактерий. М.: МАКС Пресс, 2003. 120 с.
Манучарова Н.А., Ксенофонтова Н.А., Белов А.А., Каменский Н.Н., Арзамазова А.В., Зенова Г.М., Кинжаев Р.Р., Трофимов С.Я., Степанов А.Л. Прокариотный компонент нефтезагрязненной торфяной олиготрофной почвы при разном уровне минерального питания // Почвоведение. 2021. № 1. С. 80–89. https://doi.org/10.31857/S0032180X2101010X
Манучарова Н.А., Ксенофонтова Н.А., Каримов Т.Д., Власова А.П., Зенова Г.М., Степанов А.Л. Изменение филогенетической структуры метаболически активного прокариотного комплекса почв под влиянием нефтяного загрязнения // Микробиология. 2020. Т. 89. № 2. С. 222–234. https://doi.org/10.31857/S0026365620020093
Наумов В.Д. Почвы тропиков и субтропиков и их сельскохозяйственное использование. М.: Колос, 2010. 361 с.
Нгуен Ты Сием, Фридланд В.М., Орлов Д.С. Состав и свойства гумусовых веществ главнейших почв Северного Вьетнама // Почвоведение. 1977. № 8. С. 39–54.
Околелова А.А., Тхинь Нгуен Ван, Авилов В.К. Свойства основных типов почв Биосферного Заповедника Донг Най (Южный Вьетнам) // Региональные геосистемы. 2014. № 10(181).
Першина Е.В., Чернов Т.И. Генетическая информация в почве // Основные достижения и перспективы почвенной метагеномики. СПб.: Информ-Навигатор, 2017. С. 9–18.
Полянская Л.М., Гейдебрехт В.В., Степанов А.Л., Звягинцев Д.Г. Распределение численности и биомассы микроорганизмов по профилю зональных типов почв // Почвоведение. 1995. № 5. С. 566–572.
Почвоведение / Под ред. Ковды В.А., Розанова Б.Г. М.: Высш. шк., 1988. 400 с.
Почвообразовательные процессы / Под ред. Симаковой М.С., Топконогова В.Д. М.: Почв. ин-т им. В.В Докучаева, 2006. 510 с.
Феоктистова Н.В., Марданова А.М., Хадиева Г.Ф., Шарипова М.Р. Ризосферные бактерии // Ученые записки Казанского ун-та. Сер. Естественные науки. 2016. № 2. С. 207–224.
Чернов Т.И., Железова А.Д., Тхакахова А.К., Бгажба Н.А., Зверев А.О. Микробиомы целинных почв тропических лесов южного Вьетнама // Микробиология. 2019. Т. 88. № 4. С. 479–489.
Abakumov E.V., Rodina O.A., Eskov A.K. Humification and humic acid composition of suspended soil in oligotrophous environments in South Vietnam // Appl. Environ. Soil Sci. 2018. V. 1. P. 1–8. https://doi.org/10.1155/2018/1026237
Avguštin J.A., Bertok D.Ž., Avguštin G. Isolation and characterization of a novel violacein-like pigment producing psychrotrophic bacterial species Janthinobacterium svalbardensis sp. nov. // Antonie Van Leeuwenhoek. 2013. V. 103. P. 763–769. https://doi.org/10.1007/s10482-012-9858-0
Baig Z.T., Abbasi S.A., Memon A.G., Naz A., Soomro A.F. Assessment of degradation potential of Pseudomonas species in bioremediating soils contaminated with petroleum hydrocarbons // J. Chem. Technol. Biotechnol. 2022. V. 97. P. 455–465. https://doi.org/10.1002/jctb.6820
Benzing D.H. Vascular Epiphytes: General Biology and Related Biota. Cambridge: Cambridge University Press, 1990.
Blecher H., Blecher R., Wegst W., Eberspaecher J., Lingens F. Bacterial degradation of aminopyrine // Xenobiotica. 1981. V. 11. P. 749–754. https://doi.org/10.3109/00498258109045878
Bohlman S.A., Matelson T.J., Nadkarni N.M. Moisture and temperature patterns of canopy humus and forest floor soil of a mountain cloud forest, Costa Rica // Biotropica. 1995. V. 27. P. 13–19.
Caporaso J., Kuczynski J., Stombaugh J. et al. QIIME allows analysis of high-throughput community sequencing data // Nat Methods. 2010. V. 7. P. 335–336. https://doi.org/10.1038/nmeth.f.303
Coss-Navarrete E.L., Díaz-Valle A., Alvarez-Venegas R. Induction of plant resistance to biotic stress by priming with β-aminobutyric acid (BABA) and its effect on nitrogen-fixing nodule development // Academic Press. 2020. P. 101–114. https://doi.org/10.1016/B978-0-12-817892-8.00006-4
Donald J., Maxfield P., Leroy C., Ellwood M.D. Epiphytic suspended soils from Borneo and Amazonia differ in their microbial community composition // Acta Oecologica. 2020. V. 1. P. 106. https://doi.org/10.1016/j.actao.2020.103586
Eskov A.K., Zverev A.O., Abakumov E.V. Microbiomes in Suspended Soils of Vascular Epiphytes Differ from Terrestrial Soil Microbiomes and from Each Other // Microorganisms. 2021. V. 9. P. 1033. https://doi.org/10.3390/microorganisms9051033
Fierer N., Jackson J.A., Vilgalys R., Jackson R.B. Assessment of Soil Microbial Community Structure by Use of Taxon-Specific Quantitative PCR Assays // App-l. Environ. Microbiol. 2005. V. 7. P. 4117–4120. https://doi.org/10.1128/AEM.71.7.4117-4120.2005
Gargallo-Garriga A., Sardans J., Alrefaei A.F., Klem K., Fuchslueger L., Ramírez-Rojas I., Donald J., Leroy C. et al. Tree Species and Epiphyte Taxa Determine the “Metabolomic niche” of Canopy Suspended Soils in a Species-Rich Lowland Tropical Rainforest // Metabolites. 2021. V. 11. P. 718.
Huo Y., Kang J.P., Ahn J.C., Yang D.U., Yang D.C. Ornithinimicrobium panacihumi sp. nov., Antagonistic Bacteria Against Root Rot Fungal Pathogens, Isolated from Cultivated Ginseng Soil // Current Microbiol. 2019. V. 76. P. 22–28. https://doi.org/10.1007/s00284-018-1579-9
Leys N.M., Ryngaert A., Bastiaens L., Verstraete W., Top E.M., Springael D. Occurrence and phylogenetic diversity of Sphingomonas strains in soils contaminated with polycyclic aromatic hydrocarbons // Appl. Environ. Microbiol. 2004. V. 70. P. 1944–1955. https://doi.org/10.1128/AEM.70.4.1944-1955.2004
Lincoln S.P., Fermor T.R., Tindall B.J. Janthinobacterium agaricidamnosum sp. nov., a soft rot pathogen of Agaricus bisporus // Int. J. Syst. Evol. Microbiol. 1999. V. 49. P. 1577–1589. https://doi.org/10.1099/00207713-49-4-1577
Mohagheghi A., Grohmann K., Himmel M., Leighton L., Updegraff D.M. Isolation and characterization of Acidothermus cellulolyticus gen. nov., sp. nov., a new genus of thermophilic, acidophilic, cellulolytic bacteria // Int. J. Syst. Bacteriol. 1986. V. 36. P. 435–443. https://doi.org/10.1099/00207713-36-3-435
Prashar P., Kapoor N., Sachdeva S. Rhizosphere: Its structure, bacterial diversity and significance // Rev. Environ. Sci. BioTechnol. 2013. V. 13. P. 63–77. https://doi.org/10.1007/s11157-013-9317-z
Pruesse E., Quast C., Knittel K. et al. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB// Nucleic Acids Res. 2007. V. 35. P. 7188–7196. https://doi.org/10.1093/nar/gkm864
Rob J.M. van Spanning, David J. Richardson, Stuart J. Ferguson. Introduction to the Biochemistry and Molecular Biology of Denitrification / Biology of the Nitrogen Cycle. Elsevier, 2007. P. 3–20. https://doi.org/10.1016/B978-044452857-5.50002-3
Rogel M.A., Hernández–Lucas I., Kuykendall L.D., Balkwill D.L., Martinez–Romero E. Nitrogen-fixing nodules with Ensifer adhaerens harboring Rhizobium tropici symbiotic plasmids // Appl. Environ. Microbiol. 2001. V. 67. P. 3264–3268. https://doi.org/10.1128/AEM.67.7.3264-3268.2001
Setiawan A., Setiawan F., Juliasih N., Widyastuti W., Laila A., Setiawan W.A., Djailani F.M. et al. Fungicide Activity of Culture Extract from Kocuria palustris 19C38A1 against Fusarium oxysporum // J. Fungi. (Basel). 2022. V. 8. P. 280. https://doi.org/10.3390/jof8030280
Walsh C.M., Gebert M.J., Delgado–Baquerizo M., Maestre F.T., Fierer N. A Global Survey of Mycobacterial Diversity in Soil // Appl. Environ. Microbiol. 2019. V. 85. P. 180. https://doi.org/10.1128/AEM.01180-19
Wang J., Zhang J., Ding K., Xin Y., Pang H. Brevundimonas viscosa sp. nov., isolated from saline soil // Int. J. Systematic Evolutionary Microbiol. 2012. V. 62. P. 2475–2479. https://doi.org/10.1099/ijs.0.035352-0
World Reference Base for Soil Resources 2014, Update 2015. International soil classification system for naming soils and creating legends for soil maps. Rome: FAO, 2015.
Дополнительные материалы отсутствуют.


