Почвоведение, 2023, № 6, стр. 758-773
Дыхательная активность и биоразнообразие микробиомов подзолистых почв постпирогенных еловых лесов Красноярского края и Республики Коми
И. Д. Гродницкая a, b, *, О. Э. Пашкеева a, В. В. Старцев c, А. А. Дымов c, d
a Институт леса им. В.Н. Сукачева ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, 50/28, Россия
b Сибирский федеральный университет
600041 Красноярск, пр. Свободный, 79, Россия
c Институт биологии ФИЦ Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
d МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, Россия
* E-mail: igrod@ksc.krasn.ru
Поступила в редакцию 19.10.2022
После доработки 06.02.2023
Принята к публикации 07.02.2023
- EDN: FPWOLC
- DOI: 10.31857/S0032180X22601347
Аннотация
Представлены данные по микробиологическим свойствам подзолистых почв (Retisols) старовозрастных еловых лесов на территории средней тайги Красноярского края и Республики Коми. Несмотря на различное географическое положение, почвы этих регионов характеризуются близкими морфологическими и физико-химическими свойствами. В почвах ельников Республики Коми и Красноярского края не обнаружено достоверной разницы в накоплении микробной биомассы и скорости микробного дыхания. Однако содержание в почвах углерода и азота, а также микробной биомассы оказывало значимое влияние на качественный состав микробиомов пирогенных и непирогенных горизонтов почв. Отмечено существенное влияние пирогенного фактора на α-разнообразие бактерий и грибов. Показано, что при освоении органического вещества с наличием пирогенного углерода активно участвуют представители доминантных фил бактерий (Proteobacteria, Actinobacteria и Planctomycetes) и грибов (Ascomycota, Basidiomycota и Mucoromycota). В состав микробиомов верхних пирогенных подгоризонтов входят группы карботрофных бактерий (Thermomonosporaceae, Isosphaeraceae, Bacillaceae, Xanthobacteraceae) и грибов из классов Dothideomycetes (р. Cenococcum), E-urotiomycetes (р. Penicillium), Sordariomycetes (р. Trichoderma), Leotiomycetes (р. Oidiodendron), Umbelopsidomycetes (р. Umbelopsis), которые способны к преобразованию продуктов пиролиза в доступные и нетоксичные субстраты для других организмов.
ВВЕДЕНИЕ
Подзолистые почвы преимущественно развиваются под темнохвойными лесами с доминированием ели и пихты. Они занимают значительные территории на Европейском Севере и в Сибири. Среднетаежные почвы Республики Коми содержат значительные запасы углерода 7.69 ± 0.12 кг/м2 [31]. В подзолистых почвах Красноярского края содержится около 11.1 ± 1.0 кг С/м2 [15]. Темнохвойные леса повергаются пожарам существенно реже, чем сосновые. При этом в годы с затяжными сухими периодами темнохвойные леса горят на значительных пространствах, что приводит к гибели древостоя [14]. После пожара из биомассы и детрита углерод преобразуется в основном в газообразные формы (CO2, CO и CH4), а из-за неполного сгорания биомассы и органического вещества почвы около 1–3% – в пирогенный C. В почве пирогенный C с трудом поддается минерализации и сохраняется более длительное время (от столетий до тысячелетий), по сравнению с непирогенно-измененным органическим веществом (от десятилетий до столетий) [29, 35]. В литературе есть сведения, что пожары в бореальных лесах производят 7–17 Тг пирогенного углерода в год. Его вклад может составлять от 1.6 до 60% от общего содержание органического углерода в почве [11, 35].
В результате пожаров и накопления пирогенного углерода существенно изменяются физико-химические свойства почвы, их водно-воздушный и гидротермический режимы, происходит изменение количества и стабильности органического вещества, что оказывает непосредственное влияние на их биологические свойства [3, 4, 26, 33]. Почвенные микроорганизмы играют фундаментальную роль в регуляции биогеохимических циклов в наземных экосистемах. Поскольку из-за термической деструкции органического вещества происходит снижение и изменение его качества, это отражается на состоянии почвенной микробиоты, содержании микробной биомассы и на скорости процессов минерализации [28]. Тепловое воздействие уменьшает биомассу микроорганизмов. Уменьшение происходит за счет грибной биомассы, так как она наиболее уязвима и восстанавливается после пожаров гораздо медленнее, чем бактериальная. При этом изменяется композиция микробиома – в почве становится меньше грибов, которые менее устойчивы к нагреванию, чем бактерии. Их эндоспоры способны пережить значительный нагрев почвы [30, 39], и после пожара начинают доминировать спорообразующие грамположительные бактерии. В некоторых выжженных почвах бактериальная биомасса может увеличиваться до 80% от общей микробной [25, 34]. Изменения в почвенном микробиоме, определяемые влиянием пирогенного углерода, сохраняются в течение длительного периода – от нескольких лет до десятилетий [27] и даже тысячелетий (например, в торфах и погребенных почвах) [6].
Почвенный микробиом играет заметную роль в восстановлении послепожарной экосистемы. Характер реколонизации обожженных почв неодинаков для грибов, гетеротрофных и негетеротрофных бактерий. В автоморфных почвах при выгорании органогенных горизонтов (подстилок) процессы колонизации микроорганизмами выгоревших участков идут интенсивно за счет развития бактериальных сообществ [33, 34]. Особенно значима роль актинобактерий (Actinobacteria) – представители родов Arthrobacter и Streptomyces активно участвуют в восстановлении баланса азота в постпирогенных почвах [4]. Динамика восстановления микробных сообществ в почвах лесных экосистем, подвергшихся пожарам, интенсивно изучается [2, 3, 25].
К настоящему времени наиболее полно изучены подзолы сосновых лесов [7, 25], в то время как влияние пожаров на биологическую активность подзолистых почв темнохвойных лесов – в меньшей степени. Иcследование микробиомов почв постпирогенных темнохвойных лесов позволит выявить специфику эталонных ненарушенных экосистем и дать оценку скорости их восстановления после пожаров. В этой связи актуально исследовать биологическую активность подзолистых почв темнохвойных лесов по горизонтам для оценки влияния пожаров на скорость минерализационных и почвовосстановительных процессов.
Цель работы – оценить и сравнить дыхательную активность и биоразнообразие бактерио- и микобиомов подзолистых почв в постпирогенных старовозрастных еловых лесах Красноярского края (Средняя Сибирь) и Республики Коми (Европейский север).
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследований. Исследования проводили в 2019–2020 гг. на подзолистых почвах [10], Retisols (WRB, 2014) [40], формирующихся в старовозрастных темнохвойных лесах, которые были подвержены пожарам от 100 до 204 лет назад. Исследуемые участки располагались на географически удаленных друг от друга территориях Красноярского края (Средняя Сибирь) и Республики Коми (Европейский север). Подробные морфологические, физико-химические свойства почв и геоботанический состав исследуемых участков ельников и их пирогенная история подробно описаны ранее [38]. Ниже приведена краткая характеристика участков.
На территории Красноярского края подзолистые почвы исследовали на правобережье р. Енисей, в окрестностях Средне-Енисейского стационара Института леса им. В.Н. Сукачева. Участки I-CS и II-CS расположены на левом берегу р. Вороговка. Разрез I-CS закладывали на вершине увала в межкроновом пространстве в ельнике чернично-зеленомошном (60°56′23.3″ N, 89°56′00.6″ E, h = 165 над ур. м.), где после пожара прошло 146 лет. Разрез участка II-CS закладывали на выположенном водораздельном участке ельника папоротничково-зеленомошного (60°57′11.5″ N, 89°53′06.6″ E, h = 179 над ур. м.) – 196 лет после пожара. Участок III-CS находился на правом берегу р. Порожняя, в ельнике чернично-зеленомошном (61°04′07.7″ N, 89°48′48.0″ E, h = 142 над ур. м.) – время после пожара не определено (не менее 150 лет).
В Республике Коми участок I-EN располагался в окрестностях национального парка “Койгородский” в заболоченном ельнике чернично-сфагновом с преобладанием сфагновых мхов (59°58′52.5″ N, 50°08′49.5″ E, h = 168 над ур. м.), с возрастом последнего пожара около 140 лет. Разрез II-EN закладывали в ельнике чернично-долгомошном (204 года после пожара) на территории Печоро-Илычского заповедника (62°03′49.5″ N, 58°27′02.6″ E, h = 210 над ур. м.). На третьем участке III-EN выбрали ельник чернично-зеленомошный (61°39′45.2″ N, 50°41′09.1″ E, h = 151 над ур. м.) (100 лет после пожара), который находился на территории Максимовского стационара Института биологии Коми НЦ УрО РАН. В нижней части подстилки во всех исследуемых почвах четко выражены углистые включения (микрочастицы углей).
Методы исследований. В образцах почвы участков ельников Красноярского края (п. Зотино) и Республики Коми определяли химические и микробиологические показатели.
Определение химических свойств почв. Кислотность торфов исследовали с помощью Edge HI2002-02 pH-метра (Hanna Instruments, Румыния) с цифровым электродом (±0.01 pH) при соотношении почва : раствор (для подстилок – 1 : 25, для минеральных горизонтов – 1 : 2.5) [17]. Содержание органического углерода и азота определяли на элементном анализаторе ЕА-1110 (Carlo Erba) в ЦКП “Хроматография” Института биологии Коми НЦ УрО РАН.
Дыхательную активность хемоорганотрофного микробного сообщества почв ельников исследовали методом субстрат-индуцированного дыхания (СИД), согласно методам [1, 13, 19, 37] определяли биомассу микроорганизмов (МБ), базальное дыхание (БД). Скорость продуцирования СО2 определяли на газовом хроматографе Agilent Technologies 6890 N Network GC, США. Микробную биомассу (МБ = Смик) почвенного образца исследовали согласно [37], пересчетом скорости СИД по формуле:
Вклад микробного углерода (Смик, %) в общее органическое вещество рассчитывали как Смик(%) × 100/Сорг. Подробно методики описаны ранее [5, 25].
Определение прокариот и грибов. Молекулярно-генетический анализ образцов почв выполняли в Центре коллективного пользования Всероссийского НИИ сельскохозяйственной микробиологии (Пушкин, Санкт-Петербург).
Для выделения ДНК из образцов использовали набор реактивов (NucleoSpin Soil) компании Macherey-Nagel (Германия) согласно инструкции производителя. В каждом образце определяли таксономический состав грибного, бактериального и архейного сообществ. Таксономический анализ грибного сообщества исследовали на основании анализа ампликонных библиотек фрагментов рибосомальных оперонов грибов (ITS2), полученных методом ПЦР с использованием ITS1/ITS2 праймеров (GCATCGATGAAGAACGCAGC/TCCTCCGCTTATTGATATGC). Таксономический анализ бактериального сообщества проводили с универсальными праймерами F515/R806 на вариабельный участок гена 16SрРНК v4 (GTGCCAGCMGCCGCGGTAA/GGACTACVSGGGTATCTAAT), специфичными для широкого круга микроорганизмов, включая бактерии [20]. Таксономический анализ архей проводили с праймерами A956F/A1401R (TYAATYGGANTCAACRCC/CRGTGWGTRCAAGGRGCA) [23]. Все праймеры имели служебные последовательности, содержащие линкеры и индексные последовательности (необходимые для секвенирования по технологии Illumina).
Для разных наборов праймеров выбирали одну и ту же программу ПЦР: реакционная смесь (15 мкл) содержала 0.5 ед. активности ДНК-полимеразы Q5® High Fidelity (NEB, США), по 5 пМ прямого и обратного праймеров, 10 нг шаблон ДНК и 2 нМ каждого dNTP (Life Technologies). Смесь денатурировали при 94°С 1 мин, после чего следовало 25 циклов: 94°С – 30 с, 50°С – 30 с, 72°С – 30 с. Финальную элонгацию проводили при 72°С 3 мин. ПЦР-продукты очищали по рекомендованной Illumina методике с использованием AMPureXP (Beckman Coulter, США). Дальнейшую подготовку библиотек проводили в соответствии с инструкцией производителя MiSeq Reagent Kit Preparation Guide (Illumina) [42].
Библиотеки секвенировали в соответствии с инструкцией изготовителя на приборе Illumina MiSeq (Illumina, США) c использованием набора реактивов MiSeq® Reagent Kit v3 (600 cycle) с двусторонним чтением (2 × 300 п. н.). Первоначальную обработку полученных данных, а именно демультиплексирование образцов и удаление адаптеров, проводили с помощью программного обеспечения Illumina (США). Для последующего деноизинга, объединения последовательностей, восстановления исходных филотипов (ASV, Amplicon sequence variant), удаления химерных прочтений и дальнейшей таксономической классификации полученных ASV (с использованием базы данных SSU 16s rRNA SILVA и Unite для грибов) (релиз 132 [36]) применяли программные пакеты dada2 [21], phyloseq [31] и DECIPHER [41], работа которых осуществлялась в программной среде R. Для представления данных таксономического анализа использовали средства программного пакета QIIME [22].
Для выявления зависимостей между микробиологической активностью в почвах ельников (I-CS, II-CS, III-CS и I-EN, II-EN, III-EN) и химическими параметрами проводили дисперсионный и корреляционный анализы; коэффициенты корреляции (r) были значимы при р < 0.05 (р < 0.01). С помощью кластерного анализа определяли различия прокариотного и грибного микробиомов подзолистых почв ельников по индексам биоразнообразия. Для подтверждения различий между химическими, микробиологическими параметрами исследуемых почв использовали метод главных компонент, при обработке полученных данных – программы Microsoft Excel 2003, Statistica 12, Past 3.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Морфологические, физико-химические и химические характеристики почв ельников. Подзолистые почвы исследованных старовозрастных еловых лесов Республики Коми и Красноярского края характеризуются сходными морфологическими и химическими свойствами. Органогенные горизонты состоят из нескольких подгоризонтов (O(L), O(F), O(H)). Наибольшее число углистых включений наблюдается в нижних подгоризонтах подстилки: O(H)pyr или O(F + H)pyr, в верхней части подзолистого горизонта – наличие углистых включений и потечности органического вещества. Ниже расположен субэлювиальный горизонт (BEL) c характерными языками. Текстурные горизонты расположены на глубине от 55 до 100 см и характеризуются типичной многопорядковой структурой (табл. 1). В отдельных исследуемых разрезах на территории Сибири выявлено близкое подстилание плотной породой, состоящей из слабоокатанных остатков известняка (III-CS) и песчаников (I-CS).
Таблица 1.
Некоторые химические свойства ельников Красноярского края и Республики Коми
| Участок, разрез | Горизонт | Глубина, см | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ | С, % | N, % | C/N |
|---|---|---|---|---|---|---|
| I-CS | O(L) | 0–2 | 5.4 | 37.3 | 1.13 | 39 |
| O(F + H)pyr | 2–5 | 4.3 | 42.4 | 1.48 | 33 | |
| ELpyr | 5–18 | 4.1 | 4.8 | 0.23 | 24 | |
| EL1 | 18–30 | 5.1 | 0.85 | 0.058 | 17 | |
| EL2 | 30–55 | 5.2 | 0.52 | 0.044 | 14 | |
| BT1 | 55–75 | 5.3 | 0.31 | 0.039 | 9 | |
| BT2 | 75–90 | 5.6 | 0.27 | 0.044 | 7 | |
| II-CS | O(L) | 0–2 | 5.1 | 48 | 1.42 | 39 |
| O(F + H)pyr | 2–5 | 4.4 | 39.8 | 1.71 | 27 | |
| ELhi | 5–10 | 4.3 | 1.6 | 0.035 | 53 | |
| EL1 | 10–35 | 5.1 | 0.38 | 0.035 | 13 | |
| EL2 | 35–60 | 5.5 | 0.28 | 0.03 | 11 | |
| BEL | 60–75 | 5.9 | 0.26 | 0.034 | 9 | |
| BT1 | 75–90 | 6.2 | 0.27 | 0.037 | 8 | |
| BT2 | 90–110 | 6.3 | 0.31 | 0.044 | 8 | |
| III-CS | O(L) | 0–2 | 5.0 | 46 | 1.23 | 44 |
| O(F + H)pyr | 2–5 | 4.4 | 39.9 | 1.43 | 33 | |
| ELhi | 5–17 | 4.6 | 2.7 | 0.123 | 26 | |
| EL1 | 17–30 | 5.2 | 0.76 | 0.048 | 18 | |
| EL2 | 30–50 | 5.3 | 0.45 | 0.039 | 13 | |
| BEL | 50–70 | 6.0 | 0.37 | 0.046 | 9 | |
| BT1 | 70–90 | 7.3 | 0.79 | 0.05 | 18 | |
| I-EN | O + очес | 0–3 | 4.6 | 36.6 | 1.11 | 38 |
| O(F) | 3–11 | 4.1 | 47.0 | 1.32 | 42 | |
| O(H)pyr | 11–16 | 4.4 | 28.1 | 1.00 | 33 | |
| Eg | 16–30 | 4.8 | 1.8 | 0.08 | 26 | |
| BFg | 30–50 | 5.2 | 0.47 | 0.05 | 11 | |
| BEL | 50–75 | 5.4 | 0.26 | 0.04 | 8 | |
| BT | 75–90 | 5.7 | 0.23 | 0.04 | 7 | |
| II-EN | O(L) | 0–2 | 5.1 | 41.5 | 1.43 | 34 |
| O(F) | 2–6 | 4.2 | 44.7 | 1.73 | 30 | |
| O(H)pyr | 6–8 | 4.1 | 42.1 | 0.68 | 72 | |
| ELhi | 8–12 | 4.2 | 3.0 | 0.15 | 23 | |
| ELbf | 12–15 | 4.4 | 2.8 | 0.15 | 22 | |
| EL | 15–20 | 4.7 | 1.4 | 0.08 | 20 | |
| BEL1 | 20–35 | 4.9 | 0.5 | 0.05 | 12 | |
| BEL2 | 35–55 | 5.2 | 0.34 | 0.04 | 10 | |
| BT1 | 55–80 | 5.6 | 0.2 | 0.04 | 6 | |
| BT2 | 80–100 | 6.1 | 0.14 | 0.03 | 5 | |
| III-EN | O(L) | 0–1 | 6.0 | 22.0 | 1.00 | 26 |
| O(F) | 1–4 | 5.3 | 27.1 | 1.36 | 23 | |
| O(H) | 4–6 | 4.8 | 23.3 | 0.73 | 37 | |
| ELhi | 6–10 | 4.7 | 0.91 | 0.07 | 15 | |
| ELbf | 10–25 | 5.1 | 0.39 | 0.03 | 15 | |
| EL | 25–35 | 5.6 | <0.1 | <0.01 | Неопр. | |
| BEL | 35–45 | 5.7 | <0.1 | 0.02 | » | |
| BT1 | 50–70 | 5.9 | 0.16 | 0.03 | 6 | |
| BT2 | 70–100 | 6.2 | 0.12 | 0.02 | 7 |
Почвы характеризуются от сильнокислых до близких к нейтральным значениям рН (4.1–6.0 ед.) в органогенных горизонтах. Минеральные горизонты менее кислые, значения рН плавно увеличиваются по профилю. Максимальные значения рН до 7.3 ед. выявлены в текстурных горизонтах с близким подстиланием известняка. Среди минеральных горизонтов наиболее кислыми являются верхние элювиальные (4.1–4.7 ед. рН).
Распределение содержания органического углерода и азота носит регрессивно-аккумулятивный характер. Максимальные концентрации выявлены для органогенных горизонтов, с глубиной содержание С значительно снижается. В подстилках почв Республики Коми содержание углерода варьировало от 22 до 47%, азота – 0.68–1.73%. В органогенных горизонтах почв Красноярского края содержание углерода изменялось в пределах 37.3–48.0%, содержание азота – 1.13–1.71%. Минеральные горизонты почв содержат значительно меньшие концентрации углерода и азота. Наблюдается резкое уменьшение их содержания от подстилок к минеральным горизонтам, затем плавное уменьшение – с глубиной. В минеральных горизонтах почв Республики Коми содержание углерода варьировало от 0.14 до 3.0%, азота – 0.014–0.15%. В подзолистых почвах Красноярского края минеральные горизонты содержали 0.26–2.7% общего углерода и 0.030–0.123% – общего азота. Основное количество органического углерода и азота сосредоточено в пирогенных и грубогумуссированных подгоризонтах O(H)pyr/O(F + H) подстилки и верхних минеральных потечногумусовых и пирогенных горизонтах ELhi/ELpyr. Отмечено, что в пирогенном горизонте участка II-EN (204 года после пожара) накапливается большее содержание углерода и меньшее азота, по сравнению с другими участками ельников Республики Коми. В Красноярском крае на участках ельников в пирогенных горизонтах содержится от 40 до 42% С и в 2 раза больше N. Важным показателем органического вещества является его обогащенность азотом. Наиболее широкое отношение C/N выявлено для лесных подстилок. В них C/N изменяется от 23 до 72. Можно предположить, что различия в составе органического вещества связаны со спецификой качественного состава, а не с принадлежностью к региону. В минеральных горизонтах отношение становится существенно уже – от 6.7 до 53.3. Общая тенденция профильного изменения – сужение отношений C/N с глубиной в индивидуальных разрезах.
На основании химических параметров почв старовозрастных ельников можно констатировать, что исследуемые подзолистые почвы характеризуются типичными морфологическими и химическими свойствами, близкими к ранее описанными для этих регионов исследований [7–9, 12, 16].
Микробиологические характеристики почв ельников. Подзолистые почвы исследуемых ельников характеризуются высокими значениями МБ в органо-минеральном слое, которые с глубиной закономерно убывают. Содержание МБ в почвах приурочено к содержанию Сорг и N, также убывающих по профилю. В ельниках Красноярского края и Республики Коми наибольшие значения МБ (1309 и 1187 мкг С/г почвы) и БД (6.04 и 24.34 мкг С–СО2/(ч г) соответственно) отмечены в подстилках (OL + очес и O(F)) (рис. 1), где в процессе дыхания участвуют не только микроорганизмы, но и живые (или частично разложившиеся) мхи, что способствует увеличению дыхания (БД). На дыхательную активность микробных сообществ (МБ, БД) влияло содержание углистых включений, что было отмечено ранее для подзолов в сосняках [25]. Повышенные значения МБ и БД характерны для пирогенных горизонтов подстилок (O(F + H)pyr) (МБ – 800 и 338 мкг С/г почвы и БД – 11.47 и 14.81 мкг С–СО2/(ч г) соответственно). Поскольку в пирогенных горизонтах подзолистых почв сосредоточено большее содержание углерода, в том числе неорганического (в виде угля или угольной пыли) и азота, то и значения микробной биомассы в них также завышены, по сравнению с непирогенными [25]. Существенное снижение МБ (в 4–20 раз), как и Сорг, на всех участках отмечено в последующих после пирогенных горизонтах EL1 и ELhi, где углистых включений меньше или вовсе отсутствуют. Возможно, в этих горизонтах термическое влияние пожара повлияло на некоторые качественные характеристики почвы таким образом, что они не восстановились до изначального состояния, несмотря на длительный период [35].
Рис. 1.
Содержание микробной биомассы (МБ) и интенсивность дыхания (БД) в подзолистых почвах ельников Красноярского края (п. Зотино) и Республики Коми.
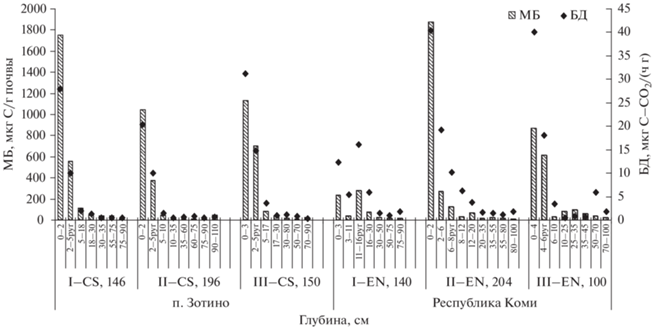
В минеральных горизонтах отмечено низкое содержание МБ, убывающее вниз по профилю (рис. 1), что свойственно для автоморфных почв. Средние значения МБ и БД по профилю участков мало различались между собой (в среднем в 1.3 раза), с преимуществом почв Сибири – МБ: 363 (I-CS), 214 (II-CS), 285 (III-CS) и 95 (I-EN), 245 (II-EN), 332 (III-EN) мкг С/г почвы. Различия в интенсивности микробного дыхания (БД) были заметнее (в 1.6 раз) – 6.11 (I-CS), 4.91 (II-CS), 7.56 (III-CS) и 6.3 (I-EN), 8.98 (II-EN), 14.74 (III–EN) мкг С–СО2/(ч г). Значимая корреляционная зависимость отмечена между МБ и БД (r = 0.999; r = = 0.99 и r = 0.988), МБ и БД с Сорг (r = 0.8 и 0.81, r = 0.92 и 0.96; r = 0.98 и 0.94) соответственно по разрезам, а также с N (r = 0.74 и 0.76 (I-CS) и r = 0.93 и 0.86 (III–CS). Вклад углерода микробной биомассы в общее органическое вещество по участкам достоверно не отличался и в среднем составлял в почвах ельников Республики Коми от 0.16 до 0.27%, в ельниках Красноярского края (п. Зотино) – от 0.15 до 0.24%.
Рис. 2.
Положение горизонтов почв ельников Красноярского края и Республики Коми в плоскости двух главных компонент, полученных по основным химическим и микробиологическим характеристикам. Каждая точка характеризуется следующими почвенными параметрами: МБ, БД, рН, Сорг, N, Смик, %, Смик/Сорг, %.
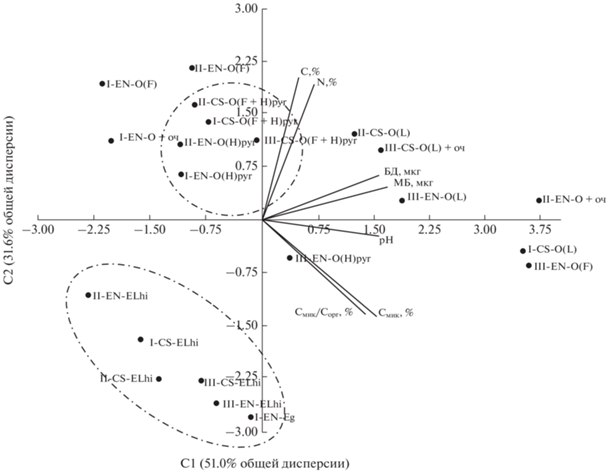
Методом главных компонент, проведенном на основе почвенных параметров, показаны различия пирогенных и непирогенных горизонтов подзолистых почв ельников Красноярского края и Республики Коми (рис. 2). На первую компоненту приходится 51.0% общей дисперсии, на вторую – 31.6%. В плоскости этих двух первых компонент выделяются два облака, различия между которыми определялись содержанием Сорг и МБ. Точки пяти участков с пирогенными горизонтами (pyr) объединились в одно облако, которые отстоят друг от друга в зависимости от времени пожара, а точка участка III-ENpyr (100 лет после пожара) находится на значительном отдалении. Второе облако по химическим и дыхательным характеристикам почв объединило постпирогенные горизонты (ELhi). В распределении точек (горизонтов) почвы в рамках этих облаков больший вклад вносили значения рН и базального дыхания (БД).
Таким образом, в подзолистых почвах ельников Европейского севера (Республика Коми) и севера Сибири (Красноярский край) значительной разницы в накоплении микробной биомассы и интенсивности дыхания не обнаружено, за исключением участка I-EN. Процессы деструкции органического вещества в верхних горизонтах (подстилке) идут интенсивно, с высокими значениями МБ и БД, в минеральных горизонтах – существенно снижены. Однако в зависимости от климатических особенностей двух регионов и времени после пожаров восстановительные процессы в почвах ельников Красноярского края и Республики Коми проходили с разной скоростью, пирогенные и непирогенные горизонты достоверно различались по кислотности, микробному дыханию и содержанию углерода.
Оценка бактериального и грибного разнообразия почв ельников. Для всех проанализированных образцов исследуемых почв были рассчитаны индексы α-разнообразия для прокариотных и грибных сообществ пирогенного и непирогенного горизонтов почв каждого участка. Оценка и сравнение биоразнообразия прокариот проведены на уровне типов (фил), по отдельным классам (табл. 2) и родам (рис. 3).
Таблица 2.
Индексы α-разнообразия бактерий и грибов для участков подзолистых почв ельников Красноярского края и Республики Коми в зависимости от времени после пожара
| Индекс | Красноярский край | Республика Коми | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I-CS, 146 лет | II-CS, 196 лет | III-CS, 150 лет | I-EN, 140 лет | II-EN, 204 года | III-EN, 100 лет | |||||||
| O(H)pyr | EL | O(F + H)pyr | ELhi | O(F + H) pyr | ELhi | O(F) | O(H)pyr | O(H)pyr | ELhi | O(H)pyr | ELhi | |
| глубина, cм | ||||||||||||
| 2–5 | 6–10 | 2–5 | 5–10 | 2–5 | 5–17 | 3–11 | 11–16 | 6–8 | 8–12 | 4–6 | 6–10 | |
| Бактерии | ||||||||||||
| Шеннон | 3.67 | 3.85 | 3.70 | 3.77 | 3.77 | 3.70 | 2.88 | 2.97 | 3.53 | 3.77 | 3.77 | 3.47 |
| Бергер–Паркер | 5.82 | 5.13 | 6.20 | 5.82 | 7.25 | 4.16 | 3.37 | 3.42 | 6.57 | 4.31 | 5.15 | 7.16 |
| Маргалеф | 3.57 | 4.41 | 3.38 | 4.04 | 3.44 | 3.97 | 2.98 | 2.82 | 3.69 | 4.41 | 3.95 | 3.89 |
| Менхиник | 2.87 | 4.22 | 2.84 | 3.78 | 2.96 | 3.53 | 2.64 | 2.53 | 3.21 | 4.43 | 3.33 | 3.38 |
| Симпсон | 0.91 | 0.91 | 0.91 | 0.91 | 0.91 | 0.90 | 0.81 | 0.84 | 0.90 | 0.87 | 0.87 | 0.90 |
| Грибы | ||||||||||||
| Шеннон | 2.32 | 2.82 | 2.74 | 2.55 | 2.29 | 2.92 | 2.40 | 2.38 | 2.08 | 2.34 | 2.63 | 2.54 |
| Бергер–Паркер | 2.23 | 3.25 | 3.37 | 3.02 | 2.20 | 4.03 | 2.79 | 2.66 | 2.86 | 2.15 | 2.93 | 2.78 |
| Маргалеф | 1.96 | 2.26 | 2.40 | 2.41 | 1.66 | 1.81 | 2.71 | 2.72 | 1.96 | 1.66 | 2.41 | 1.96 |
| Менхиник | 1.43 | 1.61 | 1.72 | 1.71 | 1.20 | 1.34 | 1.90 | 1.92 | 1.4 | 1.23 | 1.70 | 1.44 |
| Симпсон | 0.72 | 0.82 | 0.81 | 0.77 | 0.72 | 0.85 | 0.75 | 0.74 | 0.74 | 0.72 | 0.79 | 0.78 |
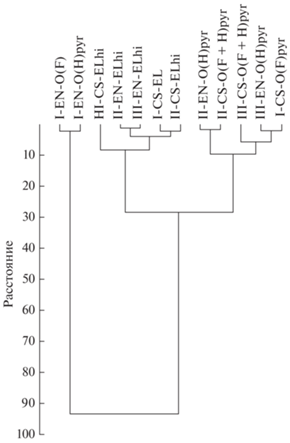
Рис. 3.
Вертикальная древовидная диаграмма кластерного анализа горизонтов почв исследованных участков на основе индексов биоразнообразия грибных и бактериальных сообществ (Шеннона, Беркер-Паркера, Симпсона, Маргалефа и Менхиника).
Анализ индексов биологического разнообразия, проведенный на основе классов прокариот и грибов, не показал достоверного отличия почв Красноярского края и Республики Коми по грибному разнообразию. Так, видовое богатство, степень доминирования и плотность грибов, описываемые индексами Шеннона, Бергера–Паркера и Маргалефа, были практически равны. В то же время по прокариотному сообществу отмечалась небольшая, но достоверная разница (p < 0.005) между почвами двух регионов. Подзолистые почвы участков ельников Красноярского края отличались более сложной структурой бактериальных сообществ, видовым богатством и при этом большей степенью доминирования определенных видов (описываемые индексами Шеннона и Симпсона), чем в Республике Коми.
Схожая ситуация отмечалась и при анализе биологического разнообразия пирогенных и непирогенных горизонтов почв. Индексы биологического разнообразия грибного сообщества достоверно не зависели от пирогенного фактора, но плотность прокариотических видов показала зависимость от этого фактора. Индексы Маргалефа и Менхиника, описывающие плотность видов и видовое богатство на исследуемой территории, достоверно отличались и были выше в пирогенных горизонтах, например, индекс Маргалефа в среднем составлял 3.47, а пирогенных – 3.95.
Таким образом, принадлежность почвы к определенному региону и послепожарному участку оказывала влияние на структуру, обильность видов бактериального сообщества, в то время как пирогенный фактор больше влиял на показатели его плотности. Грибы, как неотъемлемая часть почвенного сообщества, оказались более консервативными. Корреляционный анализ индексов биоразнообразия и основных почвенных параметров показал существенное влияние на значения индекса Бергера–Паркера (бактерии) и индексов Маргалефа и Менхиника (грибы) таких параметров, как содержание С, N, МБ, рН, Смик/Сорг (в среднем r > 0.69).
Вертикальная дендрограмма (кластерный анализ) по индексам биоразнообразия грибов и бактерий иллюстрирует распределение горизонтов почв ельников в зависимости от расположения участков и региона исследований. На дендрограмме отчетливо видно, что почва участка ельника чернично-сфагнового (заболоченный) Республики Коми выделилась в отдельный кластер, в нем разделились непирогенный (I-EN-O(F) и пирогенный (I-EN-O(H)pyr) горизонты. Остальные участки находились в другом кластере. На втором шаге прослеживается закономерность объединения исследуемых горизонтов почв ельников на основании их положения в разрезе (глубины), на четвертом шаге хорошо видна зависимость от их принадлежности к пирогенным и непирогенным горизонтам, причем регионы расположения ельников значения не имели. Так, на втором шаге объединяются в один кластер горизонты II-EN–ELhi и III-EN–ELhi, на третьем – к ним присоединяются I-CS–EL и II-CS–ELhi. На четвертом шаге формируются два больших кластера, в один из них входят все непирогенные горизонты, во второй – пирогенные. Большей схожестью выделяются II-EN O(H)pyr и II-CS O(F + H)pyr, что, вероятно, связано с периодом после пожаров (204 года и 196 лет). Таким образом, кластерный анализ показал, что на степень схожести исследуемых вариантов почв бόльшее влияние оказывала глубина залегания горизонтов и их пирогенность, чем регион отбора, за исключением заболоченной почвы ельника чернично-сфагнового (I-EN–O(F) и I-EN–O(H)pyr). В исследованиях [37] иерархический кластерный анализ выявил, что участки с разной пожарной историей образуют отдельные кластеры, свидетельствующие о возможных различиях в поддержании основных биогеохимических почвенных процессов.
Качественный состав бактерио- и микобиомов почв ельников. В освоении пирогенных горизонтов почв всех ельников активное участие отводится бактериям, среди них доминируют представители трех фил: Proteobacteria, Actinobacteria, Acidobacteria – до 50% в ельниках Красноярского края (п. Зотино), и до 37% – в Республики Коми, а на участке I-EN – до 70% (табл. 3). Высока доля в почвах ельников и Planctomycetes (до 10%), которые являются обитателями сложных биотопов с возможностью метаболизировать целый спектр различных полимеров [24]. В пирогенных горизонтах в зависимости от участка доля Actinobacteria и Planctomycetes в среднем превышала в 1.5–4.5 раза таковые в непирогенных, что согласуется с данными работы [32].
Таблица 3.
Относительное содержание прокариот и грибов на уровне типов в почвах ельников Красноярского края и Республики Коми, %
| Таксономическая принадлежность, Phylum |
Доля OTЕ от общего числа полученных последовательностей | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Красноярский край | Республика Коми | |||||||||||
| I-CS, 146 лет | II-CS, 196 лет | III-CS, около 150 лет | I-EN, 140 лет | II-EN, 204 года | III-EN, 100 лет | |||||||
| O(H)pyr | EL | O(F+H)pyr | ELhi | O(F + H) pyr | ELhi | O(F) | O(H)pyr | O(H)pyr | ELhi | O(H)pyr | ELhi | |
| глубина, см | ||||||||||||
| 2–5 | 6–10 | 2–5 | 5–10 | 2–5 | 5–17 | 3–11 | 11–16 | 6–8 | 8–12 | 4–6 | 6–10 | |
| BACTERIA | ||||||||||||
| Proteobacteria | 22.63 | 15.1 | 23.57 | 19.48 | 19.64 | 24.89 | 28.42 | 26.31 | 16.94 | 16.07 | 18.77 | 14.19 |
| Actinobacteria | 16.6 | 8.63 | 10.3 | 6.8 | 10.68 | 6.9 | 10.3 | 15.37 | 11.19 | 6.31 | 6.52 | 7.06 |
| Acidobacteria | 11.25 | 3.5 | 6.16 | 3.00 | 7.14 | 5.57 | 33.05 | 29.39 | 6.03 | 3.22 | 5.00 | 2.37 |
| Planctomycetes | 10.16 | 2.24 | 8.12 | 3.00 | 8.24 | 2.71 | 2.17 | 6.56 | 6.54 | 1.58 | 9.54 | 5.49 |
| Bacterioidetes | 2.75 | 1.00 | 2.28 | 1.25 | 2.36 | 2.31 | 2.88 | 2.49 | 0.93 | 1.81 | 1.38 | 0.94 |
| Verrucomicrobia | 1.39 | 2.77 | 1.92 | 3.03 | 1.99 | 4.71 | 7.49 | 4.89 | 1.62 | 3.88 | 2.33 | 2.69 |
| Firmicutes | 0.22 | 0.21 | 0.74 | 0.12 | 0.23 | 0.45 | 0.1 | 0.15 | 1.77 | 0.1 | 7.71 | 14.47 |
| Cyanobacteria/Chloroplast | 0.03 | 0.04 | 0.02 | 0.03 | 0.06 | 0.04 | 0.07 | 0.02 | 0.05 | 0.008 | 0.08 | 0.01 |
| Myxococcota | 0.32 | 0.27 | 0.38 | 0.33 | 0.27 | 0.5 | 0 | 0 | 0.38 | 0.3 | 0.72 | 0.24 |
| Chloroflexi | 0 | 0.27 | 0 | 0.02 | 0 | 0.03 | 0.09 | 0.7 | 0 | 0.01 | 0.16 | 0.05 |
| Unclassified_Bacteria | 1.47 | 2.21` | 1.82 | 1.76 | 1.81 | 3.17 | 9.54 | 9.48 | 0.96 | 1.92 | 1.7 | 2.59 |
| Unclassified_Others | 33.17 | 63.68 | 44.65 | 61.11 | 47.48 | 47.77 | 0.78 | 1.46 | 53.58 | 64.42 | 46.02 | 49.8 |
| FUNGI | ||||||||||||
| Ascomycota | 25.04 | 61.91 | 75.07 | 60.99 | 58.11 | 38.35 | 34.184 | 33.61 | 98.88 | 78.79 | 73.66 | 73.73 |
| Basidiomycota | 22.85 | 5.31 | 16.42 | 27.55 | 11.32 | 19.81 | 44.32 | 56.69 | 0.40 | 12.40 | 13.48 | 6.98 |
| Mortierellomycota | 4.93 | 2.17 | 2.98 | 6.43 | 0.04 | 0.06 | 15.18 | 3.94 | 0.04 | 1.18 | 2.12 | 0.11 |
| Mucoromycota | 44.94 | 29.60 | 2.05 | 1.75 | 30.22 | 37.31 | 0.99 | 1.52 | 0.07 | 6.10 | 9.30 | 16.87 |
| Unclassified_Fungi | 2.24 | 1.01 | 6.45 | 3.28 | 0.31 | 4.47 | 5.32 | 4.24 | 0.61 | 1.53 | 1.44 | 2.31 |
Ранее проведенные исследования микробной биомассы почв бореальных лесов показали высокое содержание в ней грибов [18]. Микобиота активно участвует в деструкции органики, в том числе пирогенных остатков. Вклад представителей Ascomycota, Basidiomycota и Mucoromycota в ельниках Сибири и Республики Коми различен. Так, в ельниках Красноярского края доминировали представители Ascomycota и Mucoromycota (I-CS и III-CS), а в ельниках Коми – Basidiomycota (I-EN) и Ascomycota (II-EN и III-EN).
По качественному составу прокариот и грибов почвы ельников Республики Коми и Красноярского края различаются между собой. Кроме того, почвы ельников Коми характеризуются орографической неоднородностью и удаленностью участков друг от друга, что делает различия между ними значительными.
В ельниках Республики Коми участок I-EN (140 лет после пожара) расположен на заболоченной местности, что определяет развитие бактерио- и микобиомов. Согласно индексам биоразнообразия (Маргалефа и Менхиника, Бергер–Паркера), участок I-EN отличает от других высокое видовое богатство и сложность сообщества. Почва в ельнике I-EN существенно выделяется по своим характеристикам. На участке I-EN развивается микробиота, характерная для полугидроморфных почв [6]. В ней доминируют ацидобактерии (Acidobacteria) – около 43% в непирогенном и 38% – в пирогенном горизонтах, это представители групп Gp1, Gp2, Gp3 и un_Acidobacteria.
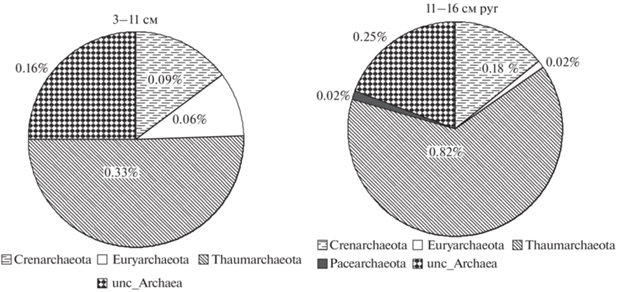
Кроме того, отмечено присутствие разных типов домена Archaea (0.65–1.28%). Среди архей преобладают представители Thaumarchaeota (0.33–0.82%), представителей других фил значительно меньше (рис. 4). В пирогенном горизонте увеличивается количество представителей Thaumarchaeota (в 2.5 раза) и Crenarchaeota (в 1.9 раз), по сравнению с непирогенными. В образцах почв других ельников археи не обнаружены. Велика доля представителей Actinobacteria (5–9%), в пирогенном горизонте их в 2 раза больше. Среди актинобактерий доминируют представители семейства Thermomonosporaceae (р. Actinoallomurus). На долю Rhizobiales (сем. Xanthobacteraceae и Beijerinckiaceae) приходится от 3 до 6%, в пирогенном горизонте их в 1.6 раза больше. Планктомицеты (сем. Isosphaeraceae) составляют до 3.3%. В непирогенном горизонте доминируют unclassified_Burkholderiales (9.7%), Opitutus (3.2%) и unc_Gammaproteobacteria (6.5%). В целом в почве участка I-EN доля unc_Bacteria составляла от 8.8 и 10.3% (11–16pyr). Среди грибов доминируют представители Basidiomycota (44–57%), также отмечена высокая доля Mortierellomycota (15.2%). В пирогенном горизонте доминируют представители Agaricales из родов Inocube (26.7%), Russula и Lactarius (1.5%), в непирогенном – грибы рода Piloderma (4.3%), отмечено присутствие р. Mortierella (5.3%). Кроме того, высока доля неопределенных грибов un_Ascomycota (29–27%), un_Tremellomycetes (33.7–0.14%), un_Mortierellales (14–3%), un_Agaricomycetes (4.4%).
Рис. 4.
Распределение представителей домена ARCHAEA в пирогенном и непирогенном горизонтах почвы ельника I-EN (разрез 13-19).
Участок II-E – самый старовозрастный из исследованных (204 года после пожара). В пирогенном горизонте доли представителей Proteobacteria и Acidobacteria существенно не различались и составляли вместе 28.13%, в непирогенном – 8.06% (в 3.5 раза меньше). Среди них в пирогенном горизонте доминировали представители Rhizobiales (сем. Xanthobacteraceae – 6% и Beijerinckiaceae – 6.5%), Acetobacter (2.5%), Planctomycetes (сем. Isosphaeraceae – 6.4%), Acidobacteria_Subgroup 1 (5.5%), которых в 1.3–2 раза больше, чем в непирогенном горизонте. Среди грибов доминировали Ascomycota, в пирогенном горизонте преобладали представители порядка Saccharomycetales (35%), родов Penicillium (23%), Oidiodendron (18%), Coniochaeta (15.5%), в непирогенном – Trichoderma (42.5%), Anthracobia (12.9%), Atheliaceae (5%), Mucor (2.9%), Umbelopsis (2.1%).
Участок III-EN – самый молодой из исследованных (100 лет после пожара). Почва здесь характеризуется высоким (наибольшим по сравнению с II-EN) видовым разнообразием и богатством бактерио- и микобиомов. Содержание представителей доминантных фил Proteobacteria и Actinobacteria в пирогенном и непирогенном горизонтах было практически одинаковым, Acidobacteria и Planctomycetes в пирогенном горизонте в 1.7–2.2 раза больше, чем в непирогенном. Кроме того, отмечено увеличение доли представителей Firmicutes до 7.8–14.5%. В пирогенном горизонте доминировали Planctomycetes (сем. Isosphaeraceae – 9.2%), Rhizobiales (сем. Xanthobacteraceae – 7.6% и Beijerinckiaceae-3.5%), Acidobacteria_Subgroup 1 (4%), Acetobacter (1.8%), сем. Burkholderiaceae (3.3%) в непирогенном – Bacillaceae (13%), Actinobacteria (4%), unc_Bacteria (16%) и un_Bacillales (23%). Увеличение доли бактерий из родов Bacillus и Pseudomonas в пирогенном горизонте почвы ельника согласуется с другими исследованиями [32]. Среди грибов представителей Basidiomycota доминировали в пирогенном, а Mucoromycota – в непирогенном горизонтах. В пирогенном горизонте наибольшая встречаемость была среди родов Penicillium (34%), Coniochaeta – 26%, Cystofilobasidium – 6.5%. Oidiodendron (3.6%), Anthracobia – 4%, пор. Saccharomycetales – 2.8%, меньшая у Tylospora – 2.3%, Piloderma – 2.4%, Mortierеlla – 2.1%, Cenococcum – 2.3%. В непирогенном горизонте доминировали рр. Archaeorhizomyces – 22%, Claussenomyces – 33.4% и Umbelopsis – 17%.
В ельниках Красноярского края участки I-CS и II-CS располагались недалеко друг от друга (на левом берегу р. Вороговка) и, несмотря на различный возраст (146 и 196 лет), характеризовались схожей тенденцией развития микробиомов. Содержание представителей основных фил бактерий в пирогенном горизонте участков I-CS и II-CS было значительно выше, чем в непирогенном: Proteobacteria – в 1.5–1.2, Actinobacteria – в 1.9–1.5, Acidobacteria – в 3.2–2.2 и Planctomycetes – в 4.5–2.7 раза соответственно. Так, в пирогенном горизонте обоих участков доминировали Rhizobiales (сем. Xanthobacteraceae – 5.5–6.3% и Beijerinckiaceae – 4.4–6.3%), Acetobacter (3.5–2.2%), Planctomycetes (сем. Isosphaeraceae – 6.4%), Acidobacteria_Subgroup 1 (10.2–5.5%), сем. Burkholderiaceae (3.6–4.9%), Solirurobacteraceae (5.2–2.1%), в непирогенном – un_Bacteria (2.5–3.5%). Представители Bacillales присутствовали в минорном количестве (<1%) в пирогенном горизонте участка I-CS. В распределении грибов по участкам отмечено больше различий, чем бактерий. Так, в пирогенном горизонте I-CS доминировали представители Mucoromycota (Umbelopsis – 40%, Mucor –3.5%), Ascomycota и Basidiomycota было практически одинаковое количество, из них доминировали роды Helotiales – 3.3%, Oidiodendron – 11.3%, Piloderma – 3.7%, Tylospora – 5.4%, Russulla – 5.6%, Cenococcum – 2.3%. В непирогенном горизонте преобладали представители родов Penicillium (12.2%), Neurospora (3.4%), Archaeorhizomyces (10%). На участке II-CS в пирогенном горизонте доминировали представители Ascomycota (р. Penicillium – 30%, р. Trichoderma – 5.2%, пор. Helotiales – 8.5%, р. Coniochaeta – 5.2%), а также р. Umbelopsis (2%). Среди Basidiomycota доминировали Russulla (2.5%), Cortinarius (5%), Lactarius (2.5%), в непирогенном – Piloderma (4%), Tylospora (2.2%), а также Archaeorhizomyces (33%), и Mortierella (6.5%).
Участок III-CS находится на значительном удалении от участков I-CS и II-CS (на правом берегу р. Порожняя), возраст последнего пожара – более 150 лет [38]. Распределение представителей основных фил бактерий и грибов отличалось от двух предыдущих участков. Доля Actinobacteria, Acidobacteria и Planctomycetes в пирогенном горизонте была больше (в 1.3–3.1 раза), чем в непирогенном, а разнообразие Proteobacteria, наоборот, превышало в непирогенном (в 1.3 раза) горизонте. В пирогенном горизонте доминировали бактерии Planctomycetes (сем. Isosphaeraceae – 8.2%), A-cidobacteria_Subgroup 1 (5.5%), Burkholderiaceae (4.2%), un_Actinobacteria (2%), р. Solirurobacteraceae (2%). В непирогенном горизонте было больше бактерий Rhizobiales (сем. Xanthobacteraceae – 9.3% и Beijerinckiaceae – 3.5%), р. Acetobacter (3%), Bacillales присутствовали в незначительном количестве (<1%). Микобиота представлена в основном Ascomycota (58–38%) и Mucoromycota (30–37%), на долю Basidiomycota приходиилось от 11 до 20%. В пирогенном горизонте доминировали грибы родов Penicillium (45.4%), Mucor (22%), Cortinarius (10.3%), Umbelopsis (8.3%), содоминантами являлись Hormonema (3%), Trichoderma (2%), Coniochaeta (1.5%). В непирогенном горизонте в значительном количестве встречались представители родов Penicillium (19.2%), Claussenomyces (10.3%), Mucor (24.8%), Umbelopsis (12.5%), Russula (7.4%), пор. Saccharomycetales (6%), Saitozyma (3.1%).
Полагаем, что разность климатических условий и длительность послепожарных периодов оказывали влияние на развитие бактерио- и микобиомов почв исследуемых ельников. Участки отличались количественным и качественным составом доминантных видов (классов/родов). Качественные анализы микробиомов также свидетельствуют о сильном влиянии пирогенного фактора на α-разнообразие бактерий и грибов.
Важным объединяющим микробиомы почв ельников фактором является высокое разнообразие бактерий и грибов в пирогенных горизонтах, превышающее таковое в непирогенных горизонтах. Других общих закономерностей в развитии микробоценозов всех участков не отмечено.
ЗАКЛЮЧЕНИЕ
Показано, что, несмотря на значительное географическое разделение, в подзолистых почвах старовозрастных постпирогенных ельников Европейского севера (Республика Коми) и Средней Сибири (Красноярский край, п. Зотино) наблюдается целый ряд сходных свойств. Исследуемые почвы характеризуются похожими химическими и морфологическими свойствами. Содержание углерода и азота в почвах исследуемых участков различалось незначительно, с небольшим увеличением в сторону почв Сибири (>1.3 раз). Процессы деструкции органического вещества в верхних горизонтах (подстилке) идут интенсивно, с высокими значениями МБ и БД, в минеральных горизонтах – существенно снижаются. В почвах всех ельников отмечена тенденция снижения микробной биомассы в постпирогенных горизонтах, свидетельствующая об общей закономерности термического влияния на некоторые качественные характеристики почвы таким образом, что полноценное функционирование микробиомов не восстановилось до изначального состояния, несмотря на длительный период, прошедший после пожара. Для минерализации пирогенного углерода и продуктов пиролиза требуется более продолжительный период и особые группы микроорганизмов. В вовлечении пирогенного углерода в биохимический круговорот участвуют представители доминантных фил бактерий Proteobacteria, Actinobacteria, Acidobacteria, Planctomycetes и грибов Ascomycota, Basidiomycota, Mucoromycota. Содержание представителей этих фил в пирогенных горизонтах превышает таковое в непирогенных в 1.3–4.5 раза. Основные различия между исследуемыми участками и регионами заключаются в соотношении и качественном составе бактерио- и микобиомов пирогенных и непирогенных горизонтов почв ельников. Наибольшим видовым богатством и сложностью структуры микробиома выделялся участок I-EN (140 лет после пожара), расположенный в полугидроморфных условиях. В бактериобиоме только этого участка отмечено присутствие разных типов домена Archaea. Среди участков автоморфного типа выделялся самый молодой III-EN (100 лет после пожара), где видовое богатство также было повышенным, по сравнению с участком II-EN (204 года после пожара). В целом по структуре бактериальных сообществ отмечена небольшая, но достоверная разница (p < 0.005) между почвами двух регионов. Подзолистые почвы участков ельников Красноярского края отличались более сложной структурой бактериальных сообществ, видовым богатством и при этом большей степенью доминирования определенных видов. Кроме того, плотность биоразнообразия прокариот достоверно зависела от пирогенного фактора. Индексы биологического разнообразия грибного сообщества достоверно не зависели ни от региона исследований, ни от пирогенного фактора. Показано, что некоторые группы карботрофных бактерий и грибов способны преобразовывать продукты пиролиза. Среди бактерий это представители фил Actinobacteria и Planctomycetes, а также сем. Bacillaceae, Xanthobacteraceae, Thermomonosporaceae, Isosphaeraceae. Микобиота верхних пирогенных горизонтов богата карботрофными грибами из классов Dothideomycetes (р. Cenococcum), Eurotiomycetes (р. Penicillium), Sordariomycetes (р. Trichoderma), Leotiomycetes (р. Oidiodendron), Umbelopsidomycetes (р. Umbelopsis), активно преобразующих продукты пиролиза в доступные и нетоксичные субстраты для других организмов.
Список литературы
Ананьева Н.Д. Микробиологические аспекты самоочищения и устойчивости почв. М.: Наука, 2003. 222 с.
Богородская А.В., Кукавская Е.А., Каленская О.П., Буряк Л.В. Микробиологическая оценка состояния почв хвойных лесов Средней Сибири после пожаров разной интенсивности // Лесоведение. 2019. № 2. С. 138–156. https://doi.org/10.1134/S0024114819010030
Воздействие пожаров на компоненты экосистемы среднетаежных сосняков Сибири. Новосибирск: Наука, 2014. 232 с.
Гладков Г.В.,Чебыкина Е.Ю., Евдокимова Е.В., Иванова Е.А., Кимеклис А.К., Зверев А.О., Кичко А.А., Андронов Е.Е., Абакумов Е.В. Восстановление почвенного микробиома в различных почвенных горизонтах после верхового и низового лесных пожаров // Экологическая генетика. 2020. Т. 18. № 3. С. 343–356.
Гродницкая И.Д., Карпенко Л.В., Сырцов С.Н., Прокушкин А.С. Микробиологические особенности и стратиграфия торфов двух типов болот северной части Сым-Дубчесского междуречья (Красноярский край) // Известия РАН. Сер. Биологическая. 2018. № 2. С. 179–190.
Гродницкая И.Д., Карпенко Л.В., Пашкеева О.Э., Гончарова Н.Н., Старцев В.В., Батурина О.А., Дымов А.А. Влияние лесных пожаров на микробиологические свойства торфяных олиготрофных почв и торфяно-подзолов глеевых в болотах северной части Сым-Дубческого междуречья (Красноярский край) // Почвоведение. 2022. № 4. С. 454–468.
Дымов А.А., Дубровский Ю.А., Габов Д.Н., Жангуров Е.В., Низовцев Н.А. Влияние пожара в северотаежном ельнике на органическое вещество почвы // Лесоведение. 2015. № 1. С. 52–62.
Дымов А.А. Сукцессии почв в бореальных лесах Республики Коми. М.: ГЕОС, 2020. 336 с. https://doi.org/10.34756/GEOS.2020.10.37828
Забоева И.В. Почвы и земельные ресурсы Республики Коми. Сыктывкар: Коми книжное издательство, 1975. 343 с.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Красильников П.В. Устойчивые соединения углерода в почвах: происхождение и функции // Почвоведение. 2015. № 9. С. 1131–1144. https://doi.org/10.7868/S0032180X15090075
Лесные экосистемы Енисейского меридиана / Под ред. Плешикова Ф.И. Новосибирск: Изд-во СО РАН, 2002. 356 с.
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М: Изд-во МГУ, 1991. 303 с.
Медведева М.В., Бахмет О.Н., Ананьев В.А., Мошников С.А., Мамай А.В., Мошкина Е.В., Тимофеева В.В. Изменение биологической активности почв в хвойных насаждениях после пожара в средней тайге Карелии // Лесоведение. 2020. № 6. С. 560–574. https://doi.org/10.31857/S0024114820060066
Осипов А.Ф., Старцев В.В., Прокушкин А.С., Дымов А.А. Запасы углерода в основных типах лесных почв и древесных пород Красноярского края // Теоретическая и прикладная экология. 2023. № 1. (в печати)
Руднева Е.Н., Забоева И.В., Урусевская И.С. Почвенно-географическое районирование центральной и восточной частей европейской территории СССР // Подзолистые почвы центральной и восточной частей европейской территории СССР. Л.: Наука, 1981. 200 с.
Теория и практика химического анализа почв / Под ред. Воробьевой Л.А. М., 2006. 400 с.
Хабибуллина Ф.М., Кузнецова Е.Г., Васенева И.З. Микромицеты подзолистых и болотно-подзолистых почв в подзоне средней тайги на Северо-Востоке Европейской части России // Почвоведение. 2014. № 10. С. 1228. https://doi.org/10.7868/S0032180X14100049
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. № 3. P. 314–322.
Bates S.T., Berg-Lyons D., Caporaso J.G., Walters W.A., Knight R., Fierer N. Examining the global distribution of dominant archaeal populations in soil // ISME J. 2010. V. 5. P. 908–917.
Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data // Bioinformatics. 2014. V. 30(15). P. 2114–2120.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N. et al. QIIME allows analysis of high through put community sequencing data // Nature Methods. 2010. V. 7(5). P. 335–336. https://doi.org/10.1038/nmeth.f.303
Comeau A.M., Li W.K.W., Tremblay J-E., Carmack E.C., Lovejoy C. Arctic Ocean Microbial Community Structure before and after the 2007 Record Sea Ice Minimum // PLoS ONE. 2011. V. 6(11). P. e27492. https://doi.org/10.1371/journal.pone.0027492
Dedysh S.N., Ivanova A.A. Planctomycetes in boreal and subarctic wetlands: Diversity patterns and potential ecological functions // FEMS Microbiol Ecol. 2019. 95(2). https://doi.org/10.1093/femsec/fiy227
Dymov A.A., Gorbach N.M., Goncharova N.N., Karpenko L.V., Gabov D.N., Kutyavin I.N., Startsev V.V., Mazur A.S., Grodnitskaya I.D. Holocene and recent fires influence on soil organic matter, microbiological and physico-chemical properties of peats in the European North-East of Russia // Catena. 2022. V. 117. P. 106449. https://doi.org/10.1016/j.catena.2022.106449
Guerrero C., Mataix-Solera J., Gómez I., García-Orenes F., Jordán M.M. Microbial recolonization and chemical changes in a soil heated at different temperatures // Int. J. Wildland Fire. 2005. V. 14. P. 385–400.
Khodadad C.L., Zimmerman A.R., Green S.J., Uthandi S., Foster J.S. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments // Soil Biol. Biochem. 2011 V. 43(2). P. 385–392. https://doi.org/10.1016/j.soilbio.2010.11.005
Knicker H. How does fire affect the nature and stability of soil organic nitrogen and carbon? A review // Biogeochemistry. 2007. V. 85 P. 91–118. https://doi.org/10.1007/s10533-007-9104-4
Lehmann J., Liang B., Solomon D., Lerotic M., Luizão F., Kinyangi J., Schafer T., Wirick S., Jacobsen C. Near-edge X-ray absorption fine structure NEXAFS) spectroscopy for mapping nano-scale distribution of organic carbon forms in soil: Application to black carbon particles, Global Biogeochem. Cycles. 2005. V. 19. P. GB1013. https://doi.org/10.1029/2004GB002435
Mataix-Solera J., Guerrero C., García-Orenes F., Bárcenas G.M., Torres M.P. Forest fire effects on soil microbiology // Fire Effects on Soils and Restoration Strategies. Eds. A. Cerdà Science Publishers: Enfield, 2009. P. 133–175.
McMurdie P.J., Holmes S. phyloseq: An R Package for Reproducible Interactive Analysis and Graphics of Microbiome Census Data // PLoS ONE. 2013. V. 8(4). P. e61217. https://doi.org/10.1371/journal.pone.0061217
Osipov A.F., Bobkova K.S., Dymov A.A. Carbon stocks of soils under forest in the Komi Republic of Russia // Geoderma Regional. 2021. V. 27. P. e00427. https://doi.org/10.1016/j.geodrs.2021.e00427
Pandey A., Chaudhry Sh., Sharma A., Choudhary V.S., Malviya M.K., Chamoli S., Rinu K., Trivedi P., Palni L.M.S. Recovery of Bacillus and Pseudomonas spp. from the ‘Fired Plots’ Under Shifting Cultivation in Northeast India // Current Microbiology. 2011. V. 62. P. 273–280. https://doi.org/10.1007/s00284-010-9702-6
Pietikäinen J., Hiukka R., Fritze H. Does short-term heating of forest humus change its properties as a substrate for microbes? // Soil Biol. Biochem. 2000. V. 32. P. 277–288.
Preston C.M., Schmidt M.W.I. Black (pyrogenic) carbon: A synthesis of current knowledge and uncertainties with special consideration of boreal regions // Biogeosciences. 2006. V. 3(4). P. 397–420. https://doi.org/10.5194/bg-3-397-2006
Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., Peplies J., Glöckner F.O. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools. 2013.
Sparling G.T. The substrate-induced respiration method // Methods in applied soil microbiology and biochemistry. Academic Press, 1995. P. 397–404.
Startsev V.V., Yakovleva E.V., Kutyavin I.N., Dymov A.A. Fire Impact on Carbon Pools and Basic Properties of Retisols in Native Spruce Forests of the European North and Central Siberia of Russia // Forests. 2022. V. 13. P. 1135. https://doi.org/10.3390/f13071135
Sun H., Santalahti M., Pumpanen J., Köster K., Berninger F., Raffaello T., Asiegbu F.O., Jussi Heinonsalo J. Bacterial community structure and function shift across a northern boreal forest fire chronosequence // Sci Rep. 2016. V. 6. P. 32411. https://doi.org/10.1038/srep32411
World Reference Base for Soil Resources 2014, International Soil Classification System for Naming Soils and Creating Legends for Soil Maps, World Soil Res. Rep. no. 106, update 2015. FAO, Rome. www.fao.org
Wright E.S. Using DECIPHER v2.0 to Analyze Big Biological Sequence Data in R. // The R J. 2016. 8(1), 352–359. https://doi.org/10.1007/BF02927260
http://web.uri.edu/gsc/files/16s-metagenomic-library-prep-guide-15044223-b.pdf
Дополнительные материалы отсутствуют.


