Почвоведение, 2023, № 5, стр. 654-663
Обилие и разнообразие прокариотных сообществ пылеаэрозоля и городских почв на территории Москвы
Л. В. Лысак a, *, С. А. Шоба a, Т. В. Прокофьева a, А. М. Глушакова a, b, Н. В. Гончаров a, А. А. Белов a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b НИИ вакцин и сывороток им. И.И. Мечникова
105064 Москва, Малый Казенный пер., 5а, Россия
* E-mail: lvlysak@mail.ru
Поступила в редакцию 19.10.2022
После доработки 30.12.2022
Принята к публикации 30.12.2022
- EDN: IFETYW
- DOI: 10.31857/S0032180X22601359
Аннотация
Получена комплексная (количественная и качественная) характеристика прокариотных сообществ твердых атмосферных выпадений (пылеаэрозоля) и образцов почв на территории г. Москвы на участках с разной интенсивностью антропогенной нагрузки. Общая численность бактерий в исследованных образцах твердых атмосферных выпадений (ТАВ) была меньше численности бактерий в образцах почв; актиномицетный мицелий в образцах ТАВ не обнаружен, хотя отмечался в образцах почв. Численность сапротрофных культивируемых бактерий в образцах ТАВ была на порядок меньше, чем в поверхностных горизонтах урбаноземов и реплантозема, отобранных на тех же участках. Среди культивируемых бактерий в пылеаэрозолях преобладали бактерии рода Micrococcus, в почвах преобладали представители филума Proteobacteria. В образцах ТАВ обнаружены представители семейства Enterobacteriaceae среди которых имеются виды, являющиеся потенциальными патогенами человека. Максимальное видовое разнообразие бактерий семейства Enterobacteriaceae зафиксировано в образцах ТАВ, отобранных на участках с повышенной антропогенной и транспортной нагрузкой. Санитарно-показательная бактерия Escherichia coli обнаружена во всех образцах ТАВ, ее содержание варьировало от 10 до 100 КОЕ/г, что по степени эпидемической опасности характеризует ТАВ как умеренно опасные. Экологические индексы, рассчитанные для прокариотных сообществ in situ (баркодинг гена 16S рРНК), свидетельствуют о меньшем таксономическом разнообразии прокариотных сообществ ТАВ по сравнению с сообществами близко расположенных городских почв.
ВВЕДЕНИЕ
Одним из приоритетных направлений современных экологических исследований урбанизированных территорий (мегаполисов) является мониторинг пылевого загрязнения воздушной среды [41]. Пыль все чаще оказывается в числе основных загрязнителей воздуха крупнейших городов [40].
Главными компонентами твердого аэрозоля атмосферы являются почвенно-породные частицы, поднимаемые с поверхности земли в результате эрозионных процессов, а также первичные биологические аэрозольные частицы – организмы (аэропланктон) или их остатки: клетки бактерий, споры грибов, живые клетки водорослей, одноклеточные животные и др. [28, 36]. Но большая часть исследований уличной пыли связана с тем, что на территориях с активной антропогенной нагрузкой, куда можно причислить все мегаполисы мира, в составе атмосферного аэрозоля появляется множество загрязнителей минеральной и органической природы [30–34].
Тем не менее пылеаэрозоль является переносчиком не только сапротрофных микроорганизмов, но и возбудителей оппортунистических инфекций (потенциально патогенных микроорганизмов) и аллергенных видов микроорганизмов. Некоторые штаммы этих организмов могут проявлять устойчивость к известным, широко применяемым в медицине противомикробным средствам (антибиотикам) из-за горизонтального переноса генов устойчивости к антибиотикам в микробных сообществах [16, 38]. В свою очередь антибиотикорезистентные штаммы микроорганизмов в окружающей человека атмосфере несут большую опасность для населения с ослабленным иммунитетом [17, 18, 26]. Несмотря на осуществляемый в обязательном порядке контроль показателей общей запыленности атмосферы в урбоэкосистемах (показатели PM2.5 и PM10), роль твердых частиц в перемещении микроорганизмов в атмосфере и связь их с почвенными микроорганизмами изучена недостаточно [35].
Цель работы – изучение обилия и разнообразия прокариотных сообществ городской пыли и поверхностных горизонтов почв г. Москвы, на участках с различной антропогенной нагрузкой.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили на территории г. Москва, расположенного в центре Восточно-Европейской равнины, сложенной рыхлыми мелкодисперсными отложениями преимущественно ледникового и водно-ледникового происхождения. Климат региона умеренно-континентальный с холодной снежной зимой и умеренно теплым летом [14]. Материал для исследований собрали летом 2021 г.
Участок 1 расположен в центральном округе города на ул. Льва Толстого и включает Дом-музей Льва Толстого в Хамовниках с примыкающим к нему садом и окрестными дворами с жилыми и офисными зданиями. Ул. Льва Толстого представляет собой однополосную дорогу, осуществляющую транзитную функцию между соседними микрорайонами. Степень автотранспортной нагрузки – средняя. Отбор проб проводили с подоконников, стен и элементов забора (1.5 м от поверхности). Тип функционального использования – рекреационный, общественно-деловой. Образцы поверхностного горизонта почв отбирали на участке, примыкающем с юго-востока к музею-усадьбе, из урбанозема легкосуглинистого с подсыпками компоста под газоном в 5 м от дорожного полотна.
Участок 2 расположен в западном административном округе г. Москвы вдоль ул. Вересаева и включает непосредственно саму улицу, часть территории Института минералогии, геохимии и кристаллохимии редких элементов РАН (ИМГРЭ РАН), а также примыкающие дворовые территории и сквер. Ул. Вересаева – однополосная дорога, заканчивающаяся тупиком, характеризуется низкой степенью автотранспортной нагрузки. Сбор проб пыли проводили с подоконников и стен зданий (1.5 м от поверхности). Тип функционального использования – жилой и общественно-деловой. Образы почвы отбирали из верхнего горизонта урбанозема легкосуглинистого, вскрытого на территории института под газоном из злаков и рудеральных видов.
Участок 3 располагается в районе Дорогомилово в Западном административном округе г. Москвы на пересечении крупных автомагистралей города: Кутузовского проспекта и Третьего транспортного кольца (ТТК). ТТК – десятиполосная крупная транспортная артерия города, одна из трех основных кольцевых магистралей, характеризуется высокой степенью автотранспортной нагрузки. Участок обособлен от примыкающих территорий шумозащитными экранами. Пробы пыли отбирали с отбойников (0.7 м от поверхности), шумозащитных экранов (1.5 м от поверхности). Тип функционального использования – транспортный. Пробы почвы отбирали из верхнего горизонта реплантозема супесчаного на участке с газонной растительностью, расположенной над Кутузовским тоннелем.
Участок 4 расположен в Донском районе г. Москвы (на границе Южного и Центрального административных округов) вдоль Ленинского проспекта и включает территорию Института проблем экологии и эволюции им. А.Н. Северцова РАН (ИПЭЭ РАН), Институт общей и неорганической химии им. Н.С. Курнакова, а также соседние жилые здания, располагающиеся вдоль проспекта. Ленинский проспект – крупная десятиполосная автодорога, соединяющая периферию города с его центром. Степень автотранспортной нагрузки – высокая. Сбор пыли осуществляли с подоконников и выступающих элементов зданий (1.5 м от поверхности). Тип функционального использования – транспортный, общественно-деловой. Пробы ТАВ собирали с помощью сметов с жестяных подоконников и других внешних элементов жилых зданий. Пробы почвы отбирали из урбанозема легкосуглинистого вскрытого на территории ИПЭЭ РАН.
Общую численность бактерий и длину актиномицетного мицелия определяли с помощью прямого люминесцентно-микроскопического метода с применением красителя акридина оранжевого. Учет численности прокариотных клеток проводили с использованием люминесцентного микроскопа ZEISS Axioscope 2+. Численность бактерий и длину актиномицетного мицелия рассчитывали по общепринятым формулам [5].
Определение численности и таксономической структуры культивируемых сапротрофных бактерий проводили при помощи посева на плотную питательную глюкозо-пептонно-дрожжевую среду с добавлением нистатина для подавления роста микроскопических грибов [8]. Посевы изучали на 10–14 сут инкубации. Представителей отдельных морфотипов бактерий выделяли в чистые культуры и определяли до рода на основании микроморфологических, культуральных и некоторых физиолого-биохимических признаков. Культивируемые сапротрофные бактерии идентифицировали в помощью определителя Берджи [21], ключа для определения родов почвенных бактерий [8], в некоторых случаях секвенированием гена 16S рРНК [19]. Полученных данные статистически обрабатывали с использованием программы Microsoft Оffice Excel 2019.
Структуры сапротрофного бактериального комплекса определяли на основании критериев, разработанных на кафедре биологии почв МГУ им. М.В. Ломоносова [8]. Выделяли следующие группы обилия: доминанты (>30%), субдоминанты (20–30%), группа среднего обилия (10–20%) и минорные компоненты (<10%). Для более полной характеристики прокариотных сообществ исследованных образцов рассчитывали показатели обилия, проводили их сравнительный анализ. Кроме того, рассчитывали коэффициент Кожевина (k) [6], как отношение данных люминесцентной микроскопии (М, кл./г) к данным посевов на плотную питательную среду (Р, кл./г):
Содержание санитарно-показательных микроорганизмов в исследованных образцах изучали в соответствии с методическими указаниями Федерального центра госсанэпиднадзора Минздрава России (МУ 2.1.7.730-99. Гигиеническая оценка качества почвы населенных мест). Определяли численность представителей семейства Enterobacteriaceae, наличие кишечной палочки (Escherichia coli), энтерококков (Enterococcus spp.), клостридий (Clostridium spp.) в соответствии с методическими рекомендациями [10, 11].
Идентификацию выделенных штаммов проводили молекулярно-генетическими методами на основании анализа нуклеотидных последовательностей вариабельных участков V3–V4 региона гена 16S рРНК с последующим использованием базы данных NCBI BLAST. Для идентификации Escherichia coli и других представителей семейства Enterobacteriaceae из образцов твердых атмосферных выпадений и почвы использовали посев на хромогенную высокоселективную среду Rebecca® EB (NF Validation EN ISO 16140).
Таксономическую структуру прокариотных сообществ in situ определяли методом высокопроизводительного секвенирования библиотек генов 16S рРНК с использованием платформы Illumina MiSeq методом парноконцевого чтения (2 × 300 пар оснований) с генерацией не менее 10 000 парных прочтений на образец по последовательностям гена гипервариабельного региона V3–V4 16S рРНК. Подготовку образцов осуществляли по двухстадийной ПЦР: амплификацией фрагмента V3–V4 региона гена 16S рРНК и последующей амплификацией полученных ПЦР-продуктов с целью баркодирования библиотек. Полученные ДНК-библиотеки после очистки на магнитных частицах и измерения концентрации флуориметрическим методом использовали в качестве матриц для высокопроизводительного секвенирования.
Данные высокопроизводительного секвенирования обрабатывали с использованием автоматизированного алгоритма QIIME [23], включающего объединение прямых и обратноконцевых прочтений, удаление технических последовательностей, фильтрации последовательностей с низкими показателями достоверности прочтения отдельных нуклеотидов (качество <Q20), фильтрации химерных последовательностей. Для разбиения последовательностей на операционные таксономические единицы использовали алгоритм с открытым референсным порогом классификации 97%. Выравнивание прочтений на последовательность 16S рРНК и распределение последовательностей по таксономическим единицам проводили с использованием базы данных Silva версии 132 [37].
Разнообразие и сходство бактериальных сообществ исследованных субстратов оценивали с помощью индексов α-разнообразия, рассчитанных при объединении полученных последовательностей в операционных таксономических единицах с уровнем сходства нуклеотидных последовательностей 97%.
Рассчитывали индексы разнообразия Шеннона и Пиелу. Более высокие значения индексов указывают на большее разнообразие [12].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определение показателей общей численности бактерий в образцах ТАВ и верхних горизонтах почв. Общая численность бактерий в образцах пылеаэрозоля (ТАВ) варьировала от 1.5 до 4.7 × 109 кл./г. Максимальные показатели численности бактерий выявили в пылеаэрозолях, отобранных на участке 2 (ИМГРЭ), а минимальные – на участке 1 (Хамовники). Общая численность бактерий в образцах почвы варьировала от 3.9 до 8.2 × 109 кл./г, максимальная численность обнаружена в реплантоземе, отобранном на участке 3 (ТТК – газон над магистралью), минимальная – в урбаноземе участка 4 (ИПЭЭ).
Во всех исследованных участках показатели общей численности бактерий в ТАВ были меньше, чем в почве. В образцах, отобранных на участках с высокой антропогенной нагрузкой (участки 1, 2 и 3), численность бактерий в почве была в 2.3–4.5 раза больше численности бактерий в ТАВ, а на участках с меньшей антропогенной нагрузкой (участок 4) эти показатели отличались мало (табл. 1).
Таблица 1.
Общая численность прокариот и численность сапротрофных бактерий в образцах твердых атмосферных выпадений и почв г. Москвы с участков 1–4
| Показатель | Участок 1 Хамовники |
Участок 2 ИМГРЭ |
Участок 3 ТТК |
Участок 4 ИПЭЭ |
||||
|---|---|---|---|---|---|---|---|---|
| ТАВ | почва | ТАВ | почва | ТАВ | почва | ТАВ | почва | |
| Общая численность прокариот, ×109 кл./г ± стандартная ошибка среднего; n = 6 | 1.5 ± 0.2 | 6.7 ± 0.7 | 4.7 ± 0.47 | 8.2 ± 0.82 | 2.8 ± 0.28 | 6.5 ± 0.65 | 3.4 ± 0.34 | 3.9 ± 0.4 |
| Численность сапротрофного бактериального комплекса, ×106 КОЕ/г стандартная ошибка среднего; n = 5 | 3.2 ± 0.3 | 17.9 ± 1.8 | 4.70 ± 0.47 | 10.25 ± 1.20 | 2.71 ± 0.28 | 31.54 ± 3.15 | 2.84 ± 0.28 | 19.51 ± 22 |
| Коэффициент Кожевина (k) | 469 | 376 | 1000 | 803.9 | 1037 | 206.4 | 1214 | 200 |
Во всех исследованных образцах ТАВ актиномицетный мицелий не обнаружен, а в образцах урбаноземов он выявлен в незначительном количестве 10–50 м/г только на участках 2 и 3. Можно предположить, что в ТАВ актиномицеты присутствуют в виде спор, известно, что бактерии в атмосфере подвергаются большему воздействию УФ-лучей и высушиванию, чем в почве [28].
Численность и структура сапротрофного бактериального комплекса ТАВ и почв. Численность культивируемых сапротрофных бактерий в образцах ТАВ варьировала в диапазоне от 2.7 до 4.7 × 106 КОЕ/г почвы: максимальная численность зарегистрирована в пылеаэрозоле, собранном на участке 2. В почвах численность сапротрофных бактерий варьировала от 1.2 до 3.15 × 107 КОЕ/г почвы. Максимальная численность 3.2 × 107 КОЕ/г почвы зарегистрирована в урбаноземе, отобранном на участке 4. Численность сапротрофных бактерий во всех исследуемых образцах почв превышала их количество в образцах ТАВ в 5–10 раз. Полученные для почв величины близки значениям, характерным для верхнего горизонта почв умеренного пояса России [3, 7].
Обычно значения коэффициента k для верхних почвенных горизонтов колеблются от 200 до 500 с постепенным увеличением в десятки и сотни раз по мере углубления в почвенный профиль [6], что свидетельствует о нарастании численности олиготрофных бактерий и бактерий, которые находятся в жизнеспособном некультивируемом состоянии и не выделяются на обычных питательных средах. Коэффициент k, рассчитанный для ТАВ, колеблется в диапазоне 469–1214 ед., что сопоставимо с данными, полученными ранее для нижних горизонтов почв, и может свидетельствовать, что в пылеаэрозоле бактерии находятся в условиях ограниченного присутствия ростовых субстратов, возможно, что они пребывают в жизнеспособном, но некультивируемом состоянии.
Доминирующими в культивируемых сапротрофных бактериальных комплексах твердых атмосферных выпадений являлись бактерии рода Micrococcus, субдоминантные позиции занимали представители филума Proteobacteria, в основном бактерии родов Myxococcus и Cytophaga. В образцах ТАВ выявлены культуры родов Arthrobacter, Rhodococcus, Streptomyces, Васillus, Mycobacterium, занимающие минорные позиции.
В образцах урбаноземов и реплантозема доминировали бактерии филума Proteobacteria (бактерии родов Myxococcus, Cytophaga, Pseudomonas, Xantomonas, Erwinia); субдоминантами были актиномицеты рода Streptomyces. Среди культивируемых бактерий, выделенных из почв, идентифицированы представители родов Arthrobacter, Васillus, Micrococcus, Cellulomonas, Rhodococcus.
Обращает на себя внимание преобладание (>30%) во всех образцах ТАВ бактерий филума Actinobacteria (главным образом, рода Micrococcus), что отмечалось многими авторами [28]. Большинство родов, выявленных в качестве группы среднего обилия и минорных компонентов, известно своей устойчивостью к высушиванию и другим неблагоприятным экологическим факторам [4, 20].
Значительное содержание актиномицетов (рода Streptomyces) и коринеподобных бактерий (рода Arthrobact-er) в городских почвах показано ранее [9], что может быть связано с преимущественно щелочной реакцией среды городских почв.
Численность санитарно-показательных микроорганизмов в исследованных образцах ТАВ и городских почв. Обнаружение санитарно-показательных организмов и их высокое относительное обилие являются важным свидетельством антропогенной нагрузки на почву, а присутствие их в твердых атмосферных выпадениях говорит о вкладе бактерий, ассоциированных с человеком и животными. Известно, что накопление в городских почвах потенциально патогенных (представители семейства Enterobacteriaceae), а также потенциально аллергенных бактерий из родов Rhodococcus и Micrococcus, свидетельствует о серьезном нарушении экологических функций почвы, как “бактериального фильтра”, и может представлять опасность для здоровья человека. Представители филума Proteobacteria, в значительных количествах обнаруженные в составе бактериального комплекса урбаноземов и ТАВ, на основании изучения микроморфологических, культуральных и физиолого-биохимических признаков были отнесены к семейству Enterobacteriaceae.
При помощи метода посева на селективную для санитарно-значимых бактерий питательную среду Rebecca из исследованных образцов были выделены представители семейства Enterobacteriaceae и некоторые сапротрофные бактерии. Всего было выделено 27 штаммов представителей родов Klebsiella, Enterobacter, Citrobacter, Escherichia, Bacil-lus, Rhodococcus, Arthrobacter, Staphylococcus, Microbacterium. Структура культивируемых комплексов, выделенных на среде Rebecca, представлена в табл. 2.
Таблица 2.
Относительное обилие отдельных видов культивируемых бактерий, выделенных из образцов ТАВ и городских почв на среде Rebecca, %
| Вид | Участок 1 Хамовники |
Участок 2 ИМГРЭ |
Участок 3 ТТК |
Участок № 4 ИПЭЭ |
||||
|---|---|---|---|---|---|---|---|---|
| ТАВ | почва | ТАВ | почва | ТАВ | почва | ТАВ | почва | |
| Arthrobacter humicola | 0 | 0 | 0.55 | 2.3 | 0.2 | 0 | 0 | 0 |
| Arthrobacter ramosus | 0 | 1.65 | 0 | 1.8 | 0 | 0 | 4.35 | 0 |
| Arthrobacter polychromogenes | 0 | 0.85 | 0 | 0 | 0 | 0 | 1.55 | 0 |
| Bacillus frigoritolerans | 6.7 | 0 | 8.25 | 0 | 8.4 | 0 | 11.3 | 0 |
| Bacillus megaterium | 16.3 | 7.45 | 15.7 | 36.25 | 22.05 | 20.8 | 13.6 | 30.8 |
| Bacillus pumilus | 0 | 3.9 | 1.05 | 0 | 0 | 5.3 | 2.4 | 2.9 |
| Bacillus silvestris | 0 | 3.25 | 0.55 | 3.05 | 0.6 | 5.35 | 0.45 | 5.6 |
| Bacillus simplex | 0 | 0 | 0 | 0 | 0 | 4.8 | 1.8 | 2.1 |
| Bacillus sp. 1 | 0 | 0 | 0 | 0 | 0 | 0 | 6.75 | 0 |
| Bacillus sp. 2 | 0 | 0.45 | 7.65 | 5.3 | 6.85 | 10.9 | 1.55 | 6.2 |
| Citrobacter europaeus | 22.1 | 26.05 | 20.45 | 27.25 | 22.85 | 28.1 | 12.3 | 15.6 |
| Escherichia coli | 17.8 | 13.85 | 18.7 | 13.9 | 13.1 | 19.6 | 15.85 | 8.8 |
| Enterobacter aerogenes | 0 | 0.55 | 1.55 | 0 | 0 | 0 | 2.55 | 3.6 |
| Enterobacter agglomerans | 0.25 | 0 | 0 | 0 | 0 | 0 | 1.05 | 2.25 |
| Enterobacter cloacae | 5.8 | 2.25 | 0 | 0.55 | 6.1 | 0 | 7.25 | 8.05 |
| Enterobacter kobei | 0 | 0 | 0 | 0 | 0 | 0 | 0.4 | 0 |
| Klebsiella granulomatis | 2.05 | 1.1 | 7.6 | 6.4 | 7.05 | 0 | 3.6 | 3.75 |
| Klebsiella grimontii | 1.2 | 5.6 | 0 | 1.9 | 0.9 | 1.75 | 4.05 | 5.1 |
| Klebsiella oxytoca | 0 | 0 | 0 | 0 | 0 | 0.55 | 1.6 | 1.6 |
| Klebsiella variicola | 0.8 | 0.6 | 1.7 | 0 | 0 | 0 | 1.35 | 1.25 |
| Microbacterium resistens | 0 | 0 | 0 | 0 | 0.45 | 0 | 0 | 0 |
| Rhodococcus coprophilus | 6.65 | 2.6 | 0.75 | 0.4 | 0 | 0 | 2.15 | 2.4 |
| Rhodococcus equi | 13.1 | 5.15 | 0 | 0 | 0 | 0 | 2.05 | 0 |
| Rhodococcus fascians | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Rhodococcus soli | 0 | 22.9 | 12.6 | 0 | 5.9 | 0 | 1.05 | 0 |
| Staphylococcus sciuri | 0 | 0 | 2.9 | 0.7 | 4.2 | 0 | 0 | 0 |
| Staphylococcus sp. | 7.25 | 1.8 | 0 | 0.2 | 1.35 | 2.85 | 0 | 0 |
Стафилококки являются естественными резидентами кожи и слизистых оболочек. Они обнаружены на всех участках, которые захватывали жилую и общественную зоны города. Стафилококков (Staphylococcus sciuri и Staphylococcus sp.) в ТАВ, как правило, было больше, чем в почве. Полученные данные свидетельствуют, что высокое содержание потенциально-патогенных микроорганизмов в почве коррелирует с большой долей их в ТАВ. Максимальное видовое разнообразие бактерий семейства Enterobacteriaceae зафиксировано в образцах ТАВ, отобранных на участках с повышенной нагрузкой (центр города и транспортная зона): Хамовники и ТТК. Вероятно, что в зоне автотранспортного загрязнения почва хуже всего справляется с функцией самоочищения от потенциальных патогенов, что отражается на содержании этих организмов в ТАВ.
Индекс бактерий группы кишечной палочки во всех участках оценивали по наличию Escherichia coli. Это санитарно-показательный организм, постоянно обитающий в теле человека и теплокровных животных. Его присутствие в почве однозначно свидетельствует о наличии в ней выделений человека и/или животных; численность санитарно-показательных организмов прямо пропорциональна степени фекального загрязнения почвы. Для всех исследованных участков значение индекса находилось в пределах >10, но <100 КОЕ/г, т.е. почвы всех участков по оценке степени эпидемической опасности относятся к умеренно опасным. Для ТАВ нормативы по содержанию бактерий группы кишечной палочки в настоящее время не разработаны, но их численность в ТАВ сравнима или даже превышает содержание в почве. Следовательно, исследованные пылеаэрозоли можно рассматривать как умеренно опасные. Относительное обилие бактерий Escherichia coli практически во всех образцах ТАВ было больше, чем в образцах городских почв, а представителей рода Citrobacter больше в почве и меньше в ТАВ.
Общеизвестно, что многие почвенные микроорганизмы проявляют высокую устойчивость к антибиотикам [1]. В феврале 2017 г. ВОЗ опубликовала список микроорганизмов, наиболее устойчивых к антибиотикам. В этом списке представители семейства Enterobacteriaceae занимают одну из ведущих позиций. Основной представитель этой группы микроорганизмов – вид Escherichia coli, штаммы которого из пылеаэрозоля тестировали в настоящем исследовании. Они проявили наибольшую резистентность к тикарциллин-клавуланату – антибиотику из группы пенициллины-клавулоновая кислота (ингибиторы β-лактамаз). Доля устойчивых штаммов составила 65.6%. Явление антибиотикорезистентности у микроорганизмов отмечается на всех континентах, но его распространенность во многом зависит от политики использования антибиотиков и существенно отличается в разных регионах [29].
На основании полученных данных о видовом разнообразии комплекса культивируемых бактерий рассчитывали экологические показатели, характеризующие видовое разнообразие бактериального комплекса (табл. 3).
Таблица 3.
Показатели биологического разнообразия культивируемых бактериальных сообществ исследованных образцов
| Индекс | Участок 1 Хамовники |
Участок 2 ИМГРЭ |
Участок 3 ТТК |
Участок 4 ИПЭЭ |
||||
|---|---|---|---|---|---|---|---|---|
| ТАВ | почва | ТАВ | почва | ТАВ | почва | ТАВ | почва | |
| Шеннона, Н | 3.04 | 3.18 | 3.13 | 2.55 | 3.11 | 2.75 | 3.87 | 3.29 |
| Пиелу, Е | 0.64 | 0.67 | 0.66 | 0.54 | 0.65 | 0.58 | 0.82 | 0.69 |
Полученные результаты свидетельствуют о высоком разнообразии исследованных комплексов культивируемых сапротрофных бактерий. Значения индекса Шеннона варьировали в ТАВ от 3.04 до 3.87, в почвах от 2.55 до 3.29. Это свидетельствует о значительном таксономическом разнообразии комплексов, как ТАВ, так и городских почв. Обращает на себя внимание большее разнообразие комплексов ТАВ на участках 2, 3 и 4. Возможно, это связано с большим привнесением в них аллохтонных микроорганизмов с автомагистралей. Полученные бóльшие значения индекса выравненности Пиелу в большинстве исследованных комплексов ТАВ также могут быть связаны с активным поступлением в них микроорганизмов из воздуха. В целом видовое разнообразие в ТАВ было больше в точках с максимальной антропогенной нагрузкой.
Таксономическая характеристика прокариотных сообществ образцов ТАВ и городских почв in situ. Характеристика филогенетического разнообразия прокариотного сообщества in situ образцов ТАВ и верхнего горизонта урбаназема на участке 1 (Хамовники) и реплантозема на участке 3 (ТТК) была произведена из-за их приуроченности к контрастным условиям по антропогенной нагрузке (рис. 1).
Рис. 1.
Структура прокариотных сообществ пылеаэрозолей и урбаноземов участков 1 (Хамовники) и 3 (ТТК) in situ.
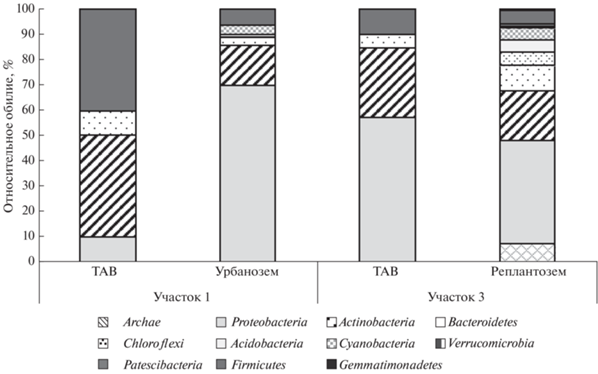
В исследованных образцах пылеаэрозолей и почв выявлено >10 филумов прокариот. Представители домена Archaea обнаружены только в образце верхнего слоя реплантозема (компостно-минеральный слой), отобранного на участке 3 (ТТК): все полученные последовательности принадлежали археям филума Тhaumarchaeota и составляли 7% от общего числа прокариот в этом образце. Представители этого филума – нитрифицирующие археи, способные к окислению аммиака в анаэробных условиях и являющиеся хемолитотрофами [2, 39].
Во всех исследованных образцах пылеаэрозоля и почвы доминировали прокариоты филумов Proteobacteria, Actinobacteria, Bacteroidetes и Firmicutes, их доля в сообществах превышала 10%. Также обнаружены представители филумов Chloroflexi, Acidobacteria, Cyanobacteria, Verrucomicrobia, Patescibacteria и Gemmatimonadetes.
Обращает на себя внимание, что содержание отдельных филумов в пылеаэрозоле и городских почвах значительно различалось как по относительному содержанию отдельных филумов, так и их числу. В пылеаэрозоле с участка 3 (ТТК) и городских почвах преобладающими являлись бактерии филума Proteobacteria (41–70%), меньше было содержание представителей филумов Actinobacteria (16–28%) и Bacteroides (3–10%). Большее филогенетическое разнообразие было характерно для образцов почв, меньшее – для пылеаэрозолей, что проявлялось как на уровне выявленных таксонов, так и для индексов биоразнообразия (табл. 4).
Таблица 4.
Индексы биоразнообразия прокариотных сообществ пылеаэрозолей и городских почв in situ
| Участок | Образец | Индекс биоразнообразия | ||
|---|---|---|---|---|
| Чао | Шеннона | Симпсона | ||
| 1, Хамовники | ТАВ | 40.50 | 3.23 | 0.84 |
| Почва | 95.60 | 5.31 | 0.97 | |
| 3, ТТК | ТАВ | 33.50 | 3.41 | 0.90 |
| Почва | 88.60 | 5.82 | 0.98 | |
Минимальное филогенетическое разнообразие отмечено в образце пылеаэрозоля, отобранного на участке 1. Здесь выявлены только прокариоты, принадлежащие к трем филумам, причем доминировали Firmicutes и Actinobacteria (40%), известные своей устойчивостью к высушиванию, воздействию УФ-облучения и других факторов среды [4, 20].
Представители филума Proteobacteria являлись доминирующими в образцах урбанозема (участок 1, Хамовники) и пылеаэрозоля (участок 3, ТТК). Наибольшим было содержание представителей классов Alpha- и Gammaproteobacteria. Эти данные коррелируют с результатами, полученными при помощи метода посева, свидетельствующими о присутствии в пылеаэрозоле и городских почвах энтеробактерий, которые являются типичными представителями класса Gammaproteobacteria. Бактерии класса Alphaproteobacteria, обнаруженные в значительных количествах в исследованных образцах в основном принадлежали к порядкам Sphingomonadales, Rhizobiales, Caulobacterales, Xanthomonadales (в городских почвах) и Sphingomonadales и Caulobacterales (в пылеаэрозолях). Известно, что представители порядков Sphingomonadales, Rhizobiales и Xanthomonadales содержат значительное число видов бактерий, обычно выделяющихся из почвы и тесно связанных с высшими растениями [13, 15, 22, 24, 25].
Филум Bacteroidetes в основном был представлен порядками Chitinophagales, Cytophagales, Sphingobacteriales и Flavobacteriales. В образцах пылеаэрозоля доминировали бактерии, принадлежащие к порядку Flavobacteriales. В образце реплантозема (ТТК) выявлено наличие сравнительно недавно описанного и малоизученного филума Gemmatimonadetes. Ранее бактерии этого филума выделялись из почв прерий, лугов, а также эвтрофных озерных отложений и альпийских горных почв. Разнообразие сред, в которых были обнаружены прокариоты из данного филума, предполагает адаптацию бактерий к условиям низкой увлажненности [27], которая характерна для сухих периодов года в тропиках.
ЗАКЛЮЧЕНИЕ
Впервые представлена комплексная (количественная и качественная) характеристика прокариотных сообществ твердых атмосферных выпадений (пылеаэрозоля) и городских почв (урбаноземов и реплантозема) на территории г. Москвы на участках с разной интенсивностью антропогенной нагрузки.
Общая численность бактерий в исследованных образцах твердых атмосферных выпадений (ТАВ) была меньше численности бактерий в образцах городских почв; актиномицетный мицелий в образцах ТАВ не выявлен, хотя обнаружен в образцах почв, что позволяет предположить, что актиномицеты присутствуют в пылеаэрозоле в виде спор. Численность сапротрофных культивируемых бактерий в образцах ТАВ составляла миллионы колониеобразующих единиц на грамм и была на порядок меньше, чем в верхних горизонтах почв, отобранных на тех же участках. Среди культивируемых бактерий в пылеаэрозолях доминировали представители рода Micrococcus, в то время как в почвах – представители филума Proteobacteria. В образцах твердых атмосферных выпадений обнаружены представители семейства Enterobacteriaceae (бактерии родов Escherichia, Klebsiella, Enterobacter и Citrobacter), среди которых имеются виды, потенциально патогенные для человека. Максимальное видовое разнообразие бактерий семейства Enterobacteriaceae зафиксировано в образцах ТАВ, отобранных на участках с повышенной транспортной нагрузкой и в центральных районах города. Санитарно-показательная бактерия Escherichia coli обнаружена во всех образцах ТАВ и почв на изученных участках, ее содержание варьировало от 10 до 100 КОЕ/г, что по оценке степени эпидемической опасности позволяет отнести эти почвы и пылеаэрозоли к классу умеренно опасных. Рассчитанные экологические показатели свидетельствуют о высоком разнообразии культивируемых бактерий в ТАВ и городских почвах на участках с повышенной антропогенной нагрузкой за счет обилия представителей семейства Enterobacteriaceae. На основании значений экологических индексов, рассчитанных для прокариотных сообществ in situ (баркодинг гена 16S рРНК), можно сделать вывод, что сообщества пылеаэрозолей характеризуется более низким таксономическим разнообразием по сравнению с сообществами близко расположенных урбаноземов и реплантозема. Очевидно, что на формирование прокариотных сообществ пылеаэрозолей оказывает значительное влияние индивидуальная устойчивость микроорганизмов к факторам среды, процессы пылепереноса, а также степень антропогенной нагрузки.
Проведенный филогенетический анализ пылеаэрозоля и почв на территории Хамовников и ТТК показал, что всех исследованных образцах доминировали представители филумов Proteobacteria, Actinobacteria, Bacteroidetes и Firmicutes. Содержание отдельных филумов в пылеаэрозоле и почвах значительно различалось, как по относительному содержанию отдельных филумов, так и их числу, в почвах в большей степени были представлены Proteobacteria, в ТАВ филум Actinobacteria, известный своей устойчивостью к воздействию УФ-лучей и высушиванию. Большое филогенетическое разнообразие характерно для образцов почв, меньшее – в образцах пылеаэрозоля, что проявлялось как на уровне выявленных таксонов, так и на уровне экологических индексов (индексы Чао и Шеннона).
Список литературы
Виноградова К.А., Булгакова В.Г., Полин А.Н., Кожевин П.А. Устойчивость микроорганизмов к антибиотикам: резистома, ее объем, разнообразие и развитие // Антибиотики и химиотерапия. 2013. Т. 58. № 5–6. С. 38–48.
Воробьева Л.И. Археи: учебное пособие для вузов. М.: ИКЦ “Академкнига”, 2007. 234 с.
Глушакова А.М., Лысак Л.В., Умарова А.Б., Прокофьева Т.В., Подушин Ю.В., Быкова Г.С., Малюкова Л.П. Бактериальные комплексы урбаноземов некоторых южных городов России // Почвоведение. 2021. № 2. С. 224–231. https://doi.org/10.31857/S0032180X21020052
Добровольская Т.Г. Структура бактериальных сообществ почв. М.: ИКЦ “Академкнига”, 2002. 281 с.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. 60 с.
Кожевин П.А. Микробные популяции в природе М.: Изд-во Моск. ун-та, 1989. 175 с.
Лысак Л.В. Бактериальные сообщества городских почв. Автореф. дис. … докт. биол. наук. М., 2010.
Лысак Л.В., Добровольская Т.Г., Скворцова И.Н. Методы оценки бактериального разнообразия почв и идентификации почвенных бактерий. М.: МАКС Пресс, 2003. 120 с.
Лысак Л.В., Лапыгина Е.В. Разнообразие бактериальных сообществ городских почв // Почвоведение. 2018. № 9. С. 1108–1114. https://doi.org/10.1134/S0032180X18090071
МР ФЦ/4022 Методы микробиологического контроля почвы.
МУ 2.1.7.730-99. Гигиеническая оценка качества почвы населенных мест.
Мэгарран Э. Экологическое разнообразие и его измерение М.: Мир, 1992. 184 с.
Першина Е.В., Чернов Т.И. Основные физико-химические параметры почв, определяющие структуру почвенного метагенома // Основные достижения и перспективы почвенной метагеномики. 2017. С. 88–96.
Ревич Б.А. Климат, качество атмосферного воздуха и здоровье москвичей. М.: Адаманть, 2006. 255 с.
Тихонович И.А., Чернов Т.И., Железова А.Д., Тхакахова А.К., Андронов Е.Е., Кутовая О.В. Таксономическая структура прокариотных сообществ почв разных биоклиматических зон // Бюл. Почв. ин-та им. В.В. Докучаева. 2018. № 95. С. 125–153.
Aminov R.I., Mackie R.I. Evolution and ecology of antibiotic resistance genes // FEMS Microbiol. Lett. 2007. V. 271. № 2. P. 147–161. https://doi.org/10.1111/j.1574-6968.2007.00757.x
Arabaghian H., Salloum T., Alousi S., Panossian B., Araj G.F., Tokajian S. Molecular characterization of carbapenem resistant Klebsiella pneumoniae and Klebsiella quasipneumoniae isolated from Lebanon // Sci. Rep. 2019. V. 9. № 1. P. 1–12. https://doi.org/10.1038/s41598-018-36554-2
Araújo R., Vázquez Calderón F., Sánchez López J., Azevedo I.C., Bruhn A., Fluch S., Ullmann J. Current status of the algae production industry in Europe: an emerging sector of the blue bioeconomy // Front. Mar. Sci. 2021. V. 7. P. 626389. https://doi.org/10.3389/fmars.2020.626389
Belov A.A., Cheptsov V.S., Manucharova N.A., Ezhelev Z.S. Bacterial communities of Novaya Zemlya archipelago ice and permafrost // Geosciences. 2020. V. 10 № 2. P. 67. https://doi.org/10.3390/geosciences10020067
Belov A.A., Cheptsov V.S., Vorobyova E.A., Manucharova N.A., Ezhelev Z.S. Stress-tolerance and taxonomy of culturable bacterial communities isolated from a central Mojave Desert soil sample // Geosciences. 2019. V. 9 № 4. P. 166. https://doi.org/10.3390/geosciences9040166
Bergey D.H. Bergey’s Manual® of Systematic Bacteriology. Springer Science & Business Media, 2001.
Bulgarelli D., Garrido-Oter R., Münch P.C., Weiman A., Dröge J., Pan Y., Schulze-Lefert P. Structure and function of the bacterial root microbiota in wild and domesticated barley // Cell Host Microbe. 2015. V. 17 № 3. P. 392–403. https://doi.org/10.1016/j.chom.2015.01.011
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Knight R. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. № 5. P. 335–336. https://doi.org/10.1038/nmeth.f.303
Chaparro J.M., Badri D., Vivanco J.M. Rhizosphere microbiome assemblage is affected by plant development // The ISME J. 2014. V. 8. № 4. P. 790–803. https://doi.org/10.1038/ismej.2013.196
Daniel R. The metagenomics of soil // Nat. Rev. Microbiol. 2005. V. 3. P. 470–478. https://doi.org/10.1038/nrmicro1160
Davin-Regli A., Pagès J.M. Enterobacter aerogenes and Enterobacter cloacae; versatile bacterial pathogens confronting antibiotic treatment // Front. Microbiol. 2015. V. 6. P. 392. https://doi.org/10.3389/fmicb.2015.00392
de Bruyn J., Nixon L., Fawaz M., Johnson M., Radosevich M. Global Biogeography and Quantitative Season Dynamics of Gemmatimonadetes in Soil // Appl. Environ. Microbiol. 2011. V. 77. № 17. P. 6295–6300. https://doi.org/10.1128/AEM.05005-11
Després V.R., Huffman J.A., Burrows S. M., Hoose C., Safatov A., Buryak G., Jaenicke R. Primary biological aerosol particles in the atmosphere: a review // Tellus B: Chem. Phys. Meteorol. 2012. V. 64. № 1. P. 15598. https://doi.org/10.3402/tellusb.v64i0.15598
Glushakova A.M., Kachalkin A.V., Prokof’eva T.V., Lysak L.V. Enterobacteriaceae in soils and atmospheric dust aerosol accumulations of Moscow city // Current Res. Microbial Sci. 2022. V. 3. P. 100124. https://doi.org/10.1016/j.crmicr.2022.100124
Goel A., Kumar P. Characterisation of nanoparticle emissions and exposure at traffic intersections through fast–response mobile and sequential measurements // Atmos. Environ. 2015. V. 107. P. 374–390. https://doi.org/10.1016/j.atmosenv.2015.02.002
Karagulian F., Belis C.A., Dora C.F.C., Prüss-Ustün A.M., Bonjour S., Adair-Rohani H., Amann M. Contributions to cities' ambient particulate matter (PM): A systematic review of local source contributions at global level // Atmos. Environ. 2015. V. 120. P. 475–483. https://doi.org/10.1016/j.atmosenv.2015.08.087
Kumari S., Jain M.K. A critical review on air quality index // Environ. Pollut. 2018. P. 87–102. https://doi.org/10.1007/978-981-10-5792-2_8
Luong L.M., Phung D., Sly P.D., Morawska L., Thai P.K. The association between particulate air pollution and respiratory admissions among young children in Hanoi, Vietnam // Sci. Total Environ. 2017. V. 578. P. 249–255. https://doi.org/10.1016/j.scitotenv.2016.08.012
Phan C.C., Nguyen T.Q.H., Nguyen M.K., Park K.H., Bae G.N., Seung-bok L., Bach Q. Aerosol mass and major composition characterization of ambient air in Ho Chi Minh City, Vietnam // Int. J. Environ. Sci. Technol. 2020. V. 17. № 6. P. 3189–3198. https://doi.org/10.1007/s13762-020-02640-0
Prokof’eva T.V., Shoba S.A., Lysak L.V., Ivanova A.E., Glushakova A.M., Shishkov V.A., Lapygina E.V., Shilaika P.D., Glebova A.A. Organic constituents and biota in the urban atmospheric solid aerosol: potential effects on urban soils // Eurasian Soil Sci. 2021. 54. №. 10. P. 1532–1545. https://doi.org/10.1134/S1064229321100094
Prokof’eva T.V., Kiryushin A.V., Shishkov V.A., Ivannikov F.A. The importance of dust material in urban soil formation: the experience on study of two young Technosols on dust depositions // J. Soils Sediments. 2017. V 17. № 2. P. 515–524. https://doi.org/10.1007/s11368-016-1546-7
Pruesse E., Quast C., Knittel K., Fuchs B.M., Ludwig W., Peplies J., Glöckner, F.O. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB // Nucleic Acids Res. 2007. V. 35. № 21. P. 7188–7196. https://doi.org/10.1093/nar/gkm864
Stokes H.W., Gillings M.R. Gene flow, mobile genetic elements and the recruitment of antibiotic resistance genes into Gram-negative pathogens // FEMS Microbiol. Rev. 2011. V. 35. № 5. P. 790–819. https://doi.org/10.1111/j.1574-6976.2011.00273.x
Tourna M., Stieglmeier M., Spang A., Könneke M., Schintlmeister A., Urich T., Schleper C. Nitrososphaera viennensis, an ammonia oxidizing archaeon from soil // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 20. P. 8420–8425. https://doi.org/10.1073/pnas.1013488108
Vlasov D., Kosheleva N., Kasimov N. Spatial distribution and sources of potentially toxic elements in road dust and its PM10 fraction of Moscow megacity // Sci. Total Environ. 2021. V. 761. P. 143267. https://doi.org/10.1016/j.scitotenv.2020.143267
World Health Organization. Air quality guidelines for Europe. World Health Organization. Regional Office for Europe, 2000.
Дополнительные материалы отсутствуют.


