Почвоведение, 2023, № 5, стр. 586-593
Исследование микробного состава бентонитов двух месторождений
Д. Д. Кошелева a, *, В. С. Чепцов a, А. Л. Степанов a, И. И. Толпешта a, В. В. Крупская a, b
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
119017 Москва, Старомонетный пер., 35, Россия
* E-mail: koshadasheleva@gmail.com
Поступила в редакцию 20.10.2022
После доработки 14.12.2022
Принята к публикации 28.12.2022
- EDN: IFLAKM
- DOI: 10.31857/S0032180X22601360
Аннотация
Бентонитовые глины обладают большой площадью удельной поверхности и большим объемом порового пространства, что определяет их высокую сорбционную способность и позволяет использовать в качестве одного из барьеров при строительстве захоронений радиационно-активных отходов. Ожидается, что глубокие геологические хранилища будут функционировать тысячи лет, поэтому актуальна проблема прогнозирования изменений, которые могут произойти с ними за это время. В процессе функционирования хранилищ бентониты могут изменять свои свойства за счет воздействия на них микроорганизмов. В работе проанализирована структура микробного сообщества бентонитов двух месторождений: 10-й Хутор (Россия) и Таганское (Казахстан) – при различных температурах (25 и 60°С) инкубации. В бентоните месторождения 10-й Хутор при инкубации при 60°С выявлено 10 филумов и 92 рода бактерий, а при 25°С – 12 филумов и 94 рода. В бентоните Таганского месторождения при температуре инкубирования 60°С выявлено 14 филумов и 87 родов, а при 25°С – 15 филумов и 123 рода. В образцах преобладали бактерии типов Proteobacteria и Firmicutes. Сделан вывод, что основным фактором, влияющим на формирование микробного сообщества в исследованных бентонитах, является температура, а не химический и минеральный состав исследованных бентонитов.
ВВЕДЕНИЕ
На данный момент разрабатывается система глубинного геологического захоронения радиоактивных отходов. Для создания подобного захоронения используется система многобарьерной конструкции [1–3]. Бентонитовые глины обладают большой площадью удельной поверхности и большим объемом порового пространства, что определяет их высокую сорбционную способность и позволяет использовать в качестве одного из барьеров при строительстве захоронений радиоактивных отходов [4]. Планируется, что глубокие геологические хранилища будут функционировать тысячи лет, поэтому актуальной является задача прогноза изменений, которые могут произойти за это время. Чтобы сделать объективный прогноз, нужно понимать условия, в которых будут существовать барьеры в глубинных геологических захоронениях. Согласно [5], температура поверхности канистры с радиоактивными отходами составляет примерно 160°C, и со временем температура будет постепенно снижаться. Ориентировочно она снизится до 100°C в течение 200 лет. При этом буферный слой из бентонита будет нагреваться неравномерно, и его температура будет варьировать в пределах 60–95°C в зависимости от расстояния до канистры. Следовательно, важно знать, какие изменения будут происходить с бентонитом в условиях захоронения при разном температурном режиме.
В процессе существования инженерного барьера бентониты могут претерпевать изменения не только из-за физического воздействия повышенных температур, но и из-за воздействия микроорганизмов на них [6]. Микроорганизмы были обнаружены в различных исследуемых месторождениях бентонита [7, 8]. Кроме того, микроорганизмы могут быть занесены во время строительства хранилища радиоактивных отходов [9], а также с потоком грунтовых вод во время эксплуатации [10].
В длительном эксперименте, который проводился акционерным обществом по атомной энергии Канады в лаборатории, расположенной под землей, была проведена сравнительная характеристика биомассы микроорганизмов в бентонитах в 1997 и 2007 гг. Установлено, что в 1997 г. биомасса аэробных гетеротрофов в бентонитах составляла среднем 3.88 КОЕ/г, а анаэробных гетеротрофов – 1.63 КОЕ/г. Через 10 лет была отмечена общая тенденция изменения численности микроорганизмов – количество гетеротрофных аэробов уменьшилось, а численность анаэробных гетеротрофов осталась примерно на том же уровне [8].
В коммерческом бентоните MX-80 (Вайоминг, США) численность микроорганизмов составляла 1.64 × 105 КОЕ/г аэробных гетеротрофов и 2.5 × × 103 КОЕ/г анаэробных гетеротрофов. Доминирующими филумами выступали Firmicutes (77%), Proteobacteria (22.6%). В доминирующем филуме Firmicutes авторы выделили следующие доминирующие классы – Bacillales и Clostridiales (8.5 и 64% соответственно) [11].
Бентониты разных месторождений характеризуются разным видовым составом микроорганизмов. В бентоните месторождения Almeria в Испании обнаружены бактерии 14 различных филумов таких, как Acidobacteria, Actinobacteria, Armatimonadetes, Bacteroidetes, Chloroflexi, Cyanobacteria, Deinococcus-Thermus, Firmicutes, Gemmatimonadetes, Planctomycetes, Proteobacteria, Nitrospirae, Verrucomicrobia и неопознанный филум. При этом доминировали представители филумов Proteobacteria и Bacteroidetes [7].
В исследовании [15] изучали разнообразие микроорганизмов в бентоните из Китая (уезд Синхэ автономного района Внутренняя Монголия). Наибольшее количество обнаруженных микроорганизмов принадлежало филумам Thaumarchaeota (50%) и Euryarchaeota (10%). Второй по распространенности филум был Proteobacteria (16%) [12]. При оценке классов были выделены следующие доминанты: β-Proteobacteria, Actinobacteria, Thermoplasmata, Bacilli, α-Proteobacteria, γ-Proteobacteria, Fusobacteria, and Methanobacteria.
В бентоните National Standard (Вайоминг, США) доминировали бактерии филумов Firmicutes (81%), Proteobacteria (10%), Actinobacteria (8%) и Chloroflexi (1%). В доминирующем филуме Firmicutes, можно выделить следующие доминирующие классы – Bacillales и Clostridiales (21.9 и 57.8% соответственно). В бентоните Canaprill (Канада) было обнаружено три филума: Firmicutes (37%) и Proteobacteria (39%), Chloroflexi (24%) [11].
Микроорганизмы, обитающие в бентонитах, могут изменять свойства минералов в процессе своей жизнедеятельности [13]. Некоторые группы бактерий могут влиять на функционирование компонентов глубинного хранилища радиоактивных отходов, например, сульфидпродуцирующие бактерии, которые могут способствовать коррозии металлических контейнеров [14, 15], и железоредукторы, которые могут восстанавливать Fe(III), локально изменяя физические и химические свойства бентонитов [16]. Кроме того, в результате функционирования микроорганизмов выделяются различные газы, которые могут быть причиной образования трещин в бентонитовой прослойке и нарушать ее герметичность [17].
Из вышесказанного следует, что микроорганизмы являются одним из факторов, способных повлиять на функционирование хранилища радиоактивных отходов.
Цель работы – оценка состава микробного сообщества глин месторождений 10-й Хутор (Республика Хакасия, Российская Федерация) и Таганское (Республика Казахстан), которые предполагается использовать для конструирования хранилища радиоактивных отходов, при разных температурных условиях инкубации.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования были бентониты месторождений 10-й Хутор и Таганское.
Месторождение Таганское расположено в Республике Казахстан, в Тарбагатайском районе Восточно-Казахстанской области, в 445 км к юго-востоку от г. Усть-Каменогорска, в 20 км к юго-востоку от с. Акжар, в 74 км к западу от пристани Тарбагатай на оз. Зайсан [18]. Месторождение 10-й Хутор расположено в Российской Федерации, в 8 км юго-западнее г. Черногорска Усть-Абаканского района [19, 20].
Бентониты отличаются по минеральному и химическому составам (табл. 1, 2) [21, 22]. Оба имеют практически одинаковое содержание монтмориллонита. В месторождении Таганское больше кварца и кальцита по сравнению с месторождением 10-й Хутор. Только в бентоните месторождения Таганское есть пирит и полевые шпаты. В бентоните месторождения 10-й Хутор почти в 4 раза больше содержание иллита, чем в месторождении Таганское. В бентоните месторождения 10-й Хутор присутствуют примеси каолинита, микроклина и альбита (около 4%).
Таблица 1.
Минеральный состав исследуемых бентонитов, %
| Порода | 10-й Хутор | Таганское |
|---|---|---|
| Монтмориллонит | 77.1 | 73 |
| Микроклин | 3.3 | – |
| Иллит | 3.7 | 1 |
| Кварц | 13.3 | 22.5 |
| Плагиоклазы (Альбит) | 4.9 | – |
| Кальцит | 0.7 | 2.3 |
| Каолинит | 0.7 | – |
| Пирит | – | 1.2 |
| Полевые шпаты | – | <0.5 |
| Сумма | 100.0 | 100.0 |
В бентоните месторождения Таганское содержится больше железа, чем в месторождении 10-й Хутор. В бентоните месторождения 10-й Хутор отмечаются оксиды фосфора и титана [21, 22].
Эксперимент по инкубированию бентонитов проводили следующим образом. Навески бентонитов массой 100 г помещали во фторопластовые стаканы, приливали к ним 300 мл раствора минеральных солей c pH 7.3, стаканы плотно закрывали крышками и помещали в термостат на 6 мес., при температурах 25 и 60°С. Раствор солей имитировал состав грунтовых вод, планируемого места создания хранилища радиоактивных отходов. Данные о составе используемого раствора опубликованы ранее [23].
После 6 мес. инкубирования образцы высушивали при температуре 60°С. Из высушенных бентонитов экстрагировали ДНК. Для экстракции использовали навеску 250 мг хорошо усредненного образца. Экстракцию ДНК проводили при помощи набора для выделения ДНК DNeasy PowerLyzer PowerSoil Kit (Qiagen, Германия) в соответствии с рекомендациями производителя.
Для определения микробного состава бентонитов проводили высокопроизводительное секвенирование генов 16S рРНК бактерий на платформе Illumina. Ампликоны получали с использованием праймеров 515F+Pro-mod-805R (последовательность 5' – GTGBCAGCMGCCGCGGTAA 3' и 5' – GACTACNVGGGTMTCTAATCC 3' соответственно) [24, 25]. Были получены парноконцевые прочтения по 250 пн. Секвенирование проводили в компании Knomics-Biota [26]. Данные анализировали с помощью Mothur v.1.44.3 [27] согласно протоколу MiSeq SOP [28] с использованием SILVA SEED v132 для выравнивания и SILVA v138 для таксономической классификации [29].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Количество качественных прочтений варьировало в диапазоне от 67 899–90 001 на образец. Покрытие для всех образцов было не ниже 96%.
В бентоните месторождения 10-й Хутор при инкубации 60°С было идентифицировано 10 филумов и 92 рода бактерий, при инкубации 25°С – 12 филумов и 94 рода. В бентоните месторождения Таганское при инкубации 60°С было идентифицировано 14 филумов и 87 родов, при инкубации 25°С – 15 филумов и 123 рода.
При анализе альфа-разнообразия при помощи индекса Чао наибольшее разнообразие бактерий было выявлено в образце месторождения Таганское, инкубированного при 60°С, а наименьшее – в образце месторождения 10-й Хутор, инкубированного при температуре 60°С. Индекс Шеннона показал аналогичные результаты (табл. 3).
Таблица 3.
Значения индексов альфа разнообразия: К1 – 10-й Хутор, 60°С, К2 – 10-й Хутор, 25°С, К3 – Таганское, 60°С, К4 – Таганское, 25°С
| Образец | Число обнаруженных ОТЕ | Обратный индекс разнообразия Симпсона | Нижняя граница доверительного интервала | Верхняя граница доверительного интервала | Индекс Чао | Нижняя граница доверительного интервала индекса Чао | Верхняя граница доверительного интервала индекса Чао | Индекс Шеннона | Индекс выравненности |
|---|---|---|---|---|---|---|---|---|---|
| К1 | 2231.9 | 5.59 | 5.53 | 5.66 | 11 101.6 | 9658.1 | 12 825.8 | 2.79 | 0.34 |
| К2 | 2708.7 | 7.24 | 7.13 | 7.35 | 13 316.3 | 11 733.08 | 15 177.4 | 3.40 | 0.41 |
| К3 | 2460 | 15.65 | 15.45 | 15.86 | 13 691.5 | 11 860.68 | 15 879.1 | 3.94 | 0.49 |
| К4 | 3199.3 | 13.19 | 13.02 | 13.36 | 13 564.8 | 12 185.13 | 15 156.3 | 3.88 | 0.46 |
Во всех образцах доминировали бактерии филума Proteobacteria (>55% последовательностей). В образцах, инкубированных при 60°С, доля филума Firmicutes увеличилась на 21.7–22.5%. В образце бентонита Таганского месторождения, инкубированного при температуре 60°С, доля филума Actinobacteriota уменьшилась на 3.9%. Образец из месторождения 10-й Хутор имел высокую долю филума Bacteria_unclassified. В обоих бентонитах доля филума Proteobacteria в образцах, инкубированных при 60°С, была на 25–39% меньше, чем в образцах, инкубированных при 25°С (рис. 1).
Рис. 1.
Структура микробных сообществ исследуемых образцов на уровне филумов: К1 – 10-й Хутор, 60°С; К2 – 10-й Хутор, 25°C; К3 – Таганское, 60°С; К4 – Таганское, 25°С.
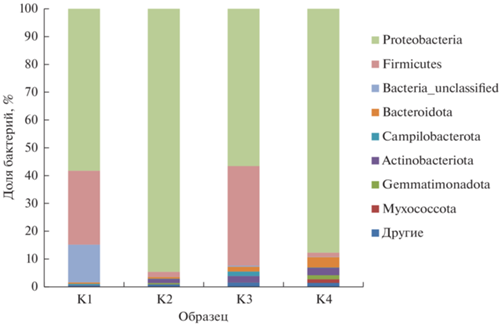
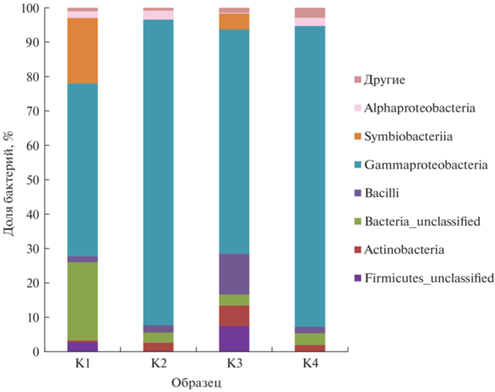
Во всех исследуемых образцах при обеих температурах инкубации доминировал класс Gammaproteobacteria. В образцах, инкубированных при 60°С, доля микроорганизмов класса Symbiobacteriia составляла 19 и 4.6% для месторождений 10-й Хутор и Таганское соответственно. При 25°С бактерии класса Symbiobacteriia идентифицированы не были.
При 60°С в бентоните месторождения 10-й Хутор также обнаружены неидентифицированные классы домена Bacteria (Bacteria_unclassified) и филума Firmicutes (Firmicutes_unclassified) (22.7 и 2.8% соответственно), а в бентоните месторождения Таганское, инкубированном при той же температуре (60°С), кроме вышеперечисленных, обнаружены среди доминантов классы Bacilli, Actinobacteria и Firmicutes_unclassified (11.9, 6 и 7.4% соответственно). В бентонитах, инкубированных при 25°С, выявлены бактерии класса Alphaproteobacteria в отличие от образцов, инкубированных при 60°С (рис. 2).
Рис. 2.
Структура микробных сообществ исследуемых образцов на уровне классов: К1 – 10-й Хутор, 60°С; К2 – 10-й Хутор, 25°С; К3 – Таганское, 60°С; К4 – Таганское, 25°С.
Во всех четырех исследуемых образцах доминировали бактерии семейства Comamonadaceae (β-Proteobacteria). В обоих образцах бентонитов, инкубированных при 60°С, также доминировали неидентифицированные бактерии (Bacteria_unclassified) и представители рода Caldinitratiruptor (Firmicutes).
В образцах бентонитов обоих месторождений после инкубирования при 25°С доминировали неидентифицированные бактерии порядка Burkholderiales (β-Proteobacteria), также многочисленными оказались представители семейства Oxalobacteraceae (β-Proteobacteria) и рода Cavicella (γ-Proteobacteria) (рис. 3).
Рис. 3.
Структура микробных сообществ исследуемых образцов на уровне рода: К1 – 10-й Хутор, 60°С; К2 – 10-й Хутор, 25°С; К3 – Таганское, 60°С; К4 – Таганское, 25°С.
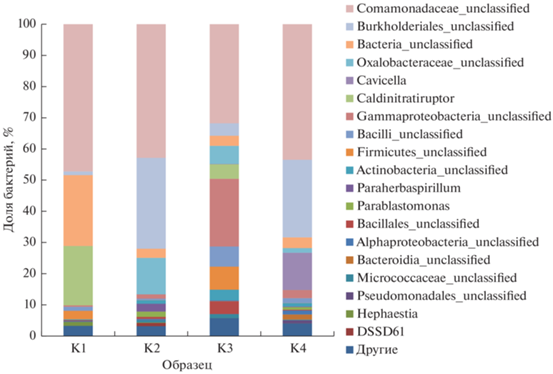
Анализируя структуру бактериальных сообществ на уровне рода можно отметить, что во всех исследуемых образцах доминантным родом являлся неидентифицированный род семейства Comamonadaceae. В образцах, которые были инкубированы при 25°С, доля Burkholderiales_unclassified была больше, чем при 60°С. После инкубирования при 25°С в бентоните Таганского месторождения численность неидентифицированного рода Oxalobacteraceae_unclassified была больше на 5.9–10.2%, чем в остальных образцах. Род Caldinitratiruptor обнаружен в обоих бентонитах, инкубированных при 60°С.
По данным взвешенного UniFrac анализа микробные сообщества образцов К1 (10-й Хутор, 60°С) и К3 (Таганское, 60°С) были наиболее похожи по таксономической структуре и составу. Вторую пару похожих образцов составляли образцы К2 (10-й Хутор, 25°С) и К4 (Таганское, 25°С) (табл. 4).
Таблица 4.
Данные анализа UniFrac взвешенный. К1 – 10-й Хутор, 60°С; К2 – 10-й Хутор, 25°С; К3 – Таганское, 60°С; К4 – Таганское, 25°С
| Параметр | K1 | K2 | K3 | K4 |
|---|---|---|---|---|
| K1 | 0 | 0.642 | 0.497 | 0.655 |
| K2 | 0.642 | 0 | 0.626 | 0.505 |
| K3 | 0.497 | 0.626 | 0 | 0.554 |
| K4 | 0.655 | 0.505 | 0.554 | 0 |
Во всех четырех образцах доминировали бактерии семейства Comamonadaceae (32–47%). Микроорганизмы этого семейства могут влиять на субстраты путем накопления β-гидроксибутирата, гидролиза ацетамида и восстановление нитрата до нитрита [30], также среди семейства Comamonadaceae встречаются анаэробные денитрификаторы и железоредуцирующие бактерии [31]. Caldinitratiruptor является факультативной микроаэрофильной нитратредуцирующей бактерией [32]. Данные процессы могут сопровождаться выделением газообразного азота и как следствие способствовать растрескиванию бентонита [23]. Кроме того, все доминирующие группы микроорганизмов являются аэробами и в процессе дыхания выделяют углекислый газ, что также может спровоцировать растрескивание бентонитов. Газогенерация микроорганизмами рассматривается как один из факторов, влияющих на герметичность хранилищ радиоактивных отходов [17].
При сравнении состава микробных сообществ исследуемых бентонитов и других бентонитов можно отметить следующие сходства: во всех бентонитах (MX-80, Almeria, National Standard, бентонит из уезда Синхэ в Китае) большую долю составляют представители филума Proteobacteria. В бентонитах месторождений 10-й Хутор и Таганское бактерии филума Proteobacteria являются наиболее многочисленными. Также в бентонитах месторождений MX80, National Standard, Canaprill и Almeria многочисленными являются представители Firmicutes. В бентонитах месторождений 10-й Хутор и Таганское филум Firmicutes является одним из доминирующих.
При рассмотрении других таксонов микроорганизмов бентонитов различных месторождений сходства не выявлено, что можно объяснить разным минеральным составом и разными условиями существованиями микроорганизмов.
Отмеченное увеличение доли представителей филума Firmicutes при росте температуры инкубации можно объяснить тем, что представители этого филума способны к образованию спор и обладают высокой устойчивостью к повышенным температурам [33, 34]. Присутствие филума Actinobacteriota в образцах, инкубированных при 60°С, может быть обусловлено тем, что оптимальные температуры жизнедеятельности многих бактерий этого филума лежат в диапазоне 20–42°С. Это может быть причиной увеличения численности представителей этого филума в образцах, инкубированных при 25°С [35].
Согласно нашим данным, только при 60°С развивались бактерии рода Caldinitratiruptor, вероятно, потому что температура инкубации соответствовала оптимальным значениям для жизнедеятельности этого рода – 65°C [32].
Отмеченное выше отсутствие рода Burkholderiales_unclassified при 60°С может быть связано с тем, что большинство представителей порядка Burkholderiales являются мезофилами с оптимальной температурой роста около 40°С [36].
При анализе филогенетического расстояния между микробными сообществами (UniFrac) сделан вывод, что между собой наиболее похожи бактериальные сообщества образцов месторождений 10-й Хутор (республика Хакасия) и Таганское (Республика Казахстан), инкубированные при 25°С; другую пару похожих образцов составляли бентониты, инкубированные при 60°С. Следовательно, главным фактором, влияющим на формирование микробного сообщества в настоящем исследовании, выступала температура, а не химический и минеральный состав бентонитов.
ЗАКЛЮЧЕНИЕ
Изучено микробное разнообразие двух бентонитов месторождений 10-й Хутор (Хакасия, Россия) и Таганское (Казахстан) при разных температурах инкубации (25 и 60°С). Во всех исследованных образцах доминировали бактерии филума Proteobacteria; при 60°С в обоих бентонитах увеличивалась доля бактерий филума Firmicutes.
Полученные данные свидетельствуют, что температура инкубации является основным фактором, определяющим таксономический состав и структуру микробных сообществ исследованных бентонитов. Следовательно, в условиях длительной эксплуатации глубинного геологического хранилища состав микробного сообщества может меняться вместе с изменением температуры внутри хранилища.
Список литературы
Belousov P.E., Krupskaya V.V., Zakusin S.V., Zhigarev V.V. bentonite clays from 10th khutor deposite: features of genesis, composition and adsorption properties // RUDN J. Engineering Researches. 2017. V. 18. № 1. P. 135–143. https://doi.org/10.22363/2312-8143-2017-18-1-135-143
Belousov P.E., Krupskaya V.V. Bentonite clays of Russia and neighboring countries // Georesursy. 2019. V. 21. № 3. P. 79–90. https://doi.org/10.18599/grs.2019.3.79-90
Bucher F., Müller–Vonmoos M. Bentonite as a containment barrier for the disposal of highly radioactive wastes // Appl. Clay Sci. 1989. V. 4. № 2. P. 157–177. https://doi.org/10.1016/0169-1317(89)90006-9
Delage P., Cui Y.J., Tang A.M. Clays in radioactive waste disposal // J. Rock Mechanics Geotechnical Engineer. 2010. V. 2. № 2. P. 111–123. https://doi.org/10.3724/SP.J.1235.2010.00111
Efimova D., Tyakht A., Popenko A., Vasilyev A., Altukhov I., Dovidchenko N., Odintsova V. et al. Knomics-Biota – a system for exploratory analysis of human gut microbiota data // BioData Min. 2018. V. 11. № 1. P. 25. https://doi.org/10.1186/s13040-018-0187-3
Esnault L., Jullien M., Mustin C., Bildstein O., Libert M. Metallic corrosion processes reactivation sustained by iron-reducing bacteria: Implication on long-term stability of protective layers // Phys. Chem. Earth, Parts A/B/C. 2011. V. 36. № 17–18. P. 1624–1629. https://doi.org/10.1016/j.pce.2011.10.018
Fardeau M.-L., Barsotti V., Cayol J.-L., Guasco S., Michotey V., Joseph M., Bonin P. et al. Caldinitratiruptor microaerophilus, gen. nov., sp. nov. isolated from a French hot spring (Chaudes-Aigues, Massif Central): a novel cultivated facultative microaerophilic anaerobic thermophile pertaining to the Symbiobacterium branch within the Firmicutes // Extremophiles. 2010. V. 14. № 3. P. 241–247. https://doi.org/10.1007/s00792-010-0302-y
Grigoryan A.A., Jalique D.R., Medihala P., Stroes-Gascoyne S., Wolfaardt G.M., McKelvie J., Korber D.R. Bacterial diversity and production of sulfide in microcosms containing uncompacted bentonites // Heliyon. 2018. V. 4. № 8. P. e00722. https://doi.org/10.1016/j.heliyon.2018.e00722
Hallbeck L., Pedersen K. Characterization of microbial processes in deep aquifers of the Fennoscandian Shield // Appl. Geochem. 2008. V. 23. № 7. P. 1796–1819. https://doi.org/10.1016/j.apgeochem.2008.02.012
Haynes H.M., Pearce C.I., Boothman C., Lloyd J.R. Response of bentonite microbial communities to stresses relevant to geodisposal of radioactive waste // Chem. Geol. 2018. V. 501. P. 58–67. https://doi.org/10.1016/j.chemgeo.2018.10.004
Hugerth L.W., Wefer H.A., Lundin S., Jakobsson H.E., Lindberg M., Rodin S., Engstrand L. et al. DegePrime, a Program for Degenerate Primer Design for Broad-Taxonomic-Range PCR in Microbial Ecology Studies // Appl. Environ. Microbiol / Ed. Löffler F.E. 2014. V. 80. № 16. P. 5116–5123. https://doi.org/10.1128/AEM.01403-14
Kale R.C., Kapil B., Ravi K. Response of compacted bentonite to hyperalkalinity and thermal history // Sci. Rep. 2021. V. 11. № 1. P. 15483. https://doi.org/10.1038/s41598-021-95023-5
Kim J.-S., Kwon S.-K., Sanchez M., Cho G.-C. Geological storage of high-level nuclear waste // KSCE J. Civil Engineering. 2011. V. 15. № 4. P. 721–737. https://doi.org/10.1007/s12205-011-0012-8
Krupskaya V.V., Zakusin S.V., Tyupina E.A., Dorzhieva O.V., Chernov M.S., Bychkova Ya.V. Transformation of the montmorillonite structure and its adsorption properties due to the thermochemical treatment // Geochem. Int. 2019. T. 57. № 3. P. 314–330.https://doi.org/10.1134/S0016702919030066
Liu H., Dang X., Zhang H., Dong J., Zhang Z., Wang C., Zhang R. et al. Microbial diversity in bentonite, a potential buffer material for deep geological disposal of radioactive waste // IOP Conf Ser. Earth Environ. Sci. 2019. V. 227. № 2. P. 022010. https://doi.org/10.1088/1755-1315/227/2/022010
Lopez–Fernandez M., Cherkouk A., Vilchez–Vargas R., Jauregui R., Pieper D., Boon N., Sanchez–Castro I. et al. Bacterial Diversity in Bentonites, Engineered Barrier for Deep Geological Disposal of Radioactive Wastes // Microbiol. Ecol. 2015. V. 70. № 4. P. 922–935. https://doi.org/10.1007/s00248-015-0630-7
Meleshyn A. Microbial processes relevant for the long-term performance of high-level radioactive waste repositories in clays // Geological Society, London, Special Publications. 2014. V. 400. № 1. P. 179–194. https://doi.org/10.1144/SP400.6
Meleshyn A.Yu., Zakusin S.V., Krupskaya V.V. Swelling Pressure and Permeability of Compacted Bentonite from 10th Khutor Deposit (Russia) // Minerals. 2021. V. 11. № 7. P. 742. https://doi.org/10.3390/min11070742
Merkel A.Yu., Tarnovetskii I.Yu., Podosokorskaya O.A., Toshchakov S.V. Analysis of 16S rRNA Primer Systems for Profiling of Thermophilic Microbial Communities // Microbiology (N.Y.). 2019. V. 88. № 6. P. 671–680. https://doi.org/10.1134/S0026261719060110
Moreno J., López–González J.A., Arcos-Nievas M.A., Suárez-Estrella F., Jurado M.M., Estrella-González M.J., López M.J. Revisiting the succession of microbial populations throughout composting: A matter of thermotolerance // Sci. Total Environ. 2021. V. 773. P. 145587. https://doi.org/10.1016/j.scitotenv.2021.145587
Nandakumar R., Shahjahan A.K.M., Yuan X.L., Dickstein E.R., Groth D.E., Clark C.A., Cartwright R.D. et al. Burkholderia glumae and B. gladioli Cause Bacterial Panicle Blight in Rice in the Southern United States // Plant Dis. 2009. V. 93. № 9. P. 896–905. https://doi.org/10.1094/PDIS-93-9-0896
Nicholson W.L., Munakata N., Horneck G., Melosh H.J., Setlow P. Resistance of Bacillus Endospores to Extreme Terrestrial and Extraterrestrial Environments // Microbiol. Molecular Biol. Rev. 2000. V. 64. № 3. P. 548–572. https://doi.org/10.1128/MMBR.64.3.548-572.2000
Pannekens M., Kroll L., Müller H., Mbow F.T., Meckenstock R.U. Oil reservoirs, an exceptional habitat for microorganisms // N. Biotechnol. 2019. V. 49. P. 1–9. https://doi.org/10.1016/j.nbt.2018.11.006
Pedersen K. Microbial processes in radioactive waste disposal. 2000. https://www.researchgate.net/publication/ 264450697_Microbial_Processes_in_Radioactive_Waste_ Disposal
Ranjani A., Dhanasekaran D., Gopinath P.M. An Introduction to Actinobacteria // Actinobacteria – Basics and Biotechnological Applications. InTech, 2016. https://doi.org/10.5772/62329
Schloss P.D., Westcott S.L., Ryabin T., Hall J.R., Hartmann M., Hollister E.B., Lesniewski R.A. et al. Introducing mothur: Open-Source, Platform-Independent, Community-Supported Software for Describing and Comparing Microbial Communities // Appl. Environ. Microbiol. 2009. V. 75. № 23. P. 7537–7541. https://doi.org/10.1128/AEM.01541-09
Smart N.R., Rance A.P., Reddy B., Hallbeck L., Pedersen K., Johansson A.J. In situ evaluation of model copper-cast iron canisters for spent nuclear fuel: a case of microbiologically influenced corrosion (MIC) // Corrosion Engineering, Sci. Technol. 2014. V. 49. № 6. P. 548–553. https://doi.org/10.1179/1743278214Y.0000000213
Steinberg J.P., Burd E.M. Other Gram-Negative and Gram-Variable Bacilli // Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 2014. V. 2. P. 2667–2683. https://doi.org/10.1016/B978-1-4557-4801-3.00238-1
Stipanicev M., Turcu F., Esnault L., Schweitzer E.W., Kilian R., Basseguy R. Corrosion behavior of carbon steel in presence of sulfate-reducing bacteria in seawater environment // Electrochim. Acta. 2013. V. 113. P. 390–406. https://doi.org/10.1016/j.electacta.2013.09.059
Stroes-Gascoyne S., Hamon C.J., Dixon D.A., Martino J.B. Microbial analysis of samples from the tunnel sealing experiment at AECL’s Underground Research Laboratory // Phys. Chem. Earth, Parts A/B/C. 2007. V. 32. № 1–7. P. 219–231. https://doi.org/10.1016/j.pce.2006.01.002
Taborowski T. et al. Bacterial presence and activity in compacted bentonites. Mölnlycke, 2019. https://igdtp. eu/wp-content/uploads/2019/05/MIND-2019-04-D2.4-BacterialPresenceActivityInCompactedBentonites-v2.pdf
Wersin P., Johnson L.H., McKinley I.G. Performance of the bentonite barrier at temperatures beyond 100°C: A critical review // Phys. Chem. Earth, Parts A/B/C. 2007. V. 32. № 8–14. P. 780–788. https://doi.org/10.1016/j.pce.2006.02.051
Willems A. The family Comamonadaceae // The Prokaryotes: Alphaproteobacteria and Betaproteobacteria. 2014. V. 9783642301971. https://doi.org/10.1007/978-3-642-30197-1_238
http://info.geology.gov.kz/
https://mothur.org/wiki/miseq_sop
https://mothur.org/wiki/silva_reference_files/
Дополнительные материалы отсутствуют.


