Почвоведение, 2023, № 5, стр. 525-535
Разнообразие бактерий, культивируемых из аридных почв и пород в условиях дефицита доступной воды
В. С. Чепцов a, b, *, А. А. Белов a, И. В. Сотников c
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт космических исследований РАН
117997 Москва, ул. Профсоюзная, 84/32, Россия
c Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр-т, 33, Россия
* E-mail: cheptcov.vladimir@gmail.com
Поступила в редакцию 20.10.2022
После доработки 29.12.2022
Принята к публикации 30.12.2022
- EDN: IFLUFI
- DOI: 10.31857/S0032180X22601372
Аннотация
Проведено исследование разнообразия бактерий, выделенных из почвы пустыни Негев (Израиль, образец SN2) и осадочной породы пустыни Сахара (Тунис, образец Alg). Для оценки способности бактерий к метаболизму при различных уровнях доступности влаги и для более полного выявления бактериального разнообразия культивирование проводили на средах R2A с добавлением глицерина в различных концентрациях для установления определенного уровня активности воды (Aw) в среде в диапазоне от 1.0 до 0.9 (с шагом 0.01 Aw). После инкубации уникальные морфотипы культивируемых бактерий выделяли, описывали, идентифицировали с помощью секвенирования 16S рРНК и тестировали на способность к росту в градиенте Aw в чистых культурах. После инкубации и выделения было идентифицировано и протестировано 355 штаммов. Культивируемые бактерии обнаруживали на средах с Aw 0.95 и больше. При уменьшении Aw от 1 до 0.95 численность культивируемых бактерий уменьшалась от 105 и 107 КОЕ/г в образцах SN2 и Alg соответственно до 2 × 104 КОЕ/г в обоих исследованных образцах. В результате культивирования выделили представителей 34 родов бактерий, преимущественно филума Actinobacteria; доминировали представители родов Arthrobacter, Kocuria и Pseudarthrobacter. При этом выявили 38 штаммов с низким сходством нуклеотидных последовательностей с базами данных, вероятно, являющихся представителями ранее не описанных видов родов Agrococcus, Arthrobacter, Bacillus, Brachybacterium, Cellulomonas, Conyzicola, Kocuria, Microbacterium, Okibacterium, Rathayibacter и Sphingomonas. Тестирование штаммов на способность к росту в чистой культуре в градиенте значений Aw позволило обнаружить 18 штаммов родов Arthrobacter, Kocuria, Brachybacterium, Serratia и Leucobacter, способных к росту на питательной среде с Aw 0.91. Проведенное исследование подтверждает, что пустынные почвы и породы являются депозитарием ранее не описанных видов бактерий, а также могут быть ценным источником биотехнологически перспективных штаммов.
ВВЕДЕНИЕ
Изучение изменений, происходящих в почвах и сопряженных системах при дефиците воды, является чрезвычайно актуальным [17, 48]. Исследование биоразнообразия микроорганизмов экстремобиосферы способствует пониманию основных физиологических процессов и роли микробных метаболитов в поддержании жизнеспособности клетки и сохранении метаболической активности в разнообразных физико-химическим условиях, а также расширяет современные представления о разнообразии и геохимической роли ксеротолерантных организмов [28, 32, 39].
Засушливые экотопы – наиболее распространенные наземные экосистемы: на их долю приходится около 30% поверхности суши, из которых 7% являются гипераридными [9]. Кроме того, необходимо учитывать, что низкие температуры ограничивают доступность воды для микробных клеток [30], что расширяет область территорий, в почвах которых микробные сообщества на протяжении годичных или сезонных циклов испытывают дефицит доступной воды. Помимо низких температур на доступность воды для микроорганизмов влияет концентрация растворимых соединений в почвенных растворах, в частности, при применении удобрений и в прикорневой зоне растений [24, 42, 47]. Это свидетельствует о широком распространении в биосфере экотопов и локусов, в которых микроорганизмы существуют в условиях недостатка доступной воды.
Нижняя граница активности воды (Aw), при которой показано сохранение репродуктивной активности микробными клетками, составляет около 0.585: в этих условиях развиваются ксерофильные микромицеты Aspergillus penicillioides [25, 52]. Считается, что функциональные границы биосферы по активности воды составляют от 1 до ≈0.60 ед., в то время как большинство микроорганизмов развивается в диапазоне Аw от 1 до 0.900 [23, 50]. Для почвенных микробных сообществ есть сведения о метаболической активности при Аw, равной 0.89 [34, 51]. Существуют данные о росте и размножении бактерий рода Streptomyces при активности воды, равной 0.5 [60, 61], и противоречащие исследования, свидетельствующие о невозможности репродукции данных видов при Aw <0.895 [51].
Недавние исследования засушливых экосистем свидетельствуют о том, что почвы и породы пустынь могут рассматриваться в качестве депозитария ранее не описанных видов бактерий, а также содержат большое разнообразие продуцентов различных биологически активных веществ [22, 38]. При этом особое внимание уделяется поиску микроорганизмов, способствующих росту сельскохозяйственных растений [36, 43]. Выявление продуцентов биологически активных веществ, способных функционировать в условиях дефицита влаги, перспективно для множества прикладных направлений, включая выращивание сельскохозяйственных культур в аридных условиях и улавливание парниковых газов [7, 27, 43, 44].
Следует отметить, что исследования разнообразия устойчивых к низкой активности воды микроорганизмов в основном сфокусированы на изучении отдельных немногочисленных видов или штаммов. Изменения структуры культивируемых прокариотных сообществ при снижении активности воды практически отсутствуют.
Цель работы – изучение разнообразия культивируемых бактериальных сообществ в градиенте активности воды от 1 до 0.9 и оценка способности выделенных бактерий к росту при пониженной доступности воды.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования являлись культивируемые бактериальные сообщества, выделенные из пустынной почвы и осадочной породы, отобранных в пустыне Негев (30°47′ N; 34°46′ E; Израиль, условное обозначение образца SN2) и на севере пустыни Сахара (33°25′ N; 9°2′ E; Тунис, условное обозначение образца Alg) соответственно. Образцы SN2 и Alg отбирали асептично с глубины 5–10 и 0–10 см соответственно в стерильные полипропиленовые контейнеры. Согласно WRB, почва, отобранная в пустыне Негев, классифицируется как Aridic Calcisol [14].
Выделение культивируемых бактерий из почв и пород проводили на плотной питательной среде R2A [45]. Для создания различных значений активности воды использовали растворы глицерина, добавленные к питательной среде. Расчет значений Aw проводили по уравнению Норриша [23, 57]. Культивирование проводили на средах со значениями активности воды от 1 до 0.90 с шагом в 0.01 ед. активности. Посевы инкубировали в течение 42 сут при +25°С, после чего проводили учет численности колониеобразующих единиц (КОЕ) по стандартной методике [1]. Посев проводили в трехкратной повторности.
После инкубации и учета численности КОЕ в каждом сообществе культивируемых бактерий учитывали число уникальных морфологических типов колоний, которые выделяли в чистую культуру. Всего из исследованных образцов при различных уровнях доступности воды (Aw) выделили 355 штаммов аэробных гетеротрофных бактерий. Чистые культуры пересевали на жидкую питательную среду R3A [45].
Для определения предельных значений Aw, при которых возможен рост выделенных штаммов, проводили культивирование исследуемых бактерий на жидкой питательной среде R3A в градиенте значений Aw от 1.0 (положительный контроль) до 0.9 с шагом в 0.01 ед. Инкубацию проводили в течение 42 сут при +25°С в трехкратной повторности, после чего регистрировали рост на среде с соответствующей активностью воды.
Для определения таксономической структуры сообществ культивируемых бактерий использовали методы амплификации фрагмента гена 16S рРНК с универсальными вырожденными праймерами, рестрикционный анализ ампликонов для выявления уникальных рибогенотипов бактерий и секвенирование по Сенгеру уникальных рибогенотипов.
Выделение ДНК чистых культур бактерий проводили по ранее описанной методике [3]: биомассу бактерий суспендировали в Трис-ЭДТА буферном растворе (рН 7.8) с 5% Triton X-100, суспензии инкубировали на водяной бане при температуре 100°С в течение 15 мин, затем обрабатывали на гомогенизаторе при 5000 об./мин в течение 30 с. Далее полученную суспензию центрифугировали при 14 000 об./мин в течение 3 мин, полученную надосадочную жидкость использовали в качестве матрицы для проведения ПЦР.
Амплификацию фрагмента гена 16S рРНК проводили с праймерной системой 27f + 537r по ранее описанной методике [3]. ПЦР-продуктов визуализировали в 1.5%-ном агарозном геле с ДНК-специфичным красителем бромистым этидием.
Для проведения риботипирования полученные ампликоны последовательно обрабатывали эндонуклеазами рестрикции Alu I, Hae III и Taq I (SibEnzyme, Россия) с сайтами рестрикции AG↑CT, GG↑CC и T↑CGA соответственно [13]. Ферментативные реакции проводили в соответствии с инструкциями производителя. Продукты рестрикции визуализировали в 2%-ном агарозном геле с ДНК-специфичным красителем бромистым этидием. Результаты рестрикции фиксировали с помощью системы гель-документирования Doc-Print II (Vilber Lourmat, Франция). Ампликоны с одинаковыми рестрикционными профилями относили к одному рибогенотипу.
Секвенирование фрагментов гена 16S рРНК проводили в научно-исследовательской компании Евроген (Россия). Редактирование нуклеотидных последовательностей проводили с помощью программы Chromas Lite 2.6.6 (http://technelysium.com.au/wp/chromas/), выравнивание, сравнение и идентификацию последовательностей выполняли с помощью программы Clustal Omega (https://www.ebi.ac.uk/Tools/msa/clustalo/) и алгоритма BLAST базы данных GenBank (https://blast.ncbi.nlm.nih.gov/). Полученные последовательности депонировали в базу данных GenBank под номерами OP673589–OP673681.
Статистическую обработку полученных результатов проводили с использованием пакетов программ R-Studio и Microsoft Office Excel. Коэффициенты несходства Брея–Кертиса рассчитывали с использованием логарифмически преобразованных данных [31]; индексы Шеннона рассчитывали по описанной ранее методике [6].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Численность культивируемых бактерий. При культивировании на среде с Aw, равной 1, численность бактерий составляла (1.1 ± 0.2) × 107 и (6.7 ± ± 0.6) × 105 КОЕ/г в образцах почвы пустыни Негев (SN2) и поверхностной осадочной породы пустыни Сахара (Alg) соответственно. При уменьшении Aw до 0.98–0.97 наблюдалось уменьшение количества бактерий, культивируемых из образца SN2, в 3–7 раз. Для образца Alg изменение числа КОЕ в этом диапазоне Aw не выявлено. При Aw 0.95 численность культивируемых бактерий была ниже в 100–1000 раз, чем при Aw 1 и достигала в обоих исследованных образцах значений ~2 × 104 КОЕ/г (рис. 1). При меньших значениях активности воды макроколонии не развивались.
Рис. 1.
Численность бактерий, культивируемых из образцов почвы пустыни Негев (SN2) и поверхностной осадочной породы пустыни Сахара (Alg) на средах с различными значениями активности воды.
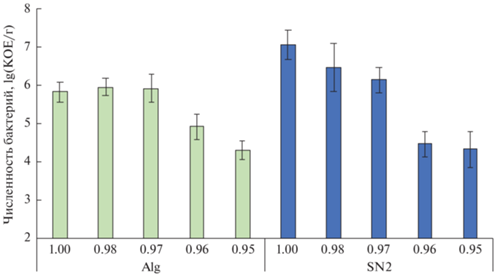
Численность аэробных гетеротрофных бактерий, культивируемых из образца SN2 на среде с Aw 1, близка к значениям, полученным ранее для данной почвы в ходе предыдущих исследований ~3 × 107 КОЕ/г [14]. Исследования осадочных пород восточной части пустыни Сахара (юго-запад Египта) выявляли от 6.5 × 105 до 9.8 × 106 КОЕ/г культивируемых бактерий на различных питательных средах [3]. В целом, значения показателей обилия прокариот в образцах SN2 и Alg типичны для различных аридных экотопов [4, 19, 28, 29]. Сведения о численности бактерий при культивировании из каких-либо почв и пород на средах с пониженной доступностью воды в литературе отсутствуют.
Разнообразие и структура культивируемых бактериальных сообществ. Доминирующими во всех выделенных сообществах являлись представители родов Arthrobacter, Kocuria, Pseudarthrobacter. Всего из исследованных образцов при разных условиях были культивированы представители 34 родов и 67 видов бактерий, преимущественно представителей филума Actinobacteria (синоним Actinomycetota [40]), к которому относятся 23 из выявленных родов. Также были обнаружены бактерии филумов Firmicutes (роды Bacillus, Mammaliicoccus, Paenibacillus), Deinococcus-Thermus (род Deinococcus), классов Alphaproteobacteria (Paracoccus, Shinella, Sphingomonas), Betaproteobacteria (Massilia, Delftia) и Gammaproteobacteria (Serratia, Stenotrophomonas). В обоих исследованных образцах было выявлено по 24 рода бактерий.
Из почвы пустыни Негев (SN2) на среде с Aw 1 были выделены бактерии 11 родов. При снижении Aw до 0.98 число культивируемых родов уменьшалось до 7 (рис. 2). При Aw 0.97 и 0.96 наблюдалось увеличение бактериального разнообразия: в этих условиях культивировались представители 12 и 13 родов соответственно. В то же время при уменьшении Aw до 0.95 были выделены бактерии лишь двух родов: Arthrobacter и Corynebacterium. Аналогичным образом изменялся индекс разнообразия Шеннона исследованных бактериальных сообществ (табл. 1).
Рис. 2.
Структура культивируемых бактериальных сообществ, выделенных из образцов почвы пустыни Негев (SN2) и осадочной породы пустыни Сахара (Alg) при различных значениях активности воды.
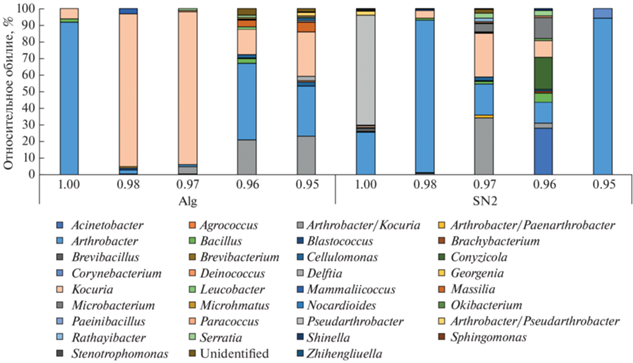
Таблица 1.
Индексы разнообразия Шеннона бактериальных сообществ, культивируемых при различных значениях Aw
| Образец | Активность воды, Aw | ||||
|---|---|---|---|---|---|
| 1 | 0.98 | 0.97 | 0.96 | 0.95 | |
| SN2 | 1.26 | 0.66 | 2.23 | 2.36 | 1.20 |
| Alg | 1.02 | 0.50 | 0.51 | 2.28 | 2.56 |
В сообществах, выделенных из осадочной породы пустыни Сахара, количество родов культивируемых бактерий возрастало по мере снижения активности воды: на среде с Aw 1 были выделены представители трех родов бактерий (Arthrobacter, Kocuria, Bacillus); при Aw 0.98 и 0.97 обнаружено по 6 родов (доминировали представители рода Kocuria). Наибольшее разнообразие родов культивируемых бактерий было выявлено при наименьшей доступности воды – 9 и 12 родов при Aw 0.96 и 0.95 соответственно; при этом наибольшую долю в сообществах составляли представители родов Arthrobacter и Kocuria. Однако индекс Шеннона изменялся несколько иначе: при Aw 0.98 и 0.97 индексы были ниже, чем при Aw 1, несмотря на большее число культивируемых родов. Это обусловлено низкой выравненностью в данных бактериальных сообществах, т.е. высокой долей (91%) в сообществе единственного доминантного таксона. Наибольшие значения индекса Шеннона были характерны для наименьших Aw.
Высокие значения индекса Брея–Кертиса свидетельствуют о резкой перестройке структуры исследованных сообществ при каждом изменении активности воды (табл. 2). Данный индекс может варьировать от 0 до 1, и наименьшие значения индекса характерны для наиболее похожих сообществ. Для бактериальных сообществ, выделенных из образца SN2, наименьшие значения индекса составляли 0.71 для двух пар сообществ: выделенных при Aw 1 и 0.98 и при Aw 0.97 и 0.96. Наибольшее сходство было характерно для сообществ, выделенных из осадочной породы пустыни Сахара при Aw 0.96 и 0.95; индекс в этом случае был равен 0.57.
Таблица 2.
Матрицы коэффициентов несходства Брея–Кертиса исследованных микробных сообществ
| SN2 | Alg | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Aw | 1 | 0.98 | 0.97 | 0.96 | 0.95 | 1 | 0.98 | 0.97 | 0.96 | 0.95 |
| 1 | 0 | 0.71 | 0.87 | 0.85 | 0.91 | 0 | 0.97 | 0.91 | 0.82 | 0.92 |
| 0.98 | 0.71 | 0 | 0.82 | 0.79 | 0.93 | 0.97 | 0 | 0.96 | 0.83 | 0.91 |
| 0.97 | 0.87 | 0.82 | 0 | 0.71 | 0.94 | 0.91 | 0.96 | 0 | 0.88 | 0.91 |
| 0.96 | 0.85 | 0.79 | 0.71 | 0 | 0.94 | 0.82 | 0.83 | 0.88 | 0 | 0.57 |
| 0.95 | 0.91 | 0.93 | 0.94 | 0.94 | 0 | 0.92 | 0.91 | 0.91 | 0.57 | 0 |
Таким образом, наибольшее разнообразие (как количество обнаруженных родов, так и индексы Шеннона) для обоих исследованных образцов наблюдалось при пониженных значениях Aw. Важно, что при выделении и идентификации чистых культур из исследованных образцов были обнаружены 38 штаммов бактерий (10.7% от исследованной выборки штаммов), характеризующихся низким сходством последовательностей генов 16S рРНК с последовательностями базы данных GenBank [15], что может указывать на то, что данные организмы являются представителями ранее не описанных видов бактерий родов Agrococcus, Arthrobacter, Bacillus, Brachybacterium, Cellulomonas, Conyzicola, Kocuria, Microbacterium, Okibacterium, Rathayibacter и Sphingomonas. Наименьшим сходством (95.6%) характеризовался штамм рода Arthrobacter, выделенный из образца Alg на среде с активностью воды, равной 0.95. Наибольшее количество штаммов, предположительно являющихся не описанными видами, было выделено из образца SN2 на средах с Aw 0.97 и 0.96 – 13 и 9 культур соответственно (табл. 3).
Таблица 3.
Количество штаммов, предположительно являющихся неописанными видами бактерий, выделенных при различных условиях культивирования
| Aw | Образец | Число штаммов | Родовая принадлежность |
|---|---|---|---|
| 1 | Alg | 0 | – |
| SN | 1 | Kocuria | |
| 0.98 | Alg | 1 | Kocuria |
| SN | 1 | Kocuria | |
| 0.97 | Alg | 4 | Kocuria, Agrococcus |
| SN | 13 | Brachybacterium, Cellulomonas, Kocuria, Microbacterium, Rathayibacter | |
| 0.96 | Alg | 3 | Arthrobacter, Bacillus |
| SN | 9 | Arthrobacter, Brachybacterium, Cellulomonas, Conyzicola, Kocuria, Microbacterium | |
| 0.95 | Alg | 6 | Arthrobacter, Cellulomonas, Okibacterium, Sphingomonas |
| SN | 0 | – |
Ранее с применением культуральных и молекулярно-биологических методов неоднократно было показано доминирование бактерий филумов Actinobacteria, Firmicutes, Proteobacteria, в некоторых случаях Chloroflexi в почвах и породах пустынь [3, 4, 33, 53, 54]. Эти данные подтверждаются и в настоящем исследовании. Высокая представленность актинобактерий в пустынных почвах и породах, а также при культивировании в условиях дефицита доступной влаги, вероятно, обусловлена устойчивостью многих представителей этого филума к широкому спектру экстремальных воздействий, включая повышенное содержание солей и сильных окислителей, высокие и низкие температуры, кислотность среды и др. [4, 5, 32, 59]. Для бактерий большинства родов, доминировавших в исследованных сообществах образцов SN2 и Alg, а также выделенных при Aw 0.95, показана высокая радиорезистентность [11, 13, 14, 16, 26, 41]. Следует отметить взаимосвязанность механизмов устойчивости к различным факторам, благодаря чему устойчивость к одному типу воздействия может способствовать выживанию и сохранению активности микроорганизмами при другом типе воздействия [35, 55].
Полученные данные подтверждают существующую точку зрения о том, что аридные экосистемы содержат большой пул неописанных культивируемых микроорганизмов и, в частности, актинобактерий [22, 38]. В настоящее время предлагаются и разрабатываются подходы для выделения и описания этого микробного пула. Так, недавно показано, что применение традиционного метода посева, но с использованием нескольких питательных сред в градиенте концентраций, может быть эффективно для выделения неописанных видов бактерий. Таким путем из образцов почвенных корочек пустыни Табернас (Испания) было выделено 254 штамма, из которых 31% предположительно относились к неописанным видам бактерий [33]. Использованный нами подход может являться как альтернативой указанному выше методу, так и применяться в сочетании с ним, что может быть эффективно при поиске новых таксонов микроорганизмов.
Способность чистых культур к росту при различных значениях Aw. Все выделенные культуры исследовали на предмет способности к росту при различных значениях активности воды. На рис. 3 изображена представленность бактерий с различными нижними границами значения Aw, при которых наблюдался рост в чистой культуре, в сообществах, выделенных при различных значениях активности воды. Из всей исследованной выборки 4, 5, 24, 45, 17 и 5% штаммов были способны к росту в чистой культуре при Aw не ниже 1, 0.98, 0.97, 0.96, 0.95 и 0.91 соответственно. Штаммы, для которых граничные значения Aw были равны 0.92–0.94, отсутствовали. В большинстве сообществ культивируемых бактерий, независимо от Aw, при которой они были выделены, преобладали бактерии, способные к росту в чистой культуре при Aw 0.96.
Рис. 3.
Представленность бактерий с различными нижними границами значения Aw, при которых наблюдался рост в чистой культуре, в сообществах, выделенных при различных значениях активности воды.
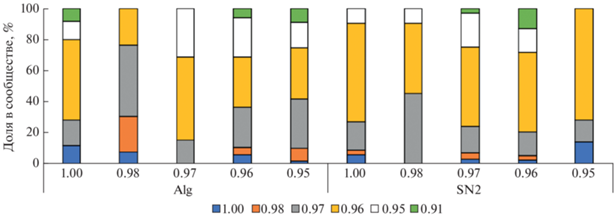
Зависимостей между значением Aw, при котором было выделено сообщество, и значениями Aw, при которых способны расти штаммы из этого сообщества, не обнаружено. Полученные результаты указывают на то, между значениями Aw, при которых выделен каждый конкретный штамм, и его способностью к росту в чистой культуре на средах с различным уровнем доступности воды нет прямой связи. В частности, в нескольких выделенных сообществах выявлены культуры, способные к росту при Aw 0.91, в то время как при первичном выделении из почв и осадочных пород рост бактерий при соответствующем значении активности воды не обнаружен. В то же время для многих исследованных штаммов наблюдалась способность к росту при более низких Aw при первичном выделении из природных образцов и потеря способности к росту в этих условиях в чистых культурах. Это может быть объяснено различиями в условиях культивирования (первичное выделение на плотной среде R2A, субкультивирование и тестирование на жидкой среде R3A). Также нельзя исключить некоторое влияние микроэлементов и метаболитов, содержащихся в природных образцах и вносимых на поверхность питательной среды при посеве. Известно, что ряд веществ, содержащихся в почвах и породах, способен оказывать стимулирующее воздействие на рост бактерий, а также способствовать функционированию микробных клеток в стрессовых условиях [18, 20].
Анализ коллекции выделенных из образцов SN2 и Alg бактерий выявил, что при активности воды от 1.0 до 0.96 происходит постепенное уменьшение количества штаммов и разнообразия бактерий, способных к росту в данных условиях; при Aw 0.95 происходит резкое сокращение числа культур, способных к росту. В диапазоне Aw 0.94–0.91 росли представители пяти родов бактерий A-rthrobacter, Brachybacterium, Kocuria, Leucobacter и Serratia (рис. 4). Ранее показано, что по крайней мере некоторые представители этих родов обладают ксеротолерантными свойствами [8, 12, 37, 46, 58].
Рис. 4.
Способность выделенных бактерий к росту в чистой культуре при различных значениях активности воды.
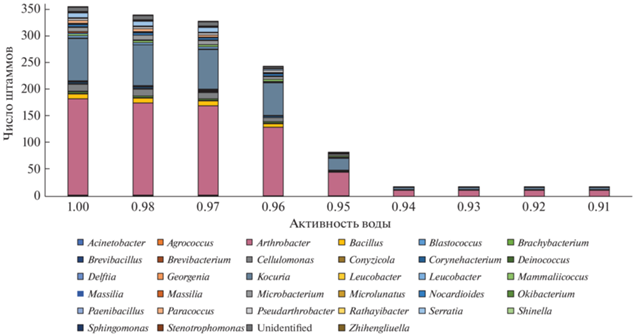
Отметим, что в целом большинство бактерий не способно к росту при Aw ниже 0.95–0.94 [10, 21, 49]. В связи с этим штаммы, проявившие способность к росту при Aw 0.91, могут представлять значительный интерес как с точки зрения изучения механизмов ксеротолерантности, так и с биотехнологической позиции, особенно в случае продукции данными штаммами каких-либо промышленно значимых соединений. Анализ продукции ряда ферментов выявленными устойчивыми штаммами предполагается в продолжении исследования.
Внимания заслуживает и тот факт, что некоторые штаммы в чистой культуре могут расти при пониженной активности воды по сравнению с условиями выделения. Так, некоторые штаммы, растущие в чистой культуре при Aw 0.91, были выделены на среде с Aw 1. В то же время некоторые исследования по поиску экстремотолерантных микроорганизмов сфокусированы на создании в начале эксперимента довольно строгих селективных условий, выделении небольшого количества предположительно наиболее устойчивых культур и их дальнейшей характеристике [2, 35, 56]. Полученные результаты свидетельствуют о том, что применение подобного подхода может препятствовать обнаружению некоторых устойчивых микроорганизмов; в то же время очевидно, что характеристика большого числа штаммов значительно более трудоемка и не всегда технически возможна.
ЗАКЛЮЧЕНИЕ
Проведено исследование биоразнообразия и структуры бактериальных комплексов двух аридных экосистем при культивировании на средах с различными значениями активности воды. В ходе работы выделено и идентифицировано 355 штаммов бактерий, относящихся к 34 родам. Полученные данные дополняют современные знания о микробном разнообразии аридных экотопов.
Установлено, что при изменении Aw от 1 до 0.95 численность культивируемых бактерий уменьшается на 2–3 порядка. Снижение доступности влаги с шагом Aw 0.01 приводило к резким перестройкам таксономической структуры микробных сообществ. При этом показатели биоразнообразия сначала снижались (при Aw 0.98) и затем возрастали и достигали наибольших значений при Aw 0.95–0.96. Во всех выделенных сообществах доминировали представители родов Arthrobacter, Kocuria, Pseudarthrobacter.
В результате работы получено 38 бактериальных культур, которые могут являться представителями не описанных ранее видов бактерий. Показано, что проведение культивирования с градиентом значений Aw способствует выявлению существенно большего культивируемого разнообразия, что может применяться для поиска новых видов микроорганизмов, в том числе в сочетании с существующими подходами. Обнаружен ряд штаммов родов Arthrobacter, Brachybacterium, Kocuria, Leucobacter и Serratia, способных расти при Aw 0.91; эти штаммы могут быть перспективны для изучения механизмов ксеротолерантности, а также с биотехнологической точки зрения.
Полученные результаты в совокупности с литературными данными указывают на то, что в лабораторных условиях преимущественно актинобактерии демонстрируют способность к росту в условиях дефицита доступной влаги. Учитывая их высокую устойчивость к УФ- и ионизирующему излучению, высушиванию, окислительному и солевому стрессу, колебаниям температуры, рН и другим факторам окружающей среды, филум Actinobacteria можно рассматривать как один из ключевых таксонов, представители которого способны сохранять метаболическую активность в условиях дефицита влаги.
Проведенное исследование подтверждает данные о том, что экстремальные экосистемы, в частности, пустынные почвы и породы, являются депозитарием ранее не описанных видов бактерий, а также могут быть ценным источником биотехнологически перспективных штаммов.
Список литературы
Белов А.А., Чепцов В.С., Лысак Л.В. Методы идентификации почвенных микроорганизмов. М.: МАКС Пресс, 2020. 196 с.
Albdaiwi R.N., Khyami-Horani H., Ayad J.Y., Alananbeh K.M., Al-Sayaydeh R. Isolation and characterization of halotolerant plant growth promoting rhizobacteria from durum wheat (Triticum turgidum subsp. durum) cultivated in saline areas of the dead sea region // Front. Microbiol. 2019. V. 10. P 1639. https://doi.org/10.3389/fmicb.2019.01639
Belov A.A., Cheptsov V.S., Vorobyova E.A. Soil bacterial communities of Sahara and Gibson deserts: Physiological and taxonomical characteristics // AIMS Microbiol. 2018. V. 4. № 4. P. 685. https://doi.org/10.3934/microbiol.2018.4.685
Belov A.A., Cheptsov V.S., Vorobyova E.A., Manucharova N.A., Ezhelev Z.S. Stress-tolerance and taxonomy of culturable bacterial communities isolated from a central Mojave Desert soil sample // Geosciences. 2019. V. 9 № 4. P. 166. https://doi.org/10.3390/geosciences9040166
Belov A.A., Cheptsov V.S., Manucharova N.A., Ezhelev Z.S. Bacterial communities of Novaya Zemlya archipelago ice and permafrost // Geosciences. 2020. V. 10. № 2. P. 67. https://doi.org/10.3390/geosciences10020067
Bianchi M.A., Bianchi A.J. Statistical sampling of bacterial strains and its use in bacterial diversity measurement // Microb. Ecol. 1982. V. 8. № 1. P. 61–69. https://doi.org/10.1007/BF02011462
Bose H., Satyanarayana T. Microbial carbonic anhydrases in biomimetic carbon sequestration for mitigating global warming: prospects and perspectives // Front. Microbiol. 2017. V. 8. P. 1615. https://doi.org/10.3389/fmicb.2017.01615
Brown A. Microbial water stress // Bacteriol. Rev. 1976. V. 40. № 4. P. 803–846. https://doi.org/10.1128/br.40.4.803-846.1976
Bull A.T. Actinobacteria of the extremobiosphere // Extremophiles Handbook / Ed. K. Horikoshi Springer, 2011. P. 1203–1240. https://doi.org/10.1007/978-4-431-53898-1
Cervenka L., Vytrasova M., Jelinek D., Brezina P. Determination of minimum water activity values for the survival of bacteria in a culture medium // Bull. Food Res. 2002. V. 41. № 1. P. 59–68. https://agris.fao.org/agris-search/ search.do?recordID=SK2002000296
Chanal A., Chapon V., Benzerara K., Barakat M., Christen R., Achouak W., Heulin T. The desert of Tataouine: an extreme environment that hosts a wide diversity of microorganisms and radiotolerant bacteria // Environ. Microbiol. 2006. V. 8. № 3. P. 514–525. https://doi.org/10.1111/j.1462-2920.2005.00921.x
Chen M.S., Li F.N., Chen X.H., Yan X.R., Tuo L. Brachybacterium halotolerans sp. nov., a halotolerant, endophytic actinomycete isolated from branch of Bruguiera gymnoirhiza // Antonie van Leeuwenhoek. 2021. V. 114. № 6. P. 875–884. https://doi.org/10.1007/s10482-021-01565-z
Cheptsov V.S., Vorobyova E.A., Manucharova N.A., Gorlenko M.V., Pavlov A.K., Vdovina M.A., Bulat S.A. 100 kGy gamma-affected microbial communities within the ancient Arctic permafrost under simulated Martian conditions // Extremophiles. 2017. V. 21. № 6. P. 1057–1067. https://doi.org/10.1007/s00792-017-0966-7
Cheptsov V., Vorobyova E., Belov A., Pavlov A., Tsurkov D., Lomasov V., Bulat S. Survivability of soil and permafrost microbial communities after irradiation with accelerated electrons under simulated Martian and open space conditions // Geosciences. 2018. V. 8. № 8. P. 298. https://doi.org/10.3390/geosciences8080298
Chun J., Oren A., Ventosa A., Christensen H., Arahal D.R., da Costa M.S., Trujillo M.E. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes // Int. J. Syst. Evol. Microbiol. 2018. V. 68. № 1. P. 461–466. https://doi.org/10.1099/ijsem.0.002516
Cox M.M., Battista J.R. Deinococcus radiodurans – the consummate survivor // Nat. Rev. Microbiol. 2005. V. 3. № 11. P. 882–892. https://doi.org/10.1038/nrmicro1264
Degré A., van der Ploeg M.J., Caldwell T., Gooren H.P. Comparison of soil water potential sensors: a drying experiment // Vadose Zone J. 2017. V. 16. № 4. P. 1–8. https://doi.org/10.2136/vzj2016.08.0067
Dieser M., Greenwood M., Foreman C.M. Carotenoid pigmentation in Antarctic heterotrophic bacteria as a strategy to withstand environmental stresses // Arct. Antarct. Alp. Res. 2010. V. 42. № 4. P. 396–405. https://doi.org/10.1657/1938-4246-42.4.396
Drees K.P., Neilson J.W., Betancourt J.L., Quade J., Henderson D.A., Pryor B.M., Maier R.M. Bacterial community structure in the hyperarid core of the Atacama Desert, Chile // Appl. Environ. Microbiol. 2006. V. 72. № 12. P. 7902–7908. https://doi.org/10.1128/AEM.01305-06
El-Registan G.I., Mulyukin A.L., Nikolaev Y.A., Suzina N.E., Gal’chenko V.F., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology. 2006. V. 75. № 4. P. 380–389. https://doi.org/10.1134/S0026261706040035
Fontana Jr A.J. D Minimum Water Activity Limits for Growth of Microorganisms. // Water Activity in Foods. 2020. V. 406. P. 571–572. https://doi.org/10.1002/9781118765982
Goodfellow M., Nouioui I., Sanderson R., Xie F., Bull A.T. Rare taxa and dark microbial matter: novel bioactive actinobacteria abound in Atacama Desert soils // Antonie van Leeuwenhoek. 2018. V. 111. № 8. P. 1315–1332. https://doi.org/10.1007/s10482-018-1088-7
Grant W.D. Life at low water activity // Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 2004. V. 359. № 1448. P. 1249–1267. https://doi.org/10.1098/rstb.2004.1502
Gunde-Cimerman N., Plemenitaš A., Oren A. Strategies of adaptation of microorganisms of the three domains of life to high salt concentrations // FEMS Microbiol. Rev. 2018. V. 42. № 3. P. 353–375. https://doi.org/10.1093/femsre/fuy009
Huang W., Ertekin E., Wang T., Cruz L., Dailey M., DiRuggiero J., Kisailus D. Mechanism of water extraction from gypsum rock by desert colonizing microorganisms // Proc. Natl. Acad. Sci. U.S.A. 2020. V. 117. № 20. P. 10681–10687. https://doi.org/10.1073/pnas.2001613117
Ishii N., Fuma S., Tagami K., Honma–Takeda S., Shikano S. Responses of the bacterial community to chronic gamma radiation in a rice paddy ecosystem // Int. J. Radiat. Biol. 2011. V. 87. № 7. P. 663–672. https://doi.org/10.3109/09553002.2010.549534
Karan R., Capes M.D., DasSarma S. Function and biotechnology of extremophilic enzymes in low water activity // Aquat. Biosyst. 2012. V. 8. № 1. P. 1–15. https://doi.org/10.1186/2046-9063-8-4
Köberl M., Müller H., Ramadan E.M., Berg G. Desert farming benefits from microbial potential in arid soils and promotes diversity and plant health // PLoS One. 2011. V. 6. № 9. P. e24452. https://doi.org/10.1371/journal.pone.0024452
Lester E.D., Satomi M., Ponce A. Microflora of extreme arid Atacama Desert soils // Soil Biol. Biochem. 2007. V. 39. № 2. P. 704–708. https://doi.org/10.1016/j.soilbio.2006.09.020
Margesin R., Collins T. Microbial ecology of the cryosphere (glacial and permafrost habitats): current knowledge // Appl. Microbiol. Biotechnol. 2019. V. 103. № 6. P. 2537–2549. https://doi.org/10.1007/s00253-019-09631-3
McKnight D.T., Huerlimann R., Bower D.S., Schwarzkopf L., Alford R.A., Zenger K.R. Methods for normalizing microbiome data: an ecological perspective // Methods Ecol. Evol. 2019. V. 10. № 3. P. 389–400. https://doi.org/10.1111/2041-210X.13115
Mohammadipanah F., Wink J. Actinobacteria from arid and desert habitats: diversity and biological activity // Front. Microbiol. 2016. V. 6. P. 1541. https://doi.org/10.3389/fmicb.2015.01541
Molina-Menor E., Gimeno-Valero H., Pascual J., Peretó J., Porcar M. High culturable bacterial diversity from a European desert: The Tabernas desert // Front. Microbiol. 2021. V. 11. P. 583120. https://doi.org/10.3389/fmicb.2020.583120
Moyano F.E., Manzoni S., Chenu C. Responses of soil heterotrophic respiration to moisture availability: An exploration of processes and models // Soil Biol. Biochem. 2013. V. 59. 72–85. https://doi.org/10.1016/j.soilbio.2013.01.002
Musilova M., Wright G., Ward J.M., Dartnell L.R. Isolation of radiation-resistant bacteria from Mars analog Antarctic Dry Valleys by preselection, and the correlation between radiation and desiccation resistance // Astrobiology. 2015. V. 15. № 12. P. 1076–1090. https://doi.org/10.1089/ast.2014.1278
Nafis A., Raklami A., Bechtaoui N., El Khalloufi F., El Alaoui A., Glick B.R., Hassani L. Actinobacteria from extreme niches in morocco and their plant growth-promoting potentials // Diversity. 2019. V. 11. № 8. P. 139. https://doi.org/10.3390/d11080139
Narváez–Reinaldo J.J., Barba I., González–López J., Tunnacliffe A., Manzanera M. Rapid method for isolation of desiccation-tolerant strains and xeroprotectants // Appl. Environ. Microbiol. 2010. V. 76. № 15. P. 5254–5262. https://doi.org/10.1128/AEM.00855-10
Nithya K., Muthukumar C., Biswas B., Alharbi N.S., Kadaikunnan S., Khaled J.M., Dhanasekaran D. Desert actinobacteria as a source of bioactive compounds production with a special emphases on Pyridine-2, 5-diacetamide a new pyridine alkaloid produced by Streptomyces sp. DA3-7 // Microbiol. Res. 2018. V. 207. P. 116–133. https://doi.org/10.1016/j.micres.2017.11.012
Okoro C.K., Brown R., Jones A.L., Andrews B.A., Asenjo J.A., Goodfellow M., Bull A.T. Diversity of culturable actinomycetes in hyper-arid soils of the Atacama Desert, Chile // Antonie Van Leeuwenhoek. 2009. V. 95. № 2. P. 121–133. https://doi.org/10.1007/s10482-008-9295-2
Oren A., Garrity G.M. Notification that new names of prokaryotes, new combinations, and new taxonomic opinions have appeared in volume 71, part 10 of the IJSEM // Int. J. Syst. Evol. Microbiol. 2022. V. 72. № 1. P. 005165. https://doi.org/10.1099/ijsem.0.001620
Osman S., Peeters Z., La Duc M.T., Mancinelli R., Ehrenfreund P., Venkateswaran K. Effect of shadowing on survival of bacteria under conditions simulating the Martian atmosphere and UV radiation // Appl. Environ. Microbiol. 2008. V. 74. № 4. P. 959–970. https://doi.org/10.1128/AEM.01973-07
Pascual I., Antolín M.C., García C., Polo A., Sánchez–Díaz M. Effect of water deficit on microbial characteristics in soil amended with sewage sludge or inorganic fertilizer under laboratory conditions // Bioresour. Technol. 2007. V. 98. № 1. P. 29–37. https://doi.org/10.1016/j.biortech.2005.11.026
Patel S., Jinal H.N., Amaresan N. Isolation and characterization of drought resistance bacteria for plant growth promoting properties and their effect on chilli (Capsicum annuum) seedling under salt stress // Biocatal. Agric. Biotechnol. 2017. V. 12. P. 85–89. https://doi.org/10.1016/j.bcab.2017.09.002
Ramakrishna W., Rathore P., Kumari R., Yadav R. Brown gold of marginal soil: Plant growth promoting bacteria to overcome plant abiotic stress for agriculture, biofuels and carbon sequestration // Sci. Total Environ. 2020. V. 711. P. 135062. https://doi.org/10.1016/j.scitotenv.2019.135062
Reasoner D.J., Geldreich E.E. A new medium for the enumeration and subculture of bacteria from potable water // Appl. Environ. Microbiol. 1985. V. 49. № 1. P. 1–7. https://doi.org/10.1128/aem.49.1.1-7.1985
Rebelo Romão I., Rodrigues dos Santos A.S., Velasco L., Martínez–Ferri E., Vilchez J.I., Manzanera M. Seed-Encapsulation of Desiccation-Tolerant Microorganisms for the Protection of Maize from Drought: Phenotyping Effects of a New Dry Bioformulation // Plants. 2022. V. 11. № 8. P. 1024. https://doi.org/10.3390/plants11081024
Rietz D.N., Haynes R.J. Effects of irrigation-induced salinity and sodicity on soil microbial activity // Soil Biol. Biochem. 2003. V. 35. № 6. P. 845–854. https://doi.org/10.1016/S0038-0717(03)00125-1
Siebielec S., Siebielec G., Klimkowicz–Pawlas A., Gałązka A., Grządziel J., Stuczyński T. Impact of water stress on microbial community and activity in sandy and loamy soils // Agronomy. 2020. V. 10. № 9. P. 1429. https://doi.org/10.3390/agronomy10091429
Stanaszek–Tomal E. Environmental factors causing the development of microorganisms on the surfaces of national cultural monuments made of mineral building materials // Coatings. 2020. V. 10. № 12. P. 1203. https://doi.org/10.3390/coatings10121203
Stevenson A., Burkhardt J., Cockell C.S., Cray J.A., Dijksterhuis J., Fox-Powell M., Hallsworth J.E. Multiplication of microbes below 0.690 water activity: implications for terrestrial and extraterrestrial life // Environ. Microbiol. 2015. V. 17. № 2. P. 257–277. https://doi.org/10.1111/1462-2920.12598
Stevenson A., Hallsworth J.E. Water and temperature relations of soil Actinobacteria // Environ. Microbiol. Rep. 2014. V. 6. № 6. P. 744–755. https://doi.org/10.1111/1758-2229.12199
Stevenson A., Hamill P.G., O’Kane C.J., Kminek G., Rummel J.D., Voytek M.A., Hallsworth J.E. Aspergillus penicillioides differentiation and cell division at 0.585 water activity // Environ. Microbiol. 2017. V. 19. № 2. P. 687–697. https://doi.org/10.1111/1462-2920.13597
Sun Y., Shi Y.L., Wang H., Zhang T., Yu L.Y., Sun H., Zhang Y.Q. Diversity of bacteria and the characteristics of actinobacteria community structure in Badain Jaran Desert and Tengger Desert of China // Front. Microbiol. 2018. V. 9. P. 1068. https://doi.org/10.3389/fmicb.2018.01068
Warren–Rhodes K.A., Lee K.C., Archer S.D., Cabrol N., Ng-Boyle L., Wettergreen D., Pointing S.B. Subsurface microbial habitats in an extreme desert Mars-analog environment // Front. Microbiol. 2019. V. 69. P. 1–11. https://doi.org/10.3389/fmicb.2019.00069
Wassmann M., Moeller R., Reitz G., Rettberg P. Adaptation of Bacillus subtilis cells to Archean-like UV climate: relevant hints of microbial evolution to remarkably increased radiation resistance // Astrobiology. 2010. V. 10. № 6. P. 605–615. https://doi.org/10.1089/ast.2009.0455
Williams J.P., Hallsworth J.E. Limits of life in hostile environments: no barriers to biosphere function? // Environ. Microbiol. 2009. V. 11. № 12. P. 3292–3308. https://doi.org/10.1111/j.1462-2920.2009.02079.x
Winston P.W., Bates D.H. Saturated solutions for the control of humidity in biological research // Ecology. 1960. V. 41. № 1. P. 232–237. https://doi.org/10.2307/1931961
Wright P.C., Tanaka T. Physiological modelling of the response of Kocuria rosea exposed to changing water activity // Biotechnol. Lett. 2002. V. 24. № 8. P. 603–609.
Zenova G.M., Manucharova N.A., Zvyagintsev D.G. Extremophilic and extremotolerant actinomycetes in different soil types // Eurasian Soil Sci. 2011. V. 44. № 4. P. 417–436. https://doi.org/10.1134/S1064229311040132
Zvyagintsev D.G., Zenova G.M., Sudnitsyn I.I., Gracheva T.A., Lapygina E.V., Napol’skaya K.R., Sydnitsyna A.E. Development of actinomycetes in brown semidesert soil under low water pressure // Eurasian Soil Sci. 2012. V. 45. № 7. P. 717–723. https://doi.org/10.1134/S1064229312030155
Zvyagintsev D.G., Zenova G.M., Sudnitsyn I.I., Gracheva T.A., Napol’skaya K.R., Belousova M.A. Dynamics of spore germination and mycelial growth of streptomycetes under low humidity conditions // Microbiology. 2009. V. 78. № 4. P. 440–444. https://doi.org/10.1134/S0026261709040079
Дополнительные материалы отсутствуют.
Инструменты
Почвоведение


