Почвоведение, 2023, № 5, стр. 567-578
Лабораторное исследование влияния солей аммония и лантана на окисление метана и состав микробных сообществ в дерново-подзолистой почве
И. К. Кравченко a, *, Л. Р. Сизов b, Л. В. Лысак c
a Институт микробиологии им. С.Н. Виноградского, ФИЦ биотехнологии РАН
119991 Москва, Ленинский пр-т, 33, стр. 2, Россия
b Федеральный исследовательский центр проблем химической физики и медицинской химии РАН
142432 Московская обл., Черноголовка, пр-т акад. Семенова, 1, Россия
c МГУ им. М.В. Ломоносова, факультет почвоведения
119991 Москва, Ленинские горы, 1, Россия
* E-mail: irinakravchenko@inbox.ru
Поступила в редакцию 21.10.2022
После доработки 29.12.2022
Принята к публикации 30.12.2022
- EDN: IFOLQM
- DOI: 10.31857/S0032180X22601384
Аннотация
Одним из перспективных подходов в решении вопросов устойчивости экосистем к стрессовым воздействиям является оценка реакции микробных сообществ почв, осуществляющих важные эколого-биосферные функции, на природные или антропогенные воздействия. В модельном эксперименте с дерново-подзолистой почвой (Eutric Albic Retisol (Abruptic, Loamic)) установлено ингибирующее действие аммония и стимулирующее действие лантана на окисление метана микроорганизмами почвы. Внесение аммония и лантана снижало таксономическое разнообразие бактериального сообщества почвы и изменяло его структуру: уменьшалось относительное содержание грамположительных бактерий филумов Actinobacteriota и Bacillota, тогда как доля грамотрицательных бактерий филума Pseudomonadota возрастала. Внесение лантана на несколько порядков увеличивает относительное содержание в сообществе метанотрофов рода Methylobacter и облигатных метилотрофов рода Methylotenera. Результаты работы могут быть использованы для разработки подходов регуляции активности почвенного метанового фильтра и сопутствующей микробиоты.
ВВЕДЕНИЕ
Метан является важнейшим парниковым газом, хотя его содержание в атмосфере составляет <0.02 об. %, вклад в современное глобальное потепление оценивается в 15% [30]. Единственным известным биологическим механизмом регуляции его содержания в атмосфере Земли является окисление микробными сообществами аэробных почв. Согласно современным расчетам, оно составляет 22.4 Тг/год, из которых половина приходится на лесные почвы умеренной зоны [18]. Поэтому любые изменения интенсивности поглощения атмосферного метана лесными почвами в результате поступления азотных соединений, внесения минеральных удобрений, перевода в сельскохозяйственное использование имеют глобальные последствия. Более 20 лет проводится активное изучение различных аспектов биологического поглощения метана в почвах, результаты этих работ обобщены в ряде обзоров [14, 15, 31]. Однако ни в одной из этих публикаций не приводятся данные о вкладе почв России в этот важнейший процесс глобального метанового цикла. Регулярные исследования поглощения атмосферного метана почвами России обобщены в работе [25].
Агроэкологические системы, ставшие неотъемлемой составной частью современной биотехносферы, испытывают постоянные техногенные воздействия, подвергаются влиянию различных загрязнений локального, регионального и глобального характера. Почвы и их микробные сообщества находятся под постоянным воздействием глобальных изменений климата, одним из последствий которого является увеличение продолжительности и интенсивности процессов иссушения значительных площадей [19]. Кроме того, они подвергаются влиянию возрастающего загрязнения азотными соединениями, поступающими с атмосферными осадками, удобрениями, из выбросов предприятий и автотранспорта, а также таких стрессовых факторов, как повышение температуры, засоление, уплотнение почвы [27]. Микробные сообщества почв отвечают за осуществление важнейших экосистемных процессов, поэтому наблюдается постоянно растущий интерес к изучению их устойчивости и восстановления состава и метаболической активности после стрессового воздействия [19].
Несмотря на интенсивные исследования, до сих пор нет ясности в вопросах: какие микроорганизмы отвечают за окисление метана атмосферы, как изменяется их активность и разнообразие при антропогенном воздействии, являются эти изменения обратимыми и существуют способы регуляции микробных процессов цикла метана. До недавнего времени считалось, что окислять метан в аэробных условиях могут только представители двух хорошо филогенетически очерченных групп протеобактерий, относящихся к семействам Methylocystaceae и Methylococcaceae. В последнее десятилетие произошли значительные изменения в представлениях о таксономическом разнообразии аэробных метанотрофов. Согласно современным представлениям, аэробные метанотрофы относятся к филумам Gammaproteobacteria (Type I), Alphaproteobacteria (Type II) и Verrucomicrobia [24]. Список метанотрофных протеобактерий пополнился представителями Beijerinckiaceae [17, 35]. Установлена способность к метаноокислению у нитчатых Gammaproteobacteria Crenothrix polyspora [33] и Clonothrix fusca [34].
Важнейшим и до конца не ясным остается вопрос о механизмах и факторах, которые определяют направленность и величину потоков метана между почвой и атмосферой. Поток метана является результирующей процессов метаногенеза и метанотрофии, причем в аэробных почвах доминирует последний процесс [13]. В проведенных ранее исследованиях, выполненных на объектах серой лесной почвы, установлена тесная коррелятивная связь величины потока метана с такими физико-химическими факторами, как температура и влажность почвы, содержание минеральных соединений азота и легкогидролизуемых фракций почвенного органического вещества, величины порового пространства и среднего размера пор [4]. В настоящее время существует большое количество публикаций, демонстрирующих снижение метаноокисляющей активности различных почв естественных экосистем после их перевода в сельскохозяйственное использование [23, 29]. Таким образом, активность и разнообразие почвенных метанотрофных бактерий могут быть использованы как индикаторные показатели влияния антропогенных воздействий на экосистему.
Влияние соединений азота на окисление метана почвенными микроорганизмами широко обсуждается, однако причины этого явления до конца не ясны. Внесение азотных соединений может ингибировать, стимулировать или не оказывать влияния на процесс окисления метана [11]. Внесение небольших количеств аммонийного азота, как правило, стимулирует окисление метана, в то время как высокие дозы аммонийного азота ингибируют [28].
Влияние на окисление метана иных, чем азот минеральных элементов, изучено очень слабо. В последнее десятилетие большое внимание уделяется лантаноидам в связи с их стимулирующим воздействием на рост растений [3] и участием в метаболизме метилотрофов [32]. В процессе почвообразования и разрушения литогенных минералов, а также при применении фосфоритной муки в качестве удобрения, лантаноиды поступают в почву, но находятся в недоступной форме в составе минеральной фазы и комплексов с гумусовыми кислотами, в то время как подвижные формы лантаноидов вымываются из почвы [3]. Для увеличения урожайности и качества сельскохозяйственной продукции в Китае применяют микроудобрения, содержащие соли лантаноидов, что приводит к изменениям содержания микробной биомассы и ферментативной активности почвы [21]. В России исследования в этом направлении проводятся в Бурятии, показано, что внесение солей лантана в почву стимулирует микробные процессы цикла азота [8].
Цель работы – изучить влияние солей аммония и лантана на активность окисления метана и состав микробных сообществ дерново-подзолистой почвы в модельных условиях лабораторного инкубационного эксперимента.
ОБЪЕКТЫ И МЕТОДЫ
Характеристика почвы и условия проведения лабораторного эксперимента. Для модельных опытов с микрокосмами использовали постагрогенную почву залежного разнотравно-злакового луга вблизи Пошехонской птицефабрики, Ярославская область (58°5099′ N, 39°1423′ E). Почва характеризовалась как дерново-подзолистая на моренных отложениях согласно классификации почв России [2] или Eutric Albic Retisols (Abruptic, Loamic) по международной реферативной базе почвенных ресурсов (WRB [22]). Почву более 15 лет использовали для выращивания кормовой вико-овсяной смеси с применением высоких доз куриного помета и суперфосфата, последние 6 лет – залежь.
Образцы почвы отбирали 02 июня 2020 г. в пяти точках из верхнего 0–20 см слоя. Смешанный почвенный образец просеивали через сито 2 мм, удаляя фрагменты растительных остатков и камней, и использовали для закладки лабораторного эксперимента и оценки базовых микробиологических параметров почвы. Оценку базального и субстрат индуцированного дыхания почвы, а также количества почвенных микроорганизмов проводили, как описано ранее [1]. Часть почвы высушивали на воздухе и использовали для определения физико-химических характеристик почвы в Центре коллективного пользования “Физико-химические методы исследования почв и экосистем” ИФХиБПП РАН. Полученные результаты приведены в табл. 1.
Таблица 1.
Характеристика дерново-подзолистой почвы, использованной для проведения инкубационных экспериментов. Приведены средние значения ± стандартное отклонение (n = 5)
| Параметр | Значение |
|---|---|
| Гранулометрический состав, содержание фракции, % | |
| 0.5–0.25 мм | 5.75 |
| 0.25–0.05 мм | 24.30 |
| 0.05–0.01 мм | 27.11 |
| <0.01 мм | 42.84 |
| ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | 5.4 ± 0.1 |
| Азот общий, % | 0.27 ± 0.02 |
| Углерод общий, % | 6.17 ± 0.58 |
| С : N | 22.9 |
| Cорг, % | 4.87 ± 0.7 |
| N–${\text{NH}}_{4}^{ + }$, мг/100г | 0.64 ± 0.01 |
| N–${\text{NO}}_{3}^{ - }$, мг/100г | 26.1 ± 0.3 |
| P2O5, мг/100г | 5.63 ± 0.09 |
| K2O, мг/100г | 10.10 ± 0.01 |
| Ca2+, ммоль/100 г | 22.4 ± 0.141 |
| Mg2+, ммоль/100 г | 4.601 ± 0.014 |
| Базальное дыхание, мкг С–СО2/(г ч) | 0.56 ± 0.07 |
| Микробная биомасса, мкг С/г | 1352 ± 65 |
| Метаболический коэффициент (qCO2) | 1.59 ± 0.31 |
| Количество бактерий (микроскопия), кл./г | 12.8 ± 1.3 × 1010 |
| Численность бактерий сапротрофного блока, КОЕ/г | 5.5 ± 0.9 × 107 |
Модельные опыты с почвенными микрокосмами. Исходную почву (вариант К) использовали для создания микрокосмов, каждый из которых представлял собой 10 г почвы естественной влажности, помещенной в стеклянный флакон объемом 100 мл. Изучили следующие варианты эксперимента: М ‒ почва без добавок; ML1 – внесение водного раствора хлорида лантана (5 мкг La3+/г); MN – внесение водного раствора хлорида аммония (100 мкг ${\text{NH}}_{4}^{ + }$–N/г); MNL1 – внесение водного раствора хлорида аммония (100 мкг ${\text{NH}}_{4}^{ + }$–N/г) и водного раствора хлорида лантана (5 мкг La3+/г). Вариант ML2 – это 5 флаконов для газовых анализов варианта ML1, которые дополнительно инкубировали в течение 1 мес.
Для каждого варианта закладывали по 35 флаконов. Пять из них извлекали из эксикаторов, принудительно проветривали, измеряли потенциальное окисление метана и после измерений возвращали в эксикатор. В течение 1 мес. анализировали 12 точек: 0, 1, 2, 3, 6, 7, 9, 10, 15, 20, 25 и 30 сут после начала эксперимента. В те же дни (0–15, 30 сут) 3 флакона изымали деструктивно для анализа рН и азотных соединений. Экстракцию тотальной ДНК проводили в начале эксперимента (К), через 1 мес. инкубации (варианты М, ML1, MN, MNL1) и через 2 мес. (ML2).
Влажность почвы К при закладке эксперимента составляла 23 мас. %. Растворы солей вносили в начале эксперимента в объеме 0.5 мл/10 г почвы, в вариант М добавляли дистиллированную воду. Флаконы инкубировали в эксикаторах с метано-воздушной смесью 10 : 90 по объему при 25°С. Газовую смесь заменяли раз в неделю, одновременно контролируя влажность почвы весовым методом, при необходимости компенсируя потери добавлением дистиллированной воды.
Измерение скорости окисления метана и дыхательной активности почвы. Флаконы с почвой герметично закрывали резиновыми пробками и добавляли в газовую фазу метан до концентрации около 200 ppm. Реальную величину концентрации определяли на газовом хроматографе (значение С0). Флаконы инкубировали при 25°С в течение 24 ч, после чего повторно определяли концентрацию метана (значение С1) и определяли разницу в содержании метана (ppm), исходя из которой считали количество окисленного метана А (мг СН4) по формуле:
Скорость окисления метана v (мкг СН4/(г почвы ч)) рассчитывали по формуле :
где А – количество окисленного метана, мг СН4; mн – масса воздушно-сухой навески почвы в флаконе; t – время экспозиции, ч.Измерение концентрации СН4 и СО2 в газовой фазе микрокосмов проводили на газовом хроматографе Кристалл 5000.1 (Хроматэк, Россия), снабженном пламенно-ионизационным детектором на колонке размером 3.0 м × 0.2 см, заполненной HayeSep N. Температура колонки составляла 40°С, детектора 200°С. Аргон, служивший в качестве газа-носителя, подавали со скоростью 25 мл/мин.
Определение концентрации ионов водорода и нитрат-ионов. Концентрацию ионов водорода в почвенной суспензии (почва : вода 1 : 2.5) измеряли методом прямой потенциометрии на приборе pH-Meter-pH410 компании “Аквилон” с комбинированным pH-электродом ЭСК-10601/7. Измерение активности нитрат-иона проводили в той же суспензии на иономере pX-150.1MИ с помощью ионоселективного нитратного электрода ЭЛИС-121NO3 и хлорсеребряного электрода сравнения ЭСР-10101, насыщенного раствором KCl. Значение показателя активности нитрат-ионов $\left( {p{\text{NO}}_{3}^{ - }} \right)$ пересчитывали в массовую долю азота нитратов в почве (Х, мг/кг) по формуле:
Выделение ДНК. Секвенирование и обработка данных. ДНК выделяли из образцов почвы массой 0.25 г с помощью коммерческого набора реактивов MO BIO Power Soil DNA Isolation Kit (QIAGEN) согласно протоколу производителя.
Высопроизводительное секвенирование 16S рРНК проводили при помощи системы Illumina MiSeq в ООО Биоспарк, Троицк. Подготовку и секвенирование ДНК-библиотек для гипервариабельного V3–V4 участка гена 16S рРНК и обработку данных проводили как было описано нами ранее [5].
С помощью программных пакетов QIIME 2 определяли индексы разнообразия [12], рассчитанные при объединении нуклеотидных последовательностей в операционные таксономические единицы (ОТЕ) с уровнем сходства в 97%. Альфа-разнообразие оценивали по индексу Шеннона, выровненность ОТЕ в сообществе по индексу Пиелу. В качестве показателя филогенетического разнообразия использовали индекс Фейта PD [6].
Статистическая обработка данных. Все измерения выполняли не менее чем в трех повторностях. Для каждой выборки считали среднее и стандартное отклонение в программном продукте Excel 2013 (Microsoft Corp.). Статистическую обработку проводили с использованием программы Statistica 8.0 (StatSoft Inc., США). Для парных сравнений использовали критерий Стьюдента (t-test), статистически значимыми считали критерии при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние солей аммония и лантана на скорость окисления метана. Изменение скорости окисления метана в почве за время инкубации представлено на рис. 1. В первые 3 сут в вариантах с внесением соли аммония (MN) скорость метаноокисления снижалась с 0.024 до 0.006 мкг СН4 /(г ч), в то время как в почве без внесения аммония (M) – до 0.015 мкг СН4/(г ч) (t-test, p = 0.01). Уменьшение метанотрофной активности в почве при внесении солей аммония было отмечено в ряде исследований [4, 28]. Данный эффект можно объяснить конкурентным механизмом ингибирования, при котором метанмонооксигеназа окисляет аммоний вместо метана, и накоплением токсичных продуктов окисления аммония. Через 10 сут в обоих вариантах скорость метаноокисления составляла 0.008 мкг СН4/(г ч). К концу периода инкубации (30 сут) величина метаноокисляющей активности варианта MN составляла 0.01 мкг СН4/(г ч). Эти различия были небольшими в абсолютном выражении, но значимыми (t-test, p = 0.03).
Рис. 1.
Скорость окисления метана в дерново-подзолистой почве без внесения солей, M (1); c внесением сульфата аммония, MN (2); c внесением хлорида лантана, ML1 (3). Представлены средние значения величин и стандартные отклонения.
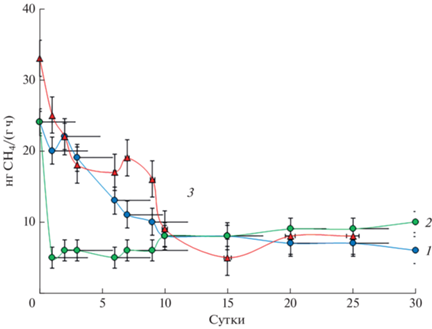
Внесение хлорида лантана (ML1) положительно повлияло на потребление метана. Уже через сутки скорость окисления метана в почве стала выше, чем в контроле, и составила 0.033 СН4/(г ч) (t-test, p = 0.01). Эта тенденция сохранялась в течение 20 сут, и максимальный эффект, двухкратное превышение, был отмечен на 10 сут. Через 25 сут достоверных отличий от контроля не зафиксировано.
Влияние солей лантана и аммония на накопление нитратов и кислотность почвы. Результаты изменения содержания нитрат-ионов в почвенном растворе и актуальной почвенной кислотности представлены на рис. 2. В вариантах эксперимента с внесением соли аммония (MN и MNL1) наблюдается снижение его содержания и увеличение содержания нитрата. Добавление соли лантана (MNL1) положительно повлияло на процесс потенциальной нитрификации, к концу инкубации содержание нитрат-ионов было на 24% больше, чем в варианте без лантана MN, и составило 155 и 125 мкг N–${\text{NO}}_{3}^{ - }$/г соответственно. Интересно отметить, что в некоторых образцах количество нитратного азота превысило внесенный аммонийный азот. Возможно, это проявление затравочного эффекта, при котором наличие легкодоступного для окисления аммония позволило микроорганизмам использовать азот органического вещества почвы.
Рис. 2.
Окисление аммония (a), накопление нитрата (b) и изменение рН (с) в дерново-подзолистой почве с внесением сульфата аммония, MN (1); с внесением сульфата аммония и хлорида лантана, MNL1 (2). Представлены средние значения величин и стандартные отклонения.
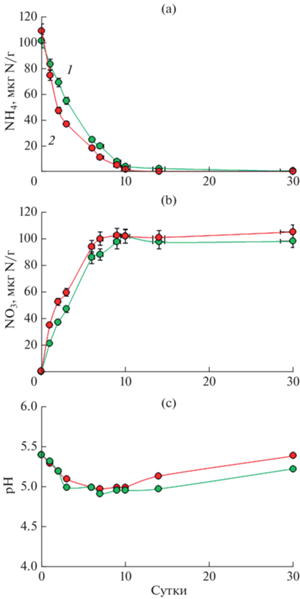
Изучаемая дерново-подзолистая почва (К) имела умеренно кислую реакцию среды рН 5.4 и высокое содержание нитратов. После недели инкубации наблюдали значимое (p = 0.01), но в абсолютных выражениях небольшое повышение кислотности почвы в образцах MN и MNL1 с внесением аммония (рис. 2b) до рН 4.8–4.9, так как сульфат аммония и хлорид лантана – это физиологически кислые соли. Благодаря буферным свойствам почвы уже через 20 сут уровень кислотности практически вернулся к исходному значению.
Таким образом, хлорид лантана стимулирует процессы окисления аммония и накопления нитратов, что положительно влияет на окисление метана. Однако нужно учитывать, что при внесении хлорида лантана возможно подкисление почвы, которое будет снижать интенсивность процессов нитрификации на срок, зависящий от буферных свойств почвы.
Влияние солей аммония и лантана на таксономическую структуру и разнообразие бактериального сообщества. В исходной почве (К) было обнаружено два доминантных филума: Pseudomonadota (35% от числа всех последовательностей) и Acidobacterota (28%), а также значительное содержание Bacteroidota (18%) (рис. 3). Значительную часть составляли представители филума Verrucomicrobiota (7%), а также филумов Actinomycetota, Chloroflexota, Gemmatimonadota и Nitrospirota (по 2% каждый). В минорном компоненте с относительным содержанием <1% обнаружены Armatimonadota, Chlorobiota, Cyanobacteria, Elusimicrobiota, Fibrobacterota, Bacillota, Ignavibacteriota, Latescibacteria, Parcubacteria, Planctomycetota, Saccharibacteria, Spirochaetota и Berkelbacteria.
Рис. 3.
Таксономическая структура бактериального сообщества дерново-подзолистой почвы на уровне филумов (% от общего числа последовательностей в образце). Условные обозначения здесь и далее: K – исходная почва; M – инкубация с метаном, 1 мес.; ML1 – инкубация с метаном и лантаном 1 мес.; ML2 – инкубация с метаном и лантаном 2 мес.; MN – инкубация с аммонием, 1 мес.
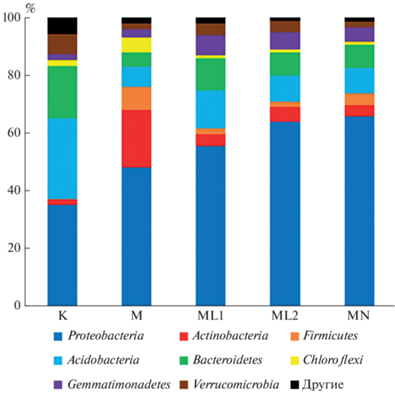
Таксономическая структура сообщества значительно изменилась при инкубировании образцов в воздушно-метановой атмосфере. Как тенденция отмечено увеличение доли филума Pseudomonadota особенно в вариантах с внесением солей. Так, в варианте М после 1 мес. инкубации доля Pseudomonadota возросла до 48%, и значительно увеличилась представленность филумов грамположительных бактерий Actinomycetota (20%) и Bacillota (8%). Кроме того, по сравнению с исходной почвой выросло относительное содержание филумов Chloroflexota (5%) и Gemmatimonadota (3%), а филумов Acidobacterota (7%), Bacteroidota (5%) и Verrucomicrobiota (2%) значительно уменьшилась.
В вариантах с внесением солей наблюдали дальнейшее увеличение доли Pseudomonadota в сообществе: 55% в варианте ML1, 64% – ML2 и 66% – MN. Сохранялась высокая представленность филумов Acidobacterota (9–13%) и Bacteroidota (8–11%) соответственно. По сравнению с почвой М значительно уменьшился вклад в сообщество, вносимый бактериями филумов Actinomycetota (4–5%) и Bacillota (2–4%), а также Chloroflexota (1%). В то же время выросла доля представителей филумов Gemmatimonadota (5–7%).
Для определения влияния солей аммония и лантана на альфа-разнообразие бактериального сообщества дерново-подзолистой почвы сравнили сообщества по количеству филумов и ОТЕ, определенных до рода.
В сообществе почвы М после месяца инкубации было определено 290 родов из 16 филумов, что значительно меньше, чем было в исходной почве К (421 род из 21 филума). Внесение хлорида лантана еще больше сократило разнообразие: через 1 мес. после внесения было определено только 203 рода из 16 филумов, а через 2 мес. – 218 родов из 17 филумов. Негативное воздействие соли лантана на разнообразие подтверждается значениями индексов разнообразия Шеннона (4.0–4.2) и PD (3.4–3.8), которые были значительно меньше таковых в контрольной почве (индекс Шеннона 4.9, PD 5.6). Кроме того, снизилось значение выровненности таксонов в сообществе с 0.89 до 0.86 (табл. 2).
Таблица 2.
Альфа-разнообразие бактериального сообщества дерново-подзолистой почвы
| Параметр | Вариант инкубационного эксперимента бактерии | |||
|---|---|---|---|---|
| M | ML1 | ML2 | MN | |
| Количество определенных родов (филумов) | 290 (16) | 203 (16) | 218 (17) | 228 (17) |
| Индекс Пиелу | 0.89 | 0.86 | 0.91 | 0.93 |
| Индекс Шеннона | 4.9 | 4.0 | 4.2 | 4.8 |
| Индекс PD | 5.6 | 3.8 | 3.4 | 4.2 |
При инкубировании с сульфатом аммония разнообразие снизилось, но в меньшей мере. В бактериальном сообществе было определено 228 родов из 17 филумов, разнообразие по индексу Шеннона (4.8) было практически на том же уровне, что в контроле. Значение показателя выровненности увеличилось до 0.93. При этом индекс филогенетического разнообразия Фейта снизился с 5.6 до 4.2, что говорит о том, что большее количество таксонов стало находиться относительно недалеко друг от друга на филогенетическом древе. По-видимому, при этом нарушается устоявшееся сочетание экологических ниш и вырастает относительное обилие специфических групп микроорганизмов.
Основные роды бактерий (относительное содержание >1%) сообщества дерново-подзолистой почвы до и после инкубации представлены в табл. 3. Относительное обилие протеобактерий увеличилось после месяца инкубации почвы в контрольных условиях за счет представителей класса Alphaproteobacteria, обилие которых выросло от 12 до 31%, в первую очередь за счет рода Sphingomonas (доля выросла о 4 до 15%). Бактерии рода Sphingomonas принадлежат более чем к ста видам, являются аэробными гетеротрофами и выделяются из воздуха, почвы, водных экосистем, донных отложений, ризосферы и растений [10]. Большое таксономическое и экофизиологическое разнообразие позволяет бактериями Sphingomonas доминировать во многих местообитаниях и эффективно приспосабливаться к изменяющимся условиям среды. Другие представители Alphaproteobacteria, содержание которых значительно увеличилось при инкубации, принадлежат к родам Varibacter (рост от 0.3 до 1%) и Bradyrhizobium (от 0.5 до 1%). Относительное обилие представителей классов Beta- и Gammaproteobacteria не изменилось. В пределах этих двух классов преобладающими родами являлись Massilia (3%) и Lysobacter (5%), в то время как в исходной почве наиболее представлены были бактерии рода Acidibacter (1%). Значительно снизилась доля в сообществе представителей класса Deltaproteobacteria, в особенности рода Geobacter (от 3 до 0.02%). Бактерии данного рода способны восстанавливать железо и марганец в анаэробных условиях [9], и снижение их относительного обилия можно объяснить возросшей конкуренцией в почве за доступное органическое вещество.
Таблица 3.
Изменения в составе бактериальных сообществ дерново-подзолистой почвы лабораторных экспериментов на уровне рода, относительное содержание, %*
| Филум | Вариант инкубационного эксперимента бактерии | ||||
|---|---|---|---|---|---|
| K | M | ML1 | ML2 | MN | |
| Pseudomonadota | Sphingomonas (4%) Geobacter (3%) Acidibacter (1%) |
Sphingomonas (15%) Variibacter (1%) Bradyrhizobium (1%) Massilia (3%) Lysobacter (5%) |
Sphingomonas (13%) Phenylobacterium (1%) Methylotenera (10%) Methylobacter (4%) |
Sphingomonas (6) Methylotenera (19%) Methylobacter (7%) Hyphomicrobium (1%) |
Sphingomonas (15%) Variibacter (1%) Bradyrhizobium (1%) Massilia (3%) Lysobacter (5%) |
| Acidobacteriota | Cand. Solibacter (5%) Bryobacter (2%) | Cand. Solibacter (1%), Bryobacter (1%) | Cand. Solibacter (2%) Bryobacter (1%) | Cand. Solibacter (1%) | Cand. Solibacter (1%) Bryobacter (1%) |
| Actinobacteriota | Streptomyces (2%) Blastococcus (1%) | Streptomyces (2%) Blastococcus (1%) | |||
| Bacillota | Bacillus (5%) | Paenibacillus (1%) | |||
| Gemmatimonadota | Gemmatimonas (2%) | Gemmatimonas (2%) | Gemmatimonas (2%) | Gemmatimonas (2%) | Gemmatimonas (2%) |
| Bacteroidota | Pedobacter (1%) | Flavisolibacter (1%) | Flavisolibacter (1%) | ||
| Nitrospirota | Nitrospira (2%) | ||||
В пределах филума Acidobacteriota существенно уменьшилась доля представителей класса Solibacteres (от 7 до 2%), особенно родов Candidatus Solibacter (с 5 до 1%) и Bryobacter (от 2 до 1%). В филуме Bacteroidota от 12 до 5% уменьшилось относительное содержание представителей класса Sphingobacteriia, род Pedobacter (от 1 до 0.1%). На порядок уменьшилось относительное содержание представителей рода Nitrospira из филума Nitrospirae, от 2 до 0.2%. Эти облигатные хемолитоавтотрофы способны осуществлять полное окисление аммония до нитрата, что отличает их от других нитрифицирующих бактерий [16]. Вклад, вносимый в сообщество представителями классов Actinobacteria и Bacilli, вырос до 10 и 7% соответственно. Для сравнения в исходной почве эти два класса суммарно составляли лишь 0.6%. Основные роды грамположительных бактерий: Bacillus (5%), Streptomyces (2%) и Blastococcus (1%). Некоторое преимущество при инкубации получили представители рода Gemmatimonas из филума Gemmatimonadota, содержание которых возросло с 0.5 до 2%.
После внесения хлорида лантана (ML1) в таксономической структуре и разнообразии бактериального сообщества произошли значительные изменения. Представители класса Alphaproteobacteria уже не доминировали и были только третьими по относительному обилию: 22% через 1 мес. и 15% через 2 мес. Вклад представителей остальных классов протеобактерий, напротив, значительно увеличился. Так, доля Betaproteobacteria составила 18 и 28%, а Gammaproteobacteria – 11 и 18% через 1 и 2 мес. соответственно. Доля представителей Deltaproteobacteria составила 3–4%. Примечательно, что на уровне родов доминировали метило- и метанотрофные бактерии, что не характерно для вариантов без внесения лантана, несмотря на одинаково высокую концентрацию метана. Возможно, представители этих родов не могли доминировать в бактериальном сообществе в условиях ограниченного содержания в почве кальция и лантана, элементов, необходимых для активности метанолдегидрогеназ и ассимиляции метана. Вклад, вносимый представителями рода Sphingomonas, уменьшился от 15% в контрольном варианте до 13% при внесении лантана за 1 мес. и до 6% за 2 мес. Из других филумов существенное относительное обилие имели роды Candidatus Solibacter (1–2%) и Bryobacter (0.6–1%) из класса Solibacteres; Flavisolibacter (1%) из класса Chitinophagia; Gemmatimonas (4–5%) из класса Gemmatimonadetes.
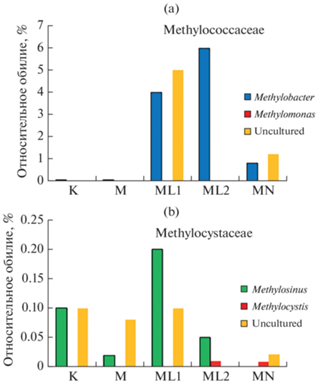
Влияние солей аммония и лантана на состав сообщества метанотрофных и нитрифицирующих бактерий. Анализ таксономического состава микробных сообществ показал доминирование метанотрофных бактерий в вариантах с внесением солей лантана. На рис. 4 представлены данные о представленности в микробных сообществах метанотрофных бактерий, относящихся к Methylococcaceae (4a) и Methylocystaceae (4b). Внесение солей лантана приводило к многократному возрастанию количества метанотрофов рода Methylobacter из класса Gammaproteobacteria, которые составляли 4% через 1 мес. инкубации и 6% через 2 мес. Одновременно возрастала представленность облигатного метилотрофа рода Methylotenera – 10, 19% через 1 и 2 мес. соответственно. Это может быть объяснено наличием у Methylotenera только одной формы метанолдегидрогеназы, XoxF-MDH, содержащей в активном центре лантан [32]. Созданные в условиях лабораторных экспериментов высокое содержание в почве лантана и высокое содержание метана в газовой фазе, вероятно, создают селективные условия для развития лантанозависимых метанотрофов.
Рис. 4.
Изменения в составе метанотрофов семейства Methylococaceae (a) и Methylocystaceae (b) в образцах почвы инкубационного эксперимента после инкубации в течение месяца.
Исходная почва К характеризуется высоким содержанием хемолитотрофных нитрифицирующих бактерий как первой, так и второй фазы нитрификации (рис. 5a). В составе аммонийокисляющих бактерий обнаружены представители рода Nitrosospira, однако их относительное обилие очень мало (0.09%), а остальная часть (2.91%) представлена некультивируемыми представителями семейства Nitrosomonadaceae. Внесение солей аммония и лантана не приводило к увеличению количества этих нитрификаторов. Бактерии второй фазы нитрификации представлены только представителями рода Nitrospira (рис. 5b), относительная представленность которых снижалась при внесении солей, как лантана, так и аммония.
Рис. 5.
Изменения в составе нитрификаторов семейства Nitrosomonadaceae (a) и Nitrospiraceae (b) в образцах почвы инкубационного эксперимента после инкубации в течение 1 мес.
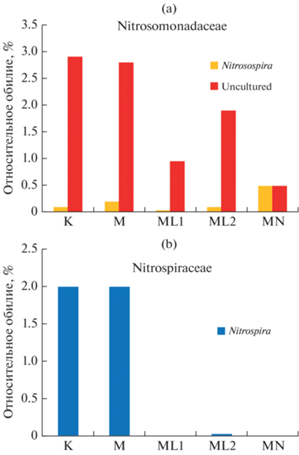
Таким образом, соли лантана стимулируют процесс нитрификации, но снижают содержание автотрофных нитрификаторов. Вероятно, это связано с активизацией гетеротрофных нитрификаторов. Одним из возможных участников могут быть бактерии рода Sphingomonas, которые обладают нитрифицирующей способностью [10], и представленность которых значительно возрастает при внесении солей лантана и аммония.
ЗАКЛЮЧЕНИЕ
На основании проведенных экспериментов установлено, что сульфат аммония и хлорид лантана, которые могут поступать в почву с азотными (минеральными и органическими), фосфорными (фосфориты) и лантансодержащими удобрениями, оказывают значительное влияние на почвенное микробное сообщество.
В инкубационных модельных экспериментах показано, что аммоний ингибирует метанотрофную активность на первых этапах инкубации дерново-подзолистой почвы, а положительное влияние лантана прослеживается на протяжении 20 сут. Соли лантана стимулируют процесс потенциальной нитрифицирующей активности, однако в почвах с низкой буферной емкостью возможно уменьшение активности за счет увеличения кислотности. Внесение сульфата аммония в почву в количестве, соответствующем применяемой в сельском хозяйстве дозе (300 кг N–${\text{NO}}_{4}^{ + }$/га), ведет к увеличению доли протеобактерий в бактериальном сообществе.
В условиях высокого содержания метана происходит значительное (на несколько порядков) увеличение содержания метанотрофов I типа (Gammaproteobacteria), что можно объяснить их высокой адаптивностью и способностью быстро реагировать на доступность субстратов. Одновременно наблюдается увеличение количества лантанозависимых облигатных метилотрофов рода Methylotenera. Можно предположить, образование ассоциаций метано- и метилотрофных лантанозависимых бактерий, что приводит к изменениям в активности метанового фильтра почвы. Количество внесенного лантана 5 мкг/г многократно превышает содержание доступного лантана в почве, что создает преимущества для бактерий, обладающих лантансодержащей метанолдегидрогеназой.
Полученные результаты требуют дальнейших исследований возможных механизмов влияния лантана на процессы окисления метана и аммония в почве; определение факторов, влияющих на доминирование в естественных условиях тех или иных микроорганизмов в сообществе; исследование зависимости численности бактерий в экосистемах от выполняемой ими функции. Результаты работы могут способствовать разработке современных подходов регуляции активности почвенного метанового фильтра и сопутствующей микробиоты, что позволит уменьшить негативное влияние глобального потепления климата и стабилизировать запасы почвенного углерода. Данные будут полезны при уточнении безопасных доз аммонийных удобрений и лантансодержащих микроудобрений при ведении сельского хозяйства в средней полосе России.
Список литературы
Ананьева Н.Д., Сусьян Е.А., Гавриленко Е.Г. Особенности определения углерода микробной биомассы почвы методом субстрат-индуцированного дыхания // Почвоведение. 2011. № 11. С. 1327–1333.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Котельникова А.Д., Рогова О.Б., Столбова В.В. Лантаноиды в почве: поступление, содержание, влияние на растения, генотоксичность (обзор) // Почвоведение. 2021. № 1. С. 100–119. https://doi.org/10.31857/S0032180X21010056
Кравченко И.К., Семенов В.М., Кузнецова Т.В., Быкова С.А., Дулов Л.Е., Пардини Д., Гисперт М., Боукс П., Ван Климпут О., Гальченко В.Ф. Физико-химические и биологические факторы, контролирующие окисление атмосферного метана в серых лесных почвах // Микробиология. 2005. Т. 74. № 2. С. 255–260.
Кравченко И.К., Сизов Л.Р., Тихонова Е.Н., Лысак Л.В. Влияние лантана на состав метанотрофного сообщества дерново-подзолистой почвы // Микробиология. 2022. Т. 91. № 5. С. 638–643. https://doi.org/10.31857/S0026365622100238
Мэгарран Э. Экологическое разнообразие и его измерение. М.: Мир, 1992. 184 с.
Фастовец И.А., Котельникова А.Д., Рогова О.Б., Сушков Н.И., Волков Д.С., Проскурнин М.А., Пашкевич Е.Б. Влияние внесенного в почву лантана на химический состав растений ячменя в условиях вегетационного опыта // Бюл. Почв. ин-та им. В.В. Докучаева. 2017. № 88. С. 27–46. https://doi.org/10.19047/0136-1694-2017-88-27-46
Чимитдоржиева И.Б., Абашеева Н.Е. Влияние лантана на микробиологическую активность и динамику азотного фонда почв. Улан-Удэ: Изд-во БГСХА им. В.Р. Филиппова, 2014. 98 с.
Abdel-Haleem A.S., Sroor A., El-Bahi S.M., Zohny E. Heavy metals and rare earth elements in phosphate fertilizer components using instrumental neutron activation analysis // Appl. Radiat. Isot. 2001. V. 55(4). P. 569–573. https://doi.org/10.1016/s0969-8043(01)00098-7
Asaf S., Numan M., Khan A.L., Al-Harrasi A. Sphingomonas: from diversity and genomics to functional role in environmental remediation and plant growth // Crit. Rev. Biotechnol. 2019. V. 40(2). P. 138–152. https://doi.org/10.1080/07388551.2019.1709793
Bodelier P.L.E., Laanbroek H.J. Nitrogen as a regulatory factor of methane oxidation in soils and sediments // FEMS Microbiol. Ecol. V. 47(3). P. 265–277. https://doi.org/10.1016/S0168-6496(03)00304-0
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N. et al. QIIME allows analysis of high throughput community sequencing data // Nat. Methods. 2010. V. 7(5). P. 335–336. https://doi.org/10.1038/nmeth.f.303
Chan A.S.K., Parkin T.B. Methane oxidation and production activity in soils from natural and agricultural ecosystems // J. Environ. Qual. 2001. V. 30. P. 1896–1903. https://doi.org/10.2134/jeq2001.1896
Conrad R. The global methane cycle: recent advances in understanding the microbial processes involved // Environ. Microbiol. Rep. 2009. V. 1(5). P. 285–292. https://doi.org/10.1111/j.1758-2229.2009.00038.x
Cowan N., Maire J., Krol D., Cloy J.M., Hargreaves P., Murphy R., Carswell A. et al. Agricultural soils: A sink or source of methane across the British Isles? // Eur. J Soil Sci. 2020. V. 72(4). P. 1842–1862. https://doi.org/10.1111/ejss.13075
Daims H., Lebedeva E.V., Pjevac P., Han P., Herbold C., Albertsen M., Jehmlich N. et al. Complete nitrification by Nitrospira bacteria // Nature. 2015. V. 528(7583). P. 504–509. https://doi.org/10.1038/nature16461
Dunfield P.F., Belova S.E., Vorob’ev A.V., Cornish S.L., Dedysh S.N. Methylocapsa aurea sp. nov., a facultative methanotroph possessing a particulate methane monooxygenase, and emended description of the genus Methylocapsa // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 2659–2664. https://doi.org/10.1099/ijs.0.020149-0
Dutaur L., Verchot L.V. A global inventory of the soil CH4 sink// Global Biogeochem. Cycles. 2007. V. 21. P. GB4013. https://doi.org/10.1029/2006GB002734
Griffiths B.S., Philippot L. Insights into the resistance and resilience of the soil microbial community // FEMS Microbiol. Rev. 2013. V. 37(2). P. 112–129. https://doi.org/10.1111/j.1574-6976.2012.00343.x
Forster P., Ramaswamy V., Artaxo P., Berntsen T., Betts R., Fahey D.W., Haywood J. et al. Changes in atmospheric constituents and in radiative forcing // Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change in Climate Change 2007: The Physical Science Basis. Cambridge: Cambridge University Press, 2007. P. 131–217.
Hu Y., Shu X., He Jia Deng, Ou-Ping Xiao, Hai-Hua Pu, Qin. Influence of lanthanum on microbial biomass C, P and C and P-cycling enzyme activities in tea garden soil // Arch. Agron. Soil Sc. 2016. V. 63. P. 700–709. https://doi.org/10.1080/03650340.2016.1235266
IUSS Working Group WRB. 2015. World Reference Base for Soil Resources 2014, update 2015. International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106. FAO, Rome. 192 p.
Kim D.-G., Kirschbaum M.U.F. The effect of land-use change on the net exchange rates of greenhouse gases: a meta-analytical approach // Biogeosc. Discuss. 2014. V. 11. P. 1053–1095. https://doi.org/10.5194/bgd-11-1053-2014
Knief C. Diversity and habitat preferences of cultivated and uncultivated aerobic methanotrophic bacteria evaluated based on pmoA as molecular marker // Front. Microbiol. 2015. V. 6. P. 1346. https://doi.org/10.3389/fmicb.2015.01346
Kravchenko I. Microbial oxidation of the atmospheric methane in natural and agricultural upland soils // Agro-Environmental Sustainability. V. 2. Managing Environmental Pollution. Springer, 2017. P. 183–213. https://doi.org/10.1007/978-3-319-49727-3_10
Le Mer J., Roger P. Production, oxidation, emission and consumption of methane by soils: A review // Eur. J. Soil Biol. 2001. V. 37. P. 25–50. https://doi.org/10.1016/S1164-5563(01)01067-6
Levine U.T., Teal T.K., Robertson G.P., Schmidt T.M. Agriculture’s impact on microbial diversity and associated fluxes of carbon dioxide and methane // The ISME J. 2011. V. 5. P. 1683–1691. https://doi.org/10.1038/ismej.2011.40
Mohanty S.R., Bodelier P.L., Floris V., Conrad R. Differential effects of nitrogenous fertilizers on methane-consuming microbes in rice field and forest soils // App-l. Environ. Microbiol. 2006. V. 72. P. 1346–1354. https://doi.org/10.1128/aem.72.2
Powlson D.S., Goulding K.W.T., Willison T.W., Webster C.P., Hütsch B.W. The effect of agriculture on methane oxidation in soil // Nutr. Cycling Agroecosyst. 1997. V. 49. P. 59–70. https://doi.org/10.1023/A:1009704226554
Saunois M., Bousquet P., Poulter B., Peregon A., Ciais P., Canadell J.G., Dlugokencky E.J. et al. The global methane budget 2000–2012 // Earth Syst. Sci. Data. 2016. V. 8. P. 697–751. https://doi.org/10.5194/essd-8-697-2016
Smith P., House J.I., Bustamante M., Sobocká J., Harper R., Pan G., West P.C. et al. Global change pressures on soils from land use and management // Glob. Change Biol. 2016. V. 22(3). P. 1008–1028. https://doi.org/10.1111/gcb.13068
Skovran E., Raghuraman C., Martinez–Gomez N.C. Lanthanides in methylotrophy // Curr. Issues Mol. Bio-l. 2019. V. 33. P. 101–115. https://doi.org/10.21775/cimb.033.101
Stoecker K., Bendinger B., Schöning B., Nielsen P.H, Nielsen J.L., Baranyi C., Toenshoff E.R. et al. Cohn’s Crenothrix is a filamentous methane oxidizer with an unusual methane monooxygenase // Proc. Natl. Acad. Sci. U.S.A. 2006. V. 103. P. 2363–2367. https://doi.org/10.1073/pnas.0506361103
Vigliotta G., Nutricati E., Carata E., Tredici S.M., De Stefano M., Pontieri P., Massardo D.R. et al. Clonothrix fusca Roze 1896, a filamentous, sheathed, methanotrophic gamma-proteobacterium // Appl. Environ. Microbiol. 2007. V. 73(11). P. 3556–3565. https://doi.org/10.1128/AEM.02678-06
Vorobev A.V., Baani M., Doronina N.V., Brady A.L., Liesack W., Dunfield P.F., Dedysh S.N. Methyloferula stellata gen. nov., sp. nov., an acidophilic, obligately methanotrophic bacterium that possesses only a soluble methane monooxygenase // Int. J. Syst. Evol. Microbiol. 2011. V. 61(10). P. 2456–2463. https://doi.org/10.1099/ijs.0.028118-0
Дополнительные материалы отсутствуют.


