Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2023, № 5, стр. 3-15
Проект сканирующего и проекционного микроскопов для станции “Наноскопия” для биологических исследований в “окне прозрачности воды”
И. В. Малышев a, *, А. Е. Пестов a, В. Н. Полковников a, Д. Г. Реунов a, М. Н. Торопов a, Н. И. Чхало a, Я. В. Ракшун b, Ю. В. Хомяков b, В. А. Чернов b, И. А. Щелоков c
a Институт физики микроструктур РАН
603950 Нижний Новгород, Россия
b Институт ядерной физики им. Г.И. Будкера СО РАН
630090 Новосибирск, Россия
c Институт проблем технологии микроэлектроники и особочистых материалов РАН
142432 Черноголовка, Россия
* E-mail: ilya-malyshev-wot@yandex.ru
Поступила в редакцию 21.07.2022
После доработки 17.10.2022
Принята к публикации 17.10.2022
- EDN: AJWIBH
- DOI: 10.31857/S1028096023050126
Аннотация
Дано краткое описание концепции мягкого рентгеновского микроскопа для станции “Наноскопия”, которая планируется для установки на синхротроне четвертого поколения СКИФ. Микроскоп будет предназначен для изучения строения клеток и динамических процессов в них с нанометровым пространственным разрешением. Прибор будет использовать уникальный абсорбционный контраст ~15 между углеродсодержащими структурами и водой в спектральном диапазоне “окна прозрачности воды” λ = 2.3–4.3 нм, что исключает необходимость контрастирования и применения флуорофоров и минимизирует необходимые для получения высококачественных 3D-изображений поглощенные в образцах дозы ионизирующего излучения. Приведены сканирующая и проекционная схемы микроскопа, их основные технические характеристики, в том числе расчетные спектры и параметры ондуляторного источника, получена оценка поглощенных доз в зависимости от разрешения. Основное преимущество предлагаемой концепции заключается в использовании объектива из высокоапертурных многослойных рентгеновских зеркал, который позволяет четко визуализировать фокальный срез образца. Для восстановления трехмерной структуры замороженных или высушенных образцов будет также использована технически простая аксиальная томография. В сканирующей схеме благодаря малой дозе облучения можно будет изучать живые клетки растений с разрешением до 10 нм, животных – до 80 нм и замороженные образцы с разрешением до 5 нм. В проекционной схеме за счет одномоментного наблюдения всего фокального ХY-среза существенно уменьшено время получения трехмерных изображений, но за счет большой дозы она будет ориентирована в основном на изучение фиксированных образцов.
ВВЕДЕНИЕ
В современных биологических и медицинских задачах для понимания механизмов функционирования биологических клеток, а также для изучения влияния различных болезней на клетки [1, 2] требуется увидеть детали нативных, в идеале живых, клеток с разрешением в десятки нанометров. Для решения этой проблемы в настоящее время в арсенале исследователей имеются фактически два инструмента – электронная микроскопия [3] и оптическая микроскопия с суперразрешением [4].
Основным физическим ограничением этих методов является необходимость использования флуорофоров в случае флуоресцентных методов или контрастирования в электронной микроскопии. Использование этих веществ уже само по себе модифицирует исследуемый объект. Эти методы позволяют наблюдать только структуры и молекулы, несущие на себе флуоресцентную метку или контрастное вещество, в то время как остальная часть материала образца, образующая биологический “контекст”, в котором находится исследуемая структура или протекает исследуемый процесс, остается недоступной для наблюдения.
Уже более 30 лет развивается мягкая рентгеновская микроскопия в спектральной области “окна прозрачности воды” 2.3–4.3 нм. Уникальность этого метода заключается в следующем. Во-первых, наблюдается большой, ~15, абсорбционный контраст между протеинами, жирами и углеводами, основу которых составляет углерод, по отношению к межклеточной жидкости (основой поглощающий элемент кислород). Благодаря этому не требуется контрастирование и минимизируется поглощенная доза, необходимая для получения качественных изображений. Во-вторых, практически полностью отсутствует рассеяние, что в совокупности с достаточно большой длиной пробега излучения позволяет изучать достаточно толстые, до 10 мкм и более, образцы, которые даже могут быть помещены в кювету при нормальном давлении. Подробнее об особенностях взаимодействия излучения этого диапазона с биологическими образцами изложено в [2].
В виду актуальности темы на современных синхротронах имеются соответствующие станции мягкой рентгеновской микроскопии. Микроскопы делятся на сканирующие [5–8] и проекционные [9–12]. Как сканирующие, так и проекционные микроскопы на основе зонных пластинок Френеля обеспечивают высокое латеральное (2D) разрешение. Например, в [6] 2D-разрешение составило менее 10 нм. Существенно хуже ситуация с объемным разрешением. В [5] получено 3D-разрешение 30 нм в латеральной плоскости и 550 нм вдоль оптической оси. В лучших проекционных мягких рентгеновских микроскопах, в которых изучали замороженные образцы, было получено объемное (3D) разрешение на уровне 50–60 нм [9–12]. Однако, несмотря на перспективы и демонстрацию ряда несомненных достижений, мягкая рентгеновская микроскопия так и не стала важным инструментом в клеточной биологии.
Основная причина этого – недостатки используемой концепции микроскопов на базе зонных пластинок Френеля. Главными недостатками таких пластинок являются низкие эффективность и угловая апертура (NA < 0.1). Низкая эффективность пластинок в проекционных микроскопах приводит к дополнительной поглощенной дозе. Низкая числовая апертура приводит к большой (единицы микрометров) глубине фокуса, что сильно ограничивает 3D-разрешение в схеме сканирующего микроскопа. Проекционная микроскопия для восстановления 3D-структуры клетки требует применения трудоемкой и длительной процедуры угловой томографии, которая помимо потери точности приводит к дополнительным поглощенным дозам.
Поэтому поиск новых подходов к построению микроскопов для “водного окна прозрачности” является крайне актуальным. Целью предлагаемых в работе решений является достижение нанометрового 3D-разрешения при минимально возможных поглощенных дозах в биологических образцах, в идеале – возможность наблюдения за живыми клетками. Для достижения этой цели на синхротроне четвертого поколения СКИФ будет разработана станция “Наноскопия”, предназначенная для изучения строения клеток и динамических процессов в них с нанометровым пространственным разрешением. В работе описаны принципы построения микроскопа, его рентгенооптические схемы и оценка поглощенных доз в зависимости от разрешения.
ВЫБОР ТИПА МИКРОСКОПА, ОПТИКИ И ДЛИНЫ ВОЛНЫ
При выборе типа микроскопа руководствовались следующими соображениями. Минимальных поглощенных доз можно достичь при использовании сканирующих рентгеновских микроскопов. Это связано с тем, что в проекционном микроскопе потери интенсивности на рентгенооптических элементах объектива напрямую приводят к увеличению поглощенной дозы. Например, при эффективности схемы 10% для достижения требуемого числа полезных событий необходимо в 10 раз увеличить поглощенную дозу. В сканирующем микроскопе потери на рентгенооптических элементах приводят лишь к потере интенсивности зондового пучка и никак не влияют на поглощенную в образце дозу.
Еще одним преимуществом сканирующего микроскопа является то, что для регистрации изображений не требуются матричные детекторы. Это позволяет повысить эффективность регистрации почти до 100% и заметно (до МГц) увеличить быстродействие детектора.
Однако использование сканирующего микроскопа для 3D-реконструкции образцов ограничено величиной глубины фокуса DoF фокусирующей оптики:
(1)
$DoF \approx \pm {\lambda \mathord{\left/ {\vphantom {\lambda {N{{A}^{2}},}}} \right. \kern-0em} {N{{A}^{2}},}}$Большими геометрическими и угловыми апертурами обладают многослойные рентгеновские зеркала нормального падения, нанесенные на фокусирующие подложки. В частности, на основе этих элементов изготовлены объективы для проекционной литографии на длине волны 13.5 нм с числовой апертурой NA = 0.3–0.33 [13, 14] и в разработке объектив с NA = 0.55 [15].
Максимального абсорбционного контраста между протеинами и водой (около 20), а также минимального поглощения (длина поглощения около 10 мкм) можно достичь на длине волны непосредственно вблизи края поглощения кислорода λOK = 2.33 нм. Для этой спектральной области наибольшим коэффициентами отражения R ≈ 9% при нормальном падении на длине волны λ = 2.42 нм обладают многослойные рентгеновские зеркала Cr/V [16]. Полоса пропускания составляет 0.2%.
Интерес также представляют зеркала Cr/Ti/B4C и Cr/Sc. В первом случае на длине волны 2.83 нм при нормальном падении получен коэффициент отражения R ≈ 15.75% при спектральной полосе пропускания 0.3% [17]. Однако результаты [16, 17] вызывают определенные сомнения, так как приведены однократно и в не реферируемых изданиях.
Многослойные рентгеновские зеркала Cr/Sc имеют рекордный коэффициент отражения R ≈ 23% на длине волны 3.12 нм при спектральной полосе пропускания 0.3% [18]. Для разрабатываемого микроскопа была выбрана пара материалов Cr/Sc и, соответственно, рабочая длина волны 3.12 нм. Этот выбор сделан по следующим причинам. Во-первых, авторы имеют многолетний опыт в разработке и применении зеркала Cr/Sc [19–21]. В [22] на структурах без барьерных слоев Cr/Sc был получен коэффициент отражения R ≈ 21%. Полагаем, что применение барьерных покрытий и нитридизации слоев, как в [18], позволит заметно увеличить коэффициент отражения. Во-вторых, многослойные рентгеновские зеркала Cr/Sc обладают как большим коэффициентом отражения, так и широкой спектральной полосой, что увеличит интенсивность зондового пучка и, соответственно, уменьшит время проведения эксперимента. В-третьих, при изготовлении многослойных зеркал для объектива очень жесткие требования предъявляют к подложкам. Для обеспечения дифракционного качества изображения, согласно критерию Марешаля, среднеквадратическая аберрация объектива не должна превышать RMS ≤ ≤ λ/14. В случае λ = 3.12 нм это соответствует величине RMS ≤ 0.22 нм. Изготовление таких подложек находится на пределе возможностей современных технологий [23]. В-четвертых, несмотря на отход от края поглощения кислорода, абсорбционный контраст и длина поглощения уменьшились не сильно, до 15 и 6 мкм соответственно.
Как уже отмечалось выше, достоинством сканирующего микроскопа является минимально возможная доза, поглощенная в исследуемом образце. Однако эта схема мягкого рентгеновского микроскопа имеет один существенный недостаток. Из-за ограниченной скорости пьезоэлектрического 3D-наносканера (например, [24]) время съемки томограммы может достигнуть часа и более. Этого недостатка лишена схема проекционного микроскопа, в которой за один кадр снимается сразу все ХY-поле, а для восстановления 3D строения образец перемещается вдоль оптической оси Z. Такой подход позволяет уменьшить время томографии до долей единиц минут, а при наблюдении тонких образцов или выбранных срезов – долей секунды. Поэтому для реализации обеих мод работы на станции “Наноскопия” будут установлены два мягких рентгеновских микроскопа – сканирующего и проекционного типов.
РЕНТГЕНООПТИЧЕСКАЯ СХЕМА СКАНИРУЮЩЕГО МИКРОСКОПА
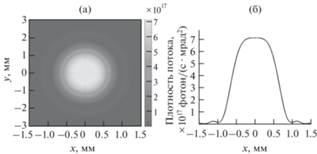
При разработке рентгенооптической схемы микроскопа надо учитывать особенности синхротронного источника четвертого поколения. Параметры источника рентгеновского излучения приведены в табл. 1. На рис. 1, 2 показаны интенсивности различных гармоник источника, из которых следует следующее. Во-первых, часть энергии пучка синхротронного излучения соответствует высоким гармоникам и должна быть “убрана”, чтобы не попадать на прецизионные рентгенооптические элементы микроскопа. Во-вторых, на расстоянии 20 м от источника размер рентгеновского пучка на полувысоте интенсивности составит 1 мм (рис. 3). Это является серьезнейшей проблемой для применения зеркальной оптики, так как фактически требуется использование изображающей микрооптики. С учетом того, что многослойные рентгеновские зеркала – это брэгговские отражатели, в каждой точке падения излучения на зеркало должно выполняться брэгговское условие. Очевидно, что большие градиенты толщин пленок на общей длине порядка 1 мм не могут быть получены.
Таблица 1.
Основные параметры источника рентгеновского излучения
| Параметр | Значение |
|---|---|
| Тип источника × планарный вертикальный ондулятор: | |
| Период, см | 5 |
| Число периодов | 78 |
| Продольная длина, м | 3.9 |
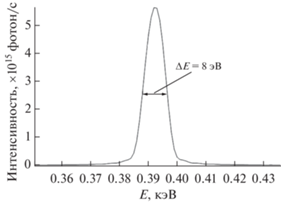
| Рабочая длина волны, нм; энергия, эВ | 3.12; 397.4 |
| Монохроматичность пучка, %; уровень ширины на половине максимума (FWHM), эВ | 2; 8 |
| Размер на полувысоте интенсивности (наибольший), мкм | 30 |
| Угловая расходимость, мкрад | 25 |
| Средняя интенсивность излучения первой гармоники в полосе 0.1%, 1015 фотон/с | 5.6 |
| Полная мощность излучения, Вт | 500 |
Рис. 1.
Интенсивность различных гармоник источника в 0.1% полосе энергии (кольцевой ондулятор, B = = 0.39 Tл, λu = 50 мм, диаметр потока фотонов 1 мм на расстоянии 20 м от источника, Lu = 3.9 м, Np = 78).
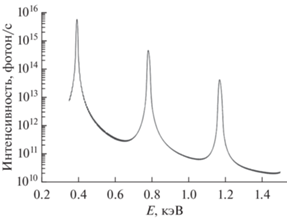
Рис. 3.
Расчетный пучок на расстоянии 20 м от источника синхротронного излучения, сечение в 0.1% полосе энергии: а – ХY; б – X.
Другая проблема – это ориентация оптической оси микроскопа. Оси микроскопов, описанных в упомянутых выше работах, расположены горизонтально, в плоскости орбиты синхротрона. С точки зрения эргономики и удобства работы с образцами – это неудобная ориентация. Обычно все микроскопы имеют вертикальную оптическую ось.
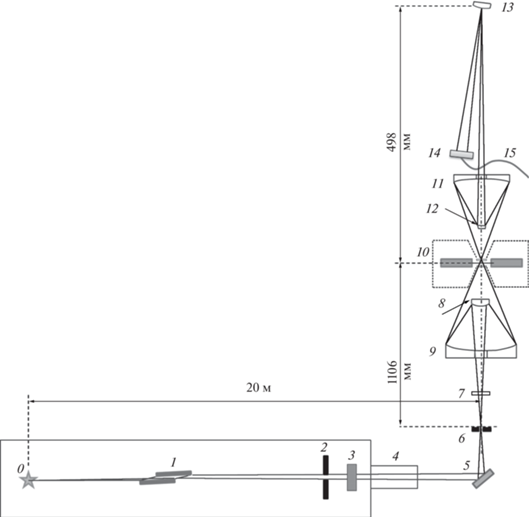
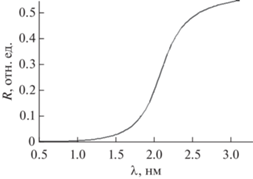
В настоящем проекте обе эти проблемы решены за счет гибридной схемы микроскопа, включающей отражательные и дифракционные рентгенооптические элементы. Рентгенооптическая схема сканирующего мягкого рентгеновского микроскопа приведена на рис. 4, основные элементы и их взаимное расположение описаны в табл. 2. Излучение из ондулятора, распространяясь по каналу, падает на систему двух плоских зеркал 1 (рис. 4). Система зеркал выполняет функции фильтра высоких гармоник и аттенюатора интенсивности рентгеновского пучка, попадающего в микроскоп. Для примера на рис. 5 приведена спектральная зависимость коэффициента отражения от кремниевого зеркала при угле падения излучения 3°. Как видно из рисунка, при коэффициенте отражения первой (рабочей) гармоники 55%, подавление второй гармоники составит около 16 раз, соответственно, при двукратном отражении – около 260. Положение относительно источника и параметры зеркал (угол падения, материал покрытия) будут оптимизированы в дальнейшем с целью обеспечения близости к 100% отражения. Тем не менее видно, что такая система обеспечивает практически полное подавление всех гармоник, что в дальнейшем не потребует охлаждения зеркал микроскопа. Отсутствие сильных тепловых нагрузок имеет принципиальное значение для предотвращения искажения волновых фронтов.
Рис. 4.
Рентгенооптическая схема сканирующего микроскопа на станции “Наноскопия”: 1 – два плоских зеркала; 2 – выходная апертура фронтенда; 3 – визуализатор рентгеновского пучка; 4 – сильфон с шиберами; 5 – линза Брэгга–Френеля; 6 – диафрагма; 7 – набор фильтров; 8 – первичное зеркало М1 объектива 54 крат; 9 – вторичное зеркало М2 объектива 54 крат; 10 – образец; 11 – детектор; 12 – криокамера; 13 – система виброизоляци; 14 – вакуумная система.
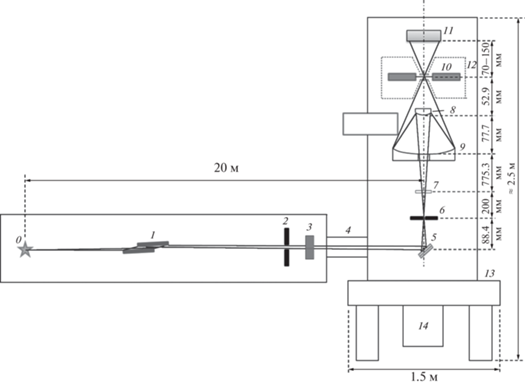
Таблица 2.
Оптические элементы станции “Наноскопия”
| № | Элемент | Расстояние от предыдущего элемента | Описание |
|---|---|---|---|
| 0 | Источник СИ | 0 | Ондулятор |
| 1 | Два плоских зеркала | 15 м | Охлаждаемый фильтр гармоник – аттенюатор интенсивности пучка |
| 2 | Выходная апертура фронтенда | 13 м | Система охлаждаемых щелей, выделяющих центральный конус излучения с NA = 25 мкрад |
| 3 | Визуализатор рентгеновского пучка | 0.5 м | Мониторы положения и интенсивности пучка |
| 4 | Сильфон с шиберами | 0.5 м | |
| 5 | Линза Брэгга–Френеля | 1 м | Многослойное зеркало Cr/Sc с эллиптической зонной пластинкой на поверхности, наклонено на 45°. Рабочая область – эллипс (2a = 1.4 мм, 2b = 1 мм), охлаждается LN2 |
| 6 | Диафрагма | 88.4 мм | Диафрагма размером 1 мкм, охлаждаемая H2O |
| 7 | Набор фильтров | 200 мм | Многослойные фильтры для контроля потока падающего излучения |
| 8 | Первичное зеркало М1 | 853 мм | Выпуклое зеркало Cr/Sc объектива Шварцшильда, строящего изображение диафрагмы 1 мкм на образце с уменьшением в 54 раза. R = –28.2 мм, D = 12 мм NA = 0.4 |
| 9 | Вторичное зеркало М2 | 77.7 мм | Вогнутое зеркало Cr/Sc объектива Шварцшильда. R = –107.6 мм, D = 78 мм |
| 10 | Образец | 130.6 мм | Образец на Х,Y,Z-сканере с обратной связью (табл. 3) |
| 11 | Детектор | 70–150 мм | Pin-диод или микроканальная пластина, регистрирующий сигнал, прошедший через наблюдаемые точки образца |
| 12 | Криокамера | Предусмотрена возможность установки криокамеры с охлаждением образца парами LN2 | |
| 13 | Система виброизоляции | Оптический стол; пружинный подвес оптической фермы; магнитный демпфер на токах Фуко | |
| 14 | Вакуумная система | Высоковакуумная откачка |
Рис. 5.
Фильтр гармоник. Спектральная зависимость коэффициента отражения кремниевого зеркала при скользящем угле падения 3°. Подавление второй гармоники при двукратном отражении достигает 260.
Проходя далее, излучение падает на первый элемент наноскопа – линзу Брэгга–Френеля 5 (рис. 4) [25]. В качестве отражающего будет использовано покрытие Cr/Sc. Линза Брэгга–Френеля выполняет сразу несколько функций. Во-первых, осуществляет первую стадию фокусировки рентгеновского излучения до размера порядка 0.125 мкм (уменьшение 200 раз). Во-вторых, поворачивает пучок на 90°, тем самым обеспечивая удобную ориентацию оптической оси микроскопа. В-третьих, так как на линзу падает квазимонохроматический пучок, при ее изготовлении не требуется напыления многослойного зеркала с градиентом периода по поверхности.
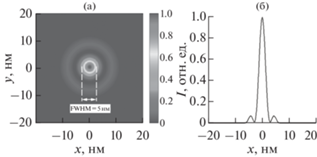
В плоскости фокусировки устанавливают диафрагму с субмикронным отверстием. Диафрагма выполняет функцию фильтра для обрезания “хвостов” зондового пучка. Расходящийся пучок падает на объектив Шварцшильда. Объектив с числовой апертурой NA = 0.4 еще в 54 раза уменьшает размер фокуса в плоскости образца. Расчетное распределение интенсивности зондового пучка, ограниченное дифракцией, приведено на рис. 6. Поперечный размер изображения составляет FWHM = 5 нм. Таким образом, потенциально рентгенооптическая схема обеспечивает латеральное разрешение на уровне 5 нм.
Рис. 6.
Изображение (а) и поперечное сечение фокуса (б) зондового рентгеновского пучка в схеме сканирующего мягкого рентгеновского микроскопа.
В плоскости изображения помещают исследуемый образец. Прошедшее через образец излучение регистрирует детектор (pin-диод, микроканальная пластина), синхронизованный с электронными банчами синхротрона. Для реконструкции 3D-структуры образец помещают на столик-сканер, осуществляющий перемещение образца по трем координатам x, y, z с нанометровой точностью. В качестве сканера выбран столик от компании PI модели P-561.3DD. Технические характеристика сканера, взятые из [24], приведены в табл. 3.
Таблица 3.
Характеристики Х,Y,Z-столика образца марки PI модели P-561.3DD (взяты из [24])
| Характеристика | P-561.3DD |
|---|---|
| Направление перемещения | X, Y, Z |
| Скорость смещения, мм/с | 0.2 |
| Встроенный сенсор | Емкостный |
| Диапазон перемещений без обратной связи (от –20 до +120 В), мкм | 58 × 58 × 18 |
| Диапазон перемещений с обратной связью, мкм | 45 × 45 × 15 |
| Разрешение без обратной связи, нм | 0.1 |
| Разрешение с обратной связью, нм | 0.2 |
| Нелинейность, % | 0.01 |
| Точность повторного позиционирования X, Y, Z, нм | 2 |
| Отклонение от поперечной оси (Pitch) при движении по осям X, Y, мкрад | ±3 |
| Отклонение от осей X, Y при движении по оси Z (Runout), мкрад | ±3 |
| Отклонение от вертикальной оси (Yaw) при движении по осям X, Y, мкрад | ±3 |
| Плоскопараллельность в плоскости X, Y, нм | ±10 |
| Перекрестное влияние вдоль осей X, Y (Crosstalk) при движении по оси Z, нм | ±20 |
| Диапазон рабочих температур, °С | от –20 до +80 |
| Материал | Алюминий |
| Масса, кг | 1.55 |
| Длина кабеля, м | 1.5 |
| Рекомендуемый контроллер | E-725, E-712 |
Методика проведения измерений и реконструкция 3D-структуры аналогичны конфокальной микроскопии, за исключением отсутствия флуорофоров и того, что полезный сигнал формируется по всему объему образца, в то время как в конфокальной микроскопии сигнал дают только области с флуорофором. Образцы для исследований могут быть как зафиксированы с использованием заморозки в парах жидкого азота, так и помещены в специальные кюветы при нормальных условиях.
Для уменьшения деформаций волнового фронта и обеспечения размерной стабильности рентгенооптической схемы в условиях мощных рентгеновских потоков первое зеркало двухзеркальной системы будут охлаждать жидким азотом или водой, что будет определено при более детальной проработке, второе зеркало – водой. Последующие элементы в силу достаточно малой мощности очищенного от гармоник излучения не требуют принудительного охлаждения, и достаточно будет пассивного (радиаторного) охлаждения.
Для сохранения размерной стабильности рентгенооптической схемы при ее разработке будут использованы материалы с низкими, на уровне 10–8–10–7 К–1, температурными коэффициентами линейного расширения (ULE, астроситалл и титан-ниобиевый сплав ТВ-36). Кроме того, корпус объектива будет термостабилизирован.
ОЦЕНКА ИНТЕНСИВНОСТИ ЗОНДОВОГО ПУЧКА В СКАНИРУЮЩЕМ МЯГКОМ РЕНТГЕНОВСКОМ МИКРОСКОПЕ
Оценка интенсивности зондового пучка PBI может быть определена из следующего соотношения:
(2)
$PBI = {{I}_{{{\text{SR}}}}}\Delta {{\lambda }_{{\text{M}}}}{{R}_{{{\text{BFL}}}}}R_{{{\text{GIM}}}}^{2}R_{{{\text{MLM}}}}^{2}\,\,\left[ {{{{\text{фотон}}} \mathord{\left/ {\vphantom {{{\text{фотон}}} {\text{с}}}} \right. \kern-0em} {\text{с}}}} \right],$ОЦЕНКА ПОГЛОЩЕННОЙ ДОЗЫ В ЗАВИСИМОСТИ ОТ ПРОСТРАНСТВЕННОГО РАЗРЕШЕНИЯ
Для получения качественных рентгеновских изображений необходимо, чтобы число зарегистрированных событий было как минимум 25. В этом случае пуассоновский шум составит 20%. Так как контраст изображений между водой и протеинами превышает 10, для оценки можно считать, что все акты поглощения (события) происходят в протеине. В этом случае для обеспечения разрешения с латеральным размером d в кубике с объемом d 3 должно быть поглощено 25 фотонов. Соответственно, в схеме сканирующего мягкого рентгеновского микроскопа поглощенная доза D [Грей] может быть выражена в виде:
(3)
$D(d) = 1.6 \times {{10}^{{ - 19}}}{{N{{E}_{{{\text{ph}}}}}} \mathord{\left/ {\vphantom {{N{{E}_{{{\text{ph}}}}}} {({{d}^{3}}\rho ),}}} \right. \kern-0em} {({{d}^{3}}\rho ),}}$(4)
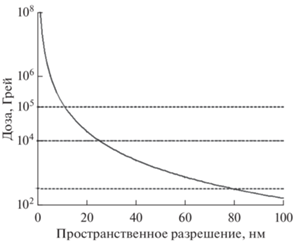
$D(d) = 1.6 \times {{{{{10}}^{8}}} \mathord{\left/ {\vphantom {{{{{10}}^{8}}} {{{d}^{3}}}}} \right. \kern-0em} {{{d}^{3}}}}\,\,\left[ {{{{\text{Грей}}} \mathord{\left/ {\vphantom {{{\text{Грей}}} {{\text{н}}{{{\text{м}}}^{3}}}}} \right. \kern-0em} {{\text{н}}{{{\text{м}}}^{3}}}}} \right].$На рис. 7 приведена зависимость требуемой дозы от разрешения, рассчитанная по (4). Из приведенной зависимости можно выделить следующее. Во-первых, даже при разрешении 1 нм необходимая доза не превышает допустимой 108 Грей [26] для сохранения замороженных клеток в нативном состоянии, поэтому разрешение ограничивается уже не дозой, а размером зондового пучка 5 нм. Во-вторых, предельно допустимая доза 300 Грей, при которой сохраняется жизнедеятельность клеток животного происхождения [2], соответствует предельному разрешению 80 нм. В-третьих, предельно допустимая доза 104–105 Грей, при которой сохраняется жизнедеятельность клеток растений [27, 28], соответствует предельному разрешению 10–25 нм.
ОЦЕНКА ВРЕМЕНИ ЭКСПОЗИЦИИ ДЛЯ ВОССТАНОВЛЕНИЯ 3D-СТРУКТУРЫ В СКАНИРУЮЩЕМ МЯГКОМ РЕНТГЕНОВСКОМ МИКРОСКОПЕ
Без учета временных потерь на перемещение сканера необходимое время для получения 3D томографических данных Texp определяется размером образца L × W × H, разрешением d, интенсивностью пробного пучка на образце PBI и числом фотонов Nph, поглощенных в кубе со стороной, равной разрешению. Взаимосвязь между этими параметрами может выть выражена в виде:
(5)
${{T}_{{{\text{exp}}}}} = {{({{N}_{{{\text{ph}}}}}LWH)} \mathord{\left/ {\vphantom {{({{N}_{{{\text{ph}}}}}LWH)} {(PBI{{d}^{3}})}}} \right. \kern-0em} {(PBI{{d}^{3}})}}\,\,\left[ {\text{с}} \right].$(6)
${{T}_{{{\text{exp}}}}} = {{({{N}_{{{\text{ph}}}}}{{L}^{3}})} \mathord{\left/ {\vphantom {{({{N}_{{{\text{ph}}}}}{{L}^{3}})} {(PBI{{d}^{3}})}}} \right. \kern-0em} {(PBI{{d}^{3}})}}\,\,\left[ {\text{с}} \right].$(7)
${{T}_{{{\text{exp}}}}} = 2.4 \times {{10}^{{ - 13}}}{{{{L}^{3}}} \mathord{\left/ {\vphantom {{{{L}^{3}}} {{{d}^{3}}}}} \right. \kern-0em} {{{d}^{3}}}}\,\,\left[ {\text{с}} \right].$Например, для клетки размером 10 × 10 × 10 мкм и разрешения 20 нм потребуется время 3 × 10–5 с. Таким образом, основным ограничением выступает не мощность источника рентгеновского излучения, а скорость перемещений сканера. Для рассмотренного случая время полного сканирования составит около 3.5 ч. Так как время сканирования обратно пропорционально кубу пространственного разрешения (т.е. кубу шага сканирования), при изучении динамических процессов, где ожидаемое разрешение составит 80 нм, время измерений клетки размером 10 × 10 × 10 мкм сократится примерно до 3 мин, а ее фокального среза до 15 мс!
ПОЛНОПОЛЬНЫЙ ПРОЕКЦИОННЫЙ МИКРОСКОП
Первая половина проекционной схемы (элементы 0–7 на рис. 8) в точности повторяет сканирующую схему (рис. 4). Далее идет двухзеркальный объектив-осветитель, состоящий из зеркал 8 и 9. В отличие от объектива сканирующей схемы он должен собирать излучение не в точку, а подсвечивать поле зрения размером 16.6 × 16.6 мкм (равно размеру матрицы детектора 13.3 × 13.3 мм, деленному на увеличение 800 крат) на образце 10, поэтому требование к точности формы оптики у него умеренные. Изображение образца с увеличением проецируется трехзеркальным объективом 11–13 (рис. 8) на матричную камеру 14. Увеличение 800 крат оптимально, чтобы, с одной стороны, размер пикселя в предметной области был мал и равен 8 × 8 нм, а с другой, поле зрения было достаточно для наблюдения большинства клеток. Описание основных элементов проекционной схемы и их взаимное расположение приведено в табл. 4.
Таблица 4.
Оптические элементы проекционного микроскопа для станции “Наноскопия”
| № | Элемент | Расстояние от предыдущего элемента, мм | Описание |
|---|---|---|---|
| 0 | Источник СИ | 0 | Ондулятор |
| 1 | Два плоских зеркала | 15 000 | Охлаждаемый фильтр гармоник – аттенюатор интенсивности пучка |
| 2 | Выходная апертура фронтенда | 3000 | Система охлаждаемых щелей, выделяющих центральный конус излучения с NA = 25 мкрад |
| 3 | Визуализатор рентгеновского пучка | 500 | Мониторы положения и интенсивности пучка |
| 4 | Сильфон с шиберами | 500 | |
| 5 | Линза Брэгга–Френеля | 1000 | Многослойное зеркало Cr/Sc с эллиптической зонной пластинкой на поверхности, наклонено на 45°. Рабочая область – эллипс (2a = 1.4 мм, 2b = 1 мм), охлаждается H2O или LN2 |
| 6 | Диафрагма | 88 | Диафрагма, охлаждаемая H2O |
| 7 | Набор фильтров | 200 | Многослойные фильтры для контроля потока падающего излучения |
| 8 | Первичное зеркало конденсорного объектива Шварцшильда | 853 | Выпуклое зеркало Cr/Sc конденсорного объектива Шварцшильда, увеличивающего апертуру пучка в 50 раз до 0.28 и создающего равномерное поле засветки на образце. R = –28.2 мм, D = 12 мм |
| 9 | Вторичное зеркало конденсорного объектива Шварцшильда | 77 | Вогнутое зеркало Cr/Sc конденсорного объектива R = –107.6 мм, D = 78 мм |
| 10 | Образец | 130 | Образец на Z-сканере с обратной связью |
| 11 | Первичное зеркало объектива ×800 | 166.3 | Вогнутое зеркало проекционного объектива R = 133.3 мм, D = 100 мм, Dсветовой = 92 мм |
| 12 | Вторичное зеркало объектива ×800 | 95.9 | Выпуклое зеркало проекционного объектива R = –31.1 мм, D = 12.6 мм |
| 13 | Третичное зеркало объектива ×800 | 401.4 | Выпуклое зеркало проекционного объектива R = –16.3 мм, D = 20 мм, Dсветовой = 0.6 мм |
| 14 | Регистрирующая матрица | 265, угол 4° к горизонтали |
GPIXEL GSENSE2020BSI PulSar с размером поля 2048 × 2048 пикселей и размером пикселя 6.5 мкм |
| 15 | Охлаждение матрицы | Медный хладопровод, от “холодного пальца”, охлаждаемого парами жидкого азота с наружи вакуумной камеры |
Высота проекционного объектива составила около 500 мм, ширина 100 мм – достаточно компактные для такого большого увеличения. Диаметр малого выпуклого зеркала 12.6 мм достаточно большой, поэтому удобен для механической и ионной полировки шероховатой поверхности и нанесения отражающего многослойного покрытия. Расчетные аберрации объектива для всех полевых точек субнанометровые. Это обеспечивает близкую к дифракционному пределу (рис. 9а, верхняя кривая) долю энергии пятна фокусировки в одном пикселе размером 6.5 мкм – от 51 до 62% в зависимости от полевой точки. На рис. 9б показано, как пятно фокусировки на регистрирующей матрице укладывается в пиксели.
Рис. 9.
Распределение энергии в пятне фокусировки для разных полевых точек (центра и краев матрицы (а). Пятно фокусировки в центре поля зрения на регистрирующей CMOS-матрице GPIXEL 2020BSI Pulsar (б).
Запись и обработка изображений образца будет осуществляться следующим образом. Образец будет сдвигаться вдоль оптической оси, и будет получена серия изображений его срезов I(x', y'), где x', y' – координаты на регистрирующей матрице. Далее в стандартных программах, например в ImageJ с плагином Deconv.Lab2 [29], итерационно решается уравнение:
(8)
$~\mu ~ = ~~{{ - {\text{ln}}\left( {{I \mathord{\left/ {\vphantom {I {{{I}_{0}}}}} \right. \kern-0em} {{{I}_{0}}}}} \right)} \mathord{\left/ {\vphantom {{ - {\text{ln}}\left( {{I \mathord{\left/ {\vphantom {I {{{I}_{0}}}}} \right. \kern-0em} {{{I}_{0}}}}} \right)} {\Delta L~\,{{ \otimes }^{{ - 1}}}\,~h}}} \right. \kern-0em} {\Delta L~\,{{ \otimes }^{{ - 1}}}\,~h}},$ОЦЕНКА ВРЕМЕНИ ЭКСПОЗИЦИИ ДЛЯ ВОССТАНОВЛЕНИЯ 3D-СТРУКТУРЫ В ПРОЕКЦИОННОЙ СХЕМЕ
Время томографии складывается из времени на z-перемещение столика и времени экспозиции всех кадров Texp. Время на z-перемещение столика на 30 мкм составляет 0.15 с, так как скорость движения столика от компании PI составляет 0.2 мм/с [24]. Время на экспозицию всех кадров Texp определяется по формуле:
(9)
${{T}_{{{\text{exp}}}}} = \frac{{{{C}_{{{\text{pix}}}}}{{E}_{e}}{{N}_{{{\text{pix}}}}}}}{{{{E}_{p}}PBI}}\frac{H}{{\Delta h}}k,$(10)
$\begin{gathered} k = {\text{exp}}( - ({{\mu }_{{{\text{льда}}}}}{{H}_{{{\text{льда}}}}} + {{\mu }_{{{\text{белка}}}}}{{H}_{{{\text{белка}}}}})) \approx \\ \approx {\text{exp}}\left( { - \left( {{1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}} \right)20} \right) \approx 150. \\ \end{gathered} $Оценим время на сохранение кадров в памяти компьютера для толщины 20 мкм с z-шагом 16 нм. Оно составит 10 мин при скорости сохранения 2 кадр/с. Так как это время равно времени экспозиции всех кадров, накопление сигнала и сохранение в памяти кадра, полученного на предыдущем z-шаге, могут быть реализованы одновременно, поэтому время томографии не увеличится и составит те же 10 мин.
Таким образом, сканирующая схема лучше подходит для изучения живых образцов, потому что обеспечивает на три порядка меньшую дозу, а проекционная схема – для изучения химически фиксированных или замороженных образцов, потому что время съемки меньше примерно в 300 раз.
ЗАКЛЮЧЕНИЕ
Описана концепция и рентгенооптическая схема станции “Наноскопия”, которая планируется к установке на синхротроне четвертого поколения СКИФ. Станция предназначена для изучения строения клеток и динамических процессов в них с нанометровым пространственным разрешением в спектральной области “окна прозрачности воды”. Новизной подхода является использование для формирования зондового пучка многослойных рентгеновских зеркал. Благодаря большой числовой апертуре объектива Шварцшильда по сравнению с зонной пластинкой Френеля глубина фокуса (область острой фокусировки) зондового пучка составляет DoF = λ/NA 2 = = 20 нм для λ = 3.12 нм и NA = 0.4, что позволяет для восстановления объемной структуры использовать Z-томографию вместо более сложной, менее точной и увеличивающей поглощенную в образце дозу угловой томографии. Также малая глубина фокуса дает возможность изучения динамики живых клеток с нанометровым разрешением путем слежения за остро изображаемым фокальным срезом в сканирующей схеме (с временны́м разрешением миллисекунды) или путем полного ХYZ-скана (с временным разрешением единицы минут).
При построении схем рентгеновского микроскопа впервые предложена гибридная схема транспортировки пучка до образца, включающая оптику Брэгга–Френеля и зеркальную оптику, которая позволяет работать с пучками рентгеновского излучения малых размеров.
Проведенные расчеты показывают, что во всем диапазоне разрешений, которые обеспечивает мягкая рентгеновская микроскопия, благодаря уникальному абсорбционному контрасту между протеинами и водой можно изучать даже живые образцы с разрешением до 10 нм (для клеток растений), а замороженные – с разрешением до 5 нм в сканирующей схеме и до 8 нм в проекционной схеме.
Ожидаем, что работы на станции позволят найти новые ниши для микроскопии в “окне прозрачности воды”, а также позволят продвинуться в разрешении и скорости проведения исследований по сравнению с аналогичными микроскопами, установленными на синхротронах.
Список литературы
Hanssen E., Knoechel C., M. Dearnley M. et al. // J. Struct. Biol. 2012. V. 177. № 2. P. 224. https://doi.org/10.1016/j.jsb.2011.09.003
Kirz J. // Q. Rev. Biophys. 1995 V. 28. P. 33. https://doi.org/10.1017/s0033583500003139
Eltsov M., Grewe D., Lemercier N. et al. // Nucl. Acids Res. 2018. V. 46. № 17. P. 9189. https://doi.org/10.1093/nar/gky670
Hell S.W., Wichmann J. // Opt. Lett. 1994. V. 19. № 11. P. 780. https://doi.org/10.1364/OL.19.000780
Späth A., Schöll S., Riess C. et al. // Ultramicroscopy. 2014. V. 144. P. 19. https://doi.org/10.1016/j.ultramic.2014.04.004
Vila-Comamala J., Jefimovs K., Raabe J. et al. // Ultramicroscopy. 2009. V. 109. № 11. P. 1360. https://doi.org/10.1016/j.ultramic.2009.07.005
Späth A., Raabe J., Fink R.H. // J. Synchr. Radiat. 2015. V. 22. № 1. P. 113. https://doi.org/10.1107/S1600577514022322
Kotani Y., Senba Y., Toyoki K. et al. // J. Synchr. Radiat. 2018. V. 25. № 5. P. 1444. https://doi.org/10.1107/S1600577518009177
Takman P.A.C., Stollberg H., Johansson G.A. et al. // J. Microscopy. 2007. V. 226. № 2. P. 175. https://doi.org/10.1111/j.1365-2818.2007.01765.x
Larabell C.A., Le Gros M.A. // Mol. Biol. Cell. 2004. V. 15. № 3. P. 957. https://doi.org/10.1091/mbc.E03-07-0522
Малышев И.В., Пестов А.Е., Полковников В.Н. и др. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2019. № 1. С. 3. https://doi.org/10.1134/S0207352819010128
Schneider G., Guttmann P., Heim S. et al. // Nat. Methods. 2010. V. 7. Iss. 12. P. 985. https://doi.org/10.1038/nmeth.1533
Chkhalo N.I., Malyshev I.V., Pestov A.E. et al. // Appl. Opt. 2016. V. 55. № 3. P. 619. https://doi.org/10.1364/AO.55.000619
Turkot B. // Proc. SPIE. 2016. V. 9776. P. 977602. https://doi.org/10.1117/12.2225014
Pirati A., v. Schoot J., Troost K. et al. // Proc. SPIE. 2017. V. 10143. P. 101430G. https://doi.org/10.1117/12.2261079
Gullikson E.M., Salmassi F., Aquila A.L., Dollar F. Lawrence Berkeley National Laboratory: Berkeley, CA, USA, 2006. http://escholarship.org/uc/item/8hv7q0hj (accessed on 20 June 2008).
Jingtao Z., Haochuan L., Hongchang W. et al. PXRNM workshop-2016, 2016. https://www.utwente.nl/en/tnw/xuv/workshops/archive/ pxrnm-workshop-2016/program/pxrnms-2016-abstracts-poster-presentations.pdf.
Burcklen C., de Rossi S., Meltchakov E. et al. // Opt. Lett. 2017. V. 42. № 10. P. 1927. https://doi.org/10.1364/OL.42.001927
Andreev S.S., Bibishkin M.S., Chkhalo N.I. et al. // J. Synchr. Radiat. 2003. V. 10. Iss. 5. P. 358. https://doi.org/10.1107/S0909049503015255
Bibishkin M.S., Chkhalo N.I., Fraerman A.A. et al. // Nucl. Instrum. Methods Phys. Res. A. 2005. V. 543. № 1. P. 333. https://doi.org/10.1016/j.nima.2005.01.251
Akhsakhalyan A.D., Kluenkov E.B., Lopatin A.Ya. et al. // J. Surf. Invest.: X-ray, Synchrotron Neutron Tech. 2017. V. 11. № 1. P. 1. https://doi.org/10.1134/S1027451017010049
Полковников В.Н., Гарахин С.А., Квашенников Д.C., Малышев И.В., Салащенко Н.Н., Свечников М.В., Смертин Р.М., Чхало Н.И. // ЖТФ. 2020. V. 90(11), P. 1893.
Chkhalo N.I., Malyshev I.V., Pestov A.E. et al. // Physics-Uspekhi. 2020. V. 63. № 1. P. 67. https://doi.org/10.3367/UFNe.2019.05.038601
http://www.eurotek-general.ru/products/systems_pi/ multicoordinate/p-561-p-562-p-563-pimars/"\l “ad- image-0
Schelokov I.A., Roshchupkin D.V., Kondakov A.S. et al. // Optics Commun. 1999. V. 159. № 4–6. P. 278. https://doi.org/10.1016/S0030-4018(98)00598-7
Schneider G., Niemann B. // X-ray Sci. 1994. V. 2. P. 8.
Gilbert J.R. Soft X-Ray Microimaging of Whole Wet Cells. PhD thesis, California Institute of Technology, Pasadena, California, 1992.
Chkhalo N.I., Malyshev I.V., Pestov A.E., Polkovnikov V.N., Reunov D.G., Salashchenko N.N., Shchelokov I.A. X-ray Optical Scheme for Station “Nanoscope” for Biological Research in the Water Window. Synchrotron and Free Electron Laser Radiation: Generation and Application (SFR-2020). https://doi.org/10.1063/5.0031702
Малышев И.В., Реунов Д.Г., Чхало Н.И. и др. // Матер. XXVI Междунар. симп. “Нанофизика и наноэлектроника”. Нижний Новгород, 14–17 марта 2022. Т. 1. С. 562.
Sage D., Donati L., Soulez F. et al. // Methods-Image Processing for Biologists. 2017. V. 115. P. 28. https://doi.org/10.1016/j.ymeth.2016.12.015
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования