Расплавы, 2021, № 5, стр. 469-481
Термодинамические свойства расплавов бинарной системы Al–Y
И. О. Гилев a, *, А. Б. Шубин a, П. В. Котенков a
a Институт металлургии Уральского отделения РАН
Екатеринбург, Россия
* E-mail: i.o.gilev@yandex.ru
Поступила в редакцию 28.04.2021
После доработки 03.06.2021
Принята к публикации 07.06.2021
Аннотация
Изучены термодинамические характеристики расплавов системы алюминий–иттрий. Проведен анализ и расчет термодинамических свойств (${{\Delta }_{f}}H_{{298}}^{0}$, $S_{{298}}^{0}$, ($H_{{298}}^{0} - H_{{{\text{\;}}0}}^{0}$), cp(T) и cp(liq)) соединений Al3Y, Al2Y, AlY, Al2Y3, AlY2. Значения стандартных энтальпий образования интерметаллидов были рассчитаны на основе полуэмпирической модели Миедема, и составили –49.4, –60, –63.4, –55, ‒46.5 кДж/моль ⋅ ат. для каждого из интерметаллидов, соответственно. Результаты расчетов были использованы при термодинамическом моделировании (ТМ) расплавов системы Al–Y. В качестве расчетного инструмента при ТМ применялся программный комплекс “TERRA”. При моделировании состава и термодинамических характеристик расплавов в качестве расчетной была использована модель идеальных растворов продуктов взаимодействия (ИРПВ). На основе данной модели была изучена термодинамика жидких растворов в системе алюминий–иттрий. Моделирование проводилось в исходной среде аргона при общем давлении 105 Па. Исследована область температур и составов, соответствующая жидкому состоянию данной системы (1900–2100 К). Сопоставление полученных результатов с результатами моделирования в приближении идеального раствора, позволило определить избыточные интегральные термодинамические характеристики расплавов данной системы (энтальпия, энтропия, энергия Гиббса). Показано, что энтальпии смешения закономерно уменьшаются по абсолютному значению с ростом температуры. Найденные значения сравнивались с известными экспериментальными данными интегральных энтальпий смешения для расплавов системы Al–Y. Склонность к наиболее сильному взаимодействию компонентов во всей области концентраций демонстрируют данные, полученные на основе расчетных методов, использованных в настоящей работе. При этом значение интегральной энтальпии смешения достигает –59.6 кДж/моль. Полученные в результате ТМ энергетические кривые проходят через экстремум при XY = 0.46, состав в данной точке близок к составу интерметаллида AlY. Экспериментальные данные, свидетельствуют о более слабом взаимодействии компонентов, экстремум расположен на уровне –49.6 кДж/моль. Полученные в работе данные находятся в удовлетворительном соответствии с экспериментальными, использованная при ТМ модель ИРПВ позволила адекватно описать термодинамические свойства расплава алюминий–иттрий.
ВВЕДЕНИЕ
Исследование термодинамических свойств сплавов редкоземельных элементов (РЗМ, R) c легкоплавкими p-металлами (Me) предъявляет ряд жестких требований к экспериментальному оборудованию [1–5]. Эти сплавы обладают уникальными физико-химическими характеристиками и представляют интерес для различных отраслей промышленности. В частности, подобные сплавы могут применяться при создании систем замкнутого топливного цикла в атомной промышленности [6, 7]. Изучение термохимических свойств металлических систем дает важные представления о взаимодействии входящих в их состав компонентов, что позволяет решать задачи синтеза и использования сплавов на их основе [8–12]. Наиболее изученными с точки зрения термохимии являются твердые, а также жидкие двухфазные сплавы R–Me. В то же время, экспериментальные данные по теплотам смешения этих систем весьма ограничены. Кроме того, в ряде литературных источников наблюдаются значительные систематические расхождения термодинамических данных, что требует тщательного анализа: уточнения, обобщения и систематизации представленных результатов. В связи с этим, в некоторых случаях становится необходимым применение расчетных методов, в частности различных полуэмпирических моделей, например, модель Миедемы [13–16], ИРПВ [17, 18], Викса–Чандлера–Андерсона (WCA) [19] и другие. Указанные модели могут быть использованы для оценки и сравнения данных различных групп исследователей, а также для расчетов при недостаточности экспериментальных данных по отдельным системам R–Me.
Повышенный интерес к бинарным системам Al–R связан (помимо изложенного выше) с возможным практическим применением получаемых на основе этих сплавов нанокристаллических и аморфных материалов [20–22]. Термодинамические характеристики систем Al–R в твердом состоянии подробно изучены в работах [23–26], однако их свойства в жидком состоянии сравнительно мало исследованы (имеются скудные данные по сплавам отдельных систем и составов). Это обусловливает необходимость проведения критической оценки термохимических свойств фаз и изучения термодинамически жидких растворов Al–РЗМ.
Данная работа направлена на изучение термодинамических свойств расплавов бинарной системы Al–Y во всем концентрационном интервале на основе модели идеальных растворов продуктов взаимодействия (ИРПВ), частного случая модели ассоциированных растворов Пригожина и Дефея [27]. Моделирование проводилось с использованием отечественного программного комплекса “TERRA” [28], содержащего в своей базе данных множество полиномов, описывающих температурную зависимость приведенной энергии Гиббса наиболее распространенных веществ.
РАСЧЕТ ТЕРМОДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК
В качестве основы была использована диаграмма состояния бинарной системы Al–Y, предложенная в работе [29], полученная и оптимизированная с учетом наиболее современных данных. В соответствии с фазовой диаграммой в данной системе образуется пять интерметаллидов: Al3Y, Al2Y, AlY, Al2Y3 и AlY2. Соединения Al2Y и Al2Y3 плавятся конгруэнтно при 1764 и 1377 К, соответственно. Остальные интерметаллиды формируются по перитектическим реакциям: Al3Y при температуре 1251 К, AlY при 1402 К и AlY2 при 1246 К.
Для оценки полного комплекса термохимических характеристик системы Al–Y, предварительно был произведен расчет термодинамических свойств индивидуальных веществ и продуктов их взаимодействия: стандартная энтальпия образования при 298.15 К (${{\Delta }_{f}}H_{{298}}^{0}$); стандартная энтропия при 298.15 К ($S_{{298}}^{0}$); изменение энтальпии при нагреве вещества от 0 до 298.15 К ($H_{{298}}^{0} - H_{{{\text{\;}}0}}^{0}$); температура перехода вещества из твердого состояния в жидкое (Tф.п); энтальпия плавления вещества (ΔHф.п); зависимость удельной теплоемкости от температуры (cp(T)) при давлении p = 0.1 МПа – const; а так же cp(liq) при Т > Tф.п. Для металлических Al и Y описанный набор величин содержится в базе данных TERRA и совпадает со справочными значениями.
Величины ${{\Delta }_{f}}H_{{298}}^{0}$ были рассчитаны на основе полуэмпирической модели Миедема [13]. Несмотря на то, что использованная модель позволяет описывать системы R–Me с доверительным интервалом для каждого отдельного значения приблизительно ±13 кДж/г ⋅ ат. [30], что превышает случайную погрешность экспериментального определения ${{\Delta }_{f}}H_{{298}}^{0}$, она применима для оценочных расчетов и при анализе сильно различающихся опытных данных [30]. Согласно [13], стандартная энтальпия образования рассчитана по уравнению (1):
(1)
${{\Delta }_{f}}H_{{298}}^{0} = f(C_{{{\text{Al}}}}^{{\text{S}}},{\kern 1pt} {\kern 1pt} C_{{\text{Y}}}^{{\text{S}}}) \cdot g\left( {{{C}_{{{\text{Al}}}}},{\kern 1pt} {\kern 1pt} {{C}_{{\text{Y}}}}} \right) \cdot F \cdot P \cdot \left[ { - {\kern 1pt} {{{\left( {\Delta \varphi {\text{*}}} \right)}}^{2}} + {\text{\;}}\frac{{{{Q}_{0}}}}{P}{\text{\;}}{{{\left( {\Delta n_{{{\text{WS}}}}^{{\frac{1}{3}}}} \right)}}^{2}} - \frac{R}{P}} \right],\,\,({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}{\kern 1pt} {\kern 1pt} \cdot {\kern 1pt} {\kern 1pt} {\text{ат}}{\text{.}}){\kern 1pt} ,$Поверхностные концентрации Al и Y в интерметаллиде были вычислены из зависимостей (2) и (3) соответственно:
(2)
$C_{{{\text{Al}}}}^{{\text{S}}} = {\text{\;}}\frac{{{{C}_{{{\text{Al}}}}} \cdot V_{{{\text{Al}}}}^{{\frac{2}{3}}}{\text{\;}}}}{{\left( {{{C}_{{{\text{Al}}}}} \cdot V_{{{\text{Al}}}}^{{\frac{2}{3}}} + {{C}_{{\text{Y}}}} \cdot V_{{\text{Y}}}^{{\frac{2}{3}}}{\text{\;}}} \right)}},$(3)
$C_{{\text{Y}}}^{{\text{S}}} = {\text{\;}}\frac{{{{C}_{{\text{Y}}}} \cdot V_{{\text{Y}}}^{{\frac{2}{3}}}{\text{\;}}}}{{\left( {{{C}_{{{\text{Al}}}}} \cdot V_{{{\text{Al}}}}^{{\frac{2}{3}}} + {{C}_{{\text{Y}}}} \cdot V_{{\text{Y}}}^{{\frac{2}{3}}}{\text{\;}}} \right)}},$Функции концентраций были рассчитаны из следующих уравнений (4) и (5):
(4)
$f(C_{{{\text{Al}}}}^{{\text{S}}},C_{{\text{Y}}}^{{\text{S}}}) = C_{{{\text{Al}}}}^{{\text{S}}} \cdot C_{{\text{Y}}}^{{\text{S}}} \cdot \left[ {1 + 8 \cdot {{{(C_{{{\text{Al}}}}^{{\text{S}}} \cdot C_{{\text{Y}}}^{{\text{S}}})}}^{2}}} \right],$(5)
$g\left( {{{C}_{{{\text{Al}}}}},{{C}_{{\text{Y}}}}} \right) = {\text{\;}}\frac{{2 \cdot \left( {{{C}_{{{\text{Al}}}}} \cdot V_{{{\text{Al}}}}^{{\frac{2}{3}}}{\text{\;}} + {\text{\;}}{{C}_{{\text{Y}}}} \cdot V_{{\text{Y}}}^{{\frac{2}{3}}}{\text{\;}}} \right){\text{\;}}}}{{\left( {V_{{{\text{Al}}}}^{{\frac{2}{3}}} + V_{{\text{Y}}}^{{\frac{2}{3}}}} \right)}}.$(6)
${{n}_{{{\text{WS}}}}} = {{\left[ {{{{\left( {\frac{B}{{{{V}_{{{\text{Mе}}}}}}}} \right)}}^{{\frac{1}{2}}}} \cdot {{{10}}^{{ - 2}}}} \right]}^{{\frac{1}{3}}}},\,\,{{({\text{ед}}{\text{. пл}}{\text{.}})}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}},$Значения параметров, рассчитанных для чистых компонентов, приведены в табл. 1 .
Таблица 1.
Значения параметров $V_{{{\text{Мe}}}}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}$, $n_{{{\text{ws}}}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}$, φ * и $\frac{R}{P}$
| Металл | $V_{{{\text{Me}}}}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}$, см2 | $n_{{{\text{ws}}}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}$, (ед. пл.)1/3 | φ*, В | $\frac{R}{P}$, В2 |
|---|---|---|---|---|
| Al | 4.6 | 1.39 | 4.2 | 0 |
| Y | 7.36 | 1.22 | 3.2 | – |
Подставляя полученные значения в ур. (1), были вычислены стандартные энтальпии образования интерметаллидов в системе Al–Y. Результаты расчетов, а так же экспериментально измеренные значения ${{\Delta }_{f}}H_{{298}}^{0}$ представлены в табл. 2 .
Таблица 2.
Стандартные энтальпии образования(${{\Delta }_{f}}H_{{298}}^{0}$) интерметаллических соединений в системе алюминий–иттрий
Экспериментальные данные из источников [32, 33] (дифференциальная сканирующая калориметрия) и [34] (высокотемпературный изопериболический Кальве-калориметр) демонстрируют хорошую согласованность между собой для соединений Al2Y и Al2Y3. Однако для остальных ИМС значения ${{\Delta }_{f}}H_{{298}}^{0}$ не приведены. Величины, полученные в работе [35] (метод измерения ЭДС) значительно отличаются от калориметрических данных. Наличие “пробелов” и большой разброс экспериментальных значений, ограничивают их использование для дальнейших расчетов. Таким образом, для дальнейшего анализа были приняты данные, рассчитанные в настоящей работе на основе модели Миедемы, адаптированной для данной группы сплавов.
На рис. 1 приведены опытные и принятые нами величины энтальпий образования интерметаллидов.
Рис. 1.
Стандартные энтальпии образования интерметаллидов: экспериментальные данные (точки), рассчитанные значения (сплошная линия).
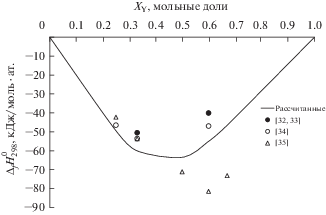
Можно наблюдать, что большинство экспериментальных величин попадают в доверительный интервал значений ${{\Delta }_{f}}H_{{298}}^{0}$, полученных при описании системы на основе модели Миедемы (при одинаковых концентрациях Y). Это подтверждает корректность принятых для анализа значений.
Дальнейшая оценка проводилась при помощи расчетных методик, подробно изложенных в работах [36, 37], в соответствии с которыми:
1) Величина $S_{{298}}^{0}$ может быть представлена как аддитивная сумма энтропий составляющих систему исходных компонентов;
2) Для определения значения $H_{{298}}^{0} - ~H_{{{\text{\;}}0}}^{0}$ возможно применение уравнения (7):
где $c_{{p298}}^{0}$ – удельная теплоемкость при постоянном давлении (p – const) и температуре 298.15 K (рассчитывается аддитивно).3) Величина ΔHф.п была оценена на основе соотношения (8):
(8)
$\Delta {{H}_{{{\text{ф}}.{\kern 1pt} {\text{п}}}}}{\text{\;}} = {{T}_{{{\text{ф}}.{\kern 1pt} {\text{п}}}}} \cdot \Delta {{S}_{{{\text{ф}}.{\kern 1pt} {\text{п}}}}}.$(9)
$\Delta {{S}_{{{\text{ф}}{\text{.}}{\kern 1pt} {\text{п}}}}} \approx \mathop \sum \limits_i {{N}_{i}} \cdot \Delta {{S}_{{{\text{пл}}}}}({\text{M}}{{{\text{e}}}_{i}}),$4) Для определения температурной зависимости удельной теплоемкости применимо правило Нейманна–Коппа. Зависимость cp(T) была представлена в виде стандартного полинома (10):
(10)
${{c}_{p}}(T) = a + by + c{{y}^{2}} + d{{y}^{3}} + e \cdot {{10}^{5}}{{T}^{{ - 2}}},\,\,\,\,y = T \cdot {{10}^{{ - 3}}}$5) cp(liq) при Т > Tф.п рассчитывали по уравнению (11) из [36]:
(11)
${{c}_{p}}({\text{liq}}) \approx ({{c}_{p}}({\text{cr}}) + ({1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}) \cdot \Delta {{S}_{{{\text{пл}}}}}),\,\,{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {({\text{моль}} \cdot {\text{K}}),}}} \right. \kern-0em} {({\text{моль}} \cdot {\text{K}}),}}$Термохимические свойства соединений системы Al–Y, принятые для дальнейших расчетов, приведены в табл. 3.
Таблица 3.
Термохимические свойства соединений системы Al–Y
| ИМС | $ - {{\Delta }_{f}}H_{{298}}^{0}$, кДж/моль | $S_{{298}}^{0}$, Дж/моль ⋅ K | $H_{{298}}^{0} - H_{0}^{0}$, Дж/моль | Тф.п, K | ΔHф.п, Дж/моль | cp(T) = a + by + cy2 + dy3 + e ⋅ 105T–2, y = T ⋅ 10–3 |
cp(liq) при T > Tпл, Дж/моль ⋅ K | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| a | b | c | d | e | |||||||
| Al3Y | 197.6 | 129.48 | 14 845 | 1251 | 50 869 | 89.62 | –2.02 | 107.12 | –66.18 | 2.61 | 135.4 |
| Al2Y | 180 | 101.13 | 11 215 | 1764 | 51 512 | 20.42 | 161.87 | –117.47 | 29.31 | 14.6 | 109.0 |
| AlY | 126.8 | 72.78 | 7584 | 1402 | 24 873 | 22.11 | 84.47 | –57.92 | 14.18 | 7.52 | 70.6 |
| Al2Y3 | 275 | 189.99 | 19 122 | 1377 | 57 506 | 82.73 | 128.48 | –61.44 | 8.08 | 11.24 | 175.3 |
| AlY2 | 139.5 | 117.21 | 11 538 | 1246 | 29 930 | 69.7 | 12.04 | 35.69 | –22.05 | 1.39 | 103.5 |
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
При термодинамическом моделировании была использована модель ИРПВ. В соответствии с данной моделью, состав содержащихся в растворе ассоциатов тождествен составу реально существующих соединений в соответствии с фазовой диаграммой [18]. Избыточные термодинамические функции расплава могут быть вычислены при сравнении результатов с применением модели ИРПВ и результатами моделирования в приближении идеального раствора (ИР) [18, 38].
Моделирование выполнено в атмосфере аргона при общем давлении системы p = = 105 Па, при температурах от 1900 до 2100 К, в интервале концентраций 0 ≤ xY ≤ 1, где xY – исходное содержание иттрия в расплаве. В соответствии с фазовой диаграммой, в изученном температурном интервале система Al–Y находится в жидком состоянии. При моделировании учитывали термодинамические функции следующих элементов и соединений: газообразных Al, Al2, Y, Ar, а так же конденсированных Al, Y, Al3Y, Al2Y, AlY, Al2Y3 и AlY2. В состав идеального раствора были включены только чистые алюминий и иттрий. В модели ИРПВ наряду с Al и Y в состав раствора были включены ассоциаты, соответствующие соединениям Al3Y, Al2Y, AlY, Al2Y3 и AlY2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
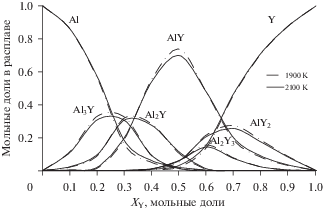
На рис. 2 приведены концентрационные зависимости составляющих расплава Al–Y при температурах 1900 и 2100 К по результатам термодинамического моделирования. При повышении температуры количество атомов алюминия и иттрия в расплаве увеличивается, а содержание ассоциатов снижается. Согласно диаграмме состояния максимальные концентрации ассоциатов YmAln соответствуют составу отвечающих им интерметаллидов.
Рис. 2.
Концентрационные зависимости составляющих расплавов системы Al–Y в модели ИРПВ: при Т = 1900 (–.–.–) и 2100 К (—).
Интегральные избыточные энтальпия ($\Delta H_{{{\text{инт}}}}^{{{\text{изб}}}}$) и энтропия ($\Delta S_{{{\text{инт}}}}^{{{\text{изб}}}}$) смешения, были найдены из данных термодинамического моделирования по ур. (12) и (13) соответственно, как разность величин, рассчитанных в модели ИРПВ и ИР:
Интегральная избыточная энергия Гиббса была рассчитана по ур. (14):
(14)
$\Delta G_{{{\text{инт}}}}^{{{\text{изб}}}} = {\text{\;}}\Delta H_{{{\text{инт}}}}^{{{\text{изб}}}} - T\Delta S_{{{\text{инт}}}}^{{{\text{изб}}}}.$В табл. 4 приведены расчетные данные об избыточных функциях системы Al–Y при температурах 1900, 2000 и 2100 К.
Таблица 4.
Зависимость избыточных интегральных термодинамических функций от температуры и состава в системе Al–Y
| XY | 1900 К | 2000 К | 2100 К | ||||||
|---|---|---|---|---|---|---|---|---|---|
| $ - \Delta H_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | $ - \Delta G_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | $ - \Delta S_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль ⋅ K |
$ - \Delta H_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | $ - \Delta G_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | $ - \Delta S_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль ⋅ K |
$ - \Delta H_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | $ - \Delta G_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль | $ - \Delta S_{{{\text{инт}}}}^{{{\text{изб}}}}$, Дж/моль ⋅ K |
|
| 0.1 | 18 679 | 18 686 | –0.01 | 18 616 | 18 689 | –0.04 | 18 551 | 18 694 | –0.07 |
| 0.2 | 36 789 | 35 394 | 0.73 | 36 615 | 35 326 | 0.64 | 36 440 | 35 265 | 0.56 |
| 0.3 | 49 908 | 46 752 | 1.66 | 49 666 | 46 592 | 1.54 | 49 429 | 46 444 | 1.42 |
| 0.4 | 56 786 | 51 961 | 2.54 | 56 518 | 51 714 | 2.40 | 56 244 | 51 480 | 2.27 |
| 0.5 | 59 619 | 53 127 | 3.42 | 59 282 | 52 794 | 3.24 | 58 946 | 52 479 | 3.08 |
| 0.6 | 54 710 | 49 556 | 2.71 | 54 654 | 49 287 | 2.68 | 54 581 | 49 019 | 2.65 |
| 0.7 | 42 714 | 40 201 | 1.32 | 42 738 | 40 067 | 1.34 | 42 759 | 39 932 | 1.35 |
| 0.8 | 28 919 | 27 943 | 0.51 | 28 948 | 27 892 | 0.53 | 28 975 | 27 838 | 0.54 |
| 0.9 | 14 576 | 14 342 | 0.12 | 14 595 | 14 329 | 0.13 | 14 613 | 14 316 | 0.14 |
В соответствии с табл. 4, энтальпия смешения и энергия Гиббса закономерно уменьшаются по абсолютному значению с ростом температуры. Высокие по модулю значения $\Delta G_{{{\text{инт}}}}^{{{\text{изб}}}}$ свидетельствуют о сильном взаимодействии компонентов расплава. На рис. 3 показаны зависимости интегральной избыточной энергии Гиббса от концентрации и температуры.
Рис. 3.
Интегральная избыточная энергия Гиббса в системе алюминий–иттрий при различных температурах: T = 1900 (—), 2000 (–·–·–), 2100 K (···).
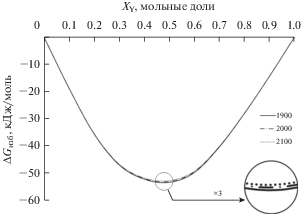
Все кривые на рис. 3 проходят через экстремум при XY = 0.46, состав в данной точке близок к составу интерметаллида AlY. Полученный результат согласуется с данными термодинамического моделирования (рис. 2): содержание ассоциата AlY в расплаве максимально, а значит и его образование вносит наибольший вклад в энергетику. Тем не менее, присутствие других ассоциатов оказывает влияние на энергию, поэтому минимум оказывается незначительно сдвинутым относительно данной точки в сторону меньшей концентрации иттрия. Из рис. 2 следует, что влияние температуры на изменение энергии Гиббса и энтальпии незначительно.
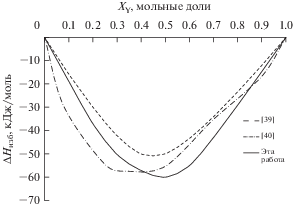
На рис. 4 представлены зависимости интегральных энтальпий смешения (ΔHmix) от концентрации компонентов в системе Al–Y, рассчитанные в данной работе, в сравнении с экспериментальными данными [39, 40].
Показано, что образование жидких сплавов данной системы сопровождается значительным выделением тепла. Так как влияние температуры на ΔHmix незначительно, следует заключить, что склонность к наиболее сильному взаимодействию компонентов в системе Al–Y во всей области концентраций демонстрируют данные, полученные на основе расчетных методов, использованных в настоящей работе. При этом значение интегральной энтальпии смешения достигает –59.6 кДж/моль. Экспериментальные данные, полученные в работе [39] методом высокотемпературной калориметрии смешения, свидетельствуют о более слабом взаимодействии компонентов, экстремум расположен на уровне –49.6 кДж/моль, однако он в большей степени оказывается смещенным относительно точки XY = 0.5 в область с меньшей концентрацией иттрия, по сравнению с данными ТМ. Согласно [3], значения энтальпий образования сплавов в ряду Sc–Y–La, полученные при помощи высокотемпературной калориметрии смешения, являются систематически заниженными, что согласуется с результатами расчетов, полученными в настоящей работе. Данные масс-спектрометрических измерений энтальпий сплавообразования [40], заметно отличаются от калориметрических, при этом значение интегральной энтальпии смешения достигает –57.1 кДж/моль, что на 4.2% ниже (по модулю) результатов ТМ. Однако кривая энтальпии смешения, в данном случае, не имеет ярко выраженного максимума. Кроме того, не трудно заметить, что в результате ее сглаживания максимум, как и в случае с данными [39], оказался бы в большей степени сдвинут относительно точки XY = 0.5, в область с меньшей концентрацией иттрия, по сравнению с результатами ТМ. Тем не менее, полученные в результате ТМ значения интегральных энтальпий смешения находятся в удовлетворительном соответствии с экспериментальными данными. В работе [41] проводилось исследование расплавов системы Al–Y методами ТМ. Концентрационные зависимости интегральной энергии Гиббса и энтальпии смешения имели вид немонотонных кривых с экстремумом при XAl = 0.5, что хорошо согласуется с результатами, полученными в настоящей работе. Так, модель ИРПВ позволила адекватно описать термодинамические свойства расплава алюминий–иттрий.
ЗАКЛЮЧЕНИЕ
В результате литературного анализа на основе полуэмпирической модели Миедемы, адаптированной для данной группы сплавов, были рассчитаны стандартные энтальпии образования интерметаллидов в системе Al–Y. Проведена оценка термодинамических свойств интерметаллидов Al3Y, Al2Y, AlY, Al2Y3 и AlY2. Полученные значения использовались при термодинамическом моделировании равновесных составов и термохимических свойств сплавов алюминий–иттрий в области выше линии ликвидус (1900–2100 К). Определены концентрационные и температурные зависимости компонентов расплава Al–Y, интегральные характеристики смешения, а также состав расплавов по модели ИРПВ. Показано, что образование жидкого сплава системы Al‒Y сопровождается значительным выделением тепла (ΔHmix = –59 619 Дж/моль при T = 1900 К). Полученные в результате ТМ значения интегральных энтальпий смешения находятся в удовлетворительном соответствии с экспериментальными данными. Энергетические кривые проходят через экстремум при XY = 0.46, состав в данной точке близок к составу интерметаллида AlY. Таким образом, использованная при ТМ модель ИРПВ позволила адекватно описать термодинамические свойства расплава алюминий–иттрий.
Работа выполнена в рамках государственного задания ИМЕТ УрО РАН с использованием оборудования ЦКП “Урал-М”.
Список литературы
Meschel S.V., Kleppa O.J. // J. Alloys Compd. 1993. 191. P. 111–116. https://doi.org/10.1016/0925-8388(93)90280-Z
Jung W.-G., Kleppa O.J., Topor L. // J. Alloys Compd., 1991. 176. P. 309–318. https://doi.org/10.1016/0925-8388(91)90039-X
Лебедев В.А., Ямщиков В.И., Ямщиков Л.Ф. Термохимия сплавов редкоземельных и актиноидных элементов. Челябинск: Металлургия. 1989.
Semari F., Boulechfar R., Dahmane F., Abdiche A., Ahmed R., Naqib S.H., Bouhemadou A., Khenata R., Wang X.T. // Inorganic Chemistry Communications. Available online 22 October 2020, 108304. https://doi.org/10.1016/j.inoche.2020.108304
Kanibolotsky D.S., Bieloborodova O.A., Lisnyak V.V. // Thermochimica Acta. 2005. 437. № 1–2. P. 62–66. https://doi.org/10.1016/j.tca.2005.06.015
Kubaschewski O. Review of alloy Thermodynamics // Thermodynamics of Nuclear Materials, IAEA, Vienna. 1968. P. 685–698.
Bowergox D.F., Reavis J.G., Mullins L.J. et al. Pyrochemical processing of plutonium and reactor fuels // Int. Conf. Nucl. and Radiochem., Linday, 1984. P. 86–92.
Yadav S.K., Lamichhane S., Jha L.N., Adhikari N.P., Adhikari D. // Physics and Chemistry of Liquids. 2016. 54. P. 370–383. https://doi.org/10.1080/00319104.2015.1095640
Dubinin N.E., Vatolin N.A. // Doklady Physics, 2016. 61. P. 527–530. https://doi.org/10.1134/S1028335816110033
Dubinin N.E. // Acta Physica Polonica A, 2017. 131. P. 237–239. https://doi.org/10.12693/APhysPolA.131.237
Trybula M.E., Szafran’ski P.W., Korzhavyi P.A. // J. Mater. Sci. 2018. 53. P. 8285–8301. https://doi.org/10.1007/s10853-018-2116-8
Son L.D., Ryltsev R.E., Sidorov V.E. // J. Non-Cryst. Solids. 2007. 353. P. 3722–3726. https://doi.org/10.1016/j.jnoncrysol.2007.05.137
Miedema A.R., Boom R., De Boer F.R. // Journal of the Less Common Metals. 1975. 41. № 2. P. 283–298. https://doi.org/10.1016/0022-5088(75)90034-X
Miedema R. // Journal of the Less Common Metals. 1976. 46. № 1. P. 67–83. https://doi.org/10.1016/0022-5088(76)90180-6
Miedem A.R., De Boer F.R. // Calphad. 1977. 1. № 4. P. 341–359. https://doi.org/10.1016/0364-5916(77)90011-6
Boom R., De Boer F.R., Miedema A.R. // J. Less Common Metals. 1976. 45. № 2. P. 237–245. https://doi.org/10.1016/0022-5088(76)90270-8
Ватолин Н.А., Моисеев Г.К., Трусов Б.Г. Термодинамическое моделирование в высокотемпературных неорганических системах. М.: Металлургия. 1994.
Моисеев Г.К., Вяткин Г.П. Термодинамическое моделирование в неорганических системах. Челябинск: Изд-во ЮурГУ. 1999.
Ueda S., Morita K. // Journal of Non-Crystalline Solids, 2020. (in press). https://doi.org/10.1016/j.jnoncrysol.2019.119743
Rachek O.P. // Journal of Non-Crystalline Solids. 2006. 352. № 36–37. P. 3781–3786. https://doi.org/10.1016/j.jnoncrysol.2006.05.031
Cuevas F.G., Lozano-Perez S., Aranda R.M., Ternero F. // Journal of Non-Crystalline Solids. 2019. 512. P. 15–24. https://doi.org/10.1016/j.jnoncrysol.2019.02.013
Yongzhi Zh., Gao H., Kuai Y., Han Y., Wang J., Sun B., Gu S., You W. // Materials Characterization. 2013. 86. P. 1–8. https://doi.org/10.1016/j.matchar.2013.09.004
Cacciamani G., Riani P., Borzone G. et al. // Intermetallics. 1999. 7. P. 101–118. https://doi.org/10.1016/S0966-9795(98)00022-3
Пягай И.Н., Вахобов А.В. Энтальпии образования алюминидов в системе Al–Sc // Металлы. 1990. № 5. С. 55–56.
Бодряков В.Ю., Замятин В.М., Московских О.П. и др. Энтальпия и теплоемкость многокомпонентных алюминиевых сплавов в твердом и жидком состояниях // Расплавы. 1997. № 3. С. 3–9.
Ryltsev R.E., Son L.D. // Physica B. 2011. 406. P. 3625–3630. https://doi.org/10.1016/j.physb.2011.06.056
Prigogine I., Defay R.: Chemical Thermodynamics. London: Longmans Green, 1954.
Белов Г.В., Трусов Б.Г. Термодинамическое моделирование химически реагирующих систем. М.: МГТУ имени Н.Э. Баумана, 2013.
Kang Y.B., Pelton A.D., Chartrand P., Fuerst C.D. // Calphad. 2008. 32. № 2. P. 413–422. https://doi.org/10.1016/j.calphad.2008.03.002
Shubin A.B., Shunyaev K.Yu., Kulikova T.V. // Russian Metallurgy. 2008. 5. P. 364–369. https://doi.org/10.1134/S0036029508050029
Шубин А.Б., Ямщиков Л.Ф., Распопин С.П. Оценка теплот образования сплавов редкоземельных и актиноидных элементов // Изв. ВУЗов. Цветная металлургия. 1986. № 4. С. 73–76.
Jung W.-G., Kleppa O.J., Topor L. // J. Alloys and Compounds. 1991. 176. № 2. P. 309–318. https://doi.org/10.1016/0925-8388(91)90039-X
Meschel S.V., Kleppa O.J. // J. of Alloys and Compounds, 1993. 191. № 1. P. 111–116. https://doi.org/10.1016/0925-8388(93)90280-Z
Timofeev V.S., Turchanin A.A., Zubkov A.A., Tomilin I.A. // Thermochimica Acta. 1997. 299. № 1–2. P. 37–41. https://doi.org/10.1016/S0040-6031(97)00134-2
Кобер В.И., Ничков И.Ф., Распопин С.П., Науман В.Н. Фазовый состав и термодинамические свойства соединений системы Y–Al // Изв. вузов. Цветная металлургия. 1979. № 5. С. 40–43.
Моисеев Г.К., Ватолин Н.А., Маршук Л.А., Ильиных Н.И. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных АСТРА.OWN). Екатеринбург: УрО РАН, 1997.
Моисеев Г.К., Ватолин Н.А. Некоторые закономерности изменения и методы расчета термохимических свойств неорганических соединений. Екатеринбург: Изд. УрО РАН, 2001.
Kulikova T., Mayorova A., Shubin A., Bykov V., Shunyaev K. // Kovové materiály – Metallic Materials. 2015. 53. № 3. P. 133–137. https://doi.org/10.4149/km_2015_3_133
Рысс Г.М., Есин Ю.О., Строганов А.И., Гельд П.В. Энтальпии образования жидких сплавов иттрия с алюминием // Журн. физич. химии. 1976. 50. № 4. С. 985–986.
Звиададзе Г.Н., Петров А.А., Казенас Е.К. Термодинамика металлических расплавов скандия, иттрия, лантана и неодима с алюминием // Тез. докл. IX Всес. конф. по калориметрии и химической термодинамике. Тбилиси. 1982. С. 356–357.
Упорова Н.С., Упоров С.А., Сидоров В.Е., Ильиных Н.И., Куликова Т.В. Магнитные свойства и состав расплавов Al–РЗМ // Материаловедение. 2011. № 11. С. 22–27.
Дополнительные материалы отсутствуют.