Расплавы, 2021, № 5, стр. 533-542
Летучести компонентов насыщенных паров расплавленных смесей UCl4–KCl и UCl4–NaCl
А. Б. Салюлев a, *, В. Я. Кудяков a, Н. И. Москаленко a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: salyulev@ihte.uran.ru
Поступила в редакцию 24.05.2021
После доработки 30.05.2021
Принята к публикации 20.06.2021
Аннотация
Измерены методом потока летучести компонентов насыщенных паров расплавленных смесей UCl4–KCl и UCl4–NaCl, содержащих 2, 5, 12, 25, 33 и 50 мол. % UCl4, в диапазоне температур 880–1300 K. Определен химический состав насыщенных паров. Сделан вывод о присутствии в паровой фазе двойных соединений наиболее вероятного состава NaUCl5 и KUCl5, вносящих существенный вклад в общее давление паров. Найдено, что исследованные расплавленные смеси имеют значительные отрицательные отклонения от идеального поведения, в сторону меньших летучестей тетрахлорида урана.
ВВЕДЕНИЕ
Растворы хлоридов урана в расплавленных хлоридах щелочных металлов могут быть использованы для получения и рафинирования металлического урана и его сплавов электролизом, а также в процессах регенерации отработавшего ядерного топлива. Летучесть является одним из важных параметров, определяющих течение этих высокотемпературных процессов и характеризующих переход того или иного компонента расплавленных смесей в паровую фазу в виде всех присущих ему газообразных соединений (например, UCl4, NaUCl5, KUCl5 в случае тетрахлорида урана).
Ранее нами была измерена летучесть компонентов расплавленных смесей UCl4–CsCl и UCl4–LiCl [1], а также UCl4–(NaCl–KCl, 1 : 1) [2]. Представляло интерес продолжить аналогичные исследования для растворов тетрахлорида урана в расплавах других хлоридов щелочных металлов с целью выявления общих закономерностей, тем более что в литературе данных по летучести компонентов этих солевых систем нет.
В настоящем сообщении приведены результаты экспериментальных исследований летучести компонентов и химического состава паров для расплавленных смесей UCl4–KCl и UCl4–NaCl в широких интервалах температур и концентраций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали хлориды натрия и калия марки “х. ч.”, тщательно осушенные [2]. Безводный тетрахлорид урана синтезировали хлорированием двуокиси урана тетрахлоридом углерода марки “ос. ч.” с последующей многократной дистилляцией полученного продукта [2–5]. Синтезированный таким путем хлорид урана представлял собой кристаллическую массу оливково-зеленого цвета, в которой атомное отношение Cl/U составляло 3.95. Соли, взятые в требуемых соотношениях, сплавляли в кварцевых пробирках в инертной атмосфере. Загрузку индивидуальных хлоридов и их плавов заданного состава в кварцевые приборы проводили в сухом боксе с P2O5 в атмосфере азота. Подробнее методика подготовки солей была описана ранее [2].
Летучести компонентов насыщенных паров расплавленных смесей UCl4–KCl и UCl4–NaCl определяли классическим методом переноса [6] с помощью кварцевого измерительного прибора по отработанной нами ранее методике [1, 2, 7, 8]. Измерения проводили в условиях, обеспечивающих термодинамическое равновесие между расплавленной солевой и паровой фазами, сведя к минимуму (не более 0.3–0.5%) вклад диффузионной составляющей в общий перенос паров из испарителя в конденсатор прибора [2, 6–9].
Для опытов брали достаточно большие навески плавов солей (по 20–40 г). В качестве газа-носителя использовали гелий марки “ос. ч.” дополнительно очищенный от следов кислорода и влаги. Скорость газового потока была в пределах 2.5 ⋅ 10–7–7 ⋅ 10–7 м3/с. Количество пропущенного газа-носителя определяли по объему вытесненной воды из газосборника. Ячейки с солями нагревали в электропечи сопротивления, снабженной массивным металлическим блоком. Температуру расплава, фиксируемую Pt/Pt–Rh термопарой, поддерживали постоянной при заданных значениях в пределах ±1 K. Детальное описание конструкции измерительной ячейки и методики проведения опытов дано в работах [1, 2, 7–9].
Конденсирующиеся пары солей накапливались в съемных кварцевых конденсаторах, которые взвешивали до и после опыта на аналитических весах АДВ-200М. Собранный конденсат паров смывали бидистиллированной водой и анализировали на содержание урана, натрия и калия. Уран находили весовым или фотоколориметрическим методом с арсеназо III в зависимости от количества возгонов и концентрации в них тетрахлорида, щелочной металл – по атомно-абсорбционным спектрам на спектрофотометре фирмы Perkin-Elmer, США. Ошибки определения урана и щелочных металлов, в зависимости от их содержания в конденсатах паров и применявшегося метода анализа, составляли от 2 до 10%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Установлено, что концентрация тетрахлорида урана в насыщенных парах рассматриваемых расплавленных бинарных смесей возрастает с температурой для большинства исследованных составов жидкой фазы. Только у наиболее концентрированных из них – с 50 мол. % UCl4 для расплава UCl4–KCl (рис. 1) и с 25, 33, 50 мол. % UCl4 для расплавов UCl4–NaCl (рис. 2) состав паров остается практически постоянным.
Рис. 1.
Изменение концентрации UCl4 в насыщенных парах в зависимости от состава расплавленных смесей UCl4–KCl при 973 (1), 1073 (2) и 1173 К (3); для идеального поведения смесей при 1073 К (4).
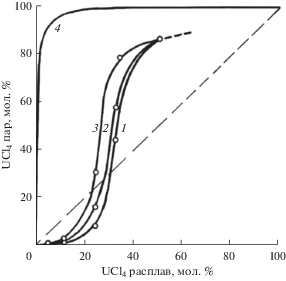
Рис. 2.
Изменение концентрации UCl4 в насыщенных парах в зависимости от состава расплавленных смесей UCl4–NaCl при 973 (1), 1073 (2) и 1173 К (3); для идеального поведения смесей при 1073 К (4).
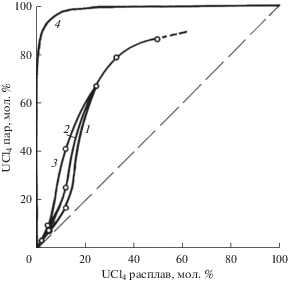
На рис. 1, 2 можно проследить также изменение состава паровой фазы с составом солевых расплавов при 973, 1073 и 1173 K. Здесь же приведены изотермы для 1073 K (кривые 4), построенные в предположении идеального поведения соответствующих бинарных расплавленных смесей с учетом литературных данных по давлению насыщенных паров над чистыми жидкими NaCl, KCl [10, 11] и UCl4 [4, 12]. Видно, что смеси UCl4–KCl и UCl4–NaCl значительно (причем тем в большей степени, чем ниже температура) отклоняются от идеального поведения в сторону меньших летучестей компонентов, очевидно, из-за комплексообразования в расплавах. В результате – равновесная паровая фаза над солевыми смесями UCl4–KCl, содержащими не более 23 или 31 мол. % UCl4 для температур 1173 и 973 K соответственно, становится даже беднее по тетрахлориду урана, чем жидкая (рис. 1). Эти расплавы при длительной неизотермической выдержке будут обогащаться легколетучим компонентом – тетрахлоридом урана, что следует учитывать при практическом использовании. У более же концентрированных растворов в этой системе и у всех растворов в системе UCl4–NaCl (рис. 2) жидкая фаза, как и следовало ожидать, будет обедняться, а паровая обогащается UCl4 по сравнению с расплавом. При неизменной температуре концентрация UCl4 в газовой фазе возрастает при увеличении его концентрации в расплаве.
Экспериментальные данные по количеству и элементному составу возгонов, отбираемых в условиях равновесия жидкой и паровой фаз в расчете на определенный объем газа-носителя, дают возможность рассчитать как и ранее [2, 7–9] по известным соотношениям [6] летучесть компонентов расплавленных смесей в предположении, что из расплава в паровую фазу они переходят только в виде мономерных молекул (UCl4, KCl, NaCl). Найденные таким способом летучести компонентов меняются с температурой согласно эмпирическим уравнениям вида lg f = A – B/T. Значения постоянных A и B, определенных из экспериментальных данных методом наименьших квадратов, приведены в табл. 1 и 2. Там же указан среднеквадратичный разброс экспериментальных точек, Δ.
Таблица 1.
Коэффициенты уравнений температурной зависимости летучестей компонентов расплавленных смесей UCl4–KCl разных концентраций
| [UCl4], мол. % |
T, K | n* | lg f** = A – B/T ± ∆, Па | |||||
|---|---|---|---|---|---|---|---|---|
| UCl4 | KCl | |||||||
| A | B | ∆ | A | B | ∆ | |||
| 2.1 | 1070–1300 | 16 | 10.0 | 11 600 | 0.02 | 10.3 | 8900 | 0.02 |
| 5.3 | 1050–1280 | 11 | 10.7 | 11 600 | 0.03 | 10.1 | 8600 | 0.02 |
| 12.0 | 1001–1190 | 11 | 11.0 | 11 500 | 0.02 | 11.0 | 9700 | 0.04 |
| 25.0 | 972–1180 | 12 | 11.7 | 11 400 | 0.02 | 8.5 | 7300 | 0.02 |
| 33.0 | 912–1130 | 11 | 12.1 | 10 900 | 0.01 | 9.7 | 8600 | 0.01 |
| 50.0 | 877–1115 | 13 | 12.0 | 8800 | 0.02 | 11.2 | 8800 | 0.03 |
* Количество экспериментальных точек. ** По нашим оценкам из расплавов с низкой концентрацией UCl4 тетрахлорид испаряется преимущественно в составе комплексных молекул (${{P}_{{{\text{KUC}}{{{\text{l}}}_{5}}}}} > {{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}})$, а хлорид калия – в виде мономеров (PKCl > ${{P}_{{{{{\text{K}}}_{2}}{\text{C}}{{{\text{l}}}_{2}}}}}$ > > ${{P}_{{K{\text{UC}}{{{\text{l}}}_{5}}}}}).$ У расплавов с высокой концентрацией UCl4 вклад различных молекулярных форм в летучесть компонентов расплава значительно изменяется (${{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}}$ > ${{P}_{{K{\text{UC}}{{{\text{l}}}_{5}}}}}$; ${{P}_{{K{\text{UC}}{{{\text{l}}}_{5}}}}}$ > PKCl > ${{P}_{{{{{\text{K}}}_{2}}{\text{C}}{{{\text{l}}}_{2}}}}}$).
Таблица 2.
Коэффициенты уравнений температурной зависимости летучестей компонентов расплавленных смесей UCl4–NaCl разных концентраций
| [UCl4], мол. % |
T, K | n* | lg f** = A – B/T ± ∆, Па | |||||
|---|---|---|---|---|---|---|---|---|
| UCl4 | NaCl | |||||||
| A | B | ∆ | A | B | ∆ | |||
| 2.0 | 1075–1220 | 11 | 8.3 | 8400 | 0.02 | 10.8 | 9600 | 0.02 |
| 5.0 | 1020–1180 | 12 | 8.5 | 8200 | 0.03 | 10.6 | 9400 | 0.03 |
| 12.0 | 1020–1180 | 14 | 9.0 | 8200 | 0.01 | 12.3 | 11 200 | 0.01 |
| 25.0 | 923–1185 | 15 | 9.9 | 8300 | 0.02 | 10.0 | 8700 | 0.04 |
| 33.0 | 880–1080 | 13 | 10.4 | 8100 | 0.03 | 9.8 | 8100 | 0.01 |
| 50.0 | 934–1170 | 12 | 10.7 | 7400 | 0.01 | 9.9 | 7400 | 0.02 |
* Количество экспериментальных точек. ** По нашим оценкам из расплавов с низкой концентрацией UCl4 тетрахлорид испаряется преимущественно в составе комплексных молекул (${{P}_{{{\text{NaUC}}{{{\text{l}}}_{5}}}}}$ $ > {{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}})$, а хлорид натрия – в виде мономеров (PNaCl > > ${{P}_{{{\text{N}}{{{\text{a}}}_{2}}{\text{C}}{{{\text{l}}}_{2}}}}} > $ ${{P}_{{{\text{NaUC}}{{{\text{l}}}_{5}}}}}).$ У расплавов с высокой концентрацией UCl4 вклад различных молекулярных форм в летучесть компонентов расплава значительно изменяется (${{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}}$ > ${{P}_{{{\text{NaUC}}{{{\text{l}}}_{5}}}}}$; ${{P}_{{{\text{NaUC}}{{{\text{l}}}_{5}}}}}$ > PNaCl > ${{P}_{{{\text{N}}{{{\text{a}}}_{2}}{\text{C}}{{{\text{l}}}_{2}}}}}$).
Известно, что в парах реальных солевых систем могут присутствовать, наряду с мономерными (KCl, NaCl, UCl4), димерные (K2Cl2, Na2Cl2), в незначительных количествах полимерные (K3Cl3, K4Cl4 и т.п.) молекулы хлоридов щелочных металлов, а также комплексные соединения (например, KUCl5, NaUCl5) [4–6, 10–16]. Тем не менее рассчитанные нами летучести компонентов очень нужны на практике для количественной оценки суммарного перехода того или иного вещества или относительного перехода (улетучиваемости) различных веществ из расплавленных смесей в паровую фазу вне зависимости от молекулярных форм, в виде которых компоненты расплавов испаряются.
Летучести UCl4, KCl и NaCl увеличиваются с ростом температуры (рис. 3, 4). У тетрахлорида урана летучесть возрастает с повышением его содержания в расплавах обеих бинарных систем и при концентрациях свыше 27–35 (рис. 3) или 16–22 мол. % UCl4 (рис. 4) становится выше летучести хлоридов калия или натрия, соответственно. Можно было ожидать, что так же как для UCl4, летучесть KCl и NaCl с понижением их содержания в расплавах должна была бы уменьшаться. В действительности же (рис. 3, 4) она при этом сначала почти не меняется (или очень слабо уменьшается), а затем начинает возрастать, достигая максимальных величин у расплавленных смесей с минимальной концентрацией хлоридов щелочных металлов (50 мол. %), где она превышает летучесть над расплавами индивидуальных KCl и NaCl. Аналогичная картина концентрационных зависимостей летучестей хлоридов щелочных металлов была обнаружена нами ранее для расплавленных смесей UCl4–CsCl, UCl4–LiCl и UCl4–(NaCl–KCl, 1 : 1) [1, 2] и для родственных им расплавов ThCl4–MCl (M = Cs, Rb, K, Na, Li) [17]. Аномальный концентрационный ход изменения fMCl однозначно свидетельствует о том, что, также как в упомянутых выше случаях, из расплавленных смесей c тетрахлоридом урана хлориды калия и натрия испаряются не только в виде мономеров и димеров MCl и M2Cl2, но и в составе их двойных соединений с более летучим UCl4. Из последних, согласно литературным сведениям [14] и результатам наших исследований [1], преобладают комплексы типа MUCl5, подобные MThCl5 [17]. Таким образом:
(1)
${{f}_{{{\text{MCl}}}}} = {{P}_{{{\text{MCl}}}}} + 2{{P}_{{{{{\text{M}}}_{{2{\kern 1pt} }}}{\text{C}}{{{\text{l}}}_{2}}}}} + {{P}_{{{\text{MUC}}{{{\text{l}}}_{5}}}}},$(2)
${{f}_{{{\text{MUC}}{{{\text{l}}}_{5}}}}} = {{P}_{{{\text{MUC}}{{{\text{l}}}_{5}}}}} + {{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}},$Рис. 3.
Изотермы летучестей компонентов расплавленных смесей UCl4–KCl: 1, 2, 4 – UCl4, 3, 5, 6 – KCl; 1, 3 – 1173 К, 2, 5 – 1073 К, 4, 6 – 973 К.
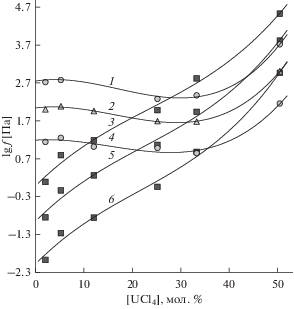
Рис. 4.
Изотермы летучестей компонентов расплавленных смесей UCl4–NaCl: 1, 3, 5 – UCl4, 2, 4, 6 – NaCl; 1, 2 – 1173 К, 3, 4 – 1073 К, 5, 6 – 973 К.
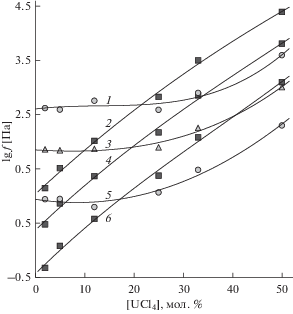
Вклад газообразных комплексов KUCl5 и NaUCl5 в летучесть хлоридов натрия и калия (fMCl) становится наибольшим у расплавленных смесей с максимальной концентрацией тетрахлорида урана. Судя по ходу изотерм fMCl на рис. 3 и 4 долевой вклад этих комплексов выше у расплавов UCl4–NaCl, поскольку становится заметным, начиная с более низких концентраций тетрахлорида в расплавленных смесях по сравнению с UCl4–KCl.
Летучесть тетрахлорида урана из расплавленных смесей UCl4–KCl и UCl4–NaCl уменьшается в 20–110 раз при понижении температуры от 1173 до 973 K (табл. 3). Значительно в большей степени летучесть UCl4 убывает при понижении его концентрации в расплавах с 50 до 2 мол. %. Так, например, она уменьшается приблизительно в 1800 и в 2700 раз в системе UCl4–NaCl при 1173 и 973 K; в 24 000 и в 90 000 раз в системе UCl4–KCl при тех же температурах, а в расплавах UCl4–CsCl – еще выше (на 3–4 порядка) [1]. При одинаковых температурах летучесть UCl4 понижается в 10–40 раз при переходе от смесей UCl4–NaCl к смесям UCl4–KCl (разбавленные растворы, табл. 3) и на 1–3 порядка при переходе от смесей UCl4–LiCl к смесям UCl4–CsCl [1]. Наибольшие изменения в летучести тетрахлорида урана для рассматриваемых переходов фиксируются при минимальных температурах и концентрациях UCl4 в расплавах, а также для его расплавленных смесей с наиболее крупными щелочными катионами (K+, Cs+).
Таблица 3.
Летучесть тетрахлорида урана (в Па) из расплавленных смесей UCl4–KCl и UCl4–NaCl
| T, K | Летучесть* UCl4 (Па) при его концентрации в расплаве, мол. % | |||||
|---|---|---|---|---|---|---|
| 2.0 | 12.0 | 50.0 | 2.0 | 12.0 | 50.0 | |
| UCl4–KCl | UCl4–NaCl | |||||
| 973 | 1.00 · 10–2 | 1.52 · 10–1 | 9.03 · 102 | 4.64 · 10–1 | 3.74 | 1.24 · 103 |
| 1073 | 1.44 · 10–1 | 1.92 | 6.29 · 103 | 2.96 | 2.28 · 101 | 6.36 · 103 |
| 1173 | 1.30 | 1.57 · 101 | 3.15 · 104 | 1.38 · 101 | 1.02 · 102 | 2.46 · 104 |
* По нашим оценкам из расплавов с низкой концентрацией UCl4 тетрахлорид испаряется преимущественно в составе комплексных молекул (${{P}_{{{\text{NaUC}}{{{\text{l}}}_{5}}}}}$ $ > {{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}};~\,\,{{P}_{{{\text{KUC}}{{{\text{l}}}_{5}}}}} > {{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}})$, а из высококонцентрированных – в составе простых молекул (${{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}}$ > ${{P}_{{{\text{NaUC}}{{{\text{l}}}_{5}}}}}$; ${{P}_{{{\text{UC}}{{{\text{l}}}_{4}}}}}{\text{\;}} > {{P}_{{K{\text{UC}}{{{\text{l}}}_{5}}}}}$).
Резкое понижение летучести тетрахлорида урана при замене соли-растворителя и при понижении его концентрации в исследованных нами расплавленных смесях происходит, очевидно, в результате комплексообразования (образования анионов ${\text{UCl}}_{7}^{{3 - }}$ и ${\text{UCl}}_{6}^{{2 - }}$ в разбавленных растворах, полимерных ${{{\text{U}}}_{2}}{\text{Cl}}_{{10}}^{{2 - }}{\text{\;}}$ и ${{{\text{U}}}_{3}}{\text{Cl}}_{{14}}^{{2 - }}{\text{\;}}$ – в концентрированных [18]). Подробнее об этом сообщалось ранее [2].
Прочность комплексных анионов, образуемых четырехвалентным ураном, должна возрастать при понижении контрполяризующего воздействия более крупного щелочного катиона (K+ вместо Na+) на анионы хлора, входящие состав хлорокомплексных группировок. Это должно приводить к понижению летучести UCl4, наиболее значительному – в области с наиболее сильным комплексообразованием UCl4 – в его разбавленных растворах (c 2–5 мол. %) в расплавленных смесях [2, 19], что и наблюдается экспериментально (табл. 3).
Летучесть тетрахлорида урана для таких разбавленных растворов, найденная в настоящей и наших предыдущих работах [1, 2], показана на рис. 5 при температурах 1173, 1073 и 973 K в зависимости от обратных величин эффективных ионных радиусов щелочных металлов по Шеннону [20]. Также как для термодинамических функций галогенидов различных поливалентных металлов [17, 19, 21, 22] наблюдается практически линейное изменение $\lg {{f}_{{{\text{UC}}{{{\text{l}}}_{4}}}}}$ от 1/rM+, что дает возможность оценивать летучесть тетрахлорида урана и из других его расплавленных смесей с хлоридами щелочных металлов.
Рис. 5.
Изотермы летучести UCl4 из его разбавленных растворов в расплавленных CsCl, KCl, NaCl, LiCl или эквимольной смеси NaCl–KCl, содержащих 2.0 мол. % UCl4.
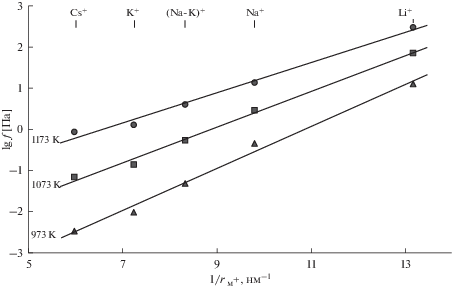
Более подробное обсуждение причин и закономерностей изменения летучести тетрахлорида урана из его расплавленных смесей мы предполагаем провести в нашей следующей статье, в которой будут также представлены результаты некоторых дополнительных экспериментальных исследований.
ЗАКЛЮЧЕНИЕ
Измерены в широком интервале температур летучести компонентов насыщенных паров расплавленных смесей UCl4–KCl и UCl4–NaCl, содержащих от ~2 до 50 мол. % UCl4. Определен химический состав насыщенных паров. Сделан вывод о присутствии в них летучих комплексных соединений наиболее вероятного состава KUCl5 и NaUCl5. Найдены температурные и концентрационные зависимости летучести компонентов исследованных расплавов. Отмечена корреляция между летучестью тетрахлорида урана и прочностью образуемых им комплексных хлоридных анионов в расплавленных смесях с хлоридами щелочных металлов различного состава.
Работа (частично) выполнена с использованием оборудования центра коллективного пользования “Состав вещества” ИВТЭ УрО РАН.
Список литературы
Смирнов М.В., Кудяков В.Я., Салюлев А.Б., Комаров В.Е., Посохин Ю.В., Афоничкин В.К. Летучести компонентов насыщенных паров расплавленных смесей UCl4–CsCl и UCl4–LiCl // Радиохимия. 1979. 21. № 1. С. 18–21.
Салюлев А.Б., Кудяков В.Я., Москаленко Н.И. Летучести компонентов насыщенных паров растворов UCl4 в расплавленной эквимольной смеси NaCl–KCl // Расплавы. 2021. № 3. С. 223–232.
Yoshimura T., Miyake Ch., Imoto Sh. Preparation of anhydrous uranium tetrachloride and measurements on its magnetic susceptibility // J. Nucl. Sci. and Technol. 1971. 8. № 9. P. 498–502.
Katz J.J., Rabinowitch E. The chemistry of uranium: The element, its binary and related compounds. New York, London: McGraw-Hill Book Company, Inc. 1951. Part 1.
Brown D. The halides of the lanthanides and actinides. London, New York, Sydney, Tokyo, Mexico: John Wiley and Sons Ltd. 1968.
Суворов А.В. Термодинамическая химия парообразного состояния. Л.: Химия. 1970.
Смирнов М.В., Кудяков В.Я., Худоложкин В.Н., Шерстобитова И.А. Летучести компонентов расплавленных смесей KCl–ThCl4 // Труды Ин-та электрохимии УНЦ АН СССР. 1972. Вып. 18. С. 33–40.
Смирнов М.В., Худоложкин В.Н., Кудяков В.Я., Шерстобитова И.А. Летучесть и активность ThCl4 и CsCl в их расплавленных смесях // Труды Ин-та электрохимии УНЦ АН СССР. 1973. Вып. 20. С. 27–32.
Салюлев А.Б. Давление насыщенных паров и термодинамика растворов тетрахлорида гафния в расплавленных хлоридах щелочных металлов и их бинарных смесях. Дис. … канд. хим. наук. Свердловск, 1981.
Roine A. HSC Chemistry 7.0 Thermochemical Database. Finland: Outokumpu Research Oy. 2009.
Миронов В.Л., Бурылев Б.П. Давление насыщенного пара индивидуальных хлоридов и их бинарных смесей // “Успехи термодинамики расплавов”: материалы Всесоюзного семинара. Краснодар: Краснодар. политехн. ин-т, 1976. С. 25–84.
Singh Z., Prasad R., Venugopal V., Sood D.D. The vaporization thermodynamics of uranium tetrachloride // J. Chem. Thermodynamics. 1978. 10. P. 129–124.
Wang L.L., Wallace T.C. Vacuum evaporation of KCl–NaCl salts: Part I. Thermodinamic modeling of vapor pressures of solid and liquid solutions // Metallurg. and Mater. Trans. 1996. 27B. P. 141–146.
Шугуров С.М. Термическая устойчивость неорганических ассоциатов в газовой фазе // Дис. … д-ра хим. наук. Санкт-Петербург, 2018.
Binnewies M., Schäfer H. Gasförmige Halogenidkomplexe und ihre Stabilität // Z. Anorg. Allg. Chem. 1974. 407. № 3. P. 327–344.
Arthers S.A., Beattie I.R. The vibrational spectra of some tetrachlorides in rare gas matrices with particular reference to the molecular shapes of ThCI4 and UCI4 // J. Chem. Soc., Dalton Trans. 1984. № 23. P. 819–826.
Smirnov M.V., Kudyakov V.Ya. The saturation vapor pressure and decomposition potential of ThCl4 solutions in molten alkali chlorides // Electrochim. Acta. 1984. 29. № 1. P. 63–68.
Li B., Dai S., Jiang D. First principles dynamic simulations of UCln–NaCl (n = 3, 4) molten salts // ACS Appl. Energy Mater. 2019. 2. № 3. P. 2122–2128.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука. 1973.
Shannon R.D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides // Acta Crystallogr. 1976. A32. P. 751–767.
Salyulev A.B., Smolenski V.V., Moskalenko N.I. Saturated vapor pressure over molten mixtures of GaCl3 and alkali metal chlorides // Radiochemistry. 2004. 46. № 4. P. 343–347.
Smirnov M.V., Salyulev A.B., Kudyakov V.Ya. Thermodynamic properties and decomposition potential of HfCl4 solutions in molten alkali chlorides and their mixtures // Electrochim. Acta. 1984. 29. № 8. P. 1087–1100.
Дополнительные материалы отсутствуют.


