Расплавы, 2021, № 6, стр. 575-581
Равновесные потенциалы алюминия в расплавленной смеси хлоридов алюминия и калия в зависимости от температуры и концентрации
Е. С. Филатов a, b, В. Я. Кудяков a, К. Р. Каримов a, Е. В. Никитина a, b, *
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет им. Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: neekeetina@mail.ru
Поступила в редакцию 19.05.2020
После доработки 25.08.2020
Принята к публикации 10.05.2021
Аннотация
Измерены равновесные электродные потенциалы алюминия в расплавленной смеси хлоридов алюминия и калия в зависимости от температуры в системе KCl–AlCl3–ZrCl4, что дает возможность рекомендовать металлический алюминий в качестве эффективного протектора защиты материалов оборудования установки разделения хлоридов циркония и гафния (УРХЦГ) от фронтальной коррозии [1–5].
ВВЕДЕНИЕ
Чтобы обеспечить защиту всего оборудования установки разделения хлоридов циркония и гафния УРХЦГ (аппаратов, насосов, трубопроводов и других устройств) от сплошной фронтальной коррозии, возможно использовать металлический алюминий в качестве протектора. В этом случае следует выполнить определенные расчеты эффективности защиты, в расчетных формулах которых должна фигурировать разность потенциалов между металлическим алюминием и защищаемым конструкционным материалом (никель-молибденовым сплавом).
Закономерности изменения равновесных потенциалов алюминия от температуры и концентрации могут быть применены для оценки коррозионной способности системы “солевой расплав хлоралюмината калия–газ (аргон)” путем измерения окислительно-восстановительного потенциала указанной среды в зависимости от состава газовой атмосферы над ней, т.е. от примесей паров воды, соляной кислоты, кислорода и других, например, углеродсодержащих газов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Процедура проведения измерений
Количество загружаемого хлоралюмината калия составляло 40 г. Загрузку соли и сборку ячейки (рис. 1) осуществляли в сухом боксе в атмосфере аргона. В собранном виде ячейку вынимали из бокса и вставляли в термостатированную печь с задаваемой программой нагрева. Ячейку в холодном состоянии вакуумировали, затем запускали аргон и вновь вакуумировали. Эту процедуру повторяли дважды, чтобы по возможности полностью удалить адсорбированные кислород и влагу с поверхностей ячейки и ее деталей. “Промытую” ячейку заполняли аргоном и начинали нагревать печь до заданной температуры. При достижении постоянного ее значения начинали измерения. За достоверные значения потенциалов принимали такие, которые оставались постоянными длительное время (от одного до двух и более часов) в пределах ±0.002 В.
Рис. 1.
Электрохимическая ячейка для измерения равновесных потенциалов в расплавленных солях. 1 – ячейка кварцевая; 2 – пробки резиновые; 3 – расплав; 4 – алюминиевый электрод; 5 – свинцовый электрод сравнения; 6 – защитные экраны; 7 – подвеска тигля; 8 – чехол для термопары; 9 – тигель из оксида алюминия (алундовый); 10 – электрод из алюминия; 11 – асбестовая диафрагма в чехле электрода сравнения; 12 – ампулы с навесками тетрахлорида циркония; 13 – шлюзы: три перекрываемые, один не перекрываемый.
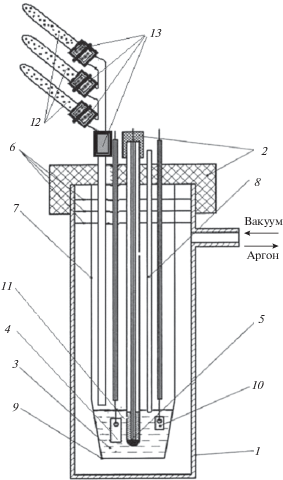
В качестве алюминиевого электрода использовали проволоку чистотой 99.9 мас. %, в качестве электрода сравнения использовали свинцовый электрод.
Измеренные значения равновесных, Е1, потенциалов алюминия относительно свинцового электрода сравнения затем пересчитывали на хлорный электрод сравнения, Е, по выражению:
где E2 – равновесный потенциал свинца относительно хлорного электрода сравнения; Е – равновесный потенциал алюминия относительно хлорного электрода сравнения; Δφ – величина диффузионного потенциала, возникающего между электролитами, разделенными асбестовой диафрагмой, LiCl–KCl и KAlCl4. Его значение для электролитов с высокой электропроводностью очень мало и не превышает 5–10 мВ [6]. Оно практически не зависит от температуры, остается постоянным для всех измерений и его значением можно пренебречь.В литературе имеется достаточное количество работ, в которых надежными и достоверными методами измерены значения равновесных потенциалов свинца относительно хлорного электрода сравнения [7], например, для низкоплавких хлоридных систем LiCl–KCl.
Так, в работе [7] приводятся экспериментальные данные, в том числе, эмпирические уравнения зависимости равновесных потенциалов свинца от температуры и концентрации его хлорида. Для концентрации хлорида свинца 1 мол. % в расплаве LiCl–KCl температурная зависимость имеет вид
относительно хлорного электрода сравнения.Таким образом, экспериментально измерены равновесные потенциалы алюминия по отношению к свинцовому электроду сравнения в зависимости от температуры (в интервале 623–703 К) и концентрации его ионов в кварцевой электрохимической ячейке [6, 8], а затем их значения пересчитаны по отношению к хлорному электроду сравнения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты измерений равновесных потенциалов алюминия относительно свинцового электрода сравнения приведены на рис. 2 и в табл. 1. Среднеквадратичные отклонения измерений не превышали ±3 мВ.
Рис. 2.
Зависимость равновесных потенциалов алюминия от температуры и содержания хлорида алюминия в хлоралюминате калия: графические знаки 1–6 представляют серию отдельных самостоятельных опытов, в которых концентрация хлорида алюминия в хлоралюминате калия была равна ~0.4574 мол. % AlCl3, а графический знак 7 – серия самостоятельных опытов, в которых концентрация хлорида алюминия в хлоралюминате была равна ~50 мол. % AlCl3.
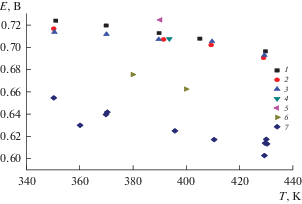
Таблица 1.
Зависимость равновесных потенциалов алюминия от температуры
| № | Температура, К | Величина потенциала Е1, В | Величина потенциала Е2, В | Величина потенциала Е, В |
|---|---|---|---|---|
| 1 | 623.0 | 0.7175 | 1.4940 | 2.2115 |
| 2 | 632.0 | 0.5787 | 1.4915 | 2.0702 |
| 3 | 633.4 | 0.5484 | 1.4910 | 2.0394 |
| 4 | 642.3 | 0.5244 | 1.4886 | 2.0130 |
| 5 | 643.0 | 0.5697 | 1.4885 | 2.0582 |
| 6 | 648.0 | 0.5133 | 1.4870 | 2.0003 |
| 7 | 653.6 | 0.5100 | 1.4855 | 1.9955 |
| 8 | 661.0 | 0.7070 | 1.4835 | 2.1905 |
| 9 | 663.0 | 0.5640 | 1.4830 | 2.0470 |
| 10 | 666.0 | 0.7060 | 1.4820 | 2.1880 |
| 11 | 673.6 | 0.5097 | 1.4800 | 1.9897 |
| 12 | 679.6 | 0.7071 | 1.4780 | 2.1851 |
| 13 | 683.0 | 0.5658 | 1.4772 | 2.0430 |
| 14 | 701.0 | 0.6900 | 1.4720 | 2.1620 |
| 15 | 703.3 | 0.5480 | 1.4715 | 2.0195 |
| 16 | 705.5 | 0.5644 | 1.4770 | 2.0414 |
Обработка экспериментальных данных изменения равновесных потенциалов алюминия от температуры методом наименьших квадратов для двух значений концентраций хлорида алюминия ~0.4574 и ~0.5000 мол. % AlCl3 дает следующие эмпирические уравнения их температурной зависимости относительно свинцового электрода сравнения соответственно:
Однако высокой воспроизводимости результатов измерений равновесных электродных потенциалов алюминия (любого металла) можно добиться только в том случае, если отношение мольнодолевых концентраций хлоридов алюминия и калия для разных партий хлоралюмината калия будет практически одинаковым, т.е., постоянным. Особенно строго постоянство этого отношения должно соблюдаться при измерениях потенциалов металлов в области составов, когда оно, [KCl]/[AlCl3], равно 1 или близко к нему. В этом случае мольнодолевые концентрации хлоридов калия и алюминия равны 0.5 и их отношение соответственно равно единице. Отклонение от постоянного значения указанного отношения при измерении температурной зависимости равновесного электродного потенциала алюминия для солевой смеси одного состава (т.е., уменьшение или увеличение концентрации любого компонента, например, потенциалопределяющего в нашем случае, хлорида алюминия, приводящего даже к незначительному изменению отношения [KCl]/[AlCl3]), приведет к значительным ошибкам. Они будут связаны в большей степени не с изменением концентрации хлорида алюминия, а с резким, скачкообразным изменением его коэффициента активности. И эти ошибки будут тем больше, чем ближе состав солевого расплава к эквимольному, т.е., когда [KCl]/[AlCl3] = 1. В этом случае отклонение от единицы даже в пределах сотых долей в любую сторону, действительно приводит к значительно большей реальной разности потенциалов Δφ, чем можно было бы ожидать по нижеприводимому уравнению Нернста (3), которое справедливо для области составов, где коэффициенты активности ионов алюминия постоянны, т.е., в области его малых концентраций в хлориде калия, не превышающих ~3–5 мол. % AlCl3. Такое отклонение равновесного электродного потенциала алюминия, не связанное с изменением величины его коэффициента активности, легко вычисляется по выражению:
(3)
$~\Delta \varphi = \frac{{RT}}{{zF}} \cdot \ln \frac{{{{{\left[ {{\text{AlC}}{{{\text{l}}}_{3}}} \right]}}_{{1~}}}}}{{{{{\left[ {{\text{AlC}}{{{\text{l}}}_{{\text{3}}}}} \right]}}_{2}}}}.$В этом выражении R – универсальная газовая постоянная, 8.314 Дж/(моль · K); Т – абсолютная температура, К; z – заряд ионов алюминия, +3; F – константа Фарадея, 9.649 ⋅ 10–4 Кл/моль; [AlCl3]1 и [AlCl3]2 – числа молей хлорида алюминия в различных по составу хлоралюминатах калия.
Такие расчеты были выполнены и получены следующие разности потенциалов алюминия для его концентраций 0.5 и 0.4574 мольных долей. Рассчитанные значения ∆φ, по выражению (1) дают величины, например, для температуры 623 и 703 К 0.0016 и 0.0018 В соответственно.
На самом деле, измеряемая экспериментально разность потенциалов, как можно видеть на рис. 1, равна около 70 и 90 мВ при 623 и 703 К соответственно.
В табл. 1 Е1, Е2 и Е – величины равновесных потенциалов алюминия по отношению к свинцовому электроду сравнения, равновесных потенциалов свинца по отношению к хлорному электроду сравнения и наконец, равновесных потенциалов алюминия по отношению к хлорному электроду сравнения соответственно.
Такое существенное отличие реально измеренных экспериментальных значений потенциалов, от рассчитанных по выражению (3), связано с тем, что в области концентраций хлорида алюминия в расплавленном хлориде калия близкой к 50 мол. % AlCl3 очень резко изменяются его коэффициенты активности при незначительном отклонении концентрации трихлорида алюминия от эквимольного состава, KAlCl4.
Определенные величины равновесных потенциалов алюминия по отношению к хлорному электроду сравнения неплохо согласуются с результатами, полученными в работе [9, 10].
После измерений равновесных электродных потенциалов были отобраны навески образцов солевых расплавов из тиглей и сборы закристаллизовавшихся конденсатов электролитов с чехлов электродов сравнения и стенок кварцевой ячейки в разных опытах. Одни и те же отобранные пробы поделили на две параллельные партии, и они были проанализированы независимо, чтобы убедиться в надежности и достоверности результатов анализа. Вскрытие проб осуществляли в водных растворах кислот, а сам анализ выполняли эмиссионным спектральным методом с индуктивно-связанной плазмой на оптическом эмиссионном спектрометре “iCAP 6300 Duo” фирмы “Thermo scientific” США.
Анализ собранных конденсатов с чехла электрода сравнения позволяет сделать какие-то разумные выводы, но достаточно осторожные. Вследствие различной летучести компонентов расплава и сложного молекулярного состава паровой фазы, отдельные ее составляющие конденсируются в различных частях измерительной системы и поэтому, собирая возгоны только с какой-то доли поверхности экспериментальной ячейки, точно свести материальный баланс для всей системы в целом, т.е. паровой и жидкой фаз, не представляется возможным. Поэтому более правильным было бы собирать возгоны со всей внутренней поверхности не простой по конструкции ячейки. Однако это сделать достаточно сложно, поскольку частично возгоны могут конденсироваться в несъемных газовых линиях и деталях аппаратурной схемы измерительной установки.
Имеет определенный смысл сопоставить экспериментально определенные значения содержания хлора в отобранных пробах исследованных солевых систем и рассчитанные по данным определения концентраций катионов металлов (Al3+, K+ и Zr4+) основных компонентов смесей, полагая, что они представляют соединения AlCl3, KCl и ZrCl4.
ВЫВОДЫ
Анализ результатов измерений равновесных потенциалов алюминия в зависимости от концентрации и температуры позволяет сделать важный вывод о принципиальной возможности реализации создания датчика контроля и регулирования состава хлоралюмината калия по резкому скачку э. д. с. в области составов 50 мол. % каждого компонента между электродами алюминиевым и, например, свинцовым (электрод сравнения).
Список литературы
Овсянникова А.Н., Останина Т.Н., Рудой В.М. Коррозионное и анодное растворение сплавов магния в присутствии ингибитора // Защита металлов. 2009. 45. № 1. С. 103–108.
Ostanina T.N., Ovsyannikova A.N., Rudoi V.M., Zaikov Y.P. The influence of inhibitors on magnesium anodes efficiency // Proceeding of the 5th International conference on mathematical Modeling and Computer Simulation of Material Technologies MMT-2008. 2008. P. 2-85–2-92.
Овсянникова А.Н., Матерн А.И., Останина Т.Н., Рудой В.М. Влияние некоторых ингибиторов на коррозионную стойкость сплава магния МП-2 // Химия и химическая технология. 2006. С. 293–298.
Овсянникова А.Н., Дайбова О.И., Останина Т.Н., Рудой В.М. Коррозионное поведение сплавов магния при анодной поляризации // Сб. статей молодых ученых: “Актуальные проблемы электрохимической технологии”. 2005. С. 101–105.
Останина Т.Н., Рудой В.М., Овсянникова А.Н., Малков В.Б. Особенности саморастворения сплавов магния при внешней анодной поляризации в присутствии ингибиторов // Электрохимия. 2010. 46. № 6. С. 753–760.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука. 1973.
Takahashi M. Thermodynamic Properties of Fused System of PbC12 (LiCl–KCl) and the Single Electrode Potential of Pb(s)/PbCl2(1) Electrode at 400–600°C // Denki Kagaku. 1957. 25. P. 481.
Смирнов М.В., Озеряная И.Н. Коррозия металлов в расплавленных солевых средах и защита от коррозии // Коррозия и защита от коррозии. 1973. 2. С. 171–208.
Ikeuchi H., Krohn C. // Acta Chemica Scandinavica. 1974. A 28. № 1. P. 48–54. https://doi.org/10.3891/acta.chem.scand.28a-0048
Tremillon B., Letisse G. // J. Electroanal. Chem. 1968. 17. P. 371–386. https://doi.org/10.1016/S0022-0728(68)80217-7
Smirnov M.V., Kudyakov V.Ya. Complexing in molten mixtures of thorium and alkali halides // Electrochimica Acta. 1983. 28. № 10. P. 1349–1359.
Smirnov M.V., Kudyakov V.Ya. The satuation vapour pressure and decomposition potential of ThCl4 solutions in molten alkali chlorides // Electrochimica Acta. 1983. 29. № 1. P. 63–68.
Smirnov M.V., Kudyakov V.Ya., Salyulev A.B. Thermodynamic properties and deconposition potential of HfCl4 solutions in molten alkali chlorides and their mixture // Electrochimica Acta. 1983. 29. № 8. P.1087–1100.
Илющенко Н.Г., Анфиногенов А.И., Шуров Н.И. Взаимодействие металлов в ионных расплавах. М.: Наука. 1991.
Жук Н.П. Курс теории коррозии и защиты металлов. М.: Металлургия. 1976.
Мигай Л.Л., Тарицына Т.А. Коррозионная стойкость материалов в хлоре и его соединениях. Справочник. М.: Металлургия. 1976.
Антропов Л.И., Погребова И.С. Связь между адсорбцией органических соединений и их влиянием на коррозию металлов в кислых средах // Коррозия и защита от коррозии. 1973. 2. С. 27–112.
Дополнительные материалы отсутствуют.


