Расплавы, 2021, № 6, стр. 638-646
Исследование взаимодействия ионов галлия и кислорода в расплавленной эвтектике NaCl–2CsCl
В. В. Смоленский a, b, *, А. В. Новоселова a, b, А. Л. Бове a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет им. Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: valeri.smolenski@mail.ru
Поступила в редакцию 29.06.2021
После доработки 11.07.2021
Принята к публикации 14.07.2021
Аннотация
Методом потенциометрического титрования исследована реакция взаимодействия ионов галлия и кислорода в расплавленной эвтектике NaCl–2CsCl в интервале температур 823–923 K в атмосфере инертного газа. Опыты проводили в двухэлектродной электрохимической ячейке с использованием стандартного YZM электрода (в качестве индикаторного) с твердоэлектролитной мембраной на основе ZrO2, стабилизированного Y2O3. С его помощью осуществляли контроль за активностью ионов кислорода в исследуемом расплаве. Измерения проводили относительно хлорного электрода сравнения. Изменение состава солевой смеси осуществляли сбрасыванием расчетных навесок оксида лития без нарушения состава газовой атмосферы. Галлий в расплав вводили анодным растворением. На кривой титрования расплава NaCl–2CsCl–GaCl3 в координатах pO2––x четко фиксируется эквивалентная точка, соответствующая образованию оксихлорида галлия, GaOCl. Эквивалентные точки при значениях х = 0.5 и 1.5 не фиксируются. Первое свидетельствует об отсутствии в расплаве ионов однозарядного галлия и возможного образования оксида галлия состава Ga2O, а второе связано с кинетическими затруднениями протекания твердофазной реакции образования Ga2O3. Анализируя кривые потенциометрического титрования, был установлен механизм образования оксихлорида и полуторного оксида галлия. Используя уравнения материального баланса и константы растворимости, была рассчитана растворимость GaOCl и Ga2O3 в исследуемом расплаве. Экспериментальные зависимости констант растворимости соединений GaOCl и Ga2O3 в зависимости от температуры в расплавленной эвтектике NaCl–2CsCl описываются следующими уравнениями: $pK_{{\text{s}}}^{{{\text{GaOCl}}}} = - 7.55 + \frac{{16{\kern 1pt} {\kern 1pt} 310}}{T} \pm 0.02,$ $pK_{{\text{s}}}^{{{\text{G}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}$ = = $ - 17.66 + \frac{{40{\kern 1pt} 410}}{T} \pm 0.02.$ Рассчитаны основные термодинамические характеристики оксихлорида и полуторного оксида галлия в расплавленной эвтектике NaCl–2CsCl.
ВВЕДЕНИЕ
При рассмотрении экологической безопасности ядерной энергетики одно из важнейших мест занимает задача уничтожения долгоживущих минорных актинидов (Np, Am, Cm) и некоторых наиболее опасных долгоживущих продуктов деления (Cs, I, Tc). Если данные элементы эффективно отделить из отработанного топлива и преобразовать в короткоживущие или стабильные изотопы, то радиологическая опасность его хранения будет существенно снижена. Концепция разделения и трансмутации (P&T) продуктов деления рассматривается в настоящее время как эффективный способ снижения активности радиоактивных отходов. Ее суть заключается в выделении долгоживущих продуктов деления из отработанного ядерного топлива (ОЯТ), внедрении их в инертную матрицу (свободную от урана) с целью последующей трансмутации в соответствующих реакторах. Пирохимическая переработка высокооблученного ядерного топлива с коротким временем выдержки в солевых расплавах на активных жидкометаллических электродах в атмосфере инертного газа представляет многообещающую альтернативу существующему гидрометаллургическому методу [1–7].
В ряду активных низкоплавких металлов Al > Ga > Sn > Bi > In > Zn > Cd коэффициенты разделения (КР) актинидов и продуктов деления уменьшаются от Al к Cd. Галлий является одним из наиболее перспективных жидких металлов в вышеприведенном ряду. Однако он относится к рассеянным элементам и поэтому дорог для промышленного использования. Поэтому инновационным направлением является использование галлия в сплавах с другими металлами при переработке ОЯТ. Исследования по регенерации отработанного ядерного топлива показали, что коэффициенты разделения основных компонентов топлива от продуктов деления лежат в пределах 103–105 при использовании галлийсодержащих сплавов. Однако в случае присутствия в электролите или в газовой фазе следов кислорода или влаги эффективность процесса разделения снижается [8–13].
Известно, что при анодном растворении галлия в условиях, близких к равновесным, в солевом расплаве происходит образование амбивалентной смеси, состоящей из катионов одно- и трехзарядного галлия, при этом доля Ga3+ в смеси уменьшается с ростом температуры и понижением общей концентрации галлия [14, 15]. Поэтому при интерпретации полученных результатов учитывалась вероятность существования в солевых расплавах ионов галлия в состояниях окисления Ga+ и Ga3+. Из-за высокой упругости паров соединений галлия [16] в процессе эксперимента могло происходить изменение их концентраций в электролите, что также учитывалось при расчете значений констант растворимости соединений галлия.
В настоящей работе изучены термодинамические свойства, растворимость и взаимодействие ионов галлия и кислорода с использованием YZM электродов в расплавленной эвтектике NaCl–2CsCl.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В опытах использовали металлический галлий (ТУ 48-4-350-84) и хлориды натрия и цезия квалификации (AR, 99.99%). Двухэлектродную электрохимическую ячейку применяли для исследований поведения ионов галлия в расплавленной эвтектике NaCl–2CsCl в интервале температур 823–923 K методом потенциометрического титрования с использованием стандартного YZM электрода с твердоэлектролитной мембраной на основе ZrO2, стабилизированного Y2O3. Его использовали в качестве индикаторного электрода для контроля за активностью ионов кислорода в исследуемом расплаве. Измерения проводили относительно хлорного электрода сравнения [17]. Разность потенциалов между хлорным и кислородным электродами, омываемыми соответственно хлором и кислородом в гальваническом элементе,
(1)
$\left. {{\text{P}}{{{\text{t}}}_{{\left( {{\text{тв}}} \right)}}}{{{\text{O}}}_{{2\left( {\text{г}} \right)}}}} \right|\left. {{\text{Zr}}{{{\text{O}}}_{2}}\left( {{{{\text{Y}}}_{2}}{{{\text{O}}}_{3}}} \right){\kern 1pt} } \right|\left. {{\text{исследуемый\;расплав}}{\kern 1pt} {\kern 1pt} } \right\|\left. {{\kern 1pt} {\kern 1pt} {\text{стандартный расплав}}{\kern 1pt} } \right|{\text{C}}{{{\text{l}}}_{{2\left( {\text{г}} \right)}}}{{{\text{C}}}_{{\left( {{\text{тв}}} \right)}}}$(2)
$\varepsilon = {{\varepsilon }^{0}} - \frac{{RT}}{{2F}}{\text{ln}}\frac{{{{a}_{{{{{\text{O}}}^{{2 - }}}{\text{\;}}}}}{\text{\;}} \cdot {{P}_{{{\text{C}}{{{\text{l}}}_{2}}}}}}}{{a_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{2}{\text{\;}} \cdot P_{{{{{\text{O}}}_{2}}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}},$(3)
$2{\text{Cl}}_{{\left( {\text{ж}} \right)}}^{ - }{\text{\;}} + {{{\text{\;}}1} \mathord{\left/ {\vphantom {{{\text{\;}}1} 2}} \right. \kern-0em} 2}{{{\text{O}}}_{{2\left( {\text{г}} \right)}}} = {\text{O}}_{{\left( {\text{ж}} \right)}}^{{2 - }}{\text{\;}} + {\text{C}}{{{\text{l}}}_{{2\left( {\text{г}} \right)}}},$(4)
${{\varepsilon }^{0}} = E_{{{{{\text{C}}{{{\text{l}}}_{2}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{l}}}_{2}}} {2{\text{C}}{{{\text{l}}}^{ - }}}}} \right. \kern-0em} {2{\text{C}}{{{\text{l}}}^{ - }}}}}}^{0}{\text{\;}} - E_{{{{{{{\text{O}}}_{2}}} \mathord{\left/ {\vphantom {{{{{\text{O}}}_{2}}} {{{{\text{O}}}^{{2 - }}}}}} \right. \kern-0em} {{{{\text{O}}}^{{2 - }}}}}}}^{0} = {\text{\;}}\frac{{ - \Delta {{G}^{0}}}}{{2F}},$Равновесный потенциал кислородного электрода описывается уравнением Нернста:
(5)
${{E}_{{{{{{{\text{O}}}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{{\text{O}}}_{{\text{2}}}}} {{{{\text{O}}}^{{{\text{2}} - }}}}}} \right. \kern-0em} {{{{\text{O}}}^{{{\text{2}} - }}}}}}}} = E_{{{{{{{\text{O}}}_{2}}} \mathord{\left/ {\vphantom {{{{{\text{O}}}_{2}}} {{{{\text{O}}}^{{2 - }}}}}} \right. \kern-0em} {{{{\text{O}}}^{{2 - }}}}}}}^{*} - \frac{{2.3~RT}}{{2F}}{\text{lg}}\left( {{{m}_{{{\text{eq}}}}}({{{\text{O}}}^{{2 - }}})} \right) = E_{{{{{{{\text{O}}}_{2}}} \mathord{\left/ {\vphantom {{{{{\text{O}}}_{2}}} {{{{\text{O}}}^{{2 - }}}}}} \right. \kern-0em} {{{{\text{O}}}^{{2 - }}}}}}}^{*} + \frac{{2.3~RT}}{{2F}}p{{{\text{O}}}^{{2 - }}}.$(6)
${\text{L}}{{{\text{i}}}_{2}}{{{\text{O}}}_{{\left( {{\text{тв}}} \right)}}}{\text{\;}} \to {\text{\;}}2{\text{Li}}_{{\left( {\text{ж}} \right)}}^{ + } + {\text{O}}_{{\left( {\text{ж}} \right)}}^{{2 - }}.$Трихлорид галлия вводили в расплав анодным растворением металлического галлия. Эксперименты проводили с использованием потенциостата-гальваностата AUTOLAB 302N в режиме потенциометрии при нулевом токе.
Образцы растворов проб, содержащие галлий, анализировали методом ICP-MS на оптическом эмиссионном спектрометре с индуктивно-связанной плазмой Perkin Elmer OPTIMA 4300 DV.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Первоначально YZM электрод был испытан на возможность его применения для исследований в расплавленном растворителе NaCl–2CsCl при различных температурах. Полученные результаты представлены в табл. 1. Достаточно хорошая корреляция между теоретическими и экспериментальными значениями предлогарифмического коэффициента в уравнении Нернста указывает на возможность использования YZM электрода в экспериментах по потенциометрическому титрованию.
Таблица 1.
Параметры калибровочной кривой для расплавленной эвтектики NaCl–2CsCl. Измерения выполнены относительно Cl–/Cl2 электрода сравнения
| T, K | $E_{{{{{{{\text{O}}}_{2}}} \mathord{\left/ {\vphantom {{{{{\text{O}}}_{2}}} {{{{\text{O}}}^{{2 - }}}}}} \right. \kern-0em} {{{{\text{O}}}^{{2 - }}}}}}}^{*},~\,\,{\text{В}}$ | ${{2.3RT} \mathord{\left/ {\vphantom {{2.3RT} {2F{\text{\;}}}}} \right. \kern-0em} {2F{\text{\;}}}}$ (эксп.) | ${{2.3RT} \mathord{\left/ {\vphantom {{2.3RT} {2F{\text{\;}}}}} \right. \kern-0em} {2F{\text{\;}}}}$ (теор.) |
|---|---|---|---|
| 823 | –0.751 ± 0.001 | 0.083 ± 0.001 | 0.083 |
| 923 | –0.771 ± 0.001 | 0.092 ± 0.001 | 0.092 |
| 1023 | –0.985 ± 0.002 | 0.109 ± 0.006 | 0.102 |
Для идентификации состава оксидных соединений галлия и определения их стабильности проводили титрование ионов Ga3+ ионами O2–. Для оценки стехиометрических коэффициентов реакций с участием исходных компонентов использовали лигандное число х.
(7)
$x = \frac{{{{m}_{{{\text{add}}}}}({{{\text{O}}}^{{2 - }}})}}{{{{m}_{0}}({\text{G}}{{{\text{a}}}^{{3 + }}})}},$Кривая потенциометрического титрования расплава NaCl–2CsCl, содержащего ионы галлия, как функция лигандного числа х от величины pO2–, приведена на рис. 1. Анализ полученной зависимости указывает на наличие четко выраженной эквивалентной точки при значении х близком к единице, что свидетельствует об образовании химического соединения с отношением Ga/O равным 1, т.е. GaOCl. При этом эквивалентные точки при значениях х равным 0.5 и 1.5 не фиксируются. Взаимодействие ионов галлия и кислорода можно представить следующим образом:
(8)
$2{\text{Ga}}_{{\left( {\text{ж}} \right)}}^{ + } + {\text{O}}_{{\left( {\text{ж}} \right)}}^{{2 - }} = {\text{G}}{{{\text{a}}}_{2}}{{{\text{O}}}_{{\left( {{\text{тв}}} \right)}}},$(9)
${\text{Ga}}_{{\left( {\text{ж}} \right)}}^{{3 + }} + {\text{O}}_{{\left( {\text{ж}} \right)}}^{{2 - }} + {\text{Cl}}_{{\left( {\text{ж}} \right)}}^{ - } = {\text{GaOC}}{{{\text{l}}}_{{\left( {{\text{тв}}} \right)}}},$(10)
$2{\text{GaOC}}{{{\text{l}}}_{{\left( {{\text{тв}}} \right)}}} + {\text{O}}_{{\left( {\text{ж}} \right)}}^{{2 - }} = {\text{G}}{{{\text{a}}}_{2}}{{{\text{O}}}_{{3\left( {{\text{тв}}} \right)}}} + 2{\text{Cl}}_{{\left( {\text{ж}} \right)}}^{ - },$(11)
$2{\text{Ga}}_{{\left( {\text{ж}} \right)}}^{{3 + }} + {\text{\;}}3{\text{O}}_{{\left( {\text{ж}} \right)}}^{{2 - }} = {\text{G}}{{{\text{a}}}_{2}}{{{\text{O}}}_{{3\left( {{\text{тв}}} \right)}}}.$Рис. 1.
Кривая потенциометрического титрования ионов галлия ионами кислорода в расплавленной эвтектике NaCl–2CsCl при 823 K. [GaCl3] = 1.73 ⋅ 10–3 моль/кг.
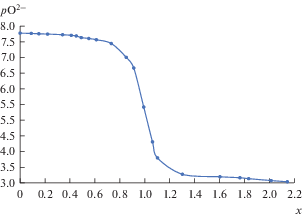
Отсутствие на кривой потенциометрического титрования эквивалентной точки при х = 0.5 (реакция (8)) свидетельствует о том, что в исследуемом расплаве нет ионов однозарядного галлия. Образование Ga2O3 не было зафиксировано на экспериментальных кривых титрования, вероятно, из-за кинетических трудностей реакции (10) в твердой фазе. Подобная картина наблюдалась ранее при исследовании поведения ионов церия в солевом расплаве [18]. Объединяя выражения (9) и (10), образование оксида Ga2O3 можно описать выражением (11).
Используя уравнения материального баланса (12), (13) и константы растворимости (14), (15) для реакций (9), (11), можно рассчитать растворимость GaOCl и Ga2O3 в исследуемом расплаве.
(12)
${{[{{{\text{O}}}^{{2 - }}}]}_{{\text{ж}}}} = {{[{{{\text{O}}}^{{2 - }}}]}_{{{\text{доб}}}}} - {{[{\text{GaOCl}}]}_{{{\text{тв}}}}} - 3{\kern 1pt} {{[{\text{G}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{3}}]}_{{{\text{тв}}}}},$(13)
${{[{\text{G}}{{{\text{a}}}^{{3 + }}}]}_{{\text{ж}}}} = {{[{\text{G}}{{{\text{a}}}^{{3 + }}}]}_{{{\text{нач}}}}} - {{[{\text{GaOCl}}]}_{{{\text{тв}}}}} - 2{{[{\text{G}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}]}_{{{\text{тв}}}}},$Активность ионов хлора в расплавленной эвтектике NaCl–2CsCl равна единице. Константы растворимости реакций (9), (11) равны:
(14)
${{K}_{{{\text{s}}\left( {{\text{GaOCl}}} \right)}}} = {\text{[G}}{{{\text{a}}}^{{3 + }}}{\text{]}} \cdot [{{{\text{O}}}^{{2 - }}}] \cdot [{\text{C}}{{{\text{l}}}^{ - }}],$(15)
${{K}_{{{\text{s}}\left( {{\text{G}}{{{\text{a}}}_{2}}{{{\text{O}}}_{3}}} \right)}}} = {\text{\;}}{{[{\text{G}}{{{\text{a}}}^{{3 + }}}]}^{2}} \cdot {{[{{{\text{O}}}^{{2 - }}}]}^{3}}.$В области осаждения оксихлорида галлия (0 < x < 1.0) теоретическая кривая потенциометрического титрования описывается уравнением (16):
(16)
$x = 1 + \frac{1}{{{{{[{\text{G}}{{{\text{a}}}^{{3 + }}}]}}_{{{\text{нач}}}}}}}\left[ {{{{[{{{\text{O}}}^{{2 - }}}]}}_{{\text{ж}}}} - \frac{{{{K}_{{{\text{s}}\left( {{\text{GaOCl}}} \right)}}}}}{{{{{[{{{\text{O}}}^{{2 - }}}]}}_{{\text{ж}}}}}}} \right].$В диапазоне (1.0 < x < 1.5), где осаждается Ga2O3, теоретическая кривая титрования имеет вид:
(17)
$x = 1.5 + \frac{1}{{{{{[{\text{G}}{{{\text{a}}}^{{3 + }}}]}}_{{{\text{нач}}}}}}}\left[ {{{{\left[ {{{{\text{O}}}^{{2 - }}}} \right]}}_{{\text{ж}}}} - \frac{{1.5 \cdot {{{({{K}_{{{\text{s(G}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{3)}}}}}}}})}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}{{\left[ {{{{\text{O}}}^{{2 - }}}} \right]_{{\text{ж}}}^{{ - {3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}}} \right].$(19)
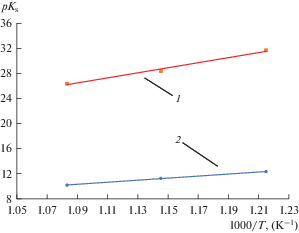
$pK_{{\text{s}}}^{{{\text{G}}{{{\text{a}}}_{2}}{{{\text{O}}}_{3}}}} = - 17.66 + \frac{{40{\kern 1pt} 410}}{T} \pm 0.02.$Таблица 2.
Рассчитанные значения констант растворимости и основные термодинамические свойства GaOCl и Ga2O3 при разных температурах в расплавленной эвтектике NaCl–2CsCl
| T, K | $p{{K}_{{\text{s}}}}$ | $\Delta G{\kern 1pt} *,\,\,{\text{кДж}}$/моль | $\Delta H{\kern 1pt} *,~{{{\text{\;кДж}}} \mathord{\left/ {\vphantom {{{\text{\;кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}$ | $\Delta S{\kern 1pt} *,~{{{\text{\;Дж}}} \mathord{\left/ {\vphantom {{{\text{\;Дж}}} {\left( {{\text{моль}} \cdot {\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}} \cdot {\text{K}}} \right)}}$ |
|---|---|---|---|---|
| GaOCl | ||||
| 823 | 12.2 | –193.2 | –311.9 | 144.1 |
| 873 | 11.1 | –185.9 | ||
| 923 | 10.2 | –178.7 | ||
| Ga2O3 | ||||
| 823 | 31.6 | –494.7 | –772.4 | 374.6 |
| 873 | 28.3 | –477.6 | ||
| 923 | 26.9 | –460.8 | ||
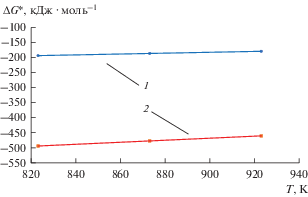
Рис. 2.
Изменение константы растворимости Ga2O3 (1) и GaOCl (2) в зависимости от температуры в расплавленной эвтектике NaCl–2CsCl.
Кажущееся изменение свободной энергии Гиббса было рассчитано по выражению (21) [20]:
(22)
$\Delta G_{{{\text{GaOCl}}}}^{*} = - 311.9 + 0.144{\text{\;}} \pm 1.9\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}{\text{,}}$(23)
$\Delta G_{{{\text{G}}{{{\text{a}}}_{2}}{{{\text{O}}}_{3}}}}^{*} = - 772.4 + 0.374{\text{\;}} \pm 2.5\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}{\text{.}}$Изменение свободной энергии Гиббса соединений GaOCl и Ga2O3 в зависимости от температуры в расплавленной эвтектике NaCl–2CsCl описывается выражениями (22), (23) и графически представлены на рис. 3.
ВЫВОДЫ
Методом потенциометрического титрования исследована реакция взаимодействия ионов галлия и кислорода в расплавленной эвтектике NaCl–2CsCl в интервале температур 823–923 K в атмосфере инертного газа. Опыты проводили в двухэлектродной электрохимической ячейке. В качестве индикаторного электрода использовали стандартный YZM электрод, который был изготовлен из ZrO2, стабилизированного Y2O3. Измерения проводили относительно хлорного электрода сравнения. Анализируя кривые потенциометрического титрования, был установлен механизм образования оксихлорида и полуторного оксида галлия. Используя уравнения материального баланса и константы растворимости, была рассчитана растворимость GaOCl и Ga2O3 в исследуемом расплаве. Показано, что она закономерно увеличивается с ростом температуры. Рассчитаны основные термодинамические характеристики оксихлорида и полуторного оксида галлия в расплавленной эвтектике NaCl–2CsCl.
Список литературы
OCDE/NEA Report: Accelerator-driven systems (ADS) and Fast Reactors (FR) in Advanced Nuclear Fuel Cycles. A Comparative Study. 2002.
Kormilitsyn M.V., Bychkov A.V., Ishunin V.S. Pyroelectrochemical reprocessing of irradiated fuel of fast reactors. VI. Generalization of experience on BOR-60 spent nuclear fuel reprocessing using approaches “UO2 to UO2” “MOX to PuO2” and “MOX to MOX”, Global 2003, USA, New Orleans. 2003. P. 782–783.
Комаров В.Е., Смоленский В.В., Афоничкин В.К. Перспективы использования расплавленных солей в радиохимических технологиях // Расплавы. 2000. № 2. С. 59–65.
Laidler J.J., Battles J.E., Miller W.E., Ackerman J.P., Carls E.L. Development of pyroprocessing technology // Prog. Nucl. Energ. 1997. 31. P. 131–140.
Sakamura Y., Hijikata T., Kinoshita K., Inoue T., Storvick T.S., Krueger C.L., Roy J.J., Grimmett D.L., Fusselman S.P., Gay R.L. Measurement of standard potentials of actinides (U, Np, Pu, Am) in LiCl–KCl eutectic salt and separation of actinides from rare earths by electrorefining // J. Alloys Compd. 1998. 271–273. P. 592–596.
Kinoshita K., Kurata M., Inoue T. Estimation of material balance in pyrometallurgical partitioning process of transuranic elements from high-level liquid waste // J. Sci. Technol. 2000. 37. P. 75–83.
Serp J., Allibert M., Le Terrier A., Malmbeck R., Ougier M., Rebizant J., Glatz J.-P. Electroseparation of actinides from lanthanides on solid aluminum electrode in LiCl–KCl eutectic melts // J. Electrochem. Soc. 2005. 152. № 3. P. C167–C172.
Лебедев В.А. Избирательность жидкометаллических электродов в расплавленных галогенидах. Челябинск: Металлургия, 1993.
Liu K., Liu Y.-L., Chai Z.-F., Shi W.-Q. Evaluation of the electroextractions of Ce and Nd from LiCl–KCl molten salt using liquid Ga electrode // J. Electrochem. Soc. 2017. 164. P. D169–D178.
Лебедев В.А., Серегин В.М., Поярков А.М. Термодинамические свойства жидких U–Ga // Журн. прикладной химии. 1973. 47. С. 712–714.
Novoselova A., Smolenski V. Solubility, Activity Coefficients and the Separation Factor of U/Pr Couple in Ga-In Alloys of Different Compositions in Fused LiCl–KCl–CsCl Eutectic // J. Electrochem. Soc. 2020. 167. 126518.
Smolenski V., Novoselova A., Bychkov A., Luk’yanova Ya., Osipenko A. Thermodynamics and separation factor of uranium from fission products in “liquid metal–molten salt” system. In book: “Uranium – Safety, Resources, Separation and Thermodynamic Calculation”, Edited by Nasser S. Awwad. IntechOpen. 2018. Ch. 6. P. 109–122.
Чергинец В.Л. Химия оксосоединений в ионных расплавах. Харьков: НТК “Институт монокристаллов”, 2004.
Яценко С.П., Данилин В.Н., Волкова Л.Н. Равновесие между галлием и его хлоридами в расплавленной эвтектической смеси хлоридов лития и калия // Журн. физической химии. 1968. 42. С. 874–877.
Усов П.М., Салтыкова Е.А. Термодинамика образования хлоридов галлия в расплаве // Расплавы. 1987. 1. С. 110–113.
Справочник химика. М.-Л.: Химия, 1965.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973.
Xu M., Smolenski V., Liu Q., Novoselova A., Jiang K., Yu J., Liu J., Chen R., Zhang H., Zhang M., Wang J. Thermodynamic properties of stable states cerium compounds in fused 3LiCl–2KCl eutectic // J. Chem. Thermodynamics. 2021. 152. 106260.
Smolenski V.V., Novoselova A.V., Luk’yanova Ya.M., Mayorshin A.A., Osipenko A.G., Kormilitsyn M.V. Potentiometric study of the interaction of Cr3+ and O2- ions in fused NaCl–2CsCl eutectic // Electrochim. Acta. 2010. 55. P. 4960–4963.
Марков Б.Ф. Термодинамика расплавленных солевых смесей. Киев: Наукова Думка, 1974.
Дополнительные материалы отсутствуют.