Расплавы, 2022, № 1, стр. 99-110
Плотность расслаивающихся солевых расплавов в двухфазной области
В. П. Степанов *
Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: v.stepanov@ihte.uran.ru
Поступила в редакцию 26.07.2021
После доработки 15.08.2021
Принята к публикации 05.09.2021
- EDN: NDYIPN
- DOI: 10.31857/S0235010622010091
Аннотация
Обобщены результаты исследования плотности фаз вдоль двухфазной линии насыщения для расплавленных несмешивающихся смесей LiF + KBr, LiF + CsCl, LiF + + RbBr, LiF + KI, LiF + CsBr, LiF + RbI, LiF + CsI, LiCl + AgBr и NaCl + AgI, полученные методом гидростатического взвешивания. Показано, что соотношение плотностей равновесных фаз существенно зависит от размеров смешиваемых ионов. Обсуждается зависимость изменения плотности вдали и вблизи критической точки смешения от природы химической связи между ионами.
ВВЕДЕНИЕ
Знание плотности расплава важно не только для расчета других физико-химических характеристик, но имеет и большое самостоятельное значение. Это одно из фундаментальных свойств, играющих значительную роль в технологических процессах. Достаточно сказать, что при отсутствии сведений о плотности невозможно спроектировать ни одну промышленную ванну, а тем более замкнутую систему с расплавленным рабочим телом, например, теплообменник высокотемпературного реактора. Часто необходимо точно регулировать соотношение плотностей электролита и металла, получаемого электролизом в жидком виде, припоя и флюса при пайке и т.п.
Важно иметь в виду, что мольный объем, связанный с плотностью, является термодинамической характеристикой жидкости, изменение которой в зависимости от различных параметров системы представляет собой источник ценной информации о межчастичных расстояниях, которые, в свою очередь, отражают природу сил, действующих между компонентами. Именно важностью величин плотности для теории ионных расплавов и практики их промышленного использования обусловлено огромное число работ по экспериментальному их определению в зависимости от температуры и химического состава системы.
Удивительно, но, несмотря на относительную простоту измерений плотности жидкостей и большую информативность этого свойства, в литературе практически нет сведений о поведении плотности в двухфазных системах. Условно к работам в этой области можно отнести исследования систем хлоридов лития и натрия с трихлоридом алюминия [1, 2]. Пикнометрическим методом авторы измерили плотности двух жидких и паровой фаз. Показано, что верхняя фаза состоит практически из чистого трихлорида алюминия, параметры которой существенно менялись с ростом температуры. Поскольку плотность нижней фазы была неизменной вплоть до критической температуры, авторы не смогли извлечь из полученных результатов какую-либо информацию о критических показателях фазового перехода жидкость–жидкость. Более того, параметры равновесия жидкость–пар в этих системах мало чем отличались от параметров, найденных для чистого трихлорида алюминия [3].
В предлагаемой работе исследовано поведение расслаивающихся галогенидных расплавов с использованием данных по плотности фаз на линии насыщения с целью установления влияния размеров ионов и характера химической связи на критические характеристики фазового перехода жидкость–жидкость. Объектом исследования явились два семейства расплавов: смеси галогенидов щелочных с преимущественно кулоновским типом межчастичного взаимодействия и системы с галогенидами серебра, склонными к образованию ковалентных связей [4, 5].
МЕТОДИКА ИЗМЕРЕНИЯ
Для измерения плотности двухфазных ионных систем был выбран метод Архимеда, как наиболее просто реализуемый при высоких температурах и обеспечивающий высокую точность измерений. Он основан на определении разности масс твердого груза, висящего в воздухе и погруженного в жидкую фазу. Отношение этой разности к объему поплавка при данной температуре дает величину плотности жидкости. Основные сложности при реализации метода Архимеда заключаются в учете эффектов натекания жидкости на нить, к которой подвешен поплавок под действием сил поверхностного натяжения; конденсации паров соли на нити подвеса при высоких температурах эксперимента, а также теплового расширения поплавка. Дополнительные сложности создает агрессивность исследуемых электролитов, содержащих фторид лития, что вносит ограничения в подборе конструкционных материалов ячейки. Существенным требованиям к экспериментам было по возможности более точное поддержание и измерение температуры в расслаивающихся солях. Это необходимо, для того чтобы иметь достаточные основания для определения состояния системы вблизи критической температуры. Негативное влияние этих факторов в максимально возможной степени было устранено в процессе разработки методики измерения плотности в двухфазных жидких системах при высоких температурах [6–13]. Установка для измерения смонтирована на базе микровесов “Sartorius”, защитный корпус которых имел с измерительной ячейкой общее газовое пространство. В качестве поплавка использован платиновый или золотой цилиндр, подвешенный к коромыслу весов на тонкой платиновой проволоке. Электролит находился в тигле из стеклоуглерода, золота или платины, помещенном в кварцевую пробирку. Температуру поддерживали автоматически с точностью 1 К и измеряли платино-платинородиевой термопарой, которую погружали в середину расплава вблизи границы раздела расслоившихся фаз. Часть термопары, контактирующая с расплавом, была защищена от агрессивного электролита чехлом из платины. Перед проведением всех экспериментов систему вакуумировали, затем заполняли ее чистым аргоном.
Объем цилиндра определяли его взвешиванием в кипяченой дистиллированной воде при 298 К, а затем в чистых расплавленных CsCl и NaCl при нескольких температурах. Из полученных значений Δm и известных плотностей жидкостей [14, 15] находили величины объема, по формуле (v = Δm/ρж). Такая калибровка автоматически учитывает влияние температуры и втягивающей силы поверхностного натяжения. Использование этих величин объема поплавка при разных температурах для определения плотностей известных солей показывает хорошее совпадение последних со справочными значениями. Неопределенность в определении плотности составляет 2 кг/м3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Величины плотностей сосуществующих фаз для смесей фторида лития с галогенидами калия, рубидия и цезия, а также смесей галогенидов щелочных металлов и серебра для соответствующих температур приведены в табл. 1.
Таблица 1.
Плотность верхней ρ1 и нижней ρ2 (кг/м3) фаз вдоль линии насыщения для расслаивающихся расплавленных смесей
| LiF + KBr | LiF + RbBr | LiF + CsBr | LiF + KI | LiF + RbI | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T, K | ρ1 | ρ2 | T, K | ρ1 | ρ2 | T, K | ρ1 | ρ2 | T, K | ρ1 | ρ2 | Т, К | ρ1 | ρ2 |
| 1101 | 1806 | 1920 | 1123 | 1826 | 2436 | 1120 | 1846 | 2690 | 1115 | 1750 | 2454 | 1119 | 1810 | 2755 |
| 1127 | 1809 | 1914 | 1133 | 1823 | 2401 | 1145 | 1828 | 2663 | 1136 | 1752 | 2430 | 1132 | 1806 | 2738 |
| 1144 | 1810 | 1912 | 1153 | 1816 | 2385 | 1153 | 1820 | 2647 | 1149 | 1758 | 2408 | 1149 | 1808 | 2719 |
| 1161 | 1812 | 1909 | 1173 | 1810 | 2349 | 1196 | 1806 | 2591 | 1163 | 1760 | 2393 | 1171 | 1804 | 2688 |
| 1175 | 1813 | 1903 | 1193 | 1793 | 2314 | 1209 | 1787 | 2565 | 1174 | 1762 | 2378 | 1192 | 1808 | 2657 |
| 1191 | 1816 | 1894 | 1211 | 1778 | 2271 | 1217 | 1773 | 2579 | 1187 | 1764 | 2377 | 1214 | 1807 | 2629 |
| 1210 | 1823 | 1881 | 1228 | 1762 | 2231 | 1238 | 1763 | 2503 | 1198 | 1765 | 2356 | 1234 | 1810 | 2618 |
| 1223 | 1827 | 1875 | 1243 | 1767 | 2204 | 1264 | 1736 | 2503 | 1211 | 1767 | 2358 | 1255 | 1807 | 2596 |
| 1230 | 1832 | 1870 | 1251 | 1764 | 2179 | 1229 | 1771 | 2339 | ||||||
| 1235 | 1836 | 1866 | 1268 | 1745 | 2100 | 1248 | 1787 | 2323 | ||||||
| 1239 | 1844 | 1864 | 1285 | 1728 | 1937 | 1260 | 1800 | 2305 | ||||||
| 1241 | 1849 | 1862 | 1295 | 1720 | 1872 | |||||||||
| 1243 | 1850 | 1850 | ||||||||||||
| LiF + CsI | LiF + CsCl | LiCl + AgBr | NaCl + AgI | |||||||||||
| T, K | ρ1 | ρ2 | T, K | ρ1 | ρ2 | T, K | ρ1 | ρ2 | Т, К | ρ1 | ρ2 | |||
| 1134 | 1796 | 2765 | 1143 | 1861 | 2365 | 819 | 2407 | 5018 | 1028 | 2301 | 4841 | |||
| 1156 | 1782 | 2729 | 1173 | 1875 | 2325 | 823 | 2500 | 4921 | 1033 | 2388 | 4669 | |||
| 1161 | 1779 | 2722 | 1203 | 1904 | 2268 | 825 | 2553 | 4844 | 1038 | 2459 | 4499 | |||
| 1176 | 1773 | 2699 | 1215 | 1917 | 2236 | 829 | 2695 | 4771 | 1043 | 2580 | 4370 | |||
| 1196 | 1765 | 2669 | 1225 | 1926 | 2212 | 833 | 2871 | 4649 | 1048 | 2769 | 4289 | |||
| 1213 | 1760 | 2644 | 1237 | 1961 | 2173 | 836 | 3031 | 4499 | 1053 | 2900 | 4170 | |||
| 1233 | 1753 | 2613 | 1243 | 1975 | 2152 | 839 | 3200 | 4401 | 1057 | 3032 | 4062 | |||
| 1251 | 1747 | 2586 | 1253 | 1990 | 2095 | 841 | 3362 | 4239 | 1060 | 3209 | 3908 | |||
| 1255 | 2020 | 2078 | 842 | 3471 | 4117 | 1063 | 3440 | 3780 | ||||||
| 1258 | 2028 | 2028 | 843 | 3650 | 3650 | |||||||||
Для наглядности плотности сосуществующих фаз для трех изученных расплавов в зависимости от температуры показаны на рис. 1 и 2.
Рис. 1.
Зависимость плотности на линии насыщения расплавленных смесей LiF + KBr (⚪, ⚫) и LiF + CsI (△, ▲).
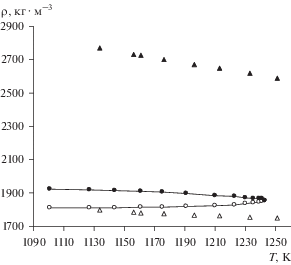
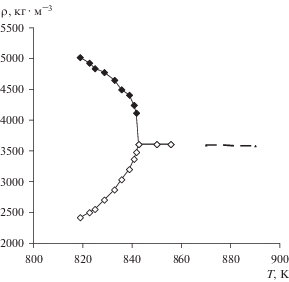
Рис. 2.
Зависимость плотности расплавленных смесей LiCl + AgBr в двухфазной и однофазной областях. Пунктиром обозначены результаты [16].
Известно, что плотность полностью смешивающихся галогенидных расплавов линейно уменьшается с ростом температуры [14, 15] за счет увеличения дефектности объема среды и интенсификации теплового движения ионов. Аналогичным образом ведут себя в зависимости от температуры склонные к сегрегации смеси LiCl + AgBr выше температуры расслаивания [16], а также равновесные фазы на линии насыщения смесей солей, плохо растворимых друг в друге из-за значительной разницы в размерах смешиваемых ионов (LiF + CsI и др.). Ситуация кардинально меняется при переходе к смесям солей с меньшей разностью в размерах ионов, более склонных к смешиванию при той же температуре. Как видно, температурные зависимости плотности сосуществующих фаз становятся нелинейными и разнонаправленными. Для выяснения причины этой метаморфозы рассмотрим подробнее одну из исследуемых систем, а именно расплав LiF + KBr с точки зрения модели заряженных твердых сфер произвольного диаметра [17]. Анализируемый расплав состоит из следующих ионов: K+, Li+, F–, Br–. Согласно модели, сегрегация компонентов смеси солей возникает из-за различной экранирующей способности ионов: чем меньше радиус иона, тем лучше его экранирующая способность. Очевидно, что большие ионные потенциалы (ze/r, где ze – заряд, а r – радиус иона) и малая поляризуемость ионов Li+ и F– провоцируют смещение обменной реакции LiF + KBr = KF + LiBr в сторону образования компонента с наименьшими ионами при температурах ниже критической точки. В результате образуется легкая фаза на основе LiF с максимально возможным энергетическим полем. В этом случае компонент с наибольшей суммой радиусов катиона и аниона не может предотвратить изоляцию фазы из-за мощной химической связи Li–F и “выдавливается” сильным полем из объема в поверхностном слое и образует вторую фазу, обогащенную бромидом калия. С ростом температуры, как следует из фазовой диаграммы [18], существенно меняется соотношение концентраций LiF и KBr в сосуществующих равновесных фазах. В тяжелой фазе, обогащенной бромидом калия, рост температуры сопровождается увеличением концентрации фторида лития. Плотность фторида лития меньше плотности бромида калия, что, как и рост температуры, способствует снижению плотности фазы в целом.
Для легкой фазы, обогащенной фторидом лития, температурный и концентрационный факторы действуют на плотность в противоположных направлениях. По мере возрастания температуры плотности расслоившихся фаз сближаются, как это и должно быть для систем с верхней критической точкой.
Следует обратить внимание на то, что плотность верхней фазы системы LiF + CsI меньше, чем у той же фазы в системе LiF + KBr, хотя плотность иодида цезия больше плотности бромида калия при одинаковой температуре. Причиной этого факта может быть только меньшая при прочих равных условиях растворимость компонента с большими размерами ионов во фториде лития, что находится в согласии с фазовыми диаграммами сравниваемых смесей [18].
Плотности фаз на линии насыщения для систем с галогенидом серебра меняется сходным образом, демонстрируя разный температурный наклон (рис. 2). График показывает, что, во-первых, плотность расплава критического состава в точке полного смешивания хорошо совпадает с величиной, полученной экстраполяцией данных [16] (3.610 и 3.619 г/см3, соответственно). Вторая особенность графика заключается в том, что температурные наклоны зависимостей в однофазной и двухфазной областях существенно разнятся. Притом, что знак температурного наклона одинаков для тяжелой фазы и однофазного расплава, темп снижения плотности фазы, обогащенной бромидом серебра, значительно больше, чем это имеет место для однофазной системы. Дополнительным фактором снижения плотности тяжелой фазы является увеличение в ней концентрации хлорида лития, плотность которого меньше плотности галогенида серебра. Увеличение с ростом температуры плотности верхней фазы, обогащенной хлоридом лития, связано с увеличением растворимости галогенида серебра.
Соотношение плотностей фаз, находящихся в термодинамическом равновесии, существенно зависит от размеров смешиваемых ионов. Это следует из графиков, приведенных на рис. 3 и 4, где разность плотностей фаз на линии насыщения, ∆ρ, отложены относительно температуры. Как видно, разность плотностей в равновесных фазах уменьшается с ростом температуры. В области низких температур характер этих зависимостей для расплавов щелочных галогенидов с большими катионами и анионами практически одинаков и хорошо передается прямыми линиями. Снижение разности плотностей по мере роста температуры резко ускоряется для смесей галогенидов щелочных металлов с меньшей разностью в размерах ионов и для всех расплавов, содержащих галогенид серебра. Для ряда систем удалось максимально приблизиться к температуре, когда плотности фаз стали неразличимыми.
Рис. 3.
Разность плотностей фаз на линии насыщения для расплавов LiF + KBr (⚫), LiF + CsCl (◼), LiF + + RbBr (⚪), LiF + KI (△), LiF + CsBr (◇), LiF + RbI (◆), LiF + CsI (▲).
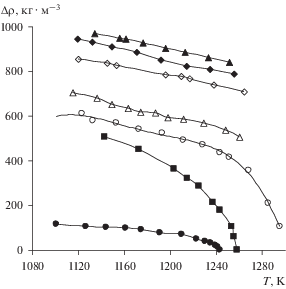
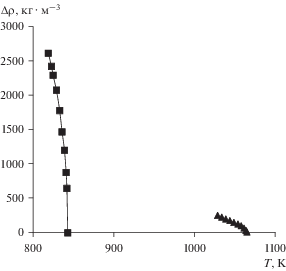
Рис. 4.
Температурная зависимость разности плотностей фаз вдоль линии насыщения для расплавов NaCl + + AgI (▲), LiCl + AgBr (◼).
Для понимания роли размерного фактора в механизме фазового перехода жидкость–жидкость в случае расплавленных солевых смесей показателен, на наш взгляд, рис. 5. Он демонстрирует соотношение между разностью плотностей сосуществующих фаз расслоившихся расплавов с кулоновским характером межчастичных связей при 1240 К и разностью в размерах смешиваемых солей ∆ = RRX– RLiF. Здесь RRX представляет собой сумму размеров крупных ионов щелочного металла и галогена, а RLiF есть сумма радиусов наименьших ионов смеси. Из него следует, что различия в состоянии жидких фаз ионных солевых смесей, находящихся в условиях термодинамического равновесия, тем значительнее, чем больше различаются размерами смешиваемые ионы.
Рис. 5.
Зависимость разности плотностей фаз на линии насыщения от размерного фактора ∆ для смесей LiF + KBr (⚫), LiF + CsCl (◼), LiF + RbBr (⚪), LiF + KI (△), LiF + CsBr (◇), LiF + RbI (◆), LiF + CsI (▲) при 1240 К.
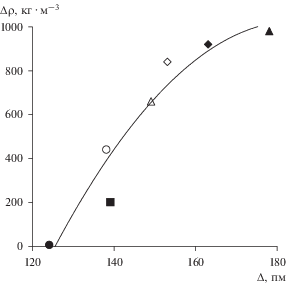
Судя по характеру фазовых диаграмм [19], подобную зависимость разности плотностей сосуществующих фаз относительно размерного фактора ∆ = RAgX– RRX (RAgX – сумма радиусов катиона серебра и галогенидного аниона, RRX – сумма размеров ионов галогена и щелочного металла) можно ожидать и для систем с галогенидом серебра. Для подтверждения этой гипотезы необходимо исследовать другие смеси этого семейства в дополнение к двум рассмотренным в статье системам. Пока лишь можно констатировать одну особенность расплавов с галогенидом серебра. Так, разность плотностей при 843 К в системе LiCl + AgBr близка к нулевому значению. При этой температуре смесь AgI + NaCl остается в твердом состоянии по причине более ионного характера химической связи в хлориде натрия по сравнению с галогенидами лития [20].
Вместе с тем, рис. 5 дает возможность выявить существенное отличие в поведении этих двух семейств расслаивающихся систем. Так, в смесях фторида лития с другими галогенидами щелочных металлов сегрегация не обнаруживается, если размерный фактор, ∆, меньше 125 пм (система LiF + KBr). Однако расплавы с галогенидом серебра склонны к расслаиванию в жидком состоянии при существенно меньших значениях размерного фактора. Так, например, для смесей AgI + NaCl разность в суммах радиусов тяжелых и легких компонентов, составляющих стабильную диагональ, равна 52 пм. По-видимому, дополнительным фактором, который способствует расслаиванию расплавов с галогенидом серебра, является более низкая плотность зарядов вокруг катиона серебра в расплаве по сравнению с галогенидом щелочного металла [21].
Графики на рис. 3 и 4 показывают, что с ростом температуры величины плотностей фаз сближаются. Для ряда расплавов (LiF + KBr, LiF + CsCl, NaCl + AgI и LiCl + AgBr) при некотором значении температуры плотности сравниваются, когда составы фаз выравниваются и системы становятся однофазными. Эта температура соответствует верхней критической точке фазового перехода жидкость–жидкость. Значения критических температур смешивания приведены в табл. 2 вместе с литературными данными [18, 19]. Здесь же даны величины критической плотности.
Как видно, найденные методом измерения плотности величины критической температуры смешивания в пределах 0.5% совпадают с известными значениями, соответствующими вершине купола несмешиваемости [19] для смесей, содержащих галогенид серебра. Для смесей галогенидов щелочных металлов измерения дали более высокие значения Тк (на 16 и 72 К для LiF + KBr и LiF + CsCl, соответственно). Как сообщают авторы [18, 19], момент фазового перехода жидкость–жидкость фиксировался визуально по помутнению расплава. Этот метод при высоких температурах, несомненно, уступает в точности инструментальному способу.
Данные табл. 2 демонстрируют существенную зависимость критической температуры смешивания от состава солевого расплава. В рамках модели заряженных твердых сфер произвольного диаметра [17] показано, что с ростом разности в размерах ионов компонентов расплавов должно происходить уширение двухфазной области и рост критической температуры смешивания. Экспериментальные величины критической температуры смешивания в целом находятся в соответствии с предсказаниями теории.
Рисунок 6 показывает, что вблизи критической точки смешивания температурная зависимость разности плотностей фаз на линии насыщения с хорошим приближением описывается универсальным уравнением ρ* ≈ (Т *)β. Здесь T * – приведенная температура (Tк – T)/Tк, ρ * – приведенная плотность Δρ/ρк. Как видно, для обеих смесей галогенидов щелочных металлов критическая экспонента β = 0.50, что соответствует средне-полевому (классическому) поведению ионных расплавов [17, 22]. Семейство расплавов с галогенидом серебра также описывается одним уравнением, но для них критическая экспонента оказалась на 13% меньше (рис. 7), приближаясь к изинговому показателю критичности [23]. Подобное соотношение между критическими экспонентами для двух рассматриваемых семейств солевых систем найдено и при выборе других параметров порядка. Так, согласно более ранним исследованиям скорости звука [24–26], электропроводности [27, 28] и поверхностной энергии [29, 30] этих систем, разница в критических показателях составляет 8–15%.
Рис. 6.
Зависимость приведенной плотности, ρ*, от приведенной температуры, T *, для расплавленных смесей LiF + KBr (⚫) и LiF + CsCl (◼) в логарифмических координатах.
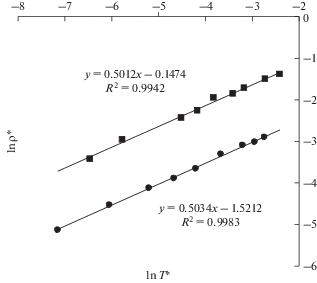
Рис. 7.
Зависимость приведенной плотности, ρ *, от приведенной температуры, T *, для расплавленных смесей NaCl + AgI (△) и LiCl + AgBr (◻).
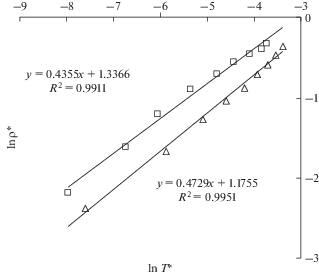
Отсюда следует важный вывод, что закон соответственных состояний строго выполняется для семейств ионных систем с одинаковым типом парного потенциала. Возможно, в этом кроется корень противоречия в описании критичности систем на основе ионных жидкостей [22, 23]: учет только кулоновских сил предсказывает классическое поведение систем в окрестностях критической точки смешивания жидкостей, тогда как введение в парный потенциал короткодействующих сил предписывает изинговое поведение расслаивающихся жидкостей.
ЗАКЛЮЧЕНИЕ
Плотности равновесных фаз для двухфазной области расплавленных смесей щелочных галогенидов друг с другом и с галогенидами серебра получены с использованием метода Архимеда с целью установления роли размера ионов в фазовом переходе жидкость–жидкость. Показано, что изменение плотности вдоль линии насыщения обусловлено суперпозицией влияний теплового движения частиц и состава фаз. Разница в значениях плотности для сосуществующих фаз возрастает с увеличением разницы в размерах замещающих друг друга ионов как для щелочных галогенидных расплавов, так и для смесей с галогенидом серебра. В окрестности критической точки смешения для исследуемых систем строго выполняется теорема о соответствующих состояниях. Однако критические показатели для расплавов, содержащих галогениды серебра, были ниже, чем для щелочных галогенидных расплавов, в которых преобладают дальнодействующие кулоновские силы. Различия в поведении расплава могут быть обусловлены тем, что галогениды серебра занимают промежуточное положение между типичными ионными солями и полностью ковалентными соединениями.
Список литературы
Fannin A.A., King L.A., Seegmiller D.W., Øye H.A. Densities and phase equilibria of aluminium chloride-sodium chloride melts // J. Chem. Eng. Data. 1982. 27. № 2. P. 114–119.
Carpio R.A., Fannin A.A., Kibler F.C., King L.A., Øye H.A. Densities and phase equilibria of aluminium chloride-lithium chloride melts // J. Chem. Eng. Data. 1983. 28. № 3. P. 34–36.
Seegmiller D.W., Fannin A.A., Olson D.S., King L.A. Liquid and Vapor Densities of Aluminium Chloride // J. Chem. Eng. Data. 1972. 17. № 3. P. 295–298.
Derrien J.Y., Dupuy J. Structure of molten silver chloride // J. Phys. Chem. Liquids. 1976. 5. № 1. P. 71–91.
Onwuagba B.N. The Electronic Structure of AgF, AgCl and AgBr // Solid Stats Comm. 1996. 97. № 4. P. 267–271.
Баталова В.Н., Рукавишникова И.В., Степанов В.П. Методика измерения плотностей в расслаивающихся солевых расплавах // Расплавы. 2005. № 2. С. 28–34.
Рукавишникова И.В., Локетт В.Н., Бурухин А.С., Степанов В.П. Плотность и поверхностное натяжение высокотемпературных расслаивающихся смесей бромидов щелочных металлов с фторидом лития // Журн. физ. химии. 2006. 80. № 12. С. 2139–2143.
Рукавишникова И.В., Локетт В.Н., Степанов В.П. Плотность фторидно-иодидных расплавов с ограниченной взаимной растворимостью компонентов // Журн. физ. химии. 2008. 82. С. 241–244.
Lockett V.N., Rukavishnikova I.V., Stepanov V.P. Phase Densities of Molten Mixtures of Alkali-Metal Halogenides with Limited Mutual Solubility // Z. Naturforsch. 2007. 62a. P. 303–308.
Stepanov V.P. Adiabatic Compressibility along the Two-Phase Saturation Line for the Molten (LiF + CsCl) System // J. Chem. Thermodyn. 2019. 138. P. 345–349.
Степанов В.П. Плотность и адиабатическая сжимаемость смесей LiF + KBr в двухфазной области // ТВТ. 2019. 57. С. 371–376.
Stepanov V.P., Kulik N.P., Peshkina K.G. Density of a Dissolving Mixture of Molten AgI + NaCl // J. Chem. Thermodyn. 2013. 63. P. 84–87.
Stepanov V.P., Kulik N.P. Density and Adiabatic Compressibility of the Immiscible Molten AgBr + + LiCl Mixture // Z. Naturforsch. 2017. 72a. P. 359–363.
Smirnov M.V., Stepanov V.P. Density and Surface Tension of Molten Alkali Halides and their Binary Mixtures // Electrochim. Acta. 1982. 27. P. 1551–1563.
Janz G.J., Dampier F.W., Lakshminarayan G.R., Lorenz P.K., Tomkins R.P.T. Molten salts, National Standard Reference Data, NBS; National Institute of Standards and Technology, Gaithersburg, MD. 1968. 15. P. 1–168.
Brooks H.C., Paul R.L. Densities and Excess Volumes of Fused Halides // Z. Naturforsch. 1975. 30a. P. 64–68.
Ткачев Н.К. Ограниченная растворимость солевых расплавов и различия в размерах ионов // Расплавы. 1999. № 5. С. 90–94.
Margheritis Ch., Flor G., Sinistri C. Miscibility Gap in Fused Salts. VII. Systems of LiF with Alkali Halides // Z. Naturforsch. 1973. 28a. P. 1329–1334.
Flor G., Margheritis Ch., Vigano G.C., Sinistri C. Miscibility gap in fused salts. XI. Systems formed with silver halides and lithium or sodium halides // Z. Naturforsch. 1982. 37a. P. 1068–1072.
Бацанов С.С. Электроотрицательность элементов и химическая связь. Новосибирск: АН СССР, 1962.
Wilson M., Madden P.A. Polarization Effects in Ionic Systems from First Principles // J. Phys.: Condens. Matter. 1993. 5. P. 2687–2706.
Fisher M.E. The Story of Coulombic Criticality // J. Stat. Phys. 1994. 75. P. 1–36.
Stell S. Criticality and Phase Transitions in Ionic Fluids // J. Stat. Phys. 1995. 78. P. 197–238.
Stepanov V.P., Minchenko V.I. Ultrasound Velocity in Dissolving Alkali Halide Melts // J. Chem. Thermodyn. 2011. 43. № 3. P. 467–470.
Stepanov V.P., Minchenko V.I. An Anion Effect on the Separation of AgI-Containing Melts Using Sound Waves // J. Chem. Thermodyn. 2015. 87. P. 65–68.
Степанов В.П. Скорость ультразвука в расслаивающихся солевых расплавах на линии насыщения // ТВТ. 2020. 58. № 3. С. 344–354.
Stepanov V.P., Babushkina L.M., Dokashenko S.I. Liquid + Liquid Equilibrium in Mixtures of Lithium Fluoride with Potassium and Rubidium Halides // J. Chem. Thermodyn. 2012. 51. P. 12–16.
Stepanov V.P. Electrical Conductivity of Biphasic Mixtures of Molten Silver Iodide and Lithium Fluoride, Chloride, and Bromide // Ionics. 2017. 23. P. 2055–2060.
Lockett V.N., Rukavishnikova I.V., Stepanov V.P., Tkachev N.K. Interfacial Tension in Immiscible Mixtures of Alkali Halides // Phys. Chem. Chem. Phys. 2010. 12. P. 1139–1144.
Stepanov V.P., Kulik N.P. Galvani Potential at Liquid| Liquid Interfaces for Dissolving AgBr + LiCl and AgI + LiCl melts // Ionics. 2018. 24. P. 2851–2856.
Дополнительные материалы отсутствуют.


