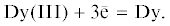Расплавы, 2022, № 3, стр. 255-265
Исследование влияния природы материала катода на электродные процессы при получении металлического диспрозия в расплавленной эвтектике LiCl–KCl–CsCl
А. В. Новоселова a, b, *, В. В. Смоленский a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: alena_novoselova@list.ru
Поступила в редакцию 19.01.2022
После доработки 26.01.2022
Принята к публикации 01.02.2022
- EDN: GPKYHN
- DOI: 10.31857/S0235010622030070
Аннотация
Нестационарными и стационарными электрохимическими методами изучены процессы катодного восстановления ионов Dy(III) до металла в низкоплавком эвтектическом расплаве LiCl–KCl–CsCl в интервале температур 623–973 K на молибденовом, галлиевом и кадмиевом электродах в атмосфере инертного газа. В экспериментах использовали реактивы, не содержащие примесей влаги, кислорода и их соединений. Все основные операции проводили в сухом боксе. Для анализа электрохимических процессов были использованы следующие методы: циклическая и квадратно-волновая вольтамперометрия, потенциометрия при нулевом токе. На циклической вольтамперограмме расплава LiCl–KCl–CsCl–DyCl3 на инертном молибденовом электроде фиксируется один катодный пик тока, соответствующий выделению металлического диспрозия, и один анодный пик тока, связанный с его растворением. На квадратно-волновой вольтамперограмме наблюдается образование одной асимметричной катодной кривой гауссовой формы. Число электронов реакции восстановления, рассчитанное из ширины полупика катодной кривой, было близко к трем (n = 2.97 ± 0.04). Используя диагностические критерии установлено, что процесс катодного восстановления ионов диспрозия(III) до металла протекает необратимо, в одну стадию и контролируется скоростью переноса заряда. Рассчитаны коэффициенты диффузии комплексных ионов [DyCl6]3– при разных температурах и определена энергия активации процесса диффузии. Температурная зависимость коэффициентов диффузии ионов Dy(III) описывается уравнением $\lg D = - 2.59 - \frac{{1840}}{T} \pm 0.02$ и подчиняется закону Аррениуса. Методом потенциометрии при нулевом токе получена температурная зависимость условного стандартного потенциала пары Dy(III)/Dy. Она описывается линейным уравнением: $E_{{{{{\text{Dy(III)}}} \mathord{\left/ {\vphantom {{{\text{Dy(III)}}} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{*}$ = –(3.701 ± 0.006) + (7.8 ± 0.1) · · 10–4T ± 0.004 B. Рассчитаны основные термодинамические характеристики образования трихлорида диспрозия из элементов. Установлено, что на активных электродах реакция электрохимического выделения диспрозия связана с процессом сплавообразования, который предшествует выделению металла и протекает с деполяризацией. Идентифицирован состав интерметаллических соединений Dy–Ga, Dy–Cd и приведены реакции их образования. Изучено влияние плотности тока на состав катодного продукта. Найдены условия получения интерметаллидов заданного состава электролизом расплавленной солевой смеси LiCl–KCl–CsCl–DyCl3.
ВВЕДЕНИЕ
Производство редкоземельных металлов (РЗМ) имеет важное значение, поскольку многие их соединения и сплавы обладают рядом уникальных физических и химических свойств и представляют большой интерес для различных отраслей промышленности. В настоящее время для производства РЗМ используют металлотермическое восстановление или электролиз галогенидных расплавов. Основным преимуществом электролитического способа получения является низкая стоимость восстановителя (электроэнергии) и возможность организации непрерывного процесса [1, 2].
За последние годы открыта новая область использования расплавленных солей – их возможное применение для процессов пирохимической переработки отработавшего ядерного топлива (ОЯТ). Лантаноиды являются нейтронными ядами и представляют собой наиболее опасные продуты деления, которые образуются в ядерном топливе во время работы реактора. Отработавшее ядерное топливо содержит более 24 кг РЗМ на тонну. Проблема переработки ОЯТ и создание замкнутого ядерного топливного цикла привлекает большое внимание ученых во всем мире. Пирохимическая регенерация отработавшего ядерного топлива в расплавленных солях может быть решена с использованием инертных или активных электродов [3–9]. Для успешной реализации данного проекта необходимо знание электрохимических и термодинамических характеристик продуктов деления в расплавленных солях.
В литературе имеются немногочисленные сведения об электрохимическом поведении соединений диспрозия в расплавленных солях. Электрохимическое восстановление ионов Dy(III) до металла в расплавленной эвтектике 3LiCl–2KCl было исследовано нестационарными электрохимическими методами [10, 11]. Авторы предположили, что данная реакция протекает в две последовательные стадии: Dy(III) + ē = Dy(II) и Dy(II) + 2ē = Dy. Однако в более поздних работах [12–14] преобладает иная точка зрения. Установлено, что процесс катодного восстановления ионов Dy(III) до металла на инертных электродах протекал необратимо, в одну стадию с участием трех электронов.
Целью данного исследования является изучение реакции катодного восстановления ионов Dy(III) до металла на инертном Mo и активных Ga, Cd электродах в расплавленной эвтектике LiCl–KCl–CsCl, а также определение условий образования и получения интерметаллических соединений Dy–Ga и Dy–Cd разного состава.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В опытах использовали безводный хлорид лития (99.99%) и трихлорид диспрозия (99.99%) фирмы “Aldrich”, хлориды калия и цезия квалификации “х. ч.”, металлический галлий (99.9999%) и кадмий (99.95%) ОАО “Пикалевский глиноземный завод”. Смеси солей заданного состава (0.575LiCl–0.165KCl–0.260CsCl) готовили из отдельных компонентов в перчаточном боксе GS MEGA (содержание кислорода <1 ppm и влаги <1 ppm).
Эксперименты проводили в стандартной трехэлектродной кварцевой ячейке в тигле из стеклоуглерода под атмосферой сухого аргона в интервале температур 623–973 K. Рабочий электрод представлял собой молибденовую проволоку диаметром 1 мм, которая была погружена в расплав на глубину 3–7 мм. В качестве жидких рабочих электродов использовали металлический галлий или кадмий (2–3 г), помещенный в мини-контейнер из кремнезема. Площадь рабочей поверхности жидких электродов составляла 0.65–0.75 см2. В качестве противоэлектрода применяли стержень из стеклоуглерода диаметром 3 мм. Измерения проводили относительно хлорного электрода сравнения.
Для анализа электрохимических процессов были использованы следующие методы: циклическая и квадратно-волновая вольтамперометрия, потенциометрия при нулевом токе. Измерения выполняли на потенциостате-гальваностате AUTOLAB PGSTAT302N с программным обеспечением (NOVA 1.11).
Образцы растворов проб, содержащие диспрозий, анализировали методом ICP-MS на оптическом эмиссионном спектрометре с индуктивно-связанной плазмой Perkin Elmer OPTIMA 4300 DV.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследования проводили в тройной эвтектике LiCl–KCl–CsCl (0.575–0.165–0.260) с низкой температурой плавления 533 K, что позволяло изучать поведение соединений диспрозия в расплаве в широком интервале температур. Ряд электрохимических методов был использован для установления механизма электрохимического восстановления ионов Dy(III) до металла на инертных и активных электродах. Циклические вольтамперограммы расплавленной смеси LiCl–KCl–CsCl–DyCl3, полученные на молибденовом инертном электроде при 653 K и различных скоростях сканирования, приведены на рис. 1. Зависимости характеризуются наличием одного пика восстановления и соответствующим ему одним пиком окисления. Это указывает на то, что реакция катодного восстановления ионов Dy(III) до металла протекает в одну стадию с возможным участием трех электронов. Увеличение скорости сканирования сдвигало потенциал катодного пика тока в сторону более электроотрицательных значений. В то же время ток катодных пиков был прямо пропорционален корню квадратному от скорости сканирования.
Рис. 1.
Циклические вольтамперограммы расплава LiCl–KCl–CsCl–DyCl3, полученные на молибденовом (S = 0.18 см2) электроде при 653 K. Скорости сканирования, В/с: 1 – 0.1; 2 – 0.08. m(DyCl3) = 2.1 ∙ 10–2 моль/кг.
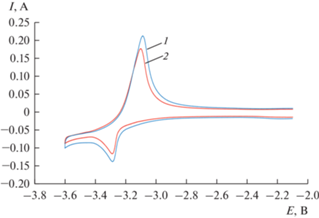
Для уточнения количества электронов, принимающих участие в катодной реакции, были проведены дополнительные эксперименты с использованием квадратно-волновой вольтамперометрии. Асимметричная катодная кривая гауссовой формы была получена в растворе LiCl–KCl–CsCl–DyCl3 при 695 K, рис. 2. Количество электронов, участвующих в электродной реакции, определяли путем измерения ширины полупика восстановления, W1/2 (В), в диапазоне частот (6–32 Гц) и рассчитывали в соответствии со следующим уравнением [15]:
где R – универсальная газовая постоянная, Дж/моль · K; T – абсолютная температура, K; n – число электронов, участвующих в реакции; F – постоянная Фарадея, Кл/моль.Рис. 2.
Квадратно-волновая вольтамперограмма расплава LiCl–KCl–CsCl–DyCl3 при 695 K. Высота импульса 25 мВ; шаг потенциала 1 мВ; частота 16 Гц; m(DyCl3) = 3.4 ∙ 10–2 моль/кг.
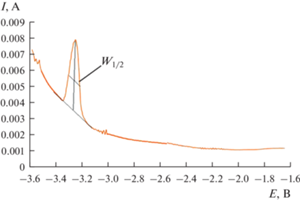
Изменение ширины катодного пика в зависимости от квадратного корня частоты было линейным в диапазоне частот 12–24 Гц. Рассчитанное число электронов катодной реакции было близко к трем (n = 2.97 ± 0.04).
На основании анализа полученных результатов и в соответствии с теорией линейной вольтамперометрии можно сделать вывод, что реакция катодного восстановления ионов Dy(III) до металла на инертном электроде протекает необратимо, в одну стадию и контролируется скоростью переноса заряда [15] и в разбавленных растворах описывается уравнением:
Коэффициенты диффузии ионов [DyCl6]3– в исследуемом расплаве определяли методом циклической вольтамперометрии с применением уравнения (3) [15], справедливого для случая необратимой системы при скоростях сканирования 0.05–0.3 В/с.
Здесь Ip – ток пика, А; S – площадь рабочего электрода, см2; C0 – концентрация ионов диспрозия, моль/см3; D – коэффициент диффузии, см2/с; υ – скорость сканирования, В/с.Зависимость коэффициента диффузии от температуры подчиняется закону Аррениуса и описывается следующим уравнением:
Значения коэффициентов диффузии и энергии активации процесса диффузии ионов диспрозия(III) в расплавленной эвтектике LiCl–KCl–CsCl при разных температурах приведены в табл. 1.
Таблица 1.
Коэффициенты диффузии и энергия активации комплексных ионов [DyCl6]3– в расплавленной эвтектике LiCl–KCl–CsCl при разных температурах
| T, K | lg D | D, cм2/с | EА, кДж/моль |
|---|---|---|---|
| 623 | –5.54 | 2.86 · 10–6 | –35.54 |
| 673 | –5.35 | 4.47 · 10–6 | |
| 723 | –5.12 | 7.59 · 10–6 | |
| 773 | –4.91 | 1.23 · 10–5 | |
| 823 | –4.87 | 1.35 · 10–5 | |
| 873 | –4.72 | 1.91 · 10–5 | |
| 973 | –4.47 | 3.39 · 10–5 |
Равновесный электродный потенциал пары Dy(III)/Dy определяли методом потенциометрии при нулевом токе в расплавленной эвтектике LiCl–KCl–CsCl при разных температурах. Значения условного стандартного потенциала пары Dy(III)/Dy рассчитывали по уравнению Нернста:
(5)
${{E}_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}} = E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}} + \frac{{RT}}{{nF}}{\text{ln}}{{X}_{{{\text{DyC}}{{{\text{l}}}_{3}}}}},$Экспериментальная зависимость описывается следующим уравнением:
(6)
$E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}} = - \left( {3.701 \pm 0.006} \right) + \left( {7.8 \pm 0.1} \right) \cdot {{10}^{{ - 4}}}T \pm 0.004\,\,{\text{В}}{\text{.}}$Условное стандартное изменение свободной энергии Гиббса при образовании трихлорида диспрозия из элементов рассчитывали по уравнению (7). Полученная зависимость описывается выражением (8):
(7)
$\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} = nFE_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}},$(8)
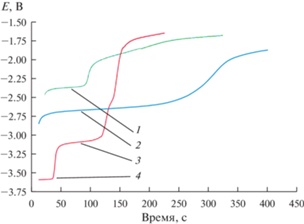
$\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} = - 1071.3 + 0.217 \cdot T \pm 1.1\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}.$На рис. 3 представлены хронопотенциограммы расплава LiCl–KCl–CsCl–DyCl3, полученные на молибденовом, галлиевом и кадмиевом электродах при 755 K. На рис. 3(1) приведена зависимость потенциал–время после кратковременной поляризации Cd электрода. Плато при потенциале –2.38 В отвечает равновесному потенциалу катодного продукта сплава Dy–Cd. На хронопотенциограмме, рис. 3(2), полученной на галлиевом катоде, процесс сплавообразования происходит при потенциале –2.61 В. В случае катодной поляризации инертного молибденового электрода на хронопотенциограммах четко фиксируются два плато, которые соответствуют равновесным потенциалам пары Dy(III)/Dy, рис. 3(3), и пары Li(I)/Li, рис. 3(4). Проведенные исследования показали, что величина деполяризации при разряде ионов диспрозия на галлиевом электроде находилась в диапазоне 0.45–0.50 В, а на кадмиевом электроде – около 0.60–0.65 В. Процесс деполяризации связан с образованием сплавов и интерметаллических соединений при использовании активных катодов во время электролиза расплава.
Рис. 3.
Зависимости потенциал-время, полученные после кратковременной катодной поляризации рабочих электродов в расплаве LiCl–KCl–CsCl–DyCl3 при 755 K. m(DyCl3) = 3.1 ∙ 10–2 моль/кг. I = 50–100 мА; τ = = 5–15 с. 1 – Равновесный потенциал сплава Dy–Cd (Cd рабочий электрод); 2 – равновесный потенциал сплава Dy–Ga (Ga рабочий электрод); 3 – равновесный потенциал пары Dy(III)/Dy (Мо рабочий электрод); 4 – равновесный потенциал пары Li(I)/Li (Мо рабочий электрод).
Для доказательства протекания реакций сплавообразования был проведен потенциостатический электролиз в течение нескольких часов при потенциалах –2.40 В на жидком кадмиевом и при –2.60 В на жидком галлиевом электродах относительно хлорного электрода сравнения. Полученные осадки были проанализированы методом рентгенофазового анализа, рис. 4. Рентгенограмма образца, полученного на галлиевом электроде после электролиза расплава LiCl-KCl–CsCl–DyCl3, не позволяла определить состав и структуру образца из-за его аморфности, рис. 4а. Рентгенограмма образца, полученного на кадмиевом электроде после электролиза, подтвердила образование интерметаллического соединения DyCd6, рис. 4б.
Рис. 4.
Рентгенограммы осадков, полученных на галлиевом (а) и кадмиевом (б) катодах после электролиза растворов расплавленной соли LiCl–KCl–CsCl–DyCl3 при 755 K. m(DyCl3) = 4.6 ∙ 10–2 моль/кг. (а) Потенциал осаждения –2.6 В, τ = 30 мин; (б) потенциал осаждения –2.4 В, τ = 180 мин.
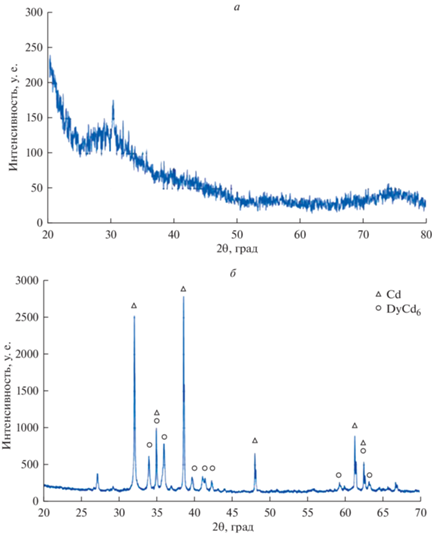
На основании полученных результатов можно заключить, что электролиз расплавленного раствора LiCl–KCl–CsCl–DyCl3 на активных электродах приводит к образованию интерметаллических соединений согласно реакциям:
(9)
$x{{[{\text{DyC}}{{{\text{l}}}_{6}}]}^{{3 - }}} + 3{{\bar {e}}} + y{\text{Ga}} = {\text{D}}{{{\text{y}}}_{x}}{\text{G}}{{{\text{a}}}_{y}} + 6x{\text{C}}{{{\text{l}}}^{ - }},$(10)
$x{{[{\text{DyC}}{{{\text{l}}}_{6}}]}^{{3 - }}} + 3{{\bar {e}}} + y{\text{Cd}} = {\text{D}}{{{\text{y}}}_{x}}{\text{C}}{{{\text{d}}}_{y}} + 6x{\text{C}}{{{\text{l}}}^{ - }}.$Влияние плотности тока на состав катодного продукта было изучено на электродах из галлия (рис. 5) и кадмия (рис. 6) методом потенциометрии при нулевом токе. Эти сведения интересны не только с научной, но и с технологической точки зрения, в первую очередь, для производства металлов высокой степени чистоты и регенерации отработавшего ядерного топлива. Зависимости потенциал–время, полученные после кратковременной катодной поляризации жидкого Ga электрода в расплаве LiCl–KCl–CsCl–DyCl3 при различных значениях поляризующего тока при 823 K, представлены на рис. 5. При токе до 10 мА на хронопотенциограммах не наблюдалось образования твердого продукта, рис. 5(1). Увеличение силы тока до 30 мА приводило к появлению плато, которое может быть связано с образованием интерметаллического соединения с низким содержанием диспрозия, рис. 5(2). Поскольку в данном случае рентгенофазовый анализ не позволял определить состав интерметаллического соединения, рис. 4а, то исходя из фазовой диаграммы Dy–Ga [16], можно заключить, что в данном случае происходило образование интерметаллического соединения наиболее бедного по диспрозию, т.е. γ-DyGa3. Дальнейшее увеличение силы тока при электролизе вызывало смещение потенциала плато в область более электроотрицательных значений, рис. 5 (3–5). Вероятно, это связано с образованием смеси интерметаллических соединений с более высоким содержанием диспрозия (DyGa2, DyGa и др.) [16].
Рис. 5.
Зависимости потенциал–время, полученные после кратковременной катодной поляризации Ga электрода в расплаве LiCl–KCl–CsCl–DyCl3 при различных значениях тока при 823 K. Поляризационный ток (мА): 10 (1); 30 (2); 60 (3); 100 (4) и 200 (5). τ = 10 с. Начальная площадь поверхности жидкого галлия – 0.75 см2. m(DyCl3) = 4.7 ∙ 10–2 моль/кг.
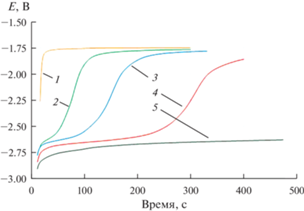
Рис. 6.
Зависимости потенциал-время, полученные после кратковременной катодной поляризации Cd электрода в расплаве LiCl–KCl–CsCl–DyCl3 при различных значениях тока при 823 K. Поляризационный ток (мА): 10 (1); 50 (2) и 100 (3). τ = 10–25 с. Начальная площадь поверхности жидкого кадмия – 0.68 см2. m(DyCl3) = 2.7 ∙ 10–2 моль/кг.
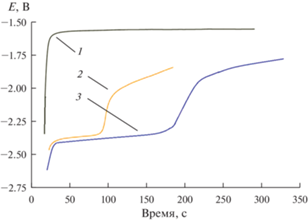
Зависимости потенциал–время, полученные после кратковременной катодной поляризации жидкого Cd электрода в растворе расплава LiCl–KCl–CsCl–DyCl3 при различных значениях поляризационного тока при 823 K, показаны на рис. 6. В этом случае влияние плотности тока поляризации на состав катодного продукта должно быть аналогично системе Dy–Ga с той лишь разницей, что состав катодного продукта может быть идентифицирован с помощью рентгенофазового анализа. При токе меньше 10 мА образования интерметаллических соединений на катоде не обнаружено, рис. 6(1). Увеличение силы тока до 50 мА приводило к появлению плато на зависимости потенциал–время, что могло быть связано с образованием интерметаллического соединения, рис. 6(2). Действительно, гальваностатический электролиз при низких плотностях тока приводил к образованию осадка, который был идентифицирован методом рентгенофазового анализа как интерметаллическое соединение состава DyCd6, рис. 3б. Дальнейшее увеличение силы катодного тока приводило к смещению потенциала плато к более электроотрицательным значениям, рис. 6(3), т.е. к образованию смеси интерметаллических соединений с более высоким содержанием диспрозия.
Проведенные исследования показали, что при силе тока 30–50 мА (40–70 мА/см2) на катоде образуется индивидуальное интерметаллическое соединение с минимальным содержанием диспрозия [16]. При более высоких плотностях токах существует большая вероятность образования смеси интерметаллических соединений.
ВЫВОДЫ
Нестационарными и стационарными электрохимическими методами изучены процессы катодного восстановления ионов Dy(III) до металла в расплавленной эвтектике LiCl–KCl–CsCl в интервале температур 623–973 K на молибденовом, галлиевом и кадмиевом электродах. Установлен механизм осаждения металлического диспрозия на инертном электроде. Доказано, что электродная реакция протекает в одну стадию, необратима и контролируется скоростью переноса заряда. Определена температурная зависимость коэффициентов диффузии ионов диспрозия(III) и установлено, что она подчиняется закону Аррениуса. Рассчитаны энергия активации процесса диффузии и основные термодинамические характеристики трихлорида диспрозия.
Установлено, что на активных электродах реакция электрохимического выделения диспрозия связана с процессом сплавообразования, который предшествует выделению металла и протекает с деполяризацией. Определен состав интерметаллических соединений Dy–Ga, Dy–Cd, приведены реакции их образования и найдены условия их получения электролизом расплавленной солевой смеси LiCl–KCl–CsCl–DyCl3.
Список литературы
Виллани Ф. Редкоземельные элементы. Технология и применение. М.: Металлургия, 1985.
Yezhovska–Trshebiatowska B., Kopacz S., Mikulski T. Rare Elements. Warsaw: Polish Academy of Sciences, 1976.
Koyama T., Iizuka M., Tanaka H., Tokiwai M., Shoji Y., Fujita R., Kobayashi T. An experimental study of molten salt electrorefining of uranium using solid iron cathode and liquid cadmium cathode for development of pyrometallurgical reprocessing // J. Nucl. Sci. Technol. 1997. 34. P. 384–393.
Yoon Jong-Ho, Kim Si-Hyung, Kim Gha-Young, Kim Tack-Jin, Ahn Do-Hee, Paek Seungwoo. A study on the electrodeposition of uranium using a liquid cadmium cathode at 440°C and 500°C // J. Nucl. Fuel Cycle Waste Techn. 2013. 11. P. 199–206.
Laidler J.J., Battles J.E., Miller W.E., Ackerman J.P., Carls E.L., Development of pyroprocessing technology // Prog. Nucl. Energ. 1997. 31. P. 131–140.
Sakamura Y., Hijikata T., Kinoshita K., Inoue T., Storvick T.S., Krueger C.L., Roy J.J., Grimmett D.L., Fusselman S.P., Gay R.L. Measurement of standard potentials of actinides (U, Np, Pu, Am) in LiCl–KCl eutectic salt and separation of actinides from rare earths by electrorefining // J. Alloys Comp. 1998. 271–273. P. 592–596.
Fredrickson Guy L., Yoo Tae-Sic. Liquid cadmium cathode performance model based on the equilibrium behaviors of U and Pu in molten LiCl–KCl/Cd system at 500°C // J. Nucl. Mater. 2020. 528. 151883.
Лебедев В.А. Избирательность жидкометаллических электродов в расплавленных галогенидах. Челябинск: Металлургия, 1993.
Комаров В.Е., Смоленский В.В., Афоничкин В.К. Перспективы использования расплавленных солей в радиохимических технологиях // Расплавы. 2000. 2. С. 59–65.
Yang Y., Zhang M., Han W., Sun P., Liu B., Jiang H., Jiang T., Peng S., Li M., Ye K., Yan Y. Selective electrodeposition of dysprosium in LiCl–KCl–GdCl3–DyCl3 melts at magnesium electrodes: Application to separation of nuclear wastes // Electrochim. Acta. 2014. 118. P. 150–156.
Castrillejo Y., Bermejo M.R., Barrado A.I., Pardo R., Barrado E., Martínez A.M. Electrochemical behavior of dysprosium in the eutectic LiCl–KCl at W and Al electrodes // Electrochim. Acta. 2005. 50. P. 2047–2057.
Novoselova A., Smolenski V., Volkovich V.A. Electrochemical Behavior of Dysprosium in Fused LiCl–KCl Eutectic at Solid Inert Mo and Liquid Active Ga Electrodes // J. Electrochem. Soc. 2020. 167. 112510.
Novoselova A., Smolenski V. The Electrochemical and Thermodynamic Properties of Dysprosium in Molten Alkali Metal Chlorides // J. Electrochem. Soc. 2021. 168. 062510.
Smolenski V., Novoselova A. Electrochemical Separation of Uranium from Dysprosium in Molten Salt/Liquid Metal Extraction System // J. Electrochem. Soc. 2021. 168. 062505.
Bard A.J, Faulkner L.R. Electrochemical Methods Fundamentals and Applications. N.Y.: John Wiley & Sons, 1980.
ASM Binary Phase Diagrams, Software, ASM International (1996).
Дополнительные материалы отсутствуют.