Расплавы, 2022, № 6, стр. 651-660
Синтез борида гадолиния в хлоридно-оксидном расплаве
Д. О. Чухванцев a, *, Н. И. Шуров a, Е. В. Никитина a, b, Е. С. Филатов a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет
Екатеринбург, Россия
* E-mail: malogorka@yandex.ru
Поступила в редакцию 18.06.2022
После доработки 13.07.2022
Принята к публикации 15.07.2022
- EDN: UNCJYA
- DOI: 10.31857/S0235010622060032
Аннотация
Экспериментально доказана возможность синтеза ультрадисперсного порошка гексаборида гадолиния из хлоридно-оксидного расплава путем электрохимического осаждения компонентов на инертном катоде. Ранее подобный синтез боридов осуществляли в хлоридно-фторидном расплаве, а в качестве источника ионов лантана использовали безводные фториды лантаноидов, которые в промышленности получают фторированием оксидов. Технологическими преимуществами нашего расплава являются: исключение промежуточного передела фторирования оксидов; возможность электролиза на воздухе без инертной атмосферы; использование простейшей конструкции электролизера и минимального набора дешевого оборудования. Все это позволит значительно уменьшить себестоимость синтезированных боридов. Все реактивы были заранее подготовлены, хранились до проведения эксперимента в инертном боксе, аттестованы химическим анализом и РФА Предварительно определены оптимальные параметры процесса синтеза боридов: температура и концентрации оксидов B2O3 и Gd2O3; катодные плотности тока при получении боридов гадолиния. Эксперимент проводили в атмосфере воздуха. Простейшая конструкция электролизера состояла из инертного катода (молибденовая проволока), графитового анода и алундового тигля. Сначала проводили очистной электролиз при плотности тока 0.3 А/см2 на протяжении 15 мин для удаления остаточных следов влаги. Основной электролиз вели при плотности тока 0.4 А/см2 на протяжении 4-х часов, с заменой рабочего электрода с интервалом в один час. Полученный осадок отмывали декантацией в дистиллированной воде, подкисленной соляной кислотой, а затем при помощи вакуумного фильтрования отделяли твердую фазу и сушили. Методом РФА идентифицирован фазовый состав и морфология полученных боридов, методом SEM определены размеры кристаллов и их формы. Показано, что в процессе электролиза на катоде образуется смесь двух фаз GdB6 (кубическая сингония, Pm-3m) и GdB4 (тетрагональная сингония, P4/mbm). Предложены химические реакции растворения оксидов бора и гадолиния в хлориде кальция за счет межоксидного взаимодействия, а также электрохимические брутто–реакции образования боридов на катоде.
ВВЕДЕНИЕ
Бориды редкоземельных металлов (РЗМ) характеризуются высокой температурой плавления, химической и термической стабильностью, высокой твердостью. Кроме этого они обладают такими полезными свойствами, как низкая работа выхода электрона, устойчивое удельное сопротивление и низкий коэффициент линейного расширения в широком температурном диапазоне [1–3]. Борид гадолиния находит применение в электронике в качестве катодных эмиттеров [4, 5]. Известно [6], что борид гадолиния обладает высоким поперечным сечением захвата тепловых нейтронов, а каркас из бора обеспечивает ему высокую прочность, что делает борид гадолиния одним из самых перспективных материалов для приготовления нейтронных экранов. Так же вызывают интерес его магнитные свойства [7, 8].
Известные способы получения гексаборидов лантаноидов можно условно разделить на химические и электрохимические, высокотемпературные (>1500°C), среднетемпературные (600–850°С) и низкотемпературные (200–400°С). Достаточно полный литературный обзор химических высокотемпературных методов синтеза гексаборидов РЗМ до 2013 г. представлен в работе Hasan et al. [9]. Для этих методов синтеза гексаборидов РЗМ необходимы специальные реакторы из дорогой высоколегированной жаропрочной стали с атмосферой защитного газа. Кроме этого, высокотемпературный синтез LnB6 путем химического восстановления оксидов Ln2O3 карбидом бора сопровождается крайне нежелательным загрязнением гексаборида углеродом. Низкотемпературные газофазные и автоклавные методы синтеза часто не позволяют получить строго однофазные порошки гексаборидов [10].
Совершенствование электрохимических способов синтеза боридов [1, 2, 11, 12] шло в направлении поиска расплавов с хорошей электропроводностью, с пониженной температурой плавления, хорошо растворимого в воде от чисто оксидных к фторидно-оксидным, и, наконец, к хлоридно-фторидным [13–15].
В данной работе предложен хлоридно-оксидный расплав для синтеза боридов гадолиния на базе хлорида кальция. Преимуществом данного расплава по сравнению с хлоридно-фторидным является использование вместо дорогостоящих фторидов бора и гадолиния их оксидов, что позволило проводить электрохимический синтез боридов на воздухе, в простейшем по конструкции электролизере.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В эксперименте использовались следующие реактивы:
– хлорид кальция CaCl2 (“ч.”), сушили при 200°С при вакуумировании, затем плавили в атмосфере аргона в корундовом тигле при 850°С;
– оксид бора B2O3 (“ч. д. а.”), сушили в твердом виде при 200°С под вакуумом;
– оксид гадолиния Gd2O3 (“ч. д. а.”), прокаливали при 600°С под вакуумом.
Готовые реактивы были аттестованы ICP-MC и рентгенофазовым анализом. Результаты подтвердили их чистоту и до проведения эксперимента они хранились в плотно закрытых ампулах в сухом боксе.
Для проведения опытов была собрана электрохимическая ячейка (рис. 1), которая состояла из корундового тигля (5) с расплавленной солью (6) (CaCl2 + 5 мас. % B2O3 + + 5 мас. % Gd2O3), графитового анода (1) и катода из молибденовой проволоки (2). Для защиты от окисления закрывали с помощью корундовых трубок, те части электродов, которые находились в зоне нагрева, за пределами расплава (3). Положение анода и катода во время опыта фиксировали специальными держателями, закрепленными на штативе.
Рис. 1.
Схема электрохимической ячейки: 1 – графитовый анод, 2 – молибденовый катод, 3 – защитные алундовые чехлы, 4 – оксид бора (B2O3), 5 – корундовый тигель, 6 –хлоридно-оксидный расплав.
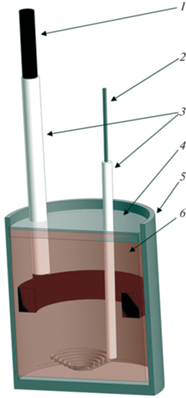
В корундовый тигель загружали необходимое количество сухих CaCl2 + 5 мас. % Gd2O3, и помещали эту смесь в шахтную печь, которую нагревали до 830°С. После расплавления электролита небольшими порциями засыпали на его поверхность 5 мас. % B2O3(тв), который после расплавления из-за меньшей плотности образовывал собственный слой над основным расплавом – (4) на рис. 1. После установления заданной температуры опускали в расплав анод, катод, подключали их к источнику тока Maisheng MP1520D и проводили очистной электролиз в течении 15 минут при плотности тока 0.3 А/см2 для удаления следов влаги. Затем проводили электролиз при различных плотностях тока и установили, что минимальной плотностью тока, при которой начинается образование GdB6, является 0.3 А/см2 с выходом по току около 45%. Оптимальная плотность тока для осаждения борида GdB6 была определена в 0.4 А/см2, при этом выход по току составлял около 86%. Дальнейшее увеличение плотности тока привело к видимым разрушениям алундового тигля и значительному росту загрязнения получаемого продукта оксидом алюминия.
После определения оптимальных параметров для электросинтеза GdB6 проводили основной электролиз на протяжении 4 ч при плотности тока 0.4 А/см2, каждый час проводя замену рабочего молибденового электрода.
Осадок отделяли от катода (рис. 2) с помощью дистиллированной воды. Полученный раствор со взмученным осадком подкисляли соляной кислотой. Нагревали его на электрической плитке и кипятили 15 мин, затем с помощью декантации отделяли твердую фазу и добавляли новую порцию подкисленной дистиллированной воды. После повторения данной процедуры несколько раз, медленно выливали раствор со взмученным осадком в воронку Бюхнера на бумажный фильтр и проводили вакуумное фильтрование. Дополнительно промывая осадок дистиллированной водой, во время откачки для удаления остатков кислоты, проверяя среду лакмусовой бумажкой. Осадок на бумажном фильтре сушили спиртом, а затем в сушильном шкафу. Полученный порошок взвешивали, определяли выход по току, затем подвергали различным методам анализа для определения его химического и фазового состава.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выход по току рассчитанный по известной формуле составил 86%:
где n = 21 – число электронов, участвующих в электродном процессе; M = 222 – молярная масса, г/моль; F = 26.8 – число Фарадея, А · ч; mf = 1.7 – масса фактически осажденного материала, г; τ = 1 – время проведения опыта, ч; I = 5 – сила тока, А.На диаграмме состояния системы гадолиний–бор [16] имеется пять соединений – GdB2, Gd2B5, GdB4, GdB6, GdB66. Пределы областей гомогенности не установлены.
Товарный “хлорид кальция безводный” всегда содержит связанную воду, что при нагревании на воздухе приводит к появлению в расплаве CaO [17] по последовательным реакциям:
(2)
${\text{CaC}}{{{\text{l}}}_{2}}\cdot{{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{CaOCl}} + {\text{HCl}}{\kern 1pt} \uparrow ,$Ранее в [18] нами было показано, что B2O3 растворяется в CaCl2 только в присутствии CaO за счет обменных реакций с образованием метабората [CaB2O4], который диссоциирует по формуле (4):
(4)
${\text{CaO}} + {{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{3}} \to \{ {\text{C}}{{{\text{a}}}^{{2 + }}} + {{[{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{4}}]}^{{2 - }}}\} .$Из справочника [19] известны соединения метаборатов лантаноидов [LnBO3], которые могут растворяться в расплаве CaCl2 с диссоциацией подобно [CaB2O4]
(5)
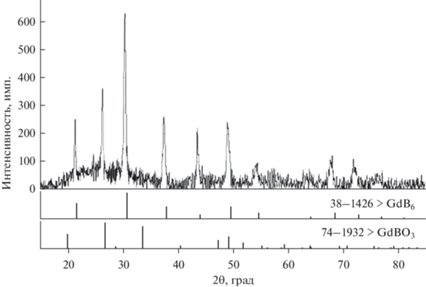
$[{\text{LnB}}{{{\text{O}}}_{3}}] \to \{ {\text{L}}{{{\text{n}}}^{{3 + }}} + {{[{\text{B}}{{{\text{O}}}_{3}}]}^{{3 - }}}\} .$В экспериментах по растворению Gd2O3(тв) в расплаве CaCl2–B2O3 в осадке, промытом после опытов, нам удалось методом РФА (рис. 3) зафиксировать наиболее интенсивную линию, соответствующую метаборату GdBO3, образование которого в расплаве возможно по представить обменной реакцией:
(6)
$\{ {\text{C}}{{{\text{a}}}^{{2 + }}} + {{[{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{4}}]}^{{2 - }}}\} + {\text{G}}{{{\text{d}}}_{{\text{2}}}}{{{\text{O}}}_{{3({\text{тв}})}}} \to 2\{ {\text{G}}{{{\text{d}}}^{{3 + }}} + {{[{\text{B}}{{{\text{O}}}_{3}}]}^{{3 - }}}\} + \{ {\text{C}}{{{\text{a}}}^{{2 + }}} + {{{\text{O}}}^{{2 - }}}\} $(7)
${\text{G}}{{{\text{d}}}_{{\text{2}}}}{{{\text{O}}}_{{3({\text{тв}})}}} + {{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{3({\text{ж}})}}} \to 2{\kern 1pt} [{\text{GdB}}{{{\text{O}}}_{3}}] \to 2\{ {\text{G}}{{{\text{d}}}^{{3 + }}} + {{[{\text{B}}{{{\text{O}}}_{3}}]}^{{3 - }}}\} .$Из законов электрохимической термодинамики следует, что первым на инертном катоде должен выделяться бор. Далее, по данным Uchida [20], даже при небольшом сдвиге катодного потенциала в отрицательную сторону происходит совместное выделение бора и гадолиния с образованием боридов GdB6 и GdB4. Этот потенциал много меньше потенциала выделения чистого гадолиния из его оксида на инертном катоде. Подобную последовательность электродных процессов мы наблюдали раньше [21, 22] при выделении на катоде гексаборидов CaB6 и LaB6.
В соответствии с классификацией Барабошкина [23], если потенциалы выделения элементов на катоде различаются более чем на 0.2 В, то процесс образования сплава или соединения происходит в кинетическом режиме и будет необратимым.
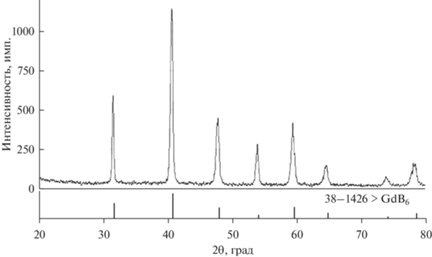
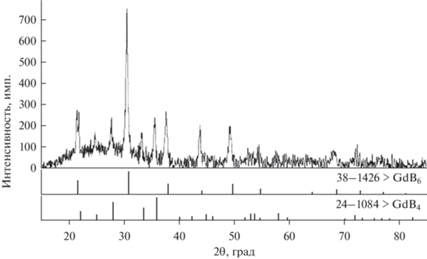
Полученный после отмывки осадок был исследован методом РФА на рентгеновском дифрактометре Rigaku D/MAX-2200VL/PC методом сопоставления экспериментального и эталонных спектров из базы данных PDF-2. Излучение – медное, хроматизированное кремниевым монохроматизатором, диапазон измерений (2θ) – 15°–85°, ширина щелей – 1 и 0.25 мм. Исследование показало (рис. 4), что все линии для осадка, извлеченного из расплава после первого часа электролиза, соответствуют фазе GdB6 (кубическая сингония, Pm-3m). Далее, в связи с отсутствием поступления в расплав новых добавок B2O3 или CaO и как следствие недостатка ионов бора в приэлектродном слое катода при дальнейшем электролизе происходит совместное образование GdB6 (кубическая сингония, Pm-3m) и GdB4 (тетрагональная сингония, P4/mbm). Поэтому в осадке, извлеченном из расплава после второго часа электролиза (и в дальнейшем), зафиксированы все линии, соответствующие фазе GdB6, наиболее интенсивные для фазы GdB4 (рис. 5).
Так как на данный момент не существует способов, которые позволят описать отдельные последовательные и/или параллельные этапы многостадийного необратимого процесса разряда с образованием боридов, мы вынуждены их представить в виде брутто-реакции катодного электроосаждения по следующим схемам:
(8)
$\{ {\text{G}}{{{\text{d}}}^{{3 + }}} + 6{\kern 1pt} {{[{\text{B}}{{{\text{O}}}_{3}}]}^{{3 - }}}\} + 21{{{\text{е}}}^{ - }} \to \left\langle {{\text{Gd}}{{{\text{B}}}_{6}}} \right\rangle + 18{\kern 1pt} {\kern 1pt} [{{{\text{O}}}^{{2 - }}}],$(9)
${\text{\{ G}}{{{\text{d}}}^{{3 + }}} + 4{\kern 1pt} {{[{\text{B}}{{{\text{O}}}_{3}}]}^{{3 - }}}\} + 15{{{\text{е}}}^{ - }} \to \left\langle {{\text{Gd}}{{{\text{B}}}_{4}}} \right\rangle + 12{\kern 1pt} [{{{\text{O}}}^{{2 - }}}].$Ионы [O2–] в ионных солевых расплавах показанные в формулах (8) и (9) могут лишь кратковременно оказываться в “свободном состоянии” в момент перехода из одних комплексов в другие [24], разряжаются на графитовом аноде в момент перехода.
(10)
$3{\kern 1pt} {\kern 1pt} [{{{\text{O}}}^{{2 - }}}] + 2{{{\text{C}}}_{{{\text{графит}}}}} \to {\text{CO}}{\kern 1pt} \uparrow + \,\,{\text{C}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow + {\text{ }}6{{{\text{e}}}^{ - }}.$Образование двухфазного продукта на катоде – обычное явление для электрохимического синтеза, так как электродные реакции (8) и (9) могут идти параллельно. По законам электрохимической термодинамики, первым должно образовываться соединение наиболее богатое по бору, поэтому возможно, что дополнительные небольшие (до 0.5 мас. %) добавки оксида кальция в процессе электролиза ускорят растворимость B2O3 и увеличат концентрацию растворенных ионов бора в расплаве. Это может “кратковременно” повысить вероятность образования однофазного GdB6.
СЭМ изображения порошковых боридов, полученные в BSE-режиме на сканирующем электронном микроскопе TESCAN MIRA 3 LMU представлены на рис. 6. Отчетливо видно, что частицы имеют как кубическую, так и тетрагональную морфологию.
Рис. 6.
Изображения со сканирующего электронного микроскопа в BSE режиме: а – осадок тетрагональной сингонии, б – осадок кубической сингонии.

Энергодисперсионная рентгеновская спектроскопия показала, что порошок состоит из элементов B, Gd и O. Наличие таких легких элементов как бор не позволяет использовать данный анализ в роли количественного. Так как другие методы анализа не подтвердили наличие посторонних оксидных примесей, мы можем предположить наличие тонкого аморфного слоя из оксида бора на поверхности кристаллов, как показано в работе [25].
ЗАКЛЮЧЕНИЕ
В данной работе показана возможность электрохимического синтеза боридов гадолиния из хлоридно-оксидного расплава на базе CaCl2 в атмосфере воздуха. Выбраны оптимальные технологические параметры синтеза – температура, состав электролита и плотность тока.
Конечный продукт аттестован методами РФА и СЭМ. Он представляет собой смесь двух фаз: GdB6, имеющего кубическую морфологию и GdB4, имеющего тетрагональную морфологию. В оптимальном составе электролита при плотности тока 0.4 А/см2 основным продуктом синтеза является GdB6.
Предложены химические реакции растворения оксидов B2O3 и Gd2O3 в расплаве CaCl2, а также электрохимические брутто-реакции образования боридов.
Авторы выражают благодарность Центру коллективного пользования ИВТЭ УрРО РАН за помощь в проведении анализов.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-33-90 279.
Список литературы
Самсонов Г.В., Серебрякова Т.И., Неронов В.А. Бориды. М.: Атомиздат, 1975.
Matkovich V.I., Samsonov G.V., Hagenmuller P.L., Lundstrom T. Boron and Refractory Borides. N.Y.: Springer-Verlag Berlin Heidelberg, 1977.
Segawa K., Tomita A. // J. Magn. Magn. Mat. 1992. 104. P. 1233–1234. https://doi.org/10.1016/0304-8853(92)90563-4
Xu S., Jia F., Yang Y., Qiao L., Hu S., Singh D.J., Ren W. // Phys. Rev. B. 2019. 10. P. 1–8. https://doi.org/10.1103/physrevb.100.104408
Han W., Wang Z., LiQ., Liu H., Fan Q., Dong Y., Kuang Q., ZhaoY. // J. Solid State Chem. 2017. 256. P. 53–59. https://doi.org/10.1016/j.jssc.2017.08.026
Bukatova G.A., Kuznetsov S.A. // Electrochem. Commun. 2005. 7. P. 637–641. https://doi.org/10.1016/J.ELECOM.2005.04.003
Ali N. // J. Appl. Phys. 1988. 63. P. 3583–3585. https://doi.org/10.1063/1.340701
Coles B.R., Cole T., Lambe J., Laurance N. // Proc. Phys. Soc. 1962. 79. P. 84–86. https://doi.org/10.1088/0370-1328/79/1/312
Hasan M., Sugo H., Kisi E. // J. Alloys Compd. 2013. 578. P. 176–182. https://doi.org/10.1016/j.jallcom.2013.05.008
Wang L., Xu L., Ju Z., Qian Y.A. // Crist. Eng. Comm. 2010. 12. P. 3923–3928. https://doi.org/10.1039/c001167c
Kamaludeen M., Selvaray I., Visuvasan A., Jayavel R. // J. Mater. Chem. 1998. № 8. P. 2205–2207. https://doi.org/10.1039/A802895H
Kaptay C., Kuznetsov S.A. // Plasmas & Ions. 1999. 2. P. 45–56. https://doi.org/10.1016/S1288-3255(00)87686-8
Bukatova G., Kuznetsov S., Gaune-Escard M. // Russ. J. Electrochem. 2007. 43. P. 929–935. https://doi.org/10.1134/S1023193507080113
Kushkhov H., Mukozheva R., Vindizheva M., Abazova A., Tlenkopachev M. // J. Mater. Sci. Chem. Eng. 2014. 2. P. 57–62. https://doi.org/10.4236/msce.2014.210010
Kushkhov Kh. B., Uzdenova A.S., Saleh M.A., Uzdenova L.A. // SOP Transactions on Physical Chemistry. 2014. 1. P. 23–29. https://doi.org/10.15764/PCHE.2014.01004
Лякишев Н.П. Диаграммы состояния двойных металлических систем. М.: Машиностроение, 1996.
Зайков Ю.П., Шуров Н.И., Суздальцев А.В. Высокотемпературная электрохимия кальция. Екатеринбург: РИО УрО РАН, 2013.
Чернов Я.Б., Филатов Е.С., Закирьянова И.Д., Каримов K.Р., Антонов Б.Д. Взаимодействие в системе CaCl2–B2O3–СаО в расплавленном состоянии // Расплавы. 2015. № 6. С. 58–66.
Massalski T.B., Pops H. Phase diagrams. N.Y.: Academic Press, 1970.
Uchida K. Cathodic behavior in the electrodeposition of LaB6 // Surface Technolog. 1978. 7. P. 137–143.
Chernov Ya., Filatov E., Shurov N., Smolenski V., Tkachev N. // Metall. Mater. Trans. B. 2019. 50. P. 1745–1751. https://doi.org/10.1007/s11663-019-01626-9
Chukhvantsev D.O., Filatov E.S., Shurov N.I., Rozhentsev D.A. // Inorg. Mater. 2021. 57. P. 14–19. https://doi.org/10.1134/S0020168521010039
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. М.: Наука, 1976.
Храмов А.П., Шуров Н.И. Современные представления о составе оксифторидных комплексов алюминия и схемах их перестройки при электролизе криолит-глиноземных расплавов // Расплавы. 2014. № 1. С. 3–19.
Yu Y., Wang S., Li W., Chen Zh. // Powder Technol. 2018. 323. P. 203–207. https://doi.org/10.1016/j.powtec.2017.09.049
Дополнительные материалы отсутствуют.