Расплавы, 2022, № 6, стр. 589-597
Отделение пленок SiO2 от поверхности кремниевых нановолокон с использованием высокотемпературной вакуумной установки
А. В. Исаков a, М. В. Лаптев a, *, А. О. Худорожкова a, А. С. Шмыгалев a, А. П. Аписаров a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: m.laptev@ihte.uran.ru
Поступила в редакцию 20.06.2022
После доработки 30.06.2022
Принята к публикации 11.07.2022
- EDN: CRHVRP
- DOI: 10.31857/S0235010622060056
Аннотация
Перспективной задачей в энергетической сфере является разработка высокоемких литий-ионных аккумуляторов (ЛИА). Использование кремниевых волокон в качестве анода позволит еще больше увеличить емкость используемых батарей. Однако при этом возникает необходимость получения кремния, свободного от образующегося на поверхности оксида, поскольку наличие кислорода сильно снижает емкость анодного материала ЛИА. В данной работе предложен метод очистки кремниевых нановолокон, полученных электролизом расплавленных солей, от оксидной пленки в реакции с фторидом аммония. Очистку осуществляли с использованием вакуумной установки, созданной авторами. Разработана методика подготовки шихты к очистке и дальнейшему анализу. Кремниевые нановолокна получены электролизом расплава KF–KCl–K2SiF6–SiO2. Химический состав исследован с помощью микрорентгеноспектрального анализа, сопряженного с электронной микроскопией, и методом масс-спектроскопии. Структура и морфология осадков кремния исследована методами электронной микроскопии и рентгеновской дифракции. Показана принципиальная возможность удаления оксидной пленки с поверхности кремниевых нановолокон. Для очистки были использованы шихты Si–NH4F с мольными соотношениями 1/1, 1/0.123 и 1/0.49. Определены состав смеси Si–NH4F и температура, при которых процесс очистки происходит наиболее полно. Рассмотрены термодинамические вероятности протекания химических реакций кремния с фторидом аммония. В ходе исследования установлен механизм взаимодействия фторида аммония с поверхностным оксидным слоем кремниевых нановолокон. Взаимодействие оксидной пленки кремния с фторидом аммония в условиях эксперимента протекает с образованием фазы гексафторсиликата аммония и легколетучих компонентов – аммиака и водяного пара. Определены массовые соотношения кремния и кислорода в очищенных волокнах. Установлено, что увеличение этого соотношения является показателем улучшения очистки поверхности кремния от кислорода. Обработка катодного осадка кремния предложенным способом с использованием высокотемпературной вакуумной отгонки является эффективным методом очистки поверхности кремния от оксидсодержащих соединений, образующихся на его поверхности.
ВВЕДЕНИЕ
Создание аккумуляторов нового поколения невозможно без поиска новых, более емких электродных материалов [1–3]. Наиболее перспективным материалом анода литий-ионных аккумуляторов (ЛИА) является кремний, т.к. он обладает большой емкостью при внедрении лития (4200 мА · ч/г), что значительно превышает теоретическую емкость графита (372 мА · ч/г) [4–6]. Однако существует проблема значительного расширения объема электрода (>300%), возникающего в ходе зарядно/разрядных процессов, что вызывает механические напряжения в кристаллическом кремнии и разрушение электрода при циклировании [7, 8]. Эта проблема может быть устранена при использовании наноструктурного и аморфного кремния [5–7, 9–11].
Перспективным способом получения нановолокон и тонких пленок кремния на различных подложках является электроосаждение из расплавленных солей [12–19], позволяющее управлять структурой и морфологией осадков, добиваться значительных скоростей роста новой фазы. Однако на поверхности полученных осадков остается оксидная пленка [20], возникающая в процессе окисления кремния на воздухе, которая препятствует работе нановолокон кремния в качестве анода ЛИА.
Пленка SiO2 выступает в качестве технологической примеси продуктов электрохимического синтеза нановолокон кремния. При извлечении катодного осадка из электролитической ячейки и отмывке от солевого расплава поверхность кремниевых нанонитей покрывается слоем оксида кремния SiO2. Предполагается, что успешное отделение оксидной пленки можно осуществить через взаимодействие окисленных кремниевых нанонитей и фторида аммония при высокой температуре. Целью данной работы является исследование возможности отвода продуктов реакции взаимодействия SiO2 и NH4F путем создания разряжения (ваккуумирования) в зоне реакции в высокотемпературной вакуумной установке.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Кремниевые нановолокна получали электролизом расплавов KF–KCl–K2SiF6 (10 мол. %)–SiO2 (2–3 мол. %) с мольным отношением KF/KCl = 2 (KF/KCl – 2/1) на графитовом электроде по методике, описанной в работах [21–24]. Полученный электролитический осадок отделяли от электролита водным раствором соляной кислоты при 353 К. Для исследования взаимодействия фторида аммония с оксидом кремния, образующегося на поверхности нановолокон, готовили шихту в расчете на монослой оксидной пленки и загружали в печь.
На рис. 1 представлена схема ячейки в высокотемпературной вакуумной установке, в которой осуществляли взаимодействие оксидной пленки на поверхности кремния с фторидом аммония.
Рис. 1.
Схема ячейки высокотемпературной вакуумной установки: 1 – печь сопротивления; 2 – нагреватели; 3 –кварцевый реактор; 4 – никелевые экраны; 5 – пробка из вакуумной резины; 6 – штуцер для создания разряжения; 7 – штуцер для подачи инертного газа; 8 – реакционный сосуд из стеклоуглерода; 9 – шихта Si/SiO2–NH4F; 10 – термопара.
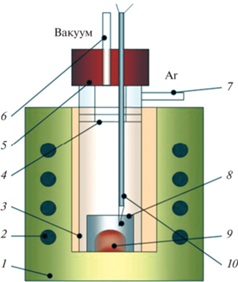
Реактор 3 закрывали пробкой из вакуумной резины 5, в которую был вмонтирован кварцевый штуцер 6 для создания вакуума. Инертную атмосферу в реакторе создавали посредством штуцера 7. Приготовленную в агатовой ступке шихту насыпали в реакционный стакан 8, который размещали в кварцевом реакторе 3. В закрытом реакторе 3 создавали разряжение и проводили нагрев до требуемой температуры. После чего выдерживали шихту в течение 30 мин при температуре эксперимента. Затем отключали форвакуумный насос, заполняли ячейку аргоном и выключали печь. Остывшую до комнатной температуры ячейку вынимали из печи, шихту в реакционном стакане извлекали из ячейки и подвергали анализу.
Исследование химического состава полученных электролитических волокон проводили методом микрорентгеноспектрального анализа, сопряженного с электронной микроскопией, и методом масс-спектроскопии. Структуру и морфологию осадков кремния исследовали методом электронной микроскопии с помощью растрового электронного микроскопа JMS-5900LV (Jeol, Япония), обладающего высоким (до 0.4 нм) разрешением. Фазовый и структурный анализ продукта, полученного при синтезе, выполняли методом рентгеновской дифракции с использованием рентгеновского дифрактометра D/MAX-2200 (Rigaku, Япония) в Cu-Kα-излучении. Полученные в процессе измерений результаты обрабатывали с использованием базы данных Powder Diffraction Files v.2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В экспериментах по удалению оксидной пленки с поверхности нановолокон кремния использовали электролитический осадок кремния, полученный электролизом KF–KCl (2/1 мол. %)–K2SiF6 (10 мол. %)–SiO2 (2–3 мол. %) при ik = 0.02 А/см2 и Т = = 973 К. Общий вид полученного осадка представлен на рис. 2.
Рис. 2.
Общий вид кремниевого осадка, полученного электролизом расплава KCl–K2SiF6–SiO2 при ik = = 0.02 А/см2 и Т = 973 К.

Исследование проводили с образцами шихты следующего мольного соотношения Siкат/NH4F: 1/0.123; 1/0.49; 1/1. На рис. 3 приведены данные электронной микроскопии (SEM) и МРСА исходного осадка кремния, отмытого от электролита.
Рис. 3.
Данные SEM и МРСА нановолокон кремния, полученных электролизом расплава KCl–K2SiF6–SiO2 при ik = 0.02 А/см2 и Т = 973 К.

Полученный осадок представляет собой волокна кремния, толщиной примерно от 2 до 5 мкм. Наличие калия и фтора в осадке объясняется остатками электролита на поверхности нановолокон. Наличие кислорода по результатам МРСА указывает на образование оксидной пленки на поверхности катодного осадка.
Представленный на рис. 2 образец использовался для подготовки шихты. В составе примесей данного образца выявлено наличие оксидной пленки на поверхности кремния. Так же в составе осадка присутствуют примеси фтора и калия – компонентов электролита. Общее содержание примесей меньше предела определения рентгенофазового анализа. Согласно термодинамическим расчетам механизма очистки кремния от окисной пленки, оптимальными температурами начала процесса очистки могут выступать температуры 473 ± 20 и 613 ± 20 К [25]. При этих температурах начинают интенсивно протекать процессы (1) и (2), однако при температуре 473 ± 20 К не происходит термического разложения гексафторсиликата аммония:
(1)
$4{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{F}} + {\text{Si}}{{{\text{O}}}_{2}} = 4{\text{N}}{{{\text{H}}}_{{\text{3}}}}{\kern 1pt} \uparrow + \,\,{\text{Si}}{{{\text{F}}}_{4}}{\kern 1pt} \uparrow + \,\,2{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \uparrow ,$(2)
$6{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{F}} + {\text{Si}}{{{\text{O}}}_{2}} = {{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{Si}}{{{\text{F}}}_{6}}{\kern 1pt} \uparrow + \,\,4{\text{N}}{{{\text{H}}}_{{\text{3}}}}{\kern 1pt} \uparrow + \,\,2{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \uparrow {\kern 1pt} .$Это означает, что если существенная очистка от примесей произойдет при 473 ± 20 К, следовательно, процесс протекает по механизму (1). Если же существенное изменение количества оксидной пленки произойдет при 613 ± 20 К, то кинетика механизма (1) затруднена, и процесс преимущественно протекает за счет реакции (2) с последующим разложением гексафторсиликата аммония по реакции (3), как и следует из очередности достижения отрицательных значений изменения изобарно-изотермического потенциала основных реакций [25].
(3)
${{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{2}}{\text{Si}}{{{\text{F}}}_{6}} = 2{\text{N}}{{{\text{H}}}_{3}}{\kern 1pt} \uparrow + \,\,{\text{Si}}{{{\text{F}}}_{4}}{\kern 1pt} \uparrow + \,\,2{\text{HF}}{\kern 1pt} \uparrow {\kern 1pt} .$На рис. 4 представлены результаты электронной микроскопии (SEM) и МРСА шихты с мольным соотношением Siкат/NH4F = 1/0.123 после проведения реакции при 473 К. Исследование поверхности образца, представленного на рис. 5, показывает, что процесс очистки не произвел должного эффекта. Содержание фтора на поверхности возросло, что говорит о том, что внесенный в шихту фтористый аммоний прореагировал с поверхностью, однако сам с поверхности не удалился.
Рис. 4.
Данные SEM и МРСА осадка, очищенного вакуумированием шихты с мольным соотношением Siкат/NH4F = 1/0.123 (473 К).
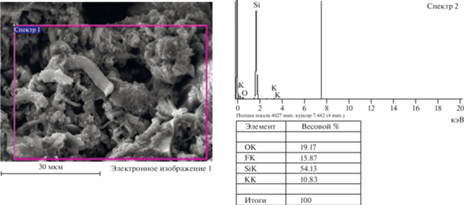
Рис. 5.
Данные SEM и МРСА осадка, очищенного вакуумированием шихты с мольным соотношением Siкат/NH4F = 1/0.49 (613 К).

На рис. 5 представлены результаты электронной микроскопии (SEM) и МРСА шихты с мольным соотношением Siкат/NH4F = 1/0.49 после проведения реакции при 613 К.
Согласно данным МРСА (рис. 5) содержание кислорода в целом по поверхности исследуемого образца снизилось. По молекулярному соотношению не достигается предела, к которому можно было бы отнести SiO2. Наличие данного количества кислорода в образце обуславливается толщиной стабилизирующего слоя, образующегося на поверхности кремния при контакте с атмосферой, который необходим для проведения анализа. Непосредственно на поверхности кремниевой нити уровень кислорода находится на уровне меньше предела определения микрорентгеноспектрального анализа.
На основании результатов проведенных экспериментов можно проследить изменение массового соотношения содержащихся в обработанном осадке кремния и кислорода (табл. 1).
Таблица 1.
Весовое соотношение Si/O в зависимости от условий обработки
| № | мас. % O относительно Si |
Мольное соотношение Siкат/NH4F | Температура обработки, К | Соотношение содержания Si/O после очистки |
|---|---|---|---|---|
| 1 | 13.54 | 1 | – | 6.38 |
| 2 | 26.15 | 1/0.123 | 473 | 2.82 |
| 3 | 8.76 | 1/0.49 | 613 | 10.38 |
Увеличение соотношения содержания кремния к кислороду в обработанном осадке говорит об эффективности процесса очистки кремниевых волокон от оксидной пленки. На основании полученных экспериментальных данных можно заключить, что процесс очистки протекает успешно при температуре обработки 613 К. На основании этого можно предложить механизм процесса очистки, где основу будут составлять химические превращения, представленные на рис. 6 [25].
Для подтверждения данного вывода проведено исследование взаимодействия шихты с фторидом аммония с мольным соотношением Siкат/NH4F = 1 при 613 К. После обработки шихта нацело перешла в вещество белого цвета. Данные рентгенофазового анализа обработанной шихты представлены на рис. 7.
Таким образом, взаимодействие оксидной пленки кремния с фторидом аммония в этих условиях действительно протекает с образованием фазы гексафторсиликата аммония.
ВЫВОДЫ
По результатам работы получены кремниевые нановолокна электролизом расплава KF–KCl (2/1 мол. %)–K2SiF6 (10 мол. %)–SiO2 (2–3 мол. %) при ik = 0.02 А/см2 и Т = = 973 К. Методами сканирующей электронной микроскопии и МРСА установлено, что основной примесью на поверхности кремниевых волокон является кислород в составе оксидной пленки (12.3 мас. %). В ходе исследования установлен механизм взаимодействия фторида аммония с поверхностным оксидным слоем кремниевых нановолокон. Взаимодействие оксидной пленки кремния со фторидом аммония в условиях эксперимента протекает с образованием фазы (NH4)2SiF6, NH3 и водяного пара. Проведены исследования при температурах 473 и 613 К. Установлено, что наилучшее удаление оксидной пленки с поверхности кремниевых нановолокон происходит при 613 К, что подтверждается данными РФА и МРСА. Показано, что обработка с использованием высокотемпературной вакуумной установки является эффективным способом для очистки поверхности кремния от такой технологически примеси как оксидная пленка, образующаяся на поверхности кремниевых нановолокон.
Список литературы
Ackermann T., Andersson G., Söder L. Distributed generation: a definition // Electric Power Systems Res. 2001. 57. P. 195–204.
Singh B., Sharma J. A review on distributed generation planning. Renew. Sustain. // Energy Rev. 2017. 76. P. 529–544.
Scrosati B., Garche J. Lithium batteries: Status, prospects and future // J. Power Sources. 2010. 195. P. 2419–2430.
Wen C.J., Huggins R.A. Chemical diffusion in intermediate phases in the lithium-silicon system // J. Solid State Chem. 1981. 37. P. 271‒278.
Chan C.K., Peng H., Liu G., McIlwrath K., Zhang X.F., Huggins R.A., Cui Y. High-performance lithium battery anodes using silicon nanowires // Nature Nanotechnology. 2008. 3. P. 31–35.
Aricò A.S., Bruce P., Scrosati B., Tarascon J.-M., van Schalkwijk W. Nanostructured materials for advanced energy conversion and storage devices // Nature Materials. 2005. 4. P. 366–377.
Liang B., Liu Y., Xu Y. Silicon-based materials as high capacity anodes for next generation lithium ion batteries // J. Power Sources. 2014. 267. P. 469‒490.
Lee S.-J., Lee J.-K., Chung S.-H., Lee H.-Y., Lee S.-M., Baik H.-K. Stress effect on cycle properties of the silicon thin-film anode // J. Power Sources. 2001. 97–98. P. 191‒193.
Liu H.K., Guo Z.P., Wang J.Z., Konstantinov K. Si-based anode materials for lithium rechargeable batteries // J. Mater. Chem. 2010. 20. P. 10055–10057.
Li W., Guo X., Lu Y., Wang L., Fan A., Sui M., Yu H. Amorphous nanosized silicon with hierarchically porous structure for high-performance lithium ion batteries // Energy Storage Materials. 2017. 7. P. 203–208.
Epur R., Ramanathan M., Beck F.R., Manivannan A., Kumta P.N. Electrodeposition of amorphous silicon anode for lithium ion batteries // Mat. Sci. Eng. B. 2012. 177. P. 1157–1162.
Чемезов О.В., Исаков А.В., Аписаров А.П., Брежестовский М.С., Бушкова О.В., Баталов Н.Н., Зайков Ю.П., Шашкин А.П. Электролитическое получение нановолокон кремния из расплава KCl–KF–K2SiF6–SiO2 для композиционных анодов литий-ионных аккумуляторов // Электрохимическая энергетика. 2013. 13. № 4. С. 201–204.
Чемезов О.В., Виноградов–Жабров О.Н. Батухтин В.П., Аписаров А.П., Исаков А.В., Зайков Ю.П. Способ получения кремния нано- или микроволокнистой структуры. Патент РФ 2399698. Опубл: 20.09.2010. Бюл. № 26.
Stern K.H., McCollum M.E. Electrodeposition of silicon from molten salts // Thin Solid Films. 1985. 124. P. 129–134.
Osen K.S., Martinez A.M., Rolseth S., Gudbrandsen H., Juel M., Haarberg G.M. Electrodeposition of crystalline silicon films from alkali fluoride mixtures // ECS Trans. 2010. 33. P. 429–438.
Yasuda K., Maeda K., Nohira T., Hagiwara R., Homma T. Silicon electrodeposition in water-soluble KF–KCl molten salt: Optimization of electrolysis conditions at 923 K // J. Electrochem. Soc. 2016. 163. P. D95–D99.
Yasuda K., Saeki K., Maeda K., Nohira T., Hagiwara R., Homma T. Electrodeposition of Si film from water-soluble KF–KCl molten salt and feasibility of SiCl4 as a Si source // ECS Trans. 2016. 75. P. 593–601.
Sakanaka Y., Goto T. Electrodeposition of Si film on Ag substrate in molten LiF–NaF–KF directly dissolving SiO2 // Electrochim. Acta. 2015. 164. P. 139–142.
Sakanaka Y., Murata A., Goto T., Hachiya K. Electrodeposition of porous Si film from SiO2 in molten BaCl2–CaCl2–NaCl // J. Alloys Comp. 2017. 695. P. 2131–2135.
Laptev M.V., Isakov A.V., Grishenkova O.V., Vorob’ev A.S., Khudorozhkova A.O., Akashev L.A., Zaikov Yu.P. Electrodeposition of thin silicon films from the KF–KCl–KI–K2SiF6 melt // J. Electrochem. Soc. 2020. 167. 042506.
Chemezov O.V., Apisarov A.P., Isakov A.V., Zaikov Yu.P. Structure silicon deposits obtained by electrolysis SiO2 in the chloride-fluoride melts // Symposium 139 “Silicon Production”, Purification & Recycling for Photovoltaic Cells, TMS 2012 in USA Orlando FL, 2012.
Чемезов О.В., Батухтин В.П., Аписаров А.П., Исаков А.В., Зайков Ю.П. Способ получения нано- и микроволокон кремния электролизом диоксида кремния из расплавов солей. Патент РФ № 2 427 526. Опубл. 27.08.2011.
Чемезов О.В., Поволоцкий И.М., Виноградов-Жабров О.Н., Зайков Ю.П. Способ получения нано- и микроструктурных порошков и/или волокон кристаллического и рентгеноаморфного кремния. Патент РФ № 2 486 290 от 27.06.2013.
Zhuk S.I., Isaev V.A., Grishenkova O.V., Isakov A.V., Apisarov A.P., Zaikov Y.P. Silicon electrodeposition from chloride–fluoride melts containing K2SiF6 and SiO2 // J. Serb. Chem. Soc. 2017. 82. № 1. P. 51–62.
Мельниченко, Е.И. Оксифториды и фторметаллаты аммония в химии и технологии редких металлов. Дис. … на соиск. уч. степ. доктора хим. наук. Владивосток. 1999. 317 с.
Дополнительные материалы отсутствуют.