Расплавы, 2022, № 6, стр. 632-639
Коррозия сплава Hastelloy С2000 в расплаве фторидов щелочных металлов, содержащем Li2O
Е. В. Никитина a, *, Э. А. Карфидов a, Ю. П. Зайков a, К. Е. Селиверстов a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: neekeetina@mail.ru
Поступила в редакцию 24.06.2022
После доработки 04.07.2022
Принята к публикации 11.07.2022
- EDN: UUPUMZ
- DOI: 10.31857/S0235010622060093
Аннотация
В большинстве высокотемпературных технологий с использование расплавленных солей, применяются сплавы, содержащие высокие концентрации хрома, кремния или алюминия, поскольку эти элементы легко образуют пассивные оксидные пленки. Однако в расплавленных галогенидных солях эти оксиды либо не образуются, либо являются нестабильными из-за очень низкой активности кислорода в расплавленных солях. В связи с этим, были проведены эксперименты по определению скорости коррозии сплава Hastelloy C2000 с различной концентрацией O2– (путем добавления в расплав оксида лития в диапазоне концентраций от 0 до 5 мас. %) во фторидном расплаве. Установлено образование защитного кислородосодержащего слоя толщиной 10 мкм. Происходит снижение скорости коррозии на порядок при концентрации анионов кислорода в расплаве от 0.14 до 0.28 мас. %, что может свидетельствовать об обнаружении явления высокотемпературной пассивации материала за счет модифицирования состава фторидного расплава и снижения его коррозионной активности. Кроме того, для сплава Hastelloy C2000 уменьшается глубина коррозонных поражений во фторидных расплавах при введении в расплав оксида лития за счет образования на поверхности кислородосодержащих соединений достаточной толщины.
ВВЕДЕНИЕ
Расплавленные фторидные соли обладают свойствами, которые позволяют их использовать в качестве солевых растворителей в жидкосолевом реакторе-сжигателе (ЖСР-С) [1–5].
Несмотря на то, что фториды щелочных металлов являются одними из самых агрессивных солей с точки зрения деградации конструкционного материала, применяемого в реакторостроении, именно эти солевые расплавы обладают огромными преимуществами из-за высокой теплопроводности, низкой вязкости, высоких температур кипения, наибольшей теплоемкости на единицу объема и нечувствительности к излучению.
Большие преимущества конструкции реакторных систем IV поколения с расплавленными солями заключаются в эффективном использовании топлива, минимальном количестве радиоактивных отходов и экономичном использовании при безопасной и экологически чистой эксплуатации [6–8]. Расплавленные соли можно использовать в качестве теплоносителя реактора или передаточной среды в высокотемпературных технологических тепловых контурах (от ядерных реакторов до производства водорода), однако серьезнейшей проблемой является коррозия металлических материалов [9–11].
Попытки снизить скорость коррозии в расплавленных солевых системах сталкиваются с серьезными подчас непреодолимыми ограничениями. В большинстве высокотемпературных технологий, где используются расплавленные соли вообще, традиционно используются сплавы, содержащие высокие концентрации хрома, кремния или алюминия, поскольку эти элементы легко образуют пассивные оксидные пленки, которые, по всей вероятности, замедляют перенос частиц между металлом и окружающей средой, препятствуя дальнейшей коррозии [12, 13]. Однако в расплавленных галогенидных солях эти оксиды либо не образуются, либо являются нестабильными из-за очень низкой активности кислорода в расплавленных солях. Следовательно, разрушение в значительной степени зависит от межфазных реакций между расплавленной солью и поверхностью чистого металла. Другими словами, механизм коррозии в расплавленных солях намного сложнее, чем в водных средах; образование пассивирующего оксидного слоя на коррозионностойких сплавах становится термодинамически невозможным, в связи с чем, использование многих коррозионностойких сплавов ограничено [14, 15].
Вопреки имеющемуся устоявшемуся мнению о нестойкости оксидного слоя в расплаве галогенидов, в частности фторидов, опубликован ряд работ, в которых есть сведения о значительном повышении стойкости конструкционного материала за счет образования на поверхности оксидного слоя шпинельного типа, тормозящего протекание коррозионного процесса.
Ранее защитное покрытие было нанесено в карбонатном расплаве на подложки из сплава Hastelloy C2000, наиболее оптимальный состав реакционной среды для создания оксидного покрытия нестехиометрического состава, хорошо сцепленного с основой – эвтектический расплав K2CO3–Na2CO3–Li2CO3. Подобные покрытия были получены посредствам 4-х часовой выдержки образцов при температуре 550°С.
Однако такие покрытия могли бы быть использованы как защитные во фторидных расплавах с составами, подходящими для ЖСР, только при условии их изотермического переноса из одного расплава в другой, что не является технологичным. Основываясь на исследованных процессах взаимодействия кандидатных материалов с кислородсодержащими соединениями в расплавленных солях, нами была исследована возможность образования пассивирующего слоя на поверхности кандидатных материалов для ЖСР непосредственно во время коррозионной выдержки в расплаве FLiNaK посредствам задания определенной концентрации от 0 до 1.1 мас. % ионов O2– (в виде Li2O). Данные эксперименты по формированию оксидного покрытия на сплаве Hastelloy C2000 непосредственно во фторидном расплаве показали, что при концентрации от 0.14 до 0.28 мас. % O2– образцы обладают феноменальной коррозионной стойкостью. Таким образом, возможен процесс образования в расплаве фторидов щелочных металлов защитного оксидного слоя, являющегося результатом взаимодействия продуктов коррозии электроотрицательных компонентов стали и анионов кислорода.
На основании полученных электрохимических и коррозионных данных были проведены эксперименты на сплаве Hastelloy C2000 с различной концентрацией O2– во фторидном расплаве с определением возможности образования защитного шпинельного типа уже при бестоковой (коррозионной) выдержке.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты были выполнены в расплаве FLiNaK c добавкой высокочистого оксида лития с концентрацией до 1.1 мас. % по аниону О2–. Исследования проводились в перчаточном боксе, в котором непрерывно поддерживалась инертная атмосфера аргона. В качестве исследуемого материала служила сталь 12Х18Н10Т. Эксперименты проводились в параллели по 3 образца при температуре 550°С и времени выдержки 24 ч.
Эвтектический расплав LiF–NaF–KF (46.5–11.5–42 мол. %) был приготовлен из индивидуальных солей NaF, LiF и KF·HF марок “х. ч.”, подробная методика представлена в работе [16].
Оксид лития синтезировали термическим разложением безводного гидроксида лития под вакуумом. Моногидрат гидроксида лития марки “х. ч.” (ТУ 6-09-3763-85) обезвоживали под вакуумом при температуре 300°С. Безводный LiOH помещали в тигель из оксида магния, тигель устанавливали в герметичную кварцевую пробирку и проводили разложение при температуре 450°С под вакуумом до прекращения выделения воды. После прекращения выделения воды температуру увеличивали до 800°С и обрабатывали синтезированный Li2O водородом для разложения карбоната лития. Синтезированный оксид лития представлял из себя белый порошок с массовой долей оксида лития 99.0% и содержанием Li2CO3 не более 0.5 мас. %.
Образцы солевых плавов, отобранных в процессе эксперимента, а также исходную солевую композицию FLiNaK и синтезированный Li2O анализировали на содержание примесей с помощью масс-спектрометра с индуктивно-связанной плазмой NexIon 2000 (Perkin Elmer, США). Результаты анализа исходного FLiNaK и Li2O приведены в табл. 1.
Таблица 1.
Элементный состав исходного FLiNaK и Li2O
| Элемент, мас. % | Исходный компонент | |
|---|---|---|
| FLiNaK | Li2O | |
| Ti | 0.0027 | 0.0007 |
| Cr | 0.0010 | 0.0011 |
| Fe | 0.0032 | 0.0120 |
| Ni | 0.0042 | 0.0014 |
| Mn | 0.0003 | <0.0001 |
| Ca | 0.0040 | 0.0130 |
| Co | 0.0002 | <0.0001 |
| Cu | 0.0018 | 0.0004 |
| V | <0.0001 | <0.0001 |
| Zr | <0.0001 | <0.0001 |
| Mg | 0.0083 | 0.0047 |
В качестве исследуемых образцов использовался сплав Hastelloy C2000 (59Ni–23Cr–16Mo мас. %). Перед испытанием образцы шлифовали и полировали абразивной бумагой различной зернистости, обезжиривали и сушили. После чего производили замеры габаритных размеров и массы на аналитических весах с погрешностью 0.00001 г, для составления материального баланса.
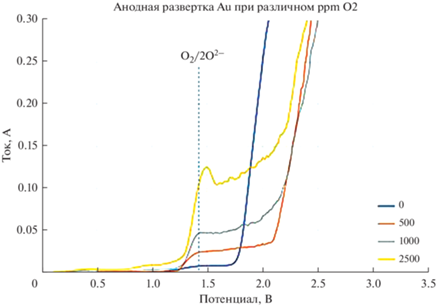
Для фиксирования количества анионов кислорода в расплаве FLiNaK осуществлялась электрохимическая диагностика расплава с помощью метода вольтамперной развертки в анодную область. В качестве измерительного устройства использовали потенциостат AutoLAB PGSTAT 302 N. Рабочий электрод – золотая проволока. В качестве электродами сравнения и вспомогательного были использованы молибденовые стержни. Скорость развертки 0.5 В/с. Полученные вольтамперные зависимости представлены на рис. 1.
По полученным вольтамперным зависимостям наблюдается четкая закономерность возрастания силы тока с увеличением концентрации оксида лития в расплаве.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 2 и 3 представлен внешний вид исследуемых образцов, а также отвердевшего расплава.
Рис. 2.
Внешний вид исследуемых образцов. а – Исходный образец; образцы, выдержанные в расплаве FLiNaK при концентрации О2–, ppm: б – 0, в – 700, г – 1400, д – 2800, ж – 5600, з – 11 200.

Рис. 3.
Внешний вид расплава после коррозионных испытаний. а – Исходный образец; образцы, выдержанные в расплаве FLiNaK при концентрации О2–, ppm: б – 0, в – 700, г – 1400, д – 2800, ж – 5600, з – 11 200.

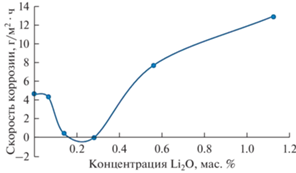
На рис. 4 представлена скорость коррозии в зависимости от концентрации добавки оксида лития в расплаве FLiNaK.
Рис. 4.
Скорость коррозии сплава Hastelloy C2000 в зависимости от концентрации оксида лития в расплаве по данным гравиметрического анализа.
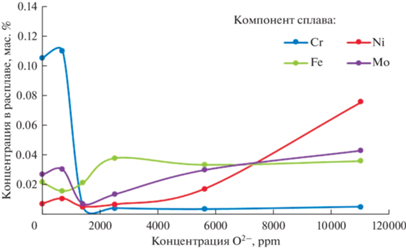
На рис. 5 представлена селективность перехода компонентов сплава в расплав в зависимости от концентрации добавки оксида лития, полученные с помощью элементного анализа отвердевшего расплава после эксперимента.
Рис. 5.
Селективность перехода компонентов сплава Hastelloy C2000 в расплав зависимости от концентрации добавки оксида лития в FLiNaK по данным элементного анализа.
На рис. 6 представлены микрофотографии поверхности и шлифов поперечного сечения исследуемых образцов сплава Hastelloy C2000 выдержанного в расплаве FLiNaK, содержащем различные концентрации Li2O.
Рис. 6.
Элементное картирование шлифа поперечного сечения исследуемых образцов сплава Hastelloy C2000 выдержанного в расплаве FLiNaK, при различной концентрации Li2O.

По данным элементного (рис. 4) и МРСА (рис. 5) анализа можно отметить, что при концентрации выше 700 ppm по O2– наблюдается значительное снижение выхода хрома в расплав, за счет того, что данный компонент стали задерживается в оксидном поверхностном слое.
ВЫВОДЫ
Были проведены эксперименты по определению скорости коррозии сплава Hastelloy C2000 с различной концентрацией O2– (путем добавления в расплав оксида лития в диапазоне концентраций от 0 до 1.1 мас. %) в расплаве фторидов лития, натрия, калия. На основании полученных электрохимических и коррозионных данных установлено образование защитного слоя шпинельного типа толщиной 1 мкм.
При увеличении концентрации анионов кислорода в расплаве от 0.14 до 0.28 мас. % происходит снижение скорости коррозии сплава на порядок, что может свидетельствовать об обнаружении явления высокотемпературной пассивации материала за счет модифицирования состава фторидного расплава и снижения его коррозионной активности.
Исследование выполнено при финансовой поддержке РФФИ и Росатом № 20-21-00022.
Список литературы
Комаров В.Е, Смоленский В.В., Афоничкин В.К. Перспективы использования расплавленных солей в радиохимических технологиях // Расплавы. 2000. № 2. С. 59–65.
LeBlanc D. // Nucl. Eng. Des. 2010. 240. P. 1644–1656. https://doi.org/10.101j.nucengdes.2009.12.033
Khokhlov V., Ignatiev V., Afonichkin V. Evaluating physical properties of molten salt reactor fluoride mixtures // J. Fluorine Chemistry. 2009. 130. P. 30–37.
Barnes J., Coutts R., Horne T., Thai J. Characterization of molten salts for application in molten salt reactors. PAM Review. 2019.
Magnusson J., Memmott M., Munro T. Review of thermophysical property methods applied to fueled and un-fueled molten salts // Annals of Nuclear Energy. 2020. 146. P. 107608.
Serp J., Allibert M., Benes O. Delpech S., Feynberg O. and other. The molten salt reactor (MSR) in generation IV: overview and perspectives // Prog. Nucl. Energy. 2014. 77. P. 308–319.
Williams D.F. Assessment of candidate molten salt coolants for the advanced highi-temperature reactor (AHTR), 2006.
Ядерные реакторы. Ч. 3. Материалы для ядерных реакторов. М.: Изд-во иностранной литературы, 1956.
Менли В., Кубс Д., де Ван Д, Дуглас Д., Инуи Х., Пэтриарка П., Роч Т., Скотт Д. Металлургические проблемы, связанные с использованием расплавленных систем фторидов // Ядерное горючее и реакторные материалы. 1959. С. 36–52.
Manly W.D., Adamson G.M., Coobs J.H., DeVan J.H., Douglas D.A., Hoffman E.E., Patriarca P. Aircraft reactor experiment-metallurgical aspects. ORNL-2349, 1957.
Игнатьев В.В., Крюков О.В., Хаперская А.В. и др. Жидкосолевой реактор для замыкания ядерного топливного цикла по всем актиноидам // Атомная энергия. 2018. 125. № 5. С. 251–255.
Young D.J. High Temperature Oxidation and Corrosion of Metals. Elsevier Science, 2016.
Guo S., Zhang J., Wub W., Zhou W. Corrosion in the molten fluoride and chloride salts and materials development for nuclear applications // Progress in Material Science. 2018. 97. P. 448–487.
Wang Y., Zhang S., Ji X., Wang P., Li W. Material corrosion in molten fluoride salts // Int. J. Electrochem. Sci. 2018. 13. P. 4891–4900.
DeVan J.H., Evans R.B. Corrosion behavior of reactor materials in fluoride salt mixtures. ORNL-TM-328, 1962.
Karfidov E., Nikitina E., Erzhenkov M. and other // Materials. 2022. 15. № 3. P. 761. https://doi.org/10.3390/ma15030761
Janz G.J. // Molten Salts Handbook. 1967. P. 383–387. https://doi.org/10.1016/B978-0-12-395642-2.50032-0
Olson L.C., Ambrosek J.W., Sridharan K., Anderson M.H., Allen T.R. Materials corrosion in molten LiF–NaF–KF salt // J. Fluorine Chem. 2009. 130. P. 67–73.
Kelleher B.C., Dolan K.P., Brooks P., Anderson M.H., Sridharan K. // J. Nucl. Eng. Radiat. Sci. 2015. 1. № 4. P. 041010. https://doi.org/10.1115/1.4030963
Zheng G., Kelleher B., Cao G., Anderson M., Allen T., Sridharan K. // J. Nucl. Mater. 2015. 46. P. 143–150. https://Doi.Org/10.1016/J.Jnucmat.2015.03.004
Yang X., Zhang D., Liu M., Feng S. and other // Corrosion Sci. 2016. 109. P. 62–67. https://doi.org/10.1016/J.Corsci.2016.03.029
De Van J.H. Effect of alloying additions of corrosion behavior of nickel–molybdenum alloys in fused fluoride mixtures. ORNL TM-2021, 1969.
Ozeryanaya I.N. Corrosion of metals by molten-salts in heat-treatment processes // Met. Sci. Heat Treat. 1985. 27. № 3–4. P. 184–188.
Fabre S., Cabet C., Cassayre L., Chamelot P., Delepech S., Finne J., Massot L., Noel D. Use of electrochemical techniques to study the corrosion of metals in model fluoride melts // J. Nucl. Mater. 2013. 441. P. 583–591.
Delpech S., Cabet C., Slim C., Picard G.S. Molten fluorides for nuclear applications // Mater. Today. 2010. 13. № 12. P. 34–41.
Raiman S.S., Lee S. Aggregation and data analysis of corrosion studies in molten chloride and fluoride salts // J. Nuclear Materials. 2018. 511. P. 523–535.
Дополнительные материалы отсутствуют.