Расплавы, 2022, № 6, стр. 622-631
Диаграммы плавкости солевых смесей фторида бериллия с хлоридами щелочных металлов
А. В. Крылосов a, *, И. Б. Половов a, О. И. Ребрин a
a Уральский федеральный университет им. Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: avkrylosov@urfu.ru
Поступила в редакцию 15.06.2022
После доработки 06.07.2022
Принята к публикации 26.07.2022
- EDN: LAAAUP
- DOI: 10.31857/S0235010622060147
Аннотация
Бериллийсодержащие галогенидные расплавы могут использоваться для электролитического получения и рафинирования бериллия, в процессах переработки отработавшего ядерного топлива. Сведения о температурах плавления солевых смесей имеют важное значение для организации технологических процессов с их использованием. Сложность исследования солевых смесей, содержащих фторид бериллия, связана с рядом факторов, среди которых гигроскопичность соли, коррозионная активность по отношению к конструкционным материалам и токсичность паров соли. В этой связи, все подготовительные операции проводили в печаточном боксе, в атмосфере аргона. Дифференциально-термический анализ (ДТА) образцов также выполнен в атмосфере сухого и чистого аргона. В работе использовали тигли из платины и оксида бериллия. Эти материалы показали лучшую устойчивость к коррозии в исследованных расплавленных солевых средах. Приведены диаграммы плавкости фторида бериллия с хлоридами щелочных металлов (Li, Na, K, Cs), построенные по результатам дифференциально-термического и рентгенофазового анализа. Определены координаты эвтектических точек. В интервале изменения концентрации фторида бериллия от индивидуального хлорида щелочного металла до соответствующей эвтектики результаты измерения представлены в форме аппроксимационных полиномов концентрационной зависимости температуры плавления систем BeF2–MeCl (Me = Li, Na, K, Cs). Исследована плавкость солевых смесей эвтектики хлоридов лития и калия с фторидом бериллия. Наиболее легкоплавкая из исследованных смесей содержит 35 мол. % фторида бериллия и плавится при температуре 331°С. Показано отсутствие в исследованных системах тройных соединений. Для идентификации фаз использован рентгено-дифракционный анализ, показавший присутствие в твердой фазе исследованных систем соответствующих хлоридов щелочных металлов. Нахождение фторида бериллия определяли по характерному пику поглощения на инфракрасных спектрах. В работе использована оригинальная методика дистилляции фторида бериллия, полученного разложением фторбериллата аммония. В виду склонности фторида бериллия к стеклообразованию сведения о температурах плавления богатых по этому компоненту солевых смесей носят оценочный характер.
ВВЕДЕНИЕ
Расплавленные солевые смеси широко используются для реализации различных технологических процессов, прежде всего, получения ряда металлов, таких как литий, бериллий, магний, кальций, алюминий, цирконий и других [1–4]. Перспективным направлением применения расплавленных солей является переработка отработавшего ядерного топлива не только с целью решения задач его утилизации, но и возврата в энергетический цикл способных к делению компонентов [5]. Бериллийсодержащие галогенидные расплавы рассматриваются как среда для использования в жидкосолевых реакторах в качестве теплоносителя и компонента топлива [6, 7].
В литературе имеются сведения о диаграммах состояния систем, содержащих фторид бериллия и фториды щелочных (Li, Na, K, Rb, Cs) [8–12] и щелочноземельных металлов (Mg, Ca) [13].
В ряду Li–Na–K–Rb–Cs происходит усложнение диаграмм состояния фторидов щелочных металлов с фторидом бериллия: увеличивается количество эвтектик, соединений и их полиморфных превращений.
Диаграммы состояния фторида бериллия со щелочноземельными металлами, кальцием и магнием описаны в работе [13]. Они имеют более простой вид, по сравнению с диаграммами состояния систем фторидов щелочных металлов с фторидом бериллия и усложняются по мере увеличения ионного радиуса катиона в ряду Mg2+–Ca2+–Sr2+–Ba2+.
В работах [8, 9, 12, 13] на диаграммах состояния указывается температура плавления фторида бериллия 545°С, что соответствует его кристобалитоподобной модификации. В работах [10, 11], ввиду неопределенности температуры плавления фторида бериллия линия ликвидуса не определена. В работе [10] отмечено, что на кривых нагревания кристобалитоподобного BeF2 наблюдается значительный эндотермический эффект, который, при визуальном наблюдении, показывает, что BeF2 плавится частично, а дальнейшее его плавление происходит постепенно. При 740–780°С расплав фторида бериллия становится прозрачным. По данным работы [14] температура плавления фторида бериллия составляет 803°С, что наблюдали и в нашем исследовании.
При выборе состава солевой смеси руководствуются комплексом сведений о физико-химических свойствах системы, важное место среди которых занимают фазовые диаграммы [15]. Как правило, в этом случае бывает достаточно сведений о температурной зависимости равновесия твердых и жидких фаз солевой системы, иными словами, о диаграммах плавкости, построением которых и посвящена настоящая работа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали хлориды щелочных металлов марки “х. ч.”, которые подвергали дополнительной очистке последовательным пропусканием через расплав соли сухого хлористого водорода и очищенного аргона с последующим медленным охлаждением под вакуумом. Контрольные измерения температуры плавления хлоридов щелочных металлов показали хорошую сходимость со справочными данными [16].
При подготовке использованных в исследованиях солей особое внимание было уделено приготовлению фторида бериллия.
Полученный разложением фторбериллата аммония фторид бериллия подвергали дополнительной очистке в аппарате, изображенном на рис. 1.
Рис. 1.
Аппарат для дистилляции фторида бериллия. 1 – Холодильник; 2 – резиновая пробка; 3 – кварцевая ячейка; 4 – экран из тефлона; 5 – экран из никеля; 6 – тигель с очищенным фторидом бериллия; 7 – тигель со фторидом бериллия; 8 – нагреватель; 9 – фильтр.
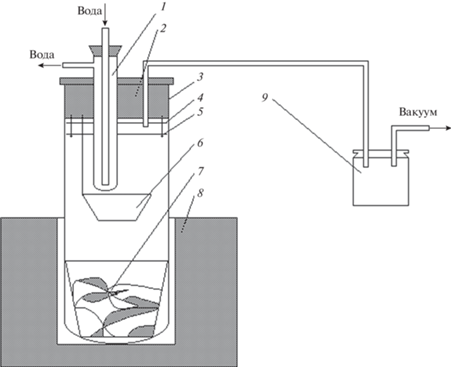
Исходный фторид бериллия загружали в нижний тигель (рис. 1, поз. 7). Ячейку нагревали при непрерывном вакуумировании до 950–1000°С.
Испаряющийся фторид бериллия конденсировался на водоохлаждаемом холодильнике. Периодически воду охлаждения отключали. Конденсат скапывал при этом в тигель-сборник. За 6–8 ч процесс заканчивался с выходом готового продукта 75–80% от исходного количества. Аппарат разгружали в перчаточной камере в атмосфере сухого, чистого аргона. Полученный таким образом фторид бериллия хранили в плотно закрытой таре в атмосфере сухого аргона. Для предотвращения взаимодействия смесей с газовой средой пробоподготовку и все измерения так же проводили в атмосфере сухого и чистого аргона. В качестве материала контейнера использовали платину и окись бериллия. Массу образца подбирали экспериментально. Для различных систем она составляла от 0.5 до 2.5 г. Основная часть исследований выполнена на установке Mettler Toledo TGA/SDTA 851.
Важным методическим моментом, на который было обращено внимание при построении диаграмм плавкости по данным дифференциально-термического анализа (ДТА), является учет склонности некоторых солевых смесей к переохлаждению.
Уменьшить влияние этого явления на корректность построения диаграмм плавкости старались, подбирая режим изменения температуры, массу образца и, используя сочетание данных о температурах фазовых превращений при охлаждении и нагреве образцов [17].
Анализируя различные экспериментальные методы построения диаграмм состояний, авторы работы [18] пришли к выводу о том, что, так называемые политермические методы, к которым относится и ДТА, дают удовлетворительные результаты для нахождения пологих участков линии ликвидуса. Для идентификации вертикальных фазовых границ химических соединений необходимо сочетание ДТА с изотермическими методами исследования. В данной работе в качестве такого дополняющего изотермического метода использовали рентгенофазовый анализ. Съемку рентгенограмм проводили на рентгеновском дифрактометре X’Pert PRO MPD (Panalytical) с быстродействующим твердотельным детектором PIXCEL (СuKα, 1.5406 Å, никелевый β-фильтр). Напряжение: 10–60 кВ, сила тока: 10–60 мА. При помощи рентгено-дифракционного анализа, как правило, решали только задачу идентификации фаз, присутствующих в исследуемом образце, пользуясь методом полнопрофильного анализа Ритвельда c использованием базы данных ICCD (International Centre for Diffraction Data) PDF-2 [19].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Солевые смеси хлоридов щелочных металлов с фторидом бериллия относятся к квазибинарным сечениям тройных взаимных систем Me, Be || Cl, F, соответствующим стабильной диагонали концентрационного четырехугольника. Термодинамический анализ, выполненный в соответствии с рекомендациями авторов работы [13], показал, что пара MeCl–BeF2 является стабильной в широком температурном интервале.
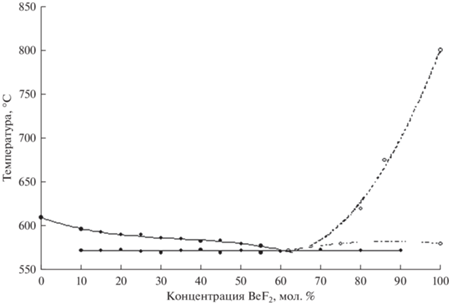
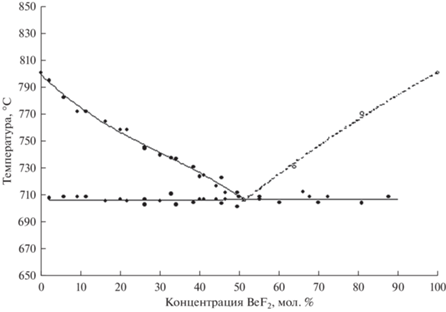
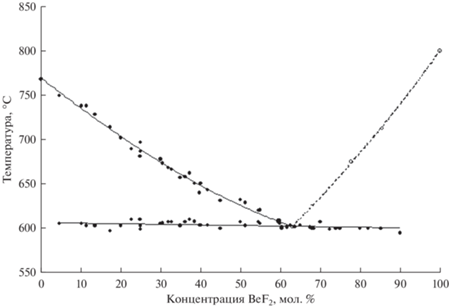
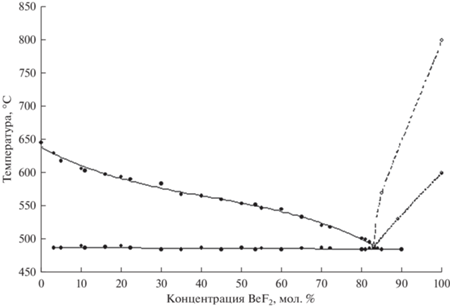
На основании данных дифференциально-термического и рентгенодифракционного анализов построены диаграммы плавкости, представленные на рис. 2–5.
Анализ плавкости сечений концентрационных треугольников MeCl–MeF–BeF2 и MeCl–BeCl2–BeF2 показал образование тройных эвтектик в этих системах и отсутствие тройных соединений. По-видимому, системы Me, Be || Cl, F могут быть отнесены, к так называемым, необратимо-взаимным [20]. Полученный на линиях ликвидуса диаграмм плавкости квазибинарных разрезов минимум является седловинной эвтектической точкой.
По данным рентгенофазового анализа в пробах составов всего исследованного концентрационного интервала присутствуют исключительно пики хлоридов щелочных металлов. Интенсивность пиков снижается с уменьшением концентрации последних. На инфракрасных спектрах обнаружен единственный широкий пик поглощения при 770–910 см–1, характерный для фторида бериллия [21].
Неопределенность в положении ликвидуса в области составов богатых по фториду бериллия связана со свойствами этой соли. Ее термическое поведение изучалось А.В. Новоселовой [22–24]. Показано, что фторид бериллия существует в кварцеподобной модификации. Соединение может быть полностью расплавлено при 580°С, однако при дальнейшем нагревании претерпевает превращение в другую модификацию типа кристобалита, кристаллизуется и вновь превращается в жидкость лишь при температуре около 800°С. Присутствие других солей в смеси может стабилизировать существование отдельных модификаций фторида бериллия.
Кроме того, составы богатые по фториду бериллия при охлаждении затвердевают в виде стекол, давая, в лучшем случае, весьма размытый пик на кривой ДТА. В связи с этим, часть данных была получена совмещенным анализом нагрева и охлаждения образцов.
Полученные сведения обработаны аналогично данным о плавкости бинарных хлоридных систем [25] и представлены в форме полиномов зависимости температуры плавления смеси (Т) от концентрации фторида бериллия (x) (табл. 1).
Таблица 1.
Коэффициенты уравнений концентрационной зависимости температуры плавления смесей в системах MeCl–BeF2
| Me | Температура плавления $T = \sum\limits_{i{\kern 1pt} = {\kern 1pt} 0}^n {{{a}_{i}}{{x}^{i}}} $, °C | |||
|---|---|---|---|---|
| a0 | a1 | a2 · 102 | a3 · 104 | |
| Li | 609.97 | –1.6295 | 4.0052 | –3.8602 |
| Na | 799.57 | –2.8385 | 4.4702 | –4.8211 |
| K | 769.70 | –3.4976 | 0.8815 | –0.7315 |
| Cs | 638.34 | –3.2057 | 5.1305 | –4.1107 |
Границей применимости аппроксимационных уравнений ликвидуса является состав соответствующей эвтектики (табл. 2).
Таблица 2.
Координаты эвтектических точек квазибинарных разрезов тройных взаимных систем Me, Be || F, Cl
| MeCl | Температура, °С | Концентрация BeF2, мол. % |
|---|---|---|
| LiCl | 572 | 61.0 |
| NaCl | 706 | 51.0 |
| KCl | 606 | 63.0 |
| CsCl | 488 | 83.0 |
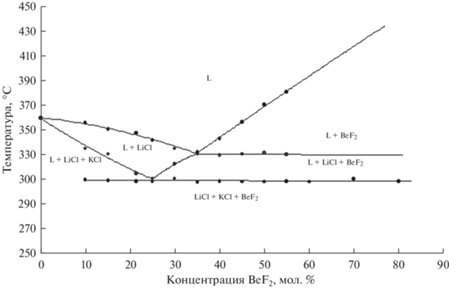
Солевые смеси эвтектики хлоридов лития и калия с фторидом бериллия относятся к четверной взаимной системе Li, K, Be || Cl, F. Составы таких систем принято изображать при помощи трехгранной призмы, в вершинах которой располагают компоненты системы. Исследованное нами сечение лежит в плоскости диагонального разреза призмы, соединяющего вершины LiCl–BeF2–KCl. Отнесение полученных тепловых эффектов кривых ДТА выполнили в предположении, что выделенная система простая эвтектическая. Как следует из приведенной на рис. 6 диаграммы плавкости исследованного сечения, температура плавления тройной эвтектики составляет 309°С. Состав эвтектического сплава специально не исследовали, поэтому можно лишь предполагать, что отмеченная на рис. 6 седловинная точка е будет смещаться в сторону понижения температуры с увеличением концентрации хлорида калия в смеси.
Наиболее легкоплавкая из исследованных смесей содержит 35 мол. % фторида бериллия и плавится при температуре 331°С.
ЗАКЛЮЧЕНИЕ
Положение линии ликвидус для составов богатых по фториду бериллия носит оценочный характер, что связано с как с экспериментальными трудностями исследования подобных солевых смесей, так и с интерпретацией результатов дифференциально-термического анализа.
Следует отметить, сравнительно простые типы диаграмм плавкости многокомпонентных солевых смесей хлоридов щелочных металлов с фторидом бериллия и отсутствие в исследованных смесях тройных соединений. Это обстоятельство обуславливает наличие довольно протяженных областей, в которых изменение концентрации бериллийсодержащего компонента не приводит к резким изменениям температуры плавления солевой смеси. Составы, принадлежащие этим концентрационным областям, представляют интерес для решения технологических задач электролитического получения бериллия и использования данных композиций для развития технологий ядерной энергетики.
Список литературы
Каплан Г.Е., Силина Г.Ф. Остроушко Ю.И. Электролиз в металлургии редких металлов. М.: ГНТИ, 1963.
Сучков А.Б. Электролитическое рафинирование в расплавленных средах. М.: Металлургия, 1970.
Зайков Ю.П., Шуров Н.И., Суздальцев А.В. Высокотемпературная электрохимия кальция. Екатеринбург: РИО УрО РАН, 2013.
Суздальцев А.В., Филатов Е.С., Николаев А.Ю., Панкратов А.А., Молчанова Н.Г., Зайков Ю.П. Извлечение скандия и циркония из их оксидов при электролизе оксидно-фторидных расплавов // Расплавы. 2018. 1. С. 5–13.
Степанов С.И., Чекмарев А.М. Концепция переработки отработавшего ядерного топлива // Доклады Академии наук. 2008. 423. № 1. С. 69–72.
Никитина Е.В., Карфидов Э.А., Зайков Ю.П. Коррозия перспективных металлических материалов во фторидных расплавах для жидкосолевых реакторов // Расплавы. 2021. № 1. С. 21–45.
Игнатьев В.В., Крюков О.В., Хаперская А.В. и др. Жидкосолевой реактор для замыкания ядерного топливного цикла по всем актиноидам // Атомная энергия. 2018. 125. № 5. С. 251–255.
Roy D.M., Roy R., Osborn E.F. // J. Am. Ceram. Soc. 1954. 37. № 7. P. 300–305. https://doi.org/10.1111/j.1151-2916.1954.tb14042.x
Roy D.M., Roy R., Osborn E.F. // J. Am. Ceram. Soc. 1953. 36. № 6. P. 185–190. https://doi.org/10.1111/j.1151-2916.1953.tb12864.x
Борзенкова М.П., Новоселова А.В., Симанов Ю.П., Черных В.И., Ярембаш Е.И. Термический и рентгенофазовый анализ системы KF–BeF2 // Журн. неорганической химии. 1956. 1. № 9. С. 2071–2082.
Гребенщиков Р.Г. Исследование диаграммы состояния системы RbF–BeF2 и ее отношение к системе BaO–SiO2 // Доклады Академии наук СССР. 1957. 114. № 2. С. 316–319.
Бреусов О.Н., Новоселова А.В., Симанов Ю.П. Термический и рентгенофазовый анализ системы CsF–BeF2 и ее взаимоотношения с системами типа MeIF–BeF2 // Доклады Академии наук СССР. 1958. 118. № 5. С. 935–937.
Counts W.E., Roy R., Osborn E.F. // J. Am. Ceram. Soc. 1953. 36. № 1. P. 12–17. https://doi.org/10.1111/j.1151-2916.1953.tb12803.x
Sense K.A., Snyder M.J., Clegg J.W. // The J. Physical Chemistry. 1954. 58. № 3. P. 223–224. https://doi.org/10.1021/J150513A008
Program ACerS – NIST Phase Equlibria Diagrams. Ver. 3.1.0.
Иориш С.В., Юнгман В.С. Термические константы веществ // Институт теплофизики экстремальных состояний РАН Объединённого института высоких температур РАН. 2022. 2. Режим доступа: http://www.chem.msu.ru/cgi-bin/tkv.pl?show=welcome.html
Шестак Я. Теория термического анализа. М.: Мир, 1987.
Чунтонов К.А., Сабирзянов Н.А. Классификация экспериментальных методов построения диаграмм состояний // Расплавы. 1987. 1. № 3. С. 85–90.
Чаттерджи А.К. Применение метода Ритвельда в рентгенофазовом анализе клинкера и цемента // Цемент и его применение. 2015. 1. С. 32–38.
Аносов В.Я., Озерова М.И., Фиалков Ю.Я. Основы физико-химического анализа. М.: Наука, 1976.
Зазубин А.И., Кунаев А.М., Евсеев Ю.Н., Бочкарев Б.А. Металлургия бериллия (физико-химические исследования). Алма-Ата: Наука КазССР, 1980.
Новоселова А.В., Симонов Ю.П. Строение и превращение фторидных соединений бериллия // Уч. записки МГУ. 1955. 174. С. 7–16.
Новоселова А. В. Исследование кварцеподобного фтористого бериллия // Журн. неорганической химии. 1956. 1. № 12. С. 2670–2675.
Новоселова А.В. Фтористый бериллий и фторбериллаты // Успехи химии. 1959. 28. № 1. С. 33–43.
Ребрин О.И., Щербаков Р.Ю., Ничков И.Ф. Представление сведений о плавкости солевых смесей хлоридов бериллия и щелочных металлов в виде полиномов // Журн. неорганической химии. 1998. 47. № 7. С. 1211–1213.
Дополнительные материалы отсутствуют.