Расплавы, 2023, № 1, стр. 48-58
О механизме образования интерметаллидов при совместном катодном восстановлении ионов в расплавленных солях
В. Е. Кротов a, *, Ю. П. Зайков a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: vekro@ihte.uran.ru
Поступила в редакцию 11.09.2022
После доработки 02.10.2022
Принята к публикации 11.10.2022
- EDN: HIPZOH
- DOI: 10.31857/S023501062301005X
Аннотация
В настоящее время известны два механизма электролитического синтеза интерметаллидов (ИМ) при одновременном восстановлении (co-reduction) их ионов на катоде в солевых расплавах. И оба они являются ошибочными. Один из них противоречит экспериментальным данным и нарушает законы термодинамики. Другой не представляет собой процесс совместного восстановления, так как на катоде должны одновременно восстанавливаться ионы обоих металлов, а не одного из них. Работа не содержит новых экспериментальных данных, она носит чисто теоретический характер. Предложен и термодинамически обоснован механизм co-reduction процесса. Впервые показано, что первые кристаллы ИМ возникают не на поверхности электроположительного металла, а они кристаллизуются на поверхности бинарного гомогенного твердого раствора, состоящего из компонентов ИМ, который образуется в начальный момент электролиза. Показано и термодинамически подтверждено, что ионы электроотрицательного металла восстанавливаются с деполяризацией. Впервые приведены электрохимические уравнения кристаллизации фазы постоянного состава при длительном электролизе, а также электрохимические уравнения кристаллизации других фаз интерметаллидов на поверхности предыдущих. Впервые объяснено наличие нескольких фаз ИМ в катодном осадке, полученном при длительном электролизе в гальваностатических условиях. Рассмотрен механизм электрокристаллизации ИМ для случаев гальваностатического и потенциостатического режимов электролиза, а также для циклической и прямоугольной вольтамперометрии. Он применим также к co-reduction процессу кристаллизации соединений металлов с неметаллами.
ВВЕДЕНИЕ
Опубликовано много работ по электролитическому получению катодных осадков интерметаллидов (ИМ) при одновременном восстановлении их ионов (co-reduction) в расплавленных солевых средах. Температура образования ИМ находится в пределах 500–900°С, что значительно ниже температур плавления их компонентов. Существенным отличием синтеза ИМ является отсутствие диффузионных затруднений в твердой фазе, так как они кристаллизуются в поверхностном слое растущего катодного осадка. Процесс контролируется диффузией ионов ИМ в расплавленной солевой фазе.
В обзорах [1, 2] рассмотрено образование ИМ в расплавленных солях co-reduction методом в системах Ag–Mo, Ag–W, Co–Mo, Co–W, Cu–Mo, Cu–W, Ni–Mo, Ni–W и Mo–W. Имеются данные об электрокристаллизации ИМ в системах Al–Ce [3, 4], Al–Dy [5], Al–La [6], Al–Nd [7], Al–Sc [8, 9], Al–Sm [3, 10, 11], А1–Zr [12], Ce–Bi [13], Ce–Zn [14], Co–Но [15], Co–Ni [15], Co–Sm [16, 17], Cu–Sm [18], Fe–Ho [15], Ho–Zn [19], Mg–Pr [20], Pr–Zn [21], Sm–Zn [22], Ti–Zr [23], Zn–Tm [24].
Известны всего два механизма образования ИМ в результате co-reduction их ионов на катоде в солевых расплавах. Однако оба они являются ошибочными. Один из них впервые предложен M. Makyta с сотр. в конце ХХ в. [25, 26]. Он получил поддержку других исследователей [27–34]. Все они [25–34] использовали механизм для объяснения процесса электрокристаллизации соединений металлов с неметаллами на катоде в расплавленных солях. Этот механизм стали приводить и в публикациях по формированию ИМ [3, 6, 7, 17, 22, 35]. Он иллюстрируется уравнениями (1)–(3), которые приведены в публикации [9]:
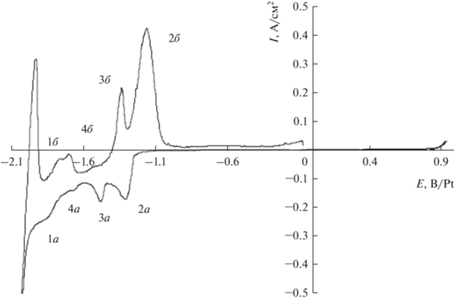
где R и N – электроотрицательный и электроположительный металлы соответственно.Авторы [3, 5–7, 17, 22, 35] считают, что сначала на катоде появляются индивидуальные металлы по уравнениям (1) и (2), которые взаимодействуют между собой с образованием ИМ согласно уравнению (3). Однако экспериментально установлено, что ИМ образуются до начала электрокристаллизации индивидуальной фазы электроотрицательного металла R. Это можно увидеть, например, на рис. 1, где представлена вольтамперная кривая для расплава LiF–CaF2–AlF3–NdF3 из [7].
Циклическая вольтамперограмма системы LiF–CaF2–AlF3–NdF3 (соответственно 1.8 · 10–4 и 2 · 10–4 моль/см3) при 100 мВс–1 и Т = 800°С. Рабочий электрод – вольфрам, противоэлектрод – стеклоуглерод, электрод сравнения – платина.
На рис. 1 наблюдаются четыре пика восстановления (обозначены буквой “а”) и соответствующие им четыре пика последующего окисления (обозначены буквой “б”). Пики 2а и 1а при потенциалах –1.33 и –1.88 В авторы отнесли к восстановлению ионов Al(III) и Nd(III) до индивидуальных металлов Al и Nd. Два других пика 3а и 4а при –1.49 и –1.69 В связаны с образованием соединений Al3Nd и AlNd2 соответственно в результате co-reduction процесса.
Кроме того, что механизм, представленный уравнениями (1)–(3), противоречит многочисленным экспериментальным данным, он нарушает также закон термодинамики. Согласно ему, индивидуальная фаза электроотрицательного металла может появиться на катоде только после электрокристаллизации всех его ИМ. Так, равновесные потенциалы, например, металла Y в системе Yn+/Y и в интерметаллиде Yn+/Y(ИM) можно выразить уравнениями (4) и (5) соответственно
(4)
${{E}_{{{{{{{\text{Y}}}^{{{\text{m}} + }}}} \mathord{\left/ {\vphantom {{{{{\text{Y}}}^{{{\text{m}} + }}}} {\text{Y}}}} \right. \kern-0em} {\text{Y}}}}}} = E_{{{{{{{\text{Y}}}^{{{\text{m}} + }}}} \mathord{\left/ {\vphantom {{{{{\text{Y}}}^{{{\text{m}} + }}}} {\text{Y}}}} \right. \kern-0em} {\text{Y}}}}}^{0} + \frac{{RT}}{{mF}}\ln \frac{{{{a}_{{{{{\text{Y}}}^{{{\text{m}} + }}}}}}}}{{{{a}_{{\text{Y}}}} = 1}},$(5)
${{E}_{{{{{{{\text{Y}}}^{{{\text{m}} + }}}} \mathord{\left/ {\vphantom {{{{{\text{Y}}}^{{{\text{m}} + }}}} {{\text{Y(IM)}}}}} \right. \kern-0em} {{\text{Y(IM)}}}}}}} = E_{{{{{{{\text{Y}}}^{{{\text{m}} + }}}} \mathord{\left/ {\vphantom {{{{{\text{Y}}}^{{{\text{m}} + }}}} {\text{Y}}}} \right. \kern-0em} {\text{Y}}}}}^{0} + \frac{{RT}}{{mF}}\ln \frac{{{{a}_{{{{{\text{Y}}}^{{{\text{m}} + }}}}}}}}{{{{a}_{{{\text{Y(in}}\,{\text{IM)}}}}}}}.$Поскольку активная концентрация металла Y в ИM меньше единицы, то E(Ym+/Y) < < E(Ym+/Y(ИМ). Поэтому кристаллизация его интерметаллических соединений должна происходить до начала появления на катоде индивидуальной фазы электроотрицательного металла Y. Кроме того, некоторые электроотрицательные металлы, являющиеся компонентами ИМ, например, Sm, не могут быть получены на катоде в расплавленных солевых средах из-за более раннего разложения соли-растворителя [36–41]. Однако, известны интерметаллиды самария с Al, Co, Cu, Zn, которые образуются на катоде в результате co-reduction процесса [3, 10, 11, 16, 17, 22]. Следовательно, на электроде не может протекать реакция (1), и соответственно исключается реакция (3). Тем не менее, авторы [3, 5–7, 17, 22, 35] суммировали три уравнения, и получили в результате уравнение (6):
(6)
$x{\text{R}}{{{\text{n}}}^{ + }} + y{\text{N}}{{{\text{p}}}^{ + }} + (n + p){\kern 1pt} {{{\text{e}}}^{ - }} \to {{{\text{R}}}_{x}}{{{\text{N}}}_{y}}.$По их мнению, оно иллюстрирует механизм синтеза ИМ при совместном восстановлении ионов на катоде в расплавленных солях. Однако, уравнение (6) не может представлять механизм процесса, так как оно формируется с учетом недействительных уравнений (1) и (3). Несмотря на это, уравнение (6) использовали для объяснения образования нескольких фаз ИМ на катоде в системах Al–Ce и Al–Sm [3] и Al–La [6].
Другой механизм co-reduction процесса синтеза ИМ в расплавленных солях на катоде приведен в XXI в. в работах [9, 10, 13, 18]. Так в [10] он представлен следующими уравнениями (7)–(9):
(8)
${\text{S}}{{{\text{m}}}^{{2 + }}} + 2{{{\text{e}}}^{ - }} + 3{\text{Al}} \to {\text{SmA}}{{{\text{l}}}_{3}},$(9)
${\text{S}}{{{\text{m}}}^{{2 + }}} + 2{{{\text{e}}}^{ - }} + 2{\text{SmA}}{{{\text{l}}}_{3}} \to 3{\text{SmA}}{{{\text{l}}}_{2}}.$Аналогичные уравнения и также без пояснений приведены в [13, 18], где показано образование пяти ИМ в системе Bi–Ce и пяти в системе Sm–Cu. Однако эти уравнения нельзя рассматривать как механизм co-reduction процесса, так как на катоде должны восстанавливаться одновременно ионы обоих металлов, а не только одного из них. Таким образом, один из известных механизмов образования ИМ противоречит экспериментальным данным, и нарушает закон термодинамики, а другой не представляет собой co-reduction процесс. Несмотря на это, исследователи продолжают цитировать их в своих публикациях [13, 18, 42].
Целью настоящей работы является разработка и обоснование механизма синтеза ИМ при одновременном восстановлении ионов на катоде в расплавленных солевых средах. Она не содержит новых экспериментальных данных, в них нет необходимости, так как качественные и количественные характеристики процесса хорошо известны. Они представлены в многочисленных публикациях.
МЕХАНИЗМ ОБРАЗОВАНИЯ ИНТЕРМЕТАЛЛИДОВ
В настоящей работе рассматриваются только те электрохимические стадии, в результате которых на катоде образуются твердые фазы. В некоторых случаях в солевом расплаве может изменяться степень окисления ионов. Однако, этот процесс не представляет интереса для настоящего исследования, поскольку не влияет на формирование ИМ. Обозначим компоненты ИM как X и Y. Предполагается, что X является благородным (электроположительным), а Y – менее благородным (электроотрицательным) металлом. В расплавленных солях их катионы существуют в виде комплексных ионов. Однако, будем выражать их в уравнениях в виде простых катионы Xn+ и Ym+, что не влияет на механизм образования твердой фазы ИМ на катоде. Механизм co-reduction процесса рассмотрим для случаев нестационарного и стационарного режимов электролиза.
Нестационарный режим электролиза с линейной разверткой потенциала
Линейная развертка потенциала используется в циклической и квадратно-волновой вольтамперометрии. Эти современные методы изучения электрохимических процессов использует большинство исследователей. Для них характерно изменение во времени потенциала катода, что сопровождается появлением и возрастанием тока.
Во время электролиза на индифферентном катоде первыми будут восстанавливаться ионы электроположительного металла Xn+ согласно уравнению (10)
После того, как будет достигнуто значение предельного диффузионного тока ионов Xn+, на электроде на поверхности электроположительного металла Х будут восстанавливаться одновременно ионы обоих компонентов ИМ. Благородный металл кристаллизуется с образованием индивидуальной фазы по уравнению (10). Его поверхность является активной подложкой для ионов Ym+. Поэтому, электроотрицательный металл будет выделяться не в виде индивидуальной фазы, Y, а в виде сплава согласно уравнению (11)
(11)
$а{\text{X}} + b{{{\text{Y}}}^{{m + }}} + bm{{{\text{e}}}^{ - }} \to {{{\text{Y}}}_{b}}{{{\text{X}}}_{a}}.$Образование соединения YbXa энергетически более выгодно, чем выделение электроотрицательного компонента в виде индивидуальной фазы, поскольку сопровождается уменьшением энергии Гиббса системы. Соответственно, восстановление ионов Ym+ должно сопровождаться деполяризацией. Потенциал процесса смещается в положительную сторону, так как активная концентрация компонента Y в катодном осадке оказывается меньше единицы. Из уравнений (4) и (5) следует, что величина деполяризации, ∆Е, равна
(12)
$\Delta E = {{E}_{{{{{{{\text{Y}}}^{{m + }}}} \mathord{\left/ {\vphantom {{{{{\text{Y}}}^{{m + }}}} {{\text{Y(in}}\,{\text{YX)}}}}} \right. \kern-0em} {{\text{Y(in}}\,{\text{YX)}}}}}}} - {{E}_{{{{{{{\text{Y}}}^{{m + }}}} \mathord{\left/ {\vphantom {{{{{\text{Y}}}^{{m + }}}} {\text{Y}}}} \right. \kern-0em} {\text{Y}}}}}} = \frac{{RT}}{{mF}}\ln \frac{1}{{{{a}_{{{\text{Y(in}}\,{\text{YX)}}}}}}}.$Первые кристаллы YbХa не являются ИМ, так как молярное отношение Y/X значительно ниже его значения в составе интерметаллида. Они представляют собой гомогенный твердый раствор на основе металла X. Далее электродный процесс будет происходить на его поверхности. На ней будут одновременно восстанавливаться катионы обоих металлов с образованием твердой фазы иного состава, что показывает уравнение (13):
(13)
${{{\text{Y}}}_{b}}{{{\text{X}}}_{a}} + i{{{\text{X}}}^{{n + }}} + f{{{\text{Y}}}^{{m + }}} + \left( {in + fm} \right){{{\text{e}}}^{ - }} \to {{{\text{Y}}}_{{(b{\kern 1pt} + {\kern 1pt} f)}}}{{{\text{X}}}_{{(a{\kern 1pt} + {\kern 1pt} i)}}}.$Поверхность YbXa является активной подложкой для электроотрицательных ионов Ym+, и они также восстанавливаются с деполяризацией. Катодный осадок Y(b+f)X(a+i) также является гомогенным сплавом, в котором повышено молярное отношение металлов: Y/X = (b + f)/(a + i) > b/а.
Первые кристаллы ИМ появляются на электроде, когда отношение Y/X достигает минимального для данной системы значения. При этом, доля электроотрицательного металла в этой фазе будет минимальной, а величина деполяризации ∆Е, реакции восстановления иона Ym+ является максимальной, что следует из уравнения (12). Например, при наличии в системе X–Y четырех ИМ составов YX2, YX, Y2X, и Y4X на катоде сначала образуется фаза YX2 с минимальным мольным отношением Y/X, равным 0.5. Процесс кристаллизации ее на поверхности гомогенного сплава можно описать уравнением (14):
(14)
${{{\text{Y}}}_{{(b{\kern 1pt} + {\kern 1pt} f)}}}{{{\text{X}}}_{{(a{\kern 1pt} + {\kern 1pt} i)}}} + h{{{\text{X}}}^{{n + }}} + d{{{\text{Y}}}^{{m + }}} + \left( {hn + dm} \right){{{\text{e}}}^{ - }} \to \left( {{{{\text{Y}}}_{{(b{\kern 1pt} + {\kern 1pt} f{\kern 1pt} + {\kern 1pt} d)}}}{{X}_{{(a{\kern 1pt} + {\kern 1pt} i{\kern 1pt} + {\kern 1pt} h)}}}} \right) \to {\text{Y}}{{{\text{X}}}_{2}}.$В этом случае (b + f + d)/(a + i + h) = 0.5. Равновесный потенциал образования ИМ можно рассчитать по уравнению (5). С этого момента и до окончания электролиза co-reduction процесс будет происходить на поверхности интерметаллидов.
По мере смещения электродного потенциала в катодную сторону в поверхностном слое осадка будут появляться другие фазы ИМ с более высокой долей электроотрицательного металла. Уравнения (15)–(17) иллюстрируют их образование в системе X–Y при совместном восстановлении ионов металлов
(15)
${\text{Y}}{{{\text{X}}}_{2}} + {\text{ }}{{{\text{Х}}}^{{n + }}} + 2{{{\text{Y}}}^{{m + }}} + \left( {n + 2m} \right){{{\text{e}}}^{ - }} \to \left( {{{{\text{Y}}}_{3}}{{{\text{X}}}_{3}}} \right) \to 3{\text{YX}},$(16)
${\text{YX}} + {{{\text{X}}}^{{n + }}} + 3{{{\text{Y}}}^{{m + }}} + (n + 3m){{{\text{e}}}^{ - }} \to ({{{\text{Y}}}_{4}}{{{\text{X}}}_{2}}) \to 2{{{\text{Y}}}_{2}}{\text{X}},$(17)
${{{\text{Y}}}_{2}}{\text{X}} + {{{\text{X}}}^{{n + }}} + 6{{{\text{Y}}}^{{m + }}} + (n + 6m){{{\text{e}}}^{ - }} \to ({{{\text{Y}}}_{{\text{8}}}}{{{\text{X}}}_{2}}) \to 2{{{\text{Y}}}_{4}}{\text{X}}.$Процесс кристаллизации новой фазы на поверхности предыдущей, например, состава YsXt, можно описать общим уравнением (18)
(18)
${{{\text{Y}}}_{{\text{s}}}}{{{\text{X}}}_{{\text{t}}}} + t{{{\text{X}}}^{{n + }}} + \left( {s + 2} \right){{{\text{Y}}}^{{m + }}} + \left[ {tn + \left( {s + 2} \right)m} \right]{{{\text{e}}}^{ - }} \to \left( {{{{\text{Y}}}_{{(2{\text{s}}{\kern 1pt} + {\kern 1pt} 2)}}}{{{\text{X}}}_{{2{\text{t}}}}}} \right) \to 2{{{\text{Y}}}_{{({\text{s}}{\kern 1pt} + {\kern 1pt} 1)}}}{{{\text{X}}}_{{\text{t}}}}.$Когда потенциал электрода достигнет значения равновесного потенциала Е(Ym+/Y) на электроде будет кристаллизоваться индивидуальная фаза электроотрицательного металла.
Стационарный режим электролиза
Потенциостатический электролиз. Очевидно, что при фиксированном потенциале электрода на нем будет кристаллизоваться ИМ неизменного фазового состава. В общем виде процесс ее образования может быть представлен уравнением (19):
(19)
${{{\text{Y}}}_{{\text{s}}}}{{{\text{X}}}_{{\text{t}}}} + t{{{\text{X}}}^{{n + }}} + s{{{\text{Y}}}^{{m + }}} + (tn + sm){\kern 1pt} {{{\text{e}}}^{ - }} \to ({{{\text{Y}}}_{{{\text{2s}}}}}{{{\text{X}}}_{{{\text{2t}}}}}) \to 2{{{\text{Y}}}_{{\text{s}}}}{{{\text{X}}}_{{\text{t}}}}{\text{.}}$Например, в случае фазы состава Y2X co-reduction процесс ее кристаллизации описывается уравнением
(20)
${{{\text{Y}}}_{{\text{2}}}}{\text{X}} + {{{\text{X}}}^{{{\text{n}} + }}} + 2{{{\text{Y}}}^{{{\text{m}} + }}} + (n + 2m){\kern 1pt} {{{\text{e}}}^{ - }} \to ({{{\text{Y}}}_{{\text{4}}}}{{{\text{X}}}_{2}}) \to 2{{{\text{Y}}}_{{\text{2}}}}{\text{X}}.$Гальваностатический электролиз. В гальваностатических условиях в отличие от потенциостатического режима не исключено изменение фазового состава катодного осадка в процессе электролиза. Он может содержать не один, а несколько интерметаллидов, которые кристаллизуются в разные промежутки времени.
ИМ при co-reduction процессе образуются в условиях, когда величина тока электролиза становится больше предельного диффузионного тока ионов электроположительного металла. С течением времени его значение будет уменьшаться из-за снижения концентрации ионов Xn+ в расплаве. Будет возрастать доля тока, который расходуется на электрокристаллизацию электроотрицательного компонента ИМ. Соответственно, следует ожидать появление в катодном осадке ИМ с более высокой концентрацией электроотрицательного металла. Его образование на поверхности предыдущей фазы иллюстрирует уравнение (18).
В литературе имеются данные о присутствии нескольких фаз ИМ в катодных осадках [10, 15, 30]. Так, фазы разного состава содержали твердые осадки, полученные из расплава KCl–NaCl–HoCl3 с добавками хлоридов никеля, кобальта или железа после одного часа гальваностатического электролиза [15]. В системе Ho–Ni установлены следующие три ИМ: HoNi5, HoNi3 и HoNi. В двух других системах, Ho–Co и Ho–Fe, были получены двухфазные катодные осадки. Они содержали ИМ Ho2Co17, HoCo5 и HoFe5, HoFe2 соответственно [15]. Две фазы SmAl4 и SmAl3 были обнаружены в катодном продукте, полученном в расплаве LiCl–KCl–AlCl3 (2.5 мас. %) – Sm2O3 (1.5 мас. %) после 2 ч гальваностатического электролиза током –40 мА [10]. Авторы работы [30] зафиксировали изменение фазового состава в процессе гальваностатического электролиза. Эти результаты представлены в табл. 1.
Таблица 1.
Влияние продолжительности электролиза системы NaCl–Na3AlF6–Na2MoO4–SiO2 на фазовый состав катодных осадков. T = 1173 K, iк = 1 A/см2 [30]
| Состав расплава, мас. % | Состав катодных осадков | Примечание | ||||
|---|---|---|---|---|---|---|
| продолжительность электролиза, мин | ||||||
| 10 | 20 | 30 | 45 | 60 | ||
| NaCl – 49, Na3AlF6 – 49, Na2MoO4 – 1, SiO2 –1 | Мо | Мо, Мо3Si5 | Мо3Si5 МоSi2 | МоSi2 | МоSi2 Si |
[30] |
| Мо | МоSi1.25 | МоSi1.75 | МоSi2 | МоSi3 | Рассчитано автором | |
| Мольное отношение Si/Мо | 0 | 1.25 | 1.75 | 2.0 | 3.0 | |
В таблицу [30] добавлена строка, в которой приведены значения мольного отношения электроотрицательного элемента к электроположительному – Si/Mo. Его рассчитывали путем деления суммы чисел атомов этих компонентов во всех фазах при фиксированной продолжительности электролиза. Осадки, которые были получены в течение 20, 30 и 60 мин, оказались двухфазными. В последнем из них можно было бы ожидать присутствие не двух, MoSi2 и Si, а всех фаз ИМ, представленных в табл. 1. Это несоответствие можно объяснить тем, что исследователи анализировали, по-видимому, осадок без его разрушения. Поэтому зафиксированы только фазы, которые кристаллизуются последними. Они располагаются ближе к поверхности катодного осадка, и экранируют глубинные фазы Мо и Мо3Si5. Вероятно, поэтому последние и не были обнаружены. Подтвердить или опровергнуть это предположение не представляется возможным, так как в публикации [30] не приводится методика анализа катодных осадков. Однако, однозначно установлено возрастание от нуля до трех мольного отношения Si/Mo с увеличением продолжительности электролиза.
ЗАКЛЮЧЕНИЕ
Показано, что известные механизмы электролитического синтеза интерметаллических соединений с одновременным восстановлением ионов на катоде в расплавленных солевых средах являются ошибочными. Предложен, и обоснован механизм, устраняющий их недостатки. Установлено, что первые кристаллы ИМ появляются на поверхности гомогенного твердого раствора, который образуется на катоде после включения тока электролиза. Приведены электрохимические уравнения кристаллизации ИМ для случаев гальваностатического и потенциостатического режимов электролиза. Впервые объяснено наличие нескольких фаз одной бинарной системы ИМ в катодных осадках, полученных методом гальваностатического электролиза. Механизм применим также к co-reduction процессу кристаллизации соединений металлов с неметаллами.
Список литературы
Шаповал В.И., Малышев В.В., Новоселова И.А., Кушхов Х.Б. Современные проблемы высокотемпературного электрохимического синтеза соединений переходных металлов // Успехи химии. 1995. 64. С. 133–141.
Малышев В.В., Кушхов Х.Б. Успехи высокотемпературного электрохимического синтеза в ионных расплавах на рубеже веков // Журн. общей химии. 2004. 74. С. 1233–1240.
Gibilaro M., Massot L., Chamelot P., Taxil P. Co-reduction of aluminium and lanthanide ions in molten fluorides: Application to cerium and samarium extraction from nuclear wastes // Electrochim. Acta. 2009. 54. P. 5300–5306.
Wang L., Liu Y.L., Yuan L.Y., Liu K., Tang S.L., Yuan L.Y., Su L.L., Chai Z.F., Shi W.Q. Electrochemical extraction of cerium from CeO2 assisted by AlCl3 in molten LiCl–KCl // Electrochim. Acta. 2014. 147. P. 385–391.
Su L.L., Liu K., Liu Y.L., Wan L., Yuan L.Y., Wan L., Li Z.J. Electrochemical behaviors of Dy(III) and its co-reduction with Al(III) in molten LiCl–KCl salts // Electrochim. Acta. 2014. 147. P. 87–95.
Liu Y.L., Yuan L.Y., Ye G.A., and others. Co-reduction behaviors of lanthanum and aluminium ions in LiCl–KCl eutectic // Electrochim. Acta. 2014. 147. P. 104–113.
Gibilaro M., Massot L., Chamelot P., Taxil P. Study of neodymium extraction in molten fluorides by electrochemical co-reduction with aluminium // J. Nuclear Materials. 2008. 382. P. 39–45.
Москвитин В.И., Махов С.В. О возможности получения алюминиево-скандиевой лигатуры в алюминиевом электролизере // Цветные металлы. 1998. 7. С. 43–46.
Castrillejo Y., Vega A., and others. Electrochemical formation of Sc-Al intermetallic compounds in the eutectic LiCl–KCl. Determination of thermodynamic properties // Electrochim. Acta. 2014. 118. P. 58–66.
Liu K., Liu Y.L., Yuan L.Y., Hed H., and others. Electroextraction of samarium from Sm2O3 in chloride melts // Electrochim. Acta. 2014. 129. P. 401–409.
Ji D.B., Yan Y.D., Zhang M.L., and others. Electrochemical preparation of Al–Sm intermetallic compound whisker in LiCl–KCl eutectic melts // Electrochim. Acta. 2015. 165. P. 211–220.
Mellors G.W., Senderoff S. The electrodeposition of coherent deposits of refractory metals III. Zirconium // J. Electrochem. Soc. 1966. 113. P. 60–66.
Kim B.K., Park B.G. Characterization of Ce–Bi the intermetallic compounds formation by electrolytic reduction in molten LiCl–KCl eutectic // Electrochim. Acta. 2019. 295. P. 270–277.
Wang L., Liu Y.L., Liu K., and others. Electrochemical extraction of cerium by forming Ce–Zn alloys in LiCl–KCl eutectic on W and liquid Zn electrodes // J. Electrochem. Soc. 2015. 162. E179–E184.
Кушхов Х.Б., Карданов Р.А. Синтез функциональных материалов на основе гольмия и металлов триады железа из хлоридных расплавов // Тр. Кольского научного центра РАН. Химия и материаловедение. 2015. 5. № 31. С. 244–247.
Iida T., Nohira T., Ito Y. Electrochemical formation of Sm–Co alloys by co-deposition of Sm and Co in a molten LiCl–KCl–SmCl3–CoCl2 system // Electrochim. Acta. 2003. 48. P. 2517–2521.
Liu Y.H., Yan Y.D., Zhang M.L., Y. Liang Y., and others. Electrochemical synthesis of Sm–Co metal magnetic materials by co-reduction of Sm(III) and Co(II) in LiCl–KCl–SmCl3–CoCl2 melt // Electrochim. Acta. 2017. 249. P. 278–289.
Liu Y.H., Yan Y.D., Zhang M.L., and others. Electrochemical synthesis of Sm-Cu dendritic metal catalysts by co-reduction of Sm(III) and Cu(II) in LiCl–KCl–SmCl3–CuCl2 melt // J. Alloys and Compounds. 2019. 772. P. 978–987.
Liu Y.H., Zhou W., Tang H.B., Liu Z.R., and others. Diffusion coefficient of Ho3+ at liquid zinc electrode and co-reduction behaviors of Ho3+and Zn2+ on W electrode in the LiCl–KCl eutectic // Electrochim. Acta. 2016. 211. P. 313–321.
Tang H., Yan Y.D., Zhang M.L., and others. Fabrication of Mg–Pr and Mg–Li–Pr alloys by electrochemical co-reduction from their molten chlorides // Electrochim. Acta. 2013. 107. P. 209–215.
Li M., Wang J., Han W., Yang X., and others. Electrochemical formation and thermodynamic evaluation of Pr–Zn intermetallic compounds in LiCl–KCl eutectic melts // Electrochim. Acta. 2017. 228. P. 299–307.
Liu Y.L., Yuan L.Y., Liu K., Ye G.A., and others. Electrochemical extraction of samarium from LiCl–KCl melt by forming Sm–Zn alloys // Electrochim. Acta. 2014. 120. P. 369–378.
Mellors G.W., Senderoff S. The electrodeposition of coherent deposits of refractory metals III. Zirconium // J. Electrochem. Soc. 1966. 113. P. 60–66.
Yan Li.X., Zhang Y.D., and others. ZnCl2 and liquid zinc assisted electrochemical extraction of thulium from LiCl–KCl melt // J. Electrochem. Soc. 2014. 161. D248–D255.
Makyta M., Matiasovsky K., and Taranenko V.I. Mechanism of cathode process in the electrochemical synthesis of TiB2 in molten salts. I. The synthesis in an all-fluoride electrolyte // Electrochim. Acta. 1989. 34. P. 861–866.
Taranenko V.I, Zarutski I.V., Shapoval V.I., Makyta M., Matiasovsky K. Mechanism of cathode process in the electrochemical synthesis of TiB2 in molten salts. II. Chloride-fluoride electrolytes // Electrochim. Acta. 1992. 37. P. 263–268.
Кушхов Х.Б., Адамокова М.Н., Квашин В.А., Карданов А.Л. Электрохимический синтез твердосплавных композиций на основе карбида вольфрама и металлов триады железа // Расплавы. 2010. 4. С. 35–46.
Шаповал В.И., Кушхов Х.Б., Малышев В.В., и др. Теоретические основы технологий высокотемпературного электрохимического синтеза в ионных расплавах. // Теоретические основы химической технологии. 1997. 31. С. 286–295.
Кузнецов С.А., Девяткин С.В., Глаголевская А.Л., и др. Высокотемпературный синтез диборида гафния в солевых расплавах // Расплавы. 1992. № 2. С. 67–70.
Malyshev V.V., Kushkhov Kh.B., Shapoval V.I. High-temperature electrochemical synthesis of carbides, silicides and borides of VI-A group metals // J. Applied Electrochemistry. 2002. 32. P. 573–579.
Кушхов Х.Б., Шогенова Д.Л. Исследование совместного электровосстановления ионов иттрия и бора на серебряном и стеклоуглеродном электродах в расплавах KCl–NaCl, KCl–NaCl–CsCl // Расплавы. 2007. № 4. С. 47–54.
Шогенова Д.Л., Кушхов Х.Б. Электрохимический синтез боридов иттрия и двойных боридов иттрия с металлами триады железа // Перспективные материалы. 2010. 9. С. 301–304.
Kushkhov Kh.B., Uzdenova A.S., Qahtan A.M.F., and others. Electrosynthesis of dysprosium borides in NaCl–KCl melt at 973 K // SOP Transactions on Physical Chemistry. 2014. 1. P. 18–22.
Kushkhov Kh.B., Uzdenova A. S., Saleh M.M.A., Uzdenova L.A. Electrosynthesis of Gadolinium Borides in CsCl–KCl–NaCl Melt at 823 K // SOP Transactions on Physical Chemistry. 2014. 1. P. 23–28.
Taxil P., Chamelot P., Massot L., Hamel C. Electrodeposition of alloys or compounds in molten salts and application // J. Mining and Metallurgy. 2003. 39. № 1–2. P. 177–200.
Yasuda K., Kondo K., Kobayashi S., Nohira T. Selective formation of rare-earth–nickel alloys via electrochemical reactions in NaCl–KCl molten salt // J. Electrochem. Soc. 2016. 163. D140–D145.
Cordoba G., Caravaca C. An electrochemical study of samarium ions in the molten eutectic LiCl + + KCl // J. Electroanalytical Chem. 2004. 572. P. 145–151.
Massot L., Chamelot P., Taxil P., Cathodic behavior of samarium(III) in LiF–CaF2 media on molybdenum and nickel electrodes // Electrochim. Acta. 2005. 50. P. 551–5517.
Castrillejo Y., Fernandez P., Medina J. and others. Electrochemical extraction of samarium from molten chlorides in pyrochemical processes // Electrochim. Acta. 2011. 56. P. 8638–8644.
Straka M., Korenko M., Lisý F., Szatmáry L. Electrochemistry of samarium in lithium-beryllium fluoride salt mixture // J. Rare Earth. 2011. 29. P. 798–803.
Castrillejo Y., de la Fuente C., Vega M., and others. Cathodic behaviour and oxoacidity reactions of samarium(III) in two molten chlorides with different acidity properties: The eutectic LiCl–KCl and the equimolar CaCl2–NaCl melt // Electrochim. Acta. 2013. 97. P. 120–131.
Кушхов Х.Б., Тленкопачев М.Р., Жаникаева З.А., Мукожаева Р.А. Электрохимический синтез магнитных материалов на основе редкоземельных металлов в ионных расплавах // Физическая химия и электрохимия расплавленных и твердых электролитов: Материалы конференции. 2020. С. 399–402.
Дополнительные материалы отсутствуют.