Расплавы, 2023, № 1, стр. 22-38
Анализ структурных единиц и их стабильности в расплаве Na2О–B2O3 методом первопринципной молекулярной динамики
А. А. Юрьев a, *, М. М. Цымбалист a, М. А. Самойлова a, А. А. Хохряков a
a Институт металлургии Уральского отделения РАН
Екатеринбург, Россия
* E-mail: yurev_anatolii@mail.ru
Поступила в редакцию 01.10.2022
После доработки 09.10.2022
Принята к публикации 20.10.2022
- EDN: HCLEND
- DOI: 10.31857/S0235010623010115
Аннотация
Целью настоящей работы являлась разработка расчетно-теоретической методики детального изучения геометрии и статистических характеристик локальных структурных комплексов сложных жидкостей типа щелочноборатных систем, имеющих тенденцию к образованию объемной борокислородной сетки. Методика отрабатывалась на примере расплава 30Na2O–70B2O3 при Т = 1273 К. Использовалась первопринципная молекулярная динамика, реализованная в программном коде VASP для суперячейки из 250 атомов. Полученные на каждом шаге координаты ионов использованы для получения статистически значимой информации о детальной структуре расплава. По разработанной для этой цели оригинальной программе были определены парциальные функции радиального распределения атомов и проанализированы все найденные в модели ближайшие координации вокруг каждого сорта ионов, определены типы и количество устойчивых группировок, длины связей и углы в них. Кроме того, рассчитан критерий тетраэдричности для единиц ВО4 и ВB4. Базовыми структурными единицами оказались почти правильные треугольники (в них входит ~80% атомов бора) и тетраэдры (~19% атомов бора) с ионом бора в центре и ионами кислорода в вершинах. Эти простые структуры образуют борокислородную сетку связанную общими (мостиковыми) атомами кислорода, причем она включает практически все атомы бора. Обнаружены надструктурные единицы, а именно комбинации из трех и более базовых структур. Например, два треугольника и один тетраэдр, образуют кольца из шести чередующихся атомов бора и кислорода. Кроме того, обнаружено существование колец, которые сформированы из четырех базовых структурных единиц, но они, в отличие от шестиатомных колец, не являются планарными образованиями. Предложенная методика позволяет получать практически любые данные о структурных особенностях систем такого типа, в частности, ответить на важный вопрос о количестве мостиковых и немостиковых атомов кислорода. Оказалось, что мостиковых кислородов в изученной системе примерно 86%. Использованный подход корректно учитывает ковалентную и ионную связи в жидких системах на основе оксидов-сеткообразователей и оксидов-модификаторов, что позволит изучить изменение локальных структурных характеристик в зависимости от концентрации и температуры и объяснить поведение различных физико-химических свойств.
ВВЕДЕНИЕ
Щелочноборатные системы используются в металлургии, волоконной оптике и других отраслях. Они представляют большой интерес с фундаментальной точки зрения, так как из-за ковалентных и ионных связей имеют сложную электронную структуру. Большие сложности для теории представляет описание стеклообразования таких структур. В настоящее время принято считать, что в расплавах щелочноборатных систем, по аналогии с аморфными системами, существует объемная борокислородная сетка, состоящая из набора неупорядоченных основных базовых и надструктурных единиц. Эта информация получена в основном путем интерпретации экспериментальных данных по колебательной спектроскопии [1–3], дифракции рентгеновских лучей и нейтронов [4, 5] и ЯМР-спектрам [6]. Основными базовыми единицами принято считать группы BO3, представляющие собой почти правильные треугольники, и группы BO4, образующие почти правильные тетраэдры с атомом бора в центре. Например, в [2, 3] практически постулируются только эти две базовые координации бора с кислородом и не исследуются другие возможные структуры. Необходимо отметить, что перечисленные базовые единицы имеют заряд, либо нулевой, либо отрицательный. Последний случай соответствует образованию немостиковых кислородов с появлением групп BØ2O–, к примеру, за счет разрыва звеньев между двумя тригональными группами BØ3, а также за счет преобразования бора из трех-координированного состояния в четырех-координированное ${\text{BO}}_{4}^{ - }.$ Кроме указанных простейших базовых групп предполагается существование надструктурных образований, таких как бороксольные кольца, ди-боратные, три-боратные, пента-боратные группировки и другие [2], в основе которых лежат кольца из шести чередующихся между собой ионов бора и кислорода. В [7] обобщены экспериментальные данные по типам, длинам связей и углам между ними для боратных группировок в кристаллическом состоянии. Имеются также многочисленные измерения физико-химических свойств стеклообразных и жидких щелочноборатных систем, таких как плотность, электропроводность, вязкость и другие [8–12]. Часто эти данные существенно различаются между собой, а в отдельных случаях свойства обнаруживают сложную немонотонную зависимость от концентрации и температуры. Для интерпретации этих зависимостей необходимы сведения о строении боратных систем в зависимости от состава и температуры, количественные оценки которых расходятся у разных авторов, что может быть связано с выбранными моделями и методиками измерений.
Одним из альтернативных подходов изучения щелочноборатных систем в жидком состоянии является метод молекулярной динамики (МД) [13–19]. При использовании классической молекулярной динамики часто используются простые парные потенциалы, содержащие два вклада: кулоновское притяжение и отталкивательный вклад [16–19]. Для учета ковалентности иногда вводят эмпирический межчастичный потенциал, зависящий от углов, но при этом значение нужного угла приходится задавать заранее, как это делается, например, в [13]. Эти ограничения снимаются при использовании первопринципной молекулярной динамики, так как в этом методе силы, действующие на каждый атом, вычисляются путем дифференцирования полной электронной энергии. Для натриевоборатных систем этот метод применялся, например, в [14, 15]. В [14] на основе расчета коэффициентов диффузии интерпретируется зависимость электропроводности от концентрации оксида щелочного металла, а в нашей работе [15] на основе ab initio молекулярно-динамических расчетов с использованием программного кода SIESTA сделана попытка интерпретировать электронные спектры натриевоборатных расплавов с добавками РЗМ.
Отметим, что, во-первых, подавляющее число работ, как экспериментальных, так и теоретических, посвящены щелочноборатным стеклам, а исследований расплавов значительно меньше, в частности отсутствует детальное изучение локальных структур данных расплавов при высоких температурах (T > 1000 K), а, во-вторых, мало работ основываются на методе ab initio молекулярной динамики. Целью настоящей работы является отработка методики и детальный анализ структуры ближнего порядка щелочноборатных расплавов методом первопринципной МД.
МЕТОДИКА РАСЧЕТА
В качестве исследуемой системы была выбран типичный расплав 30% Na2O–70% B2O3 при температуре 1273 K. Первопринципные молекулярно-динамические расчеты проведены с использованием программного кода VASP [20], который считается наиболее точным. Использована кубическая суперячейка, состоящая из 250 атомов, с длиной ребра 14.811 Å, соответствующего экспериментально наблюдаемой плотности, и включающая 137 атомов кислорода, 80 атомов бора и 33 атома натрия, что в наибольшей степени соответствует выбранной концентрации. Никаких других априорных данных о системе, кроме плотности, не использовалось. Шаг по времени был выбран равным 1 фс, проведено 41500 шагов моделирования. В качестве начальных координат атомов была выбрана конфигурация из 250 узлов, полученная методом классической молекулярной динамики путем проведения нескольких сотен тысяч шагов для простой однокомпонентной жидкости с парным сферически симметричным потенциалом. Таким образом, изначально в системе отсутствовали какие-либо выделенные связи и структурные группировки. Атомы кислорода, бора и натрия в начальной конфигурации были случайным образом распределены по этим узлам.
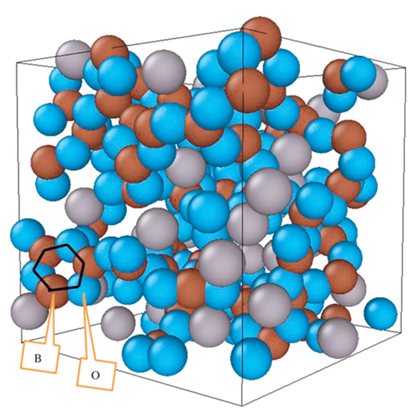
Для расчета электронной структуры в рамках функционала электронной плотности (ФЭП) использовались следующие приближения. Электронно-ионные взаимодействия были описаны псевдопотенциалами проекционных присоединенных волн с валентными электронными конфигурациями 2s22p1 для B, 2s22p4 для O, и 3s1 для Na. Были использованы: формализм PBE для обменно-корреляционного функционала в обобщенном градиентном приближении (GGA), величина энергии обрыва 400 эВ и одна Г точка в зоне Бриллюэна. Хотя в начальном положении система находится в крайне неравновесном состоянии, она, судя по таким параметрам, как полная энергия, парциальные функции радиального распределения и другим, быстро, за несколько сотен шагов, приближается к равновесному состоянию. Тем не менее, для других параметров, таких как устойчивые локальные структуры, этого недостаточно, например, группировки B–O2 исчезают после 10 000 шагов. Поэтому, для достоверности, выполнено, 41 500 шагов, что соответствует времени 41.5 пс. Все усреднения проводились по последним 20 000 шагам моделирования, что обеспечило хорошую статистику. Отметим, что в [15] нами рассчитывалась та же самая система и использовались те же самые начальные условия. Отличия состоят, во-первых, в количестве шагов моделирования (41 500 вместо 1000), во-вторых, в использовании другого программного кода (VASP вместо SIESTA), который зарекомендовал себя как более эффективный. Это позволило провести расчеты достаточно длинной траектории и получить более точные результаты. Типичный вид суперячейки на одном из последних шагов представлен на рис. 1. Можно увидеть сложную сеткообразную структуру и даже отдельные элементы в виде колец, но для получения численных характеристик необходим детальный анализ. Поэтому рассчитанные на каждом шаге координаты атомов использованы для получения статистически значимой информации о структуре расплава с использованием разработанной нами оригинальной программы StatXYZ [21] в следующей последовательности.
Рис. 1.
Общий вид расчетной суперячейки на одном из последних шагов расчета, визуализированный пакетом OVITO. B – коричневые шарики; О – синие шарики; Na – серые шарики (размеры условные).
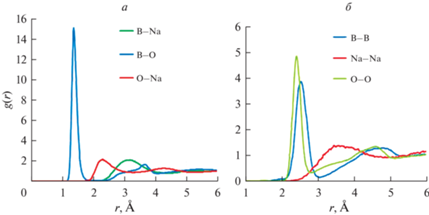
На первом этапе для всех шести возможных сочетаний пар атомов B–O, B–B, B–Na, O–O, O–Na, Na–Na были рассчитаны парциальные функции радиального распределения атомов, gij(r), (ФРРА), которые приведены на рис. 2. Шаг по r был выбран равным 0.001 длины ребра суперячейки. Выбор начальной конфигурации обусловил равнозначность всех парных корреляций, поэтому все парциальные ФРРА на первых шагах имели примерно одинаковый вид: главный пик имел координату r = 2.5 Å и высоту примерно 2.5. В ходе расчетов положения главных пиков всех парциальных функций для пар, содержащих Na, либо остались на месте, либо сдвинулись в сторону больших расстояний, а высота пиков при этом снизилась. Это позволяет предположить, что корреляции атома Na с остальными элементами наименее значимы. Остальные корреляции, наоборот, усилились. Для пар B–B и О–О значительно выросла высота пика, а для пар B–O изменения максимальны: пик стал гораздо более острым, его положение сдвинулось к значению r = 1.4 Å, а высота выросла до 15. Эти данные согласуется с результатами [5], полученными из обработки данных по рассеянию нейтронов на стеклах реверсным методом Монте-Карло. Отличие заключается в том, что парциальная ФРРА для В–О в [5] явно содержит субпик справа от главного, в то время как в нашей работе в районе первого пика получена гладкая функция, имеющая лишь небольшую асимметрию. Возможно, это связано с тем, что в [5] изучалось стекло при низких температурах, а в данной работе исследовался расплав. Вычисленная нами ранее парциальная ФРРА для B–O в [15] достигала высоты около 9, что связано с недостаточным количеством шагов моделирования.
Рис. 2.
Рассчитанные парциальные функции радиального распределения атомов, gij(r), расплава системы 30Na2O–70B2O3 при 1273 К. а) Для разнородных атомов; б) для одинаковых атомов.
ФРРА использованы для определения длин связей между парами атомов, а именно, положение минимума gij(r) после главного пика мы приняли за границу первой координационной сферы и при дальнейшем анализе использовали как критерий наличия или отсутствия связи между атомами. Эти значения приведены в табл. 1.
Таблица 1.
Максимальные длины связей для различных пар атомов
| Пара атомов | B–O | O–O | B–B | O–Na | B–Na | Na–Na |
|---|---|---|---|---|---|---|
| Предельная длина связи, Å | 2.0 | 2.8 | 3.0 | 3.2 | 4.3 | 5.0 |
Следующая стадия – расчет среднестатистического распределения по количеству связей: для каждого сочетания атомов типа X–Y, где X, Y = B, O, Na, проводился перебор по всем парам атомов в суперячейке, а наличие/отсутствие связи определялось сравнением расстояний между ними с критериями, приведенными в табл. 1. При этом корректно учитывались случаи связи с атомами, находящимися в соседних суперячейках. Таким образом были выделены все группы XYnна каждом шаге моделирования. Для каждой рассчитывали их количество, плотности распределения по длине связи ΔN/Δr (количество групп на единичную длину) и по углам между связями Y–X–Y, ΔN/ΔФ (количество групп на единичный угол). Для групп с 3 и 4 связями дополнительно рассчитывалась плотность распределения по сумме углов ΔN/ΔФ при атоме X. При таком представлении площадь под кривой дает полное количество данных группировок в суперячейке. Кроме суммы углов для проверки близости четырехгранников к правильному тетраэдру использовался критерий “тетраэдричности”, введенный в [22] и усовершенствованный в [23]:
Помимо описанных статистических характеристик, отдельно проводили поиск шести- и восьми-атомных колец, в которых атомы B и O последовательно чередуются, и анализировали их ближайшее окружение. Для каждого атома бора находили все цепочки связей B–O–…–О–B. Затем из них выбирали только те, которые на шестом или восьмом звене возвращаются к первому атому. После этого в каждой выбранной цепочке производили сортировку по номерам атомов с целью исключить пары с одинаковыми номерами, но разным порядком обхода.
Совокупность полученных данных позволила сделать вывод о взаимном расположении и геометрии локальных группировок в системе. Для визуализации пространственной ориентации атомов и их структур использовали открытые версии пакетов OVITO и GeoGebra.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
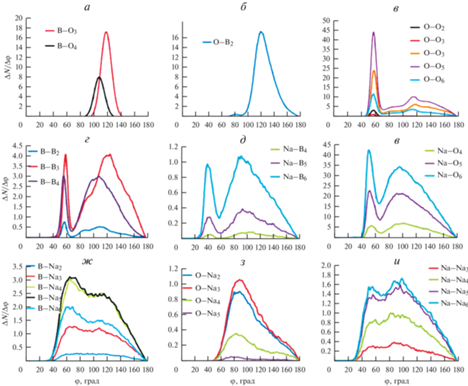
Ниже систематически представлены результаты, полученные по описанной выше методике для нашей модели и проведен их анализ. На рис. 3 показаны количества всех обнаруженных групп XYn в расплаве 30Na2O–70B2O3. Хорошо видно, что ВОn и ОВn стремятся образовать вполне определенные группировки, и таких группировок всего по 2 варианта. Бор в основном существует в составе BO3 (80.2% атомов бора) и BO4 (19.06% атомов бора) и очень редко (<1%) в 2-x координированных состояниях с кислородом и в свободном состоянии. Кислород встречается почти исключительно в 1- и 2-х координированных состояниях с бором, в 14.19 и 85.53% случаев соответственно. Свободный кислород, не связанный с бором, найден в 0.17%, а в группировках OB3 в 0.30% случаев. Следует учитывать, что связи В–О самые короткие (до 2 Å) и это соответствует известным представлениям о строении сетки боратных систем [2, 3]. BO3 и BO4 считаются основными базовыми единицами борокислородной сетки в системах хNa2O–(1 – х)B2O3.
Рис. 3.
Все структурные единицы, обнаруженные в модели при 1273 К. а) Количество связей бора и кислорода; б) количество связей между одноименными атомами; в) количество связей B c Na; г) количество связей O c Na.
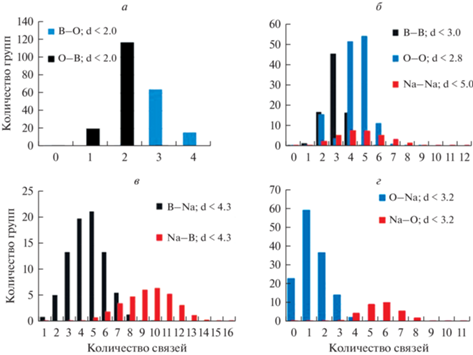
Менее выражена упорядоченность у групп атомов ООn и ВВn, хотя вариантов таких групп также немного. Отметим немонотонность изменения количества групп ООn с ростом n. В отличие от предыдущих случаев, выявленные группы, имеющие атом Na в центре, многовариантны: n меняется в широком диапазоне и распределение имеет один максимум. Ранее такие группы раздельно не рассматривались. Распределения на рис. 3 можно сравнить с аналогичными данными для стекла, полученными в [5]. Имеются существенные отличия: в стекле доли групп BO4 и ОВ3 значительно больше, чем в расплаве, нет минимума в распределении групп ООn при n = 3, а распределение групп ВВn имеет более широкий спектр по n.
На рис. 4 показаны статистические распределения по длинам связей для всех найденных групп. В расчетах диапазон значений длин связи для каждой пары X–Y разбивался на сто интервалов. Как и ожидалось, наиболее локализованы распределения у элементов борокислородной сетки: групп BOn, OBn, BBn и OOn, тогда как распределения всех длин связей с натрием сильно размыто. В базовых единицах BO3 и BO4 средние длины связей равны 1.3386 и 1.505 Å и они образуют первую координационную сферу. Во второй координационной сфере с радиусом около 2.5 Å находятся атомы бора (BBn), кислорода (OOn и NaOn) и натрия (ONan). Третья координационная сфера образована атомами натрия (BNan и NaNan) и бора (NaBn) и имеют размытый максимум в районе 3.5–4 Å. Следующие координационные сферы образованы сложными комбинациями указанных выше групп и не имеют четких максимумов (рис. 1).
Рис. 4.
Функции распределения по длинам связей для всех групп атомов в системе 30Na2O–70B2O3 при 1273 К. a) Бор с кислородом и другими атомами бора; б) кислород с бором и другими атомами кислорода; в) натрий с кислородом и кислород с натрием; г) бор с натрием и натрий с бором; д) связи Na–Na.
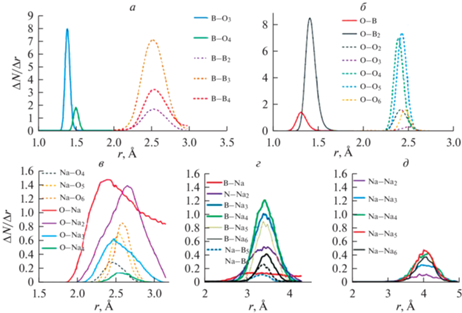
На рис. 5 приведены рассчитанные с шагом по углу 2 град функции распределения по углам Y–X–Y между связями в группах XYn, начиная с n = 2. По характеру распределения их можно подразделить на три категории. Первая, характерная для связей бора с кислородом (рис. 2а, 2б), имеет только один пик вблизи 120° (BO3 и OB2) или 110° (BO4). Второй тип углового распределения описывает связи ООn, ВВn, NaВn и NaOn, (рис. 5в–5е). Здесь наблюдается довольно острый пик в области 40°–60° и широкий в остальной части диапазона от 70° до 180°. Третий тип распределения – без выраженных пиков во всем интервале от 40° до 180° – характеризует связи BNan, ONan и NaNan, (рис. 5ж–5и).
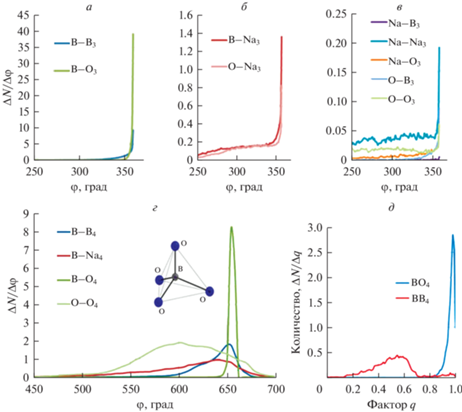
Наконец, на рис. 6а–6г представлены распределения по суммам углов в группировках XYn с n = 3 и n = 4 с шагом по углу 1.1 и 4 град соответственно, и критерий тетраэдричности для двух наиболее интересных с точки зрения суммы углов групп BO4 и BB4 (рис. 6д). Эти данные использованы для дополнительного обоснования отнесения группировок к определенным геометрическим формам: планарному треугольнику в случае n = 3 и правильному тетраэдру при n = 4. Хорошее соответствие найдено для базовых структурных единиц BO3 и BO4. В меньшей степени соответствует треугольнику структура BB3. Для других групп XY3, рис. 6б, 6в, несмотря на схожую форму распределения, максимальные значения ΔN/ΔФ на полтора-два порядка меньшие, т.е. статистически менее значимы.
Рис. 6.
Функции распределения по суммам углов Ф между связями X–Y, в группах XY3 (а–в) и XY4 (г), а также критерий “тетраэдричности” для отдельных групп с четырьмя связями (д).
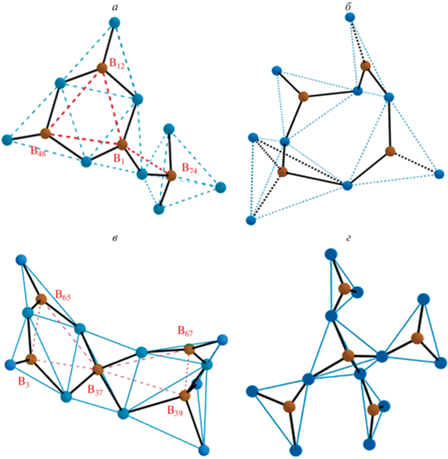
Типичные схемы формирования элементов борокислородной сетки приведены на рис. 7 и представляют из себя скриншоты фрагментов реальных структур, полученных в пакете VASP на одном из последних расчетных шагов, воспроизведенных в 3D с соблюдением масштаба при помощи пакета GeoGebra. Оказалось, что в общую борокислородную сетку входят практически все атомы бора и кислорода.
Рис. 7.
Визуализация примеров характерных сочетаний базовых структурных единиц на последних шагах расчета а) бороксольное кольцо из 6 атомов – образовано тремя треугольниками BO3 и связанное с тетраэдром BO4; б) кольцо из 8 атомов, образованное одним тетраэдром BO4 и тремя треугольниками BO3; в) два 6–атомных кольца – триборатная группа (слева) и ди-триборатная группа (справа), объединенные общим тетраэдром BO4; г) фрагмент борокислородной сетки, не включающий кольца, и состоящий из четырех треугольников BO3, связанных с тетраэдром BO4. B – коричневые шарики; О – синие шарики.
В табл. 2 представлены основные численные характеристики приведенных на рисунках статистически значимых распределений. Также приведены значения этих величин из литературных данных [5, 7, 16–19, 24, 25], если таковые имеются, причем, в таблице учтены только концентрации Na2O, близкие к 30 мол. %. В этих источниках на основании различных экспериментальных данных и результатов расчетов высказываются схожие представления об основных базовых единицах натриево-боратных стекол и расплавов. Чистый B2O3 состоит исключительно из трех-координированного бора, т.е. групп BO3, планарных треугольников с атомом B в центре. С ростом концентрации Na2O появляются тетраэдрические структуры BO4 и их количество растет до концентрации 42 мол. % Na2O [16]. В отличие от данной работы, в литературе длины связей и углы между ними оцениваются, как правило, для системы в целом, без разбиения на группы XYn по параметру n. Кроме того, бóльшая часть приводимых данных относится к стеклообразному состоянию. Несмотря на эти оговорки наши данные хорошо согласуются с литературными, что подтверждает мнение об устойчивости базовых структурных единиц для разных систем.
Таблица 2.
Характеристики основных структурных единиц борокислородной сетки по данным статистического анализа координат атомов
| XYn | Доля среди всех XYn, % | Вероятная
длина связи X–Y, Å |
Длина связи X–Y, Å, лит. данные |
Вероятный угол Y–X–Y |
Угол Y–X–Y, лит. данные |
Вероятная сумма углов Y–X–Y |
|---|---|---|---|---|---|---|
| B–O3 | 80.2 | 1.386 | 1.38 (BO3), 1.55 (BO4) [5]; 1.33–1.39 (BO3) 1.45–1.47 (BO4) [7]; 1.38 (BO3), 1.5 (BO4) [16]; 1.38 (BO4), 1.52 (BO4) [17, 18] 1.48 [19]; 1.40 [24]; 1.43/1.41 (стекло/расплав) [25] |
119° | Угол O–B–O: 110°, 120° [5] 120° (BO3), 110° (BO4) [7] 120° (BO3), 110° (BO4) [16] 119.4° (BO3), 109° (BO4) [17, 18] 120° (BO3), 109.7° (BO4) [19] Угол B–O–B: 125° [5] 155° [16] |
359° |
| B–O4 | 19.06 | 1.505 | 108° | 655° | ||
| O–B | 14.19 | 1.317 | – | – | ||
| O–B2 | 85.53 | 1.416 | 120° | |||
| O–O2 | 11.29 | 2.426 | 2.41 [4]; 2.30 [5]; 2.40 [16]; 2.41 [17, 18] 2.4 [25] |
58° | 60°, 120° [5] | |
| O–O3 | 2.64 | 2.497 | 58° | ~358° | ||
| O–O4 | 37.60 | 2.391 | 58°,118° | ~600° | ||
| O–O5 | 39.35 | 2.426 | 58°, 116° | – | ||
| O–O6 | 8.06 | 2.461 | 58°, 114° | – | ||
| B–B2 | 20.75 | 2.525 | 2.45, 2.70 [5]; 2.78 [16]; 2.41 [24]; |
58°, 110° | 55°, 120° [5] | – |
| B–B3 | 56.70 | 2.525 | 60°, 126° | 359° | ||
| B–B4 | 20.34 | 2.525 | 58°, 108° | 650° |
Рассмотрим более подробно структурные единицы, представленные в табл. 2 и на рис. 2–6, чтобы выделить и охарактеризовать основные устойчивые структурные элементы борокислородной сетки.
BO3 – одна из двух базовых структурных единиц, причем самая распространенная (80.2% всех BOn). Она представляет собой планарный треугольник, близкий к правильному, с атомом бора в центре и атомами О в вершинах. В общем случае в пирамиде XY3 сумма углов Y–X–Y при вершине X всегда меньше 360°. Стремление этой суммы к 360° означает вырождение пирамиды в плоский треугольник с атомом X в центре, что и наблюдаем для BO3 (рис. 6а), где наиболее вероятная величина равна 359 град. Этим подтверждается планарность всех групп ВО3. А то, что эти треугольники правильные, подтверждает резкий пик (рис. 4а) распределения длин связи В–О в нем. Среднестатистическим сторонам B–O по 1.386 Å и углу O–B–O 119° в треугольнике соответствует средняя длина O–O, равная 2.38 Å, которая коррелирует с длинами связи в структурах ООn (табл. 2). Отклонение наиболее вероятного угла O–B–O от 120°, а суммы углов от 360° связано с тепловыми колебаниями.
BO4 – вторая базовая структурная единица, – тетраэдр, близкий к правильному, с атомом B в центре и атомами О в вершинах. Среднестатистическим связям B–O по 1.505 Å соответствует длина O–O, равная 2.4577 Å, которая также коррелирует с длинами связи в группах OOn. В правильном тетраэдре XY4, с атомом X в центре углы Y–X–Y составляют 109.47°, а их сумма 656.83°. Для реальных групп ВО4 нами получены очень близкие значения: угол O–B–O равен примерно 108°, а наиболее вероятная сумма шести углов около 655°. Дополнительно, близость четырехгранников ВО4 к правильному тетраэдру подтверждают примерное равенство длин сторон В–О (резкий пик на рис. 4а) и близость критерия “тетраэдричности” к единице (математическое ожидание величины q, приведенной на рис. 6д равно 0.96). Полученная нами концентрация группы ВО4 – 19.1% коррелирует с приводимыми в экспериментальных работах величинами: 14% по спектроскопическим данным [2] и 15 ± 5% по рентгеновским данным [24]. Отметим, что расстояния В–О в треугольниках существенно (на 8.6%) меньше, чем в тетраэдрах.
Группы OB и OO2 – рассматриваются вместе, так как соответствуют немостиковому атому кислорода при атоме бора в группе ВО3. НМК, составляющие 14.2% всех атомов кислорода, обнаружены нами только в составе базовых структурных единиц BO3, а в составе тетраэдров BO4 практически отсутствуют. Спектроскопические данные, приведенные в [3], также свидетельствуют, что при Т = 1273 К, тетраэдры, содержащие НМК, практически отсутствуют. Поэтому угол B–O–B, на угловом распределении для OO2 имеет только один пик при 58° (рис. 5в). Естественно предположить, что количество групп ОВ должно быть равно количеству групп ОО2, но последних меньше (11.3%). Это объясняется тем, что к НМК в треугольниках могут приближаться другие базовые структуры, не связанные с ним через атомы бора, но создающие дополнительные связи О–О.
Группа OB2 охватывает 85.5% всех атомов кислорода. Она соответствуют мостиковому кислороду (МК), связывающему атомы бора – центры двух базовых структурных единиц. Если оба B принадлежат планарным треугольникам BO3, то при наиболее вероятном угле B–O–B, равном 120° (рис. 5б), длина связи B–B должна составить 2.40 Å, в случае двух тетраэдров B–O4 получаем длину связи B–B, равную 2.61 Å, а в смешанном случае величину около 2.50 Å. Эти величины отлично коррелируют с длинами в группах ВВn. В свою очередь, попавшая в статистику для ОВ2 длина 1.416 Å – это комбинация длин 1.386 (группы ВО3) и 1.505 Å (группы ВО4). Укажем также, что из-за несимметричного взаимодействия немостиковая связь О–В (1.317 Å) еще короче, чем средняя в треугольниках ВО3.
Таким образом, связями бора с кислородом формируются базовые структурные единицы расплава: ВО3 и ВО4, представляющие собой правильные треугольники и тетраэдры. Углы O–B–O сформированы лучами из центра треугольника или тетраэдра в вершины, а углы B–O–B находятся при мостиковом кислороде, связывающим два треугольника ВО3, два тетраэдра ВО4, либо тетраэдр с треугольником.
Группа OO3 – малочисленна (2.6%). Она могла бы реализоваться как НМК в вершине тетраэдра BO4, но, как указано выше, такие случаи практически не встречаются. Как правило, группы ОО3 образуются немостиковыми кислородами, принадлежащими ВО3, к которым приблизился на расстояние меньше 2.8 Å еще один кислород от соседней базовой единицы. Соответственно, на угловом распределении только 1 пик, соответствующий внутренним углам в треугольнике. К нему относятся примерно 15% углов, а остальные углы распределены в диапазоне 70°–180°.
OO4. Таких групп среди OOn – максимальное количество. Группа ОO4 складывается вокруг мостикового атома кислорода, общего для двух треугольников BO3. Вокруг него связи O–B образуют 2 “внутренних” угла треугольников, близких к 60° и 4 “внешних” угла (между сторонами разных треугольников), формирующих на угловом распределении широкий пик около 120° (рис. 5в). Острому пику принадлежит 38.3% углов.
OO5 формируется вокруг атома кислорода, общего для двух разных базовых единиц – треугольника BO3 и тетраэдра BO4. В этом случае имеется 4 “внутренних” угла ~60° плюс 6 “внешних” углов в диапазоне от 70° до 180°. Соответственно на угловом распределении 2 пика (острому пику принадлежит 42.42% углов).
Структур ОО5 и ОО4 наибольшее количество среди OOn.
OO6 соответствует атому кислорода, связывающему два тетраэдра BO4. Здесь присутствуют 6 “внутренних” углов ~60° и 9 “внешних” углов от 70° до 180°. Отсюда также два пика на угловом распределении: острому пику принадлежит 38.95% углов. Эта группа встречается относительно редко (8% групп OOn) из-за малого количества связанных тетраэдров.
Таким образом, для всех групп ООn острый пик отражает внутренние углы базовых структурных единиц, остальное – углы между ребрами разных треугольников и тетраэдров, связанных мостиковым кислородом.
BB2 – эта группа образуется, в основном, атомом бора в центре треугольника BO3, имеющего один НМК, в силу чего теряется связь с третьим атомом бора. Таких групп 20.75% среди всех BBn. Острому пику на угловом распределении принадлежит незначительная доля углов (19.5%).
BB3 – самая массовая группа среди BBn (56.7%). Формируется вокруг атома бора в центре треугольника BO3, связанного общими кислородами с 3 другими базовыми единицами: треугольниками BO3 или тетраэдрами BO4. Острому пику на угловом распределении принадлежит 13.7% групп. На рис. 7а приведен пример группы ВВ3 вокруг атома “В1” (выделена красными линиями). Видно, что угол “B48–B1–B12” близок к 60°, а углы “B12–B1–B74” и “B48–B1–B74” ~ 120°.
BB4 – группа с атомом бора в центре тетраэдра, связанного с 4 другими базовыми единицами: треугольниками BO3 или тетраэдрами BO4. Количество таких группировок (20.3%) практически совпадает с долей тетраэдров, что еще раз подтверждает отсутствие в тетраэдрах немостиковых кислородов. Острому пику на угловом распределении принадлежит 15.7% углов. На рис. 7в приведен пример группы ВВ4 вокруг атома “В37” (выделена красными линиями). Здесь углы “B3–B37–B65” и “B39–B37–B67” близки к 60°, а все прочие углы “B–B–B” при атоме “B37” – тупые.
Для групп BB4 был также рассчитан критерий “тетраэдричности”, но его значение оказалось много меньше единицы (рис. 6д), что не позволяет считать их правильными тетраэдрами, хотя распределение по сумме углов имеет небольшой пик вблизи 650°.
Острый пик вблизи 60° на угловых распределениях во всех группах BBn объясняется склонностью базовых структурных единиц BO3 и BO4 связываться в шестиатомные кольца. Если центральный в группе BBn атом бора окружен не связанными друг с другом треугольниками и тетраэдрами, как, например, на рис. 7г, то углы B–B–B случайны и, как правило, тупые. Если же эти группы формируют кольцо, то принадлежащие этому кольцу связи B–B образуют треугольник, близкий к правильному, как, например, на рис. 7а, 7в, что и приводит к углам близким к 60°.
В работе подробно проанализированы группы XYn до n = 6 и этого достаточно для всех компонентов борокислородной сетки, но недостаточно для групп, содержащих Na.
Ионы натрия кластеризуются в сетке рядом с НМК и полиэдрами ${\text{BO}}_{4}^{ - }$ и образуют сложные группировки с большими координационными числами n (для бора от 5 до 13, а для кислорода от 4 до 8), как видно из рис. 3. В группах NaBn и NaOn предпочтительные углы в 40°–44° указывают на то, что атом натрия встраивается в борокислородную сетку с соблюдением некоторой упорядоченности относительно бора и кислорода. Из данных по ИК-спектроскопии [26] известно, что ионы натрия в стеклах занимают две позиции, одну первичную (близкую к кристаллографической) и вторичную, с наиболее вероятным координационным числом 5.5. В расплавах возможно увеличение числа позиций ионов натрия. Вокруг каждого Na имеются пары атомов кислорода или бора с характерными длинами связей, которые и образуют указанные выше предпочтительные острые углы, причем атомы кислорода ближе к натрию и поэтому угол О–Na–O менее острый, чем B–Na–B. Отметим, что группы ONan имеют небольшое число возможных вариантов (в основном n = 1, 2, 3), при этом максимум приходится на n = 1, что связано с тем. что оксид натрия отдает часть кислородов в борокислородную сетку, образуя тетраэдры.
В угловых распределениях BNan, ONan и NaNan никаких элементов упорядоченности не наблюдается (рис. 5ж–5и). По-видимому, все комплексы, не входящие в борокислородную сетку, являются неустойчивыми. Об этом свидетельствует большое количество возможных группировок и сильно размытые распределения длин связей и особенно углов между ними.
Базовые структурные единицы BO3 и BO4 склонны объединяться в надструктурные образования, например кольцевые структуры на основе B3O3 и B4O4. Это иллюстрирует рис. 7.
В ячейке постоянно присутствуют шестиатомные кольца (их в среднем 11.2 шт., т.е. в них находится около 40% атомов бора) и 3–4 восьмиатомных кольца. Причем, однажды сформировавшееся кольцо, стремится сохранить в себе составляющие его атомы. Атомы шестичленных колец незначительно отклоняются от общей плоскости.
Разное соотношение единиц BO3 и BO4 в кольцевых группах формируют разные типы полиборатных групп на основе B3O3 [2]. В нашей модели обнаружены бороксольные, триборатные, ди-триборатные, ди-пентаборатные группы. Восьмиатомные кольцевые структуры, в отличие от шестиатомных, имеют сложные пространственные формы и не стремятся выстроиться в одной плоскости. Вероятно, в сложной борокислородной сетке можно обнаружить и более длинные замкнутые цепочки BnOn, но они не образуют единообразные фигуры и вряд ли могут считаться структурными единицами.
ЗАКЛЮЧЕНИЕ
Проведено теоретическое изучение локальных структурных комплексов в расплаве состава 30Na2O–70B2O3 при Т = 1273 К. Для получения достаточно длинных траекторий движения атомов использовалась первопринципная молекулярная динамика, а геометрические характеристики ближайших окружений для каждого атома и их статистика по всем шагам моделирования рассчитывались с помощью оригинальной программы. В отличие от других работ, где, как правило, рассматривались интегральные характеристики и использовался метод классической молекулярной динамики, нами были рассмотрены все возможные ближайшие координации и для каждой вычислены средние длины связей, углы между ними и другие характеристики, которые представлены в таблицах и на рисунках.
Показано, что, введение оксида натрия в борный ангидрид модифицирует борокислородную сетку, в которую по-прежнему входят практически все атомы бора. Часть тригональных единиц BO3, составляющих сетку чистого расплава В2О3, преобразуются в полиэдры BO4. Эти две группы являются основными стабильными группировками в жидкости, причем первые представляют собой планарные треугольники (80.20% атомов B), а вторые – правильные тетраэдры (19.06% атомов B) с атомами бора в центре. Это подтверждается полученными острыми пиками распределений для длин связей В–О, углов О–В–О, сумм этих углов (в треугольниках они близки к 360°, а в тетраэдрах – к 657°) и критерием “тетраэдричности”, очень близким к единице.
Их сочетания формируют более сложные надструктурные единицы на основе колец из 6 и 8 чередующихся между собой атомов бора и кислорода (бороксольные кольца, триборатные, ди-триборатные и более сложные кольцевые группы), в которые входит более половины атомов B.
Доля мостиковых атомов кислорода в системе составляет примерно 85.5%, а доля НМК около 14.2%, причем практически все немостиковые атомы кислорода входят в базовые единицы BØ2O–.
Полученные нами геометрические параметры борокислородной сетки расплава хорошо коррелируют с литературными данными, но являются более детализированными. Разработанная методика позволяет без использования каких-либо эмпирических данных получать труднодоступную экспериментально информацию о локальных структурах в щелочно-боратных системах. Кроме того, что такая информация имеет самостоятельную ценность, она позволит в дальнейшем интерпретировать концентрационные и температурные зависимости различных физико-химических свойств этих систем. Именно в этом направлении работа будет продолжена.
Расчеты были проведены на суперкомпьютере “Уран” ИММ УрО РАН.
Работа выполнена в рамках госзадания ИМЕТ УрО РАН.
Список литературы
Krogh-Moe J. // Phys. Chem. Glasses 1969. 6. 2. P. 46–54. https://doi.org/10.1016/0022-3093(69)90025-8
Yano T., Kunimine N., Shibata S., Yamane M. // J. Non-Crystalline Solids. 2003. 321. P. 147–156. https://doi.org/10.1016/S0022-3093(03)00159-5
Osipov A.A., Osipova L.M. // GlassPhys. Chem. 2009. 35. P. 121–131. https://doi.org/10.1134/S1087659609020011
Handa K., Kita Y., Kohara S. // J. Physics and Chemistry of Solids. 1999. 60. P. 1465–1471. https://doi.org/10.1016/S0022-3697(99)00143-2
Fábián M., Sváb E., Proffen T., Veress E. // J. Non-Crystalline Solids 2010. 356. P. 441–446. https://doi.org/10.1016/j.jnoncrysol.2009.12.013
Guillaume F., Charpentier T., Seitsonen A.P., Takada A., Lazzeri M., Cormier L., Calas G., Mauri F. // Phys. Rev. Lett. 2008. 101. 065504. https://doi.org/10.1103/PhysRevLett.101.065504
Бубнова Р.С., Филатов С.К. Высокотемпературная кристаллохимия боратов и боросиликатов. Санкт-Петербург: Наука, 2008.
Kaiura G.H., Toguri J.M. The viscosity and structure of sodium borate melts // Physics and chemistry of glasses // Phys and Chem Glasses. 1976. 17. № 3. P. 62–69.
Shartsis L., Capps W., and Spinner S. Viscosity and electrical resistivity of molten alkali borates // J. Am. Cer. Soc. 1953. 36. № 2. P. 35–43.
Claes P., Coq J.L., Glibert J. // Electrochimica Acta. 1988. 33. P. 347–352. https://doi.org/10.1016/0013-4686(88)85027-8
Melchakov S.Y., Khokhryakov A.A., Samoilova M.A., Ryabov V.V., Yagodin D.A. // Glass. Phys. Chem. 2022. 48. № 3. P. 174–179. https://doi.org/10.1134/S1087659622030063
Khokhryakov A.A., Melchakov S.Y., Samoilova M. A., Ryabov V. V. // Inorganic materials. 2022. 58. № 5. P. 538–543. https://doi.org/10.1134/S0020168522050053
Cristos-Platon E., Varsamis // Phys. Rev B. 2002. 65. P. 104203-104217. https://doi.org/10.1103/PhysRevB.65.104203
Ohkubo T., Takahiro O., Tsuchida E., Gobet M., Sarou-Kanian V., Bessada C., Yasuhiko I. // J. Phys. Chem. B. 2013. 117. P. 5668–5674. https://doi.org/10.1021/jp312486m
Yuryev A.A., Samoylova M.A. // J. Structural Chemistry. 2020. 61. 5. P. 681–687. https://doi.org/10.1134/S0022476620050029
Xu Q., Kawamura K., Yokokawa T. // J. Non-Cryst. Solids. 1988. 104. P. 261–272. https://doi.org/10.1016/0022-3093(88)90397-3
Kita Y., Misawa M. Umesaki N., Kirihara T., Fukunaga T., Iida T. ISIJ International. 1993. 33. № 1. P. 188–194. https://doi.org/10.2355/isijinternational.33.188
Umesaki N., Kita Y., Kirihara T., Iida T., Fukunaga T., Misawa M. // J. Non-Crystalline Solids.1994. 177. P. 200–207. https://doi.org/10.1016/0022-3093(94)90531-2
Pooja S., Pente A.A., Mandar D.S., Chowdhri I.A., Sharma K., Goswami M. Kalsanka T.S., Sadhana M. // J. Phys. Chem. B. 2019. 123. P. 6290–6302. https://doi.org/10.1021/acs.jpcb.9b03026
Kresse G., Furthmuller J. // Phys. Rev. B. American Physical Society. 1996. 54. P. 11 169–11 186. https://doi.org/10.1103/PhysRevB.54.11169
Цымбалист М.М., Юрьев А.А. Свидетельство о государственной регистрации программы для ЭВМ № 2020618833 программа для ЭВМ “StatXYZ”.
Errington J.R., Debenedetti P.G. // Nature. 2001. 409. P. 318–321. https://doi.org/10.1038/35053024
Kumar P., Buldyrev S.V., Stanley H. E. PNAS. 2009. 106. № 52. P. 22130–22134. www.pnas.org/cgi/doi/10.1073/pnas.0911094106
Alderman O.L.G. // J. Phys. Chem. C. 2015. https://doi.org/10.1021/acs.jpcc.5b10277
Majérus O., Cormier L., Calas G., Beuneu B. // Phys. Rev. B. 2003. 67. P. 024210–024217. https://doi.org/10.1103/PhysRevB.67.024210
Kamitsos E.I., Chyssikos G.D. Solid State Ionics 1998. 105. P. 75–85. https://doi.org/10.1016/S0167-2738(97)00451-7
Дополнительные материалы отсутствуют.