Агрохимия, 2019, № 10, стр. 72-84
ИССЛЕДОВАНИЕ ПРОДУКТИВНОСТИ, МОРФОМЕТРИЧЕСКИХ И ФИЗИОЛОГО-БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ КОНТРАСТНЫХ ПО УСТОЙЧИВОСТИ К СВИНЦУ СОРТОВ ЯРОВОГО ДВУРЯДНОГО ЯЧМЕНЯ
А. В. Дикарев 1, *, В. Г. Дикарев 1, Н. С. Дикарева 1
1 Всероссийский научно-исследовательский институт радиологии и агроэкологии
249032 Калужская обл., Обнинск, Киевское шоссе, 109 км, Россия
* E-mail: ar.djuna@yandex.ru
Поступила в редакцию 04.03.2019
После доработки 05.04.2019
Принята к публикации 10.07.2019
Аннотация
В вегетационном эксперименте исследовали действие свинца на изменение морфофизиологических, биохимических показателей и продуктивности 4-х сортов ярового ячменя, контрастных по устойчивости к свинцу. Задачей исследования было выяснение воспроизводимости результатов, полученных в лабораторных условиях, в ситуации вегетационного опыта. Выясняли, выявляется ли описанный ранее полиморфизм сортов ячменя по реакции на действие свинца не только на проростках, но и на протяжении всего жизненного цикла растения. Растения выращивали на дерново-подзолистой почве в 3-х вариантах – контроль и критические дозы свинца, вызывающие значимое угнетение развития растений, выявленные в предыдущих исследованиях (1000 и 1500 мг Pb2+/кг почвы). Отметили подавление развития зеленой массы растений при действии свинца, при этом наибольшие различия между группами контрастных по устойчивости сортов выявлены на ранних этапах онтогенеза. Наблюдали изменение биохимических параметров по сравнению с контролем: отмечен рост содержания свободного пролина, особенно у устойчивых сортов. Морфо- и биометрические параметры растений ячменя хотя и демонстрировали некоторое угнетение при действии свинца, но между группами контрастных по устойчивости сортов значимых различий не отмечено.
ВВЕДЕНИЕ
В настоящее время весьма актуальной является проблема исследования загрязнения почв сельхозугодий всевозможными техногенными поллютантами, в частности, тяжелыми металлами (ТМ). О значимости этой проблемы говорят хотя бы такие факты: более 1 млн га сельскохозяйственных угодий РФ загрязнено особо токсичными элементами (I класс опасности) и 2.3 млн га – токсичными (II класс опасности) [1].
Одним из распространенных ТМ является свинец, который накапливается в окружающей среде вследствие добычи полезных ископаемых, использования автономных источников питания, сжигания моторных топлив, производства лакокрасочных материалов и другими путями. Данный металл поступает в атмосферу в количестве >250 тыс. т ежегодно, и городская пыль может содержать ≈1% свинца, в осадках его содержание доходит до 300 мг/дм3 [2]. При этом, несмотря на то что в разные годы выполнено множество работ, посвященных исследованию воздействия этого ТМ на растения [3–6], в данном вопросе все еще нет полной ясности. Считается, что одним из основных способов, которым свинец оказывает негативное воздействие на растительный организм, является повышенная выработка свободных радикалов. Последние, в свою очередь, индуцируют процессы перекисного окисления липидов плазмалеммы [7]. Это предположение подтверждает еще и то обстоятельство, что введение в среду соединений-ловушек свободных радикалов способствует нивелированию стрессовых реакций [8, 9].
Следует отметить общность основных механизмов поступления и метаболизма ТМ в организмах всех живых существ, в том числе и растений. Но в случае, если речь идет о сельскохозяйственных культурах, то необходимо учитывать помимо видовых особенностей растения еще и характеристики почв, на которых их выращивают, например, их гранулометрический состав, плодородие, физико-химические свойства. Причина, по которой эти особенности заслуживают повышенного внимания – это их модифицирующее влияние на то, насколько ярко могут проявиться негативные эффекты воздействия ТМ в конкретном случае.
Помимо фундаментального, несомненно и практическое значение проблемы устойчивости растений к техногенному стрессу. Очевидно, что продуктивность угнетенных вследствие негативного воздействия техногенных поллютантов растений существенно снижается. Таким образом, более глубокое изучение механизмов воздействия ТМ и других загрязнителей на живые системы непосредственно связано с задачей повышения продуктивности сельского хозяйства. Конечной целью такой работы является уточнение допустимых концентраций ТМ в различных типах почв и разработка методов, обеспечивающих получение качественной и безопасной сельскохозяйственной продукции на загрязненных территориях.
В наших предыдущих работах [10] были оценены концентрации свинца, оказывающие достоверный токсический эффект на проростки ячменя, исследован внутривидовой полиморфизм ярового ячменя по устойчивости к действию свинца и выделено 12 контрастных по реакции на воздействие свинца сортов – по 6 сортов устойчивых и чувствительных. В связи с этим было интересно проверить результаты лабораторного эксперимента в условиях вегетационного опыта с почвенной культурой, установив, будут ли выявленные на основе исследования проростков сорта демонстрировать аналогичные реакции на действие ТМ на протяжении всего жизненного цикла растения.
Для реализации этой задачи был проведен вегетационный опыт с использованием нескольких, наиболее контрастных по устойчивости к свинцу сортов ячменя из тех, что были отобраны в предыдущих экспериментах. При этом изучали влияние свинца на морфофизиологические и биохимические показатели растений ячменя. Анализировали площадь листьев, накопление воздушно-сухой массы растений, а также содержание свободного пролина и малонового диальдегида в органах.
Цель работы – оценка воспроизводимости результатов лабораторного эксперимента с проростками сортов ячменя различного географического происхождения по исследованию устойчивости их к свинцу во время всего жизненного цикла растений по морфометрическим, физиолого-биохимическим показателям и продуктивности. Таким образом, новизной представленного исследования явилось то, что впервые было изучено, сохраняется ли дифференциация сортов ячменя различного происхождения на устойчивые и чувствительные к действию свинца в течение всего жизненного цикла растений, или же она обнаруживается только у проростков, а далее нивелируется.
МЕТОДИКА ИССЛЕДОВАНИЯ
Эксперимент по изучению влияния загрязнения почвы свинцом на рост, развитие, биохимические показатели и продуктивность ярового двурядного ячменя был заложен на дерново-подзолистой супесчаной почве. Для работы были взяты следующие сорта ярового ячменя из мировой коллекции ВИР: устойчивые к действию свинца – Заря (Кировская обл.) и Тео (Великобритания); чувствительные к действию свинца – NSGL1 (Югославия) и Заветный (Ростовская обл.). Методика и процедура выбора этих сортов были описаны в работах [10–12]. Растения выращивали в пластиковых сосудах емкостью 5 кг по общепринятой методике [13]. Агрохимические характеристики почвы [14] приведены в табл. 1.
Таблица 1.
Физико-химические характеристики почв опыта
| Показатель | Дерново-подзолистая супесчаная |
|---|---|
| pHKCl | 5.27 ± 0.01 |
| Гумус, % | 1.31 ± 0.02 |
| Hг, мг-экв/100 г почвы | 1.82 ± 0.03 |
| Сумма обменных оснований, мг-экв/100 г почвы | 6.05 ± 0.18 |
| Обменный K2O (по Масловой), мг/кг почвы | 77.6 ± 3.3 |
| Подвижный P2O5 (по Кирсанову), мг/кг почвы | 65.0 ± 0.6 |
Свинец был внесен в почву в виде Pb(NO3)2 в концентрациях 1500 и 1000 мг/кг. При выборе концентрации ТМ, использованной в данном исследовании, руководствовались данными, полученными в проведенных ранее вегетационных опытах по изучению ответа растений ячменя на действие диапазона возрастающих доз свинца [15]. На основе анализа данных по реакции морфометрических и биохимических показателей растений ячменя была выбрана доза ТМ, которую можно считать критической, т.е. такой, которая вызывает существенное угнетение изученных параметров, но еще позволяет растению нормально развиваться и завершить свой жизненный цикл. Предполагали, что используя эту концентрацию свинца, можно обнаружить разделение выбранных сортов ячменя на устойчивые и чувствительные к этому ТМ.
В каждом случае опыт проводили в четырехкратной повторности для каждого сорта, плюс еще 4 повторности контроля. При закладке опыта почву тщательно перемешивали и вносили в нее питательные элементы в виде водных растворов солей NH4NO3, и K2HPO4 из расчета N200P25K33. При внесении в почву питательных веществ учитывали и корректировали количество азота, поступавшее с раствором соли ТМ. Контролем служил вариант NPK без внесения свинца. При выборе солей питательных элементов, их концентраций руководствовались рекомендациями, приведенными в работах [13, 14], на которых основывали всю методику данного опыта.
Перед посевом почву инкубировали в течение 14 сут при температуре 20–23°С и влажности 60% ПВ. Растения выращивали до товарной спелости в условиях постоянной влажности почвы (60% ПВ). Положение вегетационных сосудов меняли ежедневно по схеме, обеспечивающей однородные условия роста и развития растений. Поливали растения дистиллированной водой.
До урожая оставляли по 10 растений в сосуде. В течение всего вегетационного периода вели фенологические наблюдения. При уборке урожая через 90 сут после всходов в пробах определяли структуру урожая по следующим показателям: высота растений, общее число стеблей и число продуктивных стеблей, вес колосьев, масса соломы; общее число колосьев и число колосьев с зерном, масса зерна, число зерен.
Отбор растительных проб для морфометрического и биохимического анализов проводили через 30 сут после всходов. Биохимические показатели (содержание свободного пролина [16] и малонового диальдегида (МДА) [17]) определяли в пробах листьев.
Статистическую обработку экспериментальных данных проводили стандартными методами с использованием программных пакетов MS Excel 2003 и Statistica 10.0. На графиках и диаграммах приведены средние арифметические величины в расчете на одно растение и доверительные интервалы показателей (в % к контролю)) при 95%-ном уровне значимости.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Внешний вид растений ярового ячменя через 30 сут после всходов представлен на рис. 1. На этом этапе органогенеза были уже заметны различия во внешнем виде и особенно по высоте растений при действии свинца по сравнению с контрольным вариантом (на рис. 1 показан вариант с внесением 1500 мг/кг, как наиболее наглядный). Изменилась и биомасса растений. Так же следует отметить, что устойчивые сорта (сосуды 2 и 4) демонстрировали меньшее угнетение по сравнению с чувствительными (сосуды 6 и 8). Следовательно, доза в 1500 мг/кг является достаточной для обнаружения эффектов воздействия ТМ и дифференциации сортов на устойчивые и чувствительные, что подтверждают результаты ранее проведенных исследований [10, 11]. Использование более высоких доз ТМ было бы нежелательным, поскольку исследование реакции растений на цитогенетическом уровне с использованием в качестве тест-системы интеркалярной меристемы листьев, вероятно, не позволило бы получить искомую информацию при бóльших концентрациях ТМ. Более того, была надежда получить достаточный урожай зерна во всех вариантах для проведения цитогенетического анализа в апикальных меристемах корней проростков следующего после воздействия поколения.
Рис. 1.
Общий вид растений ячменя через 30 сут после всходов, варианты: 1 – Заря (контроль), 2 – Заря 1500 мг Pb/кг, 3 – Тео (контроль); 4 – Тео 1500 мг Pb/кг, 5 – NSGL (контроль), 6 – NSGL 1500 мг Pb/кг, 7 – Заветный (контроль), 8 – Заветный 1500 мг Pb/кг.

На рис. 2 приведены количественные данные, которые подтвердили визуальные данные о влиянии свинца на высоту растений ячменя. В целом отмечено несущественное угнетение показателя по сравнению с контрольным вариантом для всех сортов. При этом показатель площади листьев был подвержен воздействию сильнее, сокращаясь по сравнению с контролем примерно в 2 раза. Не удалось выявить различий для обоих показателей между устойчивыми и чувствительными сортами. Хотя можно отметить, что сорт Заря из группы устойчивых по площади листьев опередил остальные сорта. Третий показатель – биомасса был подвержен влиянию свинца существенно сильнее, но различий между сортами не отмечено.
Рис. 2.
Влияние тестирующей концентрации свинца на высоту, площадь листьев и биомассу растений ярового ячменя.

Аналогичные по форме дозовые зависимости площади листьев растений подтвердили тесную взаимосвязь с высотой растений. Однако для площади листьев кривая проходила гораздо ниже контроля, чем для высоты растений. Таким образом, первый показатель был более чувствителен к действию свинца и в целом снижался. Однако из-за сильной вариабельности данных этого показателя можно утверждать лишь о тенденции к его снижению. В то же время высота растений не позволила ни выявить различий между сортами, ни обнаружить явных признаков воздействия ТМ. Вероятно, этой дозы еще недостаточно для четкой и статистически значимой дифференциации сортов на устойчивые и чувствительные, хотя визуально на уровне целого растения разница присутствовала.
Сильнее всего при действии свинца изменилась величина надземной биомассы. Являясь интегральным показателем, включающим в себя как высоту растений, так и площадь листьев, биомасса показала сходную с другими показателями реакцию на действие ТМ. Причем в отличие от площади листьев варьирование биомассы было выражено гораздо меньше, и показатели накопления биомассы всех 4-х сортов почти не отличались. Можно отметить следующую закономерность: при действии свинца сильнее всего сокращалась биомасса, в меньшей степени – площадь листьев, и, наконец, высота растений реагировала слабее всего. Есть лишь одно исключение для этого показателя – сорт Тео, у которого величина биомассы почти совпала с таковой для площади листьев. Из полученных результатов следует, что изученные морфометрические показатели не позволили уверенно разделить устойчивые и чувствительные сорта по реакции на действие свинца. Однако можно отметить некоторые особенности, характерные для устойчивых сортов. Например, сорт Заря выделялся статистически значимо большей площадью листьев, а у сорта Тео биомасса не была наиболее чувствительным показателем. Вероятно, такие особенности являются следствием устойчивости этого сорта к действию поллютанта. В то же время оба чувствительных сорта демонстрировали одинаковый ответ на действие свинца – снижение всех 3-х показателей таким образом, что высота растений реагировала слабее всего, а биомасса – наиболее сильно.
Действие повреждающих агентов вызывает включение у живых организмов механизмов защиты. Например, ТМ вызывают нарушение функционирования ферментных систем, индуцируют образование перекисных и свободнорадикальных соединений. Реакции структурных и ферментных систем клеток с этими соединениями вызывают обширные повреждения в структурах и нарушения ферментных циклов метаболизма, объединяемых под общим термином оксидативный стресс. Одним из классов соединений, которые организм направляет на нейтрализацию вредных воздействий, служит ряд аминокислот – γ-аминомасляная кислота, пролин, цистеин [18, 19], среди которых особый интерес вызывает пролин [20].
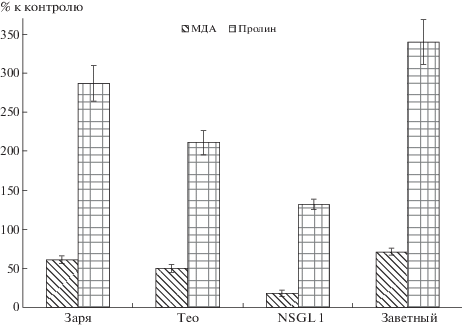
Экспериментальные данные по содержанию МДА и пролина в листьях ячменя при действии свинца в настоящем эксперименте представлены на рис. 3. При изученной концентрации ТМ у всех 4-х сортов содержание МДА было примерно в 2 раза меньше контроля. Между сортами существенных различий данного показателя не обнаружено, хотя суммарно содержание МДА было больше у устойчивых сортов. Такое снижение его содержания, возможно, вызвано действием защитных систем организма, нейтрализующих образование перекисных соединений, к которым относится МДА. Также возможно, что у ячменя защита от стресса обусловлена в большей степени иными соединениями. Возможно, причина того, что у устойчивых сортов содержание МДА несколько больше, чем у чувствительных, было связано с тем, что их защитные системы работали эффективнее.
Содержание пролина, одного из защитных соединений, синтез которого у растений активизируется при оксидативном стрессе, показало иную закономерность. В наших предыдущих исследованиях с другими культурами (конские бобы, салат, редис [21]) уже при концентрации свинца 50 мг/кг почвы отмечено резкое увеличение концентрации пролина, вполне объяснимое с точки зрения его роли как защитного соединения. Аналогичный эффект наблюдали и в данном эксперименте (увеличение содержания пролина от 1.5 до 3.5 раза по сравнению с контролем). Особенно велико было содержание пролина у чувствительного сорта Заветный, что могло быть обусловлено развитием у него выраженных стрессовых реакций.
На рис. 4 представлены диаграммы, характеризующие содержание пигментов фотосинтеза у 4-х изученных сортов ячменя, контрастных по устойчивости к действию свинца. Установлено, что исследование содержания пигментов фотосинтеза не позволило выявить существенных различий между сортами ячменя. Содержание всех пигментов у каждого из 4-х сортов при действии свинца и в контроле находилось примерно на одном уровне. Тем не менее, можно отметить, что у устойчивых сортов содержание пигментов было несколько больше, чем у чувствительных, и это особенно заметно для содержания хлорофилла а в растениях сорта Тео. Вероятно, это было следствием работы защитных механизмов, которые более эффективны у устойчивых сортов, однако использованная концентрация была недостаточно велика, чтобы выявить очевидные различия между контрастными по устойчивости сортами. Фотосинтез, как один из ключевых для растительного организма физиологических процессов, поддерживается до самых высоких уровней содержания ТМ в почве, и его подавление фактически означает гибель растения.
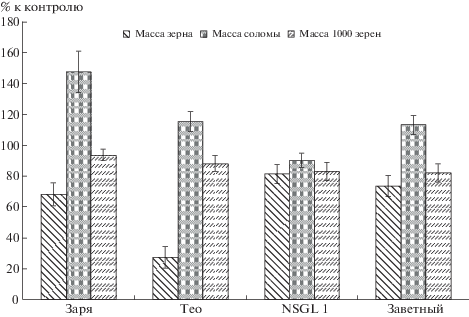
Экспериментальные данные, характеризующие влияние свинца на продуктивность ярового ячменя, представлены на рис. 5. Воздействие ТМ было неоднозначным для разных показателей. Например, при изученной концентрации свинца снижение главного показателя продуктивности – урожая зерна – было несущественным и составило ≈20%. При этом нельзя выявить явных различий между сортами по этому критерию. Для 3-х из 4-х сортов этот показатель был примерно равным, хотя и незначимо меньше, чем для устойчивого сорта Заря. Лишь один сорт Тео показал значимое уменьшение массы зерна при действии ТМ. Надо полагать, что снижение урожая зерна этого сорта вызвано сильным поражением его бактериальной инфекцией, которая проявляла себя при токсическом стрессе. Статистически значимое снижение урожая зерна можно объяснить тем, что при умеренной концентрации ТМ барьерные механизмы корневой системы еще недостаточно активированы, и поступление свинца в растения не встречает значительных препятствий. В результате поступившего количества свинца оказывается достаточно для нарушения сложных процессов формирования семян. Нельзя исключить и негативного эффекта, вызванного упомянутой выше инфекцией.
Урожай соломы, отражающий биомассу созревших растений, показал иные эффекты. Можно отметить, что у устойчивых сортов этот показатель был больше, чем у чувствительных. У сорта Заря это различие было значимым, у сорта Тео величина этого показателя мало отличалась от чувствительного сорта Заветный. При этом почти во всех случаях масса соломы была больше, чем в контроле (за исключением чувствительного сорта NSGL1). Такие результаты можно объяснить тем, что изученная доза свинца была недостаточной для существенного угнетения жизненных процессов ячменя и при ее действии защитные реакции растения активизировались, что приводило к росту массы соломы. Однако активизация защитных реакций требует увеличения расхода энергии, поэтому урожай снижался. Особенно это характерно для устойчивых сортов, у которых защитные системы работали активнее. Поэтому на рис. 5 видно, что если масса соломы устойчивых сортов в целом была больше, чем у чувствительных, то урожай – меньше. Это было следствием модификации физиологических процессов для лучшей защиты растения, что вело к снижению продуктивности [22–24]. Чувствительные сорта сохраняли ресурсы для производства большего количества семян. Поскольку доза свинца была не слишком высокой, работа защитной системы растения еще не являлась критичной для выживания. Возможно, при более высокой концентрации ТМ наблюдали бы эффект, более близкий к ожидаемому: чувствительные сорта оказались бы полностью угнетенными и дали низкий урожай, в то время как устойчивые сорта были бы способны успешно завершить жизненный цикл.
Такой хозяйственно важный показатель как масса 1000 зерен, характеризующий в интегрированном виде ряд показателей качества урожая зерна не выявил значимых различий между сортами, равно как и существенного изменения при действии ТМ. Этот показатель у устойчивых сортов все же несколько превышал таковой у чувствительных, но эти различия не были достоверными.
Ведущие прикрепленный образ жизни растения часто оказываются в неблагоприятных и даже стрессовых условиях. Это абиотические стрессы, такие как засуха, засоление, экстремальные температуры, болезни, загрязнения. Любое из этих воздействий нарушает нормальный метаболизм, рост и развитие, является причиной снижения продуктивности. Определить первичную мишень, на которую действует стрессовый фактор, либо сложно, либо невозможно в принципе. Стрессы разной природы интегрируются в растительной клетке таким образом, что провоцируют сверхпродукцию активных форм кислорода (АФК) и развитие окислительного стресса. Следует отметить, что антиокисдантные системы даже в нормальных условиях не гарантируют клетке идеальную защиту от АФК. Под действием внешних стрессовых факторов возникает серьезный дисбаланс между образованием АФК, возможностью их ликвидации и скоростью репарационных процессов. Возникает ситуация, когда антиокисдантные системы не справляются с количеством АФК, а системы репарации не успевают восстанавливать повреждения. Это и приводит к развитию окислительного стресса, который может вызываться как сверхпродукцией АФК, так и уменьшением эффективности защитной системы. В клеточных компартментах повышается содержание пероксида водорода и наблюдаются характерные повреждения, в первую очередь мембран и фотосинтетического аппарата [25, 26].
Существуют симптомы и общепринятые тесты, характеризующие степень окислительного стресса в растениях. В физиологических исследованиях чаще всего используют биохимические тесты, так или иначе связанные с оценкой уровня окислительного стресса: например, оценка уровней содержания пролина и малонового диальдегида. Последний образуется в процессе перекисного окисления фосфолипидов клеточных мембран (ПОЛ) и основан на реакции с тиобарбитуровой кислотой, в которой возникает окрашенный комплекс.
Практически при всех абиотических стрессах, с которыми может столкнуться растение, отмечают интенсивное образование АФК в апопласте, митохондриях, пероксисомах. При повторном действии на растение стрессовых факторов количество АФК увеличивается во всех компартментах, и окислительный стресс охватывает всю клетку. В то же время на начальных этапах развития стресса иногда удается зафиксировать образование АФК, которое начинается в одном из компартментов [9]. Часто причиной развития окислительного стресса являются именно те факторы, которые провоцируют дисбаланс между поглощением световой энергии и возможностью ее реализации. В данном случае сверхпродукция АФК начинается в хлоропласте и лишь позднее охватывает всю клетку. Вследствие обусловленных АФК повреждений нарушается работа фотосинтетического аппарата, разрушается хлорофилл. Развитие окислительного стресса сопровождается прогрессивным накоплением пероксидов в хлоропластах, пероксисомах, митохондриях, а уж потом – в клетке в целом [27].
Окислительный стресс может возникнуть в листьях растений на фоне высокого содержания в почве ионов ТМ. Наиболее токсичными для растений являются ионы кадмия, цинка, меди, железа, никеля, свинца и др. [28]. В каком из компартментов сверхпродукция АФК начинается в первую очередь, сказать сложно. Причинами окислительного стресса в этом случае, по-видимому, является одновременное диффузное токсическое действие ионов на многие ферментные системы и мембраны, а также снижение эффективности антиоксидантных систем.
Молекулы липидов в целом и ненасыщенные жирные кислоты, в частности, чувствительны к окислению АФК, вырабатываемых в условиях стресса. Малоновый диальдегид (МДА) – цитотоксический продукт перекисного окисления липидов и индикатор производства свободных радикалов, которые вызывают повреждение тканей [29]. Таким образом, стабильность клеточных мембран становится показателем стрессового ответа. Следовательно, наличие повышенных уровней органических пероксидов обычно считается индикатором существенного окислительного стресса. Индукция оксидативных повреждений в растениях в условиях вызванного ТМ стресса подтверждена неоднократно [30, 31], также доказано и накопление АФК и повышенный уровень перекисного окисления липидов [32, 33]. Например, в одной из этих работ изучили несколько генотипов гороха, среди которых в наименее чувствительной к кадмию линии 3429 отмечены и меньшие уровни содержания органических пероксидов в корнях по сравнению с высокочувствительными линиями 4788 и 188. Можно полагать, что окислительный стресс, вызванный Cd, проявлялся в разной мере у различных генотипов этой культуры. В то же время наибольшее содержание МДА наблюдали в корнях генотипа 8456, хотя растения не проявляли признаков существенного угнетения, т.е. этот генотип проявлял высокую способность противостоять стрессу.
В работе [34] было обнаружено, что содержание МДА возрастало линейно по мере роста концентрации кадмия в питательном растворе. Аналогичные результаты получены с Spyrodela polyrhiza [35]. Таким образом, повышенный синтез МДА показывал развитие окислительного стресса, и последний может считаться одной из причин угнетения растительного организма в условиях избытка ионов металлов в среде [36]. Однако в работе [37] показано, что Al не может служить катализатором окисления, но в присутствии ионов Fe2+ и Fe3+ тоже включается в процесс ПОЛ. В исследовании [38] полагали, что возможной причиной отсутствия ПОЛ при ответе растений кукурузы на действие Fe2+ создались условия, при которых мембраны оказались недоступны для атаки H2O2.
В соответствие с уровнями условно-нормальных концентраций металлов, которые приведены для проростков различных растений в работе [39], 3 металла в исследовании [40] содержались в избыточных количествах в тканях Trifolium repens и Lolium perenne (Cd – от 0.59 до 24.4 мг/кг сухого вещества, Pb – 34.6–1140 и Zn – 61.6–1250). Избыточные количества этих металлов могли вызывать окислительный стресс, который можно оценить величиной содержания МДА и уровнем активности супероксиддисмутазы (SOD) [41]. При этом уровни содержания этих биологических маркеров могут варьировать так, что они могут давать противоположные результаты: низкий уровень синтеза МДА и высокий – активности SOD (и наоборот) в зависимости от вида растения или органа [42]. Вариации уровней перекисного окисления липидов и активности SOD показали, что вид L. perenne более чувствителен к действию металлов, чем T. repens. Поскольку АФК постоянно возникают в клетках в условиях аэробного метаболизма, то это предопределило параллельную с самими растениями эволюцию антиоксидантных систем. SOD обычно называют одним из главных компонентов этой системы. Однако следует учитывать, что в условиях тяжелого стресса могут возникать модификации и в самой структуре антиоксидантных ферментов, блокирующие их функционал [42]. Действительно, литературные данные свидетельствуют, что молекулы SOD не имеют какой-то специфической защиты от свободных радикалов, что может вести к ее полной или частичной инактивации [43]. По этой причине в растениях, произрастающих на загрязненных ТМ почвах, отмечено неуклонное уменьшение содержания SOD в тканях и органах, что вело к накоплению АФК и окислительному стрессу, проявлявшемуся частично через реакции ПОЛ [40]. В работе [44] сообщали об аналогичных отношениях между накоплением МДА и активностью SOD в проростках ячменя и других зерновых культур в условиях загрязнения кадмием. Однако стоит отметить, что в подобных исследованиях зачастую эксперименты проводили в теплицах при использовании гидропонной культуры или искусственных грунтов, а металлы вносили в виде солей, т.е. в легкодоступной для растений форме [45]. При этом хорошо известно, что растения по-разному реагируют на различные концентрации металлов и/или время и условия воздействия, как это показано на горохе (Pisum sativum) и пшенице (Triticum durum) [46]. Результаты, полученные в таких искусственных условиях, могут разнится с таковыми, когда речь идет о полевых условиях.
По существующему в настоящий момент мнению научного сообщества [47], свободный пролин накапливается в тканях большинства растений в ответ на широкий диапазон средовых стрессов, таких как водный дефицит, засоление, высокая или низкая температура, инфекции, недостаток кислорода и питательных веществ, загрязнение различными химическими агентами (в т.ч. ТМ), УФИ. Тем не менее, существуют некоторые сомнения в том, действительно ли повышенное содержание пролина в тканях играет адаптивную роль. Учитывая сложность всех метаболических процессов, обеспечивающих гомеостаз растительного организма, можно полагать, что в условиях стресса некоторые из них будут подвержены угнетению в большей степени, чем другие. Хотя во многих работах сообщали, что имеются положительные корреляции между содержанием пролина у различных сортов (линий) одного растения и их устойчивостью к стрессорам (например, засолению или избытку ионов металлов) [48], то другие исследователи не обнаружили такой связи и говорили о пролине, как о маркере сопротивляемости организма, без привязанности к видовой принадлежности [49].
Следует учитывать, что в условиях прогрессирующего загрязнения окружающей среды возрастает частота мутационных событий в природных и аграрных популяциях растений и возрастает их генетическая неоднородность. Дополнительно этому способствует и развитие генетической инженерии, которая тоже приводит к появлению у сельскохозяйственных растений ранее неизвестных и неисследованных генетических свойств. Соответственно возрастает интерес к пониманию механизмов адаптации растений к меняющимся условиям среды и ее негативным факторам, в частности, к роли пролина в стрессовом ответе. Например, имеются данные, что повышенный биосинтез пролина в растениях трансгенного табака позволяет легче переносить засоление почв [50]. Подобные наблюдения уверенно доказывают наличие причинно-следственной связи между содержанием пролина и устойчивостью к негативным условиям среды. Однако предварительные исследования растений, в тканях которых вырабатывается повышенное количество пролина, не всегда подтверждают это мнение [51]. Столь противоречивые данные наглядно показывают необходимость дополнительных исследований механизмов стрессового ответа, в которые вовлечен пролин. Внимательный анализ таких работ дает основание полагать, что было бы неправильно объяснять накопление пролина в условиях стресса строго биофизическими причинами, поскольку данная аминокислота обладает целым рядом иных биологических функций.
Однако несмотря на все эти ограничения, индукция накопления пролина в ответ на стрессы различной природы дает основания полагать, что имеется прямая связь между высоким содержанием пролина и устойчивостью растения к стрессу. Возможно, в целях увеличения устойчивости растений и их продуктивности было бы уместно создание таких трансгенных растений, у которых накопление пролина было бы искусственно усилено.
Главным образом протекторную роль пролина принято объяснять биофизическими эффектами, которые отмечают при повышении концентрации этой аминокислоты в цитозоле. Полагают, что пролин защищает ферменты [52], мембраны [53] и полисомы [54], которые могут пострадать в неблагоприятных условиях среды. В такой ситуации (накопление нежелательных ионов в клеточном соке) могут измениться физико-химические свойства цитоплазмы, что негативно отражается на функциях клетки. Убедительные доказательства прямой роли пролина в преодолении подобных эффектов были продемонстрированы на бактериях [55]. При введении им экзогенного пролина или при работе с мутантами, накапливающими пролин в повышенных количествах, обнаружили, что эти организмы оказались более устойчивыми [55]. При выращивании кукурузы на загрязненных почвах было показано, что поддержание нормальных осмотических свойств цитоплазмы клеток корней до 45% определяется действием пролина [56].
Помимо стабилизации клеточной структуры, пролин также может участвовать в обезвреживании свободных радикалов, служа их ловушкой (формируя долгоживущие и малоактивные радикалы после реакции с АФК, за счет чего последние обезвреживаются) [56]. Прогрессирующее накопление АФК в условиях стрессов различной природы способно приводить к накоплению пролина [57]. Окислительный стресс, вероятно, является результатом таких условий среды, при которых нарушается нормальный процесс рассеивания энергии, поглощенной различными молекулами под действием солнечного излучения. Механизм этого процесса состоит в том, что электроны, поглотив квант света, перескакивают на более высокую орбиталь, однако поскольку в силу законов термодинамики они не могут находиться в таком состоянии длительное время, эти частицы обязаны сбросить излишки энергии и вернуться в стабильное состояние. Это процесс может проходить различными путями, но в данном случае наибольшее значение имеет активация молекулы кислорода. Возбужденные электроны переходят на вакантную 2π-орбиталь молекулы кислорода, превращая его в один из радикалов – активную частицу с высокой энергией. Внешним проявлением этого процесса может служить сокращение ассимиляции углекислого газа при неблагоприятных для растения условиях. В этом случае хлоропласты накапливают избыточную энергию, которая по описанной выше схеме приводит к возникновению АФК (возбужденные электроны передаются не молекуле CO2, а O2) [57].
В этой связи можно отметить, что пролин приводит к усилению фотохимического транспорта электронов в изолированных тилакоидных мембранах Brassica juncea [58]. При введении в среду 1М пролина отмечено сокращение интенсивности ПОЛ, вызываемого интенсивным освещением, что дает основания полагать, что пролин обладает способностью инактивировать свободные радикалы [58]. В полном соответствии с этими данными находится исследование [59], в котором обнаружена позитивная корреляция целостности мембран хлоропластов с уровнем содержания пролина в растениях табака. Накопление пролина в растениях, облученных УФИ, также дало основания предполагать у этого соединения противорадикальную активность: введение 1М пролина препятствовало превращению линолевой кислоты в малоновый диальдегид (МДА) [60].
ЗАКЛЮЧЕНИЕ
Таким образом, анализ полученных экспериментальных данных показал, что на ранних этапах развития растений ячменя на дерново-подзолистой почве в изученном диапазоне концентраций свинца эффекты действия последнего выражены достаточно слабо. Особенно это касается внешнего вида растений. Из них более выраженными были эффекты воздействия свинца на площадь листьев и биомассу растений. При этом различия между контрастными по устойчивости к свинцу сортами ячменя по этим показателям не были значимыми. Только один сорт (Заря) по площади листьев превосходил остальные.
Показатели продуктивности растений ячменя (масса зерна и соломы) проявили похожие закономерности. В целом все изученные показатели менялись при действии свинца несущественно. Однако у устойчивых сортов было отмечено снижение урожайности по сравнению с чувствительными, в то время как масса соломы в целом была больше. Вероятно, это связано с тем, что благодаря большей устойчивости эти сорта способны накопить бóльшую биомассу, что связано с существенными расходами ресурсов и ведет к снижению урожая. Чувствительные сорта при такой дозе поллютанта показали сходный с контролем эффект. Надо полагать, что при более высокой концентрации свинца устойчивые сорта явно проявят свои преимущества, будучи способными успешно завершить жизненный цикл и дать урожай, в то время как чувствительные окажутся угнетенными, поскольку приспособленные к негативным факторам среды сорта растений лучше выживают в стрессовых условиях, но проигрывают обычным видам при благоприятных условиях. Полученные результаты отражают сложность процессов формирования урожая зерна по сравнению с формированием вегетативной массы, зависимость которой от концентрации свинца является практически линейной, что было выявлено в предшествующих исследованиях.
Обнаружено, что содержание МДА при действии свинца было меньше, чем в контроле, и, хотя значимых различий выявить не удалось, у устойчивых сортов его содержание было больше. Это могло быть связано с тем, что, во-первых, использованная концентрация свинца не вызывала острого стресса, во-вторых, защитные системы устойчивых сортов реагировали на наличие поллютанта в среде более активно, в-третьих, можно предположить, что ответ на действие свинца в данном случае связан с иными соединениями. Содержание свободного пролина, защитного антиоксидантного соединения, напротив, существенно реагировало на воздействие ТМ. Отмечено возрастание содержания пролина в растениях всех сортов, кроме сорта NSGL1. В целом у устойчивых сортов его содержание больше, что можно объяснить примерно так же, как и в случае с МДА. Однако у сорта Заветный оба эти показателя (особенно содержание пролина) были относительно высокими. Вероятно, данный сорт остается чувствительным в силу иных, не попавших в рассмотрение причин.
Исследование содержания пигментов фотосинтеза не показало существенных различий. Содержание всех 3-х пигментов не отличалось от контроля, и не было отмечено значимых различий между изученными сортами.
Учитывая, что в настоящей работе использована доза свинца, которая не вызывала серьезного угнетения жизненных процессов ячменя, становится понятным, почему в настоящем исследовании не удалось выявить значимых эффектов на морфологическом и биохимическом уровне организации и обнаружить различия между контрастными по устойчивости сортами ячменя. Поскольку растение в таких условиях функционирует относительно нормально, то не возникает необходимости в серьезной перестройке физиологических процессов и расхода ресурсов на преодоление стресса. Хотя у устойчивых сортов, обладающих специфическими особенностями, способствующими выживанию в негативных условиях среды, отметили некоторую реакцию на свинец. В данном случае она не являлась критичной для выживания, и, более того, привела к некоторому снижению продуктивности.
Список литературы
Алексахин Р.М., Фесенко С.В., Гераськин С.А. Методика оценки экологических последствий техногенного загрязнения агроэкосистем. М.: Изд-во МГУ, 2004. 206 с.
Николайкин Н.И., Николайкина Н.Е., Мелехова О.П. Экология. М.: Дрофа, 2004. 622 с.
Гуральчук Ж.З. Механизмы устойчивости растений к действию тяжелых металлов // Физиол. и биохим. культ. растений. 1994. Т. 26. № 2. С. 107–117.
Феник С.И., Трофимяк Т.Б., Блюм Я.Б. Механизмы формирования устойчивости растений к тяжелым металлам // Усп. совр. биол. 1995. Т. 115. № 3. С. 261–276.
Серегин И.В., Иванов В.Б. Физиологические аспекты токсического действия кадмия и свинца на высшие растения // Физиология растений. 2001. Т. 48. № 4. С. 606–630.
Мурзаева С.В. Эффекты тяжелых металлов на проростки пшеницы; активация антиоксидантных энзимов // Прикл. биохим. и микробиол. 2004. Т. 40. № 1. С. 114–119.
Muller L. Consequences of cadmium toxicity in rat hepathocytes: mitochondrial dysfunction and lipid peroxidation // Toxicology. 1986. V. 40. P. 285–292.
Farris M.W. Cadmium toxicity: unique cytoprotective properties of alpha tocopheryl succinate in hepathocytes // Toxicology. 1991. V. 69. P. 63–77.
Полесская О.Г. Растительная клетка и активные формы кислорода. М.: Университет, 2007. 139 с.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С., Гераськин С.А. Внутривидовой полиморфизм ярового ячменя (Hordeum vulgare L.) по устойчивости к действию свинца // Сел.-хоз. биол. 2014. № 5. С. 78–87.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С. Влияние нитрата свинца на морфологические и цитогенетические показатели растений ярового двурядного ячменя (Hordeum vulgare L.) // Агрохимия. 2014. № 7. С. 45–52.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С., Гераськин С.А. Исследование изозимного полиморфизма у сортов ярового ячменя (Hordeum vulgare L.), контрастных по устойчивости к свинцу // Сел.-хоз. биол. 2016. Т. 51. № 1. С. 89–99.
Журбицкий З.И. Теория и практика вегетационного метода. М.: Наука, 1968. 260 с.
Агрохимические методы исследования почв. М.: Наука, 1975. 656 с.
Дикарев В.Г., Гераськин С.А., Дикарев А.В., Дикарева Н.С. Сравнительный анализ эффективности использования интеркалярных и апикальных меристем ячменя для биоиндикации генотоксического действия свинца // Экол. генетика. 2018. Т. 16. № 3. С. 37–46.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. № 1. P. 189–198.
Bates L.S., Waldern R.P., Teare I.D. Rapid determination of free proline for water-stress studies // Plant and Soil. 1973. V. 39. № 1. P. 205–207.
Шевякова Н.И. Роль γ-аминомасляной кислоты, пролина, цистеина в нейтрализации вредных воздействий на растительный организм // Физиология растений. 1983. Т. 30. № 4. С. 768–783.
Бритиков Е.А. Биологическая роль пролина. М.: Колос, 1975. 124 с.
Кузнецов В.В., Шевякова Н.И. Пролин при стрессе: Биологическая роль, метаболизм, регуляция // Физиология растений. 1999. Т. 46. № 2. С. 321–336.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С. Исследование фитотоксичности свинца для растений редиса и салата при выращивании на разных типах почв // Агрохимия. 2019. № 3. С. 93–101.
Baker A.J.M., Grant C.J., Martin M.H., Shaw S.C., Whitebrook J. Induction and loss of cadmium tolerance in Holcus lanatus and other grasses // New Phytologist. 1986. V. 102. P. 575–587.
Baker A.J.M. Metal tolerance // New Phytol. 1987. V. 106. P. 93–111.
Barnatt J., Penny R. The lead legacy. London: Peak district national park authority, English heritage and English nature, 2004. 132 p.
Mittler R. Oxidative stress, antioxidants and stress tolerance // Trends Plant Sci. 2002. V. 7(9). P. 405–410.
Foyer C.H., Noctor G. Oxidant and antioxidant signaling in plants: a re-evaluation of the concept of oxidative stress in a physiologic context // Plant Cell Environ. 2005. V. 28. P. 1056–1071.
Alonso R., Elvira S., Castillo F.J., Gimeno B.S. Interactive effects of ozone and drought stress on pigments and activities of antioxidative enzymes in Pinus halepensis // Plant Cell Environ. 2001. V. 24. P. 905–916.
Foyer C.H., Teodolou F.L., Delrot S. The functions of inter and intracellular glutathione transport systems in plants // Trends Plant Sci. 2001. V. 6 (10). P. 486–492.
Wei X., Dunhai L., Guihua L. Antioxidative responses of Elodea nutallii (Planch.) H.S. John to short-term iron exposure // Plant Physiol. Biochem. 2010. V. 48. P. 873–878.
Dietz K.J., Baier M., Kramer U. Free radicals and reactive oxygen species as mediators of heavy metal toxicity in plants // Heavy metal stress in plants: from molecules to ecosystems / Eds. Prasad M.N.V., Hagemeyer J. Berlin, Heidelberg: Springer Verlag, 1999. P. 73–97.
Metwally A., Safronova V.I., Belimov A.A., Deitz K.-J. Genotypic variation of the response to cadmium toxicity in Pisum sativum L. // J. Exp. Bot. 2005. V. 56. P. 167–178.
Romero-Puertas M.C., McCarthy I., Sandalio L.M., Palma J.M., Corpas F.J., Gomez M., del Rio L.A. Cadmium toxicity and research oxidative metabolism of pea leaf peroxisomes // Free Radical. 1999. V. 31. P. 25–31.
Sandalio L.M., Dalurzo H.C., Gomez M., Romero-Puertas M.C., del Rio L.A. Cadmium-induced changes in the growth and oxidative metabolism of pea plants // J. Exp. Bot. 2001. V. 52. P. 2115–2126.
Parlak K.U., Yilmaz D.D. Ecophysiological tolerance of Lemna gibba L. exposed to cadmium // Ecotoxicol. Environ. Saf. 2013. V. 91. P. 79–85.
Upadhyay R., Panda S.K. Zinc reduces copper toxicity induced oxidative stress by promoting antioxidant defense in freshly grown aquatic duckweed Spirodela polyrhiza L. // J. Hazard. Mater. 2010. V. 15 (175). V. 1081–1084.
Gupta D.K., Nicoloso F.T., Schetinger M.R.C., Rossato L.V., Pereira L.B., Castro G.Y., Srivastava S., Tripathi R.D. Antioxidant defense mechanism in hydroponically grown Zea mays seedlings under moderate lead stress // J. Hazard. Mater. 2009. V. 172. P. 479–484.
Yamamoto Y., Kobayashi Y., Devi S.R., Rikiishi S., Matsumoto H. Aluminum toxicity is associated with mitochondrial dysfunction and the production of reactive oxygen species in plant cells // Plant Physiol. 2002. V. 128. P. 63–72.
Boscolo P.R.S., Menossi M., Jorge R.A. Aluminum induced oxidative stress in maize // Phytochemistry. 2003. V. 62. P. 181–189.
Kabata-Pendias A., Pendias H. Trace elements in soils and plants, 3rd ed. London, N.-Y., Washington, DC: CRC Press Inc, Boca Raton, 2001. P. 413.
Bidar G., Garcon G., Pruvot C., Dewaele D., Cazier F., Douay F., Shirali P. Behaviour of Trifolium repens and Lollium perenne growing in heavy metal contaminated field: plant metal concentration and phytotoxity // Environ. Pollut. 2007. V. 147. P. 546–553.
Reddy B.K., Kumar G.N.M., Jyothsnakumari G., Thimmanaik S., Sudhakar C. Lead induced changes in antioxidant metabolism of horsegram (Macrotyloma uniflorum (Lam.) Verdc.) and bengalgram (Cicer arietinum L.) // Chemosphere. 2005. V. 60. P. 97–104.
Schutzendubel A., Polle A. Plant responses to abiotic stresses: heavy metal-induced oxidative stress and protection by mycorrhization // J. Exp. Bot. 2002. V. 53 (372). P. 1351–1365.
Garcon G., Dagher Z., Zerimech F., Ledoux F., Courcot D., Aboukais A., Puskaric E., Shirali P. Dunkerque city air pollution particulate matter-induced cytotoxicity, oxidative stress and inflammation in human epithelial lung cells (L132) in culture in vitro // Toxicology. 2006. V. 39. P. 158–163.
Wu F., Zhang G., Dominy P. Four barley genotypes respond differently to cadmium: lipid peroxidation and activities of antioxidant capacity // Environ. Exp. Bot. 2003. V. 50. P. 67–78.
Verma S., Dubey R.S. Lead toxicity induces lipid peroxidation and alters the activities of antioxidant enzymes in growing rice plants // Plant Sci. 2003. V. 164. P. 645–655.
Milone M.T., Sgherri C., Clijsters H., Navari-Izzo F. Antioxidative responses and of wheat treated with realistic concentration of cadmium // Environ. Exp. Bot. 2003. V. 50 (3). P. 265–276.
Hare P.D., Cress W.A. Metabolic implications of stress-induced proline accumulation in plants // Plant Growth Regul. 1997. V. 21. P. 79–102.
O’Regan B.P., Cress W.A., van Staden J. Root growth, water stress, water relations, abscisic acid and proline levels of drought resistant and drought-sensitive maize cultivars in response to Cd // S. Afr. J. Bot. 1993. V. 59. P. 98–104.
Heuer B. Osmoregulatory role of proline in water and salt-stressed plants // Handbook of Plant and Crop Stress / Eds. Pessarakli M. N.Y.: Marcel Dekker, Inc., 1994. P. 363–381.
Kavi Kishor P.B., Hong Z., Miao G.-H., Hu C.-A.A., Verma D.P.S. Overexpression of Δ1-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants // Plant Physiol. 1995. V. 108. P. 1387–1394.
Blum A., Munns R., Passioura J.B., Turner N.C., Sharp R.E., Boyer J.S., Nguyen H.T., Hsiao T.C., Verma D.P.S., Hong Z. Genetically engineered plants resistant to soil drying and salt stress: How to interpret osmotic relations? // Plant Physiol. 1996. V. 110. P. 1051–1053.
Arakawa T., Timasheff S.N. The stabilisation of proteins by osmolytes // Biophys. J. 1985. V. 47. P. 411–414.
Rudolph A.S., Crowe J.H., Crowe L.M. Effects of three stabilising agents – proline, betaine and trehalose – on membrane phospholipids // Arch. Biochem. Biophys. 1986. V. 245. P. 134–143.
Kandpal R.P., Rao N.A. Alterations in the biosynthesis proline on protein biosynthesis of proteins and nucleic acids in finger millet (Eleucine coracana) seedlings during water stress // Plant Sci. 1985. V. 40. P. 73–79.
Delauney A.J., Verma D.P.S. Proline biosynthesis and osmoregulation in plants // Plant J. 1993. V. 4. P. 215–223.
Floyd R.A., Nagy Z.S. Formation of long-lived in a Fenton reaction. Hydroxyl free radical adducts of proline and hydroxyproline // Biochem. Biophys. Acta. 1984. V. 790. P. 94–97.
Smirnoff N., Cumbes Q.J. Hydroxyl radical scavenging activity of compatible solutes // Phytochemistry. 1989. V. 28. P. 1057–1060.
Alia P.S.P., Mohanty P. Proline enhances primary photochemical activities in isolated thylakoid membranes of Brassica juncea by arresting photoinhibitory damage // Biochem. Biophys. Res. Commun. 1991. V. 181. P. 1238–1244.
van Rensburg L., Kruger G.H.J., Kruger H. Proline in Nicotiana tabacum L. accumulation as drought tolerance selection criterion: Its relationship to membrane integrity and chloroplast ultrastructure // J. Plant Physiol. 1993. V. 141. P. 188–194.
Pardha S.P., Alia A.S., Prasad K.V.S.K. Proline accumulates in plants exposed to UV radiation and protects them against UV induced peroxidation // Biochem. Biophys. Res. Commun. 1995. V. 209. P. 1–5.
Дополнительные материалы отсутствуют.