Агрохимия, 2019, № 11, стр. 72-76
ТОКСИКОЛОГИЧЕСКОЕ ТЕСТИРОВАНИЕ ГОМОЗИГОТНЫХ И ДИГЕТЕРОЗИГОТНЫХ ПО ГЕНАМ РЕЗИСТЕНТНОСТИ К МАЛАТИОНУ И ФЕНПИРОКСИМАЙТУ ГЕНОТИПОВ ОБЫКНОВЕННОГО ПАУТИННОГО КЛЕЩА
Х. Г. И. Али 1, 3, О. В. Сундуков 2, *, Т. С. Астарханова 1
1 Российский университет дружбы народов, Аграрно-технологический институт
117198 Москва, ул. Миклухо-Маклая, 6, Россия
2 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург–Пушкин, ш. Подбельского, 3, Россия
3 Сохагский университет, факультет сельского хозяйства
82524 Сохаг, Египет
* E-mail: ldg@iczr.ru
Поступила в редакцию 25.11.2018
После доработки 18.02.2019
Принята к публикации 08.08.2019
Аннотация
Отселектированные дизруптивным отбором гомозиготные по генам резистентности к малатиону и к фенпироксимайту самки обыкновенного паутинного клеща были сопоставлены по уровню смертности при действии диагностических концентраций этих акарицидов с полученными при скрещивании дигетерозиготными самками. У гибридных самок признак резистентности к фенпироксимайту не проявлялся, а смертность их при действии малатиона увеличивалась в 2 раза по сравнению с гомозиготными самками. Эпистатическое взаимодействие генов резистентности проявлялось вследствие несовместимости детерминируемых ими биохимических процессов защиты от отравления к токсикантам различных химических классов.
ВВЕДЕНИЕ
Использование инсектоакарицидов различных химических классов в мероприятиях по предотвращению или задержке развития резистентности членистоногих приводит к появлению в их популяциях особей с совмещенными в геноме аллелями резистентности к применяемым токсикантам. По существующим представлениям такие членистоногие должны быть мультиустойчивыми к использовавшимся инсектоакарицидам. Результаты, полученные на гибридных генотипах обыкновенного паутинного клеща с генами резистентности к акарицидам 2-х различных химических классов, выявили диаметрально противоположную закономерность. Присутствующий в геноме клещей ген резистентности к токсиканту другого химического класса подавлял экспрессию гена резистентности к действующему акарициду [1]. Цель работы – выяснение характера эпистатического взаимодействия генов резистентности к малатиону (класс фосфорорганических соединений – ФОС) и к фенпироксимайту (класс ингибиторов митохондриального электронного транспорта – МЕТИ).
МЕТОДИКА ИССЛЕДОВАНИЯ
Линии обыкновенного паутинного клеща Tetranychus urticae Koch. были получены дизруптивным отбором по проявлению признака резистентности при обработках диагностическими концентрациями малатиона или фенпироксимайта. Клещей содержали посемейно на листовых плотиках фасоли, уложенных на мокрую вату.
При скрещивании клещей резистентных линий на отдельные листовые плотики помещали по одной готовой к линьке дейтонимфе и одного самца, которых выбирали из протестированных семей с наименьшим показателем смертности в них самок при действии диагностической концентрации селектирующего акарицида.
Диагностическими концентрациями (СК95 × 2 – для самок чувствительной линии клещей) малатиона и фенпироксимайта были водные растворы 0.05% д.в. карбофоса (50%-ный концентрат эмульсии (к.э.) и 0.005%-ный д.в. ортуса (5%-ный к.э.).
Токсикологическое тестирование проводили методом погружения кусочков листа фасоли с отсаженными на них самками клеща в раствор диагностической концентрации акарицида. Показатель смертности самок (в %) учитывали через 1 сут после обработки токсикантом. Токсичность оценивали по вычисленным величинам средних арифметических показателя смертности самок во всех семьях каждого из вариантов и коэффициенту вариаций этих величин по соответствующим формулам [2]. Графическое распределение семей по показателю смертности самок в них получали в вариантах тестирования с помощью компьютерной программы Microsoft@Excel 2016.
Проведенным дизруптивным отбором по наличию или отсутствию признака резистентности к малатиону и к фенпироксимайту линий обыкновенного паутинного клеща были выделены семьи с наименьшим показателем смертности при обработках диагностическими концентрациями селектирующих акарицидов. Средние арифметические показатели смертности, использованные для скрещивания самок из этих семей, представлены в табл. 1.
Таблица 1.
Показатель смертности гомозиготных по генам резистентности к малатиону и фенпироксимайту самок обыкновенного паутинного клеща от диагностических концентраций селектирующих акарицидов
| Линии паутинного клеща | Количество семей | Количество самок | Смертность самок ($\dot {x}$ ± Sp, %) | Коэффициент вариаций (ν, %) |
|---|---|---|---|---|
| R-малатион | 20 | 210 | 19.3 ± 2.7 | 14.0 ± 0.7 |
| R-фенпироксимайт | 13 | 135 | 35.5 ± 4.1 | 11.5 ± 0.7 |
Реципрокным скрещиванием самцов с дейтонимфами из этих семей было получено поколение дигетерозиготных клещей с совмещенными в геноме аллелями резистентности к малатиону и фенпироксимайту. Половину самок из каждой семьи этого поколения тестировали диагностической концентрацией малатиона, а другую половину – диагностической концентрацией фенпироксимайта.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
По сравнению с гомозиготными по генам резистентности родительскими самками показатель смертности гибридных клещей двукратно увеличивался при действии малатиона и более чем в 2 раза при действии фенпироксимайта (табл. 2).
Таблица 2.
Показатель смертности дигетерозиготных самок обыкновенного паутинного клеща поколения F1 от диагностических концентраций малатиона и фенпироксимайта
| Действующий токсикант | Вариант скрещивания | Количество семей | Количество самок | Смертность самок ($\dot {x}$ ± Sp, %) | Коэффициент вариаций (ν, %) |
|---|---|---|---|---|---|
| Малатион |  R-мал × R-мал ×  r-фен r-фен
|
40 | 410 | 38.9 ± 2.4 | 6.2 ± 0.2 |
 r-фен × r-фен ×  R-мал R-мал
|
35 | 350 | 39.4 ± 2.6 | 6.6 ± 0.3 | |
| Фенпироксимайт |  R-мал × R-мал ×  r-фен r-фен
|
40 | 400 | 81.2 ± 1.9 | 2.3 ± 0.1 |
 r-фен × r-фен ×  R-мал R-мал
|
35 | 350 | 78.6 ± 2.2 | 2.8 ± 0.1 |
Графический анализ распределения семей по уровням смертности в них самок показал, что наибольшее количество гибридных семей при обработке клещей диагностической концентрацией малатиона оказалось в интервале уровня смертности самок от 30 до 70% по сравнению со смертностью самок в родительских семьях – 20–40% (рис. 1).
Рис. 1.
Распределение семей по уровням смертности дигетерозиготных самок с генами резистентности к малатиону и к фенпироксимайту после обработки диагностической концентрацией малатиона (в скобках – количество взятых семей. То же на рис. 2).
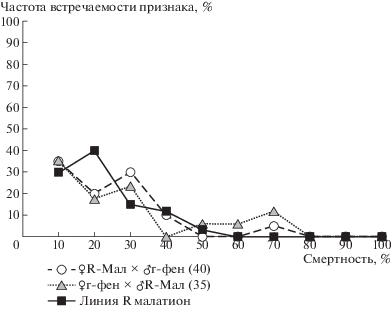
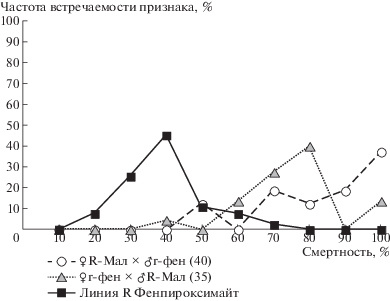
Более существенное изменение распределения гибридных семей в зависимости от уровня смертности самок происходило при действии на клещей диагностической концентрации фенпироксимайта. У дигетерозиготных самок во всех семьях не проявлялся признак резистентности к фенпироксимайту (рис. 2). Показатель смертности гибридных самок (табл. 2) был таким же, как и у клещей, полученных дизруптивным отбором чувствительной к фенпироксимайту линии [3].
Рис. 2.
Распределение семей по величине показателя смертности дигетерозиготных самок с генами резистентности к малатиону и к фенпироксимайту после обработки диагностической концентрацей фенпироксимайта.
Эпистатическое взаимодействие объединенных в геноме клещей аллелей резистентности к акарицидам различных химических классов происходит на этапе регуляции ими биохимических процессов, противодействующих развитию патогенеза отравления [4]. При индуцировании малатионом экспрессии гена резитентности к этому токсиканту происходит нормализация транспортных функций плазматической мембраны клеток с участием изозима карбоксилэстеразы, увеличенный синтез которого кодируется этим геном [5, 6].
Ген резистентности к фенпироксимайту активирует процессы электронного транспорта и окислительного фосфорилирования, происходящие на мембране митохондрий [7]. Осуществление этих процессов зависит от вариаций электролитного и органического состава цитоплазмы, регулируемого плазматической мембраной. Эта зависимость проявилась в экспериментах при сопоставлении перекрестной токсичности малатиона и фенпироксимайта для резистентных к этим акарицидам паутинных клещей [3].
Различия в детерминируемых генами резистентности к малатиону и фенпироксимайту биохимических процессах противодействия отравлению выявляются при сопоставлении синергистического действия бутифоса и пиперонилбутоксида (ППБ) на гомозиготных по генам резистентности к этим акарицидам самок паутинного клеща.
Бутифос является сильным ингибитором эстераз, включая и карбоксилэстеразный изозим, являющийся молекулярным маркером гена резистентности к малатиону. Добавка бутифоса в соотношении 1 : 1 к диагностической концентрации малатиона полностью подавляет защитный эффект гена резистентности к этому токсиканту. В 10 раз меньшая концентрация бутифоса в 2 раза увеличивала показатель смертности резистентных к малатиону самок паутинного клеща (табл. 3).
Таблица 3.
Токсическое действие диагностических концентраций малатиона и фенпироксимайта отдельно и вместе с бутифосом на гомозиготных самок обыкновенного паутинного клеща
| Действующий токсикант | R-линия | S-линия | ||||||
|---|---|---|---|---|---|---|---|---|
| количество | смертность ($\dot {x}$ ± Sp, %) | коэффициент вариации (ν, %) | количество | смертность ($\dot {x}$ ± Sp, %) | коэффициент вариации (ν, %) | |||
| семей | самок (n) | семей | самок (n) | |||||
| Малатион | 16 | 160 | 15.8 ± 2.9 | 14 | 140 | 98.6 ± 1.0 | 1.0 ± 0.1 | |
| Малатион + бутифос (1:1) | 16 | 170 | 100 | – | – | – | – | – |
| Малатион + бутифос (1:0.1) | 15 | 160 | 34.9 ± 3.7 | 10.6 ± 0.6 | – | – | – | – |
| Фенпироксимайт | 15 | 150 | 41.3 ± 4.0 | 9.7 ± 0.6 | 17 | 170 | 80.5 ± 3.0 | 3.8 ± 0.2 |
| Фенпироксимайт + бутифос (1:1) | 15 | 155 | 100 | – | 17 | 178 | 100 | – |
| Фенпироксимайт + бутифос (1:0.1) | 14 | 140 | 88.9 ± 2.6 | 2.9 ± 0.2 | 15 | 150 | 100 | – |
Зависимость происходящих на митохондриальной мембране биохимических процессов проявлялась при ингибировании бутифосом эстеразной активности на плазматической мембране клеток. Бутифос в соотношении 1 : 1 к диагностической концентрации фенпироксимайта снимал защитное действие гена резистентности к этому токсиканту, а 10-кратно меньшая его концентрация в 2 раза увеличивала смертность резистентных к фенпироксимайту клещей.
Пиперонилбутоксид считается специфическим ингибитором Р450- монооксигеназ, которые участвуют в конвейере окислительных реакций на митохондриальной мембране. Добавка этого синергиста в соотношении 1 : 1 к диагностической концентрации малатиона не оказывала никакого влияния на экспрессию гена резистентности к малатиону (табл. 4). В таком же соотношении к диагностической концентрации фенпироксимайта пиперонилбутоксид полностью подавлял защитные биохимические реакции от отравления, кодируемые геном резистентности к этому токсиканту.
Таблица 4.
Токсическое действие диагностических концентраций малатиона и фенпироксимайта отдельно и вместе с пиперонилбутоксидом (ППБ) в соотношении 1 : 1 на гомозиготных самок обыкновенного паутинного клеща
| Действующий токсикант | R-линия | S-линия | ||||||
|---|---|---|---|---|---|---|---|---|
| количество | смертность ($\dot {x}$ ± Sp, %) | коэффициент вариации (ν, %) | количество | смертность ($\dot {x}$ ± Sp, %) | коэффициент вариации (ν, %) | |||
| семей | самок (n) | семей | самок (n) | |||||
| Малатион | 16 | 166 | 21.5 ± 3.2 | 14.8 ± 0.8 | 19 | 192 | 97.4 ± 1.1 | 1.17 ± 0.6 |
| Малатион + ППБ | 18 | 200 | 25.8 ± 3.1 | 11.9 ± 0.6 | – | – | – | – |
| Фенпироксимайт | 13 | 140 | 23.3 ± 3.5 | 15.0 ± 0.9 | 16 | 160 | 91.4 ± 2.2 | 2.4 ± 0.1 |
| Фенпироксимайт + ППБ | 18 | 187 | 100 | – | – | – | – | – |
Эпистатический эффект взаимодействия объединенных в геноме членистоногих аллелей резистентности к 2-м разным по механизму действия инсектоакарицидам позволил в мероприятиях антирезистентной стратегии вместо постоянного обновления ассортимента применяемых химических соединений, количество которых к настоящему времени превышает уже 55 химических классов [8], использовать поочередно только 2 токсиканта. Образующиеся в популяции в абсолютном большинстве гетерозиготы по генам резистентности к этим инсектоакарицидам будут чувствительны к токсическому действию каждого из них при поочередном применении. Для подбора такой пары инсектоакарицидов необходимо знать биохимический механизм защитного эффекта, проявляемого генами резистентности к каждому из токсикантов. Исследованная в этом плане пара инсектоакарицидов – малатион и фенпироксимайт – не является оптимальным вариантом для такой комбинации, вследствие выраженных доминантно-рецессивных отношений в происходящих биохимических процессах, детерминируемых генами резистентности к ФОС и МЕТИ.
ЗАКЛЮЧЕНИЕ
Таким образом, последовательное применение против вредных членистоногих инсектоакарицидов различных химических классов не может приводить к появлению в их популяциях аддитивно мультиустойчивых к ним особей. Присутствие в геноме членистоногих аллелей резистентности к инсектоакарицидам 2-х различных химических классов препятствовало проявлению их экспрессии к каждому из токсикантов.
Список литературы
Сундуков О.В., Тулаева И.А., Зубанов Е.А. Эпистатическое взаимодействие генов резистентности к акарицидам у межлинейных гибридов обыкновенного паутинного клеща // Экол. генетика. 2016. Т. 14. № 4. С. 27–33.
Урбах В.Ю. Биометрические методы. М.: Наука, 1964. 415 с.
Али Х.Г.И., Сундуков О.В., Астарханова Т.С. Сопоставление признаков резистентности к малатиону и фенпироксимайту у отселектированных дизруптивным отбором генотипов обыкновенного паутинного клеща // Агрохимия. 2018. № 5. С. 45–53.
Сундуков О.В., Тулаева И.А., Зубанов Е.А. Физиологический механизм эпистатического взаимодействия генов резистентности к инсектоакарицидам различных химических классов у межлинейных гибридов обыкновенного паутинного клеща // Экол. генетика. 2017. Т. 15. № 2. С. 21–27.
Bass Ch., Field L.M. Gene amplification and insecticide resistance // Pest. Manag. Sci. 2011. V. 67. № 8. P. 886–890.
Devorshak C., Roe R.M. The role of esterases in insecticide resistance // Rev. Toxicol. 1998. V. 2. P. 501–537.
Lümmen P. Mitochondrial electron transport complexes as biochemical target sites for insecticides and acaricides // Insecticide design using advanced technologies. Berlin–Heidelberg: Springer-Verlag, 2007. P. 197–215.
Sparks T.C., Nauen R. IRAC: Mode of action, classification and insecticide resistance management // Pest Biochem. Physiol. 2015. V. 121. P. 122–128.
Дополнительные материалы отсутствуют.


