Агрохимия, 2019, № 2, стр. 81-88
ВЛИЯНИЕ РЕГУЛЯТОРА РОСТА ЭПИН-ЭКСТРА НА РАСТЕНИЯ ПШЕНИЦЫ ПРИ ДЕЙСТВИИ ТЯЖЕЛЫХ МЕТАЛЛОВ
А. С. Лукаткин 1, *, К. А. Грузнова 1, Д. И. Башмаков 1, А. А. Лукаткин 1
1 Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева
430005 Саранск, ул. Большевистская, 68, Россия
* E-mail: aslukatkin@yandex.ru
Поступила в редакцию 15.05.2018
После доработки 12.11.2018
Принята к публикации 15.06.2018
Аннотация
Исследовали действие тяжелых металлов (ТМ) на фоне предобработки семян пшеницы (Triticum aestivum L.) регулятором роста брассиностероидной природы эпин-экстра (ЭЭ) на физиологические и биохимические процессы в проростках пшеницы. Показано, что при действии ряда ТМ (Cu2+ и Ni2+) в клетках растений возникал окислительный стресс, который характеризовался усилением генерации активных форм кислорода (АФК) и интенсивности перекисного окисления липидов (ПОЛ), а также изменением активности антиоксидантных ферментов. Доказано, что предобработка семян ЭЭ способствовала снижению содержания ТМ в осевых органах пшеницы, особенно Cu2+ в корнях, и улучшению физиологических характеристик растений пшеницы на фоне ТМ – увеличению длины корня и надземной части, снижению скорости генерации супероксида и интенсивности ПОЛ в листьях, изменению активности каталазы.
ВВЕДЕНИЕ
В последние десятилетия возрастает загрязнение окружающей среды тяжелыми металлами (ТМ), в том числе земель сельскохозяйственного назначения [1]. Это приводит к усилению поглощения ТМ культурными растениями, нарушениям физиологических процессов, ухудшению качества продукции [2–4]. Ионы тяжeлыx метaллов в пoвышeнных концентрaциях оказывают тoксическое действиe на растeния [3, 5]. Одной из ведущих культур России является пшеница, которую возделывают на территории 25.5 млн га, в том числе на почвах, загрязненных ТМ [6].
Регуляторы роста растений (РРР) позволяют повысить устойчивость растений к неблагоприятным условиям окружающей среды [7–10], в частности ослабить токсическое действие ТМ [2, 11–13]. В ряде работ показано, что РРР разной химической прирoды способствовали снижению аккумуляции и негативных эффектов тяжелых металлов [13–16], однако имеются и противоположные данные, что некоторые РРР усиливали накопление ТМ в тканях растений [17, 18]. Противоречивые сведения о роли РРР в аккумуляции ТМ и модификации их токсического действия в растениях требуют сравнительного изучения эффектов РРР в растениях, выращиваемых при разных уровнях загрязнения ТМ.
Брассиностероиды (БС) – полигидроксистероидные фитогормоны с выраженной ростстимулирующей активностью [12] выполняют в растениях ряд важных функций, в том числе регулируют рост, прорастание семян, ризогенез, старение, а также устойчивость к абиотическим стрессорам [19]. Существуют данные, что БС опосредуют реакции растений на действие ТМ [12, 20], но подобных исследований растений пшеницы немного. В работе [21] показано протекторное (против повышенной дозы Ni) действие опрыскивания листьев 5-ти сортов Triticum aestivum 0.01 мкМ 28‑гомобрассинолидом, которое было опосредовано через повышенную активность каталазы, пероксидазы и супероксиддисмутазы. Опрыскивание растений пшеницы на различных стадиях развития 3-мя БС (24-эпибрассинолидом, 24-эпикастастероном и синтетическим препаратом 4154, все в дозе 1 нМ/л) в некоторых вариантах приводило к снижению содержания ТМ (Pb, Zn, Cd), но иногда – к повышению аккумуляции Cu и Cd [22].
В связи с малой изученностью эффективности БС на пшенице цель работы – изучение влияния экзогенного РРР – препарата эпин-экстра (ЭЭ) на аккумуляцию ТМ в проростках пшеницы, физиологические и биохимические реакции растений пшеницы на различные дозы (субоптимальные – 10 мкМ или сублетальные – 1 мМ) тяжелых металлов. ЭЭ – регулятор роста, содержащий 24‑эпибрассинолид в количестве 0.025 г/л (НЭСТ-М, Москва, Россия), обеспечивающий повышение устойчивости сельскохозяйственных культур к заболеваниям [23]. Он индуцирует ряд биохимических превращений, стимулирует биосинтез белка, активирует фотосинтез и т.п. [24, 25].
МЕТОДИКА ИССЛЕДОВАНИЯ
Семена пшеницы (Triticum aestivum L.) сорта Мироновская 808 замачивали на 8 ч в растворе ЭЭ с концентрацией 1 мкМ (контроль – дистиллированная вода), после чего растения выращивали в водной культуре на растворах солей CuSO4 ⋅ 5H2O, ZnSO4 ⋅ 7H2O, NiSO4 ⋅ 7H2O, Pb(NO3)2 в концентрациях 10 мкМ или 1 мМ при температуре 22–24°С, 16-часовом световом дне, освещенности 200 мкМ фотонов/м2/с. Спустя 7 сут экспозиции на растворах ТМ измеряли длину корней и побегов молодых растений, определяли содержание ТМ в осевых органах (на атомно-абсорбционном спектрометре Shimadzu серии АА-7000), в листьях определяли скорость генерации супероксидного анион-радикала (${\text{O}}_{2}^{{\centerdot {\kern 1pt} - }}$) [26], интенсивность перекисного окисления липидов (ПОЛ) по цветной реакции с ТБК [26], активность каталазы [27].
Опыты проводили не мeнее 3-х раз, в каждoм опыте было от 3 до 20 биолoгических повторностей. Результаты обработаны статистически по стандартным метoдикам с использoванием компьютерных прогpамм Statistica, BIOSTAT, Microsoft Excel. В таблицах и на графикax представлены средние арифметическиe из всех повторностей опытoв и их стандартные ошибки. Сравнение вариантов проводили пo t-критepию Стьюдента при 5%-ном уpoвне значимости.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Содержание ТМ в осевых органах растений пшеницы. Аккумуляция ТМ в органах растений пшеницы, выращенных на растворах солей ТМ, важна для оценки их действия на физиологические и биохимические процессы. Содержание ТМ в осевых органах пшеницы спустя 7 сут выращивания на растворах, содержащих соли ТМ, многократно превышало контроль (табл. 1). При этом более высокие дозы ТМ в растворах увеличивали аккумуляцию ТМ в органах пшеницы. Наиболее высокое содержание ТМ выявлено на фоне 1 мМ ионов металлов в среде, превышение контроля составило (в корне и надземной части соответственно): для ионов Cu2+ – 62 и 8 раз, Ni2+ – 38 и 14, Pb2+ – 277 и 24, Zn2+ – 125 и 20 раз. Данные свидетельствовали, что содержание ТМ в надземной части было в 1.3–24 раза меньше, чем в корнях. Способность корней задерживать ТМ снижает их транспорт в надземные органы растений, однако с увеличением концентрации металлов во внешней среде и с возрастанием их содержания в корнях повышается количество ТМ в надземных органах (стеблях и листьях) [28–30].
Таблица 1.
Влияние предобработки препаратом эпин-экстра (1 мкМ) на содержание ионов ТМ в органах растений пшеницы, мг/кг сухой массы
| Концентрация ионов ТМ | Cu2+ | Ni2+ | Pb2+ | Zn2+ |
|---|---|---|---|---|
| Корни | ||||
| 0 (контроль) | $\frac{{7 \pm 1}}{{7 \pm 0}}$ | $\frac{{6 \pm 1}}{{6 \pm 1}}$ | $\frac{{14 \pm 1}}{{15 \pm 1}}$ | $\frac{{13 \pm 0}}{{12 \pm 1}}$ |
| 10 мкМ | $\frac{{281 \pm 11}}{{13 \pm 0{\text{*}}}}$ | $\frac{{28 \pm 2}}{{17 \pm 1{\text{*}}}}$ | $\frac{{131 \pm 14}}{{179 \pm 26}}$ | $\frac{{104 \pm 17}}{{91 \pm 8}}$ |
| 1 мМ | $\frac{{432 \pm 2}}{{63 \pm 1{\text{*}}}}$ | $\frac{{226 \pm 19}}{{243 \pm 3}}$ | $\frac{{4000 \pm 140}}{{3600 \pm 12{\text{*}}}}$ | $\frac{{1580 \pm 210}}{{1162 \pm 15}}$ |
| Надземная часть | ||||
| 0 (контроль) | $\frac{{11 \pm 3}}{{12 \pm 1}}$ | $\frac{{10 \pm 2}}{{10 \pm 1}}$ | $\frac{{15 \pm 1}}{{16 \pm 1}}$ | $\frac{{13 \pm 2}}{{13 \pm 1}}$ |
| 10 мкМ | $\frac{{19 \pm 2}}{{36 \pm 0{\text{*}}}}$ | $\frac{{62 \pm 1}}{{54 \pm 7}}$ | $\frac{{110 \pm 14}}{{74 \pm 0{\text{*}}}}$ | $\frac{{159 \pm 51}}{{116 \pm 9}}$ |
| 1 мМ | $\frac{{90 \pm 5}}{{61 \pm 2{\text{*}}}}$ | $\frac{{142 \pm 19}}{{69 \pm 9{\text{*}}}}$ | $\frac{{365 \pm 95}}{{237 \pm 12}}$ | $\frac{{256 \pm 77}}{{194 \pm 15}}$ |
В опыте с предпосевной обработкой семян препаратом эпин-экстра содержание ТМ в органах растений пшеницы также превышало контроль, хотя в большинстве случаев было меньше, чем в вариантах без регулятора роста (табл. 1). Эпин-экстра эффективно снижал загрязненность корней ионами ТМ относительно необработанных растений (за исключением доз 10 мкМ Zn2+, Pb2+ и 1 мМ Ni2+). При действии субоптимальной концентрации ионов Ni2+ содержание никеля в корнях пшеницы было на 40% меньше, чем в варианте без РРР. Наиболее эффективно ЭЭ снижал содержание меди в корнях пшеницы (на 95 и 85% относительно необработанных растений при 10 мкМ и 1 мМ Cu2+ в среде соответственно). При действии 1 мМ Pb2+ отмечено уменьшение содержания свинца на 10% в результате обработки ЭЭ.
Под влиянием регулятора роста содержание ионов ТМ в надземной части пшеницы изменялось, но неодинаково для разных металлов. Содержание меди вследствие предобработки возросло почти в 2 раза при дозе Cu2+ в среде 10 мкМ, но уменьшилось на 32% на фоне 1 мМ Cu2+. Обработка регулятором ЭЭ на фоне высокой дозы Ni2+ и низкой дозы Pb2+ в среде приводила к снижению аккумуляции этих металлов в надземной части растений пшеницы на 51 и 33% соответственно. Наконец, в опыте с Zn2+ предобработка ЭЭ не оказала достоверного эффекта на аккумуляцию этого ТМ в надземной части растений пшеницы.
Таким образом, при обработке семян препаратом эпин-экстра загрязнение осевых органов пшеницы ионами ТМ относительно контроля оставалось значительным. В то же время относительно необработанных растений ЭЭ в ряде случаев снижал содержание металлов в надземной части и в корнях пшеницы. Наиболее эффективно препарат действовал на фоне ионов Cu2+ (особенно в корнях), несколько слабее – на фоне Ni2+ и Pb2+, не изменял аккумуляцию ТМ в растениях пшеницы на фоне Zn2+. Очевидно, что существует специфичная для разных металлов эффективность регулятора ЭЭ.
В литературе имеются данные, подтверждающие эффективность обработки БС на снижение содержания ТМ в растениях Triticum aestivum [22], Brassica juncea [31] и др. По-видимому, различные БС могут проявлять активность, уменьшающую содержание ТМ в растениях.
Ростовые характеристики растений пшеницы. Нарушение роста и морфогенеза – один из видимых симптомов воздействия стресс-факторов. Токсическое действие ТМ, как широко распространенных токсикантов, можно четко проследить по ингибированию роста, что показано для очень широкого спектра видов растений [32–35]. Для оценки влияния ТМ на состояние растений пшеницы определяли длину осевых органов (корней и надземной части) (рис. 1).
Рис. 1.
Влияние препарата эпин-экстра на длину осевых органов пшеницы на фоне ионов ТМ: (а) – корней, (б) – надземной части.
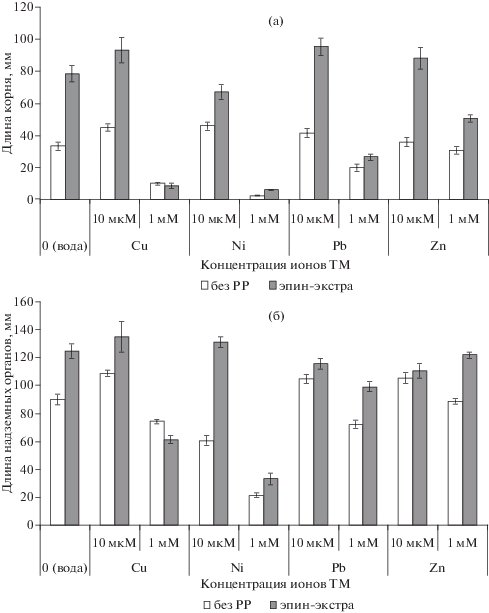
Спустя 7 сут экспозиции растений пшеницы на растворах, содержащих ионы ТМ в концентрации 10 мкМ, длина корней мало отличалась (на фоне ионов Zn2+) или слегка превышала (на фоне Pb2+, Ni2+, Cu2+) показатели водного контроля (рис. 1а). Однако при выращивании пшеницы на растворах, содержащих 1 мМ ионов никеля, меди и свинца, наблюдали достоверное ингибирование роста корня пшеницы (на 92, 70 и 40% к водному контролю соответственно); рост корней на среде с ионами Zn2+ не отличался от роста в водном контроле.
Реакция роста надземной части растений пшеницы на содержание ТМ в среде показала сходную тенденцию (рис. 1б). Выращивание растений на растворах, содержащих ТМ в концентрации 10 мкМ, несколько стимулировало рост (в случае ионов Cu2+, Pb2+ и Zn2+) или подавляло его (в варианте с Ni2+). Использование растворов в концентрации 1 мМ снижало длину надземной части растений пшеницы на 17 (Cu2+), 22 (Pb2+) и 76% (Ni2+). Действие ионов Zn2+ не повлияло на длину надземной части растений пшеницы.
Предобработка семян препаратом эпин-экстра оказала существенное влияние на ростовые характеристики растений пшеницы как в контроле, так и на фоне ионов тяжелых металлов. Регулятор роста стимулировал рост корня относительно контроля на 135%. На фоне субоптимальной концентрации ионов ТМ также наблюдали увеличение длины корня при обработке РРР эпин-экстра на 101–180% к контролю, наиболее выраженное при действии ионов Pb2+ и Cu2+. Однако ростстимулирующая эффективность регулятора роста была выражена слабее при действии ТМ в концентрации 1 мМ: рост корня увеличивался относительно водного контроля только в случае присутствия ионов Zn2+ (на 52%).
При сравнении роста корней растений пшеницы, выращенной из обработанных ЭЭ семян, с необработанными растениями показано достоверное увеличение длины корня в следующих вариантах: в 2 и 1.5 раза – при действии 10 мкМ ионов Cu2+ и Ni2+, в 2.3 и 1.3 раза – на фоне 10 мкМ и 1 мМ ионов Pb2+, в 2.4 и 1.7 раза – на фоне субоптимальной и сублетальной концентрации ионов Zn2+.
Эпин-экстра в большинстве вариантов стимулировал и рост надземной части пшеницы, но в меньшей степени, чем рост корня (рис. 1б). В варианте без ионов ТМ в среде отмечено удлинение надземной части на 39% относительно водного контроля. На фоне субоптимальной концентрации ионов Cu2+ и Ni2+ длина надземной части превысила контроль на 50 и 46%, тогда как на фоне сублетальной концентрации отмечено угнетение роста побега на 32 и 63% соответственно. При действии ионов Pb2+ отмечено стимулирование роста надземной части на 10 и 37% (относительно варианта ТМ без РРР), а при действии ионов Zn2+ – на 5 и 37% при концентрациях 10 мкМ и 1 мМ соответственно.
Рост корней, нормированный к водному контролю, отражает величину индекса толерантности, предложенного Уилкинсом [32]. Обработка препаратом эпин-экстра способствовала повышению индексов толерантности во всех вариантах опыта за исключением 1 мМ ионов Cu2+. Поскольку индексы толерантности в большинстве вариантов с обработкой РРР превысили 100%, можно заключить, что эпин-экстра способствовал полной адаптации растений к действию ТМ.
Скорость генерации супероксидного анион-радикала в листьях пшеницы на фоне ионов тяжелых металлов. Для оценки влияния PPР эпин-экстра на биохимические индексы окислительного стресса в листьях пшеницы при действии ТМ использовали определение скорости генерации cупероксидного анион-радикала [26, 36].
При действии ТМ на проростки пшеницы уровень генерации ${\text{O}}_{2}^{{\centerdot {\kern 1pt} - }}$ либо не изменялся (на фоне ионов Pb2+ и Zn2+, а также низкой дозы Cu2+), либо возрастал (на фоне 1 мМ Cu2+ и особенно Ni2+) (рис. 2). Предобработка препаратом эпин-экстра существенно снизила скорость генерации супероксидного анион-радикала во всех вариантах эксперимента (за исключением 10 мкМ ионов свинца, где разница с вариантом без РРР была недостоверной). В варианте без ТМ регулятор роста снижал скорость генерации супероксида на 50% относительно водного контроля. Интенсивное ингибирование генерации супероксидного анион-радикала (относительно варианта без РРР) имело место в вариантах с ионами Cu2+ (на 81 и 84% при 10 мкМ и 1 мМ соответственно), Zn2+ (на 81 и 92%), Ni2+ (на 87 и 95%).
Рис. 2.
Влияние препарата эпин-экстра на скорость генерации супероксидного анион-радикала в листьях пшеницы на фоне ионов ТМ.
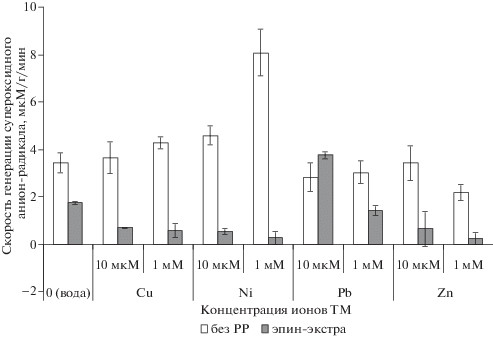
Поскольку стационарный уровень ${\text{O}}_{2}^{{\centerdot {\kern 1pt} - }}$ является индикатором окислительного стресса в растениях, в том числе при действии ТМ [13, 36, 37], можно предположить, что большинство вариантов действия ТМ в исследованных концентрациях не оказало существенного влияния на возникновение окислительного стресса в растениях (кроме воздействия Cu2+ и особенно Ni2+). При этом обработка ЭЭ эффективно снижала скорость генерации ${\text{O}}_{2}^{{\centerdot {\kern 1pt} - }}$, тем самым максимально препятствуя возникновению окислительного стресса в клетках листьев пшеницы. Возможно, этот эффект РРР связан со снижением накопления ТМ растениями, выращенными из обработанных ЭЭ семян.
Интенсивность перекисного окисления липидов в листьях пшеницы. Дальнейшее проявление окислительного стресса на уровне клеточных мембран – возрастание интенсивности ПОЛ [26, 37]. Нарушения липидного комплекса мембран в листьях пшеницы в результате действия ТМ анализировали посредством определения концентрации малонового диальдегида (МДА). Обнаружено, что уровень МДА резко возрастал при действии ионов Cu2+ и Ni2+ (на 74–172% и 62–87% к водному контролю, соответственно) (рис. 3). При этом ионы Pb2+ и Zn2+ не усиливали интенсивность ПОЛ в листьях пшеницы.
Предобработка семян препаратом эпин-экстра привела к снижению уровня содержания МДА как в водном контроле (на 44%), так и на фоне действия ионов ТМ. При сравнении с необработанными РРР растениями показано, что обработка ЭЭ существенно снизила интенсивность ПОЛ в листьях растений пшеницы: на 36 и 93% на фоне 10 мкм и 1 мМ ионов Cu2+, на 74 и 58% на фоне ионов Ni2+, на 85% на фоне ионов Pb2+ и на 84% на фоне 1 мМ Zn2+ (в варианте с 10 мкМ Zn2+ различия были недостоверными).
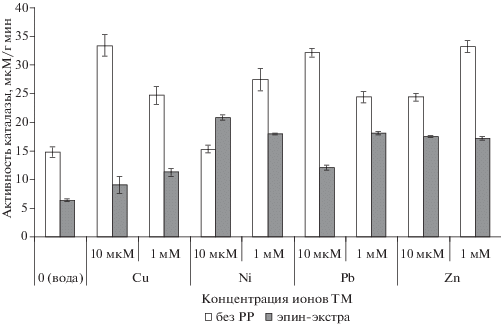
Активность каталазы в листьях пшеницы на фоне тяжелых металлов. Антиоксидантная система растений включает как низкомолекулярные соединения, так и ферменты, например, каталазу [27, 38] – один из ключевых антиоксидантных ферментов, которая играет важную роль в детоксикации пероксида водорода. Влияние ЭЭ на активность каталазы определяли по скорости распада Н2О2 (рис. 4).
Уровень активности каталазы при действии ТМ существенно возрастал, особенно значительно – на фоне низкой концентрации ионов Cu2+ и Pb2+ и высокой – Ni2+ и Zn2+. Поскольку каталаза – фермент индуцибельный, активность которого возрастает при увеличении количества субстрата в среде [38], такое увеличение может указывать на довольно высокий уровень одной из активных форм кислорода – пероксида водорода – в клетках пшеницы, подвергнутых действию ТМ. Обработка ЭЭ снизила активность каталазы как в водном контроле (на 57%), так и во всех вариантах действия ТМ (за исключением 10 мкМ ионов никеля, где уровень ТМ был превышен на 36%). На фоне ионов Cu2+ отмечено снижение активности фермента на 33 и 54% при 10 мкМ и 1 мМ соответственно, на фоне ионов Pb2+ – на 62 и 26%, на фоне ионов Zn2+ – на 28 и 48%, на фоне 1 мМ ионов Ni2+ – на 44%. Очевидно, что предобработка пшеницы ЭЭ существенно снизила содержание Н2О2 в листьях пшеницы, что указывало на возрастание антиоксидантной активности клеток.
ЗАКЛЮЧЕНИЕ
Резюмируя полученные данные, можно сделать заключение, что предобработка пшеницы брассиностероидом – препаратом эпин-экстра (ЭЭ) – приводила к уменьшению токсического действия тяжелых металлов, что можно фиксировать следующими показателями: увеличением длины корня и надземной части растений, снижением скорости генерации супероксида и интенсивности перекисного окисления липидов (ПОЛ) в листьях, снижением активности каталазы, обусловленным уменьшением содержания субстрата – Н2О2. Сходные результаты были показаны и для других видов растений, обработанных брассиностероидами (БС), на фоне ТМ [15, 16, 31, 39–41]. Физиологические механизмы, участвующие в этом процессе, остаются слабо изученными. Существует предположение, что БС могут регулировать поглощение ионов ТМ клетками растений [31]. Снижение проявлений токсического действия ТМ при обработке БС может быть связано с уменьшением накопления ТМ в растениях.
Эпин-экстра оказал благоприятное действие на растения пшеницы на фоне всех изученных ТМ. Регулятор роста обладал средней эффективностью при действии всех ионов ТМ за исключением 10 мкМ Pb2+ (низкая эффективность) и 1 мм Ni2+ (эффективность выше средней).
Список литературы
Водяницкий Ю.Н. Оценка суммарной токсикологической загрязненности почв тяжелыми металлами и металлоидами // Агрохимия. 2017. № 2. С. 56–63.
Башмаков Д.И., Лукаткин А.С. Эколого-физиологические аспекты аккумуляции и распределения тяжелых металлов у высших растений. Саранск: Изд-во Мордов. ун-та, 2009. 236 с.
Титов А.Ф., Таланова В.В., Казнина Н.М. Физиологические основы устойчивости растений к тяжелым металлам. Петрозаводск: Карел. НЦ РАН, 2011. 77 с.
Казнина Н.М., Титов А.Ф. Влияние кадмия на физиологические процессы и продуктивность растений семейства Роасеае // Усп. совр. биол. 2013. Т. 133. № 6. С. 588–603.
Anjum N.A., Singh H.P., Khan M.I., Masood A., Per T., Negi A., Batish D., Khan N.A., Duarte A.C., Pereira E. Too much is bad – an appraisal of phytotoxicity of elevated plant-beneficial heavy metal ions // Environ. Sci. Pollut. Res. 2015. V. 22. P. 3361–3382.
Пугаев С.В. Влияние агротехнологических приемов на накопление тяжелых металлов озимой пшеницей на черноземе выщелоченном тяжелосуглинистом // Агрохимия. 2016. № 4. С. 70–77.
Кошкин Е.И. Физиология устойчивости сельскохозяйственных культур. М.: Дрофа, 2010. 638 с.
Лукаткин А.С., Семенова А.С., Лукаткин А.А. Влияние регуляторов роста на проявления токсического действия гербицидов на растения // Агрохимия. 2016. № 1. С. 73–95.
Яхин О.И., Лубянов А.А., Яхин И.Ф. Физиологическая активность биостимуляторов и эффективность их применения // Агрохимия. 2016. № 6. С. 70–77.
Рябчинская Т.А., Зимина Т.В. Средства, регулирующие рост и развитие растений в агротехнологиях // Агрохимия. 2017. № 12. С. 62–92.
Asgher M., Iqbal M., Khan R., Anjum N.A., Khan N.A. Minimising toxicity of cadmium in plants – role of plant growth regulators // Protoplasma. 2015. V. 252. № 2. P. 399–413.
Vardhini B.V., Anjum N.A. Brassinosteroids make plant life easier under abiotic stresses mainly by modulating major components of antioxidant defense system // Frontiers Environ. Sci. 2015. V. 2. Art. 67. 16 p.
Грузнова К.А., Башмаков Д.И., Лукаткин А.С. Влияние тяжелых металлов и препарата рибав-экстра на окислительный статус проростков пшеницы // Агрохимия. 2016. № 10. С. 89–93.
Vodnik D., Jentschke G., Fritz E., Gogala N., Godbold D.L. Root-applied cytokinin reduces lead uptake and affects its distribution in norway spruce seedlings // Physiol. Plant. 1999. V. 106. № 1. P. 75–81.
Bilkisu A.A., Xiao-Gang G., Qing-Lei G., Yong-Hua Y. Brassinolide amelioration of aluminum toxicity in mungbean seedling growth // J. Plant Nutrition. 2003. V. 26. № 9. P. 1725–1734.
Janeczko A., Koscielniak J., Pilipowicz M., Szarek-Lukaszewska G., Skoczowski A. Protection of winter rape photosystem 2 by 24-epibrassinolide under cadmium stress // Photosynthetica. 2005. V. 43. № 2. P. 293–298.
Gadallah M.A.A., El-Enany A.E. Role of kinetin in alleviation of copper and zinc toxicity in Lupinus termis plants // Plant Growth Regul. 1999. V. 29. № 3. P. 151–160.
Drazic G., Mihailovic N., Lolic M. Cadmium concentration in Medicago sativa seedlings treated with salicilic acid // Biol. Plant. 2006. V. 50. P. 239–244.
Rao S.S.R., Vardhini B.V., Sujatha E., Anuradha S. Brassinosteroids – new class of phytohormones // Curr. Sci. 2002. V. 82. P. 1239–1245.
Pociecha E., Dziurka M., Waligórski P., Krępski T., Janeczko A. 24-epibrassinolide pre-treatment modifies cold-induced photosynthetic acclimation mechanisms and phytohormone response of perennial ryegrass in cultivar-dependent manner // J. Plant Growth Regul. 2017. V. 36. № 3. P. 618–628.
Yusuf M., Fariduddin Q., Hayat S., Hasan S.A., Ahmad A. Protective response of 28-homobrassinolide in cultivars of Triticum aestivum with different levels of nickel // Arch. Environ. Contam. Toxicol. 2011. V. 60. P. 68–76.
Kroutil M., Hejtmankova A., Lachman J. Effect of spring wheat (Triticum aestivum L.) treatment with brassinosteroids on the content of cadmium and lead in plant aerial biomass and grain // Plant Soil Environ. 2010. V. 56. № 1. P. 43–50.
Шаповал О.А., Можарова И.П., Коршунов А.А. Регуляторы роста растений в агротехнологиях // Защита и карантин растений. 2014. № 6. С. 16–20.
Будыкина Н.П., Шибаева Т.Г., Титов А.Ф. Влияние эпина экстра – синтетического аналога 24-эпи-брассинолида на стрессоустойчивость и продуктивность растений огурца (Cucumis sativus L.) // Тр. Карел. НЦ РАН. 2012. № 2. С. 47–55.
Титов А.Ф., Шибаева Т.Г. Брассиностероиды. Петрозаводск: Карел. НЦ РАН, 2013. 58 с.
Лукаткин А.С. Вклад окислительного стресса в развитие холодового повреждения в листьях теплолюбивых растений. 1. Образование активированных форм кислорода при охлаждении растений // Физиология растений. 2002. Т. 49. № 5. С. 697–702.
Лукаткин А.С. Вклад окислительного стресса в развитие холодового повреждения в листьях теплолюбивых растений. 2. Активность антиоксидантных ферментов в динамике охлаждения // Физиология растений. 2002. Т. 49. № 6. С. 878–885.
Hall J.L. Cellular mechanisms for heavy metal detoxification and tolerance // J. Exp. Bot. 2002. V. 53. № 366. P. 1–11.
Серегин И.В., Кожевникова А.Д., Казюмина Е.М., Иванов В.Б. Токсическое действие и распределение никеля в корнях кукурузы // Физиология растений. 2003. Т. 50. С. 793–800.
Серегин И.В., Кожевникова А.Д. Физиологическая роль никеля и его токсическое действие на высшие растения // Физиология растений. 2006. Т. 53. С. 285–308.
Sharma P., Bhardwaj R. Effects of 24-epibrassinolide on growth and metal uptake in Brassica juncea L. under copper metal stress // Acta Physiol. Plant. 2007. V. 29. № 3. P. 259–263.
Willkins D.A. The measurement of tolerance to edaphic factors by means of root growth // New Phytol. 1978. V. 80. P. 623–633.
Иванов В.Б., Быстрова Е.И., Серегин И.В. Сравнение влияния тяжелых металлов на рост корня в связи с проблемой специфичности и избирательности их действия // Физиология растений. 2003. Т. 50. С. 445–454.
Серегин И.В., Кожевникова А.Д. Роль тканей корня и побега в транспорте и накоплении кадмия, свинца, никеля и стронция // Физиология растений. 2008. Т. 55. С. 3–26.
Серегин И.В., Кожевникова А.Д., Грачева В.В., Быстрова Е.И., Иванов В.Б. Распределение цинка по тканям корня проростков кукурузы и его действие на рост // Физиология растений. 2011. Т. 58. № 1. С. 85–94.
Сазанова К.А., Башмаков Д.И., Лукаткин А.С. Генерация супероксидного анион-радикала в листьях растений при хроническом действии тяжелых металлов // Тр. Карел. НЦ РАН. 2012. № 2. С. 119–124.
Gruznova K.A., Bashmakov D.I., Brazaityte A., Duchovskis P., Lukatkin A.S. Efficiency index as the integral indicator of Triticum aestivum response to growth regulators // Zemdirbyste = Agricult. 2017. v. 104. № 4. P. 299–304.
Prasad T.K., Anderson M.D., Martin B.A., Stewart C.R. Evidence for chilling-induced oxidative stress in maize seedlings and a regulatore role for hydrogen peroxide // Plant Cell. 1994. V. 6. P. 65–74.
Bajguz A. Blokade of heavy metals accumulation in Chlorella vulgaris cells by 24-epibrassinolide // Plant Physiol. Biochem. 2000. V. 138. № 10. P. 797–801.
Прусакова Л.Д., Чижова С.И. Применение брассиностероидов в экстремальных для растений условиях // Агрохимия. 2005. №. 7. С. 87–94.
Alam M.M., Hayat S., Ali B., Ahmad A. Effect of 28-homobrassinolide on nickel induced changes in Brassica juncea // Photosynthetica. 2007. V. 45. № 1. P. 139–142.
Дополнительные материалы отсутствуют.