Агрохимия, 2019, № 3, стр. 37-43
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ФИЗИОЛОГИЧЕСКОГО ДЕЙСТВИЯ ОКСИДА АЗОТА И 6-БЕНЗИЛАМИНОПУРИНА НА СОСТОЯНИЕ КОМПОНЕНТОВ ГЛУТАТИОНОВОГО КОМПЛЕКСА В КОРНЯХ ПРОРОСТКОВ ПШЕНИЦЫ
Д. Р. Масленникова 1, А. А. Плотников 1, Ф. М. Шакирова 1, *
1 Институт биохимии и генетики – обособленное структурное подразделение,
Уфимский федеральный исследовательский центр РАН
450054 Уфа, просп. Октября, 71, лит 1Е, Россия
* E-mail: shakirova@anrb.ru
Поступила в редакцию 04.06.2018
После доработки 19.06.2018
Принята к публикации 10.12.2018
Аннотация
С целью выявления роли эндогенных цитокининов в реализации физиологического действия оксида азота (NO) на растения пшеницы проведен сравнительный анализ влияния нитропруссида натрия – донора оксида азота и 6-бензиламинопурина (БАП), на состояние основных компонентов глутатионового комплекса в нормальных условиях произрастания. Выявлен сопоставимый по уровню стимулирующий эффект NO и БАП на рост корней проростков пшеницы. Впервые обнаружена способность NO и БАП сходным образом позитивно регулировать соотношение восстановленной формы глутатиона к оксиленной – GSH/GSSG, активность глутатионредуктазы и глутатион-S-трансферазы, что вносит важный вклад в реализацию физиологического действия этих фитогормонов. Полученные данные свидетельствовали о возможном выполнении эндогенными цитокининами роли гормональных интермедиатов в проявлении физиологического действия NO на растения пшеницы.
ВВЕДЕНИЕ
Оксид азота (NO) является внутриклеточной сигнальной молекулой, вовлекаемой в регуляцию фундаментальных физиологических процессов на всех этапах жизненного цикла растений [1].
К настоящему времени получено немало сведений о том, что в основе разнообразия проявлений физиологического действия NO лежит его способность взаимодействовать с различными фитогормонами, такими как АБК, этилен, гиббереллин, салициловая и жасмоновая кислоты [2], а также сигнальными молекулами Са2+ и АФК [3], механизмы восприятия и пути передачи NO-сигналов в растениях изучены пока ограниченно. Из данных литературы известно о взаимодействии пероксинитрита – активного производного NO – c зеатином в системе in vitro, приводившем к снижению уровня содержания эндогенного оксида азота в клетке [4]. Цитокинины (ЦК), как и оксид азота, регулируют фотоморфогенез, рост и старение, программируемую гибель, процессы деления и дифференциации клеток, удлинение гипокотиля у проростков, растущих в темноте, также оказывает сходный эффект на аккумуляцию пигмента бетацианина [4, 5]. Существует предположение, что NO способствует выполнению цитокининами своих функций [5]. Вместе с тем в литературе имеются сведения о том, что данные фитогормоны могут проявлять противоположные эффекты на процессы прорастания семян, цветения и закрытия устьиц [4].
Ранее авторами было обнаружено, что обработка растений донором оксида азота SNP (sodium nitroprusside) в концентрации 200 мкМ и цитокинином 6-бензиламинопурином (БАП) в концентрации 44 нМ индуцирует сходное по величине двукратное накопление эндогенных цитокининов в проростках пшеницы в отсутствии сдвигов в содержании ИУК и АБК в нормальных условиях произрастания [6, 7], что позволило высказать предположение о вовлечении эндогенных ЦК в реализацию физиологического действия SNP на растения пшеницы [7].
Наряду с гормональной системой важный вклад в регуляцию роста и развития растений вносят компоненты антиоксидантной системы, в частности низкомолекулярный антиоксидант глутатион, а также ферменты глутатионредуктаза (ГР) и глутатион-S-трансфераза (ГСТ), которые не только вовлечены в формирование защитных реакций растений в ответ на воздействие неблагоприятных факторов внешней среды, но и играют значительную роль в нормальных условиях произрастания [8, 9].
Цель работы – выяснение принципиальной возможности вовлечения эндогенных цитокининов в регуляцию физиологических ответов растений пшеницы на обработку SNP. В связи с этим был проведен сравнительный анализ влияния обработки проростков БАП и NO на показатели роста, соотношение содержания восстановленного глутатиона (GSH) к его окисленной (GSSG) форме (GSH/GSSG), активность ферментов глутатионредуктазы и глутатион-S-трансферазы в корнях проростков пшеницы в нормальных условиях произрастания.
МЕТОДИКА ИССЛЕДОВАНИЯ
Опыты проводили на корнях 4-суточных проростков мягкой яровой пшеницы Triticum aestivum L. сорта Салават Юлаев. Семена после стерилизации 96%-ным этанолом проращивали в кюветах на фильтровальной бумаге в течение 3 сут (16-часовой световой фотопериод, 15 клк, 22–24°С). После отделения эндосперма часть проростков корнями помещали в стаканы с раствором 2%-ной сахарозы в качестве питательной среды на 24 ч, после чего проростки переносили на свежий раствор 2%-ной сахарозы, содержащий 200 мкМ SNP или 44 нМ БАП. Для сравнения ростовых параметров корней другую часть 3-суточных проростков помещали на раствор 2%-ной сахарозы, содержащий 200 мкМ SNP или 44 нМ БАП и инкубировали 24 ч. Контролем служили проростки, растущие на растворе 2%-ной сахарозы.
Для определения митотического индекса (МИ) апикальную меристематическую зону корней проростков фиксировали в смеси уксусной кислоты с этанолом (1 : 3) в течение 4 ч. После фиксации растительный материал отмывали водопроводной водой и обрабатывали смесью 5%-ной пектиназы и 5%-ной целлюлазы при 37°С в течение 1 ч. Временные давленые препараты окрашивали 1%-ным ацетокармином, приготовленным на 45%-ной уксусной кислоте, затем клетки просматривали при 600-кратном увеличении и подсчитывали МИ клеток по традиционной методике как соотношение числа клеток в состоянии митоза и общего числа клеток ткани (в %) [10], используя микроскоп Amplival (“Carl Zeiss”, Германия). Каждый вариант опыта содержал не менее 40 проростков, анализ МИ проводили на 2000 клеток в каждом варианте. Об интенсивности ростовых процессов судили по линейным размерам корней проростков, их сырой и сухой массе. Эксперименты по оценке показателей роста проводили в трех–четырех биологических повторностях, каждый вариант включал по 30–50 растений.
Содержание восстановленной (GSH) и окисленной (GSSG) форм глутатиона из одной растительной навески определяли с помощью спектрофлуорометрического метода, основанного на получении флуоресцирующего продукта о-фталевого альдегида (“Sigma”, Австралия) в зависимости от pH среды. Навеску корней ≈0.5 г гомогенизировали в 4 мл смеси, состоящей из 0.1 М калий-фосфатного буфера (pH 8.0) и 25%-ного раствора метафосфорной кислоты в соотношении 3.75 : 1 (по объему), как рекомендовано в работе [11]. Гомогенат центрифугировали в течение 10 мин при 8000 g, затем надосадочную жидкость повторно центрифугировали 5 мин при 13000 g. Количественную оценку GSH и GSSG в полученном супернатанте проводили с использованием реагентов, детально описанных в работе [12]. Для оценки содержания GSH и GSSG регистрировали кинетику интенсивности флуоресценции образовавшихся комплексов при pH 8.0 и 12.0 соответственно с использованием прибора “Perkin Elmer LS 55 Luminescence Spectrometr Cell” (США) при 420 нм (длина волны возбуждения – 350 нм).
Активность глутатионредуктазы (ГР, КФ 1.8.1.7) и глутатион-S-трансферазы (ГСТ, КФ 2.5.1.18) определяли согласно [13].
Оценка активности ГР основана на способности фермента катализировать восстановление окисленного глутатиона, используя в качестве восстановителя НАДФН, поэтому в ходе анализа измеряли изменение абсорбции раствора при образовании НАДФ+. Для этого 0.25 г навески корней растирали в жидком азоте, затем добавляли 0.75 мл буфера, содержащего 680 мг K2HPO4, 4 г поливинилпирролидона, 3 мг Na-ЭДТА, 280 мкл Тритон-Х, растворенных в 100 мл дистиллированной воды (непосредственно перед использованием в 20 мл полученного буфера добавляли 200 мкл 100 мМ фенилметилсульфонилфторида), после чего смесь центрифугировали 10 мин при 12 000 g, полученный супернатант использовали в работе. Реакционная смесь содержала 50 мкл экстракта, 1.91 мл буфера измерения, содержащего 6.05 г Трис-HCl и 146 мг Na-ЭДТА, растворенных в 500 мл дистиллированной воды (раствор до pH 8.0 доводили с помощью концентрированной HCl), и 20 мкл 0.4%-ного раствора НФДФН (“Sigma-Aldrich”, США). Реакцию в смеси инициировали внесением 20 мкл 3%-ного раствора окисленного глутатиона (“Sigma-Aldrich”, США). Контрольная проба содержала все внесенные компоненты, за исключением глутатиона окисленного. Активность ГР измеряли ежесекундно в течение 5 мин при длине волны 340 нм. При расчете активности глутатионредуктазы использовали коэффициент экстинкции для НАДФН, равный 6.22 мM–1 см–1, и выражали в единицах измерения ммоль/мин/мг белка.
Активность глутатион-S-трансферазы определяли по скорости образования глутатион-S-коньюгатов между GSH и 1-хлор-2,4-динитробензолом (ХДНБ) (“Сarl Roth Gmb@Co”, Германия). Навеску 0.35 г корней растирали холодным пестиком в холодной ступке в 0.7 мл экстракционного буфера (состав буфера описан выше), центрифугировали 5 мин при 12 000 g, для анализа активности глутатион-S-трансферазы использовали супернатант. Реакционная смесь содержала 2.5 мл 0.1 М калий-фосфатного буфера pH 6.5, содержащего 0.68 г K2HPO4 и 0.046 г NaOH, растворенных в 50 мл дистиллированной воды (pH буфера корректировали концентрированной H3PO4 или 5%-ным NaOH), 0.2 мл 0.015 М раствора GSH (“Sigma-Aldrich”, США) и 0.1 мл супернатанта, реакцию инициировали внесением в кювету 0.2 мл 0.015 М ХДНБ, контрольная проба содержала все внесенные реагенты, за исключением ХДНБ. Накопление коньюгатов регистрировали ежесекундно в течение 90 с при длине волны 340 нм. Активность ГСТ рассчитывали, используя коэффициент экстинкции 9.6 мM–1 см–1 для ГS–ХДНБ при длине волны 340 нм, и выражали ее в ммоль/мин/мг белка. Определение активности ГР и ГСТ проводили с использованием спектрофотометра “UNICO 2800” (США). Содержание белка определяли по методу Бредфорда [14].
Проницаемость клеточных мембран целых проростков оценивали по уровню выхода электролитов с использованием кондуктометра “ОК 102/1” (“Radelkis”, Венгрия), измеряя омическое сопротивление водных экстрактов в постоянном токе. Для этого 1 г растительной навески промывали водопроводной водой, нарезали на одинаковые кусочки и вновь промывали водопроводной водой в течение 3 мин. Далее отрезки промывали дистиллированной водой, слегка обсушивали, приливали к ним по 20 мл дистиллированной воды и инкубировали 1 ч при 25–27°С. Затем образцы фильтровали и измеряли электропроводность полученных растворов [7].
На рисунках данные представлены как средние арифметические 3–4-х независимых опытов, каждый из которых проведен в 3-х биологических повторностях, и их стандартные ошибки. Полученные результаты обрабатывали статистически с помощью дисперсионного анализа ANOVA, используя SPSS 13.0 для Windows (SPSS Inc., Chicago, IL USA). Достоверные различия между средними рассчитывали с помощью LSD-теста при Р ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Полученные ранее данные о сходном влиянии цитокининов и NO на гормональную систему растений [6, 7] дают основание предполагать аналогичный эффект на ростовые параметры растений, при этом важно отметить, что сведения о сравнительном влиянии БАП и NO на показатели роста проростков пшеницы в литературе отсутствуют. В связи с этим авторами был впервые проведен сравнительный анализ влияния БАП и NO на митотическую активность клеток апекса, длину, сырую и сухую массу корней проростков пшеницы в нормальных условиях произрастания.
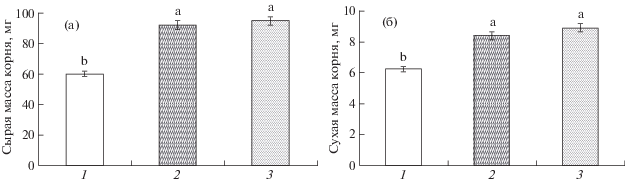
Инкубирование проростков на растворах SNP или БАП в течение 24 ч вызвало в целом сходный ростстимулирующий эффект, о котором судили по митотической активности клеток апикальной меристемы корней и показателям их линейных размеров (рис. 1). Увеличение митотической активности и удлинение корней в среднем на 150% от контроля отмечено при оценке корней проростков, обработанных как SNP, так и БАП. Сходный по величине стимулирующий эффект NO и цитокининов на рост корней проростков пшеницы наблюдали при анализе их сырой и сухой массы (рис. 2). Полученные данные демонстрировали сопоставимый по величине ростстимулирующий эффект SNP и БАП на растения пшеницы.
Рис. 1.
Митотическая активность клеток апикальной меристемы корней (а) и длина корней (б) 4-суточных проростков пшеницы. 3-суточные проростки инкубировали 24 ч на среде, содержащей 200 мкМ SNP или 44 нМ 6-бензиламинопурин. Варианты: 1 – контроль, 2 – SNP, 3 – БАП. Разными буквами обозначены достоверные отличия вариантов от контроля при р ≤ 0.05 (ANOVA, LSD-тест). Обозначения те же на рис. 2.
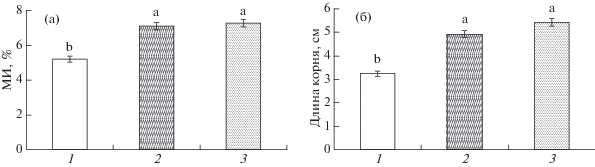
Рис. 2.
Влияние 24 ч инкубирования 3-суточных растений пшеницы на растворах, содержащих 200 мкМ SNP или 44 нМ 6-бензиламинопурина, на сырую (а) и сухую массу (б) корней проростков пшеницы.
Известно, что оксид азота вовлечен в регуляцию синтеза глутатиона и активности основных ферментов глутатионового комплекса – глутатионредуктазы и глутатион-S-трансферазы [15, 16]. Вместе с тем имеются сведения об участии цитокининов в регуляции синтеза цистеина – аминокислоты, лимитирующей образование глутатиона [17]. Из данных литературы известно, что обработка БАП тормозит индуцируемое темнотой старение листьев пшеницы, при этом отмечают значительное снижение содержания пероксида водорода и повышение активности каталазы и аскорбатпероксидазы [18]. Вместе с тем совместная обработка растений БАП и NO в таких же условиях также тормозила процесс старения на фоне повышения активности супероксддисмутазы (СОД), каталазы и аскорбатпероксидазы [19]. Аналогичный стабилизирующий эффект обработки цитокинином на состояние антиоксидантной системы выявлен в луковицах китайского лука Allium tuberosum после уборки урожая, что способствует их лучшему сохранению [20].
Проведенный анализ величин соотношения GSH/GSSG в корнях проростков пшеницы показал, что обработки SNP или БАП вызывали сходное по уровню увеличение данного показателя (рис. 3). Ранее было выявлено, что в нормальных условиях произрастания растений нута SNP не вызывал изменений в соотношении GSH/GSSG и лишь незначительно активировал ГР [21]. Вместе с тем имеются сведения о способности SNP и цитокининов стимулировать транскрипцию генов синтеза глутатиона и его накопление [16, 22], что согласуется с полученными авторами данной статьи результатами.
Рис. 3.
Влияние 200 мкМ SNP или 44 нМ 6-бензиламинопурина на величину соотношения GSH/GSSG в корнях 4‑суточных проростков пшеницы.

Далее провели анализ активности глутатионредуктазы в корнях проростков пшеницы в ходе их инкубирования на растворах SNP и БАП. Хорошо известно, что глутатионредуктаза участвует в НАДФН-зависимой реакции восстановления GSSG в GSH в стрессовых условиях [8].
Показано, что обработки растений SNP и БАП вызывали в равной степени повышение активности данного фермента на 30–40% относительно контроля (рис. 4). Таким образом, накопление GSH и активация фермента ГР в ходе обработки SNP и БАП способствовали поддержанию в клетке восстановленной формы глутатиона, что, в свою очередь, могло внести вклад в ростстимулирующий эффект этих фитогормонов (рис. 1, 2), поскольку известно, что высокий уровень GSH является необходимым для поддержания физиологической активности антиоксидантных ферментов и прохождения клеточного цикла в тканях корней в нормальных условиях произрастания [5, 23].
Рис. 4.
Влияние 200 мкМ SNP или 44 нМ 6-бензиламинопурина на активность глутатионредуктазы в корнях 4-суточных проростков пшеницы.

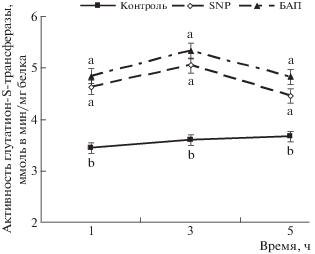
Глутатион-S-трансферазы – суперсемейство ферментов, которые играют важную роль в детоксикации и метаболизации продуктов перекисного окисления липидов при окислительном стрессе, вызываемым неблагоприятными факторами среды, и являются маркерами клеточного редокс-статуса в нормальных условиях произрастания [24]. Анализ активности ГСТ показал, что обработка растений SNP или БАП вызывала небольшую транзиторную активацию, которая составляла 30–40% от контроля с максимумом при 3-часовом воздействии (рис. 5). Такая активация ГСТ не является показателем повреждающего действия этих фитогормонов на проростки пшеницы, что подтверждено результатами оценки экзоомоса электролитов из растительных тканей (табл. 1) и показателями роста корней проростков (рис. 1, 2).
Рис. 5.
Влияние 200 мкМ SNP или 44 нМ 6-бензиламинопурина на активность глутатион-S-трансферазы в корнях 4-суточных растений пшеницы.
ЗАКЛЮЧЕНИЕ
Данные о сопоставимом по степени воздействия влиянии нитропруссида натрия (SNP) – донора оксида азота и 6‑бензиламинопурина (БАП) на показатели роста и величину соотношения GSH/GSSG, активность глутатионредуктазы и глутатион-S-трансферазы в корнях проростков в нормальных условиях произрастания указали на возможность выполнения эндогенными цитокининами роли гормональных интермедиатов в проявлении физиологического действия оксида азота на растения пшеницы.
Список литературы
Nawaz F., Shabbir R.N., Shahbaz M., Majeed S., Raheel M., Hassan W., Sohail M.A. Cross talk between nitric oxide and phytohormones regulate plant development during abiotic stresses // Phytohormones – signaling mechanisms and crosstalk in plant development and stress responses. Intech. 2017. Chapter 6. P. 117–141.
Xia X.-J., Zhou Y.-H., Shi K., Zhou J., Christine H.F., Yu J.-Q. Interplay between reactive oxygen species and hormones in the control of plant development and stress tolerance // J. Exp. Bot. 2015. V. 66. № 10. P. 2839–2856.
Карпец Ю.В., Колупаев Ю.Е. Функциональное взаимодействие оксида азота с активными формами кислорода и ионами кальция при формировании адаптивных реакций растений // Вестн. Харьков. нац. аграрн. ун-та. 2017. Вып. 2. № 41. С. 6–31.
Liu W.-Z., Kong D.-D., Gu X-X., Gao H.-B., Wang J.-Z., Xia M., Gao Q., Tiana L.-L., Xu Z.-H., Bao F., Hu Y., Ye N.-S., Pei Z.-M., He Y.-K. Cytokinins can act as suppressors of nitric oxide in Arabidopsis // PNAS. 2013. V. 110. № 4. P. 1548–1553.
Битюцкий Н.П. Минеральное питание растений. СПб.: Изд-во СПбГУ, 2014. 540 с.
Shakirova F.M., Avalbaev A.M., Bezrukova M.V., Fatkhutdinova R.A., Maslennikova D.R., Yuldashev R.A., Allagulova Ch.R., Lastochkina O.V. Hormonal intermediates in the protective action of exogenous phytohormones in plants under salinity: A case study on wheat // Phytohormones and abiotic stress in plants / Eds. Khan N., Nazar R., Iqbal N., Anjum N. 2012. P. 185–228.
Масленникова Д.Р., Аллагулова Ч.Р., Федорова К.А., Плотников А.А., Авальбаев А.М., Шакирова Ф.М. Вклад цитокининов в реализацию ростстимулирующего и протекторного действия оксида азота на растения пшеницы // Физиология растений. 2017. Т. 64. № 5. С. 355–363.
Ithayaraja C.M. Mini-review: metabolic functions and molecular structure of glutathione reductase // Inter. J. Pharm. Sci. Rev. Res. 2011. V. 9. P. 104–115.
Hasanuzzaman M., Nahar K., Anee T.I., Fujita M. Glutathione in plants: biosynthesis and physiological role in environmental stress tolerance // Physiol. Mol. Biol. Plants. 2017. V. 23. № 2. P. 249–268.
Fusconi A., Repetto O., Bona E., Massa N., Gallo C., Dumas-Gaudot E., Berta G. Effect of cadmium on meristem activity and nucleus ploide in roots of Pisum sativum L. cv. Frisson seedlings // Environ. Exp. Bot. 2006. V. 58. P. 253–260.
Hissin P.J., Hilf R.A. A fluorometric method for determination of oxidize and reduced glutathione in tissues // Anal. Biochem. 1976. P. 214–226.
Шалыго Н.В., Щербаков Р.А., Доманская И.Н., Радюк М.С. Спектрофлуориметрический метод определения окисленного и восстановленного глутатиона в растениях // Физиол. и биохим. культ. раст. 2007. Т. 39. № 3. С. 264–270.
Акулов А.Н., Гумерова Е.А., Костюкова Ю.А., Никанорова Н.А., Румянцева Н.И., Сибгатуллина Г.В., Хаертдинова Л.Р. Методы определения редокс-статуса культивируемых клеток растений. Учеб.-метод. пособ. Казань: Казан. ун-т, 2012. 51 с.
Bradford M.M. A rapid and sensitive methods for quantitation of microgram quantities of protein utilizing the principle of protein dye binding // Anal. Biochem. 1976. P. 248–254.
Mello C.S., Hermes V.S., Guerra M.P., Arisi A.C.M. Sodium nitroprusside modulates gene expression involved in glutathione synthesis in Zea mays leaves // Biol. Plant. 2012. V. 6. № 2. P. 383–388.
Shan C., Dong N. Nitric oxide donor SNP regulates the ascorbate and glutathione metabolism in Agropyron cristatum leaves through MEK1/2 // Biol. Plant. 2017. V. 61. № 4. P. 774–778.
Kopriva S., Rennenberg H. Control of sulphate assimilation and glutathione synthesis: interaction with N and C metabolism // J. Experiment. Bot. 2004. V. 55. № 404. P. 1831–1842.
Zavaleta-Mancera H.A., Lo’pez-Delgado H., Loza-Tavera H., Mora-Herrera M., Trevilla-Garcı’a C., Vargas-Sua’rez M., Ougham H. Cytokinin promotes catalase and ascorbate peroxidase activities and preserves the chloroplast integrity during dark-senescence // J. Plant Physiol. 2007. V. 164. P. 1572–1582.
Poor P., Ördog A., Czekus Z., Borbely P., Takacs Z., Kovacs J., Tari I. Regulation of the key antioxidant enzymes by developmental processes and environmental stresses in the dark // Biol. Plant. 2017. https://doi.org/. doi 10.1007/s10535-018-0782-7
Li-e J., Sheng L., Xiao-ming D., Chao Z., Zhan-hui W., Ming-chi L., Shao-gui G., Jin-hua Z., Li-bin W. 6-Benzylaminopurine treatment maintains the quality of Chinese chive (Allium tuberosum Rottler ex Spreng.) by enhancing antioxidant enzyme activity // J. Integrat. Agricult. 2017. V. 19. № 9. P. 1968–1977.
Sheokand S., Bhankar V., Sawhney V. Ameliorative effect of exogenous nitric oxide on oxidative metabolism in NaCl treated chickpea plants // Brazil. Soc. Plant Physiol. 2010. V. 22. № 2. P. 81–90.
Wu X., He J., Ding H., Zhu Z., Chen J., Xu Sh., Zha D. Modulation of zinc-induced oxidative damage in Solanum melongena by 6-benzylaminopurine involves ascorbate–glutathione cycle metabolism // Environ. Exp. Bot. 2015. V. 116. P. 1–11.
Tyburski J., Tretyn A. Ascorbate and glutathione in organogenesis, regeneration and differentiation in plant in vitro cultures // Ascorbate-glutathione pathway and stress tolerance in plants / Ed. Anjum N.A. Chapter 2. 2010. P. 55–90.
Gill S.S., Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants // Plant Physiol. Biochem. 2010. V. 48. P. 909–930.
Дополнительные материалы отсутствуют.


