Агрохимия, 2019, № 3, стр. 85-95
ВЛИЯНИЕ ГУМИНОВЫХ ВЕЩЕСТВ НА РАСТЕНИЯ И РИЗОСФЕРНЫЕ МИКРООРГАНИЗМЫ В РАСТИТЕЛЬНО-МИКРОБНЫХ СИСТЕМАХ
В. Н. Пищик 1, 2, *, Л. В. Бойцова 1, Н. И. Воробьев 2
1 Агрофизический институт
195220 Санкт-Петербург, Гражданский пр., 14, Россия
2 Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии
196608 Санкт-Петербург–Пушкин, ш. Подбельского, 3, Россия
* E-mail: veronika-bio@rambler.ru
Поступила в редакцию 20.08.2018
После доработки 29.08.2018
Принята к публикации 10.12.2018
Аннотация
В обзоре рассмотрены вопросы природы и строения гуминовых веществ (ГВ), их поступление в растение, влияние на растения и микроорганизмы. Рассмотрена гипотеза ауксиноподобной активности ГВ, активирование АТФ-азной активности клеточных мембран растений, индукция образования сигнальной молекулы NO в растениях. Предложена гипотеза влияния ГВ на растительно-микробную систему. ГВ активизируют синтез ИУК ризосферными микроорганизмами. При воздействии экзогенных фитогормонов микрофлоры увеличивается количество и изменяется профиль корневых экссудатов растений, что приводит к увеличению численности и активности ризосферных микроорганизмов, в том числе микроорганизмов–деструкторов ГВ, трансформирующих ГВ в доступные для растений формы.
ВВЕДЕНИЕ
Первые научные исследования действия гуминовых веществ (ГВ) на физиологические свойства растений [1, 2] и микроорганизмов [3] проводили в 1950-е гг. Интерес к этому вопросу не ослабевает и в настоящее время, о чем свидетельствуют многие научные обзоры последних лет [4, 5]. Появление новых результатов, свидетельствующих о молекулярной структуре ГВ [6, 7], а также молекулярно-генетические данные об изменении свойств растений под действием ГВ [8] и распределению ГВ в тканях растений [9] поставили новые задачи для научных исследований в этой области. Кроме непосредственного влияния ГВ на растения и микроорганизмы, необходимо исследовать эмерджентные реакции растительно-микробных систем (РМС) на воздействие ГВ.
ГВ входят в состав гумуса – почвенного органического вещества, определяющего почвенное плодородие. Реакционная способность ГВ обусловлена их гидрофобно-гидрофильным соотношением [10]. ГВ представляют собой гетерогенные полидисперсные азотсодержащие соединения фенольной природы. В составе молекул ГВ выделяют ароматические кольца с заместителями (в основном карбоксильными и фенольными группами), N- и S-содержащие гетероциклы и алифатические цепочки. Ранее ГВ рассматривали как макромолекулы [11]. В более поздних исследованиях ГВ описывают как супрамолекулярные образования, состоящие из молекул, связанных между собой ковалентными связями [6, 12]. Супрамолекулярная природа ГВ была подтверждена электронно-микроскопическим анализом гумусовой матрицы почвенных гелей [7]. Для макромолекул характерна подвижность сегментов, а супрамолекулярные образования имеют четко определенную жесткую структуру. При образовании матричной структуры (гелевой фазы) супрамолекулы, в отличие от макромолекул, должны обладать большей свободой движения в матрице, образуя при этом не только наночастицы, но и микронные частицы, а также фрактальные образования [7, 12]. Макромолекулы в гелевой фазе имеют наноразмеры, они не способны перемещаться по матрице, и образуют ограниченный набор структур. В состав супрамолекулярных комплексов ГВ могут входить макромолекулы. Предлагаемый авторами подход привел к обобщению супра- и макромолекулярных теорий [7].
Цель работы – изучение влияния гуминовых веществ на растения и ризосферные микроорганизмы в растительно-микробных системах.
ПОСТУПЛЕНИЕ ГВ В РАСТЕНИЕ И ФИЗИОЛОГИЧЕСКАЯ РЕАКЦИЯ РАСТЕНИЙ
Поскольку ГВ имеют поверхностно-активную структуру, содержащую гидрофильные домены (карбоксильные и фенольные группы), они могут сорбироваться на биологических мембранах [13]. При использовании 14С углеродной метки [14] и 3H тритиевой метки [9] доказана способность низкомолекулярных ГВ проникать в растительную клетку. Обнаружено, что ГВ в основном накапливаются в корнях растений, но также поступают в надземные органы растений [9]. Предполагают, что крупные молекулы ГВ могут распадаться на фрагменты и проникать в цитоплазму клетки [15].
Молекулы, высвобождаемые из супрамолекулярного комплекса ГВ, могут взаимодействовать с клеточными мембранами и индуцировать различные физиологические реакции растений [16]. Возможно, этими процессами объясняется ранее обнаруженная гормоноподобная активность ГВ: ауксиновая [17], цитокининовая, гиббереллиновая [18] и полиаминовая [19]. Результаты исследований показали, что содержание путресцина, спермидина и спермина в ГВ из разных источников составляло 1.54–7.00, 0.39–3.88, 0.48–4.79 нМ/г соответственно [19], т.е. полиамины могут объяснить активность ГВ. Обнаруженная гормоноподобная активность ГВ была намного ниже, чем гормонов растений, поэтому был сделан вывод об отсутствии фитогормональной активности ГВ [18].
Однако при анализе описанных гормоноподобных эффектов ГВ остается невыясненным вопрос, содержат ли ГВ функциональные группы, распознаваемые комплексами приема/передачи сигнальных путей растений, или ГВ стимулируют ризосферные микроорганизмы, продуцирующие гормоны и обеспечивающие опосредованную гормоноподобную активность ГВ. Физиологическую активность ГВ связывают также с концентрацией в них свободных радикалов [20]. Физиологическая реакция на внесение ГВ связана с большим уровнем клеточной активности и дифференцировки тканей, что приводит к росту корней [21].
Показано, что ГВ могут индуцировать образование окиси азота (NO) корнями растений [22]. NO является биологически активной сигнальной молекулой [23] и участвует в процессе формирования корневых волосков арабидопсиса как в инициации образования, так и в росте за счет растяжения корневых волосков [24]. Обработка ГВ корней растений огурца вызвала увеличение концентрации NO, что сопровождалось увеличением количества вторичных корней, толщины и массы корней [25].
Поскольку ГВ увеличивают количество корневых волосков и динамику роста корней, подобно фитогормону ауксину, была предложена гипотеза ауксиноподобного действия ГВ на растения [26]. Эта гипотеза была подкреплена выделением небольших количеств индолил-3-уксусной кислоты (ИУК) из гуминовых веществ почв [17].
ИУК в растениях синтезируется в тканях верхушечной меристемы побега и транспортируется к корням по флоэме. ИУК-сигналы побуждают группы клеток перицикла корня к образованию боковых корней в зоне деления [27]. Экзогенная ИУК, синтезируемая ризосферными микроорганизмами [28, 29], изменяет морфологию корней растений, образуя большое количество боковых корней и корневых волосков. Подобные изменения происходят и при действии ГВ. Корневые волоски корней растений являются удобным объектом для изучения механизма гормон-регулируемой элонгации клеток. Большие успехи были достигнуты в изучении мутантных (по гену rhd6) растений арабидобсиса A. thaliana, дефектных по образованию корневых волосков [30]. При изучении действия ГВ в концентрациях от 1 до 20 мг Cорг на данные растения оказалось, что ГВ (в отличие от ауксинов) не оказывали влияние на образование корневых волосков [31]. Следовательно, ГВ не могут заменить ауксины в развитии роста корневых волосков, однако способны изменить развитие корня, не оказывая значительного влияния на гомеостаз ауксина в растении [31]. Это предположение также подтверждено отсутствием экспрессии ауксин-чувствительного гена GH3 при воздействии гуминовых кислот (ГК) [31]. Известно, что транскрипты генов из семейства GH3 накапливаются после воздействия ауксина, возможно, для ослабления сигнализации ауксина путем инактивации ИУК посредством конъюгации с аминокислотами [32]. Для визуализации ответов на ауксин и маркирования ауксинового сигнала в боковых корнях арабидобсиса (A. thaliana) был использован DR5 – синтетический промоутер, активизирующий ген-репортер β-глюкуронидазы (GUS) (DR5::GUS) [33]. При обработке корней ГВ обнаружена активация экспрессии гена-репортера β-глюкуронидазы в боковых корнях, сопоставимая с экзогенно применяемыми ауксинами [33]. При ответной реакции растений A. thaliana и томатов на воздействие ГВ была необходима трансдукция ауксинового сигнала [34]. ГВ могут действовать как буфер, поглощая либо высвобождая сигнальные молекулы ИУК в соответствии с изменениями pH в ризосфере, проявляя себя как регулятор гормонального баланса по отношению к появлению боковых корней.
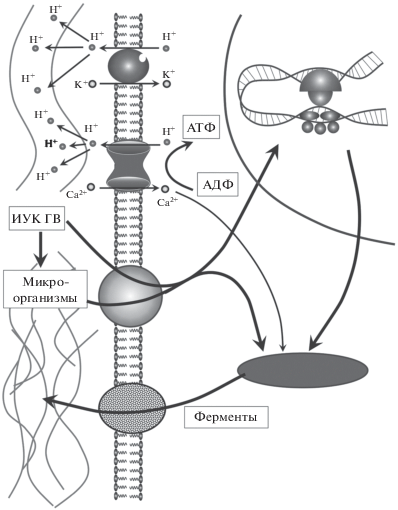
Наличие биологически активных молекул ауксина в супрамолекулярном гуминовом комплексе обусловливает активацию Н+-АТФазы клеточных мембран растений [35]. Доказана стимуляция ванадат-чувствительной АТФазы мембранных везикул плазмы клеток корней кукурузы при обработке их ГВ из биогумуса [36]. ГВ индуцировали экспрессию основной изоформы Н+-АТФазы плазматической мембраны кукурузы [37]. У проростков, обработанных ГВ, наблюдали почти 2-кратное увеличение содержания мРНК этой изоформы. ГВ-индуцированный синтез новых H+-АТФаз приводил к увеличению количества ионов Н+ и количества Н+-АТФаз в данной области мембраны. Несмотря на растяжение плазмалеммы в процессе роста, эти изменения приводят к поддержанию мембранного потенциала, энергозависимого транспорта растворенных веществ и тургора клетки [32].
ГВ, также как ИУК в низких концентрациях (10–5 и 10–10 M), способствовали активации не только H+-АТФазы цитоплазматической мембраны, но и вакуолярных H+-АТФаз и H+-пирофосфатазы [22]. Cовместная активация H+-АТФ-помп плазмалеммы и тонопласта играет ключевую роль в процессе растяжения клеток корня. ГВ ускоряли рост корней проростков пшеницы, активируя Н+-АТФазу плазмалеммы, что приводило к увеличению продольной растяжимости клеточных стенок и поглотительной способности корней [38]. Согласно теории “кислого роста” [32], ИУК активирует работу Н+-помпы в плазматической мембране. При перекачивании из внутренней области клетки ионов Н+ к мембране локально снижается величина рН в том или ином ее участке. Снижение величины рН активирует рН-чувствительные ферменты и белки клеточной стенки – гидролазы, которые разрыхляют клеточную стенку и инициируют растяжение клетки.
Однако ауксин-зависимая активация Н+-помпы и рост клеток растяжением наблюдалась не всегда [39]. Наряду с теорией кислого роста, предполагали непосредственную передачу ауксинового сигнала в ядро клетки с дальнейшей транскрипцией и экспрессией генов [40]. Недавно была предложена теория ферментативного роста клеток [30]. Эта теория объясняет первичное действие ауксинов их взаимодействием с рецепторами и образованием гормон-рецепторного комплекса, который проникает в ядро клетки, вызывая экспрессию генов, что в свою очередь вызывает биосинтез ферментов, определяющих разрыхление клеточной стенки [30]. Влияние ГВ на рост корневых волосков растений схематично представлено на рис. 1.
Увеличение H+-АТФазной активности плазматической мембраны приводит к росту электрохимического градиента протонов Н+, который увеличивает транспорт ионов через клеточные мембраны [41]. ГВ увеличивают поглощение неорганических элементов (N, P, K), кальция и магния [4], серы [42] растениями. Низкомолекулярные фракции ГВ способствуют большему поглощению минеральных веществ, чем высокомолекулярные [43]. Влияние ГВ на минеральное питание растений зависит от химического, гранулометрического состава и pH почвы [44]. При изучении влияния ГВ на поступление Fe в растения обнаружена индукция экспрессии генов CsFRO1 и CsIRT1 (кодирующих фермент-редуктазу Fe (III) и корневой транспортер Fe (II) соответственно) в растениях огурца, обработанных гуминовой кислотой [45]. Эти результаты подтверждали гипотезу о положительном действии ГВ на развитие растений за счет улучшения доступности Fe при его дефиците [44].
Первичный метаболизм является базовым биохимическим процессом. В реакциях первичного метаболизма происходит образование и расщепление нуклеиновых кислот, белков и пептидов, а также большинства углеводов, некоторых карбоновых кислот [40]. ГВ увеличивали активность ферментов, связанных с гликолизом и циклом трикарбоновых кислот [47]. В процессе гликолиза при расщеплении молекулы глюкозы образуется 2 молекулы пировиноградной кислоты, которая при окислении превращается в ацетил-кофермент А, являющийся основным субстратом дыхательного цикла растений [40]. Активность ферментов глюкокиназы, фосфоглюкоизомеразы, PPI-зависимой фосфофруктокиназы и пируваткиназы (гликолиз), цитратсинтазы, малатдегидрогеназы и цитозольной формы НАДФ+-изоцитратдегидрогеназы (окисление трикарбоновых кислот) значительно повышалась при концентрации 1 мг ГВ/л C [47]. Увеличение активности ферментов, связанных с гликолизом, в дальнейшем сказывалось на усилении дыхания растений. При выращивании томатов на питательных растворах, содержащих либо гуминовую кислоту (50 мг/л), либо фульвокислоту (50 мг/л), потребление кислорода растениями увеличилось на 23 и 34%, соответственно [2].
Концентрация хлорофилла в листьях томатов увеличивалась на 63% при выращивании на растворе гуминовой кислоты на 69% – на растворе фульвокислоты [2], что свидетельствовало о стимулировании ГВ процессов фотосинтеза. При исследовании влияния ГВ на фотосинтез листьев кукурузы обнаружено, что ГВ уменьшали содержание крахмала в листьях, при этом увеличивая количество растворимых сахаров [48].
Сахароза, синтезируемая из углеводов, полученных в результате фотосинтеза (цикл Кальвина–Бенсона), представляет собой исходное соединение для дыхательного пути, и увеличение ее содержания способствует повышению на 40% рибулозо-1,5-бифосфаткарбоксилазо/оксигеназной активности в растениях, обработанных ГВ [48].
ГВ увеличивали содержание некоторых полярных липидов, которые являются компонентами мембран тилакоидов и хлоропластов, что свидетельствует об увеличении активности фотосистемы I и II растений [9]. Увеличение количества свободных жирных кислот, которые являются основными компонентами суберина и кутина, а также концентрации трития 3H в тканях кутикулы и пробковых тканях указывает на возможную роль ГВ в биосинтезе суберина и кутина [9].
Азотный метаболизм является основой образования аминокислот, белков, ферментов и нуклеотидов. Обработка ГВ повышала поглощение N-NO3 растениями [49]. В исследовании [50] не нашли зависимость между поглощением и степенью сродства NO$_{3}^{ - }$ клеточного транспортера к ГВ, это доказывало, что ГВ не влияют на первичный транспорт нитрат-ионов. Повышение поглощения нитратов при обработке ГВ объясняется облегчением H+/NO$_{3}^{ - }$ симпорта ионов. ГВ увеличивали поглощение NH$_{4}^{ + }$ растениями, при этом увеличивалась активность ферментов малатдегидрогеназы, глутаматдегидрогеназы и фосфоэнолпируваткарбоксилазы [51].
При изучении влияния ГВ на плазматические мембранные белки кукурузы обнаружено [52], что регуляция всех изученных белков подавлялась при обработке ГВ, за исключением триозофосфатизомеразы, активность которой увеличилась на 69%, и глицеральдегид-3-Р-дегидрогеназы, которая поддерживалась на том же уровне экспрессии. При этом обнаружилась высокая регуляция цитозольной аконитатгидратазы (ACO) (спот 224, +79%), которая может вызывать изменения в корневой экссудации.
Наряду с протеомным анализом, проводили геномный анализ растений [53]. Показано, что ГВ влияют на физиологию растений Arabidopsis thaliana с помощью сложных регуляторных элементов транскрипционных сетей, ослабляя и усиливая экспрессию генов [53]. При обработке ГВ растений Brassica napus была выявлена сверхэкспрессия генов в девяти кластерах, которые охватывали основные элементы обмена веществ: углерод и фотосинтез, общий клеточный метаболизм, жирные кислоты, азот/сера, фитогормоны, развитие растений, старение, реакции на стресс и перенос ионов и воды [54]. ГВ могут индуцировать метаболизм углерода и азота и регулировать другие физиологические процессы в клетке за счет повышения (или понижения) экспрессии генов [53].
Эффект ГВ на вторичный метаболизм растений был впервые показан в работе [55]. ГВ усиливали экспрессию фермента фенилаланин-(тирозин)-аммоний-лиазы, который катализирует первый шаг биосинтеза фенольных соединений, путем преобразования фенилаланина в транс-коричную кислоту и тирозина в p-кумаровую кислоту [55]. Экспрессия фенилаланин-(тирозин)-аммоний-лиазы сопровождалась накоплением фенола в листьях.
Стимулирующие эффекты ГВ на вторичный метаболизм растений можно использовать в исследовании реакции растений на стресс [55]. ГВ влияет на активность ферментов, связанных с защитой клеток, благодаря индукции активности эстеразы и защите от окислительного стресса [56]. ГВ используют в растениеводстве в качестве стимулятора вторичных метаболитов для улучшения свойств лекарственных и ароматических растений, специй [4, 26].
ВЛИЯНИЕ ГВ НА РИЗОСФЕРНЫЕ МИКРООРГАНИЗМЫ
ГВ могут опосредованно воздействовать на растения, активизируя ризосферные микроорганизмы. Гуминовые препараты, внесенные в почву, увеличивают ее биологическую активность [57].
ГВ оказывают неоднозначное влияние на ферментативную активность почвенных микроорганизмов: они ингибировали синтез инвертазы, пероксидазы, фосфатазы [58] и в то же время стимулировали синтез нитрогеназы [59] и инвертазы [60]. Эти противоречивые результаты по влиянию ГВ на ферментативную активность микроорганизмов, вероятно, свидетельствуют о неоднозначности почвенных химических условий, а также о различиях в химическом составе гуминовых препаратов [61].
ГВ могут стимулировать почвенные микроорганизмы к разложению нерастворимых фракций гумусовых веществ почвы. Почвенные микромицеты Acremonium murorum, Botrytis cinerea, Chaetomium globosum, Cunninghamella elegans, Hyphomycetes, Rhizoctonia solani, Scytalidium lignicola, Trichoderma spp. [62], Fusarium oxysporum, Trichoderma atroviride [63], так же как и бактерии Alcaligenes eutrophus, Alcaligenes faecalis, Bacillus brevis, Bacillus cereus, Pseudomonas fluorescens, Pseudomonas putida, Xanthomonas campestris [62], способны минерализовать нерастворимые фракции гумусовых веществ. Известно, что в процессах минерализации гумуса особенно интенсивно изменяется его азотистая часть, что связывают с микробиологической активностью почв. При разложении гумуса азот освобождается в виде аммиака, причем интенсивность аммонификации зависит от состава и строения гумусовых веществ, а также от уровня биологической активности почвы [64]. При разложении гумусовых веществ микроорганизмами высвобождаются доступные для растений элементы органического и минерального питания.
Наибольшее воздействие ГВ оказывают на группы азотфиксаторов, аммонификаторов и нитрификаторов, целлюлозоразлагающие и маслянокислые бактерии, почвенные микромицеты [3, 65, 66]. ГВ увеличивали численность и активность азотфиксаторов, амилолитических и целлюлозолитических микроорганизмов [67] и в то же время ингибировали рост фитопатогенных микромицетов Fusarium oxisporum [68, 69]. Также ГВ стимулировали азотфиксирующие симбиотические бактерии клевера Rhizobium trifoli, максимальный эффект был обнаружен при концентрации ГВ 500 мг/л [65].
При добавлении ГВ в культуральную среду увеличивалось окисление NH4+, NO2– и рост нитрифицирующих бактерий Nitrosomonas europaea и Nitrobacter agilis [66]. Стимулирующее действие ГВ происходило за счет увеличения проницаемости микробных мембран благодаря лучшему использованию питательных веществ [66].
В зависимости от состава и происхождения ГВ отмечены различия в отклике микроорганизмов [70]. ГВ из бурого угля оказывали токсическое действие, подавляя на 25–35% рост тест-культуры Escherichia coli, а ГВ из более “молодого” сырья (торфа, лигносульфоната), напротив, стимулировали рост культуры на 10–33% относительно контроля [71].
Почвенные бактерии Aminobacter aminovorans, Arthrobacter spp., Bacillus spp., Pseudomonas spp. способны использовать углерод гумусовых кислот в качестве единственного источника углерода и сорбировать гумусовые кислоты, причем грамположительные бактерии сорбировали гумусовые кислоты в бóльших количествах, чем грамотрицательные [70, 72].
ГВ в концентрациях, рекомендованных для промышленного применения (200 мг/л × 10–2, 10–3), ингибировали рост бактерий Pseudomonas spр. и Bacillus subtilis в 1.5–2 раза. При уменьшении концентрации ГВ ингибирование роста бактерий не наблюдали [73].
ВЛИЯНИЕ ГВ НА ПРОЦЕССЫ В РАСТИТЕЛЬНО-МИКРОБНЫХ СИСТЕМАХ
Корни растений выделяют в ризосферу огромное количество органических соединений – корневых экссудатов. Количество и качество корневых экссудатов зависят от вида растений, возраста и внешних факторов [74, 75]. Корневые экссудаты усиливают поглощение питательных веществ растениями, повышают доступность субстрата для ризосферных микроорганизмов, способствуют иммобилизации токсичных элементов и защите растений и микроорганизмов от воздействия токсичных веществ [76]. ГВ усиливают корневую экссудацию и приводят к изменению профиля экссудации органических кислот корнями растений, в частности, значительно увеличивается синтез щавелевой, лимонной, винной кислот (на 75–210%) и уменьшается синтез малеиновой и фумаровой кислот (на 50–75%) [77]. Органические кислоты, продуцируемые растениями и микробным сообществом, разрушают ассоциации ГВ [78]. Показано увеличение экссудации лимонной кислоты у проростков при обработке их ГВ [77, 79]. Лимонная кислота является компонентом экссудатов корней и играет важную роль в дезагрегировании супрамолекулярной структуры ГВ.
В присутствии водонерастворимой фракции ГВ в растительно-микробной системе увеличивается количество органических экссудатов, вследствие этого в ризосфере увеличивается численность микроорганизмов-деструкторов ГВ, превращающих ГВ в доступные для растений формы. Растения, таким образом, стимулируют ризосферную микрофлору, разлагающую почвенные гумусовые вещества [50]. Схема взаимодействия растений и микроорганизмов в РМС при внесении гуминовых препаратов представлена на рис. 2.
Рис. 2.
Схема взаимодействия растений и микроорганизмов в растительно-микробном сообществе при внесении гуминовых препаратов. ГВ – гуминовые вещества (действующее вещество гуминовых препаратов), PGPR – стимулирующие рост растений бактерии, ГД – микроорганизмы-гуматдеструкторы, ЭКС – корневые экссудаты растений, ФР – ферменты.

ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ ГУМИНОВЫХ И БАКТЕРИАЛЬНО-ГУМИНОВЫХ ПРЕПАРАТОВ
Гуминовые препараты (ГП) стимулируют физиологическую активность микроорганизмов, в том числе продуцирование фитогормонов. Гуминовые препараты, содержащие в своем составе ГВ, различаются по своим свойствам, поскольку их производят по различным технологиям и из различных сырьевых источников [4, 80, 81]. В России среди ГП преобладают торфяные и сапропелевые формы (С : N = 35 : 2), за рубежом ГП в основном представлены углефицированными гуматами, полученными из бурого угля и сланцев (лигнитов, леонардитов, гумалитов) [82].
Использование ГП в растениеводстве приводит к повышению продуктивности растений в среднем на 20–30% [4, 83], устойчивости растений к различным фитопатогенам [84], эффективности и окупаемости минеральных удобрений [85].
Физиологическую активность лигниновых ГП изучали в широком диапазоне концентраций от 10–8 до 10–1% раствора оксигуматов [80, 81]. Установлено, что ГП в концентрациях 10–7, 10–5, 10–3% стимулировали всхожесть различных культур на 15–18%. ГП достоверно увеличивали длину корней проростков томатов, огурцов и пшеницы (на 15–20%) и урожайность ячменя и гороха (на 25–30%). Подобные результаты позже были получены другими исследователями [86]. Обнаруженная физиологическая активность ГВ в низких концентрациях (10–5, 10–7%) подтверждает гормональный регуляторный характер воздействия ГВ на растения. Известно, что при действии ИУК в минимальной концентрации 10–7 обнаруживалось максимальное растяжение клеток колеоптилей кукурузы [87].
Однако некоторые исследователи сообщают о нестабильных и негативных результатах применения ГП в полевых условиях [88, 89]. Отрицательные результаты при применении ГП авторы объясняют нивелированием процессов, а также высоким содержанием кальция в почве [88]. Поскольку полученные результаты нестабильны, авторы делают вывод о необходимости дополнительных исследований по влиянию ГП на растения.
Для повышения продуктивности сельскохозяйственных культур и эффективности действия ГВ на растения предлагают использовать комплексные бактериально-гуминовые препараты (БГП) [73, 90, 91], а также комплексные биопрепараты, содержащие микроорганизмы-деструкторы лигнина [92]. Эти препараты способны нивелировать отрицательные результаты, полученные в полевых условиях при применении ГП, поскольку они содержат в своем составе микроорганизмы, являющиеся активным компонентом РМС. В качестве одного из механизмов положительного действия ГП на растения обсуждается увеличение доступного углерода для микрофлоры ризосферы и активизация биологической активности почвы [93].
При использовании БГП в полевых условиях урожайность различных сельскохозяйственных культур: пшеницы, кукурузы, картофеля, томата, огурца – в среднем увеличилась на 20–30% [94]. В регулируемых условиях происходило ускорение созревания (на 3–5 сут) и увеличение урожайности на 25% пшеницы скороспелой линии [95]. Использование БГП актуально даже на богатых органическим веществом почвах [96]. В полевых производственных опытах по выращиванию пшеницы на карбонатном черноземе прибавка урожая в обработанных БГП вариантах составила 6.9–12.8 ц/га, или 19–36%. Авторы связывают это с повышением численности и активности ризосферных микроорганизмов различных физиологических групп – фосфатмобилизирующих, аммонифицирующих, целлюлозолитических микроорганизмов [96].
Эффективность действия препаратов, по-видимому, определяется эффективностью создавшейся в конкретных полевых условиях РМС. Применение ГП обеспечило прибавку урожайности томатов по сравнению с контролем (семена обрабатывали водой) на 2.6% и со стандартом (семена обрабатывали KMnO4) – на 20%, что связано с нивелированием в почве ростстимулирующего эффекта предпосевной обработки ГП [97]. Авторы данного обзора предполагают, что в контрольном варианте за счет эпифитной микрофлоры томатов создалась устойчивая РМС, которая не отреагировала на внесение ГП.
ГП при внекорневой обработке могут изменять микробоценоз филлосферы растений за счет смены доминирующих видов микроорганизмов [98]. В обработанных ГП вариантах доминировали целлюлозоразлагающие бактерии родов Cellulomonas и Cytophaga, в контрольном варианте – бактерии рода Arthrobacter. Следует отметить, что в составе ГП обнаружены бактерии рода Cellulomonas. Обработка растений картофеля этим ГП привела к увеличению урожайности картофеля в среднем на 33% [98].
В результате исследований показано, что для повышения эффективности действия бактериального и гуминового препаратов при их совместном внесении рабочая концентрация ГП должна быть уменьшена по сравнению с индивидуальным внесением ГП [73, 99].
ЗАКЛЮЧЕНИЕ
Гуминовые вещества (ГВ) оказывают комплексное воздействие на растения и ризосферные микроорганизмы. Они действуют на растения подобно фитогормонам, активизируя различные физиологические процессы. В частности, индуцируют образование сигнальных молекул NO в корнях растений, которые запускают в дальнейшем каскад физиологических реакций.
ГВ активизируют АТФ-азную активность клеточных мембран растений, увеличивают поступление питательных веществ, влияют на метаболизм растений.
Гуминовые вещества влияют на растительно-микробную систему в целом, приводя к качественным изменениям структуры взаимодействия растения и микроорганизмов. Это проявляется в следующем: ризосферные микроорганизмы при воздействии ГВ увеличивают синтез ИУК, при действии ИУК на корневую систему растений увеличивается выделение экссудатов растениями, что в свою очередь приводит к увеличению численности и активности микроорганизмов-деструкторов ГВ. В результате деятельности микроорганизмов-деструкторов ГВ увеличивается количество доступных для растений фрагментов ГВ.
Авторы выражают признательность сотрудникам Агрофизического нститута к.б.н. Е.В. Балашову и акад. РАН В.А. Драгавцеву за обсуждение работы.
Список литературы
Христева Л.А. Роль гуминовой кислоты в питании растений и гуминовые удобрения // Тр. Почв. ин-та им. В.В. Докучаева АН СССР. 1951. Т. 38. С. 104–184.
Sladky Z. The effect of extracted humus substances on growth of tomato plants // Biol. Plant. 1959. V. 1. № 2. P. 142–150. doi 10.1007/BF02927050
Рыбалкина А.В. Влияние гуминовой кислоты на развитие Clostridium pasterianum // Тр. Ин-та микробиол. АН СССР. 1958. Вып. 5. С. 136–149.
Богословский В.Н., Левинский Б.В., Сычев В.Г. Агротехнологии будущего. Кн. 1. Энергены. М.: Изд-во РИФ “Антиква”, 2004. 163 с.
Canellas L.P., Olivares F.L. Physiological responses to humic substances as plant growth promoter // Chem. Biol. Technol. Agricult. 2014. V. 1 № 3. P. 1–11. doi 10.1186/2196-5641-1-3
Piccolo A. The supramolecular structure of humic substances: a novel understanding of humus chemistry and implications in soil science // Adv. Agron. 2002. V. 75. P. 57–134.
Федотов Г.Н., Шоба С.А. О природе гумусовых веществ // Почвоведение. 2015. № 12. С. 1424–1432.
Trevisan S., Botton A., Vaccaro S., Vezzaroa A., Quaggiotti S., Nardi S. Humic substances affect Arabidopsis physiology by altering the expression of genes involved in primary metabolism, growth and development // Environ Exp. Bot. 2011. V. 74. № 1. P. 45–55. doi 10.4161/psb.5.6.11211
Kulikova N.A., Abroskin D.P., Badun G.A., Chernysheva M.G., Korobkov V.I., Beer A.S., Tsvetkova Eu.A., Senik S.V., Klein O.I., Perminova I.V. Label Distribution in tissues of wheat seedlings cultivated with tritium-labeled leonardite humic acid // Sci. Rep. 2016. № 6. Art. № 28869. P. 1–10. doi 10.1038/srep28869
Piccolo A. The nature of sol organic matter and innovative soil management to fight global changes and maintain agricultural productivity // Carbon sequestrat. in Agricult. soils: a multidiscipline. approach to innovative methods. Heidelberg: Springer, 2012. P. 1–19.
Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во МГУ, 1990. 325 с.
Sutton R., Sposito G. Molecular structure in soil humic substances: The new view // Environ. Sci. Technol. 2005. V. 39. Iss. 23. P. 9009–9015. doi 10.1021/es050778q
Демин В., Терентьев В., Завгородняя Ю. Вероятный механизм действия гуминовых веществ на живые клетки // Тр. II Международ. конф. “Гуминовые вещества в биосфере”. М.: Изд-во МГУ, 2004. С. 37–40.
Vaughan D., Ord B.G. Uptake and incorporation of 14C-labelled soil organic matter by roots of Pisum sativum L. // J. Exp. Bot. 1981. V. 32. № 4. P. 679–687 (https://doi.org/). doi 10.1093/jxb/32.4.679
Попов А.И. Гуминовые вещества: свойства, строение, образование / Под ред. Ермакова Е.И. СПб.: Изд-во СПбГУ, 2004. 248 с.
Šmejkalová D., Piccolo A. Aggregation and disaggregation of humic supramolecular assemblies by NMR diffusion ordered spectroscopy (DOSY-NMR) // Environ. Sci. Technol. 2008. V. 42. Iss. 3. P. 699–706. doi 10.1021/es071828p
Nardi S., Pizzeghello D., Muscolo A., Vianello A. Physiological effects of humic substances on higher plants // Soil Biol. Biochem. 2002. V. 34. P. 1527–1536.
Phoung H.K., Tichy V. Activity of humic acids from peat as studied by means of some growth regulator bioassay // Biol. Plant (Prague). 1976. V. 18. Iss. 2. P. 195–199.
Young C.C., Chen L.F. Polyamines in humic acid and their effect on radical growth of lettuce seedlings // Plant Soil. 1997. V. 195. № 1. P. 143–149 (https://doi.org/). doi 10.1023/A:1004247302388
Чуков С.Н., Голубков М.С. Сравнительное изучение физиологической активности гумусовых кислот почв на культуре водорослей Chlorella vulgaris // Вестн. СПбГУ. 2005. Сер. 3. № 1. С. 103–113.
Rose M.T., Patti A.F., Little K.R., Brown A.L., Jackson W.R., Cavagnaro T.R. A meta-analysis and review of plant-growth response to humic substances: practical implications for agriculture / Ed. Sparks D.S. // Adv. Agron. 2014. V. 124. P. 37–89. 103. doi 10.1104/pp
Zandonadi D.B., Santos M.P., Dobbss L.B., Olivares F.L., Canellas L.P., Binzel M.L., Okorokova-Facanha A.L., Facanha A.R. Nitric oxide mediates humicacids-induced root development and plasma membrane H+-ATPase activation // Planta. 2010. V. 231. Iss. P. 1025–1036. doi 10.1007/s00425-010-1106-0
Lombardo M.C., Graziano M., Polacco J.C., Lamattina L. Nitric oxide functions as a positive regulator of root hair development // Plant Signaling Behav. 2006. V. 1. № 1. P. 28–33.
Lombardo M.C., Lamattina L. Nitric oxide is essential for vesicle formation and trafficking in Arabidopsis root hair growth // J. Exp. Bot. 2012. V. 63. № 13. P. 4875–4885. doi 10.1093/jxb/ers166
Mora V., Baigorri R., Bacaicoa V., Zamarreño A., García-Mina J.M. The humic acid-induced changes in the root concentration of nitric oxide, IAA and ethylene do not explain the changes in root architecture caused by humic acid in cucumber // Environ. Exp. Bot. 2012. V. 76. № 1. P. 24–32 (https://doi.org/). doi 10.1016/j.envexpbot.2011.10.001
Nasiroleslami E., Safaridolatabad S. The comparison of organic and biologic fertilizers effects on growth and essential oil of dill (Anethum graveolens L.) // IJB. 2014. V. 5. № 7. P. 65–74.
Casimiro I., Marchant A., Bhalerao R.P., Beeckman T., Dhooge S., Swarup R., Graham N., Inzé D., Sandber G., Casero P.J., Benett M. Auxin transport promotes Arabidopsis lateral root initiation // Plant Cell. 2001. V. 13. Iss. 4. P. 843–852.
Pishchik V.N., Chernyaeva I.I., Kozhemiakov A.P., Vorobyev N.I., Lazarev A.M., Kozlov L.P. Effect of inoculation with nitrogen fixing Klebsiella on potato yield // Nitrogen fixation with non-legumes. Kluwer Academic Publishers, 1998. P. 223–235.
Ahmad F., Ahmad I., Khan M.S. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities // Microb. Res. 2008. V. 163. № 2. P. 173–181 (https://doi.org/). doi 10.1016/j.micres.2006.04.001
Хаблак С.Г., Абдуллаева Я.А. Теория ферментативного роста клеток растяжением // Экосистемы, их оптимизация и охрана. 2013. Вып. 9. С. 185–196.
Schmidt W., Santi S., Pinton R., Varanini Z. Water extractable humic substances alter root development and epidermal cell pattern in Arabidopsis // Plant Soil. 2007. V. 300. № 1–2. P. 259–267 (https://doi.org/). doi 10.1007/s11104-007-9411-5
Gramss G., Ziegenhagen D., Sorge S. Degradation of soil humic extract in intact soybean hypocotyl and excised hypocotyl sections // Planta. 1984. V. 162. Iss. № 1. P. 147–153.
Trevisan S., Pizzeghello D., Ruperti B., Francioso O., Sassi A., Palme K., Quaggiotti S., Nardi S. Humic substances induce lateral root formation and the expression of the early auxin-responsive IAA19 gene and DR5 synthetic element in Arabidopsis // Plant Biol. 2010. V. 12. Iss. P. 604–61. doi 10.4161/psb.5.6.11211
Dobbss L.B., Medici L.O., Peres L.E.P., Pino-Nunes L.E., Rumjianek V.M., Fazanha A.R., Canellas L.P. Changes in root development of Arabidopsis promoted by organic matter from oxisols // Ann. Appl. Biol. 2007. V. 151. Iss. 2. P. 199–211. doi 10.1111/j.1744-7348.2007.00166.x
Muscolo A., Cutrupi S., Nardi S. IAA detection in humic substances // Soil Biol. Biochem. 1998. V. 30. P. 1199–1201 (https://doi.org/). doi 10.1016/S0038-0717(98)00005-4
Canellas L.P., Teixeira Junior L.R.L., Dobbss L.B., Silva C.A., Medici L.O., Zandonadi D.B., Façanha A.R. Humic acids crossinteractions with root and organic acids // Ann. Appl. Biol. 2008. V. 153. Iss. P. 157–166. doi 10.1111/j.1744-7348.2008.00249.x
Quaggiotti S., Ruperti B., Pizzeghello D., Francioso O., Tugnoli V., Nardi S. Effect of low molecular size humic substances on nitrate uptake and expression of genes involved in nitrate transport in maize (Zea mays L.) // J. Exp. Bot. 2004. V. 5. № 6. P. 803–813. doi 10.1093/jxb/erh085
Pishchik V.N., Ktitorova I.N., Skobeleva O.V., Mirs-kaya G.V., Vorobyov N.I. Method of instrumental assessment of plant-bacterial interaction in agricultural system in forecasting the yield // EFITA/WCCA. Proc. 8th Europ. Fed. Inform. Technol. Agricult. Food Environ/World Congress on Computers in Agricult. Prague, 2011. P. 597–605.
Kutschera U.P., Schopfer P. Evidence against the acidgrowth theory of auxin action // Planta. 1985. V. 163. № 4. P. 483–493. doi 10.1007/BF00392705
Полевой В.В. Физиология растений: учеб. для биол. спец. вузов. М.: Высш. шк., 1989. 464 с.
Morsomme P., Boutry M. The plant plasma membrane H+-ATPase: structure, function and regulation // Biochim. Biophys. Acta. 2000. V. 1465. Iss. 1–2. P. 1–16 (https://doi.org/). doi 10.1016/S0005-2736(00)00128-0
Гуминский С.А. Современные точки зрения на механизм физиологических эффектов, вызываемых в растительных организмах гумусовыми веществами // Почвоведение. 1968. № 9. С. 92–98.
Chen Y., Aviad T. Effects of humic substances on plant growth / Eds. Mac Carthy P., Malcolm R.L., Clapp C.E., Bloom P.R. // Humic Subs. Soil Crop Sci.: Selected Readings. Madison: Am. Soc. Agron. Soil Sci. Soc., 1990. P. 161–187.
Chen Y., De Nobili M., Aviad T. Stimulatory effects of humic substances on plant growth // Soil organic matter sustainable agriculture. Boca Raton: CRC Press, 2004. P. 103–129.
Aguirre E., Lemenager D., Bacaicoa E., Fuentes M., Baigorri R., Zamarreco A.M.A., Garcнa-Mina J.M.A. The root application of a purified leonardite humic acid modifies the transcriptional regulation of the main physiological root responses to Fe deficiency in Fe-sufficient cucumber plants. // Plant Physiol Biochem. 2008. V. 47. Iss. 3. P. 215–223. doi 10.1016/j.plaphy.2008.11.013
Chen Y., De Nobili M., Aviad T. Stimulatory effects of humic substances on plant growth // Soil organic matter sustain. agricult. Boca Raton: CRC Press, 2004. P. 103–129.
Nardi S., Muscolo A., Vaccaro S., Baiano S., Spaccini R., Piccolo A. Relationship between molecular characteristics of soil humic fractions and glycolytic pathway and krebs cycle in maize seedlings // Soil Biol. Biochem. 2007. V. 39. P. 3138–3146 (http://dx.doi.org/). doi 10.1016/j.soilbio.2007.07.006
Ertani A., Francioso O., Tugnoli V., Righi V., Nardi S. Effect of commercial lignosulfonate-humate on Zea mays L. metabolism // J. Agri. Food Chem. 2011. V. 59. Iss. 22. P. 11940–11948. doi 10.1021/jf202473e
Pinton R., Cesco S., Iacoletti G., Astolfi S., Varanini Z. Modulation of NO3 – uptake by water-extractable humic substances: involvement of root plasma membrane H+ATPase // Plant Soil. 1999. V. 215. № 2. P. 155–161.
Puglisi E., Trevisan M. Combining rhizobox, reporter gene systems, and molecular analyses to assess the effects of humic substances on plant–microbes Interactions in soil rhizosphere // Molecular Microb. Ecol. Rhizosphere. 2013. V. 1–2. P. 933–942. doi 10.1002/9781118297674.ch88
Panuccio M.R., Muscolo A., Nardi S. Effect of humic substances on nitrogen uptake and assimilation in two species of pinus // J. Plant Nutr. 2001. V. 24. № 4–5. P. 693–704.
Carletti P., Masi A., Spolaore B., Polverino De Laureto P., De Zorzi M., Turetta L., Ferretti M., Nardi S. Protein expression changes in maize roots in response to humic substances // J. Chem. Ecol. 2008. V. 34. Iss. 6. P. 804–818. 804–818. doi 10.1007/s10886-008-9477-4
Trevisan S., Botton A., Vaccaro S., Vezzaroa A., Quaggiotti S., Nardi S. Humic substances affect Arabidopsis physiology by altering the expression of genes involved in primary metabolism, growth and development // Environ. Exp. Bot. 2011. V. 74. № 1. P. 45–55. doi 10.4161/psb.5.6.11211
Jannin L., Arkoun M., Ourry A., Laîné P., Goux D., Garnica M., Fuentes M., Francisco S.S., Baigorri R., Cruz F., Houdusse F., Garcia-Mina J.M., Yvin J.C., Etienne P. 2012. Microarray analysis of humic acid effects on Brassica napus growth: involvement of N, C and S metabolisms // Plant Soil. 2012. V. 359. № 1–2. P. 297–319. doi 10.1007/s11104-012-1191-x
Schiavon M., Pizzeghello D., Muscolo A., Vaccaro S., Francioso O., Nardi S. High molecular size humic substances enhance phenylpropanoid metabolism in maize (Zea mays L.) // J. Chem. Ecol. 2010. V. 36. Iss. 6. P. 662–669 (https://doi.org/). doi 10.1007/s10886-010-9790-6
Garcia A.C., Santos L.A., Guridi F., Sperandi M.V.L., Castro R.N., Berbara R.L.L. Vermicompost humic acids as an ecological pathway to protect plant agaisnt oxidative stress // Ecol. Eng. 2012. V. 47. Oct. P. 203–208.
Александрова Л.Н. Органическое вещество почвы и процессы его трансформации. Л.: Наука, 1980. 288 с.
Muter O., Limane B., Strikauska S., Klavins M. Effect of humic-rich peat extract on plant growth and microbial activity in contaminated soil // Mater. Sci. Appl. Chem. 2015. Iss. 32. P. 68–74. https://doi.org/ 10.1515/msac-2015-0012
Rezazadeh M.K., Nejad T.S., Shokouhfar A. The effect of different levels of humic acid fertilizer on components of biological nitrogen fixation in cowpea cultivars in Ahvaz // Inter. J. Biosci. 2014. V. 5. Iss. 2. P. 167–174.
Чундерова А.И. Активность инвертазы в дерново-подзолистых почвах // Научн. докл. высш. шк. Биол. науки. 1970. Т. 13. № 12. С. 104–110.
Безуглова О.С., Полиенко Е.А., Горовцов А.В. Гуминовые препараты как стимуляторы роста растений и микроорганизмов // Изв. Оренбург. ГАУ. 2016. Т. 60. № 4. С. 11–14.
Gramss G., Ziegenhagen D., Sorge S. Degradation of soil humic extract by wood- and soil associated fungi, bacteria, and commercial enzymes // Microbiol. Ecol. 1999. V. 37. Iss. 2. P. 140–151.
Holker U., Ludwig S., Scheel T., Hofer M. Mechanisms of coal solubilization by the deuteromycetes Trichoderma atroviride and Fusarium oxysporum // Appl. Microbiol. Biotechnol. 1999. V. 52. Iss. 1. P. 57–59 (https://doi.org/). doi 10.1007/s002530051486
Туев Н.А. Микробиологические процессы гумусообразования. М.: Агропромиздат, 1989. 239 с.
Bhardwaj K.R., Gaur A.C. Growth promoting effect of humic substances on Rhizobium trifoli // Ind. J. Microbiol. 1972. V. 12. № 1. P. 19–21.
Vallini G., Pera A., Agnolucci M., and Valdrighi M.M. Humic acids stimulate growth and activity of in vitro tested axenic cultures of soil autotrophic nitrifying bacteria // Biol. Fert. Soils. 1997. V. 24. Iss. 3. P. 243–248 (https://doi.org/). doi 10.1007/s003740050238
Свиридова О.В., Андрущук О.В., Орлова О.В. Физиологическое действие гумусовых веществ на почвенные микроорганизмы // Бюл. ВНИИСХМ. 1988. № 49. С. 30–35.
Sviridova O.V., Pishchik V.N. Effect of new humic fertilizer on soil micro biocenosis and the yield of plants // Program abstracts inter. conf. biotechnol. St.-Petersburg, Russia, Sept. 21–23, 1994. 132 p.
Sviridova O.V., Vorobyov N.I., Pishchik V.N., Mikhaleva L.V. Effect of humic preparation on plant-microbial associations // Proc. EUCARPIA 22th fodder crops amenty grasses section meet / Eds. Provorov N.A., Tikhonovich I.A., Veronesi F. / St.-Petersburg: VIR, 2000. P. 171–173.
Тихонов В.В., Якушев А.В., Завгородняя Ю.А., Бызов Б.А., Демин В.В. Действие гуминовых кислот на рост бактерий // Почвоведение. 2010. № 3. С. 333–341.
Изосимов А.А. Физико-химические свойства, биологическая активность и детоксицирующая способность гуминовых препаратов, отличающихся генезисом органического сырья: Дис. … канд. биол. наук. М., 2016. 156 с.
Тихонов В.В., Орлов Д.С., Лисовицкая О.В., Завгородняя Ю.А., Бызов Б.А., Демин В.В. Сорбция гуминовых кислот бактериями // Микробиология. 2013. Т. 82. № 6. С. 691–697.
Pishchik V.N., Vorobyov N.I., Walsh O.S., Surin V.G., Khomyakov Y.V. Estimation of synergistic effect of humic fertilizer and Bacillus subtilis on lettuce plants by reflectance measurements // Plant Nutr. 2016. V. 39. № 8. P. 1074–1086 (http://dx.doi.org/). doi 10.1080/01904167.2015.1061551
Baldri D.V., Vivanco J.M. Regulation and function of root exudates // Plant Cell Environ. 2009. V. 32. Iss. 6. P. 666–681. doi 10.1111/j.1365–3040.2008.01926.x
Шапошников А.И., Белимов А.А., Кравченко Л.В., Виванко Д.М. Взаимодействие ризосферных бактерий с растениями: Механизмы образования и факторы эффективности ассоциативных симбиозов // Сел.-хоз. биол. 2011. № 3. С. 16–22.
Хомяков Ю.В. Роль корневых выделений растений в формировании биохимических свойств корнеобитаемой среды: Дис. … канд. биол. наук. СПб., 2009. 144 с.
Canellas L.P., Teixeira Junior L.R.L., Dobbss L.B., Silva C.A., Medici L.O., Zandonadi D.B., Façanha A.R. Humic acids crossinteractions with root and organic acids // Ann. Appl. Biol. 2008. V. 153. P. 157–166. doi 10.1111/j.1744-7348.2008.00249.x
Волков О.И. Влияние корневых выделений прорастающих семян ячменя (Hordeum vulgare L.) на качественный и количественный состав органических компонентов почвы // Журн. общ. биол. 2010. Т. 71. № 4. С. 359–368.
Puglisi E., Fragoulis G., Del Re A.A., Spaccini R., Piccolo A., Gigliotti G., Said-Pullicino D., Trevisan M. Carbon deposition in soil rhizosphere following amendments with compost and its soluble fractions, as evaluated by combined soil–plant rhizobox and reporter gene systems // Chemosphere. 2008. V. 73. Iss. 8. P. 1292–1299. doi 10.1016/j.chemosphere.2008.07.008
Комаров А.А. Получение гумусоподобных соединений из лигнина и их физиологическое действие на растения. СПб.: Изд-во “Невский стандарт”, 2004. 120 с.
Комаров А.А. Роль гидролизного лигнина в плодородии почв и питании растений: Дис. … д-ра с.-х. наук. СПб., 2004. 383 с.
Якименко О.С., Терехова В.А. Гуминовые препараты и проблема оценки их биологической активности для целей сертификации // Почвоведение. 2011. №. 11. С. 1334–1343.
Попов А.И. Биологическая коррекция продуктивности агрофитоценозов // Вестн. СПбГУ. 2006. Сер. 3. Вып. 1. С. 136–146.
Соколов А.А., Виноградов Д.В. Эффективность гуминового препарата гумми 80 в повышении продуктивности и устойчивости растений ячменя к корневым гнилям // Вестн. Рязан. гос. агротехнол. ун-та им. П.А. Костычева. 2016. Т. 31. № 3. С. 103–106.
Корсаков К.В., Пронько В.В. Повышение окупаемости минеральных удобрений при использовании препаратов на основе гуминовых кислот // Плодородие. 2013. Т. 71. № 2. С. 18–20.
Касимова Л.В., Кравец А.В., Бобровская Д.Л. Биологическая активность новых водорастворимых комплексных гуминовых стимуляторов роста растений с макроэлементами // Плодородие. 2010. Т. 51. № 1. С. 48–49.
Rayle D.L., Evans M.L., Hertel R. Action of auxin on cell elongation // Proc. Nat. Acad. Sci. 1970. V. 65. № 1. P. 184–191.
Leventoglu H., Erdal I. Effect of high humic substance levels on growth and nutrient concentration of corn under calcareous conditions. // J. Plant Nutr. 2014. V. 37. P. 2074–2084. doi 10.1080/01904167.2014.920373
Little K.R., Rose M.T., JacksonW.R., Cavagnaro T.R., Patti A.F. Do lignite-derived organic amendments improve early-stage pasture growth and key soil biological and physicochemical properties? // Crop Pasture Sci. 2014. V. 65. № 9. P. 899–910 (https://doi.org/). doi 10.1071/CP13433
Цыганова Е.Н., Звягинцев Д.Г., Лысак Л.В., Степанов А.А. Действие бактериально-гумусового препарата на биологическую активность почв // Почвоведение. 2013. № 7. С. 867–871.
Canellas L.P., Olivares F.L. Physiological responses to humic substances as plant growth promoter // Chem. Biol. Technol. Agricult. 2014. V. 1. № 3. P. 1–11. doi 10.1186/2196-5641-1-3
Свиридова О.В., Воробьев Н.И., Проворов Н.А., Орлова О.В., Русакова И.В., Андронов Е.Е., Пищик В.Н., Попов А.А., Круглов Ю.В. Выравнивание почвенных условий для развития растений при деструкции растительных остатков микробными препаратами // Сел.-хоз. биол. 2016. Т. 51. № 5. С. 664–672.
Lyons G., Genc Y. 2016. Commercial humates in agriculture: real substanceor smoke and mirrors? // Agronomy. V. 50. № 6. P. 1–8. doi 10.3390/agronomy6040050
Сидоренко О.Д. Перспективы использования биологических препаратов на основе микроорганизмов // Изв. ТСХА. 2012. Вып. 6. С. 70–79.
Pishchik V.N., Ktitorova I.N., Skobeleva O.V., Mirs-kaya G.V., Vorobyov N.I. Method of instrumental assessment of plant-bacterial interaction in agricultural system in forecasting the yield // EFITA/WCCA. Proc. 8th Europ. Federat. Inform. Technol. Agricult, Food Environ./World Congress Comput. Agricult. Prague, 2011. P. 597–605.
Bezuglova O.S., Polienko E.A., Gorovtsov A.V., Lyhman V.A., Pavlov P.D. The effect of humic substances on winter wheat yield and fertility of ordinary chernozem // Ann. Agrar. Sci. 2017. V. 15. Iss. 2. P. 239–242 (http://dx.doi.org/). doi 10.1016/j.aasci.2017.05.006
Сахарчук Т.Н., Поликсенова В.Д., Наумова Г.В., Макарова Н.Л. Влияние гуминовых препаратов на морфогенез и устойчивость к фитофторозу растений томата // Вестн. БГУ. Сер. химия, биол. геогр. Минск: Изд-во БГУ, 2013. № 3. С. 56–60.
Добровольская Т.Г., Леонтьевская Е.А., Хуснетдинова Т.А., Балабко П.Н. Влияние гуминовых удобрений на численность и структуру бактериальных комплексов картофельного поля // Вестн. МГУ. Сер. 17. Почвоведение. 2013. № 3. С. 47–50.
Терещенко Н.Н., Бубина А.Б., Сысоева Л.Н., Бурмистрова Т.И., Трунова Н.М. Исследование эффективности комплексного применения оксигумата торфа и бактериальной культуры Pseudomonas spр. для создания биопрепарата системного действия // Вестн. Томск. гос. ун-та. Биология. 2009. Т. 5. № 1. С. 27–36.
Дополнительные материалы отсутствуют.