Агрохимия, 2019, № 5, стр. 29-34
АНТИДОТНАЯ АКТИВНОСТЬ НОВОГО ПРОИЗВОДНОГО СТИМУЛЯТОРА РОСТА РАСТЕНИЙ ФЛОРОКСАН ПО ОТНОШЕНИЮ К ГЕРБИЦИДУ РЯДА СУЛЬФОНИЛМОЧЕВИН – МЕТСУЛЬФУРОНМЕТИЛУ
О. Ю. Федоровский 1, *, С. С. Халиков 1, Ю. Я. Спиридонов 2, Н. Д. Чкаников 1
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
2 Всероссийский научно-исследовательский институт фитопатологии
143050 Московская обл., Одинцовский р-н, р.п. Большие Вяземы, ул. Институт, влад. 5, Россия
* E-mail: offskii@rambler.ru
Поступила в редакцию 06.08.2018
После доработки 10.08.2018
Принята к публикации 10.02.2019
Аннотация
Проведена химическая модификация регулятора роста растений флороксан, получена фторсодержащая диарилмочевина, обладающая способностью защищать посевы от токсического действия промышленного гербицида метсульфуронметила. Показано, что полученное соединение в низких концентрациях (1.0 г/т семян) обладает антидотной активностью при предпосевной обработке семян рапса.
ВВЕДЕНИЕ
Одной из актуальных задач агрохимии является поиск новых антидотов для широко распространенных в сельскохозяйственном производстве России гербицидов из ряда сульфонилмочевин. Это гербициды нового поколения, которые обладают высокой фитотоксичностью и сохраняют гербицидную активность в объектах окружающей среды, в частности в почве, в течение длительного времени (до нескольких лет). Применение таких гербицидов привело к возникновению в растениеводстве новой проблемы – экологических последствий их использования. Указанные гербициды более 20 лет применяют для борьбы с сорняками в посевах практически всех основных сельскохозяйственных культур, причем особенно широко эти гербициды используют в почвенно-климатических регионах Центрального, Поволжского и Сибирского округов РФ. Систематическое применение таких гербицидов привело к загрязнению их остатками до 22% почв указанных регионов, что составляет более 17 млн га сельхозугодий. Ежегодный ущерб урожаю таких культур как рапс, отличающейся особенно высокой чувствительностью к остаткам сульфонилмочевин в почве, составляет ≈20% и более [1, 2]. Современные гербициды не обладают высокой избирательностью по отношению к культурным растениям и сорнякам и могут оказывать токсическое действие и на культурные растения. Применение антидотов (сейфнеров) гербицидов устраняет или снижает токсическое действие гербицидов на культурное растение, тем самым повышая урожайность [3–5].
В настоящее время в рекомендациях по выращиванию рапса отсутствуют данные о применении каких-либо антидотов, способных эффективно снижать токсическое действие гербицидов из ряда сульфонилмочевин, содержащихся в почве.
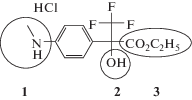
Цель работы – поиск антидотов (сейфнеров) для гербицидов ряда сульфонилмочевин среди новых синтезированных производных флороксана (торговое название гидрохлорида этилового эфира 2-гидрокси-3,3,3-триф-торметил-2-(4-метиламино-фенил)-пропионовой кислоты [6]), а именно – синтез новых производных диарилмочевин, содержащих фрагмент флороксана.
МЕТОДИКА ИССЛЕДОВАНИЯ
В целях поиска антидота химическую модификацию фторсодержащего стимулятора роста растений флороксан проводили по положениям 1–3:
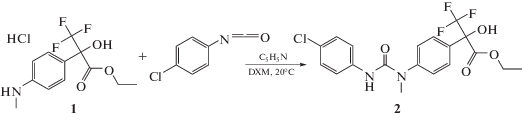
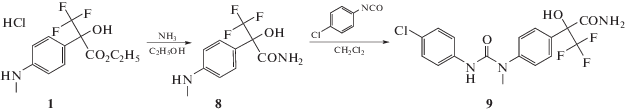
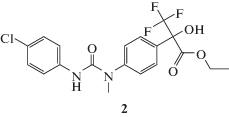
Один из способов введения заместителя в положение 1 фрагмента флороксана приводит к получению соединения 2 и основан на взаимодействии гидрохлорида этилового эфира 2-гидрокси-3,3,3-трифторметил-2-(4-метиламинофенил)-пропионовой кислоты 1 с пара-хлорфенилизоцианатом в присутствии пиридина в растворе дихлорметана при температуре 20–25°С. Синтез соединения 2 проводили по схеме 1:
К суспензии 2.8 г (0.009 моль) гидрохлорида солянокислого этилового эфира 2-гидрокси-3,3,3-трифторметил-2-(4-метиламино-фенил)-пропионовой кислоты 1 в 50 мл сухого дихлорметана добавляли 0.7 г (0.009 моль) пиридина при интенсивном перемешивании. Через 10 мин прибавляли раствор 1.37 г (0.009 моль) пара-хлорфенилизоцианата в 7 мл дихлорметана и перемешивали в течение 2 ч без доступа влаги воздуха при 20–25°C. Завершение реакции проверяли методом тонкослойной хроматографии (ТСХ). Затем дихлорметан упаривали, остаток растворяли в 30 мл эфира и отмывали гидрохлорид пиридина водой (2 раза по 50 мл). Эфирный слой сушили сульфатом натрия, фильтровали и фильтрат упаривали на роторном испарителе при пониженном давлении до образования твердого остатка. Полученный продукт-сырец кристаллизовали из смеси дихлор-метан/петролейный эфир (40–70) в соотношении 1 : 2 и получали 2.7 г (выход 69%) соединения 2 в виде белого кристаллического вещества, Тпл = 121–123°С. Вещество хорошо растворимо в спирте, ацетоне, хлороформе, диметилсульфоксиде и плохо в воде. Соединение 2 стабильно при хранении при 20–25°С.Строение соединения 2 подтверждено 1Н- и 19F-ЯМР-спектроскопией и масс-спектрометрией (прямой ввод образца, ионная ловушка, ЭУ, 70 ЭВ). Спектр ЯМР 1Н (400 Мгц, DMSO-d6, стандарт ТМС): 1.23 (т, 3Н, J = 7Гц, –СН3); 3.30 (с, 3Н, –NCH3); 4.27 (к, 2Н, J = 7Гц, –СН2–); 7.27–7.58 (м, 8Н, Ar); 7.81 (с, 1Н, –ОН); 8.65 (уш. с, 1Н, –NH). Спектр ЯМР 19F (400 Мгц, DMSO-d6, стандарт CCl3F): –75.22 (с, –CF3). Масс-спектр (электронный удар, 70 эВ), m/z (Iотн, %): 430 [M]+ (12); 204 [C9H9F3NO]+ (100); 134 [C8H8NO]+ (93); 107 [C7H9N]+ (14).
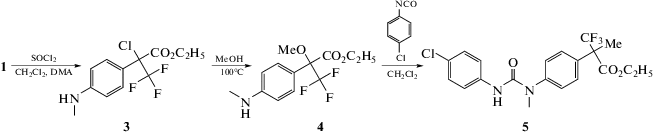
Диарилмочевина 5, имеющая 2 заместителя во фрагменте флороксана по положению 2 – метоксигруппу в α-положении β-трифторпропионовой кислоты и арилмочевину по положению 1, синтезирована по схеме 2:
Реакцию замещения гидроксильной группы на атом хлора проводили с помощью хлористого тионила в среде сухого дихлорметана в присутствии каталитического количества N,N-диметиланилина. Затем раствор хлорпроизводного 3 упаривали на роторном испарителе и к остатку прибавляли двукратный по массе избыток метанола. Реакционную массу кипятили ≈1 ч до завершения реакции. Далее метанол упаривали на роторном испарителе и к оставшейся массе, содержащей соединение 4, прибавляли дихлорметан и пара-хлорфенилизоцианат. Соединение 5 было получено с выходом 91%.
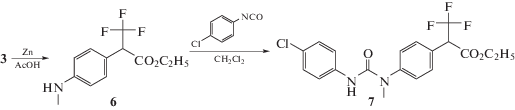
Диарилмочевину 7, имеющую 2 заместителя по положению 1 и 2, получали восстановлением хлорпроизводного флороксана 3 активированным цинком в растворе уксусной кислоты (схема 3):
После завершения реакции непрореагировавший цинк отфильтровывали и уксусную кислоту упаривали на роторе. Продукт сырец 6 очищали колоночной хроматографией на силикагеле, общий выход на 2 стадии составил 67%. Затем соединение 6 растворяли в дихлорметане, и к раствору добавляли пара-хлорфенилизоцианат в эквимолярном количестве.
Диарилмочевина 7 была получена с выходом 70%.
Для повышения растворимости в воде сложноэфирная группа во фрагменте флороксана (позиция 3) была заменена на амидную группу. Амидомочевину 9 получали по схеме 4:
Флороксан 1 обрабатывали водно-спиртовой смесью аммиака, упаривали, получали промежуточный амид 8, который растворяли в дихлорметане, с последующим добавлением эквимолярного количества пара-хлорфенилизоцианата. Выход соединения 9 составил 88%.
Строение всех полученных соединений подтверждено 1Н- и 19F-ЯМР-спектроскопией и масс-спектрометрией (прямой ввод образца, ионная ловушка, ЭУ, 70 ЭВ).
Все полученные производные (кроме соединения 3) прошли скрининг на антидотную и рострегулирующую активность. Предварительную оценку активности осуществляли с помощью экспресс-метода, разработанного ранее [7]. В соответствии с этим методом, оценку активности проводили на прорастающих семенах рапса сорта Ратник и кукурузы сорта Краснодарская 291 АМВ в чашках Петри на влажной фильтровальной бумаге. При этом оценивали снятие угнетающего действия гербицида, содержащегося в среде, потенциальными антидотами, которыми перед началом опыта обрабатывали семена.
Методика приготовления растворов испытуемых соединений и их смесей с гербицидами приведена в работе [7]. Проращивание семян проводили в чашках Петри. В чашку Петри вкладывали круглый фильтр соответствующего размера из фильтровальной бумаги и помещали обработанные растворами химических веществ семена рапса по 15 шт. в чашку. Опыт проводили в пятикратной повторности. В качестве контрольных вариантов использовали семена, обработанные только гербицидом или водой. В чашки Петри опытных вариантов и контроля приливали по 4 мл дистиллированной воды и помещали на 7 сут в термостат при температуре 25°С. Для проветривания семян чашки Петри ежедневно открывали на 30 мин и добавляли по 1 мл дистиллированной воды, чтобы не допустить высыхания семян. После этого во всех вариантах опыта проводили измерение длины проростков и длины их корней и находили их средние величины. Увеличение (или снижение) длины проростков и корней в опытных вариантах относительно водного контроля рассчитывали по формуле:
В результате этого скрининга было отобрано производное флороксана – этиловый эфир 2-{4-[3-(4-хлорфенил)-1-метил-уреидо]-фенил}-2-гидрокси-3,3,3-трифторпропионовой кислоты 2:
Замещенная диарилмочевина 2 в дозе всего 1 г/т семян в условиях опыта in vitro снижала угнетающее действие гербицида метсульфуронметила (препарат зингер СП, АО “Щелково-Агрохим”), который в опыте более чем на 40% подавлял рост корней и проростков рапса. Остальные соединения 1–9, проявляя различную рострегулирующую способность, антидотной активностью не обладали.Дальнейшее изучение антидотной активности полученных соединений проводили в сравнении со следующими известными промышленными антидотами. Известен антидот [8, 9], представляющий собой 1,8-нафталевый ангидрид (НА), который проявляет антидотную активность по отношению к некоторым производным сульфонилмочевин на кукурузе, яровой пшенице и рапсе. Однако доза 1,8-нафталевого ангидрида, при которой он проявляет антидотную активность, существенно выше 100 г/т семян. Такая доза приводит к загрязнению посевов и почвы.
Известен антидот фурилазол – (RS)-3-дихлор-ацетил-5-(2-фурил)-2,2-диметилоксазолидин, который производит компания “Monsanto” [10]. Фурилазол (ФА) используют в смеси с гербицидами при опрыскивании посевов кукурузы. Кроме того, показано, что ФА обладает заметной антидотной активностью в отношении гербицидов класса сульфонилмочевин, находящихся в почве и его можно использовать для предпосевной обработки семян кукурузы [11].
Методика приготовления препаративной формы для равномерного нанесения соединения 2 на семена рапса была следующей. В фарфоровую ступку помещали 105 мг соединения 2 (с учетом 95%-ного содержания основного вещества), добавляли 10.5 г полипропиленгликоля и растирали массу до образования опалесцирующей суспензии. Затем при постоянном перемешивании добавляли 105 мг ПАВ (Тренд-90) и 6.2 г 1%-ного раствора Na-КМЦ и получали суспензионную массу кремовато-молочного цвета. Аликвоту суспензии в количестве 20 мг использовали для приготовления рабочих растворов путем ее разбавления дистиллированной водой в 5 раз (100 г/т) и в 500 раз (1 г/т). Полученными растворами обрабатывали семена рапса – 0.1 г раствора/5 г семян. Препаративные формы других антидотов приготовляли аналогично.
Изучение антидотной активности препарата 2 проводили в лаборатории искусственного климата, использовали черноземную почву Тамбовской обл., в которую за 1 сут до посадки ярового рапса вносили гербицид метсульфуронметил в дозе 1 г/га. Семена рапса за 3-е сут до посева обрабатывали антидотами в дозе 1 г/т, высевали в вегетационные сосуды (емкость 600 г) с загрязненными гербицидами образцами черноземной почвы и помещали в камеру искусственного климата фирмы “Фетч” (ФРГ) при следующих гидротермических условиях: долгота светового дня – 16 ч при 22 тыс. лк, ночи – 8 ч; температура воздуха в камере днем – 25°С, ночью – 20°С; влажность воздуха 75%; влажность почвы (путем ежедневного полива обессоленной водой) 60% ПВ. В указанных условиях эксперимент проводили в течение 25 сут, затем определяли надземную массу растений. Контрольный вариант содержал в почве гербицид в дозе 1 г/га и семена рапса не обрабатывали антидотом. Повторность опыта пятикратная, по 3 растения в каждом сосуде.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты испытаний антидотной активности соединения 2 по отношению к гербициду метсульфуронметилу приведены в табл. 1.
Таблица 1.
Антидотное действие соединения 2 на растения ярового рапса сорта Ратник, выращенного на почве, загрязненной гербицидом метсульфуронметилом (препаратом зингер СП)
| Антидот | Доза применения антидота, г/т семян | Доза гербицида, г/га | Надземная масса тест-растений, г | Снижение массы тест-растений, % к контролю | |||||
|---|---|---|---|---|---|---|---|---|---|
| повторность | среднее | ||||||||
| 1-я | 2-я | 3-я | 4-я | 5-я | |||||
| Соединение 2 | 1 | 1.0 | 1.3 | 1.5 | 1.8 | 1.8 | 1.7 | 1.6 | 27.3 |
| Фурилазол | 1 | 1.4 | 0.9 | 0.8 | 0.8 | 0.9 | 1.0 | 54.5 | |
| 1,8-нафталевый ангидрид | 1 | 0.9 | 0.8 | 0.7 | 0.9 | 0.7 | 0.8 | 63.6 | |
| Контроль | – | 0.8 | 0.8 | 0.6 | 0.7 | 0.5 | 0.7 | 68.2 | |
| Контроль водный | – | – | 2.4 | 2.0 | 2.3 | 2.3 | 2.0 | 2.2 | – |
| НСР05 | 2.8 | ||||||||
Установлено, что предпосевная обработка семян рапса соединением 2 в норме 1 г/т семян эффективно ослабляла токсическое действие гербицида и приводила к увеличению надземной массы растений на 41% по сравнению с контролем [12]. Активность известных ранее антидотов фурилазола и 1,8-нафталевого ангидрида при их применении в дозе 1 г/т семян была невелика: эти антидоты лишь незначительно подавляли действие гербицида, увеличение надземной массы растений составило лишь 5–14% по сравнению с контролем.
ЗАКЛЮЧЕНИЕ
Таким образом, соединение 2 представляет собой первый пример вещества, эффективно защищающего рапс от токсического действия гербицидов класса сульфонилмочевин (метсульфуронметила) при предпосевной обработке семян в дозе 1 г препарата/т семян и может расширить ассортимент высокоэффективных антидотов для практического применения в сельском хозяйстве.
Список литературы
Спиридонов Ю.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов // Агрохимия. 2009. № 5. С. 81–91.
Спиридонов Ю.Я. Научно-практическое обоснование успешной борьбы с сорняками на современном этапе // Мат-лы Международ. научн.-практ. конф. “Современные проблемы гербологии и оздоровления почв”, посвящ. 85-летию со дня рождения Д.И. Чканикова (21–23 июня 2016 г., ВНИИ фитопатологии). Большие Вяземы, 2016. С. 118–136.
Crop safeners for pesticides: Development, uses, and mechanisms of action / Eds. Hatzios K.K., Hoagland R.E. N.Y.: Academic Press, 1989. 400 p.
Jablonkai I. Herbicide safeners: effective tools to improve herbicide selectivity // Herbicides – current research and case studies in use / Eds. Price A.J., Kelton J.A. InTech, 2013. P. 589–620.
Яблонская Е.К., Котляров В.В., Федулов Е.П. Антидоты гербицидов сельскохозяйственных культур // Научн. журн. КубГАУ. 2013. № 94 (10).
Пат. РФ № 2369094, опубл. 10.10.2009 // Бюл. 2009. № 28.
Осипов С.Н., Голубев А.С., Воробьева Д.В., Ягафарова И.Е., Васильева Т.П., Спиридонов Ю.Я., Протасова Л.Д., Чкаников Н.Д. Стимуляторы роста и развития проростков кукурузы в ряду α-(трифторметил)индол-3-илуксусных кислот // Агрохимия. 2016. № 10. С. 57–61.
Пат. РФ № 2585858 // Бюл. 2016. № 16.
Питина М.Р., Познанская Н.Л. Использование антидотов как путь экологически безопасного применения гербицидов на основе сульфонилмочевин // Агрохимия. 1994. № 4. С. 114–120.
The pesticide manual. 12th ed. / Ed. Tomlin C.D.S. The British Crop Protection Council, 2000. 482 p.
Голубев А.С., Коротов Н.А., Федоровский О.Ю., Спиридонов Ю.Я., Чкаников Н.Д. Фторсодержащие аналоги промышленного антидота фурилазол // Агрохимия. 2017. № 4. С. 26–31.
Пат. РФ по заявке № 2017125487/04, A01N25/32, C07C 275/30 (2017) “Этиловый эфир 2-{4-[3-(4-хлорфенил)-1-метилуреидо]-фенил}-2-гидрокси-3,3,3-трифторпропионовой кислоты): применение в качестве антидота гербицидов и способ получения” // Решение о выдаче патента от 27.07.2018 г.
Дополнительные материалы отсутствуют.